-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Celkové intravenózne anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
General intravenous anesthetics – pharmacodynamics, pharmacokinetics and chiral properties
In continuation of our published review on general inhalational anesthetics, the current article presents a survey of intravenous agents for general anaesthesia. From chemical point of view these compounds belong to structurally diverse categories, such as barbiturates − thiopental (Sodium pentothal®, Trapanal®, Pentothal®), methohexital (Brevital®), and hexobarbital (Evipan®, Hexenal®, Citopan®, Tobinal®); non-barbiturate derivatives − ketamine (Ketalar® Ketaset®), esketamine (Ketanest®), and etomidate (Amidate®, Hypnomidate®), phenolic derivatives − propofol (Diprivan®); steroid derivatives – mixture of alfadolone and alfaxalone (Althesin® in human and Saffan® in veterinary anesthesia); and derivatives of phenylacetic acid − propanidid (Epontol®, Sombrevin®). Most of these compounds are chiral, with the exception of propofol and propanidid. Apart from etomidate and esketamine, they are used in the form of their racemates. Besides their characteristics and mechanism of action, attention is centred also on their chiral properties.
Keywords:
pharmacokinetics – pharmacodynamics – general anesthetics – chirality – stereochemistry – intravenous anesthetics
Autoři: Ružena Čižmáriková; Ladislav Habala; Mário Markuliak
Působiště autorů: Farmaceutická fakulta UK Katedra chemickej teórie liečiv
Vyšlo v časopise: Čes. slov. Farm., 2023; 72, 155-164
Kategorie: Přehledy a odborná sdělení
doi: https://doi.org/10.5817/CSF2023-4-155Souhrn
V uvedenom článku je v nadväznosti na už publikovaný prehľad o celkových inhalačných anestetikách pozornosť venovaná intravenóznym (vnútrožilným) anestetikám. Z chemického hľadiska ide o štruktúrne rôznorodú kategóriu, ako sú barbiturátové deriváty − tiopental (Sodium pentothal®, Trapanal®, Pentothal®), metohexital (Brevital®), hexobarbital (Evipan®, Hexenal®, Citopan®, Tobinal®), nebarbiturátové deriváty − ketamín (Ketalar® Ketaset®), esketamín (Ketanest®) a etomidát (Amidate®, Hypnomidate®), deriváty fenolu − propofol (Diprivan®) a steroidné deriváty – zmes alfadolónu a alfaxalónu (Althesin® v humánnej a Saffan® vo veterinárnej anestézii), deriváty kyseliny fenyloctovej − propanidid (Epontol®, Sombrevin®). S výnimkou propofolu a propanididu ide väčšinou o chirálne zlúčeniny, ktoré sa okrem etomidátu a esketamínu používajú vo forme racemátov. U uvedených anestetík je pozornosť venovaná okrem ich charakteristiky a mechanizmu účinku aj ich chirálnym vlastnostiam.
Klíčová slova:
farmakokinetika – farmakodynamika – celkové anestetiká – chiralita – stereochémia – intravenózne anestetiká
Úvod
Ďalšiou skupinou celkových anestetík sú intravenózne (vnútrožilné) anestetiká, ktoré sa využívajú hlavne v úvodnej fáze anestézie. V klinickej medicíne, obzvlášť v chirurgii, majú nezastupiteľné miesto. Kombinované bývajú s analgetikami, hlavne s opiátmi, pretože väčšina z nich nemá takýto typ účinku 1. Ďalšími prídavnými látkami sú myorelaxanciá, α2 -agonisti a benzodiazepíny, o ktorých budeme informovať v ďalšom prehľade. Mnohé z inhalačných anestetík, ako je tiopental a propofol, sa používajú pri ťažkých epileptických záchvatoch trvajúcich viac než 5 minút 2–6. Tiopental patrí medzi najčastejšie používané barbituráty v pôrodníctve, pretože veľmi rýchle (počas 30 sekúnd) preniká placentou 7. V súčasnosti sa tiopental využíva aj ako substitučná terapia pri kriticky chorých pacientoch s COVID 198.
U mnohých intravenóznych anestetík mechanizmus účinku má multireceptorový charakter, podobne ako u anestetík inhalačných9. Dochádza pri tom k zvýšeniu inhibície sprostredkovanej kyselinou γ-aminomaslovou (GABA)10–12, zníženiu excitácie sprostredkovanej glutamátom a hyperpolarizácii membrán zvýšenou vodivosťou draslíka13, 14.
Ketamín tlmí excitačný synaptický prenos pôsobením na glutamátové receptory podtypu N-metyl-D-aspartátu (NMDA)15. Propofol účinkuje v rozpoznávajúcom mieste na receptore GABA, ktoré sa líši od väzbových miest barbiturátov aj benzodiazepínov16.
Potenciálnym cieľom anestetických účinkov tiopentalu môžu byť nikotínové acetylcholínové receptory (nAChRs) v centrálnom nervovom systéme 17–19.
V mnohých štúdiách sa uvádza, že anestetiká s antioxidačnými vlastnosťami, ako sú propofol a tiopental, majú mechanizmus účinku súvisiaci s inhibíciou peroxidácie lipidov v tkanive a zmierňujú reperfúzne poškodenie20.
Rozdelenie intravenoznych anestetík 21–23:
• barbiturátové deriváty: tiopental (Sodium pentothal®, Trapanal®, Pentothal®), metohexital (Mebaral®, Mephyltaletten®, Phemiton®, Prominal®, Brevital®), hexobarbital (Evipan®, Hexenal®, Citopan®, Tobinal®)
• nebarbiturátové deriváty: ketamín (Ketalar®, Keta[1]set®), esketamín (Ketanest®) a etomidát (Amidate®, Hypnomidate®)
• deriváty fenolu: propofol (Diprivan®, Rapinovet®), fospropofol (Lusedra®)
• steroidné deriváty: zmes alfadolónu a alfaxalónu (Althesin®, Phaxan® v humánnej a Saffan® vo veterinárnej anestézii)
• deriváty kyseliny fenyloctovej: propanidid (Epontol®)Intravenózne anestetiká typu barbiturátov
Tiopental – IUPAC názov: kyselina (RS)-5-etyl-5-(1-metylbutyl)-2-tiobarbiturová alebo 5-etyl-5-(pentán-2-yl) - -2-sulfanylidén-1,3-diazínan-4,6-dión (obr. 1)
Je to žlto-biely hygroskopický prášok so zápachom po cesnaku s teplotou topenia 158 – 160 °C. Je substituovaným derivátom kyseliny 2-tiobarbiturovej s etylom a pentán-2-ylom na uhlíku 5. Tiopental sa pre klinické použitie pripravuje ako sodná soľ rozpustná vo vode a v alkohole24. Ide o zmes tiopentalu a uhličitanu sodného. Roztoky sú nestále, a preto musia byť pripravované tesne pred použitím a aplikované výhradne intravenózne, pretože pri lokálnom použití dráždia. Používa sa ako ultrakrátke injekčné anestetikum, s použitím v úvode anestézie. Vyvoláva hypnózu do 30 – 40 sekúnd po intravenóznej injekcii.
Nedisociovaná forma tejto lipofilnej molekuly (rozdeľovací koeficient približne 2,8 dobre preniká hematoencefalickou bariérou. Charakteristický je prestup tiopentalu z CNS do menej prekrvených tkanív, hlavne tukových a pretrvávanie slabšieho útlmu po nadobudnutí vedomia. Výrazne tlmí dychové centrum 25, 26.
Tiopental má v svojej štruktúre jedno stereogénne centrum, a môže sa teda vyskytovať vo forme dvoch enantiomérov R a S. V klinickej praxi sa používa ako racemát. V literatúre sú však publikované rôzne práce, ktoré porovnávajú účinnosť oboch enantiomérov 27–29. (S)-(-)-tiopental je približne dvakrát účinnejší ako (R)-(+)-tiopental pri aktivácii receptorov GABAA, exprimovaných v modeloch oocytov z africkej žaby Xenopus laevis. To je v zhode s rozdielnym tlmivým účinkom na CNS zisteným in vivo 19, 30. Z hľadiska chirality je v pokusoch na zvieratách (S)–(-)-enantiomér narkoticky asi 2-krát účinnejší v porovnaním s (R)-(+)-izomérom 31, 32.
Tiopental ako vysoko lipofilná látka sa viaže na plazmatické bielkoviny (asi 70 %) a je takmer kompletne metabolizovaný v pečeni. Bolo zistené, že iba 1 % látky sa vylučuje močom v nezmenenom stave. Podáva sa i.v. 2,5 – 5 % čerstvo pripravený roztok. Po zohľadnení stereoselektívnej väzby vykazuje (R)-tiopental o 24 % väčšiu neviazanú frakciu v porovnaní s (S)-tiopentalom, pričom neboli zistené žiadne rozdiely medzi enantiomérmi, pokiaľ ide o neviazaný klírens a neviazaný distribučný objem v ustálenom stave 33. V novšej práci Mathera 34 na potkanoch bolo zistené, že celkové a neviazané plazmatické koncentrácie (S)-tiopentalu sú približne o 10 – 20 % vyššie ako koncentrácie (R)-tiopentalu, čo zodpovedá vyššiemu klírensu. Koncentrácie (S)-tiopentalu v tkanive CNS boli približne o 20 % vyššie v porovnaní s (R)-tiopentalom.
Hlavný metabolit tiopentalu je pentobarbital – kyselina (5-etyl-5-(1-metylbutyl)barbiturová, ktorý má tiež dve enantiomérne formy. S-enantiomér spôsobuje na pacientoch dlhšie trvanie sedácie ako (R)-enantiomér a klírens (S)-enantioméru je o 25 % nižší než klírens (R)-enantioméru 35–37.
Obr. 1. Chemická štruktúra tiopentalu 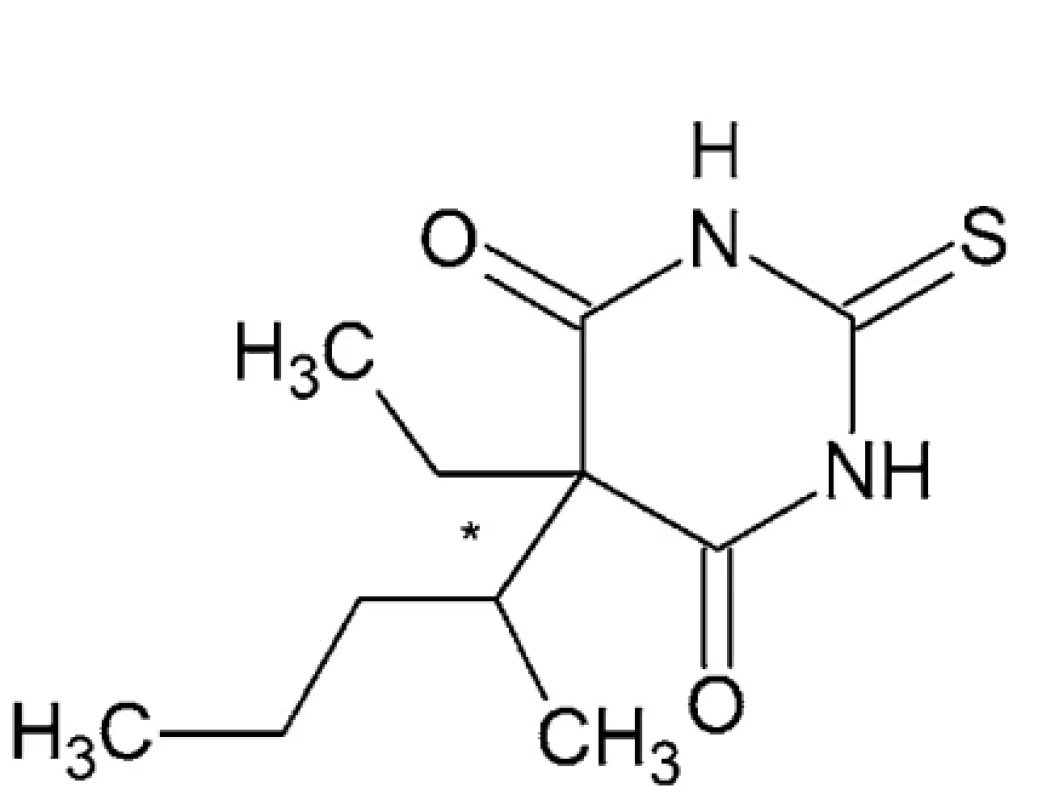
Metohexital – IUPAC názov: 5-(hex-3-ín-2-yl)-1-metyl - -5-(prop-2-én-1-yl)-1,3-diazinán-2,4,6-trión alebo kyselina (5-alyl-1-metyl-5-(1-metyl-2-pentinyl) barbiturová (obr. 2)
Je to tuhá látka o teplote topenia 96 °C (etanol), hustote 1,113 g/cm3 a pKa 7,82 ± 0,10 38, 39.
Metohexital je ultrakrátko pôsobiaci N-metylovaný barbiturát. Má 2,5-krát väčší hypnotický účinok než tiopental. Metohexital sa viaže na chloridové ionoforové miesto komplexu gama-aminomaslová kyselina (GABAA)-chloridový ionoforový receptor a tým zvyšuje inhibičné účinky GABAA receptora v mozgu. To vedie k synaptickej inhibícii, zníženej neuronálnej excitabilite a indukcii anestézie. Okrem toho metohexital znižuje glutamátové (Glu) reakcie 40, 41.
Metohexital, je zaujímavý z hľadiska chirality tým, že obsahuje dve stereogénne centrá, jedno v polohe 5 v barbiturátovom kruhu a druhé na prvom uhlíku bočného reťazca 1-metyl-2-pentynylu. Tak vzniknú dva páry stereoizomérov. Jeden pár sú enantioméry a druhý pár sú diastereoméry (t. j. nejde o zrkadlové obrazy). Klinicky sa používa ako zmes dvoch najmenej excitačných izomérov. Metohexital a tiopental vykazujú taktiež tautomériu (dynamický izomerizmus). V alkalickom roztoku je tiopental sodný vysoko rozpustný vo vode z dôvodu ionizovaného bočného reťazca. Po vstreknutí do plazmy pri pH 7,4 sa z neho stane neionizovaná forma, ktorá sa rýchlo izomerizuje na svoj tautomér, zlúčeninu vysoko rozpustnú v tukoch29. Metabolizmus prebieha v pečeni demetyláciou a oxidáciou 42.
Obr. 2. Chemická štruktúra metohexitalu 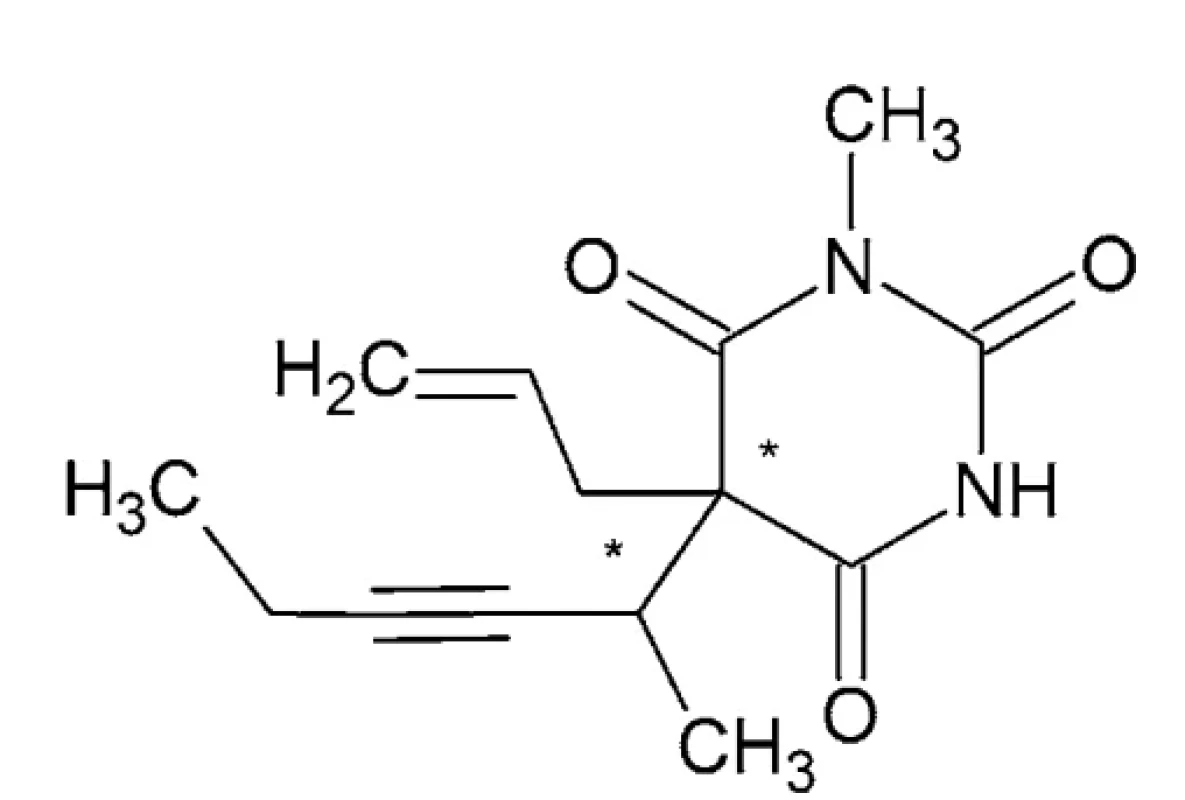
Hexobarbital – IUPAC názov: sodná soľ kyseliny (5RS) - -3,5-dimetyl-5-(1-cyklohexén-1-yl)barbiturovej alebo 5-(cyklohex-1-én-1-yl)-1,5-dimetyl-1,3-diazínan-2,4,6 - -trión (obr. 3)
Hexobarbital je racemický biely prášok s horkou chuťou. Topí sa pri 146,5 °C a má disociačnú konštantu 8,2. Hexobarbital (tiež hexobarbitón) sa vyskytuje v kyslej aj sodnej forme a má hypnotické a sedatívne účinky. Používal sa v 40. a 50. rokoch 20. storočia ako účinná látka na vyvolanie anestézie pri chirurgických zákrokoch, ako aj rýchlo pôsobiace krátkodobé hypnotikum na všeobecné použitie. Má pomerne rýchly nástup a krátke trvanie účinku. Moderné barbituráty (napríklad Tiopental) do značnej miery nahradili použitie hexobarbitalu ako anestetika, pretože umožňujú lepšiu kontrolu hĺbky anestézie 43–45. Hexobarbital sa stále používa v niektorých vedeckých výskumoch 46.
Ukázalo sa, že vyššia narkotická účinnosť in vivo (S)-(+)-izoméru hexobarbitalu súvisí s vyššími hladinami v CNS v porovnaní s enantiomérom (R)-(-). Ukazuje sa tiež, že je to kvôli zlepšenému prechodu hematoencefalickou bariérou47. Hexobarbital ako krátkodobo pôsobiace hypnotikum sa metabolizuje na 3’-hydroxyhexobarbital pomocou cytochrómu P450 a potom na 3’-oxohexobarbital pomocou pečeňovej cytosoldehydrogenázy48.
V práci Saito et al.49 sa skúmala enzymatická funkcia rekombinantného CYP2C19 pri enantiomérnej hexobarbitalovej (HB) 3’-hydroxylácii a hľadala sa úloha aminokyselinových zvyškov, ako sú Phe-100, Phe-114, Asp-293, Glu-300 a Phe-476 v CYP2C19 pri stereoselektívnej HB 3’-hydroxylácii s použitím expresného systému kvasinkových buniek a metódy cielenej mutagenézy. Výsledky naznačili, že Glu-300 a Phe-476 sú dôležité pri stereoselektívnej oxidácii HB-enantiomérov prostredníctvom CYP2C19.
Obr. 3. Chemická štruktúra hexobarbitalu 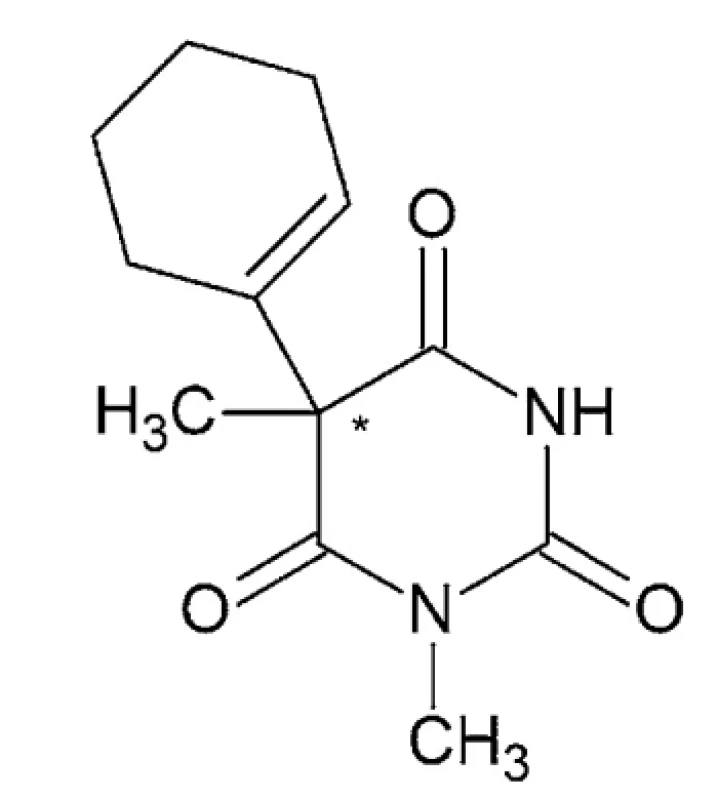
Etomidát – IUPAC názov: etyl 1-[(1R)-1-fenyletyl]-1Himidazol-5-karboxylát (obr. 4)
Etomidát je biela prášková tuhá látka s teplotou topenia 67 – 68 °C a s teplotou varu 160 – 162 °C (tlak 1 torr) a pKa 4,24 (H2 O, t = 25,0 °C)50, 51. Ide o nebarbiturátové hypnotikum bez analgetického účinku. Jeho terapeutická šírka je 4-krát väčšia než u tiopentalu 52, 53. Pôvodne bol selektovaný zo skupiny zlúčenín študovaných ako protiplesňové látky, pričom sa počas testovania na zvieratách prejavil ako silné hypnotikum. V ďalšom štúdiu sa zistilo, že pôsobí bezpečnejšie ako používané barbituráty. V klinickej praxi ide o krátkodobo pôsobiace intravenózne, infiltračné anestetikum nebarbiturátového typu s imidazolovým kruhom a chirálnym centrom v svojej štruktúre, používané na vyvolanie celkovej anestézie a sedáciu pri krátkych procedúrach a využívané aj pri elektrokonvulzívnej terapii. Pri anestézii vykazuje veľkú terapeutickú šírku, rýchly nástup účinku a bezpečný profil kardiovaskulárneho rizika. Je jediným anestetikom, ktoré dokáže znížiť intrakraniálny tlak a udržať normálny arteriálny tlak. Trvanie anestézie nie je dlhšie ako 10 minút 54–57.
(R)-(+) izomér bol oveľa účinnejší pri potenciovaní GABA indukovaných prúdov, hoci stupeň stereoselektivity sa menil v závislosti od koncentrácie anestetika. Oba izoméry boli rovnako účinné pri rozrušení lipidových dvojvrstiev. Tieto zistenia sú v zhode s teóriou, že účinky na receptor GABAA sú ústredným mechanizmom anestetickej aktivity etomidátu 58, 59.
V klinickej praxi sa používa ako jediný izomér. Anestetický účinok spočíva predovšetkým v (R)-(+) enantioméri, ktorý je približne 5-krát účinnejší ako (S)-(-)-izomér59. U zdravých pacientov sa etomidát viaže približne zo 75 % na bielkoviny. Je charakterizovaný veľkým centrálnym distribučným objemom (4,5 l/kg) a veľkým periférnym distribučným objemom (74,9 l/kg), vzhľadom k vysokej rozpustnosti v tukoch 60, 61. Metabolizmus etomidátu u laboratórnych zvierat a ľudí závisí od aktivity pečeňovej esterázy, ktorá hydrolyzuje liečivo na neaktívnu karboxylovú kyselinu a etanol 57, 62.
Obr. 4. Chemická štruktúra etomidátu 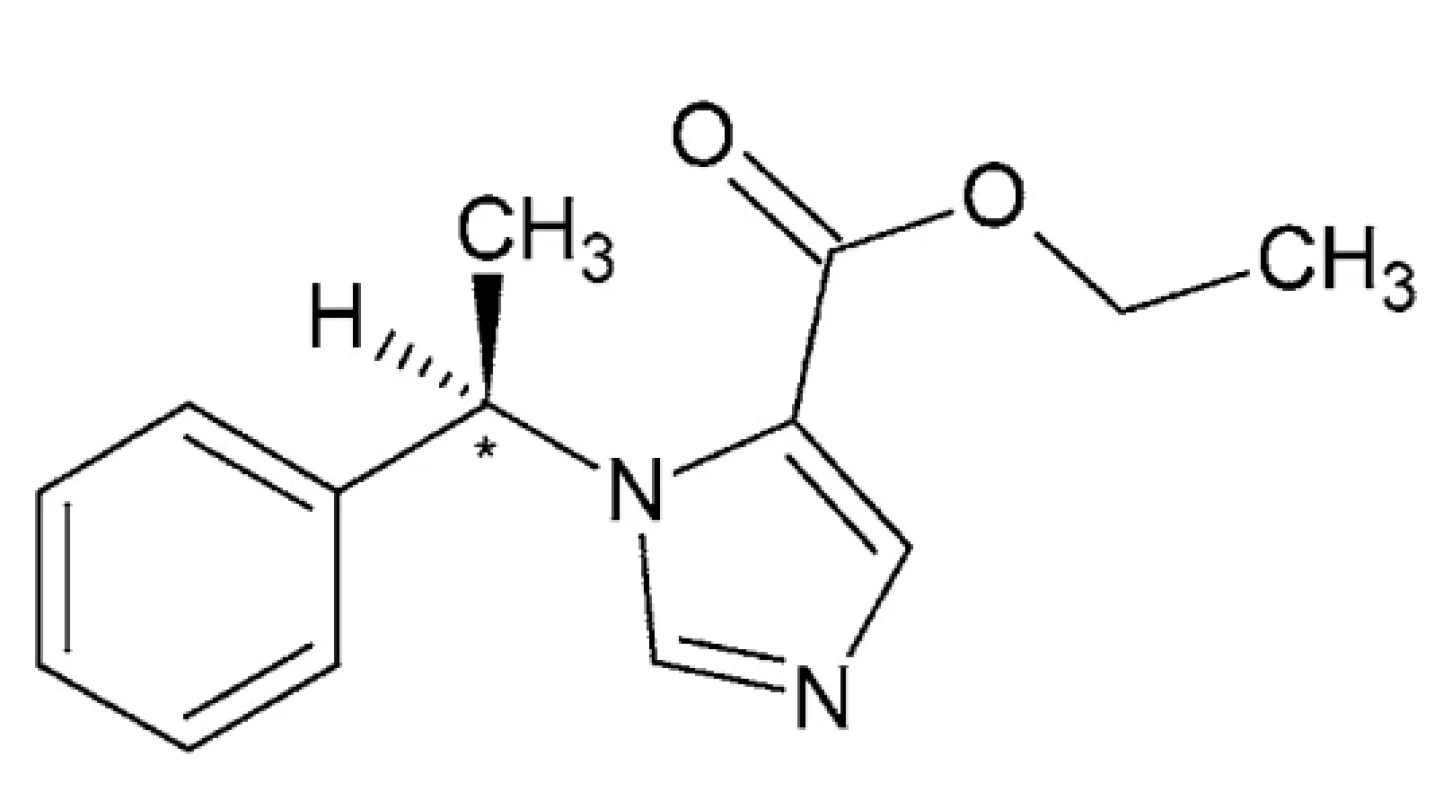
Ketamín – IUPAC názov: (2RS) - 2-(2-chlórfenyl)-2-(metylamino)cyklohexán-1-ón (obr. 5)
Ketamín sa vyskytuje ako voľná báza s teplotou topenia 92 – 93 °C, ktorá tvorí s kyselinou chlorovodíkovou soľ vo forme bieleho prášku, rozpustnú vo vode, metanole a etanole, málo rozpustnú v chloroforme. Dostupný je v ampulkách a fľašiach z tmavého skla vo forme číreho, bezfarebného roztoku s koncentráciou 1 %, 5 % alebo 10 %, určených na priame použitie 63–67. Ketamín je relatívne krátkodobo pôsobiace anestetikum so stredne silnou analgetickou aktivitou. Charakteristickým rysom ketamínu je jeho schopnosť inhibovať funkcie niektorých častí centrálneho nervového systému a zvyšovať aktivitu ostatných, čo spôsobuje takzvanú disociačnú anestéziu 68, 69. Okrem použitia v humánnej oblasti má aplikácie aj vo veterinárnej anestézii 70–74.
Ketamín vykazuje množstvo ďalších farmakologických účinkov. Je popísaná možnosť jeho použitia pri chronickej a neurospastickej bolesti 75–80, ako antidepresívum 81–83, pri iných psychických poruchách 84, 85, na zmiernenie závislosti na alkohole a heroíne 86, 87, pri epilepsii 88, 89 a pri paliatívnej starostlivosti 90, 91.
K metabolizácii dochádza hlavne v pečeni účinkom cytochrómu P450; hlavným metabolitom je norketamín. Biotransformácia ketamínu zodpovedá N-dealkylácii, hydroxylácii cyklohexánového kruhu, konjugácii na kyselinu glukurónovú a dehydratácii hydroxylových metabolitov za vzniku derivátov cyklohex-2-enónu 92–97.
Obr. 5. Chemická štruktúra ketamínu 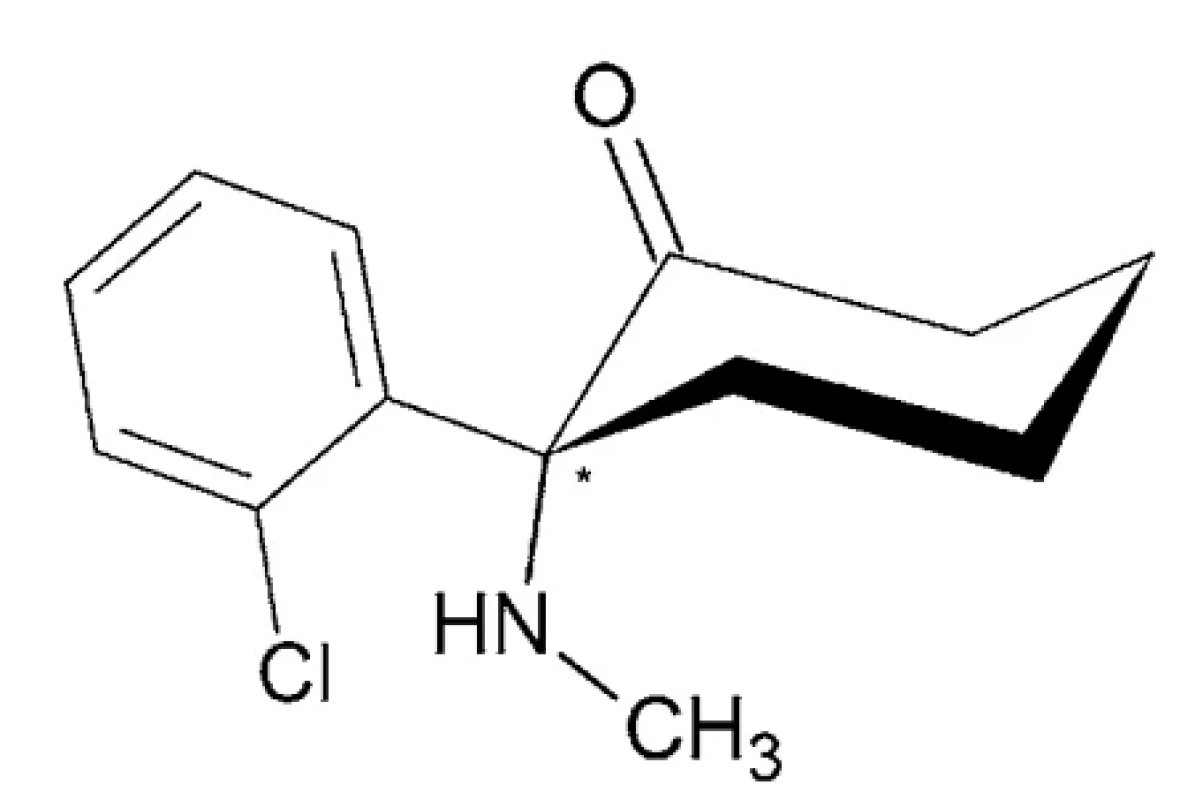
Esketamín – IUPAC názov: (2S)-2-(2-chlórfenyl)-2-(metylamino)cyclohexán-1-ón (obr. 6)
Esketamín je pravotočivý izomér ketamínu, ktorý je približne 2-krát účinnejší ako anestetikum v porovnaní s racemickým ketamínom. Z ľudského tela sa vylučuje rýchlejšie ako arketamín ((R)-(-)-ketamín) alebo racemický ketamín, hoci arketamín jeho vylučovanie spomaľuje 98–100.
Esketamín inhibuje transportéry dopamínu 8-krát účinnejšie než arketamín, čo zvyšuje dopamínovú aktivitu v mozgu. Pri dávkach spôsobujúcich rovnakú intenzitu účinkov je esketamín všeobecne považovaný za príjemnejší pre pacientov101.
Podobne ako ketamín aj esketamín je rýchlo pôsobiace antidepresívum102. V roku 2019 bol v Spojených štátoch schválený na použitie s inými antidepresívami na liečbu depresie u dospelých za predpokladu, že sa podáva v klinickom prostredí103. V auguste 2020 bol schválený americkým Úradom pre kontrolu potravín a liečiv (FDA) pre krátkodobú liečbu samovražedných myšlienok104.
Obr. 6. Chemická štruktúra esketamínu 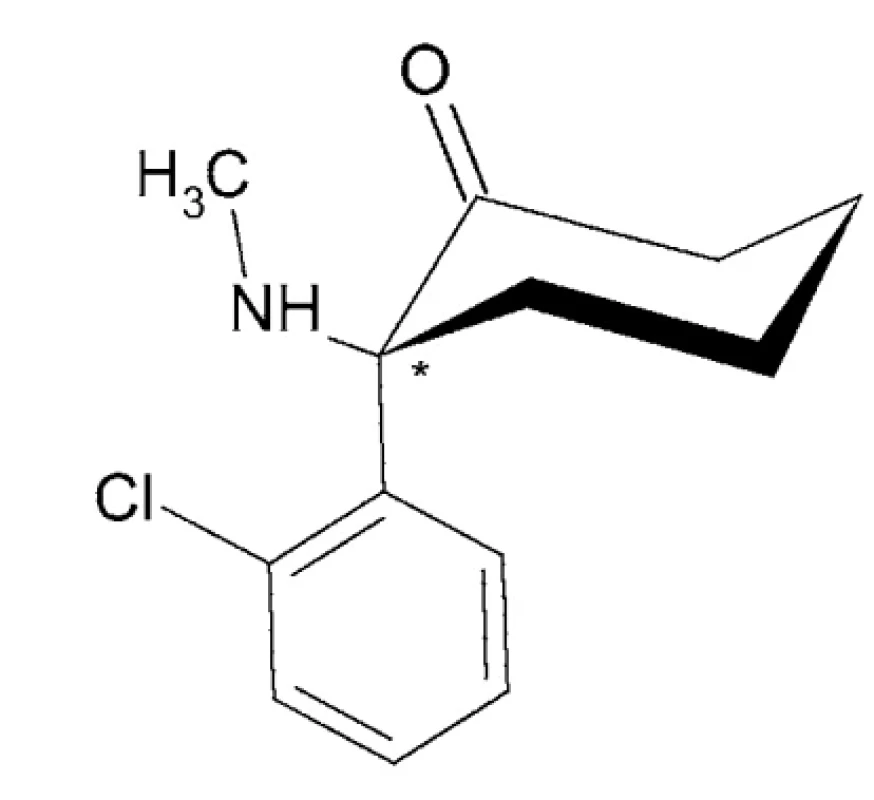
Propofol – IUPAC názov: 2, 6-diizopropylfenol (obr. 7) Ide o fenol s dvomi izopropylovými skupinami v polohách 2 a 6. Jeho teplota topenia je 18 °C, teplota varu 256 °C a log P 3,79. Je to číra kvapalina, slabo rozpustná vo vode, aplikovaná vo forme emulzie105.
Ide o intravenózne nebarbiturátové anestetikum fenolového charakteru s krátkym účinkom, ktoré si od svojho zavedenia na konci 80. rokov 20. storočia získalo široké uplatnenie.
Propofol má niekoľko mechanizmov účinku: jednak prostredníctvom aktivácie receptora GABAA a analógy propofolu tiež pôsobia ako blokátory sodíkových kanálov. Niektoré výskumy tiež naznačujú, že endokanabinoidný systém môže významne prispieť k anestetickému pôsobeniu propofolu a k jeho jedinečným vlastnostiam 106, 107.
Používa sa na operačných sálach na indukciu aj na udržanie sedácie. Vo veľkej miere nahradil tiopental sodný, pretože zotavenie z propofolu je rýchlejšie a okrem toho v porovnaní s ostatnými anestetikami je kvôli kratšej dĺžke pobytu na JIS pomerne lacný. Propofol sa tiež používa na status epilepticus, ak iné lieky nezabrali. Okrem viacerých výhodných vlastností pri anestézii má propofol množstvo neanestetických účinkov. Má anxiolytické vlastnosti, ktoré môžu súvisieť s niekoľkými neuromediátorovými systémami. Okrem toho má antioxidačné, imunomodulačné, slabé analgetické, antiemetické a neuroprotektívne účinky, inhibuje agregáciu krvných doštičiek a zvyšuje intracelulárny vápnik 108, 109. Okrem protizápalovej reakcie má tiež antitrombotický účinok, a to inhibíciou agregácie krvných doštičiek. Zvyšuje tiež produkciu oxidu dusnatého v leukocytoch a inhibíciu syntézy tromboxánu v krvných doštičkách110.
Obr. 7. Chemická štruktúra propofolu 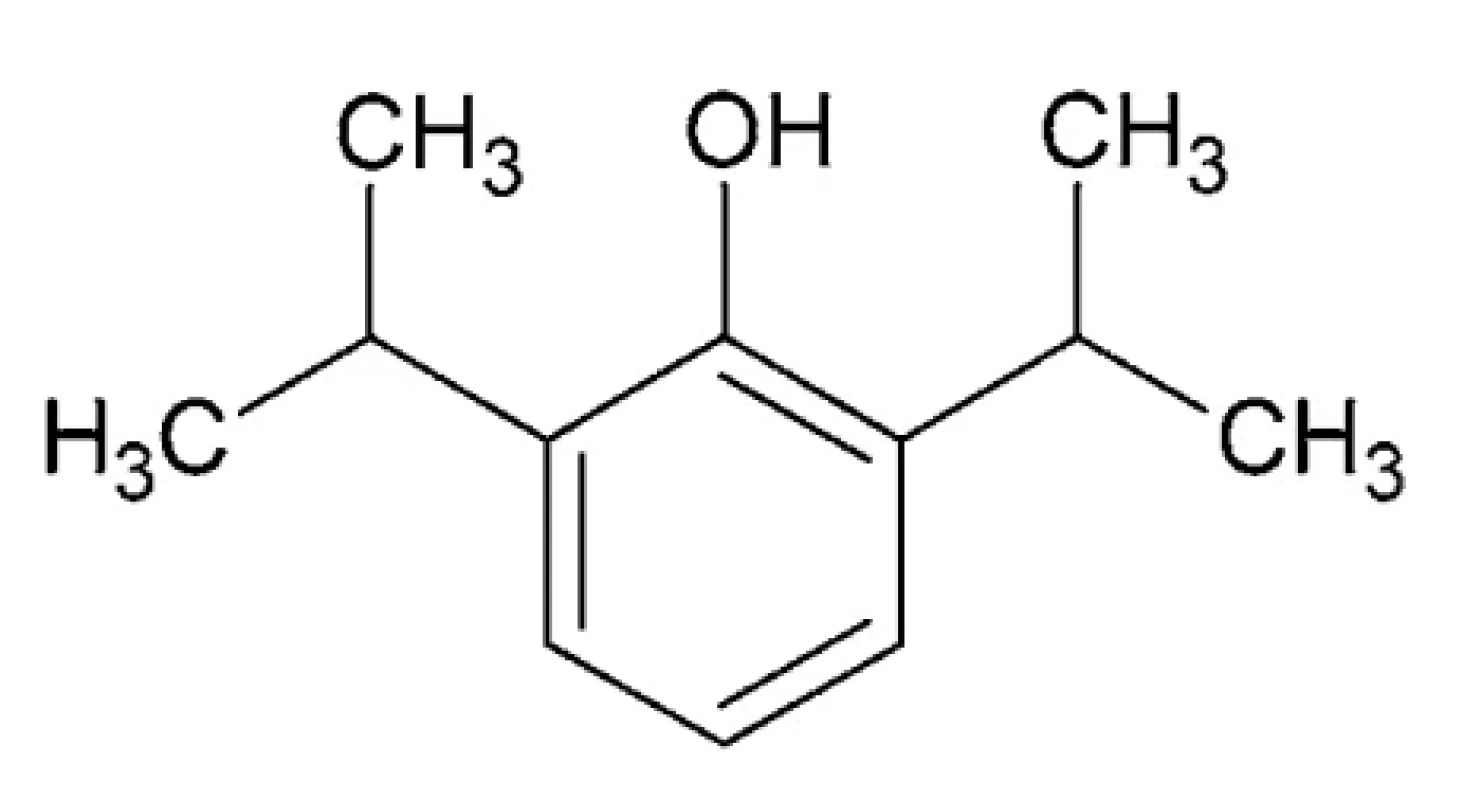
Propofol sa silne viaže na bielkoviny in vivo a metabolizuje sa konjugáciou v pečeni za vzniku glukuronidov111. Metabolizmus v pečeni prebieha na základe izoforiem cytochrómu P450112.
Metabolické cesty propofolu boli študované na niekoľkých druhoch organizmov a zahŕňajú priamu konjugáciu hydroxylovej skupiny a alifatickú alebo aromatickú hydroxyláciu v polohe 4, nasledovanú konjugáciou 2,6-diizopropyl-1,4-chinolu s kyselinou glukurónovou v polohách C1 a C4. Menšie množstvo propofolu v polohe C4 sa metabolizuje sulfatáciou katalyzovanou sulfotransferázou. Tento vedľajší metabolit sa podieľa na klírense propofolu u ľudí. Všetky metabolity sú neaktívne, okrem 2,6-diizopropyl-1,4-chinolu, ktorý má asi jednu tretinu hypnotickej aktivity propofolu113.
Bola vyvinutá a testovaná vo vode rozpustná forma proliečiva – fospropofol (dvojsodná soľ 2,6-diizopropylfenoxymetylfosfátu). Fospropofol sa rýchlo štiepi pomocou enzýmu alkalickej fosfatázy za vzniku propofolu. Farmakodynamický profil je podobný ako u propofolu, ale disodná soľ fospropofolu má rýchlejší nástup účinku a obnova sa predlžuje, pretože proliečivo sa musí najskôr previesť na aktívny metabolit 114–116.
Steroidné anestetiká – zmes dvoch steroidov alfadolónu a alfaxalónu
IUPAC názvy (alfadolón): 3α,21-dihydroxypregnán - -11,20-dión; (alfaxalón): 3α-hydroxypregnán-11,20 - -dión (obr. 8)
Po chemickej stránke ide o zmes dvoch syntetických pregnánových neurosteroidov alfaxalónu a alfadolónu, ktoré sú derivátmi progesterónu s hydroxyskupinami 117, 118. Mechanizmus účinku je založený na modulácii receptorov GABAA a NMDA 119–121.
Oba neuroaktívne steroidy alfaxalón (9 mg/ml) a alfadolón (3 mg/ml) v roztoku v Cremophor EL ako neiónovou povrchovo aktívnou prísadou majú krátkodobý účinok s významnou terapeutickou šírkou a s podobným účinkom ako u tiopentalu. Toto anestetikum je schopné znižovať intrakraniálny a vnútroočný tlak 122–126.
Obr. 8. Chemické štruktúry alfadolónu (a) a alfaxalónu (b) 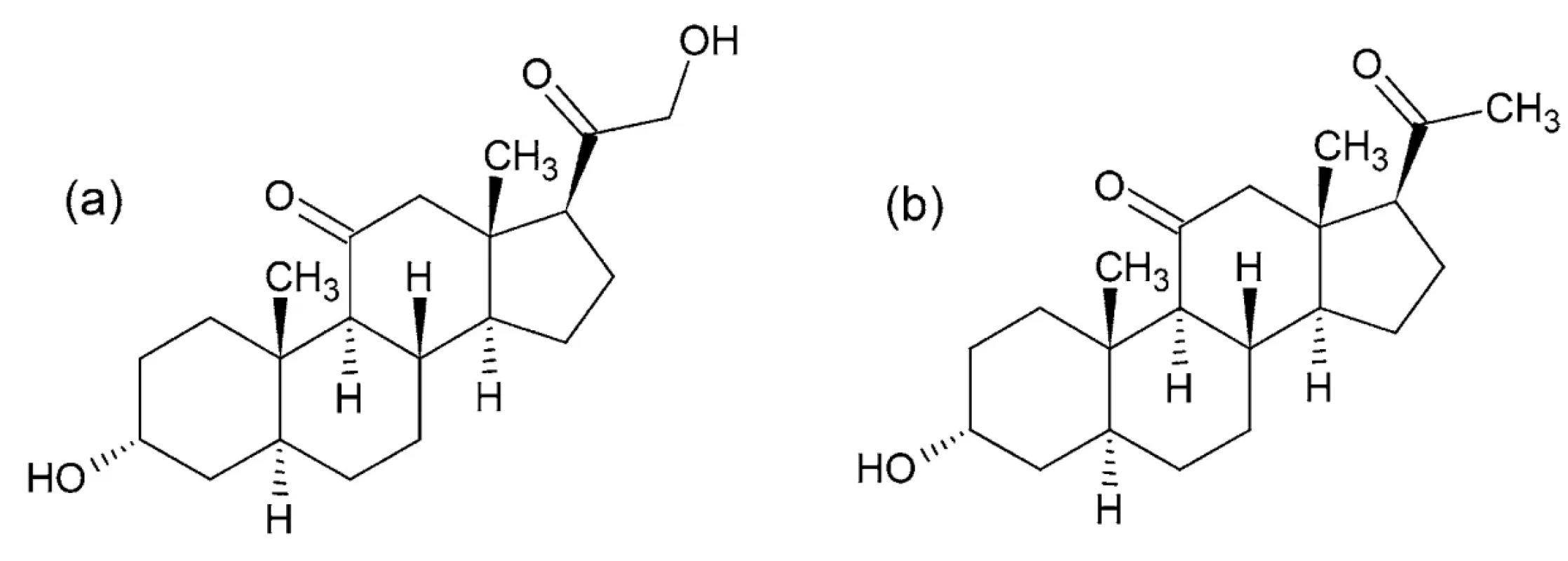
Cremophor® EL ako prísada, ktorou sa zvyšovala rozpustnosť vo vode, bola príčinou precitlivelosti, čo spôsobilo jeho stiahnutie z trhu. Z uvedeného dôvodu sa študovalo u alfaxolónu použitie sulfobutyléter-β-cyclodextrínu (SBECD) ako pomocnej látky na solubilizáciu tohto liečiva. Výsledky potvrdili, že sa nezmenil anestetický účinok127 a je vhodné jeho použitie vo veterinárnej anestéziologickej praxi 128–130.
Steroidné anestetiká obsahujú 8 chirálnych centier, čo vedie k zložitej stereochémii. V práci131 sa hodnotili u vybraných steroidov účinky na moduláciu receptora GABAA v súvislosti s anestetickým účinkom. Výsledky ukázali, že iba 5α-steroidy vykazujú vysoký stupeň stereoselektivity v porovnaní s 5β-steroidmi. Tieto údaje ukazujú, že rozpoznávacie miesto pre anestetický steroid je schopné rozlíšiť enantioméry.
Deriváty kyseliny fenyloctovej
Propanidid – IUPAC názov: propyl {4-[2-(dietylami - no)-2-oxoetoxy]-3-metoxyfenyl}acetát (obr. 9)
Propanidid je po chemickej stránke ester kyseliny octovej vo forme slabo žltého oleja o teplote varu 210 – 212 °C, prakticky nerozpustný vo vode, rozpustný v alkohole a chloroforme132.
Mechanizmus účinku je založený na aktivácii recep - torov kyseliny γ-aminomaslovej typu A. V práci bolo zis - tené, že pri tejto väzbe na receptor zohrávajú dôležitú úlohu aminokyselíny Asp245, Asp424, Asp425, Arg428, Phe307 a Ser308133.
Propanidid je ultra krátkodobo pôsobiace fenylace - tátové celkové anestetikum, ktoré pôvodne zaviedla spoločnosť Bayer v roku 1963. Vykazoval nízky výskyt excitačných alebo respiračných vedľajších účinkov a spôsobil rýchle prebudenie tým, že liek je rýchlo me - tabolizovaný a nie je redistribuovaný ako barbituráty. Jeho rozpustnosť vo vode bola dosiahnutá (ako 5 % alebo 20 % roztok) pomocou polyoxyetylovaného ri - cínového oleja (Cremophor EL), ktorý pôsobil ako so - lubilizačné činidlo. Cremophor EL však v niektorých prípadoch spôsobuje anafylaktické reakcie a zvýšenie hladiny histamínu u ľudí (pri intravenóznom aj perorál - nom podaní)134–136. Náhrada Cremophor EL použitého na zvýšenie rozpustnosti bola študovaná vo forme li - pozomálneho prípravku, ktorý bol dobre tolerovaný137. Zavedenie iných, bezpečnejších krátkodobo pôso - biacich liekov, ako je propofol, znamenalo stiahnutie propanididu z použitia138.
Obr. 9. Chemická štruktúra propanididu 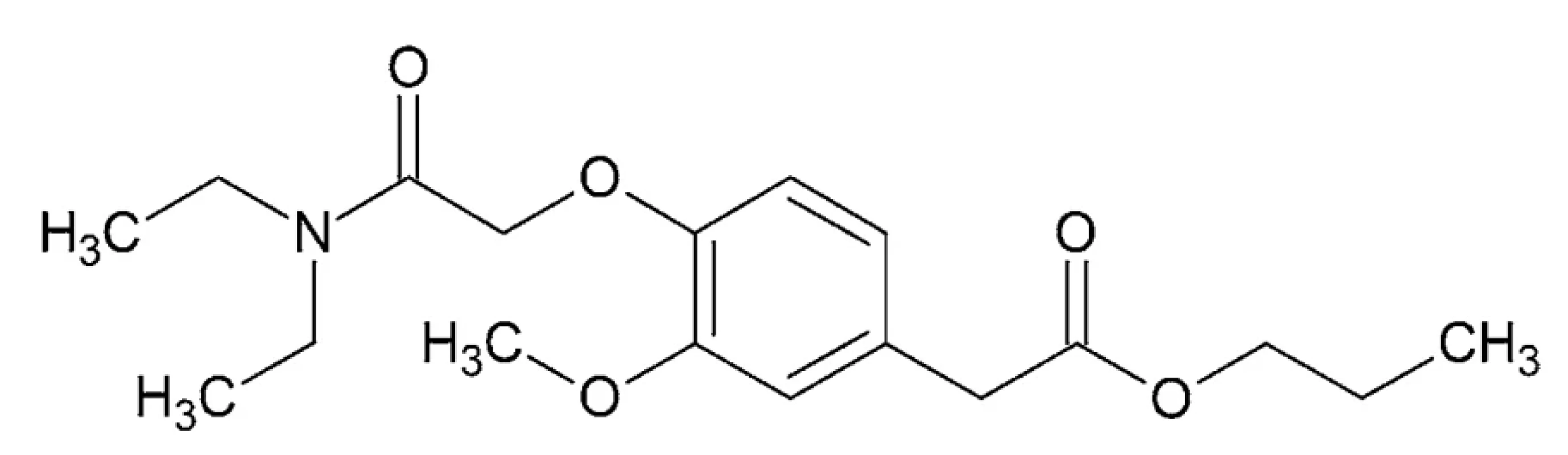
Práca bola podporovaná Vedeckou grantovou agentúrou MŠVVaŠ SR a SAV, grant VEGA 1/0145/20.
Stret záujmov: žiaden.
R. Čižmáriková • Ing. Ladislav Habala, PhD. • M. Markuliak
Farmaceutická fakulta UK
Katedra chemickej teórie liečiv
Odbojárov 10, 832 32 Bratislava, SR
e-mail: habala@fpharm.uniba.sk
Comenius University in Bratislava, Slovak Republic
Zdroje
- Lincová D., Farghali H., et al. Základní a aplikovaná far - makologie. 2. vydání. Praha: Galén 2007.
- Brodie M. J., Kwan P. Current position of phenobarbital in epilepsy and its future. Epilepsia 2012; 53 (8), 40−46.
- Bellante F., Legros B., Depondt Ch., Créteur J., Tacco - ne F. S., Gaspard N. Midazolam and thiopental for the treatment of refractory statu s epilepticus: a retrospecti - ve comparison of efficacy and safety J. Neurol. 2016; 263, 799–806.
- Kadiyala P. K., Kadiyala L. D. Anaesthesia for electro - convulsive therapy: An overview with an update on its role in potentiating electroconvulsive therapy. Indian J. Anaesth. 2017; 61(5), 373−380.
- Jindal S., Sidhu G. K., Kumari S., Kamboj P., Chauhan R. Etomidate versus propofol for motor seizure dura - tion during modified electroconvulsive therapy. Anesth. Essays Res. 2020; 14(1), 62–67.
- Mehta D., Palta S., Gupta N., Saroa R. Comparison of effect of etomidate with propofol on hemodynamics du - ring modified electroconvulsive therapy. J. Anaesthesiol. Clin. Pharmacol. 2022; 38(1), 104−110.
- Intravenózní a inhalační analgetika a anestetika. www. porodnice.cz (4. 3. 2023)
- Jean-Michel V., Caulier T., Delannoy P. Y., Meybeck A., Georges H. Thiopental as substitute therapy for critically ill patients with COVID-19 requiring mechanical ventilation and prolonged sedation. Med. Intensiva 2022; 46(1), 58–61.
- Čižmáriková R., Habala L., Markuliak M. Celkové inha - lačné anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti. Čes. slov. Farm. 2021; 70, 7–17.
- Weir C. J., Mitchell S. J., Lambert J. J. Role of GABA A receptor subtypes in the behavioural effects of intrave - nous general anaesthetics. Br. J. Anaesth. 2017; 119 (1), 67–75.
- Dickinson R., de Sousa S. L. M., Lieb W. R., Franks N. P. Selective synaptic actions of thiopental and its enantio - mers. Anesthesiology 2002; 96(4), 884–892.
- Cordato D. J., Chebib M., Mather L. E., Herkes G. K., Johnston G. A. Stereoselective interaction of thiopento - ne enantiomers with the GABA(A) receptor. Br. J. Pharma - col. 1999; 128 (1), 77–82.
- Berg-Johnsen J. Action mechanism of intravenous ane - sthetics. Tidsskr. Nor. Laegeforen 1993; 113(5), 565–568.
- Kitayama M., Hirota K., Kudo M., Kudo T., Ishihara H., Matsuki A. Inhibitory effects of intravenous anaesthe - tic agents on K(+)-evoked glutamate release from rat cerebrocortical slices. Involvement of voltage-sensi - tive Ca(2+) channels and GABA(A) receptors. Naunyn Schmiedebergs Arch. Pharmacol. 2002; 366(3), 246–253.
- Quibell R., Prommer E. E., Mihalyo M., Twycross R., Wilcock A. Therapeutic reviews: Ketamine. J. Pain Ma - nag. 2011; 41(3), 640–649.
- Kim J. J., Gharpure A., Teng J., Zhuang Y., Howard R. J., Zhu S., Noviello C. M., Walsh R. M. Jr., Lindahl E., Hibbs R. E. Shared structural mechanisms of general anaesthe - tics and benzodiazepines. Nature 2020; 585(7824), 303–308.
- Coates K. M., Mather L. E., Johnson R., Flood P. Thio - pental is a competitive inhibitor at the human alpha7 nicotinic acetylcholine receptor. Anesth. Analg. 2001; 92(4), 930−933.
- Downie D. L., Franks N. P., Lieb W. R. Effects of thiopen - tal and its optical isomers on nicotinic acetylcholine re - ceptors. Anesthesiology 2000; 93(3), 774–783.
- Dickinson R., de Sousa S. L., Lieb W. R., Franks N. P. Selective synaptic actions of thiopental and its enantio - mers. Anesthesiology 2002; 96(4), 884−892.
- Yagmurdur H., Ayyildiz A., Karaguzel E., Ogus E., Su - rer H., Caydere M., Nuhoglu B. C., Germiyanoglu C. The preventive effects of thiopental and propofol on tes - ticular ischemia-reperfusion injury. Acta Anaesth. Scand. 2006; 50(10), 1175−1317.
- Štourač P. Intravenozní anestetika. https://www.akutne.cz/res/file/prezentace/anesteziologie/intrave nozni-anestetika.ppt (4. 3. 2023).
- Celková anestezie. https://www.wikiskripta.eu/w/Celkov%C3%A1_anestezie (4. 3. 2023).
- Intravenózní anestetika. https://is.muni.cz/el/med/jaro2010/vsal081/um/anestetika.ppt (4. 3. 2023).
- Thiopental. https://pubchem.ncbi.nlm.nih.gov/compound/Thiopental (4. 3. 2023).
- Thiopental VUAB 0,5 g. https://www.adc.sk/databazy/produkty/detail/thiopental-vuab-0-5-g-359017.html (4. 3.2023).
- Thiopental VUAB 1,0 g. https://www.adc.sk/databazy/produkty/detail/thiopental-vuab-1-0-g-955524.html (4.3. 2023).
- Mather L. E., Edwards S. R. Chirality in anaesthesia –ropivacaine, ketamine and thiopentone. Curr. Opin. Anaesthesiol. 1998; 11(4), 383−390.
- Cordato D. J., Gross A. S., Herkes G. K., Mather L. E. Pharmacokinetics of thiopentone enantiomers fol - lowing intravenous injection or prolonged infusion of rac-thiopentone. Br. J. Clin. Pharmacol. 1997; 43(4), 355−362.
- Burke D., Henderson D. J. Chirality: a blueprint for the future. Br. J. Anaesth. 2002; 88(4), 563−576.
- Cordato D. J., Mather L. E., Gross A. S., Herkes G. K. Pharmacokinetics of thiopental enantiomers during and following prolonged high-dose therapy. Anesthesiology 1999; 91(6), 1693−1702.
- Haley T. J., Gidley J. T. Pharmacological comparison of R(+), S(–) and racemic thiopentone in mice. Eur. J. Phar - macol. 1976; 36, 211−214.
- Russo H., Bressolle F. Pharmacodynamics and phar - macokinetics of thiopental. Clin. Pharmacokinet. 1998; 35(2), 95−134.
- Nguyen K. T., Stephens D. P., McLeish M. J., Crankshaw D. P., Morgan D. J. Pharmacokinetics of thiopental and pen - tobarbital enantiomers after intravenous administration of racemic thiopental. Anesth. Analg. 1996; 83, 552−558.
- Mather L. E., Edwards S. R., Duke C. C., Cousins M. J. Enantioselectivity of thiopental distribution into the cen - tral neural tissue of rats: an interaction with halothane. Anesth. Analg. 1999; 89(1), 230−235.
- Winters W. D., Spector E., Wallach D. P., Shideman F. E. Metabolism of thiopental-S35 and thiopental-2-C14 by a rat liver mince and identification of pentobarbital as a major me - tabolite. J. Pharmacol. Exp. Ther. 1955; 114(3), 343–357.
- Palmer K. M., Fowler M. S., Wall M. E., Rhodes L. S., Waddell W. J., Baggett B. The metabolism of R(+) - and RS-pentobarbital. J. Pharmacol. Exp. Ther. 1969; 170(2), 355−363.
- Palmer K. H., Fowler M. S., Wall M. E. Metabolism of op - tically active barbiturates. II. S-(-)-pentobarbital. J. Phar - macol. Exp. Ther. 1970; 175(1), 38−41.151-83-7(Methohexital) ChemicalBook. https:// www.chemicalbook.com/ProductChemicalProper- tiesCB1492534_EN.htm (4. 3. 2023).
- Methohexital. https://pubchem.ncbi.nlm.nih.gov/com-pound/methohexital (4. 3. 2023).
- Schwartz R. D., Jackson J. A., Weigert D., Skolnick P., Paul S. M. Characterization of barbiturate-stimulated chloride efflux from rat brain synaptoneurosomes. J. Neurosci. 1985; 5(11), 2963−2970.
- Allan A. M., Harris R. A. Anesthetic and convulsant bar - biturates alter gamma-aminobutyric acid-stimulated chloride flux across brain membranes. J. Pharmacol. Exp. Ther. 1986; 238(3), 763–768.
- Welles J. S., McMahon R. E., Doran W. J. The metabo - lism and extretion of methohexital in the rat and dog. J. Pharmacol. Exp. Ther. 1963; 139(2), 166–171.
- Hexobarbital. https://www.chemicalbook.com/ChemicalProductProperty_EN_CB3744680.htm (4. 3. 2023).
- Hexobarbital. https://pubchem.ncbi.nlm.nih.gov/compound/Hexobarbital (4. 3. 2023).
- Hexobarbital. https://go.drugbank.com/drugs/DB01355 (4. 3. 2023).
- Tseilikman V. E., Kozochkin D. A., Manukhina E. B., Downey H. F., Tseilikman O. B., Misharina M. E., et al. Duration of hexobarbital-induced sleep and monoami - ne oxidase activities in rat brain: Focus on the behavioral activity and on the free-radical oxidation. Gen. Physiol. Biophys. 2016; 35(2), 175–183.
- Wahlstrom G. Differences in anaesthetic properties between the optical antipodes of hexobarbital in the rat. Life Sci. 1966; 5, 1781–1790.
- Takenoshita R., Toki S. [New aspects of hexobarbital metabolism: stereoselective metabolism, new metabolic pathway via GSH conjugation, and 3-hydroxyhexobarbital dehydrogenases]. Yakugaku Zasshi. 2004; 124(12), 857–871.550−558.
- Etomidate. https://www.chemicalbook.com/ChemicalProductProperty_EN_CB4113298.htm (4. 3. 2023).
- Godefroi E. F., van der Eijcken C. A. M. Imidazole car - boxylates. US Patent 3354173.
- Godefroi E. F, Janssen P. A. J., Van der Eycken C. A. M., Van Heertum A. H. M. T., Niemegeers C. J. E. DL-(1 - arylalkyl)imidazole-5-carboxylate esters: A novel type of hypnotic agents. J. Med. Chem. 1965; 56, 220–223.
- Morgan M., Lumley J., Whitwam J. G. Etomidate, a new water-soluble non-barbiturate intravenous induction agent. Lancet 1975; 321, 955–956.
- Giese J. L., Stanley T. H. Etomidate: A new intravenous anesthetic induction agent. Pharmacotherapy 1983; 3,251–258.
- Forman S. A. Clinical and molecular pharmacology of etomidate. Anesthesiology 2011; 114(3), 695–707.
- Al Ali M. S., Musa A., Hamadeh W., Seddik E. Etomida - te shows prospect as an anti-arrhythmic drug conferring safe sedation and sinus conversion simultaneously. Du - bai Med. J. 2020; 3, 105–108.
- Valk B. I., Struys M. M. R. F. Etomidate and its analogs: A review of pharmacokinetics and pharmacodynamics. Clin. Pharmacokinet. 2021; 60, 1253–1269.
- Saito K., Dan H., Masuda K., Katsu T., Hanioka N., Ya - mamoto S., Miyano K., Yamano S., Narimatsu S. Ste - reoselective hexobarbital 3’-hydroxylation by CYP2C19 expressed in yeast cells and the roles of amino acid re - sidues at positions 300 and 476. Chirality 2007; 19(7),
- Tomlin S. L., Jenkins A., Lieb W. R., Franks N. P. Stereo - selective effects of etomidate optical isomers on γ-ami - nobutyric acid type A receptors and animals. Anesthes - iology 1998; 88, 708–717.
- Janssen P. A., Niemegeers C. J., Schellekens K. H., Lenaerts F. M. Etomidate, R-(+)-ethyl-1-(-methyl - benzyl)imidazole-5-carboxylate (R 16659), a potent, short-acting and relatively atoxic intravenous hyp - notic agent in rats. Arzneimittelforschung 1971; 21, 1234–1243.
- Kaneda K., Yamashita S., Woo S., Han T. H. Population pharmacokinetics and pharmacodynamics of brief eto - midate infusion in healthy volunteers. J. Clin. Pharmacol. 2011; 51(4), 482–491.
- Carlos R., Calvo R., Erill S. Plasma protein binding of etomidate in patients with renal failure or hepatic cirrho - sis. Clin. Pharmacokinet. 1979; 4, 144–148.
- Heykants J. J. P., Brugmans J., Doenicke A. On the pharmacokinetics of etomidate (R26490) in human volunteers: Plasma levels, metabolism, and excretion. (R26490/1 Janssen Research Product Information Servi - ce), Clinical Research Report 1975; 4.
- Critical review of ketamine - WHO Critical Review Report. https://www.scribd.com/doc/77236539/34th-ECDD-20 06-Critical-Review-of-Ketamine (4. 3. 2023).
- Ketamine abuse. https://www.drugs.com/illicit/ketamine.html (4. 3. 2023).
- Ketamine: What is it, uses, treatments, effects, and more effects. https://www.medicalnewstoday.com/ articles/302663 (4. 3. 2023).
- Hakey P., Ouellette W., Zubieta J., Korter T. (S)-(+)-Ke - tamine hydrochloride. Acta Cryst. 2008; E64, o1487.
- O’Neil, M. J. (ed.). The Merck Index – An Encyclopedia of Chemicals, Drugs, and Biologicals. Cambridge: Royal Society of Chemistry 2013.
- Tang Y., Liu R., Zhao P. Ketamine: An update for obstet - ric anesthesia. Transl. Perioper. Pain Med. 2017; 4, 1–12.
- Barrett W., Buxhoeveden M., Dhillon S. Ketamine: a versatile tool for anesthesia and analgesia. Curr. Opin. Anaesthesiol. 2020; 33(5), 633−638.
- Arnbjerg J. Clinical use of ketamine-xylazine for anaesthesia in the cat. Nord. Vet. Med. 1979; 31(4), 145 – 154.
- Schmidt-Oechtering G. U., Alef M., Röcken M. Ane - sthesia of horses with xylazine and ketamine. 2. Anesthe - sia in adult horses. Tierarzt. Prax. 1990; 18(1), 47−52.
- Lin H. C., Passler T., Wilborn R. R., Taintor J. S., Caldwe- ll F. J. A review of the general pharmacology of ketamine and its clinical use for injectable anaesthesia in horses Equine veterinary education 2015; 27(3), 146−155.
- Ibrahim A. Evaluation of total intravenous anesthesia by ketamine-xylazine constant rate infusion in dogs: A novel preliminary dose study. Vet. Med. Open J. 2017; 2(2), 38–44.
- Baumgartner C., Bollerhey M., Ebner J., Laacke-Sin - ger L., Schuster T., Erhardt W. Effects of ketamine-xyla - zine intravenous bolus injection on cardiovascular func - tion in rabbits. Can. J. Vet. Res. 2010; 74(3), 200−208.
- Abdollahpour A., Saffarieh E., Zoroufchi B. H. A re - view on the recent application of ketamine in management of anesthesia, pain, and health care. J. Family Med. Prim. Care 2020; 9(3), 1317–1324.
- Hana Z., Abdulla S., Alam A., Ma D. Ketamine: Old drug but new use for neuropathic pain. Transl. Perioper. Pain Med. 2018; 5, 1–13.
- Vadivelu N., Schermer E., Kodumudi V., Belani K., Urman R. D., Kaye A. D. Role of ketamine for analgesia in adults and children. J. Anaesthesiol. Clin. Pharmacol. 2016; 32(3), 298–306.
- Pourmand A., Mazer-Amirshahi M., Royall C., Alhawas R., Shesser R. Low dose ketamine use in the emergency department, a new direction in pain management. Am. J. Emerg. Med. 2017; 35(6), 918–921.
- Niesters M., Martini Ch., Dahan A. Ketamine for chro - nic pain: risks and benefits. Br. J. Clin. Pharmacol. 2014; 77(2), 357−367.
- Culp C., Kim H. K., Abdi S. Ketamine use for cancer and chronic pain management. Front. Pharmacol. 2021; 11, 599721.
- Hashimoto K. Ketamine’s antidepressant action: beyond NMDA receptor inhibition. Expert Opin. Ther. Targets. 2016; 20(11), 1389–1392.
- Berman R. M., Cappiello A., Anand A., Oren D. A., He - ninger G. R., Charney D.S., Krystal J. H. Antidepressant effects of ketamine in depressed patients. Biol. Psychiat - ry 2000; 47, 351–354.
- Marcantoni W. S., Akoumba B. S., Wassef M., Mayrand J., Lai H., Devantoy S. R., Beauchamp S. A systematic review and meta-analysis of the efficacy of intravenous ketamine in - fusion for treatment resistant depression: January 2009 – Janu - ary 2019. J. Affect. Disord. 2020; 277, 831–841.
- Witt K., Potts J., Hubers A., Grunebaum M. F., Mur - rough J. W., Loo C., Cipriani A., Hawton K. Ketamine for suicidal ideation in adults with psychiatric disorders: A systematic review and meta-analysis of treatment trials. Australian & New Zealand Journal of Psychiatry 2020; 54(1), 29–45.
- Wilkowska A., Szałach L., Cubala W. J. Ketamine in bi - polar disorder: A review. Neuropsychiatr. Dis. Treat. 2020; 16, 2707−2717.
- Das R. K., Gale G., Walsh K., Hennessy V. E., Iskandar G., Mordecai L. A., Brandner B., Kindt M., Curran H. V., Kamboj S. K. Ketamine can reduce harmful drinking by pharmacologically rewriting drinking memories. Nat. Commun. 2019; 10, 5187.
- Krupitsky E., Burakov A., Romanova T., Dunaevsky I., Strassman R., Grinenko A. Ketamine psychotherapy for heroin addiction: immediate effects and two-year fol - low-up. J. Subst. Abuse Treat. 2002; 23(4), 273−283.
- Niquet J., Baldwin R., Norman K., Suchomelova L., Lumley L., Claude G., Wasterlain C. G. Simultaneous triple therapy for the treatment of status epilepticus. Ne - urobiol. Dis. 2017; 104, 41–49.
- Rosati A., De Masi S., Guerrini R. Ketamine for refrac - tory status epilepticus: A systematic review. CNS Drugs 2018; 32, 997–1009.
- Okon T. Ketamine: an introduction for the pain and pal - liative medicine physician. Pain Physician 2007; 10(3), 493–500.
- Goldman N., Frankenthaler M., Klepacz L. The efficacy of ketamine in the palliative care setting: A comprehen - sive review of the literature. J. Palliat. Med. 2019; 22(9), 1154−1161.
- Dayton P. G., Stiller R. L., Cook D. R., Perel J. M. The binding of ketamine to plasma proteins: emphasis on human plasma. Eur. J. Clin. Pharmacol. 1983; 24, 825–831.
- Zhao X., Venkata S. L., Moaddel R., Luckenbaugh D. A., Brutsche N. E., Ibrahim L., Zarate C. A. Jr., Mager D. E., Wainer I. W. Simultaneous population pharmacoki - netic modelling of ketamine and three major metaboli - tes in patients with treatment-resistant bipolar depres - sion. Br. J. Clin. Pharmacol. 2012; 74(2), 304–314.
- Zanos P., Moaddel R., Morris P. J., Riggs L. M., HighlandJ. N., Georgiou P., Pereira E. F. R., Albuquerque E. X., Thomas C. J., Zarate, Jr. C. A., Gould T. D. Ketamine and ketamine metabolite pharmacology: Insights into therapeutic mechanisms. Pharmacol. Rev. 2018; 70(3), 621–660.
- Kamp J., Jonkman K., van Velzen, M., Aarts L., Nies - ters M., Dahan A., Olofsen E. Pharmacokinetics of ke - tamine and its major metabolites norketamine, hydroxy - norketamine, and dehydronorketamine: a model-based analysis. Br. J. Anaesth. 2020; 125(5), 750e761.
- Dinis-Oliveira R. J. Metabolism and metabolomics of ketamine: a toxicological approach. Forensic Sci. Res. 2017; 2, 2–10.
- Hijazi Y., Boulieu R. Contribution of CYP3A4, CYP2B6, and CYP2C9 isoforms to N-demethylation of ketamine in human liver microsomes. Drug Metab. Dispos. 2002; 30, 853–858.
- Himmelseher S., Pfenninger E. The clinical use of S-(+)-ketamine a determination of its place. Anästhesio - logie, Intensivmedizin, Notfallmedizin, Schmerztherapie 1998; 33(12), 764–770.
- Zielmann S., Kazmaier S., Schnüll S., Weyland A. S-(+)-Ketamin und Kreislauf [S-(+)-Ketamine and circula - tion]. Anaesthesist 1997; 46(1), S43–S46.
- Ihmsen H., Geisslinger G., Schüttler J. Stereoselective pharmacokinetics of ketamine: R(–)-ketamine inhibits the elimination of S(+)-ketamine. Clin. Pharmacol. Ther. 2001; 70(5), 431–438.
- Nishimura M., Sato K. Ketamine stereoselectively in - hibits rat dopamine transporter. Neurosci. Lett. 1999; 274(2), 131–134.
- Turner E. H. Esketamine for treatment-resistant depres - sion: seven concerns about efficacy and FDA approval. Lancet Psychiat. 2019; 6(12), 977–979.
- Wajs E., Aluisio L., Holder R., Daly E., Lane R., Lim P., et al. Esketamine nasal spray plus oral antidepressant in patients with treatment-resistant depression: Asses - sment of long-term safety in a phase 3, open-label study (SUSTAIN-2). J. Clin. Psychiatry 2020; 81(3), 19m12891.
- Canuso C. M., Ionescu D. F., Li X., Qiu X., Lane R., Tur - koz I., Nash A. I., Lopena T. J., Fu D. J. Esketamine nasal spray for the rapid reduction of depressive symptoms in major depressive disorder with acute suicidal idea - tion or behavior. J. Clin. Psychopharmacol. 2021; 41(5), 516–524.
- Lewis, R. J., Sr. (Ed.). Hawley’s Condensed Chemical Dictio - nary. 13th ed. New York: John Wiley & Sons, Inc. 1997; 391.
- Hemmings H. C., Mackie K. The rivers of Lethe and Mnemosyne converge: propofol and memory consolida - tion. Anesthesiology 2011; 114(6), 1277−1279.
- Trapani G., Altomare C., Liso G., Sanna E., Biggio G. Propofol in anesthesia. Mechanism of action, structu - re-activity relationships, and drug delivery. Curr. Med. Chem. 2000; 7(2), 249−271.
- Vasileiou I., Xanthos T., Koudouna E., Perrea D., Klo - naris Ch., Katsargyris A., Papadimitriou L. Propofol: a review of its non-anaesthetic effects. Eur. J. Pharmacol. 2009; 605(1–3), 1−8.
- Murphy P. G., Myers D. S., Davies M. J., Webster N. R., Jones J. G. The antioxidant potential of propofol (2,6-di - isopropylphenol) Br. J. Anaesth. 1992; 68, 613–618.
- Petros A. J., Bogle R. G., Pearson A. D. Propofol stimu - lates nitric oxide release from cultured porcine aortic en - dothelial cells. Br. J. Pharmacol. 1993; 109, 6–7.
- Altmayer P., Buch U., Buch H. P. Propofol binding to human blood proteins. Drug Research. 1995; 45(10), 1053–1056.
- Guitton J., Buronfosse T., Desage M., Flinois J. P., Perdrix J. P., Brazier J. L., Beaune P. Possible involvement of multiple human cytochrome P450 isoforms in the liver metabolism of propofol. Br. J. Anaesth. 1998; 80, 788–795.
- Dinis-Oliveira R. J. Metabolic profiles of propofol and fospropofol: Clinical and forensic interpretative aspects. Biomed. Res. Int. 2018; 2018, 6852857.
- Fechner J., Ihmsen H., Jeleazcov C., Schüttler J. Fospropofol disodium, a water-soluble prodrug of the in - travenous anesthetic propofol (2,6-diisopropylphenol). Expert. Opin. Investig. Drugs 2009; 18(10), 1565–1571.
- Welliver M., Rugari S. M. New drug, fospropofol diso - dium: a propofol prodrug. AANA J. 2009; 77(4), 301–308.
- Maas A., Maier C., Iwersen-Bergmann S., Madea B., Hess C. Simultaneous extraction of propofol and propo - fol glucuronide from hair followed by validated LC–MS/ MS analyses. J. Pharm. Biomed. Anal. 2017; 146, 236–243.
- Alfaxalone. https://pubchem.ncbi.nlm.nih.gov/compound/Alfaxalone (4. 3. 2023).
- Alfadolone acetate. https://pubchem.ncbi.nlm.nih.gov/ compound/Alfadolone-acetate (4. 3. 2023).
- Martinez-Botella G., Ackley M. A., Salituro F. G., Do - herty J. J. Natural and synthetic neuroactive steroid modulators of GABAA and NMDA receptors. Annu. Rep. Med. Chem. 2014; 49, 27–42.
- Seljeset S., Laverty D., Smart T. G. Inhibitory neurosteroids and the GABAA receptor. Adv. Pharmacol. 2015; 72, 165–187.
- Alvarez L. D., Pecci A. Structure and dynamics of neu - rosteroid binding to the α 1 β 2 γ 2 GABAA receptor. J. Ste - roid. Biochem. Mol. Biol. 2018; 182, 72–80.
- Cornet W. T., Popescu D. T. Althesin (alphadione, CT 1341) a ’new’ induction agent for anesthesia. Arch. Chir. Neerl. 1977; 29(2), 135–147.
- Kharasch E. D., Hollmann M. W. Steroid anesthesia revi - sited: Again. Anesth. Analg. 2015; 120(5), 983−984.
- Towler C. M., Garrett R. T., Sear J. W. Althesin infusions for maintenance of anaesthesia. Anaesthesia 1982; 37, 428–439.
- Sear J. W. Steroid anesthetics: old compounds, new dru - gs. J. Clin. Anesth. 1996; 8(3 Suppl), 91S–98S.
- Manzella F. M., Covey D. F., Jevtovic-Todorovic V., Todorovic S. M. Synthetic neuroactive steroids as new sedatives and anaesthetics: Back to the future. J. Neuro - endocrinol. 2022; 34(2), e13086.
- Goodchild C. S., Serrao J. M., Kolosov A., Boyd B. J. Alphaxalone reformulated: A water-soluble intravenous anesthetic preparation in sulfobutyl-ether-β-cyclodex - trin. Anesth. Analg. 2015, 120(5), 1025–1031.
- Muir W., Lerche P., Wiese A., Nelson L., Pasloske K., Whittem T. The cardiorespiratory and anesthetic effects of clinical and supraclinical doses of alfaxalone in cats. Vet. Anaesth. Analg. 2009; 36, 42−54.
- Tamura J., Ishizuka T., Fukui S., Oyama N., Kawase K., Miyoshi K., Sano T., Pasloske K., Yamashita K. The pharmacological effects of the anesthetic alfaxalone af - ter intramuscular administration to dogs. J. Vet. Med. Sci. 2015; 77(3), 289–296.
- Whittem T., Pasloskhe K. S., Heit M. V., Ranasinghe M. G. The pharmacokinetics and pharmacodynamics of alfaxalone in cats after single and multiple intra - venous administration of Alfaxan at clinical and su - praclinical doses. J. Vet. Pharmacol. Ther. 2008; 31(6), 571−579.
- Covey D. F., Nathan D., Kalkbrenner M., Nilsson K. R., Hu Y., Zorumski C. F., Evers A. S. Enantioselectivity of pregnanolone‐induced gamma‐aminobutyric acid(A) receptor modulation and anesthesia. J. Pharmacol. Exp. Ther. 2000; 293,1009–1016.
- Propanidid. https://www.drugfuture.com/chemdata/ Propanidid.html (4. 3. 2023).
- Wang S., Liu Q., Li X., Zhao X., Qiu L., Lin J. Possible bin - ding sites and interactions of propanidid and AZD3043 within the γ-aminobutyric acid type A receptor (GABAAR).J. Biomol. Struct. Dyn. 2018; 36(15), 3926–3937.
- Ball Ch., Westhorpe R., Kaye G. Museum of Anaesthetic History. Anaesth. Intensive Care 2002; 30(3), 2002.
- Wyant G. M., Zoerb D. L. Propanidid – a new non-bar - biturate intravenous anaesthetic. Can. Anaesth. Soc. J. 1965; 12(6), 569–586.
- Christmas D. Immune reaction to propanidid. Anaesthe - sia 1984; 39, 470–473.
- Klockgether-Radke A., Kersten J., Schröder T., Staffor- st D., Kettler D., Hellige G. Anesthesia with propanidid in a liposomal preparation. An experimental study in swi - ne. Der Anaesthesist 1995; 44(8), 573–580.
- Deschodt J., Lubrano J. F., Peschaud J. L., Eledjam J. J., du Cailar J. Comparison of propofol and propanidid administered at a constant rate. Ann. Fr. Anesth. Reanim. 1988; 7, 459–463.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2023 Číslo 4- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Celkové intravenózne anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
- Diazotační titrace v lékopisné kontrole jakosti léčiv a návrhy pro jejich revizi v Evropském lékopisu*
- Vliv digoxinu, valproátu sodného a celekoxibu na mozkovou cyklooxygenázovou dráhu a neuron-specifickou enolázu při pentylenetetrazolem podnícené záchvaty u myší
- Studium protizánětlivých vlastností hustého extraktu Tribulus terrestris L.
- Syntéza, charakterizace, studie molekulárního dokování nových alkylových derivátů 5-(2-brom-4-fluorfenyl)-4-ethyl- 4H-1,2,4-triazol-3-thiolu
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Celkové intravenózne anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
- Studium protizánětlivých vlastností hustého extraktu Tribulus terrestris L.
- Vliv digoxinu, valproátu sodného a celekoxibu na mozkovou cyklooxygenázovou dráhu a neuron-specifickou enolázu při pentylenetetrazolem podnícené záchvaty u myší
- Diazotační titrace v lékopisné kontrole jakosti léčiv a návrhy pro jejich revizi v Evropském lékopisu*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



