-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Další vývoj obsahu Národní části Českého lékopisu 2017 v jeho doplňcích z pohledu přípravy léčiv v lékárnách
Further development of the content of the national part of the Czech Pharmacopoeia 2017 in its supplements from the point of view of drug preparation in pharmacies
The paper deals with developing the national part of the Czech Pharmacopoeia 2017 (CL 2017) in its supplements from 2018, 2019, and 2020. It focuses on the preparation of medicinal products in pharmacies. The possibilities of further developing the national part of the CL 2017 to accelerate the necessary changes in its content are also discussed.
Keywords:
Czech Pharmacopoeia 2017 – supplements 2018, 2019, 2020 – content of the national part – preparation of medicinal products in pharmacies
Autoři: Jan Šubert 1; Jozef Kolář 2
Působiště autorů: Dušínova 1512/42, 664 34 Kuřim 1; Kamenačky 25, 636 00 Brno 2
Vyšlo v časopise: Čes. slov. Farm., 2021; 70, 3-6
Kategorie: Přehledy a odborná sdělení
doi: https://doi.org/https://doi.org/10.5817/CSF2021-1-3Souhrn
Příspěvek se zabývá vývojem obsahu Národní části Českého lékopisu 2017 v jeho doplňcích z roku 2018, 2019 a 2020 z pohledu přípravy léčivých přípravků v lékárnách. Diskutovány jsou také možnosti dalšího vývoje Národní části Českého lékopisu k urychlení potřebných změn v jejím obsahu.
Klíčová slova:
Český lékopis 2017 – doplňky 2018, 2019, 2020 – obsah Národní části – příprava léčivých přípravků v lékárnách
Český lékopis (ČL) 20171) byl v posledních letech rozšířen o doplňky (Dopl.) 2018, 2019 a 20202–4). Z obsahu jejich Národní části (NČ) je z pohledu přípravy léčiv v lékárnách nejvýznamnějším krokem zařazení článku Adeps suillus stabilisatus na vepřové sádlo stabilizované 0,01 % propyl-gallátu do doplňku z roku 20204) s použitelností 6 měsíců při uchovávání v rozmezí teplot 2–8 °C. Odpovídající článek Československého lékopisu 4. vydání (ČsL 4)5) byl přes poptávku dermatologů v roce 19976) z lékopisu vypuštěn a ponechán v něm byl k dodávkám do lékáren nepoužitelný článek na nestabilizované vepřové sádlo s použitelností nejvýše 21 dnů. Tím byly lékárny stavěny před volbu odmítat recepty na individuálně připravované léčivé přípravky (IPLP) s vepřovým sádlem nebo vepřové sádlo bez atestu farmaceutické jakosti nakupovat mimo Státním ústavem pro kontrolu léčiv (SÚKL) schválené dodavatele a porušovat jeho použitím k přípravě platnou legislativu. Až v posledních letech dodával do lékáren v ČR Fagron a. s. vepřové sádlo stabilizované 0,01 % propyl-gallátu, tedy produkt odpovídající složením lékopisnému článku Adeps suillus stabilisatus ČsL 4, s dobou použitelnosti 6 měsíců7, 8). Řada článků na přípravky připravované v lékárnách je v doplňcích ČL 2017 z let 2018–2020 revidována dílčími úpravami. Mezi ně patří mimo jiné Acidi salicylici unguentum 1% cum etheroleo lavandulae v Dopl. 20182). Chybí v nich ale i nadále zařazení nových článků na často předepisované přípravky, jako např. je 50% suspenze oxidu zinečnatého v oleji, která patří ke standardu naší dermatologické receptury9), před rokem 2010 byla nejčastěji v České republice předepisovanou suspenzí k aplikaci na kůži připravovanou v lékárně10), podle práce z roku 2011 byla patnáctým nejčastěji předepisovaným IPLP11) a je plně aktuální i v současnosti. Standardizaci složení a postupu přípravy článkem v NČ ČL by proto zasluhovala. Je zařazena i v různých zahraničních kodexech, např. v Německu12, 13), ve Švýcarsku14), nalézt ji lze ale i v posledním vydání lékopisu v Japonsku15). Přípravek obsahující jako hlavní složky hydroxid hořečnatý a slunečnicový nebo olivový olej je naproti tomu národní a je po desetiletí stálicí naší dermatologické receptury, podle11) byl v době sběru dat čtrnáctým nejčastěji předepisovaným IPLP. O jeho zařazení do lékopisu bylo rozhodnuto Lékopisnou komisí (LK) ČR již v roce 1986 a bylo zadáno vypracování lékopisného článku16). Článek pro lékopis byl připraven, lékopisné oddělení SÚKL však další práce nutné k jeho zařazení do lékopisu zastavilo kvůli problémům souvisejícím s požadavkem na sterilitu přípravků na spáleniny s tím, že problém bude řešitelný až v novém lékopisu17). Využití přípravku v léčebné praxi však bylo a je podstatně širší a stanovisko lékopisného oddělení SÚKL nebránilo tomu, aby SÚKL toleroval výrobu a distribuci přípravku jako nesterilního několika výrobcům. Důvody, proč tomu tak bylo a proč přípravek zůstává i po 34 letech od rozhodnutí LK o jeho zařazení do lékopisu mimo NČ ČL, by snad bylo možné nalézt v archivu SÚKL. Obdobně chybí v doplňcích ČL 2017 z let 2018–2020 řešení většiny dílčích problémů NČ ČL 20171), na které bylo upozorněno v roce 201818), přičemž jejich odstranění v řadě případů není vázáno na experimentální ověřování. Nejsou revidovány ani chybné údaje v tabulce XVI: Skladování a doba použitelnosti přípravků připravených v lékárně, přičemž tyto údaje jsou pro lékárny v České republice přes pokyn SÚKL jediným dostupným vodítkem. Vlastní zkoušky stability za podmínek uvedených v úvodu tabulky XVI ČL 2017 pro ně nejsou reálné.
Co naopak v NČ ČL 2017 i po vyjití jeho doplňku z roku 20204) přebývá, je počet přípravků s obsahem kyseliny borité, určených k jiné aplikaci než do oka. Kyselinu boritou považuje Evropská agentura pro chemické látky (European Chemicals Agency) již delší dobu za nebezpečnou chemickou látku, která byla zařazena mezi látky vzbuzující mimořádné obavy jako látka toxická pro reprodukci19). Zahraniční receptáře a lékopisy se proto přípravků s obsahem kyseliny borité (a tetraboritanu sodného, se kterým je spojen analogický problém) na rozdíl od ČL zbavují, nebo se jich už s výjimkou přípravků určených k aplikaci do oka zbavily (tab. 1). Ve Slovenské republice jsou přípravky obsahující kyselinu boritou sice ještě zařazeny i v novějším vydání Slovenského farmaceutického kódexu (SFK)22), lékopisná komise SR a ŠÚKL však apelovaly před jeho vydáním na omezení používání kyseliny borité a jejich solí jako součástí IPLP24). V České republice bylo upozorněno na riziko používání kyseliny borité v pediatrické receptuře25). Že by její používání k přípravě IPLP mohlo být výrazně omezeno i v našich podmínkách ukazuje publikace9). Pomoci by tomu mohlo i snížení počtu přípravků obsahujících kyselinu boritou v NČ ČL. Jako první krok k tomu se nabízí revize složení přípravku Solutio Castellani sine fuchsino, ve kterém kyselina boritá zřejmě není pro požadovaný účinek důležitá. Poukazuje na to švýcarský receptář14), ve kterém lze nalézt pět variant složení Castellanova roztoku, přičemž žádná z nich kyselinu boritou neobsahuje. Důležitější pro účinek přípravku je velmi pravděpodobně fuchsin. V Německu proto po složitějším vývoji popsaném v26) po roce 1996 nahradil Solutio Castellani 0,5% vodný roztok fuchsinu obsahující určitý podíl ethanolu. Česká cesta vedla opačným směrem, jedinou větší změnou složení Castellanova roztoku od Praescriptiones Pharmaceuticae 1972 (P. P. 1972), kde bylo rozepsáno složení přípravku s fuchsinem a přípravek bez fuchsinu lékárna připravila jen v případě, že to předepsal lékař27), byl přechod na složení přípravku bez fuchsinu. To bylo rozepsáno poprvé v Českém farmaceutickém kodexu (ČFK) z roku 199328). Vzhledem k tomu, že účinnost přípravku bez fuchsinu není podle odborné literatury stejná jako účinnost přípravku s fuchsinem a přípravek ve složení podle ČL obsahuje i další součásti hodnocené z dnešního pohledu jako nebezpečné, je žádoucí posouzení složení Castellanova roztoku podle Českého lékopisu a fuchsinu z hlediska terapeutických přínosů a rizik jednotlivých látek. Toto posouzení bylo navrženo již v roce 200526). Pokud se pro ně na úrovni LK MZ ČR a SÚKL nenajde prostor ani nyní, nemělo by být problémem alespoň upravit složení přípravku vypuštěním kyseliny borité a zavedením stabilizace nízké úrovně výchozího zbarvení přípravku přídavkem 0,02 % edetanu disodného. Návrh v tomto směru byl zaslán LK MZ ČR v roce 200029), později byl experimentálně ověřen s přípravkem ve složení podle ČL30) a znovu bezvýsledně opakován, přestože tento typ stabilizace Castellanova roztoku je předepsán (a zřejmě tedy je vhodný) u tří z pěti variant složení Castellanova roztoku v14).
Tab. 1. Počet článků na léčivé přípravky obsahující kyselinu boritou* v Národní části Českého lékopisu a v některých zahraničních lékopisech, kodexech a receptářích (příklady) 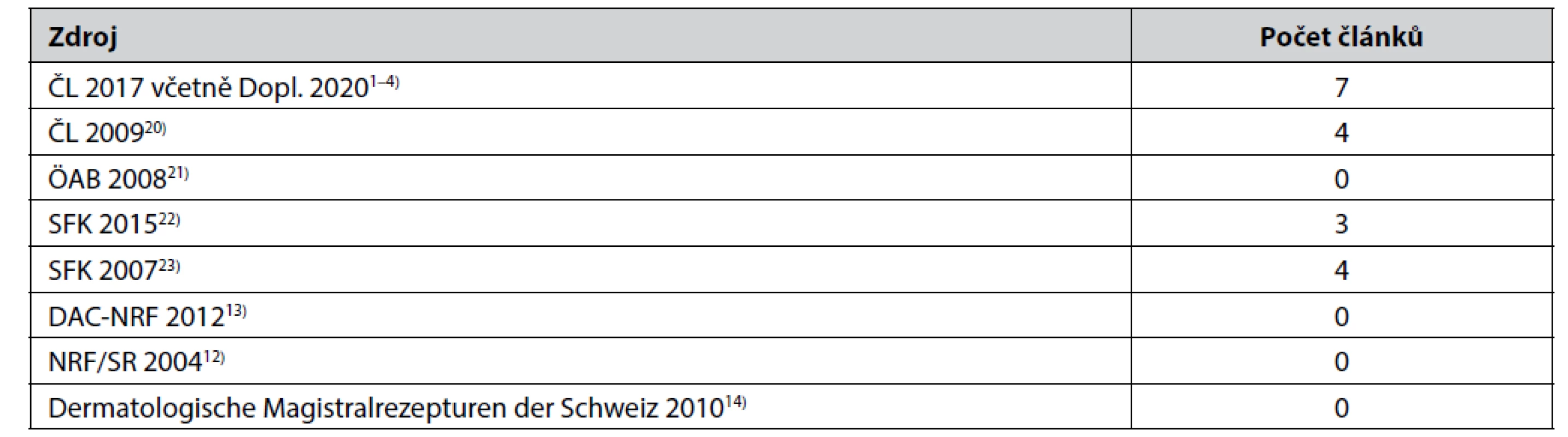
* mimo přípravky určené k aplikaci do očí Výše uvedené příklady (a řada dalších zmíněná v18) a dříve) dokládají pokračující stagnaci na tomto úseku lékopisné práce v České republice a potvrzují obavu, že NČ ČL je pro Lékopisnou komisi MZ ČR dlouhodobě jen okrajovou záležitostí těžící především z minulosti. Jde o problém, který vznikal postupně celá desetiletí, mimo jiné vzhledem ke způsobu práce sekretariátu Lékopisné komise, zejména po změnách ve funkci předsedy LK MZ ČR po roce 1990 a bývalého lékopisného oddělení SÚKL. Týká se i výběru IPLP pro nové zařazení do lékopisu či ponechání článků již zařazených. Názor, že připomínky v článcích publikovaných ve farmaceutickém tisku na adresu sortimentu léčivých přípravků v NČ ČL většinou nerespektují výsledky průzkumu výskytu léčivých přípravků ve větší části lékárenského terénu31), měl zřejmě na mysli průzkum provedený v době velmi vzdálené realitě přípravy IPLP v lékárnách v České republice v posledních desetiletích.
Mezi dalšími příčinami současného stavu NČ ČL je třeba zmínit úbytek laboratorních kapacit, které se na lékopisných pracích v České republice dříve podílely, jejich rušením po delimitaci bývalých laboratoří pro kontrolu léčiv krajského ústavu národního zdraví do SÚKL. Již v roce 2000 bylo v úvodu NČ doplňku k ČL 1997 konstatováno, že z plánovaných článků léčivých přípravků pro lékárny se nepodařilo řadu z nich dokončit vzhledem k nedostatečnému laboratornímu zázemí Lékopisné komise32). Problému si byl vědom i jeden z ředitelů SÚKL, který měl v záměru revitalizaci laboratorní činnosti SÚKL, včetně oddělení kontroly léčiv SÚKL v krajích33). K té však podle informací dostupných autorům příspěvku nedošlo. Nelze-li laboratorní kapacity pro lékopisné práce na úrovni SÚKL výrazněji rozšířit, nabízí se jako možné řešení oddělení NČ od lékopisu do samostatného receptáře bez analytiky přípravků, jejíž vývoj a ověřování jsou laboratorně nejnáročnější. Tak tomu bylo i dříve ve sbírce P. P. 1972, kterou vydalo ministerstvo zdravotnictví27), anebo v nezávazném receptáři vydaném naposledy v roce 199434). Je to cesta používaná i v zahraničí, tento vývoj proběhl např. u DAC/NRF13), ve kterém ve vzdálené minulosti byly články ve formátu lékopisu, tedy s kompletní analytikou, a již dlouho je v nich místo analytiky soubor informací, které jsou pro přípravu, uchovávání a výdej přípravku důležitější. Současná situace v České republice není pro nápravu nedostatků NČ ČL optimální. Autoři příspěvku jsou přesto názoru, že pro kvalitu obsahu NČ ČL lze udělat na úrovni LK MZ ČR a SÚKL i nyní víc, než tomu bylo v předchozích letech.
Střet zájmů: žádný.
Došlo 3. ledna 2021 / Přijato 1. února 2021
doc. RNDr. Jozef Kolář, CSc.
Kamenačky 25, 636 00 Brno
e-mail: kolarjozef02@gmail.com
Zdroje
1. Český lékopis 2017. Praha: Grada Publishing 2017.
2. Český lékopis 2017 – Doplněk 2018. Praha: Grada Publishing 2018.
3. Český lékopis 2017 – Doplněk 2019. Praha: Grada Publishing 2019.
4. Český lékopis 2017 – Doplněk 2020, 1. díl. Praha: Grada Publishing 2020.
5. Československý lékopis, 4. vydání, svazek II. Praha: Avicenum 1987; 46.
6. Český lékopis 1997, 2. díl. Praha: Grada Publishing 1997; 926–930.
7. Zemanová M. Fagron a. s. Sdělení e-komunikací 30. 1. 2018 a 2. 2. 2018.
8. Adeps suillus stabilisatus. https://shop.fagron.cz/cs-cz/product/ cat_100032/adeps-suillus-stabilisatus.aspx (25. 12. 2020).
9. Sklenář Z., Skořepová M., Staněk M., Jirásek R. Magistraliter receptura v dermatologii. Praha: Galén 2009.
10. Šubert J., Kolář J., Vašková V. Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži. Čes. slov. Farm. 2008; 57, 55–57.
11. Charvátová I. Studie léčivých přípravků připravovaných v lékárnách. Rigorózní práce, Univerzita Karlova v Praze, Farmaceutická fakulta v Hradci Králové 2011, s. 91.
12. Standardisierten Rezepturen (NRF/SR). 3. Aufl. Eschborn: Govi-Verlag 2004.
13. Deutscher Arzneimittel-Codex/Neues Rezeptur-Formularium, Band 1–3, Stand 2012. Eschborn: Govi-Verlag, Stuttgart: Deutscher Apotheker-Verlag.
14. Deplazes C., Möll F., Gloor S., Panizzon R. Dermatologische Magistralrezepturen der Schweiz. 3. Aufl. Winterthur 2010.
15. The Japanese Pharmacopoeia, Seventeenth Edition (JP17) the Electronic version, s. 1804. https://www.mhlw.go.jp/file/06-Seisakujouhou-11120000-Iyakushokuhinkyoku/JP17_REV_1.pdf (26. 12. 2020).
16. Chalabala M. Žádost Lékopisné komise ČR o vypracování článků pro Doplněk ČsL 4. Č.j. 3847/86-LK ze dne 12. 1. 1987.
17. Trávníčková M. Sdělení Lékopisného oddělení SÚKL Č.j. 01893/95 ze dne 17. 2. 1995.
18. Šubert J., Kolář J. K obsahu Národní části Českého lékopisu 2017. Čes. slov. Farm. 2018; 67, 81–84.
19. Seznam látek vzbuzujících mimořádné obavy podléhajících povolení. https://echa.europa.eu/cs/candidate-list-table (27. 12. 2020).
20. Český lékopis 2009, 3. díl. Praha: Grada Publishing 2009.
21. Österreichisches Arzneibuch Amtliche Ausgabe 2008. Wien: Verlag Österreich 2007. https://docplayer.org/27004827-Oesterreichisches-arzneibuch.html (16. 12. 2020).
22. Slovenský farmaceutický kódex (SFK), 2. vydanie Bratislava: Obzor 2015.
23. Slovenský farmaceutický kódex (SFK). 1. vydanie Bratislava: Obzor 2007.
24. Liekopisná komisia Štátny ústav pre kontrolu liečiv. Stanovisko k obmedzeniu používania kyseliny boritej a jej solí v individuálnej príprave liekov v lekárňach. https://www.sukl.sk/buxus/docs/Posudzovanie_kvality_liekov/Liekopis/kyselina_borita_List_pre_SLS_4__2_.pdf (27. 12. 2020).
25. Sklenář Z. Riziková léčiva v pediatrické dermatologické magistraliter receptuře a jejich vhodné alternativy. Pediatr. pro Praxi 2010; 11, 232–235.
26. Šubert J. Vývoj složení Castellanova roztoku. Čes. slov. Farm. 2005; 54, 199–200.
27. Praescriptiones Pharmaceuticae 1972. Praha: Ministerstvo zdravotnictví ČSR 1972.
28. Český farmaceutický kodex, 1. vydání. Praha: X-EGEM 1993.
29. Šubert J. Složení přípravku Solutio Castellani sine fuchsino Dopl. 99. Zasláno Lékopisné komisi MZ ČR 4. 4. 2000.
30. Šubert J., Farsa O., Cieslarová M. Efficiency of stabilization of low level of coloration of Castellani´s paint without fuchsine with disodium edetate. Pharmazie 2006; 61, 1049–1050.
31. Portych J. Český lékopis 2009. https://www.medon-solutio.cz/online2008/print.php?textID=4 (27. 12. 2020).
32. Český lékopis 1997 – Doplněk 2000. Praha: Grada Publishing 2000; 5159.
33. Beneš M. SÚKL. Sdělení e-komunikací 4. 4. 2009.
34. Modr Z., Hejlek J., Šedivý J. Praescriptiones magistrales, 5. vydání. Praha: Grada Avicenum 1994.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2021 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
-
ČESKÁ A SLOVENSKÁ FARMACIE
CZECH AND SLOVAK PHARMACY - Triazavirín by mohol byť novovu nádejou v súboji s koronavírusom 2 vyvolávajúcim ťažký akútny respiračný syndróm (SARS-CoV-2)
- K vývoji složení lékárniček první pomoci
- Další vývoj obsahu Národní části Českého lékopisu 2017 v jeho doplňcích z pohledu přípravy léčiv v lékárnách
- Vliv způsobu emulgace, rychlosti míchání a objemu na PLGA mikročástice s ibuprofenem
- Celkové inhalačné anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
-
ČESKÁ A SLOVENSKÁ FARMACIE
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Celkové inhalačné anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
- Triazavirín by mohol byť novovu nádejou v súboji s koronavírusom 2 vyvolávajúcim ťažký akútny respiračný syndróm (SARS-CoV-2)
- K vývoji složení lékárniček první pomoci
- Vliv způsobu emulgace, rychlosti míchání a objemu na PLGA mikročástice s ibuprofenem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



