-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCelkové inhalačné anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
General inhalational anesthetics – pharmacodynamics, pharmacokinetics and chiral properties
Since the advent of nitric oxide, diethyl ether, chloroform and cyclopropane, the greatest advancement in the area of general inhalational anesthetics has been achieved by the introduction of fluorinated anesthetics and the relevant chiral techniques. This progress led to marked decrease in mortality rates in anesthesia. In the group of chiral fluorinated compounds, halothane (Fluotan®), isoflurane (Foran®), desflurane (Supran®) and enflurane (Ehran®) are deployed as volatile anesthetics. Chiral anesthetics possess a stereogenic center in their molecules and thus exist as two enantiomers (S)-(+) and (R)-(–). Although these chiral anesthetics are used as racemates, it is crucial to study besides the bioactivities of the racemic compounds also the biological activity and other properties of the particular enantiomers.
The present survey discusses the drug category known as inhalational anesthetics in regard to their chiral aspects. These compounds exhibit marked differences between the (R) and (S)-enantiomers in their pharmacodynamics, pharmacokinetics and toxicity. The main analytical technique employed in the enantioseparation of these compounds is gas chromatography (GC). This review lists the individual chiral phases (chiral selectors) used in the enantioseparation as well as in pharmacokinetic studies. The possibilities of preparation of these compounds in their enantiomerically pure form by means of stereoselective synthesis are also mentioned.
Keywords:
general anesthetics – inhalational anesthetics – chirality – stereochemistry – pharmacodynamics – pharmacokinetics – enantioseparation
Autoři: Ružena Čižmáriková 1; Ladislav Habala 1; Mário Markuliak 1
Působiště autorů: Farmaceutická fakulta UK, Katedra chemickej teórie liečiv, Odbojárov 10, 832 32 Bratislava, SR 1
Vyšlo v časopise: Čes. slov. Farm., 2021; 70, 7-17
Kategorie: Přehledy a odborná sdělení
doi: https://doi.org/https://doi.org/10.5817/CSF2021-1-7Souhrn
V oblasti celkových inhalačných prchavých anestetík od použitia oxidu dusného, dietyléteru, chloroformu a cyklopropánu nastal vďaka zavedeniu fluórovaných anestetík a s nimi spojených chirálnych technológií pokrok, v dôsledku ktorého došlo pri anestézii k zníženiu úmrtnosti. Z fluórovaných chirálnych prchavých anestetík sa do oblasti anestézie dostali halotan (Fluotan®), izoflurán (Foran®), dezflurán (Supran®) a enflurán (Ehran®). Z nechirálnych sa používajú metoxyflurán (Penthrox®) a sevoflurán (Sevoran®). Chirálne anestetiká majú v svojej štruktúre stereogénne centrum a existujú vo forme dvoch enantiomérov (S)-(+) a (R)-(–). Hoci sa tieto chirálne anestetiká používajú vo forme racemátov, z hľadiska účinnosti a bezpečnosti je u nich dôležité študovať okrem biologickej aktivity racemátov i biologickú aktivitu ako i ďalšie vlastnosti jednotlivých enantiomérov. V predloženom prehľade je pozornosť venovaná skupine liečiv známych ako inhalačné anestetiká vo vzťahu k ich chirálnym aspektom. Boli u nich zistené významné rozdiely (R) a (S)-enantiomérov vo farmakodynamickej, farmakokinetickej aktivite, ako i v toxicite.
Na rozdelenie jednotlivých racemátov na enantioméry sa využíva hlavne plynová chromatografia (GC). V prehľade sú uvedené jednotlivé chirálne fázy, resp. selektory využívané pri ich enantioseparácii, ako i pri farmakokinetických štúdiách. Príprava jednotlivých enantiomérov okrem preparatívnej GC je možná aj pomocou metód stereoselektívnej syntézy.
Klíčová slova:
celkové anestetiká – inhalačné anestetiká – chiralita – stereochémia – farmakodynamika – farmakokinetika – enantioseparácia
Úvod
Celkové inhalačné anestetiká (používaný je aj názov narkotiká) sú látky používané pri chirurgických zákrokoch k navodeniu celkovej anestézie, t.j. stavu charakterizovaného stratou vedomia, odstráneniu schopnosti vnímať bolesť, útlmom nežiaducich vegetatívnych a somatických reflexov a svalovou relaxáciou.
Inhalačné anestetiká sú látky vstupujúce do organizmu pľúcami, odkiaľ sú krvným obehom transportované do tkanív. Cieľovým miestom je mozog, v ktorom svojím účinkom vyvolávajú celkovú anestéziu. Ideálne inhalačné anestetikum by malo mať tieto vlastnosti1):
• rýchly úvod a rýchle vyvedenie z anestézie
• dobrú korigovateľnosť hĺbky anestézie
• dostatočnú analgetickú potentnosť
• dostatočnú schopnosť svalovej relaxácie
• veľkú terapeutickú šírku (bezpečnosť)
• minimálne nežiaduce a toxické účinky
• minimálny metabolizmus v organizme
• environmentálnu neškodnosť
V skupine inhalačných anestetík sú zastúpené chemicky rôznorodé látky2):
• anorganické plyny – oxid dusný, xenón
• uhľovodíky a nehalogenované étery – cyklopropán, etoxyetán (dietyléter)
• halogenované uhľovodíky a étery – halotan, izoflurán, dezflurán, sevoflurán, metoxyflurán
Mechanizmus účinku
Prvé práce pokladali za hlavný predpoklad anestetického účinku vysokú lipofilitu, v dôsledku ktorej stúpa účinok inhalačných anestetík.
Vyjadrením lipofility je rozdeľovací koeficient krv/plyn – vyjadrujúci rozpustnosť v krvi. Látka v krvi rozpustnejšia má pomalšiu distribúciu a pomalší je aj nástup i odoznenie účinku.
Rozdeľovací koeficient olej/plyn vyjadruje rozpustnosť v lipidoch; liposolubilnejšie anestetikum bude účinnejšie a bude sa ochotnejšie distribuovať do tukového tkaniva, napr. do CNS. Rozdeľovacie koeficienty a teploty varu vybraných inhalačných anestetík sú uvedené v tabuľke 1.
Tab. 1. Fyzikálno-chemické vlastnosti vybraných inhalačných anestetík3) 
Ďalšie práce zaoberajúce sa mechanizmom účinku inhalačných celkových anestetík súvisia s účinkom na iónové kanály v nervovej bunke4). Silne aktivujú K+ kanály súvisiace s TWIK (TREK-1) a reverzibilne indukujú stratu vedomia. V prácach5) bol vysvetlený podrobný membránový účinok na iónové kanály. Ide o narušenie lipidových raft (glykolipoproteínové mikrodomény tvorené kombináciou glykosfingolipidov a proteínových receptorov, ktoré sa nachádzajú v cytoplazmatickej membráne), ktoré aktivujú TREK-1 porušením lokalizácie fosfolipázy D2 (PLD2) s následnou produkciou fosfatidovej kyseliny (PA)5, 6).
Willenbring et al.7) pokusmi s halotanom prišli k záveru, že k pôsobeniu inhalačných anestetík v proteínoch prispieva aj voda tým, že sprostredkuje interakciu medzi proteínovými podjednotkami, a tiež zmenou dynamiky proteínov.
V ďalších prácach mechanizmus účinku hlavne u halogenovaných uhľovodíkov a éterov je pripisovaný väzbe s rôznymi receptormi. V strede záujmu tejto teórie sú receptory asociované s iónovými kanálmi, predovšetkým GABA-A (inhibičný), NMDA (receptor pre glutamát, typ N-metyl-D-aspartát – excitačný), N-receptor alebo receptor pre glycín (inhibičný). Neurotransmiter GABA-A (kyselina γ-aminomaslová, resp. kyselina 4-aminobutánová) sa viaže na určité receptory nachádzajúce sa na bunkovej membráne pred - a posynaptických neurónov a otvára iónové kanály, čím umožňuje tok záporne nabitých chloridových aniónov dnu do bunky a tok kladne nabitých draslíkových katiónov von z bunky. Týmto vznikne zmena v membránovom potenciáli, čo spôsobí hyperpolarizáciu8–10).
Z ďalších typov mechanizmov je uvádzaná aktivácia membránového glycínového receptora, ktorý je súčasťou iónového kanála spojeného s chloridovým kanálom plazmatickej membrány11, 12). Prirodzeným aktivátorom je inhibičná aminokyselina glycín. U dezfluránu dochádza tiež k aktivácii na Ca2+ ATP-ázy v sarkoplazmatickom retikule (SR), ktorá prenáša Ca2+ z cytosolu bunky do lúmenu SR na úkor hydrolýzy ATP počas svalovej relaxácie. Halotan a sevoflurán inhibujú okrem toho nikotínový acetylcholínový receptor a pôsobia antagonisticky na N-metyl-D-aspartátový receptor13), ktorý potencuje prúdy glycínového receptora. U sevofluránu je popísaná inhibícia podtypu serotonínových receptorov 5-hydroxytryptamínu 3 (5-HT3)14).
Farmakodynamika, farmakokinetika a toxicita vybraných celkových inhalačných anestetík
Anorganické plyny (oxid dusný, xenón)
Z anorganických plynov má oxid dusný svoje miesto i v modernej anestézii. Výhodou je jeho analgetický účinok a efekt na NMDA receptory, potlačenie výskytu bdelosti počas anestézie a možnosť jeho využitia aj u rizikových pacientov s neurologickým alebo kardiovaskulárnym ochorením. V medicíne sa používa aj v zmesi s kyslíkom (85 % N2O + 15 % O2) ako anestetikum ku krátkodobým narkózam. Používa sa pre celkovú anestéziu pri operačných výkonoch, v gynekológii, v zubnom lekárstve a pri ďalších ambulantných výkonoch15, 16).
Zmes 50 % N2O + 50 % O2 známa pod názvom ENTONOX je bezpečné a účinné inhalačné analgetikum v situáciách, kde je potrebný rýchly nástup a ústup účinkov. ENTONOX má tiež anxiolytický účinok, teda zbavuje pacientov úzkosti.
Oxid dusný je tiež často používaný v kryochirurgii17).
Xenón je tiež účinný anestetický plyn, ktorý má veľmi vhodné vlastnosti pre lekárske použitie – nulový metabolizmus, nízky pomer plynu v krvi, krátku dobu zotavovania a hemodynamickú stabilitu. Používanie xenónu vo veľkom meradle ako hlavného anestetika je však značne obmedzené kvôli jeho vysokým výrobným nákladom, preto je vhodné ho aplikovať výhradne v úplne uzavretom okruhu a zabezpečiť jeho absorpciu a následnú recykláciu18, 19).
Uhľovodíky a nehalogenované étery
Cyklopropán a dietyléter sa v klinickej praxi vo väčšine krajín nepoužívajú. Výhodou cyklopropánu je rýchly nástup účinku a pomerne rýchle prebudenie. Je však výbušný a jeho použitie je spojené s nebezpečenstvom vzniku srdcových arytmií. Hoci bol uvedený v ČSL 3, od jeho použitia sa upúšťa20, 21).
Etoxyetán (dietyléter) sa používal viac ako 100 rokov. Je málo toxický, má analgetický a myorelaxačný účinok a iba mierne ovplyvňuje dýchanie a krvný tlak. Nahradený bol modernejšími anestetikami kvôli svojej výbušnosti22–24).
Halogenované uhľovodíky a étery
Prelom v anestézii nastal v tejto skupine zavedením do klinickej praxe fluórovaných uhľovodíkov a éterov17, 25).
Podobne ako u iných liečiv i v tejto skupine liečiv okrem štruktúry, fyzikálno-chemických vlastností a iných faktorov zohráva vplyv na biologickú aktivitu aj ich stereochemické usporiadanie.
V mnohých štruktúrach celkových narkotík (anestetík), hlavne u halogenovaných uhľovodíkov a éterov, je stereogénne centrum na uhlíkovom atóme a molekuly nie sú stotožniteľné so zrkadlovým obrazom a otáčajú rovinu polarizovateľného svetla doprava (+) alebo doľava (–), ktoré sa líšia svojimi farmakodynamickými, farmakokinetickými a toxikologickými vlastnosťami. V zmysle Cahnovho-Ingoldovho-Prelogovho systému26, 27) majú jednotlivé stereoizoméry (+) a (–) absolútnu konfiguráciu (S) a (R). Príkladom môže byť enflurán, u ktorého pravotočivý izomér má absolútnu konfiguráciu (S) a ľavotočivý (R), ako je znázornené na obrázku 1.
Obr. 1. Enantioméry enfluranu
(S)-(+)-enflurán (R)-(–)-enflurán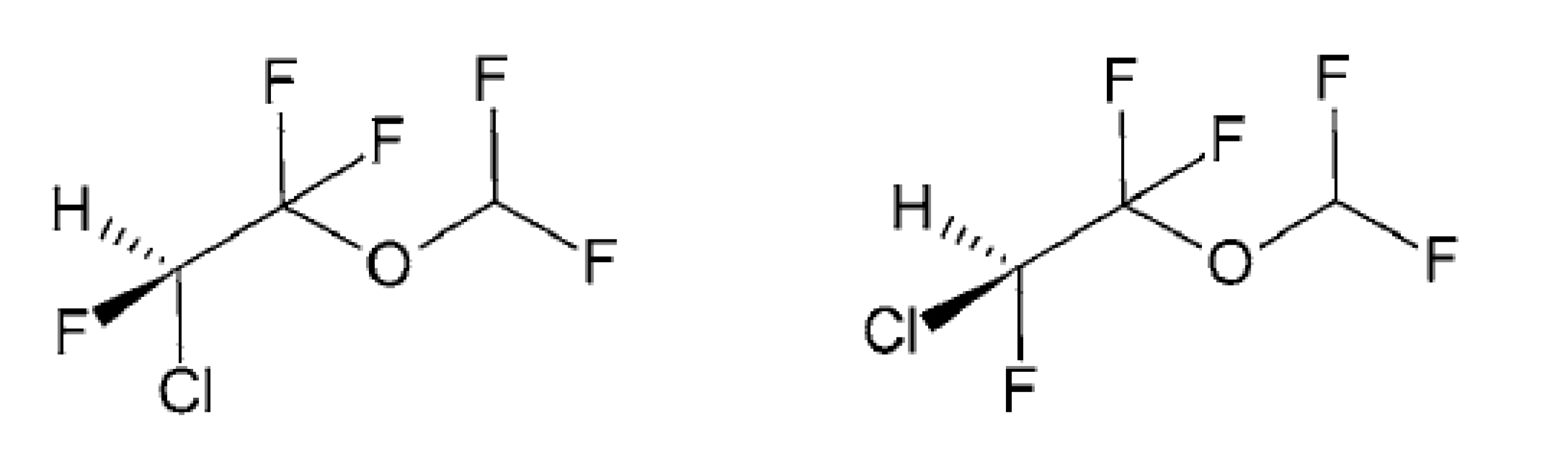
V skupine inhalačných anestetík so stereogénnym centrom sú halotan, izoflurán, enflurán a dezflurán, 1,1,2-trifluór-1-fluórmetoxy-2-chlóretán.
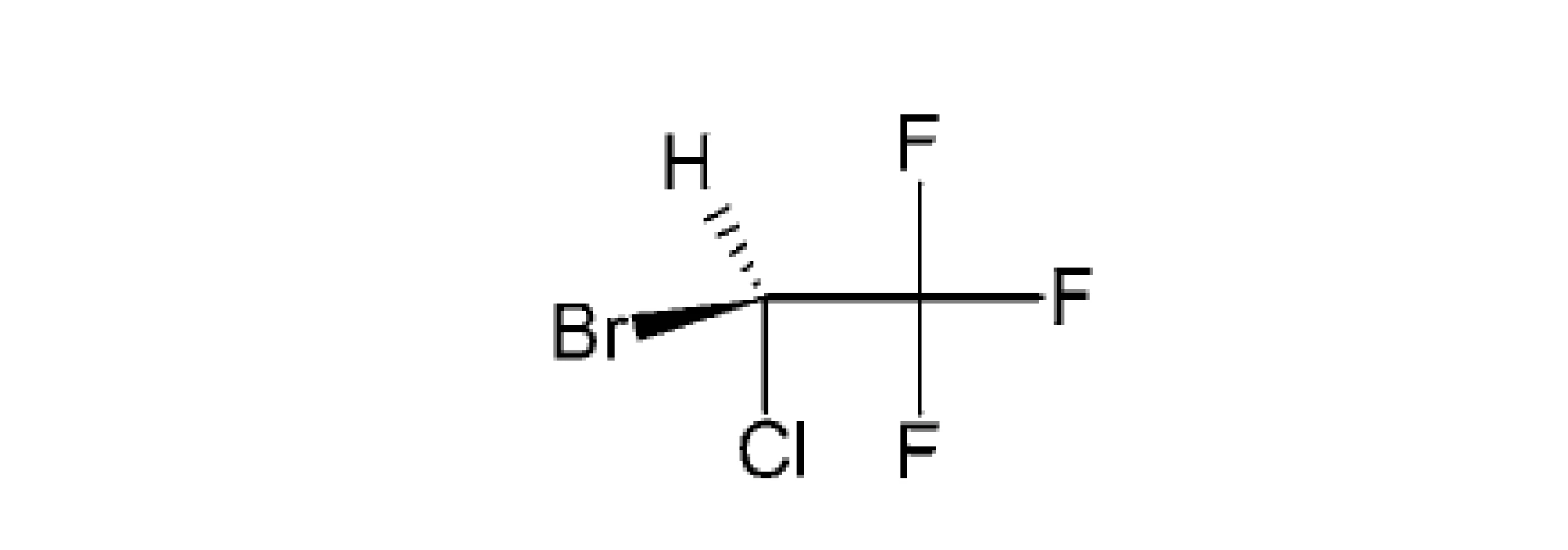
HALOTAN – IUPAC názov (RS)-1-bróm-2,2,2-trifluór-1-chlóretán
Svojou štruktúrou sa radí medzi halogénované uhľovodíky (obr. 2). Ide o nehorľavú, nevýbušnú bezfarebnú kvapalinu (teplota varu 50,2 °C), stálu v alkalickom prostredí. Mierna rozpustnosť halotanu v krvi a jeho vysoká narkotická aktivita umožňujú rýchly vstup do anestézie (5 minút od začiatku inhalácie anestetika). Preniká dobre do CNS za použitia malých dávok myorelaxancií a jeho svalové relaxačné účinky sú priemerné. Hoci je účinným anestetikom, nemá významný analgetický účinok. Jeho nestabilite sa zabraňuje skladovaním v tmavých fľašiach a prídavkom 0,01% tymolu. Halotan je chirálna molekula a podáva sa ako racemická zmes, údaje o rôznych účinkoch jednotlivých enantiomérov sú málo publikované. Predpokladá sa, že toxicitu pre pečeň spôsobuje metabolizmus halotanu na kyselinu trifluóroctovú. V pečeni sa metabolizuje približne 20 % inhalovaného halotanu a metabolity sa vylúčia v moči. Tieto zdravotné riziká boli hlavným dôvodom, prečo halotan nahradili iné anestetiká28–30).
IZOFLURÁN – IUPAC názov (RS)-1,1,1-trifluór-2-difluórmetoxy-2-chlóretán
Patrí medzi fluórované prchavé nehorľavé anestetiká typu halogénovaných éterov (obr. 3). Ide o bezfarebnú kvapalinu s éterickým zápachom a s teplotou varu 48,5 °C. Rozpustnosť pár izofluránu v krvi a tkanivách ľudského tela je omnoho nižšia ako rozpustnosť enfluránu, čo zaisťuje rýchlejšiu indukciu do anestézie (2–3 minúty) a výstup z nej (5–7 minút).
Obr. 3. Štruktúry izomérov izofluránu
(S)-izoflurán (R)-izoflurán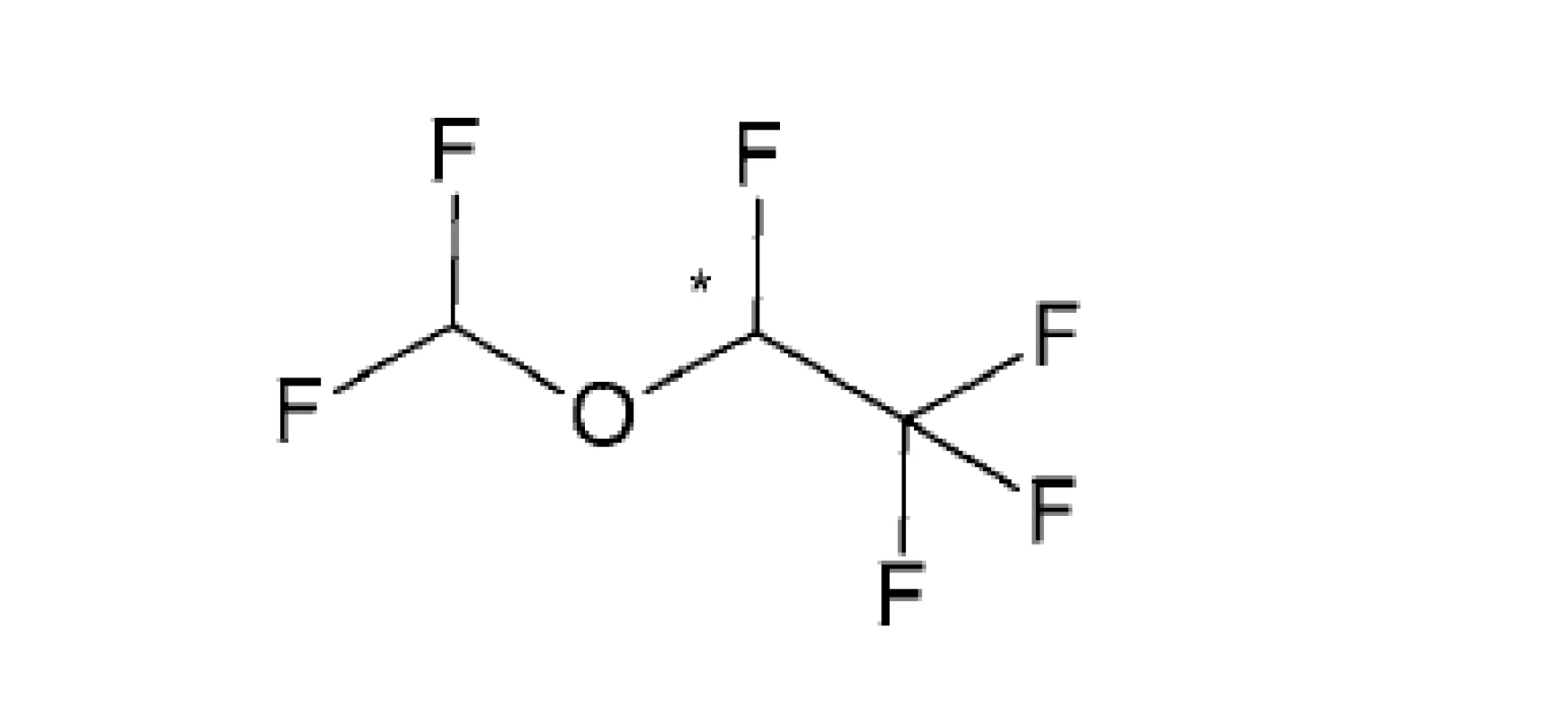
Účinok izofluránu na cievy pľúcnej artérie je podobný ako u enfluránu. Pri anestézii izofluránom je však výraznejšia hypotenzia (v dôsledku uvoľnenia hladkých svalov ciev) a tachykardia ako pri všetkých vyššie uvedených anestetikách tejto série. Nízky metabolizmus (0,17 %) izofluránu cytochrómom P450 a jeho nízka rozpustnosť v tkanivách určujú jeho nižšiu nefro - a hepatotoxicitu ako u predchádzajúcich anestetikách31–33).
V práci34) boli uverejnené prvé údaje, ktoré opisujú farmakologické rozdiely medzi stereoizomérmi prchavého anestetika izofluránu podávaného in vivo konvenčnou cestou (inhalovaním) a meraním klinicky relevantného indexu anestézie, MAC. Tieto údaje sú v súlade s účinkom izofluránu na zvlášť citlivé iónové kanály v identifikovaných neurónoch centrálneho nervového systému mäkkýšov. Pri dávke stredného účinku u človeka (ED50) pre celkovú anestéziu bol (+)-izomér približne dvojnásobne účinnejší ako (–)-izomér pri vyvolávaní anesteticky aktivovaného draslíkového prúdu IK (An) ako aj pri inhibícii prúdu sprostredkovaného pomocou neuronálnych nikotínových acetylcholínových receptorov. Na inhibíciu oveľa menej citlivého prechodného IA draslíka bol (–)-izomér okrajovo účinnejší ako (+)-izomér. Oba izoméry boli rovnako účinné pri rozrušení lipidových dvojvrstiev pôsobením na proteíny35). V práci36) bolo potvrdené, že tento stereošpecifický efekt na iónové kanály u izofluránu prebieha priamo skôr na proteíny ako lipidy.
Izoflurán pôsobí stereošpecificky aj na receptory typu kyseliny G-aminomaslovej37–39); účinnejším pri inhibícii sa ukázal stereoizomér (S)-(+).
Na druhej strane, vo väzbe na Ca2+ kanály nebol zaznamenaný žiadny rozdiel medzi jednotlivými enantiomérmi v porovnaní s racemátom40).
Pri štúdiu stereošpecifickej väzby izofluránu na hovädzí sérový albumín (BSA) meraním nukleárnej magnetickej rezonancie 19F sa pozorovala v dynamických väzbových parametroch silnejšia väzba (R)-(–) enantioméru v porovnaní s (S)-(+) stereoizomérom41).
Harris et al.42) uskutočnili štúdie in vivo a myšiam podali intraperitoneálne injekcie izomérov izofluránu. Autori zistili dlhšiu dobu spánku s (S)-(+) izomérom. Podobné dôkazy o vyššej účinnosti (S)-(+) izoméru izofluránu sa preukázali na potkaňom modeli, kde meraním klinicky relevantného indexu anestézie bol MAC (+) izomér o 53 % účinnejší než (–) izomér34).
K opačnému výsledku dospeli Eger et al.43), ktorí nezistili žiadny rozdiel v hodnotách minimálnej alveolárnej koncentrácie (MAC) u dvoch izofluránových enantiomérov.
ENFLURÁN – IUPAC názov (RS)-1-(difluórmetoxy)-1,1,2-trifluór-2-chlóretán
Enflurán (viz obr. 1) je číra, bezfarebná, sladká, prchavá kvapalina o teplote varu 56,5 °C. Z hľadiska jeho mechanizmu účinku môže zvýšiť aktivitu inhibičného neurotransmitera kyseliny γ-aminomaslovej na synaptický prenos a môže tiež inhibovať glutamatergický excitačný prenos44).
Ako veľmi silné a stabilné celkové anestetikum sa používal na vyvolanie a udržiavanie celkovej anestézie počas chirurgického zákroku a cisárskeho rezu a tiež na analgéziu počas vaginálneho pôrodu. Boli u neho pozorované ojedinelé prípady závažného akútneho poškodenia pečene podobného halotanovej hepatitíde, a preto v súčasnosti je nahradené modernejšími prchavými anestetikami.
Štúdium metabolizmu enfluránu pomocou cytochrómu P450 2E1 z ľudskej pečene potvrdilo, že metabolizmus (R)-enfluránu bol významne vyšší ako u (S)-enfluránu (pomer 1,9 : 1), zatiaľ čo miera racemického metabolizmu enfluránu bola všeobecne medzi hodnotami pozorovanými pre (R) - a (S)-enantioméry45).
DEZFLURÁN – IUPAC názov (RS)-1,1,1,2-tetrafluór-2-difluórmetoxyetán
Je chemicky veľmi podobný izofluránu, namiesto atómu chlóru má v štruktúre atóm fluóru (obr. 4). Z toho dôvodu má omnoho menej škodlivý vplyv na ozónovú vrstvu. Je to nehorľavá a nevýbušná číra tekutina so štipľavým a dráždivým zápachom. Zo všetkých prchavých anestetík má najnižšiu teplotu varu (22,8 °C), preto je pre jeho použitie potrebný špeciálny odparovač. Podáva sa vo forme pary, ktorú pacient vdychuje a vyvolá hlboký, bezbolestný spánok (celkovú anestéziu), ktorý sa udrží i v priebehu chirurgického zákroku (operácie). Zo všetkých inhalačných anestetík je u desfluranu najrýchlejší nástup i vyvedenie z anestézie a tiež najpohotovejšie usmerňovanie účinku. U dospelých sa používa na navodenie a udržanie anestézie. U detí a dojčiat sa používa len na udržanie anestézie. Pri podávaní v koncentráciách vyšších ako 10 obj.% môže spôsobiť tachykardiu a podráždenie dýchacích ciest46, 47).
Oproti ostatným inhalačným anestetikám má najslabší účinok. Jeho nevýhodou je tiež vyššia cena.
Rovnako ako u halotanu, enfluránu a izofluránu sa jedná o racemickú zmes optických izomérov (R) a (S). Spolu so sevofluranom postupne nahrádza izoflurán na humánne použitie, s výnimkou hospodársky nerozvinutých oblastí, kde jeho vysoké náklady vylučujú jeho použitie48, 49).
Z nechirálnych fluorovaných inhalačných anestetík sú známe metoxyflurán a sevoflurán.
METOXYFLURÁN – IUPAC názov 1,1-difluór-2,2-dichlór-1-metoxyetán
Ide o halogénovaný éter (obr. 5), ktorý sa predtým klinicky používal ako prchavé inhalačné anestetikum. Je známe, že metoxyflurán je potenciálne nefrotoxický pri anestetických dávkach, oveľa nižšie dávky používané na zmiernenie bolesti nesúvisia s nefrotoxicitou alebo so zvýšeným rizikom ochorenia obličiek50). Z tohto dôvodu za posledných 30 rokov bol v mnohých krajinách schválený ako analgetikum (v Austrálii, na Novom Zélande, v Spojenom kráľovstve a v Európe) na núdzové zmiernenie stredne ťažkej až ťažkej traumatickej bolesti. Analgetické použitie metoxyfluránu v subanestetických dávkach v inhalátore Penthrox nepredstavuje riziko nefrotoxicity a porovnaním s tramadolom pri liečbe akútnej muskuloskeletálnej bolesti sa prejavil účinnejší a pri poranení členka vykazoval rýchlejší nástup účinku51).
Obr. 5. Štruktúra metoxyfluránu 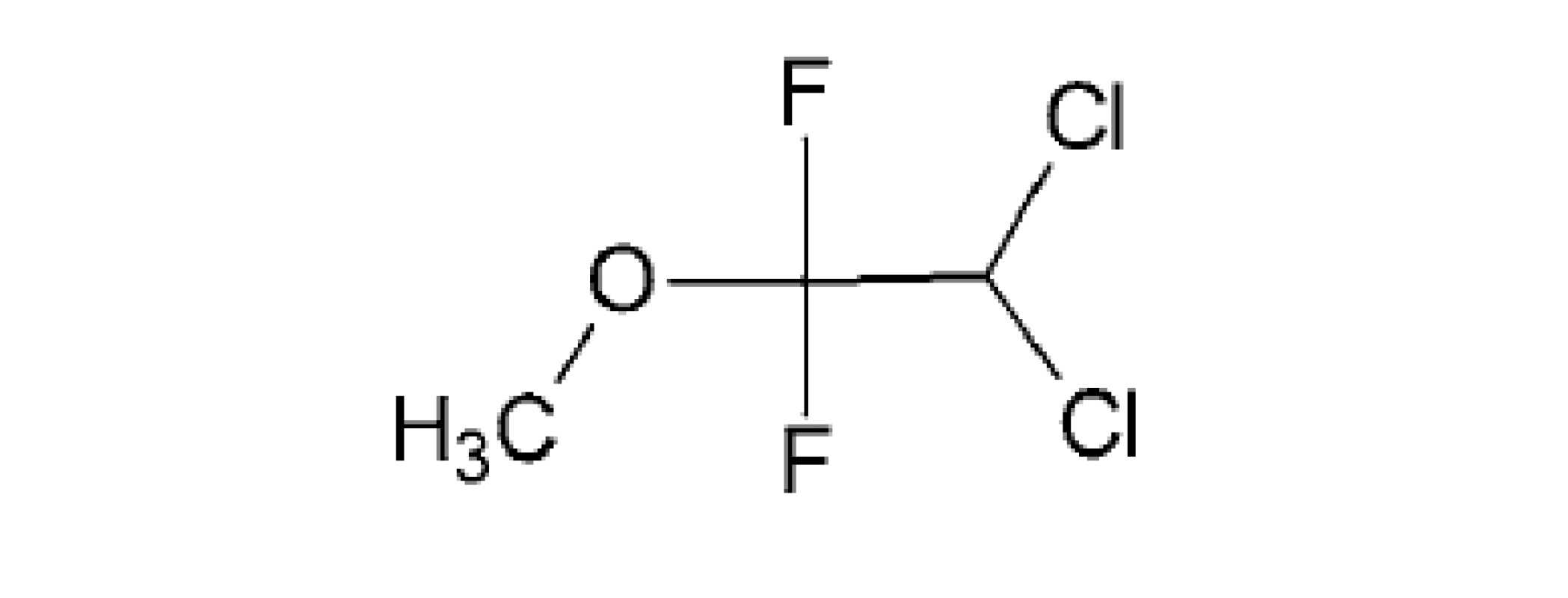
SEVOFLURÁN – IUPAC názov 1,1,1,3,3,3-hexafluór-2-(fluórmetoxy)propán
Sevoflurán je bezfarebná, priehľadná kvapalina s teplotou varu 58,5 °C, ktorá nie je výbušná.
Je to jedno z najbežnejšie používaných prchavých anestetík, najmä v prípade ambulantnej anestézie vo všetkých vekových skupinách ako aj vo veterinárnej medicíne. Nemá dobrú rozpustnosť v krvi a tkanivách, čo spôsobuje nástup anestézie 1–1,5 minúty po začiatku inhalácie lieku a rýchle odoznenie anestézie.
Spolu s dezfluránom nahrádza sevoflurán v modernej anestéziológii izoflurán a halotan. Často sa podáva v zmesi oxidu dusného a kyslíka52).
Má menej silný narkotický účinok ako izoflurán. Jeho účinok na spontánne dýchanie a hladké svaly prieduškového stromu je rovnaký ako účinok dezfluránu. Sevoflurán je inhalované anestetikum, ktoré sa často používa na spánok detí pri operácii.
Je jediným anestetikom, ktoré sa nemetabolizuje na kyselinu trifluóroctovú a tým má slabý hepatotoxický účinok. Menej ako 5 % absorbovaného sevofluránu sa metabolizuje cytochrómom P450 2E1 za vzniku hexafluóroizopropanolu (HFIP) a súčasného uvoľnenia anorganického fluoridu a oxidu uhličitého (alebo jednouhlíkového fragmentu). HFIP sa potom rýchlo konjuguje s kyselinou glukurónovou a vylučuje sa ako urinárny metabolit. Nezistili sa iné metabolické dráhy sevofluránu53).
Vďaka účinkom, ktoré sú sprostredkované receptormi kyseliny γ-aminomaslovej typu A (GABA-A), ktoré sú exprimované v rôznych typoch buniek v pľúcach, predklinické údaje poukazujú, že sevoflurán a iné inhalačné anestetická tlmia zápal pľúc a rozširujú dýchacie cesty54). V súčasnosti sa odporúča pri pacientoch s ochorením COVID-19 napojených na umelú ventiláciu pridávať do zmesi sevoflurán55).
Enantioselektívna analýza
Existencia malých molekúl v skupine inhalačných anestetík s nízkymi teplotami varu umožňuje ich enantioseparáciu pomocou metódy chirálnej GC, ktorá u iných chirálnych štruktúr je nahradzovaná metódami HPLC a CE.
Zo štúdia niektorých racemických inhalačných anestetík, napr. izofluránu vyplynulo, že z hľadiska anestézie vyššiu anestetickú účinnosť vykazuje (S)-(+)-izomér. Na delenie jednotlivých stereoizomérov sa využíva plynová chromatografia s rôznymi chirálnymi selektormi.
Mechanizmus retencie je založený na tvorbe komplexu – začlenení separovanej zlúčeniny do dutiny cyklodextrínu. Všeobecne platí, že zlúčeniny, ktoré obsahujú jeden aromatický kruh, sa najlepšie delia pomocou α-CD, zlúčeniny s naftylovým cyklom pomocou β-CD, a pri molekulách s väčším ako naftylovým kruhom s γ-CD56).
Nederivatizované cyklodextríny sa v súčasnosti v plynovej chromatografíi ako stacionárne fázy prakticky nepoužívajú, ale používajú sa ich alkyl - a acylderiváty. Najpoužívanejšími stacionárnymi fázami sú (2,3,6-tri-O-metyl)-β-CD a (2,3,6-tri-O-pentyl)-α-, β - a γ-CD. Používajú sa však aj iné deriváty cyklodextrínov: deriváty obsahujúce terc-butyldimetylsilylovú skupinu, karbamátove deriváty, cyklodextríny s aromatickými substituentami, deriváty obsahujúce hydroxypropylovú skupinu a deriváty cyklodextrínov s heterocyklickými substituentami. Lepšia trieda CSP bola získaná naviazaním derivátov CD na polysiloxány (Chirasil-dex CSP)57, 58).
Meinwald et al.59) študovali enantioseparáciu izofluránu na heptakis(2,3,6-tri-O-pentyl)-α-cyklodextríne (kolóna A) a na sklenej kapilárnej kolóne Pyrex potretej oktakis(6-O-metyl -2,3-di-O-pentyl)-γ-cyklodextrínom (kolóna B) pri 30 °C, použitého nerozpustného selektora pre B kolónu60). Zatiaľ čo izoflurán bol separovaný na oboch kolónach, halotan bol separovaný len na kolóne A a enflurán na kolóne B. V práci bola študovaná enantioseparácia izofluránu, dezfluránu a enfluránu na 2,6-di-O-pentyl-3-O-trifluoroacetyl-α,β-gama-cyklodextríne. Z ďalších chirálnych selektorov bol použitý hydroxymetylovaný cyklodextrín. Študovaný bol kapacitný a selektívný faktor ako funkcia teploty a detailne boli určené termodynamické parametre H a G. Z výsledkov štúdie vyplynulo, že rýchle enantiomérne delenie bolo možné u všetkých troch anestetík dosiahnuť na trifluóracetyl-γ-cyklodextríne.
V práci61) bolo študovaných jedenásť derivátov fluorovaných celkových anestetík kapilárnou plynovou chromatografiou na štyroch cyklodextrínových kolónach. U dvoch cyklodextrínových derivátov, oktakis(2,6-di-O-pentyl-3-O-trifluóracetyl)-γ-cyklodextríne (cyklodex GTA) a oktakis(3-O-butanoyl-2,6-di-O-pentyl)-γ-cyklodextríne (Lipodex E) bol študovaný vplyv polohy 3 na cyklodextríne, kým pri hexakis(2,3,6-tri-O--pentyl)-α-cyklodextríne a heptakis(2,3,6-tri-O-pentyl)-β-cyklodextríne bola analyzovaná veľkosť kavity cyklodextrínov. V niektorých prípadoch v tejto štúdii bol enantioseparačný faktor α korelovaný so signálmi v 1H a 19F-NMR.
Pomocou oktakis(3-O-butanoyl-2,6-di-O-pentyl)-γ-cyklodextrínu (Lipodex E) rozpustného v OV-1701 bol rozdelený enflurán so selektívnym faktorom α = 2,16 a izoflurán s α = 1,36 pri 24 °C. Zvýšením teploty na 60 °C dochádzalo k veľmi rýchlej enantioseparácii enfluránu. Izoflurán sa delil na enantioméry asi za 30 sekúnd už pri 26 °C62).
Preparatívna enantiomérna separácia inhalačných anestetík enfluránu a izofluránu vo veľmi vysokej chemickej čistote (> 99,5%) a s vysokým enantiomérnym prebytkom (ee > 99%) bola uskutočnená plynovou chromatografiou (GC) na oktakis(3-O-butanoyl-2,6-di-O-n-pentyl)-γ-cyklodextríne rozpustnom v polysiloxáne SE-54 a potiahnutom na Chromosorb P AW DMCS. Absolútna konfigurácia oboch anestetík sa stanovila anomálnou röntgenovou difrakciou.
Rozdiely v interakciách dvoch enantiomérov s CSF je možné vyjadriť zmenou Gibbsovej energie –Δ S,R (Δ G) vypočítanej zo selektívneho koeficienta α. Kombináciou s Gibbsovou - Helmholtzovou rovnicou sa získa vzťah, kde R je plynová konštanta a T je absolútna teplota kolóny. Termodynamika enantioselektivity u enfluránu, izofluránu a dezfluránu vyjadrená pomocou ΔG, –ΔH a ΔS bola v práci Schuriga skúmaná pri enantioseparácii na chirálnom selektore oktakis(3-O-butanoyl-2,6-di-O-n-pentyl)-γ-cyklodextríne v polysiloxáne SE-54. V práci boli využité pre výpočet – ΔG 1H - NMR spektroskopické merania, keďže separačný faktor je v tomto systéme závislý od koncentrácie a nie je ho možné použiť ako kritérium pre enantioselektivitu63). Termodynamicke parametre vybraných anestetík sú uvedené v tabuľke 2.
Tab. 2. Termodynamické parametre vybraných anestetík 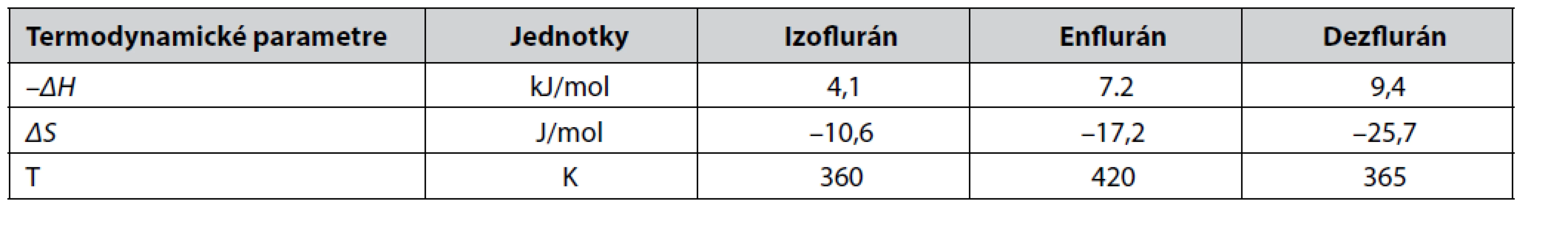
U izofluránu sa uskutočnilo klinické štúdium farmakokinetiky u 41 pacientov. Enantioméry izofluránu sa analyzovali vo vzorkách krvi odobratých pred anestéziou (deň 0) a do ôsmich dní po anestézii izofluránom (1. až 8. deň). V práci bola použitá plynová chromatografia spojená s hmotnostnou spektrometriou. Separácia enantiomérov sa dosiahla použitím kapilárnej kolóny potiahnutej oktakis(3-O-butanoyl-2,6-di-O-pentyl)-γ-cyklodextrínom (Lipodex E) rozpusteným v polysiloxáne. Bolo zistené obohatenie (S)-(+)-izofluránu vo všetkých vzorkách krvi odobratých po anestézii. Najvyššie % u väčšiny pacientov, až do 52–54 % (S)-(+)-izofluránu v porovnaní s 50 % pre racemát, sa pozorovalo v 2. deň. Koncentrácia izofluránu sa rýchlo znížila z 383 nmol/ml na 0,6 nmol/ml (priemerné hodnoty) 8 dní po anestézii. Vo vzorkách piatich pacientov sa uskutočnila kvantifikácia izofluránu značením enantiomérov, pričom ako vnútorný štandard bol použitý (S)-(+)-izoflurán64).
Študovala sa kvantitatívna analýza chirálneho prchavého anestetika izofluránu pre biomedicínske aplikácie pomocou enantioselektívnej plynovej chromatografie (hmotnostne citlivý detektor, monitorovanie vybraných iónov). Porovnali sa dve metódy na kvantifikáciu enantiomérov vo vzorkách krvi odobratých počas a po narkóze. Ako vnútorný štandard bol vybraný buď izomérny enflurán, alebo sa ako štandardný spôsob pridávania použil jediný enantiomér 1, prístup označovaný ako „značenie enantiomérov“. Koncentrácie jednotlivých enantiomérov až do 0,3 µmol/l sa dali rozlíšiť dva dni po anestézii65).
Vo vzorkách dychu boli významné rozdiely v (S)-(+) enantioméroch vo všetkých časových bodoch v porovnaní s racemátom. Počas skorej pooperačnej fázy bolo percento (S)-(+) enantiomérov významne zvýšené, zatiaľ čo 5 dní po chirurgickom zákroku boli vo vzorkách dychu zistené prevažne (R)-(–) enantioméry (50,41 %). Tiež vo vzorkách krvi bola zaznamenaná štatisticky významná akumulácia (S)-(+) enantioméru medzi 1. a 5. dňom v porovnaní s krvnou kontrolou izoflurán racemátu. Enantioméry (S)-(+) boli významne vyššie v krvi v porovnaní so vzorkami dychu a boli najzreteľnejšie 3. deň po operácii (51,43 %). Percento izofluránových enantiomérov v sledovaných vzorkách bolo určené plynovou chromatografiou v spojení s hmotnostnou spektrometriou66).
Sevoflurán, hoci je to nechirálne fluórované anestetikum, sa pri anestézii rozpadá na najmenej dva produkty, ktoré sa nazývajú „zlúčenina A“ a „zlúčenina B“ (obr. 6). Enantiomérna separácia chirálnej zlúčeniny B (1,1,1,3,3-pentafluór-2-(fluórmetoxy)-3-metoxypropán) je možná pomocou kapilárnej plynovej chromatografie (cGC) s použitím heptakis(2,3-di-O-acetyl-6-O-terc-butyldimetylsilyl)-β-cyklodextrínu ako chirálneho selektora. S týmto derivátom cyklodextrínu zriedeným v polysiloxáne PS 86 sa dosiahol vysoký separačný faktor α 4,1 (pri 30 °C). V dôsledku toho sa enantioméry zlúčeniny B izolovali preparatívnou GC a merala sa ich špecifická rotácia. Okrem toho boli ich absolútne konfigurácie stanovené röntgenovou kryštalografiou. Pre získanie röntgenových údajov sa monokryštály oboch enantiomérov pestovali in situ priamo na difraktometri. Ľavotočivý enantiomér B-(–) má (R)-konfiguráciu, zatiaľ čo pravotočivý enantiomér B-(+) má (S)-konfiguráciu. Elučné poradie enantiomérov zlúčeniny B na heptakis(2,3-di-O-acetyl-6-O-terc-butyldimetylsilyl)-β-cyklodextríne je (R) pred (S)67).
Obr. 6. Chemické transformácie sevofluránu 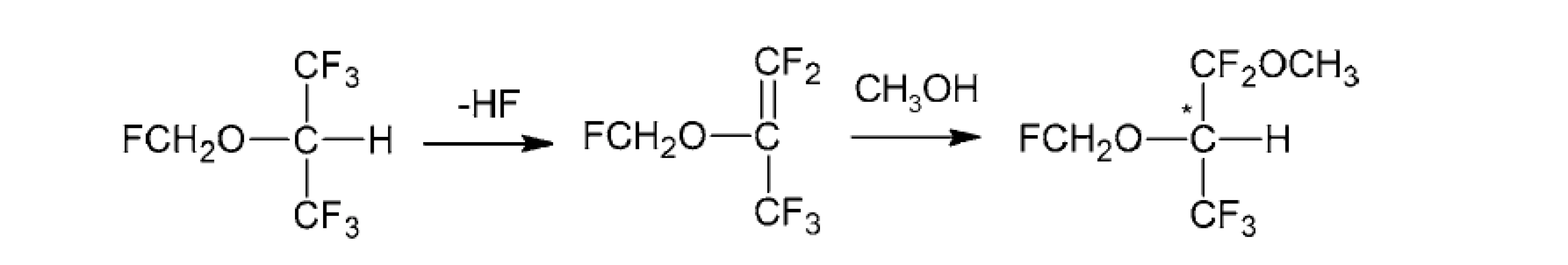
Ďalšie farmakokinetické štúdium s racemickým izofluránom bolo uskutočnené sledovaním vzoriek dychu. V prvých dňoch anestézie bolo zistené zvýšené množstvo (S)-(+)-enantioméru, zatiaľ čo po 5 dňoch vo vzorkách dychu bol detegovaný prevažne (R)-(–)-enantiomér. Porovnaním vzoriek krvi pri tomto štúdiu sa potvrdili predchádzajúce zistenia ohľadom štatisticky významnej akumulácie (S)-(+)-enantioméru mezi 1. a 5. dňom, s najvyššou hodnotou 3. deň68).
Z hľadiska metodiky GC v prácach Bodenhöfera et al. sa uskutočnilo porovnanie výsledkov GC s výsledkami s použitím kremenného senzoru potiahnutého Lipodexom E. Ukázalo sa, že výsledky z oboch analýz sú porovnateľné69–71).
Pri enantioseparácii jednotlivých prchavých anestetík bola stanovovaná absolútna konfigurácia izofluránu pomocou vibračného cirkulárneho dichroizmu, ktorým sa potvrdilo, že (+)-izomér má (S)-konfiguráciu a (–)-izomér (R)-konfiguráciu. U dezfluránu touto metódou určili opačné priradenie jednotlivých enantiomérov72). Práce Schuriga73, 74) týkajúce sa preparatívnej analýzy dezfluránu a štúdia kryštálov za kryoskopických podmienok (–180 °C) ako aj stereochémie syntéz (dekarboxylácia vedúca k retencii a Waldenová inverzia SN2 izofluránu na dezflurán) boli podnetom pre revidovanie absolútnej konfigurácie dezfluránu75).
Pomocou teoretických výpočtov spektier vibračného cirkulárneho dichroizmu a ab initio výpočtami bolo potvrdené zistenie Schuriga, že dezflurán ma absolútnu konfiguráciu ako izoflurán, t.j. (+)-izomér má (S) a (–)-izomér (R)-konfiguráciu76, 77).
Enantioselektívna syntéza
Okrem preparatívnych chromatografických metodík je možné jednotlivé stereoizoméry vo väčšom množstve získať pomocou enantioselektívnej syntézy. V práci78) je uvedených niekoľko syntéz medziproduktov a pomocou nich pripravených finálnych inhalačných anestetík, z ktorých je najpodrobnejšie rozpracovaná syntéza izofluránu.
Jedným z medziproduktov bol sevoflurán, ktorý radikálovou chloráciou poskytol dva medziprodukty, z ktorých ožarovaním UV svetlom s nadbytkom propán-2-olu dochádzalo k hladkej premene 1,1,1,3,3,3-hexafluór-2-fluórdichlórmetoxypropánu na medziprodukt 1,1,1,3,3,3-hexafluór-2-fluórchlórmetoxypropán (obr. 7)78).
Obr. 7. Fotochemické transformácie sevofluránu 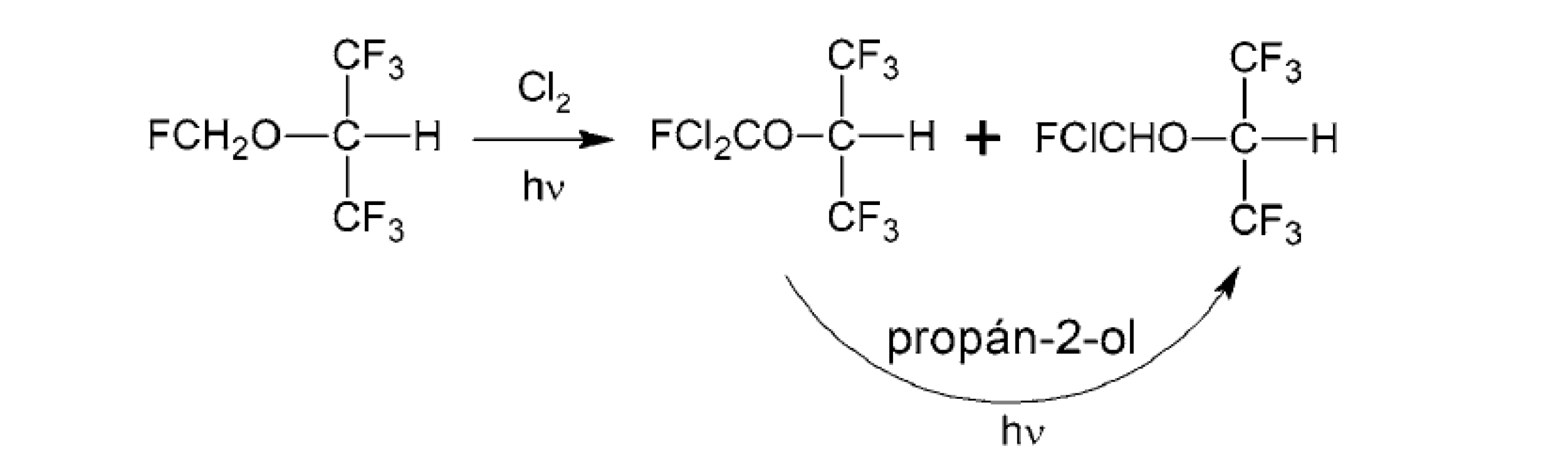
Pri príprave ďalších medziproduktov difluórmetyléterov je možné využiť SbCl5 (anorganické činidlo Swartsového typu79) a sevoflurán ako zdroj fluóru (obr. 8)80).
Obr. 8. Príprava difluórmetyléterov pomocou SbCl5 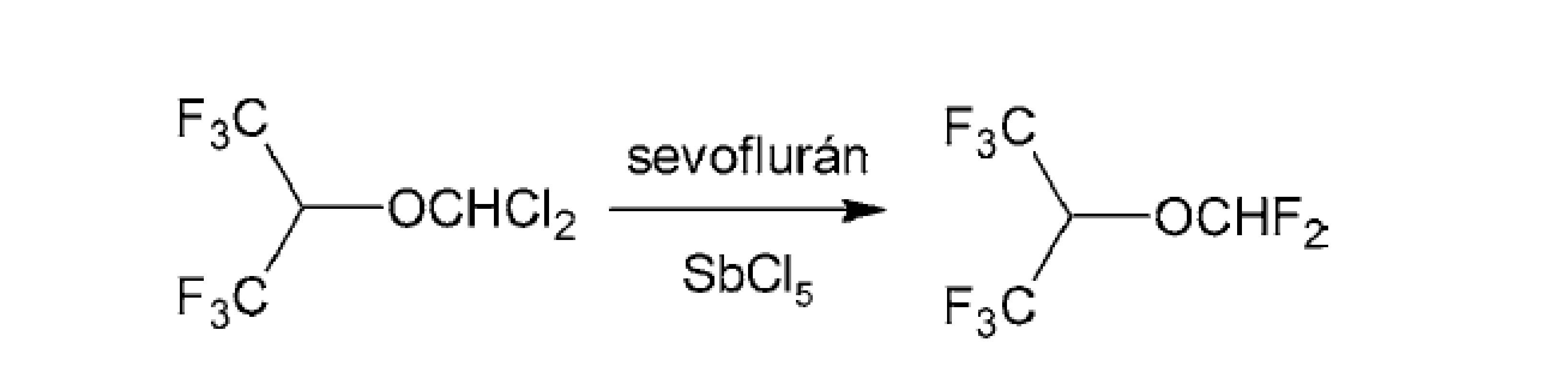
Z ďalších metód je možné využiť chemoselektívnu metanolýzu trifluórmetylskupín pomocou troch molekúl metanolátu sodného v etánnitrile s 55 % výťažkom (obr. 9)81).
Obr. 9. Príprava difluórmetyléterov chemoselektívnou metanolýzou trifluórmetylskupín 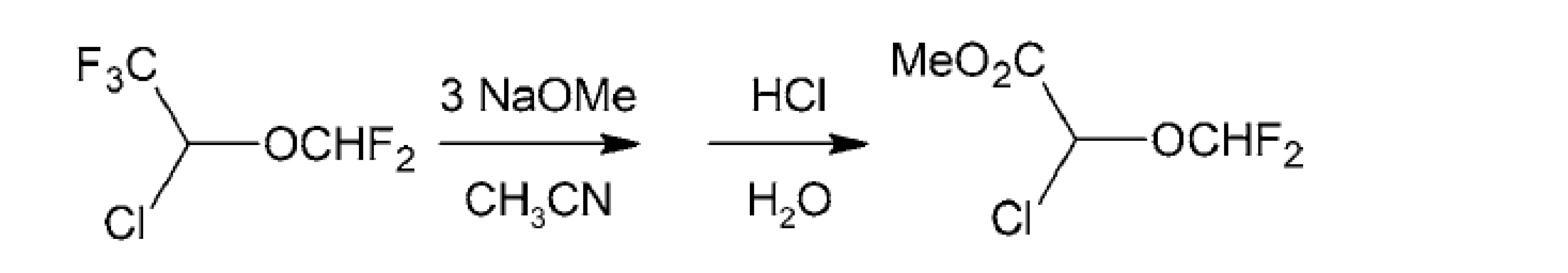
Pri príprave (S)-izofluránu sa využil chlorid kyseliny pripravenej hydrolýzou metyl-2-trifluór-2-difluórmetoxyetanoátu. Na prípravu 2-trifluórmetyl-2-difluórmetoxyetanylchloridu sa použil ftalyldichlorid82).
Radikálovou reakciou pripraveného chloridu kyseliny sa pripravila kyselina (S)-2-trifluór-2-difluórmetoxy-2-chlóretánová, z ktorej alkalickou dekarboxyláciou sa pripraví (S)-izofluran (obr. 10)81). Dekarboxylácia bola použitá aj pri stereoselektívnej syntéze halotanu83).
Obr. 10. Stereoselektívna syntéza (S)-izofluránu 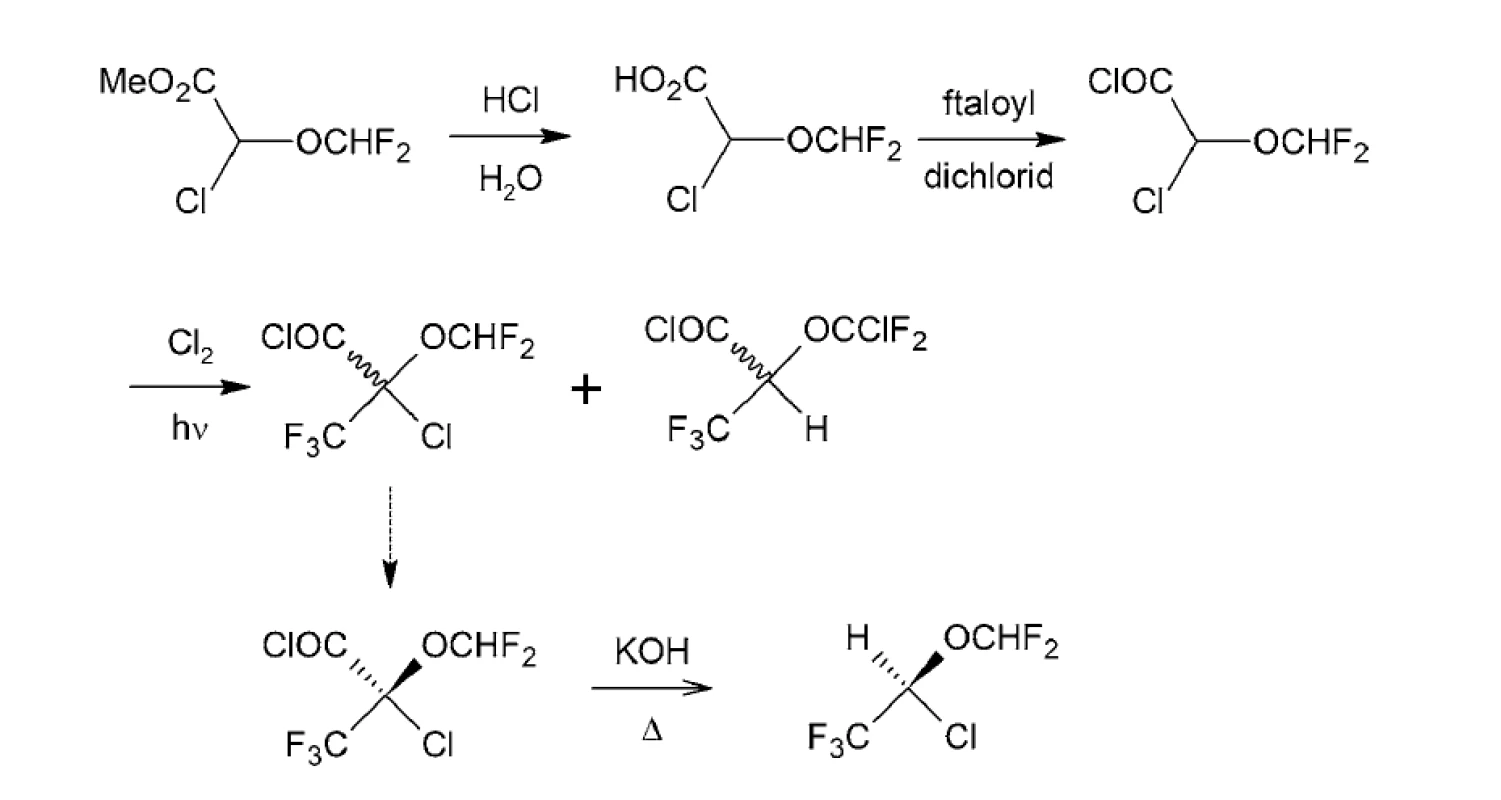
Pri príprave izofluránu je možné využiť frakčnú kryštalizáciu pripravených diastereoizomérov z kyseliny 2-trifluór-2-difluórmetoxyetánovej a N-metylbenzylamínu s následnou stereoselektívnou dekarboxyláciou84).
Izofluránové enantioméry sa môžu použiť ako východiskový materiál pre syntézu enantiomérov dezfluránu. Syntéza komerčného prchavého anestetického dezfluránu bola uskutočnená spracovaním (R)-(–)-izofluránu pomocou BrF3, pričom sa získa (S)-(+)-dezflurán s > 96% inverziou konfigurácie. Použitie nepolárneho rozpúšťadla brómu v spojení s ekvivalentom BrF3 umožnilo hladkú konverziu izofluránu s vysokým výťažkom pri dobrej stereochemickej kontrole (obr. 11)85).
Obr. 11. Príprava dezfluránu z izofluránu 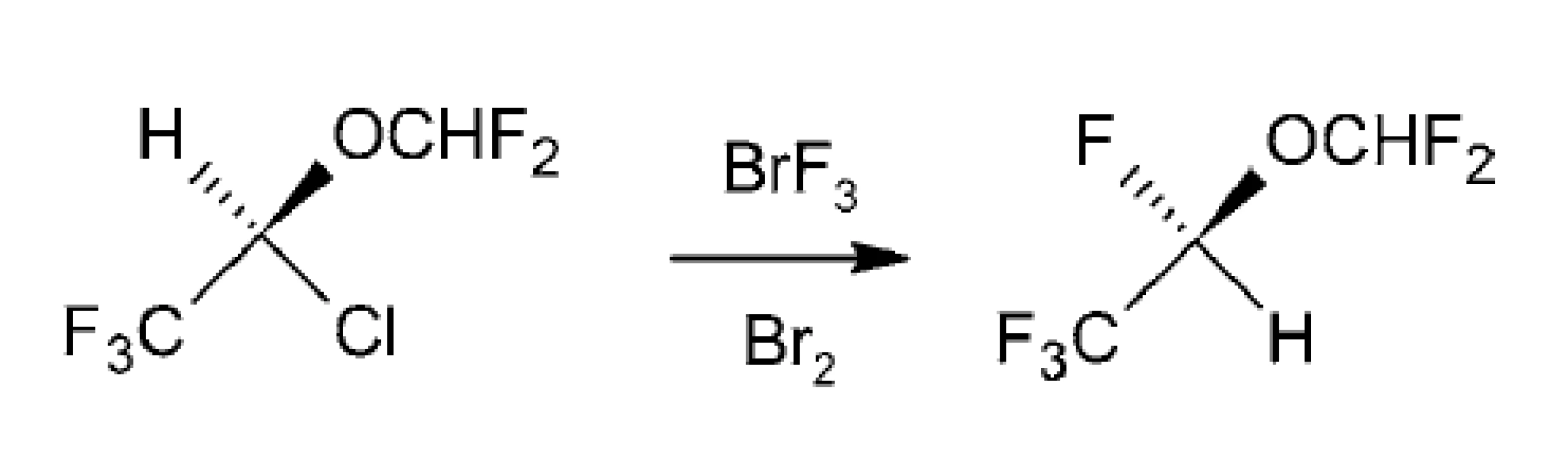
Práca bola podporovaná Vedeckou grantovou agentúrou MŠVVaŠ SR a SAV, grant VEGA 1/0145/20.
Stret záujmov: žiaden.
Došlo 3. januára 2021 / Prijato 1. februára 2021
Ing. Ladislav Habala, PhD.
Farmaceutická fakulta UK
Katedra chemickej teórie liečiv
Odbojárov 10, 832 32 Bratislava, SR
e-mail: habala@fpharm.uniba.sk
Zdroje
1. Digger T., Viira D. J. Anaesthesia and surgical pain relief – The ideal general anaesthetic agent. Hospital Pharmacist 2003; 10, 432–440.
2. Celková anestezie – WikiSkripta dostupné na: https://www.wikiskripta.eu/index.php?title=Inhala%C4%8Dn%C3%AD_anestezie&oldid=432710
3. Steihilber D., Schubert-Zsilavecz M., Roth H. J. Medizinische Chemie. Targets und Arzneistoffe. Stuttgart: Deutscher Apotheker Verlag 2005.
4. Franks N. P., Lieb W. R. Volatile general anaesthetics activate a novel neuronal K+ current. Nature 1988; 333, 662–664.
5. Pavel M. A., Petersen E. N., Wang H., Lerner R. A, Hansen S. B. Studies on the mechanism of general anesthesia. PNAS 2020; 117(24), 13757–13766.
6. Petersen E. N., Pavel M. A., Wang H., Hansen S. B. Disruption of palmitate-mediated localization; a shared pathway of force and anesthetic activation of TREK-1 channels. Biochim. Biophys. Acta Biomembr. 2020; 1862(1), 183091.
7. Willenbring D., Xu Y., Tang P. The role of structured water in mediating general anesthetic action on α4β2 nAChR. Phys. Chem. Chem. Phys. 2010; 12(35), 10263–10269.
8. Olsen R. W., Li G. D. GABA(A) receptors as molecular targets of general anesthetics: identification of binding sites provides clues to allosteric modulation. Can. J. Anaesth. 2011; 58(2), 206–215.
9. Weir C. J ., Mitchell S. J., Lambert J. J. Role of GABA(A) receptor subtypes in the behavioural effects of intravenous general anaesthetics. Br. J. Anaesth. 2017; 119(Suppl 1), i167–i175.
10. Zhang Y., Laster M. J., Hara K., Harris R. A., Eger E. I. 2nd, Stabernack C. R., Sonner J. M. Glycine receptors may mediate part of the immobility produced by inhaled anesthetics. Anesth. Analg. 2003; 96, 97–101.
11. Downie D. L., Hall A. C., Lieb W. R., Franks N. P. Effects of inhalational general anaesthetics on native glycine receptors in rat medullary neurones and recombinant glycine receptors in Xenopus oocytes. Br. J. Pharmacol. 1996; 118(3), 493–502.
12. Krasowski M. D., Harrison N. L. The actions of ether, alcohol and alkane general anaesthetics on GABAA and glycine receptors and the effects of TM2 and TM3 mutations. Br. J. Pharmacol. 2000; 129(4), 731–743.
13. Martin D. C., Plagenhoef M., Abraham J., Dennison R. L., Aronstam R. S. Volatile anesthetics and glutamate activation of N-methyl-d-aspartate receptors. Biochem. Pharmacol. 1995; 49, 809–817.
14. Dringenberg H. C. Serotonergic receptor antagonists alter responses to general anaesthetics in rats. Br. J. Anaesth. 2000; 85, 904–906.
15. Crawford J. S., Lewis M. Nitrous oxide in early human pregnancy. Anaesthesia 1986; 41, 900–905.
16. Mazze R. I., Fujinaga M., Rice S. A., Harris S. B., Baden J. M. Reproductive and teratogenic effects of nitrous oxide, halothane, isoflurane, and enflurane in Sprague-Dawley rats. Anesthesiology 1986; 64, 339–344.
17. Málek J., Dvořák A., a kol. Základy anesteziologie [online]. Inhalační anestezie – WikiSkripta dostupné na: https://www.wikiskripta.eu/w/Inhala%C4%8Dn%C3%AD_anestezie
18. Franks N. P., Dickinson R., de Sousa S. L., Hall A. C., Lieb W. R. How does xenon produce anaesthesia (letter). Nature 1998; 396, 324.
19. Lynch C., Baum J., Tenbrinck R., Weiskopf R. B. Xenon anaesthesia. Anesthesiology 2000; 92, 865–870.
20. Cyclopropane. Chemistry World Podcast, dostupné na: https://www.chemistryworld.com/podcasts/cyclopropane/3010701.article
21. MacDonald A. G. A short history of fires and explosions caused by anaesthetic agents. Br. J. Anaesth. 1994; 72, 710–722.
22. Hess L. Dietyléter a chloroform – nejstarší inhalační anestetika se zajímavou historií. Remedia online 2018. Dostupné na: http://www.remedia.cz/Archiv-rocniku/Rocnik-2018/5-2018/Dietyleter-a-chloroform-nejstarsi-inhalacni-anestetika-se-zajimavou-historii/e-2u8-2D9-2Dv.magarticle.aspx
23. Chang C. Y., Goldstein E., Agarwal N., Swan K. G. Ether in the developing world: rethinking an abandoned agent. BMC Anesthesiology 2015; 15, 149.
24. Hartl J., Palát K., Doležal M., Miletín M., Opletalová V. Farmaceutická chemie II. Univerzita Karlova Praha 1994; 9–10.
25. Huang L., Sang C. N., Desai M. S. Beyond ether and chloroform – a major breakthrough with halothane. J. Anesth. Hist. 2017; 3(3), 87–102.
26. Cahn R. S., Ingold C. K., Prelog V. Specification of molecular chirality. Angew. Chem. Int. Ed. Engl. 1965; 4, 385–415.
27. Prelog V. , Helmchen G. Basic principles of the CIP-system and proposals for a revision. Angew. Chem. Int. Ed. Engl. 1982; 21(8), 567–585.
28. Sedensky M. M., Cascorbi H. F., Meinwald J., Radford P., Morgan P. G. Genetic differences affecting the potency of stereoisomers of halothane. Proc. Nat. Acad. Sci. 1994; 91(21), 10054–10058.
29. Martin J. L., Meinwald J., Radford P., Liu Z., Graf M. L., Pohl L. R. Stereoselective metabolism of halothane enantiomers to trifluoroacetylated liver proteins. Drug Metab. Rev. 1995; 27(1–2), 179–189.
30. Mather L. E., Fryirs B. L., Duke C. C., Cousins M. J. Lack of whole body pharmacokinetic differences of halothane enantiomers in the rat. Anesthesiology 2000; 92, 192–196.
31. Bradshaw J. J., Ivanetich K. M. Isoflurane: a comparison of its metabolism by human and rat hepatic cytochrome P-450. Anesth. Analg. 1984; 63, 805–813.
32. Kharasch E. D., Hankins D. C., Cox K. Clinical isoflurane metabolism by cytochrome P450 2E1. Anesthesiology 1999; 90, 766–771.
33. Karpinskii T. M., Szulc R., Szyfter K. Role of cytochrome P450 in metabolism of inhalation anaesthetics. Noviny lekarskie 2006; 3, 292–298.
34. Lysko G. S., Robinson J. L., Casto R., Ferrone R. A. The stereospecific effects of isoflurane isomers in vivo. Eur. J. Pharmacol. 1994; 263(1–2), 25–29.
35. Franks N. P., Lieb W. R. Stereospecific effects of inhalational general anesthetic optical isomers on nerve ion channels. Science 1991; 254(5030), 427–430.
36. Dickinson R., Franks N. P., Lieb W. R. Can the stereoselective effects of the anesthetic isoflurane be accounted for by lipid solubility? Biophys. J. 1994; 66(6), 2019–2023.
37. Moody E. J ., Harris B. D., Skolnick P. Stereospecific actions of the inhalation anesthetic isoflurane at the GABAA receptor complex. Brain Res. 1993; 615, 101–106.
38. Hall A. C., Lieb W. R., Franks N. P. Stereoselective and non-stereoselective actions of isoflurane on the GABAA receptor. Br. J. Pharmacol. 1994; 112, 906–910.
39. Quinlan J. J., Firestone S., Firestone L. L. Isoflurane’s enhancement of chloride flux through rat brain gammaaminobutyric acid type A receptors is stereoselective. Anesthesiology 1995; 83, 611–615.
40. Oz M., Tchugunova Y., Dinc M., Dunn S. M. Effects of isoflurane on voltage-dependent calcium fluxes in rabbit T-tubule membranes: comparison with alcohols. Arch. Biochem. Biophys. 2002; 398(2), 275–283.
41. Xu Y., Tang P., Firestone L., Zhang T. T. 19F nuclear magnetic resonance investigation of stereoselective binding of isoflurane to bovine serum albumin. Biophys. J. 1996; 70(1), 532–538.
42. Harris B., Moody E., Skolnick P. Isoflurane anesthesia is stereoselective. Eur. J. Pharmacol. 1992; 217, 215–216.
43. Eger E. I., Koblin D. D., Laster M. J., Schurig V., Juza M., Ionescu P., Gong D. Minimum alveolar anesthetic concentration values for the enantiomers of isoflurane differ minimally. Anesth. Analg. 1997; 85, 188–192.
44. Krasowski M. D., Harrison N. L. The actions of ether, alcohol and alkane general anaesthetics on GABAA and glycine receptors and the effects of TM2 and TM3 mutations. Br. J. Pharmacol. 2000;129(4), 731–743.
45. Garton K. J., Yuen P., Meinwald J., Thummel K. E., Kharasch E. D. Stereoselective metabolism of enflurane by human liver cytochrome P450 2E1. Drug Metab. Dispos. 1995; 23, 1426–1430.
46. Patel S. S., Goa K. L. Desflurane. A review of its pharmacodynamic and pharmacokinetic properties and its efficacy in general anaesthesia. Drugs 1995; 50(4), 742–767.
47. Jakobsson J. Desflurane: a clinical update of a third-generation inhaled anaesthetic. Acta Anaesthesiol. Scand. 2012; 56(4), 420–432.
48. Saros G. B., Doolke A., Anderson R. E., Jakobsson J. G. Desflurane vs. sevoflurane as the main inhaled anaesthetic for spontaneous breathing via a laryngeal mask for varicose vein day surgery: A prospective randomized study. Acta Anaesthesiol. Scand. 2006; 50, 549–552.
49. Gupta P., Rath G. P., Prabhakar H., Bithal P. K. Comparison between sevoflurane and desflurane on emergence and recovery characteristics of children undergoing surgery for spinal dysraphism. Indian J. Anaesth. 2015; 59, 482–487.
50. Dayan A. D. Analgesic use of inhaled methoxyflurane: Evaluation of its potential nephrotoxicity. Hum. Exp. Toxicol. 2016; 35(1), 91–100.
51. Blair H. A., Frampton J. E. Methoxyflurane: A review in trauma pain. Clin. Drug Investig. 2016; 36(12), 1067–1073.
52. Sakai E. M., Connolly L. A., Klauck J. A. Inhalation anesthesiology and volatile liquid anesthetics: focus on isoflurane, desflurane, and sevoflurane. Pharmacotherapy 2005; 25(12), 1773–1788.
53. Patel S. S., Goa K. L. Sevoflurane. A review of its pharmacodynamic and pharmacokinetic properties and its clinical use in general anaesthesia. Drugs 1996; 51, 658–700.
54. Ferrando C., Aguilar G., Piqueras L., Soro M., Moreno J., Belda F. J. Sevoflurane, but not propofol, reduces the lung inflammatory response and improves oxygenation in an acute respiratory distress syndrome model. Eur. J. Anaesthesiol. 2013; 30, 455–463.
55. Liu X., Liu X., Xu Y., Xu Z., Huang Y., Chen S., Li S., Liu D. Ventilatory ratio in hypercapnic mechanically ventilated patients with COVID-19 associated ARDS. Am. J. Respir. Crit. Care Med. 2020; 201(10), 1297–1299.
56. Wilson I. D., Poole C. F. Handbook of Methods and Instrumentation in Separation Science, Volume 1. London: Elsevier 2009; 159–130.
57. Špánik I., Krupčík J. Využitie cyklodextrínov ako stacionárnych fáz na separáciu enantiomérov kapilárnou plynovou chromatografiou. Chem. Listy 2000; 94, 10–14.
58. Schurig V. Use of derivatized cyclodextrins as chiral selectors for the separation of enantiomers by gas chromatography. Ann. Pharm. Fr. 2010; 68, 82–98.
59. Meinwald J., Thomson W. P., Pearson D. L., Konig W. A., Runge T., Francke W. Inhalation anesthetics stereochemistry. Optical resolution of halothane, enflurane, and isoflurane. Science 1991; 251, 560–561.
60. König W. A., Krebber R., Mischnick P. Cyclodextrins as chiral stationary phase in capillary gas chromatography for chromatography, part V: Octakis (3-O-butyryl-2,6--di-O-pentyl)-γ-cyklodextrin. J. High. Res. Chromatogr. 1989; 12, 732–738.
61. Ramig K., Krishnaswami A., Rozov L. A. Chiral interaction of the fluoroether anesthetics desflurane, isoflurane, enflurane, and analogues with modified cyklodextrins studied by capillary gas chromatography and nuclear magnetic resonance spectroscopy, a simple method for column-suitability screening. Tetrahedron 1996; 52, 319–330.
62. Schurig V., Grosenick H., Juza M. Enantiomer separation of chiral inhalation anesthetics (enflurane, isoflurane and desflurane) by gas chromatography on a gama-cyclodextrin derivative. Recl. Trav. Chim. Pays-Bas 1995; 114, 211–219.
63. Schurig V., Juza M. Approach to the thermodynamics of enantiomer separation by gas chromatography. Enantioselectivity between the chiral inhalation anesthetics enflurane, isoflurane and desflurane and a diluted gamma-cyclodextrin derivative. J. Chromatogr. A 1997; 757(1–2), 119–135.
64. Schmidt R., Wahl H. G., Häberle H., Dieterich H. J., Schurig V. Headspace gas chromatography-mass spectrometry analysis of isoflurane enantiomers in blood samples after anesthesia with the racemic mixture. Chirality 1999; 11, 206–211.
65. Juza M., Jakubetz H., Hettesheimer H., Schurig V. Quantitative determination of isoflurane enantiomers in blood samples during and after surgery via headspace gas chromatography-mass spectrometry. J. Chromatogr. B Biomed. Sci. Appl. 1999; 735(1), 93–102.
66. Haeberle H. A., Wahl H. G., Jakubetz H., Krause H., Schmidt R., Schurig V., Dieterich H. J. Accumulation of S(+)-enantiomer in human beings after general anaesthesia with isoflurane racemate. Eur. J. Anaesthesiol. 2002; 19, 641–646.
67. Wang F., Polavarapu P. L., Schurig V., Schmidt R. Absolute configuration and conformational analysis of a degradation product of inhalation anaesthetic sevoflurane: A vibrational circular dichroism study. Chirality 2002; 14, 618–624.
68. Haeberle H. A., Wahl H. G., Aigner G., Unertl K., Dieterich H. J. Release of S(+) enantiomers in breath samples after anaesthesia with isoflurane racemate. Eur. J. Anaesthesiol. 2004; 21, 144–150.
69. Bodenhöfer K., Hierlemann A., Juza M., Schurig V., Göpel W. Chiral discrimination of inhalation anesthetics and methyl propionates by thickness shear mode resonators: new insights into the mechanisms of enantioselectivity by cyclodextrins. Anal. Chem. 1997; 69, 4017–4031.
70. Bodenhöfer K., Hierlemann A., Göpel W., Juza M., Gross B., Schurig V. Efficient gas sensor mediated enantiomer discrimination of 2-substituted methyl propionates and chiral inhalation anesthetics on a modified cyclodextrin. Chim. Oggi 1998; 16, 56–58.
71. Hierlemann A., Bodenhöfer K., Juza M., Gross B., Schurig V., Göpel W. Enantioselective monitoring of chiral inhalation anesthetics by simple gas sensors. Sens. Mater. 1999; 11, 209–218.
72. Polavarapu P. L., Cholli A. L., Vernice G. G. Determination of absolute configurations and predominant conformations of general inhalation anesthetics: desflurane. J. Pharm. Sci. 1993; 82(8), 791–793.
73. Schurig V. Salient features of enantioselective gas chromatography: the enantiomeric enflurane, isoflurane and desflurane by gas chromatography on a derivatized gamma-cyclodextrin stationary phase. J. Chromatogr. A 1997; 769(1), 119–127.
74. Schurig V., Juza M., Green B. S., Horakh J., Simon A. Absolute configuration of the inhalation anaesthetics isoflurane and desflurane. Angew. Chem. 1996; 35, 1680–1682.
75. Polavarapu P. l., Zhao C. X., Cholli A. L., Vernice G. G. Vibration circular dichroism absolute configuration, and predominant conformation of volatile anesthetics: deflurane. J. Phys. Chem. 1999; 103, 6127–6132.
76. Polavarapu P. l., Cholli A. L., Vernice G. G. Determination of absolute configuration and predominant conformations of general inhalation anesthetics: deflurane. J. Pharm. Sci. 1997; 86, 267.
77. Biedermann P. U., Cheeseman J. R., Frisch M. J., Schurig V., Gutman I., Agranat I. Conformational spaces and absolute configuration of chiral fluorinated inhalation anaesthetics. A theoretical study. J. Org. Chem. 1999; 64, 3878–3884.
78. Ramig K. Synthesis and reactions of fluoroether anesthetics. Synthesis 2002; (17), 2627–2631.
79. Swarts J. E. Étude sur le fluochloroforme. Acad. Roy. Belg. 1892; 3(24), 474–484.
80. Rozov L. A., Lessor R. A., Kudzma L. V., Ramig K. The fluoromethyl ether sevoflurane as a fluoride source in halogen-exchange reactions. J. Fluorine Chem. 1998; 88, 51–54.
81. Ramig K., Englander M., Kallashi F., Livchits L., Zhou J. Synthesis of esters by selective methanolysis of the trifluoromethyl group. Tetrahedron Lett. 2002; 43, 7731–7734.
82. Kimura Y., Matsuura D. Novel Synthetic Method for the Vilsmeier-Haack Reagent and Green Routes to Acid Chlorides, Alkyl Formates, and Alkyl Chlorides. Int. J. Org. Chem. 2013; 03(03), 1–7.
83. Ramig K., Lavida O., Szalda D. J. The highly stereoselective decarboxylation of (+)-bromo-1-chloro-2,2,2-trifluoropropanoic acid to give 1-bromo-1-chloro-2,2,2-trifluoroethane[(+)-halothane] with retention of configuration. Tetrahedron Asymmetry 2012; 23, 201–204.
84. Rozov L. A., Patrice W., Rafalko P.W., Evans S. M., Brockunier L., Ramig K. Asymmetric synthesis of the volatile anesthetic 1,2,2,2-tetrafluoroethyl chlorofluoromethyl ether using a stereospecific decarboxylation of unusual stereochemical outcome. J. Org. Chem. 1995; 60, 1319–1325.
85. Rozov L. A., Huang Ch. G., Halpern D. F.,Vernice G. G., Ramig K. Enantioselective synthesis of the volatile anesthetic desflurane. Tetrahedron Asymm. 1997; 8(18), 3023–3025.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2021 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
-
ČESKÁ A SLOVENSKÁ FARMACIE
CZECH AND SLOVAK PHARMACY - Triazavirín by mohol byť novovu nádejou v súboji s koronavírusom 2 vyvolávajúcim ťažký akútny respiračný syndróm (SARS-CoV-2)
- K vývoji složení lékárniček první pomoci
- Další vývoj obsahu Národní části Českého lékopisu 2017 v jeho doplňcích z pohledu přípravy léčiv v lékárnách
- Vliv způsobu emulgace, rychlosti míchání a objemu na PLGA mikročástice s ibuprofenem
- Celkové inhalačné anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
-
ČESKÁ A SLOVENSKÁ FARMACIE
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Celkové inhalačné anestetiká – farmakodynamika, farmakokinetika a chirálne vlastnosti
- Triazavirín by mohol byť novovu nádejou v súboji s koronavírusom 2 vyvolávajúcim ťažký akútny respiračný syndróm (SARS-CoV-2)
- K vývoji složení lékárniček první pomoci
- Vliv způsobu emulgace, rychlosti míchání a objemu na PLGA mikročástice s ibuprofenem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání