-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pokroky ve využití instrumentálního měření barevnosti ve vývoji, výrobě a v kontrole jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek III*
Advances in the use of instrumental measurement of colour in the development, production and quality control of drugs, medicinal preparations and pharmaceutical auxiliary substances III
Colour is an important indicator of the quality of pharmaceuticals, medicinal products and pharmaceutical excipients. The paper summarizes advances in the use of instrumental colour measurement in synthetic medicines and medicines of non-natural origin, their dosage forms and excipients published in 2013–2019.
Keywords:
colour measurement – synthetic drugs – medicinal products – excipients – analytical applications
Autoři: Jan Šubert; Jozef Čižmárik; Jozef Kolář
Působiště autorů: Katedra farmaceutickej chémie FaF, Univerzita Komenského v Bratislave
Vyšlo v časopise: Čes. slov. Farm., 2020; 69, 59-66
Kategorie: Přehledy a odborná sdělení
Souhrn
Barevnost je důležitým ukazatelem jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek. Příspěvek shrnuje pokroky ve využití instrumentálního měření barevnosti v oblasti syntetických léčiv a léčiv jiného než přírodního původu, jejich lékových forem a pomocných látek publikovaných v letech 2013–2019.
Klíčová slova:
měření barevnosti – syntetická léčiva – léčivé přípravky – pomocné látky – analytické aplikace
Úvod
Barevnost je často důležitým ukazatelem jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek. Mimoto může být a také je využívána i při jejich analýze. Přes nárůst publikovaných aplikací však její objektivní měření dosud není ve vývoji, výrobě a kontrole jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek běžnou metodou, přestože je opakovaně doporučováno mimo jiné pro vývoj léčivých přípravků a testování jejich fotostability1, 2). V Evropě také měření barevnosti dosud není zařazeno mezi lékopisné metody kontroly jakosti léčiv, ačkoliv nové vydání Ph. Eur.3) k tomu bylo vhodnou příležitostí. A to přesto, že vizuální odlišení porovnávacích barevných roztoků Ph. Eur. s nízkou barevností může být zatíženo vysokou chybovostí4) zapříčiněnou příliš malými barevnými rozdíly s hodnotami ΔE (CIELAB) v mezních případech < 1 a častěji ≤ 1,55), které pro spolehlivé vizuální rozlišení nepostačují. Tento příspěvek v návaznosti na6) shrnuje aplikace instrumentálního měření barevnosti v oblasti syntetických léčiv a dalších léčiv jiného než přírodního původu, včetně chemicky modifikovaných přírodních produktů, fúzních proteinů a monoklonálních protilátek, jejich lékových forem a pomocných látek publikované v letech 2013–2019. Využívány v nich byly zejména barevné prostory RGB a CIELAB, jiné podstatně méně až ojediněle. Např. barevný prostor YCbCr byl používán v aplikacích, které jsou předmětem sdělení, jen jednou skupinou autorů7–9), barevné prostory jako YIQ a CIE xyY byly použity jen výjimečně10, 11). Významným trendem je nárůst analytických aplikací v obecné rovině a v jejich rámci pak zejména aplikací využívajících chytré mobilní telefony. Kolorimetrické parametry byly v některých případech získávány v oblasti léčiv dříve méně běžnými postupy, jako z výsledků mikroskopického zobrazení7–9), resp. z konfokální laserové mikroskopie12) či CCD mikroskopie13).
<hr>
*Část II: Čes. slov. Farm. 2014; 63, 107–112.
<hr>
Popisné aplikace
Pomineme-li popis nových syntetických barevných látek testovaných jako možná léčiva14–16), nebylo ve sledovaném období měření barevnosti používáno k pouhému objektivnímu popisu zbarvení léčiv připravovaných klasickou chemickou syntézou, bylo však ověřeno (a to s použitím kolorimetrických parametrů barevného prostoru CIELAB a rozdílu barevnosti ΔE2000) k objektivnímu popisu zbarvení roztoků léčiv typu terapeutických proteinů17). V této souvislosti byla věnována pozornost také validaci metodiky pro příslušná měření18).
Obdobně tomu bylo u nepřírodních pomocných látek a z nich připravených základů pro lékové formy. Autoři19) popisují parametry v oblasti léčiv a pomocných látek málo využívaného barevného prostoru CIELUV barevnost homopolymerů sestávajících z methylcelulosy a kukuřičného škrobu při různém poměru jeho složek. K popisu zbarvení gelu připraveného z chemicky modifikované rýže a obsahujícího lidokain byly použity parametry barevného prostoru CIELAB20). Parametry téhož barevného prostoru byly použity k popisu zbarvení gelu obsahujícího rehydratační roztok, připraveného z amidovaného, tedy chemicky modifikovaného pektinu a želatiny21).
Stabilita léčiv a léčivých přípravků
U léčiv samotných byla sledována fotostabilita syntetického a biosyntetického riboflavinu v pevné fázi v různých krystalických formách měřením změn barevnosti (CIELAB, ΔE) vyvolaných osvětlením o vlnové délce 350–400 nm22).. Sledováním stability kyseliny askorbové za rozdílných podmínek (obsah vody, teplota uchovávání) různými metodami včetně měření barevnosti se zabývala studie23) (L, a, b ΔE Hunter). Autoři24) sledovali měřením Δa*, Δb* a dalšími metodami stabilitu kyseliny askorbové v amorfní pevné disperzi a v krystalické formě za různých podmínek uchovávání. Studie25) ukázala, že fotostabilitu furosemidu lze zlepšit tvorbou jeho kokrystalů s nikotinamidem (měření L*, a*, b* a z nich výpočet rozdílů barevnosti ΔE), kokrystaly furosemidu s dalšími látkami (urea, kofein) byly méně výhodné. Autoři26) sledovali (CIELAB, ΔE2000) fotostabilitu IgG1 monoklonálních protilátek za různého osvětlení. Parametry barevného prostoru CIELAB (L*, a*, b*, ΔE) byly použity k predikci změn barevnosti u tekutých léčivých přípravků v podmínkách jejich urychleného stárnutí za zvýšené teploty27). Modelový roztok obsahoval L-tryptofan a glukózu. V navazující studii byl tentýž princip použit k predikci změn barevnosti roztoků paracetamolu28). Stabilitu kurkuminu ve vodných roztocích a v emulzích olej ve vodě (změny hodnot kolorimetrického parametru b* v závislosti na pH a dalších faktorech) sledovali autoři29). Z výsledků studie30) vyplývá, že při přípravě krému o/v a hydrofobní masti s obsahem dithranolu je z pohledu stability výhodné použít pevnou disperzi léčiva (CIELAB, ΔE). Další autoři sledovali barevnou stabilitu léčiv v tabletách. Stabilitou zbarvení tablet (rozdíly barevnosti ΔE) obsahujících furosemid při různých podmínkách jejich výroby a skladování (teplota, vlhkost) se zabývala studie31). Autoři32) sledovali stabilitu zbarvení (kolorimetrické parametry L*, a*, b*, ΔE) tablet obsahujících risperidon při různém složení pomocných látek; zjistili, že fotostabilitě risperidonu v tabletách prospívá malé množství hydroxypropylcelulosy. V rámci sledování fyzikální stability tablet citlivých vůči vlhkosti (16 přípravků obsahujících osm různých jednotlivých léčiv a jednu kombinaci) byly sledovány také jejich kolorimetrické parametry (CIELAB, ΔE)33). Největší barevné změny (ΔE = 6 – 9) vykazovaly za podmínek zkoušky tablety obsahující natrium-valproát (přípravek Orfiril).
Jiné technologické problémy a výstupní kontrola jakosti
Vliv mikrofluidizace na množství obalených a neobalených mikrotobolek s obsahem α-tokoferolu byl sledován ve studii12) (CIELAB). Hodnoty souřadnice a* zjištěné obrazovou analýzou byly v dobré korelaci s účinností obalování.
Několik dalších prací bylo věnováno problematice práškových léčiv. Autoři7–9) využili barevný prostor YCbCr, přičemž pomocnou barevnou složkou byl oxid železitý7) nebo červené barvivo9). V první z citovaných prací při studiu účinnosti strojového míchání práškových směsí byly sledovány hodnoty parametru ΔCb a jejich relativní směrodatná odchylka při různé rychlosti a době strojového míchání a vliv dalších faktorů7). Ve studiích8, 9) autoři problematiku dále rozpracovali, v9) prokázali lineární korelaci mezi hodnotami ΔCr získanými nedestruktivním měřením a výsledky analýz směsí léčiv s obsahem barevné složky HPLC. Jiní autoři preferovali při řešení problémů míchání a vlastností směsí práškových léčiv barevný prostor CIELCH34–35). Pomocnou látkou k zajištění barevnosti směsi byl oxid železitý34) nebo rhodamin B35).
Další skupina aplikací měření barevnosti byla zaměřena na problematiku obalování pelet36) a tablet37, 38) a hodnocení kvality potahovaných tablet39) a dalších dělených lékových forem. Autoři36) navrhli a otestovali rychlou metodu kontroly stejnoměrnosti obalování pelet. Barevnou látkou byl tartrazin a využit byl barevný prostor HSV (odstín barvy H* odpovídající dominantní vlnové délce). Stejný barevný prostor (ale odlišné žluté barvivo) použili autoři další studie zaměřené na optimalizaci obalování tablet pomocí statisticky plánovaného experimentu. Sledovanými kolorimetrickými parametry byly odstín barvy H* (barevný tón) a sytost barvy S*37). Vývoj zbarvení tablet v průběhu jejich obalování sledovali autoři38), obalovací směs obsahovala žluté barvivo. Sledovanými kolorimetrickými parametry v barevných prostorech CIELAB a CIELCH byl jas L*, chroma C*, barevný tón H* a barevné rozdíly ΔE CIELAB a CIEDE2000. Rozdíly barevnosti ΔE = [(ΔL)2 + (Δa)2 + (Δb)2]0,5 v dnes již málo používaných jednotkách NBS (barevnou látkou byl žlutý oxid železitý) byly jedním z ukazatelů při hodnocení vzhledu potahovaných tablet podle39). K detekci odlišně zbarvených tobolek použili autoři40) hodnot váženého rozdílu barevnosti v barevném prostoru HSV. V další práci zaměřené na kontrolu jakosti produkce dělených lékových forem41) pracovali autoři s parametry barevného prostor RGB.
U léčiv ze skupiny monoklonálních protilátek byl s využitím parametrů barevného prostoru CIELAB (L*, a*, b*, ΔE) sledován vliv složení kultivačního média na zbarvení produktu se závěrem, že intenzitu jejich zbarvení snižuje snížení koncentrace vitaminů skupiny B a železnatých iontů42). Jiná skupina autorů43) sledovala příčiny a okolnosti vzniku a intenzitu zbarvení monoklonální protilátky IgG4. Byla zjištěna lineární korelace mezi hodnotou souřadnice a* popisující červené zbarvení a koncentrací kobaltu (vitamin B12) v produktu. Měření barevnosti (CIE L*, a*, b*) bylo jednou z instrumentálních analytických metod použitých při studiu příčin vzniku zbarvení u látek typu fúzních proteinů, včetně příspěvku jednotlivých chromoforů k výslednému barevnému vjemu44).
Analytické aplikace
Instrumentální měření barevnosti má dnes již rozsáhlé a dále rostoucí využití v analytice léčiv a farmaceutických pomocných látek, publikace z oblasti samotné kvalitativní analytiky léčiv však jsou málo četné. Patří k nim práce45) zaměřená na ověření identity skupiny > 40 léčiv, organických látek z různých farmakologických skupin (nesteroidní antiflogistika, β-blokátory aj.) na základě jejich barevných reakcí s roztoky sedmi chromogenních činidel. Výsledná zbarvení autoři skenovali a převáděli do barevného prostoru RGB, ve kterém byly analytické signály dále zpracovány a vyhodnocovány. Zaměřením podobná je publikace stejné skupiny autorů46), která se s předcházející překrývá počtem (> 40) a výběrem léčiv, i počtem a výběrem chromogenních činidel, řeší však navíc možnost semikvantitativního stanovení jednotlivých léčiv.
K detekci a rozlišení antibiotik (cefalosporiny, peniciliny, rifampicin) byl vyvinut senzor založený na bakteriofágu M13, změny jeho zbarvení při kontaktu s analyty byly sledovány v barevném prostoru RGB jako ΔRGB a vyhodnocovány s použitím PCA13). Autoři10) na příkladu léčiv absorbujících ultrafialové záření amodiachinu, nevirapinu a paracetamolu rozpracovali metodiku ověření identity založené na TLC následované analýzou fotografií skvrn a kvantitativním vyhodnocením s využitím mobilního telefonu a barevných prostorů RGB a YIQ. Publikace47) se na příkladu tablet obsahujících sildenafil zabývá problematikou použitelnosti výsledků měření zbarvení povrchu barevných a bílých tablet k jejich nespecifické identifikaci (CIELAB, ΔE, chroma C*, intenzita zbarvení CI = [(100 – L*)2 + a*2 + b*2]0,5, u bílých tablet také index bělosti).
Úvodem k aplikacím měření barevnosti v kvantitativní farmaceutické analytice lze zmínit teoretickou studii zaměřenou na výběr kolorimetrického parametru pro stanovení analytu48). V rámci barevných prostorů RGB, CIE XYZ, CIELAB, CIELCH, HSB a CMYK její autoři doporučují hodnotu jasu L* v barevném prostoru CIELAB, přestože jde zpravidla o závislost exponenciální48). Většina publikovaných farmaceuticky významných aplikací z posledních let však dává v případě jejich dostupnosti přednost závislostem lineárním. Jen výjimečně lze využít ke stanovení analytu jeho vlastního zbarvení. Bylo by tomu tak např. při stanovení brilantní zeleně a bazického fuchsinu49), nositelem barevnosti však může být i barvivo50), resp. zejména barvivo51) přidané do vehikula. V ostatních případech je nutné měřitelné změny zbarvení vyvolat. To se většinou děje reakcí analytu nebo jeho reakčního produktu (např.52–54)) s vhodnou látkou (v případě52) s barevným indikátorem pH). Uspořádání analýzy však může být složitější, např. v publikaci55) se sleduje rovněž změna zbarvení indikátoru pH, analyt však brání hydrolýze jiné látky na kyselinu, která ovlivňuje zbarvení indikátoru. V jiných případech může jít o agregaci nanočástic zlata56–59) nebo stříbra60, 61) vyvolanou jejich interakcí s analytem a doprovázenou změnou jejich zbarvení, případně o jejich nárůst62). Selektivita těchto analýz je v některých případech dostatečná dokonce pro stanovení enantiomerů59, 61). K získání a dalšímu zpracování analytického signálu lze použít různé techniky přímého měření, v posledních letech už nejčastěji obrazovou analýzu, trendem je využití mobilních telefonů, které umožňují i mobilní analytiku bez potřeby složitějšího a nákladnějšího přístrojového vybavení. Některé z aplikací v tomto směru jsou uvedeny v tabulce 1.
Tab. 1. Stanovení léčiv založená na měření barevnosti s použitím mobilního telefonu (příklady) 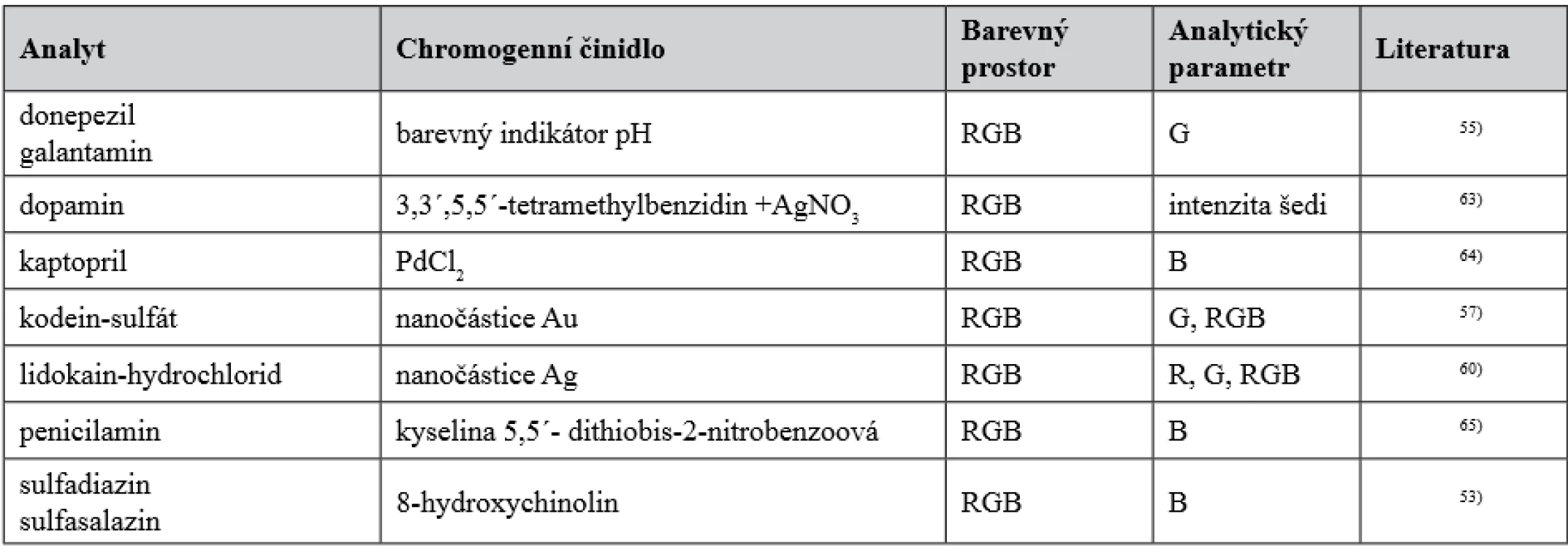
Z dalších aplikací využívajících měření barevnosti po digitalizaci a zobrazení mobilním telefonem je třeba zmínit stanovení metamfetaminu (Simonův test, barevný prostor RGB)54), stanovení železa v léčivých přípravcích (1,10-fenatrolin a další chromogenní činidla, barevný prostor xyY a jeho srovnání s RGB, CMY a XYZ, vůči kterým se jeví průběhem závislosti analytického signálu na koncentraci analytu jako výhodnější)11), stanovení efedrin-hydrochloridu, methylefedrinu a pseudoefedrinu (síran měďnatý, barevné prostory RGB a CMYK, analytické parametry B a M)66) a stanovení enantiomerů ibuprofenu vedle sebe (nanočástice zlata, barevný prostor RGB)59). Je zřejmé, že při kvantitativních analýzách s využitím mobilního telefonu převládá využití barevného prostoru RGB a totéž platí pro aplikace využívající skener. Ty byly ve farmaceuticky významných aplikacích publikovaných ve sledovaném období použity k digitalizaci a zobrazení zbarvení nejčastěji. Publikace11), ve které jsou výsledky testování použití mobilního telefonu i skeneru, ukazuje, že při použití skeneru lze dosáhnout vyšší citlivosti analýzy. Srovnání skenerů různých výrobců lze nalézt ve sdělení67). Z organických léčiv bylo jako experiment z výuky studentů popsáno a porovnáno s klasickou absorpční spektrofotometrií ve viditelné oblasti spektrální stanovení acetylsalicylové kyseliny v tabletách (Fe3+ po hydrolýze léčiva, barevný prostor RGB, G)68), na stejném principu, avšak bez hydrolýzy léčiva je založeno stanovení volné kyseliny salicylové v tabletách obsahujících acetylsalicylovou kyselinu (dusičnan železitý, RGB, G)69). Autoři70) se zabývali kolorimetrickým stanovením 8-hydroxychinolinu, prokainu, kvercetinu a tetracyklinu v léčivých přípravcích s použitím tablet z polyuretanové pěny chemicky modifikované diazotací (RGB, R). Přesnost těchto analýz uvedená v publikaci však není dostatečná k využití při kontrole jakosti v rámci obvyklých tolerancí. Stejná pracovní skupina se zabývala také kolorimetrickým stanovením tetracyklin-hydrochloridu a kyanokobalaminu po sorpci jejich barevných komplexů na polyuretanovou pěnu (FeCl3, KSCN, RGB, B, kyanokobalamin byl předem mineralizován)71). Stanovení isoniazidu v roztoku a v tabletách je založeno na jeho reakci s měďnatými ionty (octan měďnatý) na povrchu oxidu hlinitého za vzniku barevného oxidu měďného (RGB, B)72). Ke stanovení paracetamolu v tabletách využili autoři reakce léčiva s metavanadičnanem sodným a dalšími dvěma zkoumadly (barevný prostor HSV, H, výsledky byly srovnatelné s HPLC)73). Linkomycin byl stanoven na základě vysoce selektivní barevné reakce s HAuCl4 /NaOH74) (RGB, ΔRGB). Enantiomery tryptofanu byly stanoveny vedle sebe s využitím změn zbarvení nanočástic stříbra při jejich interakci s analytem (RGB, CMYK, autoři uvádějí jako charakteristiku přesnosti stanovení L-tryptofanu s využitím parametrů barevného prostoru RGB relativní směrodatnou odchylku ≤ 1,8 %)61). Autoři75) připravili reakcí rhodaninu se syringaldehydem nové chromogenní činidlo s vysokou selektivitou na stříbrné ionty a použili jej ke stanovení stříbra v krému obsahujícím stříbrnou sůl sulfadiazinu (RGB, G, R). Podobně jako jiní autoři v práci11) použili autoři67) jako chromogenního činidla ke stanovení železa (Fe2+) v léčivých přípravcích 1,10-fenantrolinu (RGB, G, B, intenzita šedi). Publikace76–79) se zabývají stanovením halogenidů a léčiv typu organických látek reagujících s jodem79). První z nich76) stanovením chloridů, které jsou převáděny na chlor, ten reaguje na papíře s nanočásticemi stříbra za změn spektra, které se po skenování vyhodnotí kolorimetricky (RGB, R, G, B). Autoři postup aplikovali mimo jiné na stanovení obsahu chloridů v 0,9% infuzním roztoku chloridu sodného a 10% roztoku chloridu vápenatého k transfuzním účelům. Při relativní směrodatné odchylce ≥ 5 % však nelze počítat s jeho praktickým uplatněním v kontrole jakosti, kde je pro stanovení chloridů v praxi zavedena přesnější argentometrická titrace. Může však být výhodný při stanovení malých množství chloridů anebo chloridů v přítomnosti rušivých látek. Další77) řeší stanovení chloridů a bromidů, resp. chloru a bromu, na které jsou chloridy a bromidy oxidovány. Chlor a brom reagují s methyloranží a pokles jejího zbarvení se po skenování hodnotí kolorimetricky (RGB, G). Z farmaceuticky významných vzorků autoři postup aplikovali na stanovení chloridů v 0,9% infuzním roztoku chloridu sodného a mimoto ke stanovení chloridů v léčivých přípravcích obsahujících propranolol-hydrochlorid a ranitidin-hydrochlorid. Pro stanovení jodidů byly opět využity nanočástice stříbra, s nimiž na papíře reagoval jod vzniklý oxidací jodidu za vzniku jodidu stříbrného (RGB, R)78). Při analýze léčivých přípravků byla relativní směrodatná odchylka ≤ 1,7 %. Možnosti postupu jsou rozšířeny v práci79), která se mimo stanovení jodidů zabývá stanovením některých léčiv reagujících s jodem (askorbová kyselina, kofein, metamizol sodná sůl v léčivých přípravcích, RGB, R). Interakce nanočástic stříbra s jodem mění zbarvení z modrého na bílé79).
V posledních letech už jen menší skupina aplikací měření barevnosti v kvantitativní analýze léčiv využívá jiné možnosti digitalizace, resp. přímého měření. Jde o digitální fotoaparáty a kamery56, 58, 62, 80) nebo webkamery81, 82) či přímo měřící digitální kolorimetry50–52). Kdysi převažující získávání kolorimetrických parametrů ze spekter ve viditelné oblasti již téměř není v publikovaných analytických aplikacích používáno. Změny zbarvení nanočástic zlata za přítomnosti chinidinu (barevný prostor RGB, R)56) anebo heparinu (RGB, G)58) byly využity ke kolorimetrickému stanovení těchto léčiv. Podobně změna zbarvení nanočástic stříbra byla využita ke stanovení kyseliny askorbové v léčivých přípravcích (barevný prostor CMY, Y)62). Produkty alkalické hydrolýzy lornoxikamu, meloxikamu a tenoxikamu poskytují barevnou reakci s 7-chlor-4-nitrobenzo-2-oxa-1,3-diazolem, což lze využít ke stanovení těchto léčiv v léčivých přípravcích (RGB, R)80). Relativní směrodatná odchylka výsledků těchto stanovení však byla násobně vyšší než při stanovení absorpční spektrofotometrií ve viditelné oblasti při 461 nm80). Ke kontrole vlhkosti ve farmaceutickém průmyslu byl vyvinut senzor založený na barvivu DenimBlu30 s funkcí oxidoredukčního indikátoru (RGB, R+B normalizované na intenzitu šedi, pro 5–100 % relativní vlhkosti)81). Další možnost stanovení železnatých iontů v léčivých přípravcích poskytlo využití jejich barevné reakce s 2,2´-dipyridylem (tištěný senzor, RGB, B, analýza tablet obsahujících FeSO4)82). Močovina byla stanovena po enzymatické hydrolýze na amoniak, který mění zbarvení indikátoru pH (RGB, R)52). Hlinité ionty v techneciových eluátech byly semikvantitativně stanoveny s využitím jejich barevné reakce s chromazurolem S (barevný prostor CMYK, C)83). Měření barevnosti digitálním kolorimetrem v barevném prostoru CIELAB bylo použito ke kontrole počtu nanesených vrstev tištěného léčivého přípravku s obsahem propranolol-hydrochloridu a tím i dávky léčiva (zdrojem barevnosti bylo barvivo přidané do nanášené tekutiny, sledován byl barevný rozdíl ΔE)50), anebo s obsahem vitaminů ze skupiny B (i zde bylo v nanášené tekutině barvivo, sledovány byly barevný rozdíl ΔE a souřadnice b*)51).
Barevný prostor RGB byl použit při vývoji kolorimetrického postupu k detekci a kvantifikaci peroxidu vodíku v desinfekčních roztocích84). Na některé další obtížněji dostupné analytické aplikace měření barevnosti při analýze léčiv od ruských autorů upozorňuje přehled85), na další souvislosti v rámci problematiky pak86).
Střet zájmů: žádný.
doc. RNDr. Jozef Kolář, CSc. (∗)
Kamenačky 25, 636 00 Brno
e-mail: kolarjozef02@gmail.com
J. Šubert
Dušínova 1512/42, Kuřim
J. Čižmárik
Katedra farmaceutickej chémie FaF
Univerzita Komenského v Bratislave
Zdroje
1. Hetrick E. M., Vannoy J., Montgomery L. L., Pack B. W. Integrating tristimulus colorimetry into pharmaceutical development for color selection and physical appearance control: A quality-by-design approach. J. Pharm. Sci. 2013; 102, 2608–2621.
2. Allain L., Baertschi S. W., Clapham D., Foti C., Lantaff W. M., Reed R. A., Templeton A. C., Tønnesen H. H. Implications of in-use photostability: Proposed guidance for photostability testing and labeling to support the administration of photosensitive pharmaceutical products, Part 3. Oral drug products. J. Pharm. Sci. 2016; 105, 1586–1594.
3. European Pharmacopoeia (Ph. Eur.) 10th ed., Strasbourg: EDQM Council of Europe 2019; 22–23. https://pheur.edqm.eu/internal/5608e6cd2d2549629e8075ad2d37c90f/10-0/10-0/page/20202E.pdf (11. 2. 2020).
4. Pack B. W., Montgomery L. L., Hetrick E. M. Modernization of physical appearance and solution color tests using quantitative tristimulus colorimetry: advantages, harmonization, and validation strategies. J. Pharm. Sci. 2015; 104, 3299–3313.
5. Šubert J., Kolář J., Čižmárik J. Teorie a praxe lékopisné kontroly jakosti léčiv a pomocných látek VII. Porovnávací barevné roztoky Evropského lékopisu (Ph. Eur.). Čes. slov. Farm. 2018; 67, 30–31.
6. Šubert J., Čižmárik J. Pokroky ve využití instrumentálního měření barevnosti ve vývoji, výrobě a kontrole jakosti léčiv, léčivých přípravků a pomocných látek I. Čes. slov. Farm. 2013; 62, 65–70.
7. Miyazaki Y., Miyawaki K., Uchino T., Kagawa Y. A novel blending method for dispensing powdered medicine. Chem. Pharm. Bull. 2014; 62, 54–57. https://doi.org/10.1248/cpb.c13-00577 (8. 2. 2020).
8. Miyazaki Y., Miyawaki K., Uchino T., Kagawa Y. Assessment of blending ratio of powdered medicine mixtures by image analysis. Chem. Pharm. Bull. 2014; 62, 322–327. https://doi.org/10.1248/cpb.c13-00772 (8. 2. 2020).
9. Miyazaki Y., Uchino T., Kagawa Y. Evaluation of degree of blending colored diluents using color difference signal method. Chem. Pharm. Bull. 2014; 62, 488–490. https://doi.org/10.1248/cpb.c14-00020 (8. 2. 2020).
10. Yu H., Le H. M., Kaale E., Long K. D., Layloff T., Lumetta S. S., Cunningham B. T. Characterization of drug authenticity using thin-layer chromatography imaging with a mobile phone. J. Pharm. Biomed. Anal. 2016; 125, 85–93.
11. Mohamed A. A., Shalaby A. A., Salem A. M. The Yxy colour space parameters as novel signalling tools for digital imaging sensors in the analytical laboratory. RSC Adv. 2018; 8, 10673–10679. https://doi.org/10.1039/C8RA00209F (5. 12. 2019).
12. Quintanilla-Carvajal M. X., Hernández-Sánchez H., Alamilla-Beltrán L., Zepeda-Vallejo G., Jaramillo-Flores M. E., de Jesús Perea-Flores M., Jimennez-Aparicio A., Gutiérrez-López G. F. Effects of microfluidisation process on the amounts and distribution of encapsulated and non-encapsulated α-tocopherol microcapsules obtained by spray drying. Food Res. Int. 2014; 63, 2–8. https://doi.org/10.1016/j.foodres.2014.05.025 (22. 12. 2019).
13. Moon J. S., Park M., Kim W. G., Kim C., Hwang J., Seol D., Kim C. S., Sohn J. R., Chung H., Oh J. W. M-13 bacteriophage based structural color sensor for detecting antibiotics. Sens. Actuators B: Chem. 2017; 240, 757–762. https://doi.org/10.1016/j.snb.2016.09.050 (26. 11. 2019).
14. Gouda M. A., Eldien H. F., Girges M. M., Berghot M. A. Synthesis and antitumor evaluation of thiophene based azo dyes incorporating pyrazolone moiety. J. Saudi Chem. Soc. 2016; 20, 151–157. https://doi.org/10.1016/j.jscs.2012.06.004 (26. 11. 2019).
15. Gaffer H., Salem M., Marzouk M. Synthesis of 4-hydroxy coumarin dyes and their applications. Pigment Resin Technol. 2016; 45, 320–329. https://doi.org/10.1108/PRT-09-2014-0071 (26. 11. 2019).
16. Abu-Melha S. Synthesis of novel biologically active thiazole dyes and their applications. Pigment Resin Technol. 2019; 48, 375–382. https://doi.org/10.1108/PRT-09-2018-0102 (26. 11. 2019).
17. Swartz T. E., Yin J., Patapoff T. W., Horst T., Skieresz S. M., Leggett G., Morgan C. J., Rahimi K., Marhoul J., Kabakoff B. A spectral method for color quantitation of a protein drug solution. PDA J. Pharm. Sci. Technol. 2016; 70, 361–381. https://doi.org/ 10.5731/pdajpst.2016.006486 (30. 6. 2016).
18. Yin J., Swartz T. E., Zhang J., Patapoff T. W., Chen B., Marhoul J., Shih N., Kabakoff B., Rahimi K. Validation of a spectral method for quantitative measurement of color in protein drug solutions. PDA J. Pharm. Sci. Technol. 2016; 70, 382–391. https://doi.org/10.5731/pdajpst.2016.006494 (30. 6. 2016).
19. Ragab H. S., El-Kader M. A. Optical and thermal studies of starch/methylcellulose blends. Phys. Scr. 2013; 87, 025602. http://dx.doi.org/10.1088/0031-8949/87/02/025602 (26. 11. 2019).
20. Okonogi S., Kaewpinta A., Yotsawimonwat S., Khongkhunthian S. Preparation and characterization of lidocaine rice gel for oral application. Drug Discov. Ther. 2015; 9, 397–403. https://doi.org/10.5582/ddt.2015.01065 (26. 11. 2019).
21. Taylor T., Chouljenko A., Bonilla F., Scott R., Bueno F., Reyes V., Lanclos C., Calumba K. F., Sathivel S. A pectin-gelatin gel containing oral rehydration solution and the release of sodium chloride under simulated gastric conditions. Int. J. Biol. Macromol. 2019; 136, 1112–1118. https://doi.org/10.1016/j.ijbiomac.2019.06.146 (22. 12. 2019).
22. Vukicevic M., Randeberg L. L., Boschker J. E., Tybell T., Tønnesen H. H. Influence of crystal modification on the photoinduced color change in riboflavin. Pharmazie 2014; 69, 117–124.
23. Jutkus R. A., Li N., Taylor L. S., Mauer L. J. Effect of temperature and initial moisture content on the chemical stability and color change of various forms of vitamin C. Int. J. Food Properties 2015; 18, 862–879. https://doi.org/10.1080/10942912.2013.805770 (22. 12. 2019).
24. Sanchez J. O., Ismail Y., Christina B., Mauer L. J. Degradation of L‐ascorbic acid in the amorphous solid state. J. Food Sci. 2018; 83, 670–681. https://doi.org/10.1111/1750-3841.13998 (22. 12. 2019).
25. Teraoka R., Fukami T., Furuishi T., Nagase H., Ueda H., Tode C., Yutani R., Kitagawa S., Sakane T. Improving the solid-state photostability of furosemide by Its cocrystal formation. Chem. Pharm. Bull. 2019; 67, 940–944. https://doi.org/10.1248/cpb.c18-00812 (8. 2. 2020).
26. Sreedhara A., Yin J., Joyce M., Lau K., Wecksler A. T., Deperalta G., Yi L., Wang J., Kabakoff B., Kishore R. S. Effect of ambient light on IgG1 monoclonal antibodies during drug product processing and development. Eur. J. Pharm. Biopharm. 2016; 100, 38–46. https://doi.org/10.1016/j.ejpb.2015.12.003 (22. 12. 2019).
27. Mochizuki K., Takayama K. Prediction of color changes using the time-temperature superposition principle in liquid formulations. Chem. Pharm. Bull. 2014; 62, 1225–1230. https://doi.org/10.1248/cpb.c14-00530 (8. 2. 2020).
28. Mochizuki K., Takayama K. Prediction of color changes in acetaminophen solution using the time–temperature superposition principle. Drug Dev. Ind. Pharm. 2016; 42, 1050–1057. https://doi.org/10.3109/03639045.2015.1107091 (2. 12. 2019).
29. Kharat M., Du Z., Zhang G., Julian D., McClements D. J. Physical and chemical stability of curcumin in aqueous solutions and emulsions: Impact of pH, temperature, and molecular environment. J. Agric. Food Chem. 2017; 65, 1525–1532. https://doi.org/10.1021/acs.jafc.6b04815 (22. 5. 2019).
30. Estanqueiro M., Conceição J., Amaral M. H., Lobo J. M. S. Use of solid dispersions to increase stability of dithranol in topical formulations. Braz. J. Pharm. Sci. 2014; 50, 583–590. http://dx.doi.org/10.1590/S1984-82502014000300018 (6. 12. 2019).
31. Katsura S., Yamada N., Nakashima A., Shiraishi S., Gunji M., Furuishi T., Endo T., Ueda H., Yonemochi E. Investigation of discoloration of furosemide tablets in a light-shielded environment. Chem. Pharm. Bull. 2017; 65, 373–380. https://doi.org/10.1248/cpb.c16-00835 (8. 2. 2020).
32. Fujisawa Y., Takahashi Y., Teraoka R., Kitagawa S. Photostability of risperidone in tablets. KONA Powder Part. J. 2018; 35, 209–215. https://doi.org/10.14356/kona.2018008 (6. 12. 2019).
33. Bjerknes K., Helmizadeh Z., Brustugun J., Smistad G. Physical stability of moisture‐sensitive tablets stored in a canister or as a unit‐dose. J. Pharm. Pract. Res. 2017; 47, 442–448. https://doi.org/10.1002/jppr.1306 (7. 12. 2019).
34. Barling D., Morton D. A., Hapgood, K. Pharmaceutical dry powder blending and scale-up: maintaining equivalent mixing conditions using a coloured tracer powder. Powder Technol. 2015; 270, 461–469. https://doi.org/10.1016/j.powtec.2014.04.069 (22. 12. 2019).
35. Nguyen D., Rasmuson A., Thalberg K., Björn I. N. A study of the redistribution of fines between carriers in adhesive particle mixing using image analysis with coloured tracers. Powder Technol. 2016; 299, 71–76. https://doi.org/10.1016/j.powtec.2016.05.030 (22. 12. 2019).
36. Šibanc R., Luštrik M., Dreu R. Analysis of pellet coating uniformity using a computer scanner. Int. J. Pharm. 2017; 533, 377–382. https://doi.org/10.1016/j.ijpharm.2017.06.016 (15. 12. 2019).
37. Barimani S., Šibanc R., Kleinebudde P. Optimization of a semi-batch tablet coating process for a continuous manufacturing line by design of experiments. Int. J. Pharm. 2018; 539, 95–103. https://doi.org/10.1016/j.ijpharm.2018.01.038 (22. 12. 2019).
38. Murillo M. A., Rodríguez‐Pulido F. J., Heredia F. J., Melgosa M., Pacheco J., Vargas R., Montero E., Gutiérrez D. Color evolution during a coating process of pharmaceutical tablet cores by random spraying. Color Res. Appl. 2019; 44, 160–167. https://doi.org/10.1002/col.22332 (22. 12. 2019).
39. Yoshino H., Yamashita K., Iwao Y., Noguchi S., Itai S. Quantitative appearance inspection for film coated tablets. Chem. Pharm. Bull. 2016; 64, 1226–1229. https://doi.org/10.1248/cpb.c15-01030 (8. 2. 2020).
40. Feng L., Xiaoyu L., Yi C. An efficient detection method for rare colored capsule based on RGB and HSV color space. In: 2014 IEEE International Conference on Granular Computing (GrC). Noboribetsu: IEEE 2014; 175–178. https://doi.org/10.1109/GRC.2014.6982830 (22. 12. 2019).
41. Senthilnathan R., Ranjani R., Nandhini M., Nithya S. A color classification algorithm for vision based pallet inspection applicable in pharmaceutical industries. J. Chem. Pharm. Sci. 2016; 9, 3289–3295. https://pdfs.semanticscholar.org/4cb3/174da5c274b1f38bec0eb63ba67206ca0403.pdf) (20. 12. 2019).
42. Vijayasankaran N., Varma S., Yang Y., Mun M., Arevalo S., Gawlitzek M., Swartz T., Lim A., Li F., Zhang B., Meier S., Kiss R. Effect of cell culture medium components on color of formulated monoclonal antibody drug substance. Biotechnol. Prog. 2013; 29, 1270–1277. https://doi.org/10.1002/btpr.1772 (22. 12. 2019).
43. Derfus G. E., Dizon-Maspat J., Broddrick J. T., Velayo A. C., Toschi J. D., Santuray R. T., Hsu S. K., Winter C. M., Krishnan R., Amanullah A. Red colored IgG4 caused by vitamin B12 from cell culture media combined with disulfide reduction at harvest. MAbs 2014; 6, 679–688. https://doi.org/10.4161/mabs.28257 (22. 12. 2019).
44. Song H., Xu J., Jin M., Huang C., Bongers J., Bai H., Wu W., Ludwig R., Li Z., Tao L., Das T. K. Investigation of color in a fusion protein using advanced analytical techniques: delineating contributions from oxidation products and process related impurities. Pharm. Res. 2016; 33, 932–941. https://doi.org/10.1007/s11095-015-1839-3 (22. 12. 2019).
45. Chaplenko A. A., Monogarova O. V., Oskolok K. V. Using a molecular sensor array with colorimetric detection to identify active ingredients in drug formulations. Pharm. Chem. J. 2019; 53, 347–352. https//doi:10.1007/s11094-019-02004-0 (22. 12. 2019).
46. Monogarova O. V., Chaplenko A. A., Oskolok K. V. Multisensory digital colorimetry to identify and determination of active substances in drugs. Sens. Actuators B: Chem. 2019; 299, 126909. https://doi.org/10.1016/j.snb.2019.126909 (22. 12. 2019).
47. Al Hagbani T., Veronin M. A., Nutan M. T., Nazzal S. Can the surface color of pharmaceutical tablets be used as a unique product identifier? J. Drug Deliv. Sci. Tech. 2017; 37, 141–146. https://doi.org/10.1016/j.jddst.2016.12.010 (22. 12. 2019).
48. Kumpanenko I. V., Roshchin A. V., Ivanova N. A., Bloshenko A. V., Shalynina N. A., Korneeva T. N. Colorimetry: Choice of colorimetric parameters for chromophore concentration measurements. Russ. J. Gen. Chem. 2014; 84, 2295–2304. https://doi.org/10.1134/S1070363214110498 (19. 1. 2020).
49. Shokrollahi A., Ebrahimi F. Simultaneous determination of brilliant green and basic fuchsin by cloud point extraction–scanometry. J. Anal. Chem. 2019; 74, 1019–1026. https://doi.org/10.1134/S1061934819100101 (22. 12. 2019).
50. Vakili H., Nyman J. O., Genina N., Preis M., Sandler N. Application of a colorimetric technique in quality control for printed pediatric orodispersible drug delivery systems containing propranolol hydrochloride. Int. J. Pharm. 2016; 511, 606–618. https://doi.org/10.1016/j.ijpharm.2016.07.032 (22. 12. 2019).
51. Wickström H., Nyman J. O., Indola M., Sundelin H., Kronberg L., Preis M., Rantanen J., Sandler N. Colorimetry as quality control tool for individual inkjet-printed pediatric formulations. AAPS Pharm. Sci. Tech. 2017; 18, 293–302. https://doi.org/10.1208/s12249-016-0620-1 (22. 12. 2019).
52. Alev-Tuzuner B., Beyler-Cigil A., Vezir Kahraman M., Yarat A. PEG-based hydrogel-coated test strip for on-site urea determination. Int. J. Polym. Mater. Polym. Biomater. 2019; 68, 597–606. https://doi.org/10.1080/00914037.2018.1482460 (22. 1. 2020).
53. Ait Errayess S., Idrissi L., Amine A. Smartphone-based colorimetric determination of sulfadiazine and sulfasalazine in pharmaceutical and veterinary formulations. Instr. Sci. Technol. 2018; 46, 656–675. https://doi.org/10.1080/10739149.2018.1443943 (28. 1. 2020).
54. Choodum A., Parabun K., Klawach N., Daeid N. N., Kanatharana P., Wongniramaikul W. Real time quantitative colourimetric test for methamphetamine detection using digital and mobile phone technology. Forensic Sci. Int. 2014; 235, 8–13. https://doi.org/ 0.1016/j.forsciint.2013.11.018 (22. 12. 2019).
55. Kostelnik A., Cegan A., Pohanka M. Acetylcholinesterase inhibitors assay using colorimetric pH sensitive strips and image analysis by a smartphone. Int. J. Anal. Chem. 2017; Article ID 3712384. https://doi.org/10.1155/2017/3712384 (23. 1. 2020).
56. Zou B., Liu Y., Yan X., Huang C. Gold nanoparticles based digital color analysis for quinidine detection. Chin. Sci. Bull. 2013; 58, 2027–2031. https://doi.org/10.1007/s11434-013-5708-3 (24. 1. 2020).
57. Lodha A., Pandya A., Sutariya P. G., Menon S. K. A smart and rapid colorimetric method for the detection of codeine sulphate, using unmodified gold nanoprobe. RSC Adv. 2014; 4, 50443–50448. https://doi.org/10.1039/C4RA06269H (24. 1. 2020).
58. Hemmateenejad B., Dorostkar S., Shakerizadeh-Shirazi F., Shamsipur M. pH-independent optical sensing of heparin based on ionic liquid-capped gold nanoparticles. Analyst 2013; 138, 4830–4837. https://doi.org/10.1039/C3AN36895E (24. 1. 2020).
59. Ping J., He Z., Liu J., Xie X. Smartphone‐based colorimetric chiral recognition of ibuprofen using aptamers‐capped gold nanoparticles. Electrophoresis 2017; 39, 486–495. https://doi.org/10.1002/elps.201700372 (22. 12. 2019).
60. Ansari N., Lodha A., Pandya A., Sutariya P. G., Menon S. K. Lab-on-phone citrate-capped silver nanosensor for lidocaine hydrochloride detection from a biological matrix. Anal. Methods 2015; 7, 9084–9091. https://doi.org/10.1039/C5AY01977J (24. 1. 2020).
61. Jafari M., Tashkhourian J., Absalan G. Chiral recognition of tryptophan enantiomers using chitosan-capped silver nanoparticles: Scanometry and spectrophotometry approaches. Talanta 2018; 178, 870–878. https://doi.org/10.1016/j.talanta.2017.10.005 (22. 12. 2019).
62. Peng J., Ling J., Zhang X. Q., Zhang L. Y., Cao Q. E., Ding Z. T. A rapid, sensitive and selective colorimetric method for detection of ascorbic acid. Sens. Actuators B: Chem. 2015; 221, 708–716. https://doi.org/10.1016/j.snb.2015.07.002 (22. 12. 2019).
63. Manmana Y., Chutvirasakul B., Suntornsuk L., Nuchtavorn N. Cost effective paper-based colorimetric devices for a simple assay of dopamine in pharmaceutical formulations using 3,3´,5,5´-tetramethylbenzidine-silver nitrate as a chromogenic reagent. Pharm. Sci. Asia 2019; 46, 270–277. doi:10.29090/psa.2019.04.018.0037 (26. 1. 2020).
64. Ravazzi C. G., Franco M. D. O. K., Vieira M. C. R., Suarez W. T. Smartphone application for captopril determination in dosage forms and synthetic urine employing digital imaging. Talanta 2018; 189, 339–344. https://doi.org/10.1016/j.talanta.2018.07.015 (22. 12. 2019).
65. Phadungcharoen N., Patrojanasophon P., Opanasopit P., Ngawhirunpat T., Chinsriwongkul A., Rojanarata T. Smartphone-based Ellman’s colourimetric methods for the analysis of d-penicillamine formulation and thiolated polymer. Int. J. Pharm. 2019; 558, 120–127. https://doi.org/10.1016/j.ijpharm.2018.12.078 (22. 12. 2019).
66. Jornet-Martínez N., Samper-Avilés M., Herráez-Hernández, R., Campíns-Falcó P. Modifying the reactivity of copper (II) by its encapsulation into polydimethylsiloxane: A selective sensor for ephedrine-like compounds. Talanta 2019; 196, 300–308. https://doi.org/10.1016/j.talanta.2018.12.054 (22. 12. 2019).
67. Solana-Altabella A., Sánchez-Iranzo M. H., Bueso-Bordils J. I., Lahuerta-Zamora L., Mellado-Romero A. M. Computer vision-based analytical chemistry applied to determining iron in commercial pharmaceutical formulations. Talanta 2018; 188, 349–355. https://doi.org/10.1016/j.talanta.2018.06.008 (22. 12. 2019).
68. da Silva R. S., Borges E. M. Quantitative analysis using a flatbed scanner: aspirin quantification in pharmaceutical tablets. J. Chem. Educ. 2019; 96, 1519–1526. https://doi.org/10.1021/acs.jchemed.8b00620 (31. 1. 2020).
69. Shokrollahi A., Mohammadpour Z., Abbaspour A. Colorimetric determination of free salicylic acid in aspirin and urine by scanometry as a new, reliable, inexpensive and simple method. Pharm. Chem. J. 2017; 51, 324–329. https://doi.org/10.1007/s11094-017-1607-2 (22. 12. 2019).
70. Chaplenko A. A., Monogarova O. V., Oskolok K. V., Chaplenko S. A. Colorimetric and indirect X-ray fluorescence determination of drug substances using chemically modified polyurethane-foam absorbents. Pharm. Chem. J. 2017; 51, 726–730. https://doi.org/10.1007/s11094-017-1682-4 (22. 12. 2019).
71. Oskolok K. V., Monogarova O. V., Chaplenko A. A. Colorimetry and indirect X-ray fluorescence determination of active ingredients in tetracycline hydrochloride drug and injection solution of B12 vitamin using of polyurethane foam sorbents. Iraqi J. Pharm. Sci. 2017; 26, 7–11. https://www.iasj.net/iasj? func=fulltext&aId=135241 (2. 2. 2020).
72. Zrelova L. V., Belyaeva E. I., Marchenko D. Y., Ivanova E. A., Sandzhieva D. A., Dedov A. G. A novel method for the rapid determination of isonicotinic hydrazide in aqueous solutions using reflectance spectrophotometry and colorimetry. J. Anal. Chem. 2018; 73, 236–242. https://doi.org/10.1134/S1061934818030139 (22. 12. 2019).
73. Kumar G. P., Rao K. S. Development of point-of-care paper based strip for the detection of simple antipyretic-analgesic drugs. Indian J. Pharm. Pract. 2019; 12, 225–228. https://dx.doi.org/10.5530/ijopp.12.4.48 (2. 2. 2020).
74. Leng Y., Hu F., Ma C., Du C., Ma L., Xu J., Lin Q., Sang Z., Lu Z. Simple, rapid, sensitive, selective and label-free lincomycin detection by using HAuCl4 and NaOH. RSC Adv. 2019; 9, 28248–28252. https://doi.org/10.1039/C9RA04095A (6. 2. 2020).
75. Mohamed A. A., Mahmoud E. H., Khalil M. M. Development of a selective and sensitive colour reagent for gold and silver ions and its application to desktop scanner analysis. RSC Adv. 2019; 9, 36358–36365. https://doi.org/10.1039/C9RA06840F (3. 2. 2020).
76. Gorbunova M. O., Shevchenko A. V., Apyari V. V., Furletov A. A., Volkov P. A., Garshev A. V., Dmitrienko S. G. Selective determination of chloride ions using silver triangular nanoplates and dynamic gas extraction. Sens. Actuators B: Chem. 2018; 256, 699–705. https://doi.org/10.1016/j.snb.2017.09.212 (22. 12. 2019).
77. Gorbunova M. O., Bayan E. M. A novel paper-based sensor for determination of halogens and halides by dynamic gas extraction. Talanta 2019; 199, 513–521. https://doi.org/10.1016/j.talanta.2019.02.093 (22. 12. 2019).
78. Gorbunova M. O., Baulina A. A., Kulyaginova M. S., Apyari V. V., Furletov A. A., Garshev A. V., Dmitrienko S. G. Determination of iodide based on dynamic gas extraction and colorimetric detection by paper modified with silver triangular nanoplates. Microchem. J. 2019; 145, 729–736. https://doi.org/10.1016/j.microc.2018.11.046 (22. 12. 2019).
79. Gorbunova M. O., Baulina A. A., Kulyaginova M. S., Apyari V. V., Furletov A. A., Volkov P. A., Bochenkov V. E., Starukhin A. S., Dmitrienko S. G. Dynamic gas extraction of iodine in combination with a silver triangular nanoplate-modified paper strip for colorimetric determination of iodine and of iodine-interacting compounds. Microchim. Acta 2019; 186, 188. https://doi.org/10.1007/s00604-019-3300-5 (22. 12. 2019).
80. Chaplenko A. A., Monogarova O. V., Oskolok K. V Spectroscopic and colorimetric determination of meloxicam, lornoxicam, tenoxicam in drugs. IJPBA 2018; 9, 31–35. Available Online at www.ijpba.info (8. 2. 2020).
81. Bridgeman D., Corral J., Quach A., Xian X., Forzani E. Colorimetric humidity sensor based on liquid composite materials for the monitoring of food and pharmaceuticals. Langmuir 2014; 30, 10785–10791. https://doi.org/10.1021/la502593g (8. 2. 2020).
82. Donato N., Aloisio D., Leonardi S. G., Neri G. Ink-jet printed colorimetric sensor for the determination of Fe (II). IEEE Sens. J. 2015; 15, 3196–3200. https://doi.org/10.1109/JSEN.2014.2379216 (22. 12. 2019).
83. Buroni F. E., Lodola L., Persico M. G., Aprile C. A sensitive, rapid and inexpensive method to assess aluminium (III) ions in technetium eluates. Nucl. Med. Commun. 2014; 35, 777–780. https://doi.org/10.1097/MNM.0000000000000108 (22. 12. 2019).
84. Fakayode O. J., Songca S. P., Oluwafemi O. S. Application of iron (III) meso-tetrakis (4-hydroxyphenyl) porphyrin-methylene blue strips for the detection and quantification of H2O2 in aqueous and pharmaceutical fluids. MRS Commun. 2019; 9, 398–405. htps://doi.org/10.1557/mrc.2019.14 (19. 12. 2019).
85. Monogarova O. V., Oskolok K. V., Apyari V. V. Colorimetry in chemical analysis. J. Anal. Chem. 2018; 73, 1076–1084. https://doi.org/10.1134/S1061934818110060 (22. 12. 2019).
86. Capitán-Vallvey L. F., Lopez-Ruiz N., Martinez-Olmos A., Erenas M. M., Palma A. J. Recent developments in computer vision-based analytical chemistry: A tutorial review. Anal. Chim. Acta 2015; 899, 23–56. https://doi.org/10.1016/j.aca.2015.10.009 (22. 12. 2019).
Štítky
Farmacie Farmakologie
Článek Nové knihy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2020 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Rhabdomyolýza po chybném užívání rosuvastatinu – kazuistika
- Nové knihy
- Pokroky ve využití instrumentálního měření barevnosti ve vývoji, výrobě a v kontrole jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek III*
- Hodnotenie adherencie k liečbe u pacientov trpiacich diabetes mellitus
- Vliv přípravku «Saprogel» na process hojetí ran u potkanů s modelem rány v plné tloušťce
- Analýza minimalizace nákladů α2b-interferoné suplementace v komplexní farmacoterapii rotavirové infekce u novorozenců
- Formulace a technologický vývoj vaginálních globulí s probiotickou aktivitou
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnotenie adherencie k liečbe u pacientov trpiacich diabetes mellitus
- Rhabdomyolýza po chybném užívání rosuvastatinu – kazuistika
- Formulace a technologický vývoj vaginálních globulí s probiotickou aktivitou
- Pokroky ve využití instrumentálního měření barevnosti ve vývoji, výrobě a v kontrole jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek III*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



