-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBeta-blokátory
Beta-blockers
Beta-adrenergic blockers rank among the principal drugs in the treatment of cardiovascular diseases. Their common mechanism of action is based on the ß-adrenergic receptor blockade. However, differences in pharmacokinetic and pharmacodynamic properties exist between the individual agents in the beta-blocker class, and these differences may be of clinical relevance. In addition, responses to beta-blockers are variable among patients. Genetic plymorphism in drug-metabolizing enzymes, including cytochrome P450 2D6, has been demonstrated to contribute to the variability of several beta-blockers. The understanding of beta-blocker properties and their differences is thus important for their proper clinical use.
Key words:
beta-blockers – pharmacokinetics – pharmacodynamics – P450 2D6
Autoři: J. Ďuricová; M. Grundmann
Působiště autorů: Fakulta zdravotnických studií Ostravské univerzity, FN Ostrava, Ústav klinické farmakologie
Vyšlo v časopise: Čes. slov. Farm., 2009; 58, 60-66
Kategorie: Přehledy a odborná sdělení
Souhrn
Beta-blokátory patria medzi základné liečivá v terapii kardiovaskulárnych ochorení. Ich spoločný mechanizmus účinku je založený na blokáde ß-adrenergných receptorov. Avšak v rámci skupiny beta-blokátorov existujú medzi jednotlivými látkami farmakokinetické a farmakodynamické rozdiely, ktoré sú klinicky relevantné. Naviac odpoveď na beta-blokátor sa môže medzi pacientmi líšiť. Na tom má určitý podiel genetický polymorfizmus biotransformačných enzýmov cytochrómu P450 (ďalej len P450), vrátane P450 2D6, ktorým sa biotransformuje niekoľko bežne užívaných beta-blokátorov. Poznanie vlastností a teda odlišností medzi beta-blokátormi je nevyhnutné pre ich správne klinické využitie.
Kľúčové slová:
beta-blokátory – farmakokinetika – farmakodynamika – P450 2D6Úvod
Beta-blokátory zohrávajú významnú úlohu v liečbe kardiovaskulárnych ochorení. Využívajú sa pre svoj antianginózny, antiarytmický a antihypertenzívny účinok. Časom získali svoje nezastupiteľné miesto i v liečbe chronického srdečného zlyhávania. Ich účinok je založený na kompetitívnom antagonizme β-adrenergných receptorov. Nadmerná aktivácia adrenergného nervového systému totiž prispieva k patofyziológii kardiovaskulárnych ochorení.
Väčšina účinkov vyvolaných beta-blokátormi je charakteristická a spoločná pre celú skupinu. Avšak v rámci skupiny možno pozorovať určité farmakokinetické a farmakodynamické rozdiely. Tieto rozdiely sú dané rozdielnou selektivitou beta-blokátorov voči adrenergným receptorom, na účinku niektorých z nich sa podieľajú i ďalšie mechanizmy. Lipofilita či hydrofilita a rozdielna farmakokinetika majú tiež svoj podiel na odlišnosti účinku beta-blokátorov. Znalosť týchto rozdielov umožňuje predvídať účinok konkrétneho beta blokátora a pomáha vo výbere optimálnej látky pre konkrétnu situáciu a pacienta.
V poslednej dobe je často diskutovaná otázka vplyvu genetického polymorfizmu na účinok liečiv. Jednou z oblastí štúdia genetického polymorfizmu sú biotransformačné enzýmy superrodiny cytochrómu P450 (ďalej len P450) a najviac študovaným enzýmom z tejto skupiny je P450 2D6. Enzým P450 2D6 zohráva významnú úlohu v biotransformácii niektorých beta-blokátorov. Rozdielna aktivita P450 2D6 vedie k odlišnostiam vo farmakokinetike beta-blokátorov, ktoré sa môžu prejaviť rozdielnou odpoveďou pacienta na daný liek.
Cieľom tohto prehľadového článku je podať obecné informácie o beta-blokátoroch, o ich účinku, odlišnostiach v rámci jednotlivých skupín a pozrieť sa na význam genetického polymorfizmu P450 2D6 na účinok beta blokátorov.
Mechanizmus účinku beta-blokátorov
Hlavným mechanizmom účinku beta-blokátorov je kompetitívna a reverzibilná blokáda β-adrenergných receptorov. Existujú 3 typy β-receptorov, β1, β2 a β3 receptory. Väčšina liečebných účinkov je daná blokádou β1 receptorov, naopak väčší počet nežiadúcich účinkov je daný blokádou β2-receptorov. β1-receptory sa vyskytujú postsynapticky predovšetkým v srdci, ďalej potom v GIT, ľadvinách a v tukovom tkanive, β2-receptory sú umiestnené postsynapticky predovšetkým v bronchiálnom trakte, cievach a pankrease, taktiež v menšej miere i v srdci. β3-receptory sú prítomné v tukovom tkanive. Beta-blokátory sa terapeuticky využívajú hlavne pre svoj účinok na kardiovaskulárny systém 1, 2).
Antianginózny účinok
Zabránením účinku katecholamínov (noradrenalín a adrenalín) na srdce, beta-blokátory znižujú srdečnú frekvenciu (účinok negatívne chronotropný) a srdečnú kontraktilitu (účinok negatívne inotropný), čo následne vedie k zníženej spotrebe kyslíka myokardom. Upravujú tak teda nepomer medzi potrebou a dodávkou kyslíka, ktorý sa vyskytuje u ischémie myokardu. Zvlášť významné je zníženie srdečnej frekvencie a kontraktility pri aktivácii sympatického nervového systému (napr. pri námahe alebo strese), účinok na frekvenciu a kontraktilitu je v kľude menší. Okrem toho, predĺžením diastoly znížením srdečnej frekvencie dochádza k zvýšeniu prekrvenia myokardu 3).
Antiarytmický účinok
Beta-blokátory znižujú mieru spontánnej depolarizácie ektopických pacemakerov,spomaľujú prevod v sinoatriálnom (SA) a atrioventrikulárnom (AV) uzle a predlžujú refraktornú fázu v AV uzle (účinok negatívne dromotropný), upravujú barorecepčnú senzitivitu.
Antihypertenzívny účinok
Na antihypertenzívnom účinku beta-blokátorov sa podieľa niekoľko mechanizmov. Patrí tam zníženie tvorby renínu, negatívne inotropný a chronotropný účinok. Dlhodobé užívanie beta-blokátorov vedie nejasným mechanizmom ku zníženiu periférnej vaskulárnej rezistencie.
Priaznivé účinky u chronického srdečného zlyhávania
Beta-blokátory zmenšujú objemové parametre a zvyšujú ejekčnú frakciu ľavej komory. Môžu pozitívne ovplyvniť i remodeláciu komory 4). Na priaznivom účinku sa ďalej podieľa zníženie napätia sympatoadrenálneho systému, zníženie srdečnej frekvencie, predĺženie diastolickej periódy a účinok antiarytmický.
Ďalšie účinky
Beta-blokátory inhibujú agregáciu doštičiek, stabilizujú ateromatózny plát a zabraňujú jeho ruptúre, niektoré beta-blokátory majú antioxidačné účinky a zabraňujú proliferácii hladkej svaloviny ciev.
Nežiadúce účinky beta-blokátorov
Kardiovaskulárne
Blokáda β1-receptorov v srdci môže vyústiť v bradykardiu a AV blokádu. Blokáda β2-receptorov v cievach môže spôsobovať chladné končatiny a zhoršiť symptómy u pacienta s periférnym vaskulárnym ochorením.
Metabolické
Blokáda β2-receptorov nepriaznivo ovplyvňuje lipidový metabolizmus (zvýšenie koncentrácie triglyceridov a zníženie koncentrácie HDL cholesterolu, možné tiež zvýšenie LDL cholesterolu), zhoršuje glukózovú toleranciu a môže maskovať príznaky hypoglykémie (tremor, tachykardia atď.) 5, 6).
Pľúcne
Beta-blokátory môžu vyvolať bronchokonstrikciu u pacientov s astma bronchiale a u pacientov s chronickou obstrukčnou bronchopulmonálnou chorobou 7).
Centrálne
Častejšie sa vyskytujú pri užívaní lipofilných beta-blokátorov, ide o únavu, bolesť hlavy, poruchy spánku, živé sny, depresiu, závrate.
Sexuálny poruchy
U niektorých pacientov môžu beta-blokátory spôsobovať stratu libida a erektilné dysfunkcie.
Náhle vysadenie beta-blokátorov
Môže vyústiť v rebound fenomén, k tomuto fenoménu dochádza upreguláciou β-receptorov pri dlhodobom užívaní beta-blokátorov.
Kontraindikácie
Medzi kontraindikácie beta-blokátorov patrí hypotenzia, bradykardia, SA a AV blokáda II. a III. stupňa, akútne srdečné zlyhanie a astma bronchiale. Chronická obstrukčná bronchopulmonálna choroba, periférne vaskulárne ochorenie, metabolický syndróm a porušená glukózová tolerancia patria medzi relatívne kontraindikácie, kedy vysoko rizikoví pacienti môžu profitovať z terapie beta-blokátormi 1, 2).
Klasifikácia beta-blokátorov
Jedným z dôležitých rozdielov medzi beta-blokátormi je ich selektivita voči β1 a β2-receptorom a vazodilatačný účinok (tab. 1). Môžeme ich teda rozdeliť na:
- neselektívne (blokujú β1 i β2-receptory),
- elektívne (majú vyššiu afinitu k β1 než k β2-receptorom),
- beta-blokátory s vazodilatačným účinkom.
Tab. 1. Klasifikácia beta-blokátorov 
Selektivita je však relatívna a na dávke závislá a stráca sa pri užití vyšších dávok. Selektivita k β1-receptorom versus k β2-receptorom študovaná na membránach ľudského tkaniva myokardu bola najvyššia u nebivololu (321×), nasledovaná bisoprololom (103×), betaxololom (93×), metoprololom (74×) a celiprololom (69×) 8). Pretože selektívne β1-blokátory majú menší inhibičný účinok na β2-receptory, je u nich nižšie riziko periférnej vazokonstrikcie a bronchokonstrikcie 7) a v menšej miere zasahujú do metabolizmu sacharidov a lipidov 9). Vazodilatačne pôsobiace beta-blokátory, nazývané tiež beta-blokátory tretej generácie, boli pôvodne vyvinuté ako antihypertenzívne látky. Vazodilatačný účinok je daný buď blokádou adrenergných α1-receptorov (karvedilol) alebo uvoľnením vazodilatačne pôsobiaceho oxidu dusnatého (NO) z endoteliálnych buniek (nebivolol) 7). Karvedilol sa vyznačuje naviac antioxidačným účinkom. Určité beta-blokátory vykazujú čiastočnú agonistickú aktivitu po naviazaní na receptor, takzvaný ISA účinok (vnútorný sympatomimetický účinok). Patria tam acebutolol, celiprolol a bopindolol. Beta-blokátory s ISA účinkom spôsobujú nižšiu kardiálnu depresiu, menej ovplyvňujú bronchy a periférny vaskulárny systém. Majú taktiež menší účinok na metabolizmus sacharidov a lipidov. Jednou z nevýhod tejto skupiny je, že u nich chýba alebo je dokonca znížený benefit zo zníženej mortality u pacientov po infarkte myokardu či so srdečným zlyhaním na rozdiel od beta-blokátorov bez ISA účinku 1).
Farmakokinetické vlastnosti beta-blokátorov
Beta-blokátory sa významne líšia vo farmakokinetických vlastnostiach, ako sú absorpcia, biodostupnosť, biotransformácia, väzba na plazmatické bielkoviny, distribučný objem, rozpustnosť v tukoch, eliminačný poločas (tab. 2).
Tab. 2. Farmakokinetické vlastnosti beta-blokátorov 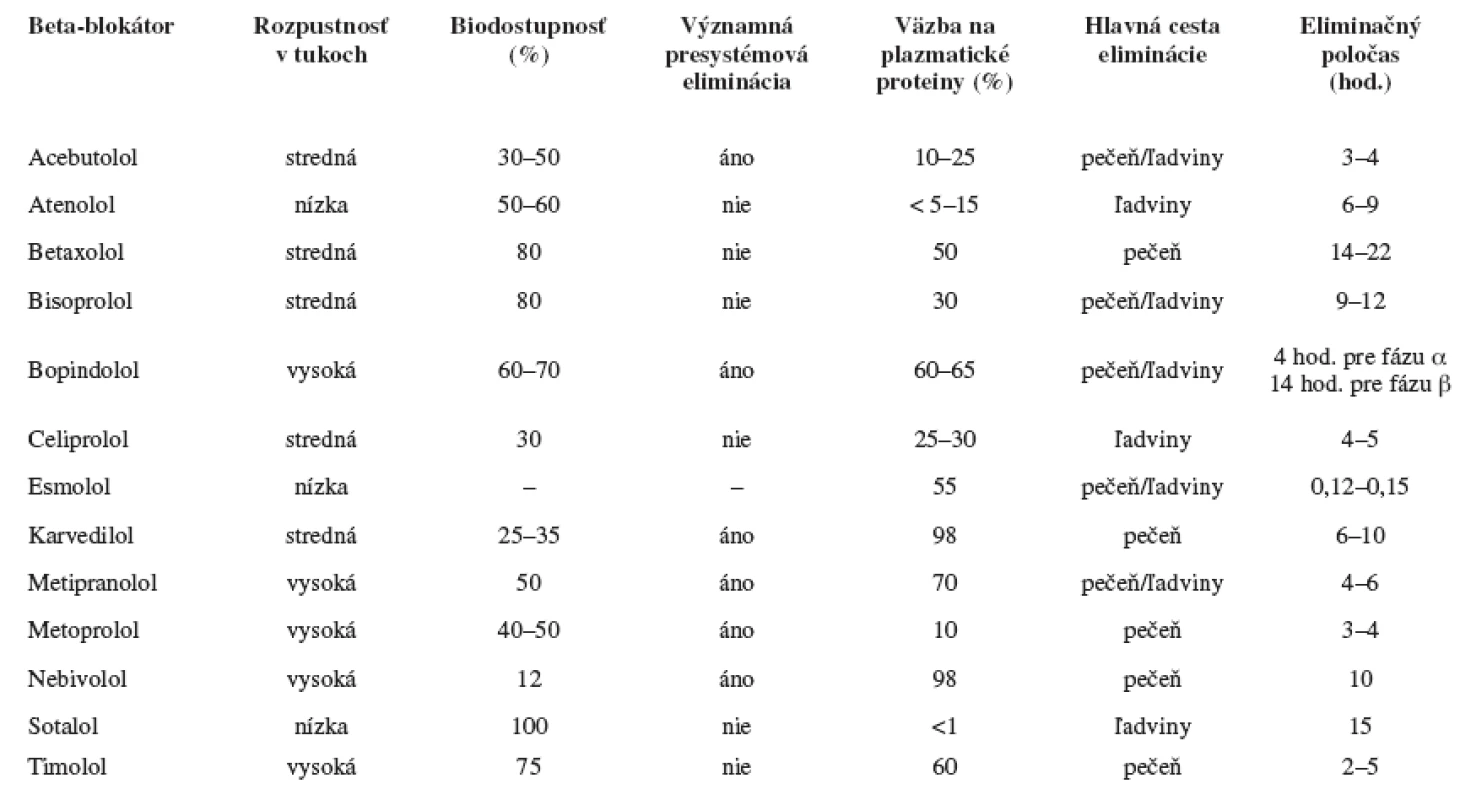
Lipofilné beta-blokátory – (metoprolol, nebivolol, timolol, karvedilol) sú z gastrointestinálneho traktu rýchlo a kompletne absorbované. Sú extenzívne biotransformované pri prvom prechode črevom a pečeňou, majú vysokú presystémovú elimináciu a tým u nich dochádza k variabilnej biodostupnosi. Ľahko prechádzajú do centrálneho nervového systému, čo môže prispievať k vyššiemu výskytu centrálnych nežiadúcich účinkov.
Hydrofilné beta-blokátory – (atenolol, sotalol) sú z gastroinestinálneho traktu absorbované nekompletne a sú prevážne vylúčené nezmenené ľadvinami. Majú menej variabilnú biodostupnosť 11-13).
Jeden z významných enzymatických biotransformačných systémov je cytochróm P450. Enzýmy P450 vykazujú genetický polymorfizmus, sú zodpovedné za rozdielnu biotransformačnú aktivitu následkom čoho dochádza k zmene farmakokinetických parametrov látky a možnému ovplyvneniu jej účinku. Z hľadiska genetického polymorfizmu je najviac preštudovaný enzým P450 2D6. Z beta-blokátorov sa P450 2D6 podieľa vo väčšej či menšej miere na biotransformácii metoprololu, karvedilolu, nebivololu, timololu, betaxololu.
Stereošpecificita – väčšina klinicky užívaných beta blokátorov sa nachádza vo forme racemickej zmesi. Jednotlivé enantioméry sa môžu líšiť vo väzbe na albumín a glykoprotein v plazme, môže u nich dochádzať k odlišnému metabolizmu v pečeni, čo nakoniec môže viesť k ich odlišným hladinám v krvi. Takisto stereoselektivita sa môže podieľať na odlišnom účinku enantiomérov na ß-blokáde, kde jeden enantiomér je účinnejší než druhý, prípadne majú oba enantioméry úplne odlišné účinky 14).
Klinický účinok beta-blokátorov
Ischemická choroba srdečná, akútny infarkt myokardu a stav po infarkte myokardu
Účinnosť beta-blokátorov v terapii ischemickej choroby srdečnej je preukázaná mnohými klinickými štúdiami. Beta-blokátory znižujú spotrebu kyslíka znížením srdečnej frekvencie a kontraktility. Zvyšujú prekrvenie ischemickej oblasti predĺžením diastoly. Sú účinné v terapii stabilnej angíny pectoris, kde zvyšujú toleranciu na záťaž, znižujú počet záchvatov a potrebu užívania krátkodobých nitrátov 15). Výsledky meta-analýzy preukázali 13% pokles rizika do progresie akútneho infarktu myokardu u pacientov s akútnym koronárnym syndrómom bez elevácie ST úsekov na EKG užívajúcich beta-blokátory. Terapia beta-blokátormi je u týchto pacientov pri neprítomnosti kontraindikácií doporučená 16, 17). Prínos dlhodobého užívania beta-blokátorov u pacientov po infarkte myokardu s eleváciou ST-segmentu je preukázaná niekoľkými štúdiami a meta-analýzami. Beta-blokátory znižujú kardiálnu mortalitu, náhlu srdečnú smrť a opätovný výskyt infarktu myokardu o 20–25 %. V akútnej fáze infarktu myokardu je priaznivý účinok beta-blokátorov najviac pozorovateľný v prvých dvoch dňoch liečby. Znižujú výskyt komorových arytmií, srdečnej zástavy a riziko srdečnej ruptúry 18, 19).
Chronické srdečné zlyhávanie
Priaznivé účinky pozorované pri terapii chronického srdečného zlyhávania beta-blokátormi, zdá sa potvrdzujú úlohu aktivácie adrenergného systému na srdečnom zlyhávaní a jeho škodlivé účinky 20). Liečba beta-blokátormi má za následok zlepšenie funkcie komory, znižuje počet hospitalizácií a o niečo neskôr (za 4–12 mesiacov terapie) dochádza ku zvratu srdečnej remodelácie. Tieto na čase závislé účinky beta-blokátorov sú spoločné pre celú skupinu. Znížená mortalita u pacientov s chronickým srdečným zlyhaním bola preukázaná v dvojite slepých multicentrických štúdiách u karvedilolu, bisoprololu, metoprololu sukcinátu a nebivololu. Beta-blokátory sú doporučené všetkým symptomatickým pacientom so srdečným zlyhaním (NYHA II–IV) v stabilizovanom stave, ischemickej alebo neischemickej etiológie a zníženou ejekčnou frakciou, pri neprítomnosti kontraindikácií 4, 10, 21, 22).
Hypertenzia
Postavenie beta-blokátorov v rámci základnej skupiny antihypertenzív sa poslednú dobu oslabuje. Zásluhu na tom nepochybne majú i nedávno publikované rozsiahle štúdie, v ktorých mali beta-blokátory nižší účinok v znížení rizika cievnych mozgových príhod 23, 24). Beta--blokátory však naďalej zostávajú liekom prvej voľby pri hypertenzii sprevádzanej ischemickou chorobou srdečnou, srdečným zlyhaním, angínou pectoris, stavmi po infarkte myokardu a u tachyarytmií. Pre dosiahnutie lepšieho antihypertenzívneho účinku je výhodné ich použitie v kombinačnej terapii 25). Vzhľadom k ich potenciálnym nežiadúcim metabolickým účinkom sa počet ich vhodných indikácií znížil 26). Na antihypertenzívnom účinku beta-blokátorov sa podieľa niekoľko mechanizmov ako je zníženie srdečnej frekvencie, zníženie kontraktility a plazmatickej hladiny renínu.
Arytmie
Beta-blokátory znižujú sínusový rytmus, automaciu a spomaľujú prevod AV uzlom. Sú účinné u supraventrikulárných tachykardií, fibrilácii a flutteru siení a taktiež v kontrole komorových arytmií. Sú účinné v prevencii vzniku arytmií vedúcich k náhlej srdečnej smrti u akútnej a chronickej ischemickej choroby srdečnej, u chronického srdečného zlyhávania a u kardiomyopatií 27, 28).
Genetický polymorfizmus P450 2D6 a jeho vzťah k beta-blokátorom
Genetický polymorfizmus biotransformačných enzýmov je jednou z príčin variability farmakokinetických vlastností liečiv, následkom ktorej môže dôjsť k zmene odpovede pacienta na liek. Významnú úlohu v biotransformácii liečiv zohráva enzymatický systém cytochrómu P450. U človeka bolo popísaných doteraz 21 rodín enzýmov cytochrómu P450, spomedzi nich rodiny 1, 2 a 3 tvoria 70 % celkového obsahu v pečeni a podieľajú sa v 94 % na biotransformácii liečiv v pečeni 29). Z hľadiska genetického polymorfizmu je najviac preštudovaným enzýmom z rodiny cytochrómu P450 enzým P450 2D6. Napriek tomu, že je v pečeni kvantitatívne málo zastúpený (4 %), P450 2D6 biotransformuje približne 25 % klinicky užívaných liečiv, vrátane niektorých beta-blokátorov 30). P450 2D6 je vysoko polymorfický, doteraz bolo objavených viac než 100 variantných aliel. Súčasný prehľad genetických variant je na http://cypalleles.ki.se. Enzýmový defekt je v populácii prenášaný autozomálne recesívne, prejavy sú preto najvýraznejšie u homozygotov pre defektný gén. Na základe stupňa aktivity enzýmov cytochrómu P450 možno rozdeliť populáciu do 4 skupín: pomalí metabolizátori (PMs), intermediárni metabolizátori (IMs), extenzívni metabolizátori (EMs) a ultrarýchli metabolizátori (UMs). PMs postrádajú funkčný enzým, sú tak vystavení vyššiemu riziku toxicity následkom vysokých hladín nezmetabolizovaného liečiva. IMs majú čiastočne zachovanú metabolickú aktivitu, ktorá však nedosahuje aktivity EMs. EMs tvoria väčšinu populácie, ide o jedincov s normálnou metabolickou aktivitou. Najvyššiu metabolickú aktivitu vykazujú UMs. V dôsledku zrýchleného metabolizmu môžu vyžadovať vyššie dávky liečiva, aby dosiahli terapeutického účinku 31). Zastúpenie jednotlivých skupín sa medzi etnikami líši. V európskej populácii sa vyskytuje okolo 6–10 % PMs a 1–7 % UMs 32).
Vplyv P450 2D6 na jednotlivé beta-blokátory
Z beta-blokátorov sa enzýmom P450 2D6 biotransformujú metoprolol, karvedilol, nebivolol, timolol a betaxolol. Podiel tohoto enzýmu na biotransformácii jednotlivých beta-blokátorov je rôzne zastúpený. Najviac závislý na biotransformačnej aktivite P450 2D6 spomedzi beta-blokátorov je metoprolol.
Timolol
Timolol je neselektívny beta-blokátor, ktorý sa u nás používa v lokálnej terapii glaukomu. Uvádza sa však, že až 80 % lokálne aplikovaného timololu je odvádzaný cez nazolakrimálny kanál a je absorbovaný do systémového obehu s výskytom celkových účinkov. Na biotransformácii timololu sa podieľa predovšetkým P450 2D6 (asi z 90 %), s malým podielom P450 2C19 33). Biotransformáciou vznikajú neaktívne metabolity, ktoré sú následne vylúčené ľadvinami. V dvoch prácach (v jednej na dobrovoľníkoch, v druhej na pacientoch s hypertenziou) bol sledovaný vzťah medzi P450 2D6 fenotypom, stanoveným použitím debrisochinu ako substrátovej látky a metabolizmom jednorázovo per orálne užitého timololu. V obidvoch prácach bola potvrdená významná korelácia medzi biotransformačnou aktivitou P450 2D6 (P450 2D6 fenotypom) a biodegradáciou timololu. PMs mali významne vyššie hodnoty AUC a priemerné plazmatické koncentrácie než EMs. Stupeň β-blokády za 24 hodin po užití timololu (meraný záťažovým testom) bol významne vyšší u PMs než EMs (P < 0,01) 34, 35). Významný vplyv genetického polymorfizmu P450 2D6 na farmakokinetiku a farmakodynamiku timololu bol pozorovaný i pri lokálnom užití timololu vo forme očných prípravkov. PMs mali vyššie maximálne plazmatické koncentrácie timololu, dlhší eliminačný poločas a vyššiu AUC v porovnaní s IMs, EMs a UMs. Medzi poslednými troma metabolickými skupinami neboli rozdiely pozorované. Tieto rozdiely však záviseli na použitom prípravku, boli významné pri užití vodného roztoku timololu, naopak neboli pozorované pri užití hydrogelu. Pri užití vodného roztoku timololu bol pozorovaný trend v odlišnosti vzostupu srdečnej frekvencie pri záťažovom teste medzi PMs a ostatnými metabolickými skupinami 36).
Karvedilol
Karvedilol je neselektívny beta-blokátor s vazodilatačným účinkom v dôsledku blokády α1-receptoru. Klinicky užívaný karvedilol je racemát, za β-blokujúci účinok je zodpovedný S(-)-enantiomér, na α1-blokáde sa podieľajú oba enantioméry rovnakou mierou. Per orálne podaný karvedilol podlieha významnej stereoselektívnej presystémovej eliminácii, ktorá je závislá na biotransformačnej aktivite P450 2D6. Enzým P450 2D6 preferenčne biotransformuje R-karvedilol, ktorý je zodpovedný len za α1-blokádu 37, 38). V práci Honda a kolektív bol sledovaný polymorfizmus P450 2D6 na stereoselektívnu biotransformáciu karvedilolu u zdravých dobrovoľníkov po jednorázovom užití karvedilolu. Orálna clearance a distribučný objem obidvoch enantiomérov boli signifikantne nižšie u jedincov majúcich aspoň jednu alelu so zníženou funkciou (P450 2D6*10 alela) v porovnaní s nositeľmi alely s normálnou funkciou (P450 2D6*1 a *2 alela), výraznejšia zmena v obidvoch farmakokinetických parametroch bola pozorovaná s R karvedilolom 39). Vplyv polymorfizmu P450 2D6 na farmakokinetiku karvedilolu bol potvrdený i v ďalšej štúdii, kde clearance u IMs bola o 39 % nižšia 40). Práca Graffa a kolektív sledovala účinok flouxetinu (silný inhibítor aktivity P450 2D6) na farmakokinetiku a účinok karvedilolu u stabilných pacientov s chronickým srdečným zlyhaním na dlhodobej terapii karvedilolom. Podanie fluoxetinu malo za následok stereošpecifickú inhibíciu biotransformácie karvedilolu, k inhibícii biotransformácie R-karvedilolu došlo vo väčšej miere v porovnaní s S-karvedilolom. Vyššia koncentrácia R karvedilolu u jedincov so zníženou aktivitou enzýmu P450 2D6 predpokladá väčšiu blokádu α1-receptoru, a tým aj väčšiu vazodilatáciu. Avšak neboli pozorované žiadne rozdiely vo výskyte nežiadúcich účinkov, v hodnotách krvného tlaku a srdečnej frekvencie medzi skupinou pacientov s a bez flouxetinu 41).
Nebivolol
Nebivolol je lipofilný vysoko selektívny beta-blokátor s vazodilatačným účinkom sprostredkovaným prostredníctvom uvoľnenia vazodilatačne pôsobiaceho NO z endotelu ciev. Nebivolol je extenzívne biotransformovaný na aktívne metabolity. Podlieha významne presystémovej eliminácii prostredníctvom enzýmu P450 2D6 8). Klinicky užívaný nebivolol je racemická zmes D a L-nebivololu. D-nebivolu je prisudzovaný hlavný podiel na β-blokáde, L-nebivololu je naopak prisudzovaný určitý podiel na vazodilatačnom účinku. Štúdia na hypertenzivných pacientoch preukázala 10 - a 15-násobne vyššie priemerné „trough“ koncentrácie v ustálenom stave u PMs v porovnaní s EMs. Avšak napriek výrazným rozdielom v plazmatických hladinách, pokles krvného tlaku a výskyt nežiadúcich účinkov sa medzi skupinou PMs a EMs nelíšil. Podobný účinok nebivololu medzi metabolickými skupinami môže byť vysvetlený prítomnosťou aktívnych metabolitov nebivololu, ktoré sa zdajú byť ekvipotentné 42).
Betaxolol
Betaxolol je selektivný beta-blokátor. Nepodlieha presystémovej eliminácii, má preto pomerne vysokú biodostupnosť. Hlavná cesta vylučovania je však prostredníctvom biodegradácie v pečeni na neaktívne metabolity 13, 43). Zdá sa, že P450 2D6 zohráva určitú úlohu v biotransformácii betaxololu, podieľa sa na tvorbe menej zastúpeného metabolitu hydroxybetaxololu 44). Zateyshchikov vo svojej práci sledoval vzťah medzi klinickou odpoveďou betaxololu u hypertenzívnych pacientov a polymorfizmom P450 2D6. Popísali významnú asociáciu medzi polymorfizmom P450 2D6 a účinkom betaxololu. Pokles kľudovej srdečnej frekvencie bol významne väčší u pacientov s detekovanou mutáciou v géne pre P450 2D6 (nositelia Ser/Pro genotypu). Nižšia srdečná frekvencia a diastolický tlak pri záťažovom teste boli taktiež pozorované u tejto skupiny pacientov. Pokles priemerného denného systolického tlaku počas 24-hodinového ambulantného monitorovania krvného tlaku bol výraznejší u pacientov so Ser/Pro genotypom 45).
Metoprolol
Metoprolol je β1-selektivný lipofilný beta-blokátor, ktorý podlieha v pečeni výraznej presystémovej eliminácii. Biotransformuje sa 3 cestami: O-demetyláciou s následnou oxidáciou, oxidatívnou deamináciou a alifatickou hydroxyláciou. Metabolity majú 1/10 aktivity materskej látky, ich účinok na β-blokáde je však klinicky nevýznamný 46). Alifatická hydroxylácia a sčasti O demetylácia prebiehajú prostredníctvom P450 2D6. Metoprolol sa používa ako substrátová látka pre stanovenie aktivity enzýmu P450 2D6, tvorba metabolitu α hydroxymetoprololu sa totiž zdá byť exkluzívne sprostredkovaná práve týmto enzýmom 47). Klinicky užívaný metoprolol je vo forme racemickej zmesi. Enantioméry majú odlišnú afinitu k β1-receptorom, za blokádu β1-receptorov je zodpovedný hlavne S-metoprolol. Odlišnosti medzi enantiomérmi sa nachádzajú i v biotransformácii s rýchlejšou elimináciou R-metoprololu u EMs, čo má za následok vyššie plazmatické hladiny aktívnejšieho S-metoprololu 48). Medzi jednotlivými metabolickými skupinami P450 2D6 možno pozorovať výrazné rozdiely v hladinách a vo farmakokinetických parametroch metoprololu 49, 50). S genotypom sa mení i preferencia metabolizmu enantiomérov, u PMs tak dochádza spomalením biotransformácie k vyrovnaniu koncentrácií R - a S-metoprololu, naopak u UMs sa podiel aktívnejšieho S-metoprololu ešte zvyšuje 51). Zmeny farmakokinetiky metoprololu medzi metabolickými skupinami majú dopad i na zmenu farmakodynamiky. Avšak odlišnosťou v preferencii biotransformácie S - a R-metoprololu u PMs a UMs v porovnaní s jedincami s normálnou biotransformačnou aktivitou nie sú farmakodynamické zmeny úplne odrazom farmakokinetických. U PMs v porovnaní s EMs bol pozorovaný významne výraznejší pokles námahou-indukovanej srdečnej frekvencie, ktorá je dobrým ukazovateľom β1-blokády. PMs mali taktiež nižšiu i kľudovú srdečnú frekvenciu 52–54). Vyššie plazmatické koncentrácie u PMs viedli k predpokladu, že PMs môžu byť vystavený vyššiemu riziku nežiadúcich účinkov v porovnaní s EMs. Wutke a kol. pozorovali 5-násobne vyššie riziko výskytu nežiadúcich účinkov u PMs 55). Iní autori však tento predpoklad nepotvrdili 56, 57).
Záver
Beta-blokátory majú svoje nezastupiteľné miesto v terapii kardiovaskulárných ochorení. Mnohé účinky beta-blokátorov sú podložené štúdiami, v ktorých boli preukázané priaznivé účinky v oplyvnení mortality pacientov. Aj keď základný mechanizmus účinku je spoločný pre celú skupinu, možno pri ich podrobnejšom preskúmaní nájsť výrazné rozdiely medzi jednotlivými zástupcami. Jednak sú to rozdiely v základných farmakokinetických vlastnostiach beta-blokátorov, tak i rozdiely vo farmakodynamických vlastnostiach, ktoré majú rozhodujúci vplyv na výsledný účinok danej látky. Poznanie vlastností danej látky je nevyhnutné pre správnu voľbu správneho beta-blokátora pre konkrétneho pacienta. Trendom posledných rokov je individualizácia terapie pre každého pacienta. Jedným z nástrojov je skúmanie príčin veľkej variability terapie medzi pacientmi, na ktorých sa významne podieľajú zmeny v aktivite biotransformačných enzýmov dané buď genetickými či negenetickými vplyvmi. Mnohé beta-blokátory podliehajú významnej biotransformácii v pečeni a ako možno badať z článku môže zmena biotransformačnej aktivity určitého enzýmu výrazne ovplyvňovať hladiny a vylučovanie beta-blokátora, a tým vyvolať i zmeny v samotnom účinku daného liečiva.
Došlo 23. března 2009 / Přijato 1. dubna 2009
Adresa pro korespondenci:
Mgr. Jana Ďuricová
Ústav klinické farmakologie FN Ostrava
17. listopadu 1790, 708 52 Ostrava-Poruba
e-mail: jankaduricova@seznam.cz nebo jana.duricova@fno.cz
Zdroje
1. Reiter M. J.: Prog Cardiovasc Dis., 2004; 47, 11–33.
2. López–Sendón J., Swedberg K., McMurray J. et al.: Eur Heart J., 2004; 25, 1341–1362.
3. O’Rourke S. T.: Am J Pharm Educ., 2007; 71, 1–6.
4. Bristow M. R.: Circulation, 2000; 101, 558–569.
5. Vítovec J., Špinar J.: Interní Med., 2008; 10, 126–128.
6. Cruickshank J. M.: Circulation., 1990; 82, 60–65.
7. Andrus M. R., Loyed J. V.: Drugs Aging., 2008; 25, 131–144.
8. Prisant L. M.: J Clin Pharmacol., 2008; 48, 225–239.
9. Souček M.: Interní Med., 2008; 2, 58–61.
10. Keating G. M., Jarvis B.: Drugs, 2003; 63, 1697–1741.
11. McDevitt D. G.: Eur Heart J., 1987; 8, 9–14.
12. Riddell J. G., Harron D. W. G., Shanks R. G.: Clin Pharmacokinet., 1987; 12, 305–320.
14. Mehvar R., Brocks D. R.: J Pharm Pharm Sci., 2001; 4, 185–200.
15. Fox K., García M. A., Ardissino D. et al.: Eur Heart J., 2006; 27, 1341–1381.
16. Bassand J. P., Hamm C. H. W., Ardissino D. et al.: Eur Heart J., 2007; 28, 1598–1660.
17. Bělohlávek J, Aschermann M.: Cor Vasa, 2008; 50, 1S7–1S23.
18. Janoušek S.: Interv Akut Kardiol., 2004; 3, 189–191.
19. van de Werf F., Bax J., Betriu A. et al.: Eur Heart J., 2008; 29, 2909–2945.
20. Gourine A., Bondar S. I., Spyer K. M. et al.: Circ Res., 2008; 102, 633–636.
21. Špinar J., Hradec J., Meluzín J. et al.: Cor Vasa, 2007; 49, 5–34.
22. Prakash A., Markham A.: Drugs, 2000; 60, 647–678.
23. Dahlöf B., Sever P. S., Poulter N. R. et al.: Lancet, 2005; 366, 895–906.
24. Dahlöf B., Devereux R. B., Kjeldsen S. E. et al.: Lancet, 2002; 359, 1004–1010.
25. Grundmann M., Kacířová I.: Postgraduální medicína., 2007; 9, 652–660.
26. Widimský J., Cífková R., Špinar J. et al.: Cor Vasa., 2008; 50, 5–22.
27. Zipes D. P., Camm A. J., Borggrefe M. et al.: Europace., 2006; 8, 746–837.
28. Blomström–Lundqvist C, Sheinman MM, Aliot EM a kol. J Am Coll Cardiol., 2003; 42 : 1493–1531.
29. Anzenbacher P., Anzenbacherová E.: CMLS Cell Mol Life Sci., 2001; 58, 737–747.
30. Mičuda S., Martínková J., Chládek J. et al.: Remedia., 1998; 8, 226–236.
31. Bernard S., Neville K. A., Nguyen A. T. et al.: Clinical Implications. Oncologist., 2006; 11, 126–135.
32. Buzková H., Pechandová K., Slanař O. et al.: Prague Med Rep., 2006; 107, 383–393.
33. Volotinen M., Turpeinen M., Tolonen A. et al.: Drug Metab Dispos., 2007; 35, 1135–1141.
34. Lewis R. V., Lennard M. S., Jackson P. R. et al.: Br. J. Clin. Pharmacol., 1985; 19, 329–333.
35. Lennard M. S., Lewis R. V., Brawn L. A.: Br. J. Clin. Pharmacol., 1989; 27, 429–434.
36. Nieminen T., Uusitalo H., Mäenpää J. et al.: Eur. J. Clin. Pharmacol., 2005; 61, 811–819.
37. Zhou H. H., Wood A. J. J.: Clin. Pharmacol. Ther., 1995; 57, 518–524.
38. Ishida K., Taira S., Morishita H. et al.: Bil. Pharm. Bull., 2008; 31, 1297–1300.
39. Honda M., Nozawa T., Igarashi N. et al.: Biol. Pharm. Bull., 2005; 28, 1476–1479.
40. Takekuma Y., Takenaka T., Kiyokawa M. et al.: Biol. Pharm. Bull., 2007; 30, 537–542.
41. Graff D. W., Williamson K. M., Pieper J. A. et al.: J. Clin. Pharmacol., 2001; 41, 97–106.
42. Lefebvre J., Poirier L., Poirier P. et al.: Br. J. Clin. Pharmacol., 2006; 63, 575–582.
43. Beresford R., Heel R. C.: Drugs., 1986; 31, 6–28.
44. Frishman W. H., Tepper D., Lazar E. J. et al.: J. Clin. Pharmacol., 1990; 30, 686–692.
45. de Groot M. J., Ackland M. J., Horne V. A. et al.: J. Med. Chem., 1999; 42, 4062–4070.
46. Zateyshchikov D. A., Minushkina L. O., Brovkin A. N. et al.: Fund. Clin. Pharmacol., 2007; 21, 437–443.
47. RegĆrdh C. G., Johnsson G.: Clin. Pharmacokinet., 1980; 5, 557–569.
48. Peřinová I., Ďuricová J., Brozmanová H., Kacířová I., Grundmann M.: Čes. a slov. Farm., 2008; 57, 254–259.
49. Cerqueira P. M., Cesarino E. J., Mateus F. H. et al.: Chirality., 1999; 11, 591–597.
50. Ismail R., Teh L. K.: J Clin Pharm Ther., 2006; 31, 99–109.
51. Koytchev R., Alken R. G., Vlahov V. et al.: Eur J Clin Pharmacol., 1998; 54, 469–474.
42. Seeringer A., Brockmöller J., Bauer S. et al.: Eur J Clin Pharmacol., 2008; 64, 883–888.
52. Kirchheiner J., Heesch C., Bauer S. et al.: Clin Pharmacol Ther., 2004; 76, 302–312.
53. Goryachkina K., Burbello A., Boldueva S. et al.: Eur J Clin Pharmacol 2008; 64, 1163–1173.
54. Bijl M. J., Visser L. E., van Schaik R. H. N. et al.: Clin Pharmacol Ther., 2009; 85, 45–50.
55. Wuttke H., Rau T., Heide R. et al.: Clin Pharmacol Ther., 2002; 72, 429–437.
56. Fux R., Mörike K., Pröhmer A. M. T. et al.: Clin Pharmacol Ther., 2005; 78, 378–387.
57. Zineh I., Beitelshees A. L., Gaedigk A. et al.: Clin Pharmacol Ther., 2004; 76, 536–544.
Štítky
Farmacie Farmakologie
Článek Nové knihy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2009 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Příznivé účinky rutinu, kvercitrinu a kvercetinu na nespecifické střevní záněty
- K pojmům farmaceutická péče, lékárenská péče a správná lékárenská praxe
- Beta-blokátory
- Produkce isoflavonoidů v suspenzní kultuře Trifolium pratense L.
- HPLC štúdium vplyvu teploty na separáciu niektorých enantiomérov sulfoxidov, stanovenie niektorých enantiomérov sulfoxidov v sére potkana
- Štúdium lokálnych anestetík Časť: 187 Extrakcia 1-metyl-2-piperidínoetylesterov alkoxyfenylkarbámových kyselín z ľudskej plazmy polymérmi s odtlačkami molekúl a porovnanie s klasickou extrakciou tuhou fázou*
- Využitie rádionuklidovej röntgenofluorescenčnej analýzy pri stanovení obsahu ťažkých kovov v dextránoch v tuhom a kvapalnom skupenstve
- Ze zasedání Výboru České farmaceutické společnosti
- Významné životní jubileum prof. RNDr. Evy Kvasničkové, CSc.
- Nové knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Beta-blokátory
- K pojmům farmaceutická péče, lékárenská péče a správná lékárenská praxe
- Příznivé účinky rutinu, kvercitrinu a kvercetinu na nespecifické střevní záněty
- Významné životní jubileum prof. RNDr. Evy Kvasničkové, CSc.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



