-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laktobacily a ich probiotické vlastnosti
Lactobacilli and their probiotic properties
Lactobacilli rank among lactic acid bacteria, fermenting saccharides to produce lactic acid. The individual species and strains differ by the profiles of fermented saccharides, but this property is not sufficient for the identification at the species level. The species and strains differ in the 16S rDNA sequence and in the intergenic space between 16S and 23S rDNA, which make their differentiation and identification possible. Some representatives of the genus Lactobacillus are included in probiotic preparations with regard to their beneficial health effects on the human and animal organisms. For example, they are able to interact with the immune system and stimulate it positively, to reduce the manifestations of lactose intolerance by consuming fermented milk products, and to shorten postantibiotic and travellers’ diarrhoea. Lactobacilli also produce bacteriocins, antimicrobially active substances.
Key words:
Lactobacillus – probiotics – bacteriocins – bacteria of lactic fermentation – 16S rDNA
Autoři: H. Kiňová Sepová; A. Bílková; M. Bukovský
Působiště autorů: Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv
Vyšlo v časopise: Čes. slov. Farm., 2008; 57, 95-98
Kategorie: Přehledy a odborná sdělení
Souhrn
Laktobacily radíme k baktériám mliečneho kvasenia, fermentujú sacharidy na kyselinu mliečnu. Profilom fermentovaných sacharidov sa jednotlivé druhy a kmene líšia, ale tento údaj nie je dostačujúci pre identifikáciu na úrovni druhu. Druhy a kmene sa líšia v sekvencii 16S rDNA a v medzigénovom priestore medzi 16S a 23S rDNA, ktoré umožňujú ich rozlíšenie a identifikáciu. Niektorí zástupcovia rodu Lactobacillus sú súčasťou probiotických prípravkov, vzhľadom na ich zdraviu prospešné účinky pre ľudský a zvierací organizmus. Sú schopné napríklad interagovať s imunitným systémom a pozitívne ho stimulovať, konzumáciou fermentovaných mliečnych výrobkov zmierňovať prejavy laktózovej intolerancie, skracovať postantibiotickú a cestovateľskú hnačku. Laktobacily taktiež produkujú bakteriocíny, antimikróbne účinné látky.
Kľúčové slová:
Lactobacillus – probiotiká – bakteriocíny - baktérie mliečneho kvasenia - 16S rDNARod Lactobacillus spp.
Lactobacillus spp. sú nesporulujúce, grampozitívne, fakultatívne anaeróbne, kataláza negatívne baktérie, morfologicky paličky pravidelného tvaru, niekedy kokobacily. Charakteristickou vlastnosťou rodu Lactobacillus je schopnosť fermentovať sacharidy na laktát. Podľa vzniknutých produktov fermentácie ich môžeme rozdeliť na obligátne homofermentatívne (OHOL), keď je produktom fermentácie len kyselina mliečna, fakultatívne homofermentatívne (FHOL) a obligátne heterofermentatívne (OHEL), kedy vzniká okrem laktátu acetát, etanol a oxid uhličitý. U niektorých zástupcov boli dokázané zdraviu prospešné účinky na ľudský a zvierací organizmus 1–3). Môžu sa využiť v profylaxii a terapii niektorých ochorení, ako probiotiká (z gr. „pro bios”, pre život). Probiotiká sú prípravky obsahujúce živé mikroorganizmy, ktoré prijaté do gastrointestinálneho traktu organizmu v adekvátnom množstve, majú zdraviu prospešné účinky 4). Probiotické účinky baktérií sa vzťahujú na jednotlivé druhy a kmene (Lactobacillus spp., ale aj Bifidobacterium spp., Lactococcus spp., Streptococcus spp., Enterococcus spp., Saccharomyces spp. a Bacillus spp.). FAO/WHO 5) určujú podmienky, za akých je možné daný mikrobiálny kmeň používať ako probiotikum.
Laktobacily, ktorých je dnes známych viac ako 90 druhov 6), nachádzame v rôznych ekologických podmienkach: Osídľujú ľudský gastrointestinálny trakt 7 – 9), pošvu žien vo fertilnom veku 10), ústnu dutinu 11), boli nájdené v siláži 12), ovčom mlieku 13), v rôznych druhoch syrov 14, 13), jogurte 12, 15), ale i vo víne 16). Podmienkam výskytu daného druhu je prispôsobená aj veľkosť genómu jednotlivých zástupcov.
Je známa kompletná nukleotidová sekvencia genómu Lactobacillus johnsonii NCC 533, izolovaného z ľudskej stolice. Jej dĺžka bola stanovená na 1 992 676 bp. V genetickej výbave L. johnsonii chýbajú gény pre syntézu väčšiny aminokyselín de novo 17). To predpokladá výskyt L. johnsonii v prostredí bohatom na živiny, akým je aj ľudské črevo. Taktiež v genóme tejto baktérie nenachádzame gény pre syntézu niektorých enzýmov, napr. glutamátsyntázu, glutamátdehydrogenázu (neschopnosť využívať amoniak), chýbajú enzýmy zodpovedné za syntézu mnohých kofaktorov, ako sú tiamín, kyselina nikotínová, riboflavín, biotín, kobalamín, pantotenát a pyridoxín. Pre obmedzené schopnosti biosyntézy sa predpokladá v L. johnsonii kompenzácia tohto nedostatku posilnením transportných systémov 17).
Sekvencia genómu Lactobacillus plantarum WCFS1 bola stanovená na 3 308 274 bp, čo je zatiaľ najrozsiahlejšia génová výbava identifikovaná u mliečnych baktérii. Kmeň bol izolovaný z ľudských slín, iné kmene tohto druhu boli izolované z fermentovaných nápojov 18, 19), mäsa 20) a rôznych rastlín 21). Veľkosť genómu predurčuje L. plantarum pre výskyt aj v prostredí chudobnom na živiny. Genóm L. plantarum kóduje kompletné cesty biosyntéz väčšiny aminokyselín, okrem aminokyselín s rozvetveným reťazcom, leucínu, izoleucínu a valínu. L. plantarum má enzýmový systém pre príjem peptidov, primárnych produktov degradácie proteínov. Devätnásť génov L. plantarum kóduje intracelulárne peptidázy rôznej špecifity. Ako u prvej baktérie zo skupiny mliečnych baktérií bol v genóme L. plantarum nájdený gén (o veľkosti 25 kb) pre neribozomálnu syntézu peptidov. Podobným systémom sú produkované aj peptidom podobné produkty, ktoré majú rôznu štruktúru a zloženie a zahŕňajú dôležité komponenty (L. plantarum NC8 produkuje plantaricín NC8 22)), používané aj vo farmácii.
Pri klasickej identifikácii (morfológia buniek, typ fermentácie glukózy, rast pri rozdielnych teplotách, DL konfigurácia kyseliny mliečnej a fermentácia rôznych sacharidov 7)) jednotlivých zástupcov rodu Lactobacillus vznikajú problémy a niektoré baktérie sa nedajú týmito metódami od seba odlíšiť. Napríklad profil fermentácie sacharidov u L. fermentum je veľmi podobný profilu L. reuteri, ale na génovej úrovni nie sú tieto dva druhy laktobacilov podobné. Napriek tomu sú fenotypové metódy pri rozlíšení týchto dvoch baktérií potrebné – zloženie peptidoglykánu je signifikantne odlišné 21). V súčasnosti sa pristupuje pri identifikácii laktobacilov k metódam molekulárnej biológie. Jednou z využívaných metód je sekvenácia variabilných regiónov 16S rDNA amplifikovaných pomocou polymerázovej reťazovej reakcie (PCR). 16S rDNA kódujúca gény pre 16S rRNA, ktorá je súčasťou menšej podjednotky ribozómu, obsahuje okrem variabilných regiónov aj konzervované regióny, ktoré sa využívajú pre konštrukciu rodovo špecifických PCR primerov 7). Iným príkladom ťažko odlíšiteľných druhov rodu Lactobacillus sú L. plantarum a L. pentosus. Opäť je fermentácia sacharidov na rozlíšenie týchto dvoch druhov nepoužiteľná, profily fermentácie oboch baktérií sú takmer identické. V prípade týchto dvoch baktérií je nemožné použiť metódu sekvenácie amplikónov 16S rDNA, lebo sa v nukleotidovej sekvencii daného génu líšia len troma nukleotidmi 24), homológia daného úseku je až 99 % 25). Na odlíšenie týchto dvoch druhov laktobacilov sa využíva iné miesto v ich genóme. Jedná sa o DNA v medzigénovom priestore, ISR („intergernic spacer region“), teda o sekvenciu ležiacu medzi 16S a 23S rDNA. Do tohto priestoru smerujú aj druhovo špecifické PCR primery pre L. plantarum a L. pentosus, pomocou ktorých možno amplifikovať časť týchto génov a odlíšiť baktérie od seba 26).
Ako bolo spomenuté, Lactobacillus spp. a niektoré mliečne baktérie (Bifidobacterium spp., Lactococcus spp., Streptococcus spp., Enterococcus spp., Saccharomyces spp. a Bacillus spp.) sa používajú v profylaxii a terapii niektorých ochorení. Dnes sa uvažuje o viacerých mechanizmoch účinku probiotických baktérií a ich pôsobkov. Už na začiatku 20. storočia predpokladal Iľja Mečnikov, že niektoré potraviny – ako fermentované mlieko a mliečne produkty – napomáhajú nahradiť škodlivé baktérie v gastrointestinálnom trakte prospešnými 4).
Pôsobenie laktobacilov
Medzi hlavné miesta pôsobenia laktobacilov v ľudskom organizme patrí črevo a pošva. V pošve sú laktobacily súčasťou prirodzenej mikroflóry a majú nezastupiteľné miesto v udržiavaní fyziologických podmienok v tomto orgáne. Tým, že laktobacily produkciou laktátu znižujú pH pošvy na 4,5 a menej, bránia kolonizácii patogénmi, ktoré pri takomto nízkom pH nie sú schopné rásť. Laktobacily sa v pošvovom sekréte nachádzajú v koncentrácii 105–107 CFU/ml 27).
Gastrointestinálny trakt dospelého jedinca je osídľovaný približne 300–400 druhmi baktérií patriacich k viac ako 190 rodom 28). Rozloženie a počet jednotlivých druhov sa mení podľa meniacich sa podmienok v GIT, pričom tu nachádzame i oportúnne patogénne druhy 28). Druhy rodu Lactobacillus sa vyskytujú v celej dĺžke tráviaceho traktu, v rôznej koncentrácii 29). Hrubé a tenké črevo sú miestom pôsobenia laktobacilov pri viacerých ochoreniach. Pri laktózovej intolerancii sa ukázala konzumácia probiotík ako prospešná. Niektoré probiotické kmene, ako L. delbrueckii subsp.bulgaricus a Streptococcus thermophillus, schopné fermentovať laktózu, zmierňujú prejavy ochorenia pri konzumácii fermentovaných mliečnych produktov 1). Podávanie probiotických kmeňov viedlo tiež k zmierneniu prejavov akútnej rotavírusovej hnačky. Po užití určitých probiotík (L. rhamnosus GG, L. reuteri, L. casei Shirota) sa pozorovalo zvýšenie hladiny špecifického antirotavírusového IgA 30), súčasne sa znížila zvýšená črevná permeabilita 31) a normalizovala sa črevná mikroflóra 2). Podaním Saccharomyces cerevisiae (boulardii) sa znížilo riziko vzniku postantibiotickej hnačky 32). Probiotiká ako L. rhamnosus GG, L. acidophilus a Enterococcus faecium SF68 tiež znižujú riziko vzniku hnačky zapríčinenej podávaním antibiotík a uľahčujú jej terapiu 3).
Mliečne baktérie sa ukazujú byť prospešné pri profylaxii kolorektálneho karcinómu. Na 21 zdravých dobrovoľníkoch sa sledoval vplyv L. acidophilus NCFM a L. acidophilus N-2 na ß-glukuronidázu, nitroreduktázu a azoreduktázu, baktériové fekálne enzýmy asociované so vznikom kancerogénov v čreve. Pozorovalo sa signifikantné zníženie špecifickej aktivity uvedených enzýmov u všetkých dobrovoľníkov po 10 dňoch podávania týchto kmeňov. Oba kmene mali rovnaký účinok. Pre túto aktivitu je ale nutná nepretržitá konzumácia týchto baktérií 33). Mlieko fermentované druhmi Bifidobacterium infantis, B. bifidum, B. animalis, L. acidophilus a L. paracasei inhibovalo rast bunkovej línie MCF7 rakoviny prsníka, pričom tento efekt nebol priamo závislý na ich prítomnosti 34). Toto zistenie predpokladá prítomnosť novovzniknutých komponentov produkovaných mliečnymi baktériami pri fermentácii mlieka alebo mikrobiálnou transformáciou biologicky aktívnych látok z komponentov mlieka 35).
Napriek tomu, že laktobacily sú všeobecne považované za nepatogénne a ich použitie je bezpečné, je nutné preukázať ich bezpečnosť 5). Boli zaznamenané prípady infekcie druhmi rodu Lactobacillus, i keď sa jednalo o imunokompromitovaných pacientov a infekcia laktobacilmi bola sekundárna. Laktobacily ako baktérie schopné produkovať kyselinu mliečnu sa zúčastňujú na tvorbe zubného kazu. Viaceré druhy rodu Lactobacillus boli asociované so zubným kazom a považujú sa za dôležitý sekundárny patogén 36). Boli nájdené ako pri povrchovom zubnom kaze, tak aj pri hlbokých léziach 37), ale nepreukázala sa ich prítomnosť v bakteriálnej invázii neexponovanej zuboviny 38). U imunokompromitovaných pacientov sa zaznamenali systémové infekcie, ako bakteriémia, endokarditída alebo lokalizovaná infekcia, zapríčinené laktobacilmi. Pri bakteriémii to boli najmä onkologickí pacienti, diabetici, pacienti s abscesom. Pri endokarditíde spôsobenej laktobacilmi mali pacienti štrukturálnu poruchu srdca alebo predchádzajúcu epizódu endokarditídy, pričom predispozičným faktorom sa ukázal byť stomatologický zákrok. Lokalizované infekcie Lactobacillus spp. boli spojené s pľúcnou infekciou, peritonitídou, chorioamnionitídou, intraabdominálnou infekciou, a i. Opäť boli dôležitým predispozičným faktorom chronické ochorenia: diabetes, rakovina, neutropénia, renálne zlyhanie 39). V popisovaných prípadoch boli najčastejšími infekčnými agens L. casei, L. rhamnosus a L. plantarum 39).
Interakcia s imunitným systémom
V ochrane proti infekčným agens hrá dôležitú úlohu tzv. s črevom asociované lymfoidné tkanivo (GALT). GALT je najväčším lymfoidným orgánom v ľudskom organizme 28). V čreve sa predpokladá viacero mechanizmov pôsobenia laktobacilov a prirodzene aj ich interakcia s imunitným systémom hostiteľského organizmu. Niektoré druhy baktérií, vrátane známych probiotických kmeňov (napr. L. plantarum 299v), sú schopné indukovať in vitro maturáciu a expresiu myších dendritových buniek, s možnosťou uprednostnenia imunitnej odpovede T pomocných buniek (TH1, TH2, TH3) 40, 41). Interakcia laktobacilov s dendritovými bunkami sa čiastočne deje cez receptor nesúci rozpoznávací znak („pattern-recognation receptor“) DC SIGN („dendric cell-specific intercellular adhesion molecule 3-grabbing non-intergrin“). Tie laktobacily, ktoré sú schopné interagovať s DC-SIGN, vedú k pomnoženiu T buniek produkujúcich IL-10 (obr. 1) 42). Svoju úlohu zohráva aj adhézia baktériových buniek na intestinálny epitel. V genetických štúdiách sa preukázala prítomnosť viacerých proteínov bunkového povrchu, ktoré sú asociované s intestinálnymi bunkami a s funkciami viažucimi sa s mukózou. Takto boli identifikované viaceré adhezívne faktory v L. acidophilus43). Taktiež bol v L. plantarum identifikovaný špecifický manózový adhezín 44). Niektoré enteropatogény sa viažu na epitelové bunky cez špecifický manózový adhezín. To znamená, že probiotické kmene s podobnými adhezívnymi vlastnosťami sú schopné inhibovať adhéziu a kolonizáciu čreva patogénmi a ochrániť hostiteľský organizmus pred infekciou (obr. 1) 45).
Obr. 1. Niektoré efektorové molekuly baktérií a hostiteľského organizmu s potenciálnymi probiotickými účinkami (podľa 45)). IL-10 – interleukín 10; DC-SIGN – dendric cell-specific intercellular adhesion molecule 3-grabbing non-intergrin 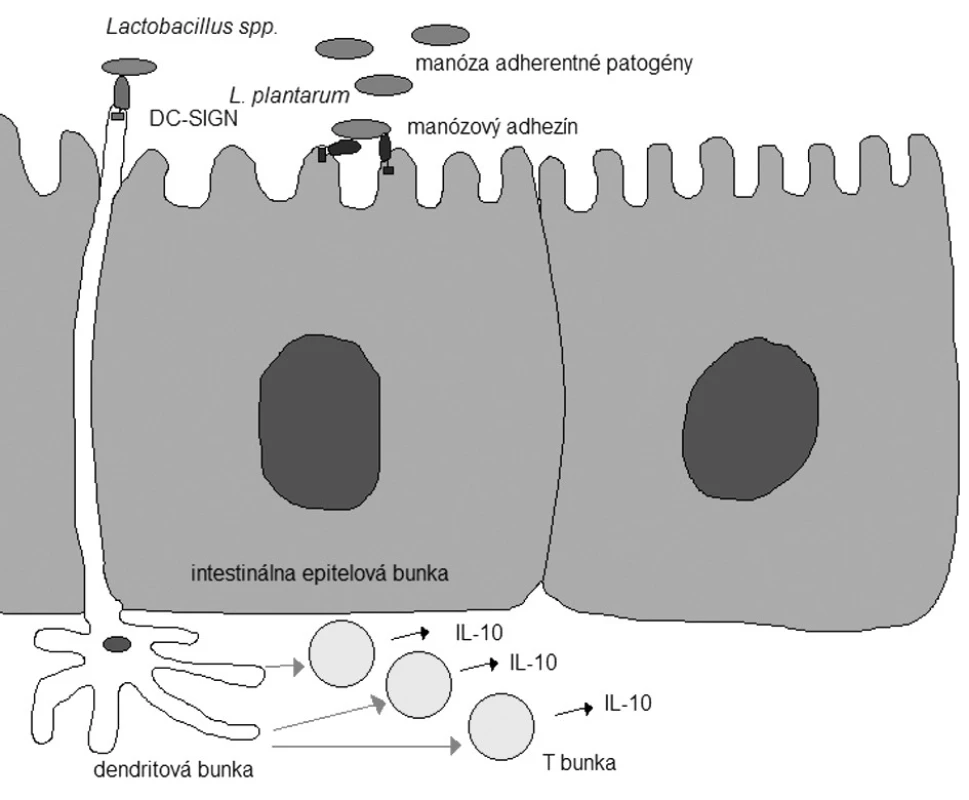
Iným mechanizmom účinku laktobacilov v čreve je znižovanie pH prostredia, a tým zabránenie rastu patogénnych organizmov. Kyslé prostredie je dôsledkom produkcie laktátu. Tento mechanizmus sa pokladá za nešpecifický. Laktobacily sú tiež známe produkciou špecifických antibakteriálnych substancií, tzv. bakteriocínov. Pôvodne boli bakteriocíny definované ako proteínové zložky, ktoré zabíjajú príbuzné baktérie 46). Aj keď väčšina bakteriocínov je proteínovej povahy, dnes je evidentné, že bakteriocíny môžu mať aj inú formu 47). L. reuteri LA6 produkuje reutericín 6, bakteriocín peptidovej povahy, s lytickým účinkom voči kmeňom L. delbrueckii subsp. bulgaricus JCM 1002T a L. delbrueckii subsp. bulgaricus NIAI B6 48). U L. reuteri bola zaznamená tvorba 3-hydroxypropionaldehydu (reuterínu), ktorý okrem využitia v probiotických prípravkoch, má aj priemyselné využitie pri príprave chemikálií, napríklad plastov alebo kyseliny akrylovej 49). Reuterín vzniká dehydratáciou a redukciou glycerolu.
ZÁVER
Laktobacily ako baktérie mliečneho kvasenia majú využitie nielen v potravinárstve, ale aj vo veterinárnej a humánnej medicíne. Produkujú substancie s pozitívnym vplyvom na hostiteľský organizmus a nešpecifickými a špecifickými mechanizmami bránia kolonizácii patogénov a svojou nepatogenitou a tým, že sú prirodzenými kolonizátormi ľudského čreva a pošvy, sú vhodnými adeptami pre použitie ako probiotiká. Využitím metód molekulárnej biológie sa zjednodušuje a urýchľuje proces identifikácie a charakterizácie izolovaných kmeňov, to vysvetľuje aj rozšírenie sortimentu probiotík v ostatnom čase. Svoje využitie našli probiotiká nielen v perorálnych formách, ale aj ako vaginálne preparáty určené na obnovu prirodzenej mikroflóry po antimykotickej a antibakteriálnej terapii.
Došlo: 22. ledna 2007
Přijato: 16. února 2008
Adresa pro korespondenci:
Mgr. Hana Kiňová Sepová
Katedra bunkovej a molekulárnej biológie liečiv FaF UK
Kalinčiakova 8, 832 32 Bratislava, SR
e-mail: kinovasepova@fpharm.uniba.sk
Zdroje
1. Ouwehand, A. C., Salminen, S., Isolauri, E.: Antonie Leeuwenhoek, 2002; 82, 279–289.
2. Salminen, S., Isolauri, E., Salminen, E.: Antonie Leeuwenhoek, 1996; 70, 347–358.
3. Gismondo, M. R., Drago, L., Lombardi, A.: Int. J. Antimicrob. Agents, 1999; 12, 287–292.
4. www.who.int/entity/foodsafety/publications/fs_manage ment/probiotics2/en, 15. 3. 2007.
5. www.who.int/foodsafety/fs_management/en/probiotic_ guidlines.pdf, 9. 3. 2007.
6. www.bacterio.cict.fr/index.html, 18. 12. 2007.
7. Heilig, H. G. H. J., Zoetendal, E. G., Vaughan, E. E. et al.: Appl. Environ. Microbiol., 2002; 68, 114–123.
8. Wilson, K. H., Blitchington, R. B.: Appl. Environ. Microbiol., 1996; 62, 2273–2273.
9. Claesson, M. J., Li, Y., Leathy, S. et al.: Proc. Natl. Acad. Sci, 2006; 107, 6718–6723.
10. Anukam, K. C., Osazuwa, E. O., Ahonkhai, I., Reid, G.: World J. Microbiol. Biotechnol, 2006; 22, 1055–1060.
11. Kleerebezem, M., Boekhorst, J., van Kranenburg, R. et al.: Proc. Natl. Acad. Sci., 2003; 100, 1990–1995.
12. Tannock, G. W., Tilsala-Timisjarvi, A., Rodtong, S. et al.: Appl. Environ. Microbiol., 1999; 65, 4264–4267.
13. Oneca, M., Irigoyen, A., Ortigosa, M., Torre, P.: FEMS Microbiol. Lett., 2003; 227, 271–277.
14. Sánchez, I., SeseĖa, S., Poveda, J. M. et al.: Int. J. Food Microbiol., 2006; 107, 265–273.
15. van de Guchte, M, Penaud, S., Grimaldi, C. et al.: Proc. Natl. Acad. Sci., 2006; 103, 9274–9279.
16. Spano, G., Beneduce, L., de Palma, L. et al.: World J. Microbiol. Biotechnol, 2006; 22, 769–773.
17. Pridemore, R. D., Berger, B., Desiere, F. et al.: Proc. Natl. Acad. Sci. USA, 2004; 101, 2512–2517.
18. Beneduce, L., Spano, G., Vernile, A. et al.: Basic Microbiol., 2004; 44, 10–16.
19. Bourdineaud, J. P., Nehme, N., Tesse, S., Lonvaud-Funel, A.: Appl. Environ. Microbiol., 2003; 69, 2512–2520.
20. Aymerich, T., Martin, B., Garriga, M., Hugas, M.: Appl. Environ. Microbiol., 2003; 69, 4583–4594.
21. Balows, A. et al.: The prokaryotes. 2. vyd. New York, Springer, 1992. s. 1564.
22. Maldonado, A., Ruiz-Barba, J.L., Jiménez-Díaz, R.: Arch. Microbiol., 2004; 181, 8–16.
23. Holzapfel, W. H., Haberer, P., Geisen, R. et al.: Am. J. Clin. Nutr., 2001; 73, 365S–373S.
24. Quere, F., Deschamps, A., Urdaci, M. C.: J. Appl. Microbiol., 1997; 82, 783–790.
25. Colins, M. D., Rodrigues, U., Ash, C. et al.: FEMS Microbiol. Lett., 1991; 77, 5–12.
26. Berthier, F., Ehrlich, S. D.: FEMS Microbiol. Lett., 1998; 161, 97–106.
27. Martius, G., Breckwoldt, M., Pfleiderer, A.: Gynekologie a porodnictví. Martin, Osveta, 1997, s. 22, 427.
28. Holzapfel, W. H., Haberer, P., Snel, J. et al.: Int. J. Food Microbiol., 1998; 41, 85–101.
29. Simon, G. L., Gorbach, S. L.: Med. Clin. North Am., 1982; 66, 557–574.
30. Kaila, M., Isolauri, E., Soppi, E. et al.: Ped. Res., 1992; 32, 141–144.
31. Isolauri, E., Kaila, M., Arvola, T. et al.: Ped. Res., 1993; 33, 1605–1610.
32. Surawitz, C. M., Elmer, G. W., Spleeman, P. et al.: Gastroenterol., 1989; 96, 981–988.
33. Goldin, B. R., Gorbach, S. L.: Am. J. Clin. Nutr., 1984; 39, 756–761.
34. Biffi, A., Coradini, D., Larsen, R. et al.: Nutr. Canc., 1997; 28, 93–99.
35. Hirayama, K., Rafter, J.: Antonie Leeuwenhoek, 1999; 76, 391–394.
36. van Houte, J.: J. Dent. Res., 1994; 73, 672–681.
37. Hanhn, C. L., Falkler Jr., W. A., Minah, G. E: Arch. Oral Biol., 1991; 36, 147–153.
38. Hoshino, E., Ando, N., Sato, M., Kota, K.: Int. Endod. J., 1992; 25, 2–5.
39. Cannon, J. P., Lee, T. A., Bolanos, J. T., Danziger, L. H.: Eur. J. Clin. Microbiol. Infect. Dis., 2005; 24, 31–40.
40. Christensen, H. R., Frokiaer, H., Pestka, J. J.: J. Immunol., 2002; 168, 171–178.
41. Hart, A. L., Lammers, K., Brigidi, P. et al.: Gut, 2004; 53, 1602–1609.
42. Smits, H. H., Engering, A., van der Kleij, D. et al.: J. Allergy Clin. Immunol., 2005; 115, 1260–1267.
43. Buck, B. L., Altermann, E., Svingerud, T., Klaenhammer, T. R.: Appl. Environ. Microbiol., 2005; 71, 8344–8351.
44. Pretzer, G., Snel, J., Molenaar, D. et al.: J. Bacteriol., 2005; 187, 6128–6136.
45. Marco, M. L, Pavan, S., Kleerebezem, M.: Curr. Opin. Biotechnol., 2006; 17, 204–210.
46. Tagg, J. R., Dajani, A. S, Wannamaker, I. W.: Microbiol. Rev., 1976; 40, 722–756.
47. Klaenhammer, T. R.: FEMS Microbiol. Rev., 1993; 12, 39–86.
48. Kabuki, T., Saito, T., Kawai, Y. et al.: Int. J. Food Microbiol., 1997; 34, 145–156
49. Hall, R. H., Stern, E. S.: J. Chem. Soc., 1950; 490–498.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2008 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Sedmdesátka doc. RNDr. Jiřího Hartla, CSc.
- K životnímu jubileu prof. RNDr. Rolfa Karlíčka, DrSc.
- Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži
- Interakcia 1,4-dihydropyridínov s iónovými kanálmi
- Nové knihy
- Polosyntetické deriváty celulosy jako základ hydrofilních gelových systémů
- Radioaktivně značené peptidy v diagnostice a terapii nádorů
- Léčivé rostliny a diabetes mellitus
- NOVÉ KNIHY
- Moderní instrumentální metody studia isoflavonů
- Ze zasedání Výboru České farmaceutické společnosti
- Laktobacily a ich probiotické vlastnosti
- Přínos alergenové imunoterapie Phostalem v léčbě sezonní alergické rýmy (dva roky aplikace)
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Polosyntetické deriváty celulosy jako základ hydrofilních gelových systémů
- Laktobacily a ich probiotické vlastnosti
- Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži
- Léčivé rostliny a diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



