-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sarkoidóza muskuloskeletálního systému
Sarcoidosis musculoskeletal system
Sarcoidosis is a multisystem granulomatous disease of unknown etiology, most commonly manifested by intrathoracic involvement with bilateral hilar lymphadenopathy and / or pulmonary infiltrates. Ophthalmic and skin lesions are the most common extrapulmonary manifestations, liver, spleen, lymph nodes, salivary glands, heart, nervous system, muscles and bones, rarely other organs, may also be affected. Musculoskeletal manifestations is present in up to 1/3 of patients and their spectrum is broad from simple arthralgia to lytic bone lesion. Inflammatory tendon lesions and periarticular edema are more common than joint synovitis. Despite current knowledge of the pathogenesis of the disease, the diagnosis of sarcoidosis of the musculoskeletal system is difficult. The definitive diagnosis is often determined by histological finding of sarcoid granuloma in tissues in combination with clinical manifestations. Musculoskeletal involvement usually occurs early in the disease. New imaging methods, especially PET/CT using fluorodeoxyglucose, are useful for assessing the extent of disease and determining disease activity. Glucocorticoids are the first-line treatment in the management of systemic symptoms of sarcoidosis, methotrexate or other disease-modifying drugs can be used as corticosteroid-sparing medications. Biological therapy, in particular TNF alpha inhibitors, has a place in the treatment of refractory disease, but the evidence for its efficacy is not clear.
Keywords:
arthritis – Sarcoidosis – granuloma – musculoskeletal system – bone lesions
Autoři: M. Žurek 1; P. Horák 1; M. Žurková 2; V. Lošťáková 2; T. Tichý 3
Působiště autorů: III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN, Olomouc 1; Klinika plicních nemocí a tuberkulózy LF UP a FN, Olomouc 2; Ústav klinické a molekulární patologie LF UP, Olomouc 3
Vyšlo v časopise: Čes. Revmatol., 27, 2019, No. 2, p. 57-64.
Kategorie: Přehledový článek
Souhrn
Sarkoidóza je multisystémové granulomatózní onemocnění neznámé etiologie, které se nejčastěji projevuje nitrohrudním postižením s bilaterální hilovou lymfadenopatií a/nebo plicními infiltráty. Z mimoplicních postižení jsou nejběžnější oční a kožní léze, mohou být také postižena játra, slezina, lymfatické uzliny, slinné žlázy, srdce, nervový systém, svaly a kosti, vzácněji i jiné orgány. Muskuloskeletální projevy se manifestují až u 1/3 pacientů a jejich spektrum je široké od prostých artralgií až po lytické kostní léze. Zánětlivé léze šlach a periartikulární otok jsou častější než kloubní synovitida. Navzdory současným poznatkům o patogenezi onemocnění je diagnóza sarkoidózy pohybového systému obtížná. Definitivní diagnóza bývá mnohdy stanovena až histologickým nálezem sarkoidního granulomu ve tkáních v kombinaci s klinickými projevy. Postižení svalové a kosterní soustavy se objevuje obvykle již v časném průběhu onemocnění. Nové zobrazovací metody především PET/CT s použitím fluorodeoxyglukózy jsou vhodné pro posouzení rozsahu onemocnění a stanovení aktivity nemoci. Glukokortikoidy jsou lékem první volby v léčbě systémových projevů sarkoidózy, methotrexát či jiné chorobu modifikující léky lze použít jako kortikoidy šetřící medikaci. Biologická léčba především inhibitory TNF-α mají své místo u onemocnění refrakterního k běžné léčbě, ale důkazy pro jejich účinnost nejsou jednoznačné.
Klíčová slova:
sarkoidóza – granulom – muskuloskeletální systém – artritida – kostní léze
ÚVOD
Sarkoidóza je systémové granulomatózní onemocnění neznámé etiologie. Obvykle postihuje jedince mladšího a středního věku, častěji ženy mladší 40 let (1, 2). Prevalence sarkoidózy kolísá mezi 6–21,3/100 000 obyvatel a je rovněž závislá na rase a pohlaví (3, 4). V České republice je incidence tohoto onemocnění 3,1/100 000 a prevalence přes 70/100 000 obyvatel (5). Muskuloskeletální projevy se objevují u 1/4 až 1/3 pacientů jako postižení kloubů, kostí a svalů. Závažnost projevů je velmi variabilní od artralgií až po lytické kostní léze.
Diagnóza sarkoidózy by měla být podpořena histopatologickým vyšetřením. Při postižení plicního parenchymu je preferována transbronchiální biopsie (TBB), kterou lze provést endoskopickou cestou. Při neúspěchu bronchoskopických metod je indikována video asistovaná torakoskopická biopsie. Bioptický materiál lze získat i z jiných tkání postižených sarkoidózou, především z periferní uzliny, kůže, bukální sliznice nebo spojivky. Nodózní erytém však nepředstavuje vhodnou indikaci k histopatologickému vyšetření, protože granulomy zde nebývají zastiženy, histologicky nález prokazuje nespecifickou kožní panikulitidu, která může provázet i jiná onemocnění. Avšak ani vzhled granulomu není pro sarkoidózu patognomonický. Podobné granulomatózní projevy lze najít u některých infekcí včetně tuberkulózy, mykobakterióz, nespecifických střevních zánětů, systémových vaskulitid nebo lymfoproliferativních onemocnění, které také mohou mít muskuloskeletální příznaky (5–8). Histologický nález granulomu bez typických klinických projevů sarkoidózy by měl vést k pátrání po alternativních diagnózách (obr. 1). Systémové projevy sarkoidózy se obvykle rozvinou během prvních 3–5 let trvání onemocnění. Pokud se tak stane později, je potřeba zvážit i širší diferenciální diagnostiku.
Obr. 1. Histologie – epiteloidní granulom v plíci (archiv autorů MUDr. M. Žurková, MUDr. T. Tichý) 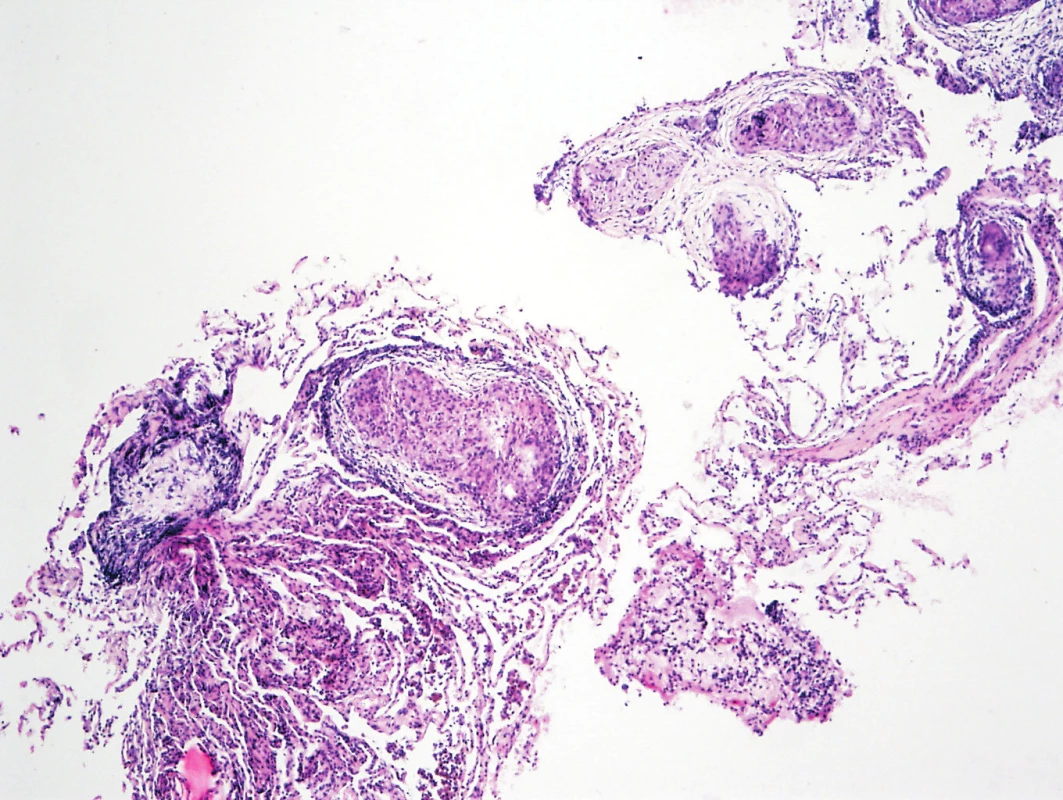
Pro diagnostiku sarkoidózy mají nezastupitelné místo endoskopické metody. Bronchoalveolární lavážní tekutina (BALTe) je materiálem pro analýzu buněčného obsahu alveolů. V lavážní tekutině nacházíme obvykle 20–40 % lymfocytů, převažují aktivované tzv. „pomocné“ helper CD4+ T-lymfocyty nad cytotoxickými CD8+ T-lymfocyty. Pro diagnózu sarkoidózy je poměr CD4+/CD8+ (tzv. imunoregulační index – IRI) v BALTe typický větší než 3,5. Normální nebo nízká hodnota IRI však diagnózu sarkoidózy nevylučuje (5).
Z laboratorních vyšetření bývá často přítomné zvýšení nespecifických markerů zánětu: sedimentace erytrocytů, CRP či hypergamaglobulinemie. Sérové hladiny enzymu konvertujícího angiotenzin (SACE), v minulosti široce používané jako určitý biomarker pro sarkoidózu, nejsou dostatečně citlivé ani specifické a špatně korelují s aktivitou nemoci (9). Sérová koncentrace solubilního receptoru pro interleukin 2 (sIL-2R) je velmi senzitivní, ale méně specifickým ukazatelem, poukazující na míru aktivace a klonální proliferace T-lymfocytů. Spolu se sérovou hladinou neopterinu patří k doporučovaným testům u sarkoidózy, koreluje s rozsahem onemocnění a úspěšností terapie. Imunoregulační index (poměr CD4+/CD8+ T-lymfocytů) v krvi dosahuje hodnot 0,8–1,0, na rozdíl od situace ve tkáních (BALTe, pleurální výpotek nebo cerebrospinální likvor) což je zřejmě následkem kompartmentalizace granulomatózního zánětu (10).
Hyperkalcemie či hyperkalciurie bývá nacházena u většiny granulomatózních zánětů (11), a jsou tedy také typické pro sarkoidózu, u které byly popsány již v roce 1939 (12). Vyskytují se dle různých literárních údajů u 30–60 % nemocných. Častější je hyperkalciurie > 7,5 mmol/24 h u 30–50 %, hyperkalcemie > 2,6 mmol/l je méně častá – u 10–20% pacientů (13). Zvýšené hodnoty nemusejí být potvrzeny jednorázovým vyšetřením, mohou být ovlivněny již nasazenou léčbou glukokortikoidy, což zřejmě vysvětluje poměrně velké rozdíly v prevalenci uváděné různými autory. V patogeneze hyperkalcemie a hyperkalciurie hraje zásadní roli nadprodukce aktivní formy vitaminu D kalcitriolu (1,25-(OH)D3) aktivovanými mononukleárními buňkami postiženými granulomatózním procesem. Vysoké sérové koncentrace kalcitriolu vedou ke zvýšené střevní absorpci vápníku a fosforu.
Zobrazovací metody u sarkoidózy včetně radiogramů plic, počítačové tomografie (CT) hrudníku či pozitronové emisní tomografie v kombinaci s počítačovou tomografií (PET/CT) určují rozsah, stadium a aktivitu onemocnění. Nálezy zobrazovacích metod jsou však nespecifické a pro stanovení diagnózy sarkoidózy je využít nelze.
AKUTNÍ ARTRITIDA (LÖFGRENŮV SYNDROM)
Nejčastějším muskuloskeletálním projevem sarkoidózy je akutní artritida, která se vyskytuje jako součást Löfgrenova syndromu: symetrická hilová lymfadenopatie, bolest kloubů a erythema nodosum (14). Syndrom je sezonní, s obvyklým začátkem na jaře (15). Riziko sarkoidózy je spojeno s HLA-DRB1*0301, HLA-DRB1*1101, HLA-DRB1*1201 a HLA-DRB1*1501; haplotyp HLA-DRB1*0301/DQB1*0201 je vysoce asociován s Löfgrenovým syndromem (16). Symetrická artritida kotníků je nejčastější manifestací a je přítomna u většiny pacientů s Löfgrenovým syndromem (17). Postiženy však mohou být i ostatní klouby, např. kolena, zápěstí, lokty a metakarpofalangeální klouby rukou. Při sonografickém vyšetření je patrný periartikulární otok měkkých tkání a/nebo tendosynovitida. Typická synovitida s kloubním výpotkem je vzácná, a pokud je přítomna, je obvykle drobná, bez výrazné aktivity v barevném dopplerovském mapování aktivity (18). Synoviální výpotek je zánětlivý s převahou mononukleárních buněk. Při histologickém vyšetření synovie obvykle nebývá nalezena granulomatózní reakce (19). Nález bilaterální hilové lymfadenopatie na skiagramu hrudníku se vyskytuje u 90 % pacientů (17). Erythema nodosum se vyskytuje u cca 40 % pacientů, častěji u kavkazského etnika a u žen (20). Někteří nemocní mohou mít přítomné systémové příznaky. Prognóza Löfgrenova syndromu je dobrá, většinou dochází k úplné remisi během 6 měsíců, někdy až do 18–24 měsíců (20). K relapsům onemocnění dochází jen velmi vzácně. Kloubní destrukce nebo jiné trvalé poškození kloubů jsou u Löfgrenova syndromu extrémně vzácné (21). Klinický syndrom u žen je tak charakteristický, že anamnéza, objektivní vyšetření a skiagram hrudníku jsou dostačující pro stanovení diagnózy, a podle některých autorů není vždy potřebné diagnózu potvrdit odběrem tkáně k histologickému vyšetření. V rámci diferenciální diagnostiky je potřeba zvažovat i ostatní možné příčiny včetně bakteriálních, mykotických a virových infekcí, zvláště u imunokompromitovaných pacientů (imunodeficitní stavy) (obr. 2).
Obr. 2. Sarkoidóza – I. stadium, hilová lymfadenopatie (archiv autorky MUDr. M. Žurkové s laskavostí Radiologické kliniky LF UP a FN Olomouc) 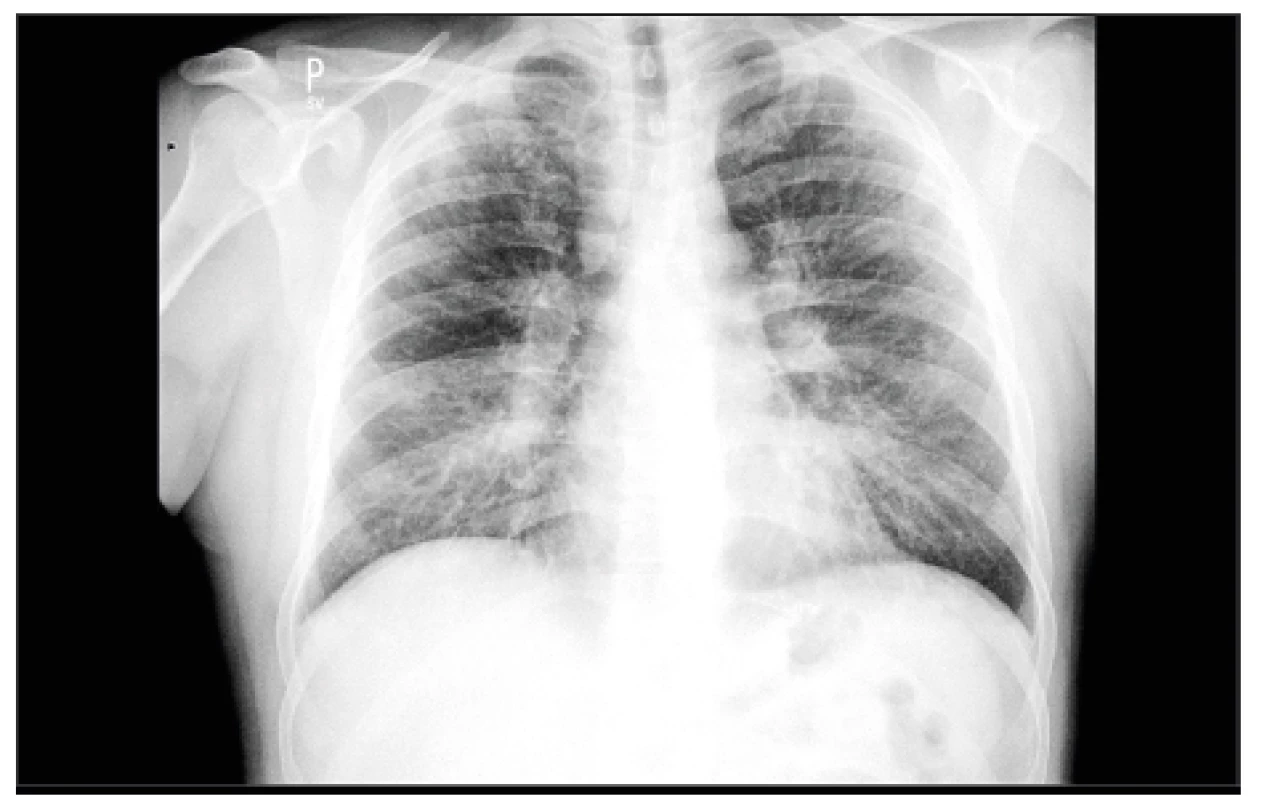
CHRONICKÁ ARTRITIDA
Artritida související s chronickou sarkoidózou se obvykle vyskytuje společně s dalšími mimoplicními projevy především současně s postižením kůže (22–24). Typický obrazem je asymetrická oligoartritida středních až velkých kloubů (17, 25). Je třeba odlišit pravou synovitidu od tendosynovitidy, která je častější. Symetrický zánět šlach extenzorů zápěstí by měl vést k podezření na muskuloskeletální projevy sarkoidózy. Destruktivní artritida je přítomna méně často (26). Synovitida velkých kloubů je vzácná a vyžaduje další došetření. Analýza kloubního výpotku je nediagnostická s nálezem mírně zánětlivého infiltrátu s převahou lymfocytů při srovnání s jinými typy artritidy (27). Histologické vyšetření synovie může diagnózu sarkoidózy potvrdit nálezem nekaseifikujících granulomů, stejně jako vyloučí jiné diagnózy, především infekce (tuberkulózu). Monoartritida je jako projev sarkoidózy neobvyklá a vyžaduje diferenciálně diagnostické jiných příčin, např. dny, pseudodny či septické artritidy. Vztah mezi dnou a sarkoidózou byl popsán již v minulosti (28). Diagnóza dnavé artritidy při sarkoidóze by měla být potvrzena aspirací synoviální tekutiny s průkazem krystalů monosodium urátu při vyšetření v polarizačním mikroskopu.
JACCOUDOVA ARTROPATIE
Deformity ručních kloubů u artropatie Jaccoudova typu jsou způsobeny především šlachovou laxitou, při neerozivní artritidě. Tento klasický obraz není pro sarkoidózu specifický a vyskytuje se také u systémového lupus erytematodes. Z hlediska diferenciální diagnostiky je významné, že Jaccoudova artropatie může napodobovat klinický obraz revmatoidní artritidy. u které jsou však současně přítomné erozivní změny. Jaccoudova artropatie se objevuje v pozdějším průběhu generalizované formy sarkoidózy s postižením vnitřních orgánů. Při histologickém vyšetření bývají nalezeny epiteloidní granulomy v obalech šlach a svalech a fibróza šlach (29).
AXIÁLNÍ ONEMOCNĚNÍ
Sarkoidóza postihující axiální skelet především páteř je často asymptomatická, a proto není skutečná prevalence přesně známa. Často se jedná o náhodný radiologický nález, např. při snímku hrudníku (30). Charakter kostních lézí může být lytický, sklerotický nebo se mohou oba typy kombinovat. Tyto změny mohou postihovat jakýkoliv segment páteře (31). Sakroilitida je vzácným projevem sarkoidózy a je obvykle unilaterální (32). U sarkoidózy byla popsána vyšší prevalence spondyloartritid 6 %, při srovnání s obecnou populací 1–1,9% (33, 34) (obr. 3a–c, 4).
Obr. 3. Sarkoidóza axiálního skeletu (poskytnuto s laskavostí Kliniky nukleární medicíny a Radiologické kliniky LF UP a FN Olomouc).
45letá žena s diagnózou sarkoidózy od roku 2009 s hilovou lymfadenopatií, závažným relabujícím průběhem choroby (pakety lymfatických uzlin v mediastinu, krku, v oblasti jaterního hilu, s lymfocytární alveolitidou). V roce 2016 PET/CT nález aktivních ložisek v oblasti Th, L páteře, pánve, ve sternu, v žebrech s podezřením na nádorovou chorobu. Cílená biopsie pod CT kontrolou s histologickým průkazem četných granulomů sarkoidního typu. Nález regredoval při terapii glukokortikoidy a metotrexátem.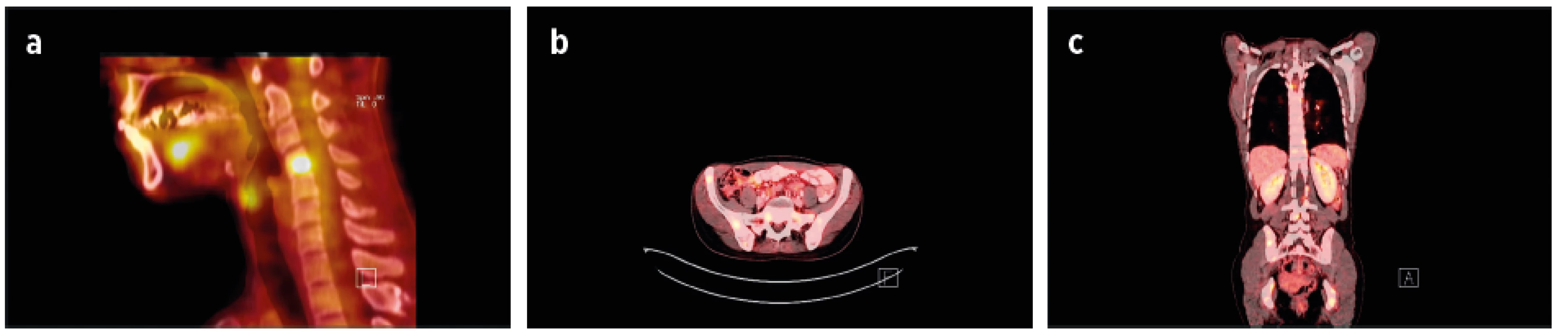
Obr. 4. Sarkoidóza v kostní dřeni (archiv autorů MUDr. M. Žurkové a MUDr T. Tichého) 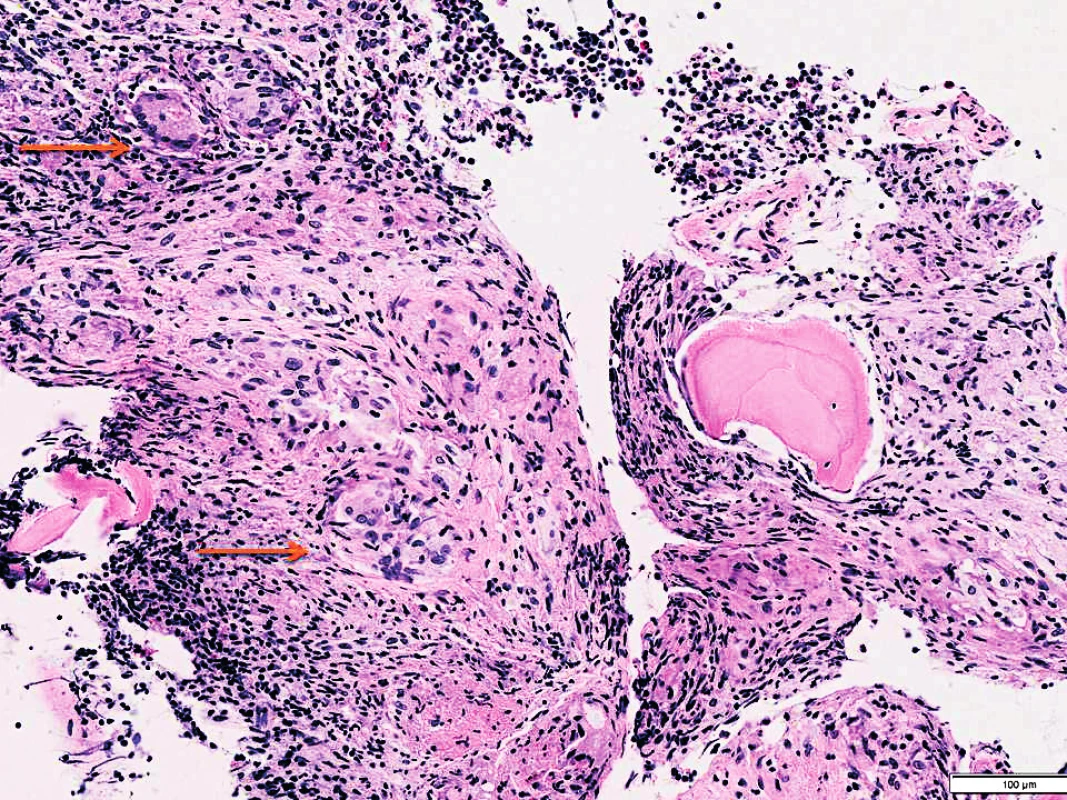
DAKTYLITIDA
Daktylitida patří mezi častější muskuloskeletální projevy chronické multisystémové sarkoidózy. Byla popsána v koexistenci s lupus pernio a s dalšími formami chronické kožní sarkoidózy.
Daktylitida je obvykle symetrická, postihuje II. a III. falangy a šetří metakarpofalangeální klouby (35). Daktylitida je spojena s otokem, erytémem a má podobný vzhled jako daktylitida u psoriatické nemoci (36). Radiograficky mohou být přítomné cystické kostní léze s charakteristickým mřížkovitým či krajkovitým vzhledem. Cystické kostní léze mohou někdy vést k výrazné destrukci kloubu. Při histologickém vyšetření je přítomna tendosynovitida s nálezem granulomů (37).
MYOPATIE
Svalového postižení u sarkoidózy se může projevit jako chronická myopatie, nodulární myopatie a akutní myopatie. Myalgie jsou u pacientů se sarkoidózou častější než zdravých kontrol (35). Některá s forem myopatie je přítomna u více než poloviny všech pacientů se sarkoidózou (39), ale je symptomatická jen vzácně u méně než 3 % pacientů (40). Symptomem myopatie bývá nejčastěji celková slabost, únava a snížená tolerance námahy (41). Diagnostické potíže mohou nastat při u pacientů léčených vyššími dávkami glukokortikoidů, protože glukokortikoidy indukovaná myopatie má podobnou distribuci svalových potíží. Jednoznačné odlišení těchto dvou jednotek je možné pouze svalovou biopsií.
Chronická sarkoidní myopatie
Chronická myopatie je nejčastější, postiženi jsou obvykle nemocní ve věku 50–60 let. Symetrická proximální svalová slabost nastupuje pozvolna, mohou být postiženy také svaly trupu a krku (42). Sérové hladiny markerů svalového poškození jsou často normální, při EMG vyšetření nález odpovídá myopatickým změnám nacházeným u jiných zánětlivých myopatií (40). Svalová biopsie typicky prokazuje granulomy a buněčnou infiltraci lymfocyty a makrofágy v endomyziu a perivaskulárně (43, 44). Při vyšetření magnetickou rezonancí (MR) nacházíme obraz svalové atrofie s tukovou degenerací (45). V posledních letech využívané PET/CT vyšetření se jeví jako nejcitlivější zobrazovací metoda při diagnostice myopatie u sarkoidózy (46).
Nodulární sarkoidní myopatie
Nodulární sarkoidní myopatie je charakterizována tvorbou jednoho nebo více uzlů ve svalech (47). Symetrické postižení svalů končetin je pro tuto formu myopatie typické (44, 48). Uzly jsou často bolestivé, v průběhu onemocnění může dojít k rozvoji svalových kontraktur. Sérové hladiny markerů svalového poškození a EMG vyšetření jsou normální. Makroskopické a histologické vyšetření nachází uzlovité léze mezi svalovými svazky bez přímé souvislosti se svalovými vlákny (49). MR vyšetření je užitečné pro lokalizaci postižení u tohoto typu myopatie (50). Při MR vyšetření se jsou zjišťovány kulaté, oválné nebo vřetenovité uzly uložené podél svalových vláken (51). Centrální struktura uzlů vykazuje sníženou intenzitu signálu v důsledku přetrvávání zánětu v centrální části granulomu s následnou fibrózní přestavbou. Okrajová oblast vykazuje mírně zvýšenou intenzitu signálu v T1-váženém zobrazení pro vysoký obsah buněk a signalizuje výrazně vyšší intenzitu signálu v T2 - váženém zobrazení způsobenou periferním edémem s granulomatózním zánětem (51).
Akutní sarkoidní myopatie
Akutní myopatie je nejméně častou formou sarkoidní myopatie. Vyskytuje se obvykle u mladších pacientů do 40 let (44). Klinická manifestace je podobná jako při jiných zánětlivých myopatiích s rychlým nástupem proximální svalové slabosti, s myalgiemi, se zvýšenými sérovými hladinami kreatinkinázy. Svalová biopsie ukazuje nevýrazné granulomy s výraznou lymfocytární infiltrací svalu (52).
SARKOIDNÍ KOSTNÍ LÉZE
Postižení skeletu u sarkoidózy je obvykle asymptomatické a bývá zjištěno při zobrazovacím vyšetření indikovaném z jiných důvodů. Vyskytuje se u 1–15 % pacientů se sarkoidózou (53) a je často asociováno s chronickými kožními projevy sarkoidózy (54). Kostní cystické projevy v oblastech rukou a nohou a jsou častější u Afroameričanů (55). V literatuře jsou popsány tři typy kostních lézí:
- drobné léze připomínající krajku nebo jakoby vykousané od molů, provázené obvykle edémem přilehlých měkkých tkání
- lytické léze, také nazývané také kostní cysty, které se objevují jako kortikální defekty v oblasti článků prstů
- sklerotické léze lokalizované obvykle v oblasti páteře (54)
Sarkoidní kostní léze jsou nejčastěji cystické, méně často osteosklerotické nebo osteolytické. Lokalizovány jsou obvykle v proximálních a intermediálních článcích prstů, dále také v lebce, nosních kůstkách, horní čelisti, hrudní kosti, žebrech, tělech obratlů, pánvi, stehenní kosti a bércové kosti zvláště v oblasti kotníků. Z důvodu rostoucího využití nových zobrazovacích metod (PET/CT nebo MR) jsou tyto změny častěji nalézány v oblasti axiálního skeletu (56). Hladiny vápníku a alkalické fosfatázy v séru jsou typicky normální i při vícečetném výskytu těchto lézí, což lze využít v diferenciální diagnostice při odlišení od kostních projevů Pagetovy choroby, osteomalacie a kostních metastáz maligních onemocnění (56).
PRINCIPY LÉČBY
Léčba sarkoidózy by měla být vedena pneumologem a stejně tak i léčba muskuloskeletálních projevů sarkoidózy by měla být s pneumologem konzultována. Indikací k systémovému podání glukokortikoidů u plicní sarkoidózy je významná porucha plicních funkcí nebo výrazné subjektivní potíže, jako jsou kašel a dušnost. Pokud onemocnění přes léčbu glukokortikoidy progreduje, měla by být zvážena kombinovaná terapie s imunosupresivy, nejčastěji s methotrexátem či leflunomidem. Těžké formy onemocnění s fibrotickou přestavbou plicního parenchymu mohou také být indikaci k transplantaci plic. Mimoplicní postižení sarkoidózou vyžaduje léčbu podle závažnosti projevů. Asymptomatické postižení většinou není třeba léčit, u některých změn stačí lokální léčba glukokortikoidy (přední oční segment). Některé formy kožní sarkoidózy vyžadují naopak intenzivní systémovou léčbu. Většina pacientů s muskuloskeletálními projevy s asymptomatickým a neprogredujícím onemocněním má dobou vyhlídku na spontánní remisi, a proto nevyžaduje specifickou léčbu. Löfgrenův syndrom je často spontánně regredující onemocnění a v mnoha případech je dostatečné podání nesteroidních antiflogistik (57). U pacientů se závažnějším průběhem onemocnění nebo při známkách orgánového poškození jsou lékem volby glukokortikoidy. Prednison v dávce 10–20 mg/den obvykle dostatečný pro kontrolu akutní artritidy u sarkoidózy. U pacientů s chronickou formou artritidy je možné podávat nižší dávky glukokortikoidů (24). Sarkoidní myopatie se léčí glukokortikoidy ve stejných dávkách jako při léčbě idiopatických myozitid. Neexistují žádné randomizované kontrolované studie zabývající se léčbou této formy myopatie. Glukokortikoidy jsou účinné v léčbě akutní a nodulární myopatie, méně efektní bývají při chronické formě myopatie u sarkoidózy. Přes počáteční efekt glukokortikoidů dochází nezřídka k recidivám onemocnění (48). Efektní mohou být intralesionální injekce triamcinolonu přímo do bolestivých nodulárních lézí (58). Kostní postižení je obvykle spojeno s chronickou formou sarkoidózy s multiorgánovým postižením. Kostní léze samy o sobě, pokud nejsou symptomatické, obvykle nevyžadují léčbu. Glukokortikoidy mohou zmírnit edém měkkých tkání, ale nevedou ke zlepšení již přítomných strukturálních změn kosti (59). Glukokortikoidy šetřící medikace je vhodná v případech, kdy je potřeba delší dobu podávat vysoké dávky glukokortikoidů. Existují omezené údaje z kontrolovaných studií zabývajících se léčbou konkrétních orgánových manifestací sarkoidózy. Nejvíce důkazů je pro použití methotrexátu v kombinaci s glukokortikoidy v léčbě intersticiálního plicního postižení u sarkoidózy (60, 61). Z tohoto důvodu je methotrexát Světovou asociací sarkoidózy doporučen jako první linie léčby muskuloskeletálních projevů svalové a kosterní sarkoidózy. Methotrexát má zřejmě lepší efekt v léčbě objektivizované synovitidy než tendosynovitidy. Methotrexát byl použit s různým efektem v léčbě v případech ke glukokortikoidům refrakterním formám akutní sarkoidní myozitidy a při kostních projevech sarkoidózy (62–64). Leflunomid může být použit jako alternativa k methotrexátu, nicméně pro jeho použití při muskuloskeletálních projevech sarkoidózy je k dispozici jen velmi málo informací (65). Hydroxychlorochin byl použit úspěšně pro léčbu akutní artritidy a u kožního postižení (66, 67). Mykofenolát mofetil byl účinný při neurosarkoidóze (68, 69). Při renálním postižení u sarkoidózy jsou k dispozici data o použití azathioprinu a mykofenolát mofetilu z malých sériích (70). Tumor nekrotizující faktor alfa (TNF-α) hraje klíčovou roli při tvorbě granulomu u sarkoidózy a je tedy potenciálním terapeutickým cílem. Multicentrická studie s 132 pacienty se sarkoidózou prokázala dobrou klinickou odpověď při léčbě inhibitory TNF-α (v 91 % případů podán infliximab) u 64 % pacientů s neurologickými, srdečními, kožními projevy sarkoidózy a u pacientů s postižením horních dýchacích cest (71). Naproti tomu adalimumab účinný v léčbě kožního postižení u sarkoidózy (72) nepotvrdil svou účinnost ve větší randomizované kontrolované studii u plicních projevů sarkoidózy (73, 74). Pozitivní zkušenosti u jednotlivých pacientů byly zaznamenány s použitím rituximabu u sarkoidózy s kardiálním a neurologickým postižením (75–77).
Hyperkalcemie u sarkoidózy vyžaduje vždy intervenci, do které patří všeobecná opatření, jako je redukce dietního příjmu vápníku (pod 400 mmol/den) a oxalátů (riziko urolitiázy), eliminace dietní substituce vitaminu D a slunění (78–80). Farmakologická intervence zahrnuje podání glukokortikoidů ve střední dávce (Prednison 10–40 mg/denně), což potlačuje nejen aktivitu sarkoidózy, ale i produkci kalcitriolu v granulomech (81). K mírnému poklesu hladin vápníku dochází během několika dní, normalizaci hladin vápníku lze očekávat v horizontu 1–2 týdnů Další možnost léčby představuje podání bisfosfonátů (např. pamidronát), které působí prostřednictvím inhibice kostní resorpce (82), avšak nemají vliv na zánětlivou aktivitu onemocnění. Je také možné podat antimalarika, hydroxychlorochin či chlorochin ovlivňující hladiny vápníku nepřímo potlačením zánětlivé aktivity sarkoidózy (83, 84). Jelikož produkci kalcitriolu snižují také inhibitory cytochromu P450, u sarkoidózy lze použít v léčbě hyperkalcemie i ketokonazol v dávce 200–800 mg denně (85, 86). Existují rovněž kazuistiky popisující dobrý efekt inhibitoru TNF-α infliximabu u refrakterních hyperkalcemií v rámci sarkoidózy (87).
Sarkoidóza pro revmatologa představuje především diferenciálně diagnostickou výzvu při řešení některých forem akutních či chronických artropatií, myopatií, kostních lézí či nálezu hyperkalcemie. Definitivní diagnostika a komplexní vedení léčby by mělo být vždy konzultováno s pneumologem zabývajícím se problematikou sarkoidózy.
Vzniklo za podpory grantu IGA_LF_2019_006 a institucionální podpory MZ ČR MH CZ – DRO (FNOL, 00098892)–2019.
Konflikt zájmů: žádný.
MUDr. Martin Žurek
III. interní klinika NRE FN a LF UP
I. P. Pavlova 6, 779 00 Olomouc
e-mail: martin.zurek@fnol.cz
Zdroje
1. Kolek V. Sarkoidóza – dosud nepoznána (1). Interní medicína pro praxi 2007; 6 : 276–279.
2. Kolek V. Sarkoidóza – dosud nepoznána (2). Interní medicína pro praxi 2007; 7–8 : 310–313.
3. American Thoracic Society/European Respiratory Society. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of sarcoidosis and Other granulomatopus disease(WASOG) adopted by the ATS Board of Directors and the ERS Executive Commitee. Am J Respir Crit Care Med 1999; 160 : 736–755.
4. Baughman R, Teirstein A, Judson M, Rossman M, Yeager H Jr, Bresnitz E, et al. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001; 164 : 1885–1889.
5. Loštakova V, Kolek V, Vašakova M. Sarkoidóza – doporučený postup diagnostiky, terapie a sledování vývoje onemocnění – str. č. 1, Standardy ČPFS – Sekce pro intersticiální plicní procesy. http://pneumologie.cz/odborne/doc/Sarkoidoza. doc (přístup 1. 3. 2019).
6. Costabel U, Hunninghake GW. ATS/ERS/WASOG statement on sarcoidosis. Eur Respir J 1999; 14 : 735–737.
7. Heinle R, Chang C. Diagnostic criteria for sarcoidosis. Autoimmun Rev 2014; 13 : 383–387.
8. Iwai K, Tachibana T, Takemura T, Matsui Y, Kitaichi M, Kawabata Y. Pathological studies on sarcoidosis autopsy. I. Epidemiological features of 320 cases in Japan. Pathol Int 1993; 43 : 372–376.
9. Studdy PR, Bird R. Serum angiotensin converting enzyme in sarcoidosis – its value in present clinical practice. Ann Clin Biochem 1989; 26(Pt 1): 13–18.
10. Gungor S, Ozseker F, Yalcinsoy M, Akkaya E, Can G, Eroglu H, Genc NS. Conventional markers in determination of activity of sarcoidosis. Int Immunopharmacol 2015; 25 : 174–179.
11. Tebben PJ, Singh RJ, Kumar R. Vitamin D-Mediated Hypercalcemia: Mechanisms, Diagnosis, and Treatment. Endocr Rev 2016; 37 : 521–547.
12. Harrell GT, Fisher S. Blood chemical changes in Boeck’s sarcoid with particular reference to protein, calcium and phosphatase values. J Clin Invest 1939; 18 : 687–693.
13. Jacobs TP, Bilezikian JP. Clinical review: Rare causes of hypercalcemia. J Clin Endocrinol Metab 2005; 90 : 6316–6322.
14. Löfgren S. Primary pulmonary sarcoidosis 1. Acta Medica Scand 1953; 145 : 424–431.
15. Glenna’s A, Kvien TK, Melby K, et al. Acute sarcoid arthritis: occurrence, seasonal onset, clinical features and outcome. Br J Rheumatol 1995; 34 : 45–50.
16. West SG. Sarcoidosis. In: Hochberg MC, Gravallese EM, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH (eds.) Rheumatology. Philadelphia: Elsevier, 7th Ed., 2019; 1470–1477.
17. Visser H, Vos K, Zanelli E, et al. Sarcoid arthritis: clinical characteristics, diagnostic aspects, and risk factors. Ann Rheum Dis 2002; 61 : 499–504.
18. Le Bras E, Ehrenstein B, Fleck M, Hartung W. Evaluationof ankle swelling due to Lofgren’s syndrome: a pilot study using B-mode and power Doppler ultrasonography. Arthritis Care Res 2014; 66 : 318–322.
19. Pettersson T. Sarcoid and erythema nodosum arthropathies. Baillieres Best Pract Res Clin Rheumatol 2000; 14 : 461–476.
20. Maña J, Gomez-Vaquero C, Montero A, et al. Lofgren’s syndrome revisited: a study of 186 patients. Am J Med 1999; 107 : 240–245.
21. Gran JT, Bohmer E. Acute sarcoid arthritis: a favourable outcome? A retrospective survey of 49 patients with review of the literature. Scand J Rheumatol 1996; 25 : 70–73.
22. Chatham W. Rheumatic manifestations of systemic disease: sarcoidosis. Curr Opin Rheumatol 2010; 22 : 85–90.
23. Abril A, Cohen MD. Rheumatologic manifestations of sarcoidosis. Curr Opin Rheumatol 2004; 16 : 51–55.
24. Sweiss NJ, Patterson K, Sawaqed R, Jabbar U, Korsten P, Hogarth K, et. al. Rheumatologic manifestations of sarcoidosis. Semin Respir Crit Care Med 2010; 31 : 463–473.
25. Spilberg I, Siltzbach LE, McEwen C. The arthritis of sarcoidosis. Arthritis Rheum 1969; 12 : 126–137.
26. Sokoloff L, Bunim JJ. Clinical and pathological studies of joint involvement in sarcoidosis. N Engl J Med 1959; 260 : 841–847.
27. Palmer DG, Schumacher HR. Synovitis with non-specific histological changes in synovium in chronic sarcoidosis. Ann Rheum Dis 1984; 43 : 778–782.
28. Longcope WT, Preiman DG. A study of sarcoidosis: based on a combined investigation of 160 cases including 30 autopsies from the Johns Hopkins Hospital and Massachusetts General Hospital. Medicine 1952; 31 : 1.
29. Sukenik S, Hendler N, Yerushalmi B, Buskila D, Liberman N. Jaccoud’s-type arthropathy: an association with sarcoidosis. J Rheumatol 1991; 18 : 915–917.
30. Boyaci B, Hornicek F, Rosenthal D, Mankin H, Pedlow FX Jr, Carrier C, et al. Sarcoidosis of the spine. J Bone Joint Surg 2012; 94: e42.
31. Ru’a-Figueroa I, Gantes MA, Erausquin C, Mhaidli H, Montesdeoca A. Vertebral sarcoidosis: clinical and imaging findings. Semin Arthritis Rheum 2002; 31 : 346–352.
32. Kötter I, Dürk H, Saal JG. Sacroiliitis in sarcoidosis: case reports and review of the literature. Clin Rheumatol 1995; 14 : 695–700.
33. Erb N, Cushley MJ, Kassimos DG, Shave RM, Kitas GD. An assessment of back pain and the prevalence of sacroiliitis in sarcoidosis. Chest 2005; 127 : 192–196.
34. Kobak S, Sever F, Ince O, Orman M. The prevalence of sacroiliitis and spondyloarthritis in patients with sarcoidosis. Int J Rheumatol 2014; 2014 : 28945.
35. Awada H, Abi-Karam G, Fayad F. Musculoskeletal and other extrapulmonary disorders in sarcoidosis. Best Pract Res Clin Rheumatol 2003; 17 : 971–987.
36. Rothschild BM, Pingitore C, Eaton M. Dactylitis: implications for clinical practice. Semin Arthritis Rheum 1998; 28 : 41–47.
37. Pitt P, Hamilton EB, Innes EH, Morley KD, Monk BE, Hughes GR. Sarcoid dactylitis. Ann Rheum Dis 1983; 42 : 634–639.
38. Hinz A, Fleischer M, Brähler E, Wirtz H, Bosse-Henck A. Fatigue in patients with sarcoidosis, compared with the general population. Gen Hosp Psychiatry 2011; 33 : 462–468.
39. Silverstein A, Siltzbach LE. Muscle involvement in sarcoidosis:asymptomatic, myositis, and myopathy. Arch Neurol 1969; 21 : 235–241.
40. Wolfe SM, Pinals RS, Aelion JA, Goodman RE. Myopathy in sarcoidosis: clinical and pathologic study of four cases and review of the literature. Semin Arthritis Rheum 1987; 16 : 300–306.
41. Marcellis RG, Lenssen AF, Elfferich MD, De Vries J, Kassim S, Foerster K, Drent M. Exercise capacity, muscle strength and fatigue in sarcoidosis. Eur Respir J 2011; 38 : 628–634.
42. Maeshima S, Koike H, Noda S, Noda T, Nakanishi H, Iijima M, et al. Clinicopathological features of sarcoidosis manifesting as generalized chronic myopathy. J Neurol 2015; 262 : 103–145.
43. Prayson RA. Granulomatous myositis. Clinicopathologic study of 12 cases. Am J Clin Pathol 1999; 112 : 63–68.
44. Le Roux K, Streichenberger N, Vial C, Petiot P, Feasson L, Bouhour F, et al. Granulomatous myositis: a clinical study of thirteen cases. Muscle Nerve 2007; 35 : 171–177.
45. Moore SL, Teirstein A, Golimbu C. MRI of sarcoidosis patients with musculoskeletal symptoms. Am J Roentgenol 2005; 185 : 154–159.
46. Cremers JP, Van Kroonenburgh MJ, Mostard RL, et al. Extent of disease activity assessed by 18F-FDG PET/CT in a Dutch sarcoidosis population. Sarcoidosis Vasc Diffuse Lung Dis 2014; 31 : 37–45.
47. Koyama T, Ueda H, Togashi K, Umeoka S, Kataoka M, Nagai S. Radiologic manifestations of sarcoidosis in various organs. RadioGraphics 2004; 24 : 87–104.
48. Fayad F, Liote’ F, Berenbaum F, Orcel P, Bardin T. Muscle involvement in sarcoidosis: a retrospective and followup studies. J Rheumatol 2006; 33 : 98–103.
49. Jamal MM, Cilursu AM, Hoffman EL. Sarcoidosis presenting as acute myositis. Report and review of the literature. J Rheumatol 1988; 15 : 1868–1871.
50. Aptel S, Lecocq-Teixeira S, Olivier P, Regent D, Teixeira PG, Blum A. Multimodality evaluation of musculoskeletal sarcoidosis: imaging findings and literature review. Diagn Interv Imaging 2016; 97 : 5–18.
51. Otake S. Sarcoidosis involving skeletal muscle: imagingfindings and relative value of imaging procedures. Am J Roentgenol 1994; 162 : 369–375.
52. Fujita H, Ishimatsu Y, Motomura M, Kakugawa T, Sakamoto N, Hayashi T, et al. A case of acute sarcoid myositis treated with weekly low-dose methotrexate. Muscle Nerve 2011; 44 : 994–999.
53. Neville E, Carstairs LS, James DG. Sarcoidosis of bone. Q J Med 1977; 46 : 215–227.
54. James DG. Dermatological aspects of sarcoidosis. Q J Med 1959; 28 : 108–124.
55. Wilcox A, Bharadwaj P, Sharma OP. Bone sarcoidosis. Curr Opin Rheumatol 2000; 12 : 321–330.
56. Sparks JA, McSparron JI, Shah N, Aliabadi P, Paulson V, Fanta CH, et al. Osseous sarcoidosis: clinical characteristics, treatment, and outcomes – experience from a large, academic hospital. Semin Arthritis Rheum 2014; 44 : 371–379.
57. Baughman RP, Lower EE. Medical therapy of sarcoidosis. Semin Respir Crit Care Med 2014; 35 : 391–406.
58. Janssen M, Dijkmans BA, Eulderink F. Muscle cramps in the calf as presenting symptom of sarcoidosis. Ann Rheum Dis 1991; 50 : 51–52.
59. Johns CJ, Michele TM. The clinical management of sarcoidosis. A 50-year experience at the Johns Hopkins Hospital. Medicine 1999; 78 : 65–111.
60. Baughman R, Lower E. A clinical approach to the use ofmethotrexate for sarcoidosis. Thorax 1999; 54 : 742–746.
61. Vorselaars AD, Wuyts WA, Vorselaars VM, Zanen P, Deneer VH, Veltkamp M, et al. Methotrexate vs azathioprine in second-line therapy of sarcoidosis. Chest 2013; 144 : 805–812.
62. Cremers JP, Drent M, Bast A, Shigemitsu H, Baughman RP, Valeyre D, et al. Multinational evidencebased World Association of Sarcoidosis and Other Granulomatous Disorders recommendations for the use of methotrexate in sarcoidosis: integrating systematic literature research and expert opinion of sarcoidologists worldwide. Curr Opin Pulm Med 2013; 19 : 545–561.
63. Braun J, Rau R. An update on methotrexate. Curr Opin Rheumatol 2009; 21 : 216–223.
64. Kaye O, Palazzo E, Grossin M, Bourgeois P, Kahn MF, Malaise MG. Low-dose methotrexate: an effective corticosteroid-sparing agent in the musculoskeletal manifestations of sarcoidosis. Br J Rheumatol 1995; 34 : 642–644.
65. Sahoo DH, Bandyopadhyay D, Xu M, Pearson K, Parambil JG, Lazar CA, et al. Effectiveness and safety of leflunomide for pulmonary and extrapulmonary sarcoidosis. Eur Respir J 2011; 38 : 1145–1150.
66. Jones E, Callen JP. Hydroxychloroquine is effective therapy for control of cutaneous sarcoidal granulomas. J Am Acad Dermatol 1990; 23(3 Pt 1): 487–489.
67. Doherty CB, Rosen T. Evidence-based therapy for cutaneous sarcoidosis. Drugs 2008; 68 : 1361–1383.
68. Moravan M, Segal BM. Treatment of CNS sarcoidosis with infliximab and mycophenolate mofetil. Neurology 2009; 72 : 337–340.
69. Bitoun S, Bouvry D, Borie R, Mahevas M, Sacre K, Haroche J, et al. Treatment of neurosarcoidosis: a comparative study of methotrexate and mycophenolate mofetil. Neurology 2016; 87 : 2517–2521.
70. Hilderson I, Van Laecke S, Wauters A, Donck J. Treatment of renal sarcoidosis: is there a guideline? Overview of the different treatment options. Nephrol Dial Transplant 2014; 29 : 1841–1847.
71. Jamilloux Y, Cohen-Aubart F, Chapelon-Abric C, Maucort-Boulch D, Marquet A, Pérard L, et al. Efficacy and safety of tumor necrosis factor antagonists in refractory sarcoidosis: A multicenter study of 132 patients.Efficacy and safety of tumor necrosis factor antagonists in refractory sarcoidosis: A multicenter study of 132 patients. Semin Arthritis Rheum 2017; 47 : 288–294.
72. Pariser RJ, Paul J, Hirano S, Torosky C, Smith M. A double-blind, randomized, placebo-controlled trial of adalimumab in the treatment of cutaneous sarcoidosis. J Am Acad Dermatol 2013; 68 : 765–773.
73. Antoniu SA, Baughman RP, Drent M, Kavuru M. Infliximab therapy in patients with chronic sarcoidosis and pulmonary involvement. Am J Respir Crit Care Med 2006; 174 : 795–802.
74. Judson MA, Baughman RP, Costabel U, Drent M, Gibson KF, Raghu G, et al. Safety and efficacy of ustekinumab or golimumab in patients with chronic sarcoidosis. Eur Respir J 2014; 44 : 1296–307.
75. Bomprezzi R, Pati S, Chansakul C, Volimer T. A case of neurosarcoidosis successfully treated with rituximab. Neurology 2010; 75 : 568–570.
76. Krause ML, Cooper LT, Chareonthaitawee P, Amin S. Successful use of rituximab in refractory cardiac sarcoidosis. Rheumatology 2016; 55 : 189–191.
77. Segal BM. Neurosarcoidosis: diagnostic approaches and therapeutic strategies. Curr Opin Neurol 2013; 26 : 307–313.
78. Tebben PJ, Singh RJ, Kumar R. Vitamin D-Mediated Hypercalcemia: Mechanisms, Diagnosis, and Treatment. Endocr Rev 2016; 37 : 521–547.
79. Harrell GT, Fisher S. Blood chemical changes in Boeck’s sarcoid with particular reference to protein, calcium and phosphatase values. J Clin Invest 1939; 18 : 687–693.
80. Jacobs TP, Bilezikian JP. Clinical review: Rare causes of hypercalcemia. J Clin Endocrinol Metab 2005; 90 : 6316–6322.
81. Manthuruthil S, Maroz N. Renal spectrum of sarcoidosis. Online SMGE books: http://smgebooks.com/sarcoidosis-diagnosis/chapters/SARD-16-05.pdf
82. Gibbs CJ, Peacock M. Hypercalcaemia due to sarcoidosis corrects with bisphosphonate treatment. Postgrad Med J 1986; 62 : 937–938.
83. O’Leary TJ, Jones G, Yip A, et al. The effects of chloroquine on serum 1,25-dihydroxyvitamin D and calcium metabolism in sarcoidosis. N Engl J Med 1986; 315 : 727–730.
84. Barré PE, Gascon-Barré M, Meakins JL, Goltzman D. Hydroxychloroquine treatment of hypercalcemia in a patient with sarcoidosis undergoing hemodialysis. Am J Med 1987; 82 : 1259–1262.
85. Conron M, Beynon HL. Ketoconazole for the treatment of refractory hypercalcemic sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2000; 17 : 277–280.
86. Tercelj M, Rott T, Rylander R. Antifungal treatment in sarcoidosis-a pilot intervention trial. Respir Med 2007; 101 : 774–778.
87. Huffstutter JG, Huffstutter JE. Hypercalcemia from sarcoidosis successfully treated with infliximab. Sarcoidosis Vasc Diffuse Lung Dis 2012; 29 : 51–52.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2019 Číslo 2- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Lze ovlivnit strukturální progresi u pacientů s axiální spondyloartritidou?
- Sarkoidóza muskuloskeletálního systému
- Sexuální dysfunkce u systémové sklerodermie
- Nový cíl v léčbě psoriatické artritidy: Proč interleukin 17?
- Abstrakta XVI. semináře mladých revmatologů 16.–18. května 2019, XVI. seminář mladých revmatologů
- „In viridi“ aneb Ve šlépějích Karla
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sarkoidóza muskuloskeletálního systému
- Sexuální dysfunkce u systémové sklerodermie
- Nový cíl v léčbě psoriatické artritidy: Proč interleukin 17?
- Lze ovlivnit strukturální progresi u pacientů s axiální spondyloartritidou?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



