-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kardiovaskulární komorbidity a ateroskleróza u systémového lupus erythematodes
Cardiovascular comorbidities and atherosclerosis in systemic lupus erythematosus
The aim of the study was to detect subclinical atherosclerosis by measuring the thickness of intima media and its relation to cardiovascular manifestations, traditional risk factors, clinical manifestations, immunological profile and selected laboratory markers.
Methods:
Patients were screened between March 2015 and January 2016. Forty-two patients with SLE (5 men, 37 women) were examined. Traditional risk factors, clinical manifestations, immunological profile, disease activity and cumulative damage with SELENA-SLEDAI 2K and SLICC scoring systems, cumulative dose of glucocorticoids, disease duration, and presence of cardiovascular events were assessed in these patients. The results were evaluated statistically.Results:
Pathological IMT was found in 10 patients (23.8%), plaque presence in 7 respondents (13.7%). Subclinical atherosclerosis evaluated by at least one parameter was detected in 14 patients (33%). IMT correlated (p ≤0.05) with the age of patients, age at diagnosis, duration and intensity of smoking, history of ischemic heart disease and stroke, SLICC damage index, low platelet count and C3 complement, and high titer of IgG and IgM anti-cardiolipin antibodies. The presence of plates correlated with age, age at diagnosis, length and intensity of smoking “pack years”, history of ischemic heart disease, SLICC damage index, and low platelet count.Conclusion:
IMT and plaque detection are very important markers of subclinical atherosclerosis. In our series and in many other studies, these parameters correlate with traditional risk factors and disease activity, and they are a good prognostic factor for the presence of cardiovascular comorbidities..Key words:
Systemic lupus erythematosus, cardiovascular comorbidities, atherosclerosis, intima media thickness
Autoři: A. Smržová; P. Horák
Působiště autorů: Fakultní nemocnice a Univerzita Palackého, Olomouc ; III. interní klinika – nefrologická, revmatologická a endokrinologická
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 3, p. 141-147.
Kategorie: Originální práce
Souhrn
Cílem studie je detekce subklinické aterosklerózy pomocí měřením tloušťky intima media a její vztah ke kardiovaskulárním manifestacím, tradičním rizikovým faktorů, klinickým projevům, imunologickému profilu a vybraným laboratorním markerům.
Metody:
Pacienti byli vyšetřeni v období od března 2015 do ledna 2016. Bylo vyšetřeno čtyřicet dva pacientů se SLE (5 mužů, 37 žen). U těchto pacientů byly detekovány tradiční rizikové faktory, klinické projevy, imunologický profil, aktivita choroby a kumulativní poškození pomocí skórovacích systémů SELENA-SLEDAI 2K a SLICC, kumulativní dávka glukokortikoidů, doba trvání onemocnění, přítomnost kardiovaskulárních příhod. Výsledky byly zhodnoceny statisticky.Výsledky:
Patologické IMT bylo zjištěno u 10 pacientů (23,8 %), přítomnost plátů u 7 respondentů (13,7 %). Subklinická ateroskleróza hodnocená alespoň jedním parametrem byla detekována u 14 pacientů (33 %). IMT korelovalo (p ≤ 0,5) s věkem pacientů, s věkem v době diagnózy, délkou a intenzitou kouření, anamnézou ischemické choroby srdeční a cévní mozkové příhody, indexem poškození SLICC, nízkou hladinou trombocytů a C3 komplementu, vysokým titrem antikardiolipinových protilátek IgG i IgM. Přítomnost plátů korelovala s věkem, věkem v době diagnózy, délkou a intenzitou kouření „kouřoroky“, anamnézou ICHS, indexem poškození SLICC a nízkou hladinou trombocytů.Závěr:
IMT a detekce plaků jsou velmi důležité markery subklinické aterosklerózy. V našem souboru i v četných dalších studiích korelují s tradičními rizikovými faktory a aktivitou onemocnění, jsou dobrým prognostickým faktorem přítomnosti kardiovaskulárních komorbidit.Klíčová slova:
Systémový lupus erythematodes, kardiovaskulární komorbidity, ateroskleróza, tloušťka intima media
Nemoci oběhové soustavy jsou na prvním místě v příčině úmrtí ve všeobecné populaci. V České republice v roce 2015 činil podíl kardiovaskulárních příhod na celkové standardizované úmrtnosti 43 % (u mužů to bylo 41,8 %, u žen 44,9 %) (1). Profil úmrtnosti na kardiovaskulární onemocnění a revmatologické diagnózy shrnuje graf 1. V celkových číslech by se mohlo zdát, že úmrtnost spojená se systémovými chorobami pojiva je nízká, je však třeba vzít v potaz fakt, že řada úmrtí je finálně přiřazena jiným jednotkám a komorbiditám, které mohou se systémovými chorobami úzce souviset (1). Nejde ale jen o úmrtnost pacientů, systémové choroby pojiva jsou spojeny rovněž s vyšší nemocností. V pracovní neschopnosti pro diagnóze systémové choroby pojiva bylo v roce 2012 12,1/100 000 pacientů s průměrnou délkou pracovní neschopnosti 80,2 dne. Rovněž počet hospitalizací činil nezanedbatelné číslo, 47 000 s průměrnou délkou hospitalizace 7,4 dne (1).
Graf 1. Úmrtnost na kardiovaskulární a revmatologická onemocnění v České republice (počet/100,000 obyvatel). Data: Ústav zdravotnických informací a statistiky České republiky 2015. 
Systémový lupus erythematodes (SLE) je typickým představitelem systémové choroby pojiva s četnými orgánovými manifestacemi a komplikacemi, kdy kardiovaskulární projevy jsou na předním místě v morbiditě i mortalitě pacientů. Vysoké riziko kardiovaskulárních příhod u pacientů s SLE bylo popsáno již v roce 1976 (2). Urowitz a Gladman popsali bimodální model úmrtnosti pacientů se SLE, kdy první vrchol přisoudili aktivitě choroby. Druhý, pozdější nárůst úmrtnosti souvisel s pozdními manifestacemi a komplikacemi choroby s nárůstem indexu poškození a také vedlejšími účinky léčby. Zlepšením diagnostických a léčebných metod SLE se právě druhý vrchol nárůstu úmrtí stává důležitým terapeutickým a preventivním cílem. Poslední studie ukazují, že pacienti s SLE mají 2,66krát větší riziko kardiovaskulárních příhod než běžná populace (3). Tradiční rizikové faktory nejsou jediným parametrem způsobujícím aterosklerózu u systémového lupusu. Po adjustaci rizikových faktorů je relativní riziko nefatálního infarktu 10,1, ischemické srdeční choroby 7,5, cévní mozkové příhody 7,9 a smrti v důsledku ischemické choroby srdeční 17,0 (4). Zvyšuje se také potřeba i délka hospitalizace pacientů s SLE (5). Vzhledem k těmto skutečnostem se jeví detekce subklinické aterosklerózy u pacientů s SLE jako velmi důležitá složka účinné prevence.
Metody
V naší studii jsme se zaměřili na detekci tloušťky intima media (intima media thickness – IMT) a přítomnost aterosklerotických plátů u pacientů se SLE. V období od března 2015 do ledna 2016 bylo vyšetřeno 42 pacientů s SLE (5 mužů, 37 žen) splňujících klasifikační kritéria ACR (American College of Rheumatology) pro SLE (6). Průměrný věk činil 40,2 (± 12,4) let a délka trvání choroby 10,4 (± 6,7) let. U pacientů s SLE jsme hodnotili klinické manifestace a anamnézu kardiovaskulárních příhod, kde pokladem je ateroskleróza (ischemická choroba srdeční manifestovaná jako angina pectoris, infarkt myokardu či srdeční selhání, cévní mozková příhoda – CMP). Jednalo se o diagnózy stanované kardiologem či neurologem dle doporučení jednotlivých společností identifikované rozborem dokumentace pacienta. Hodnotila se aktivita choroby a index poškození (určení remise, skórovací systémy SLEDAI-2K a SLICC) (7, 8). Byly zhodnoceny tradiční rizikové faktory. Obezita a nadváha hodnocena pomocí BMI (hmotnostně – výškový index). Kouření se hodnotilo anamnesticky dle dokumentace a dle rozhovoru s nemocným. Dyslipidémie byla stanovena jako minimálně jeden patologický laboratorní odběr – celkového cholesterolu, triglyceridů, HDL a LDL cholesterolu. Z dalších rizikových faktorů byla zjišťována přítomnost diabetu a arteriální hypertenze dle doporučení České diabetologické a Kardiologické společnosti (9, 10). Byla spočtena průměrná a kumulativní dávka glukokortikoidů jako významný rizikový faktor aterosklerózy. Z laboratorních parametrů byly hodnoceny high sensitivity C-reaktivní protein (hsCRP, při vyloučení infekční příčiny jeho elevace – norma 0–5 mg/l), lipidogram (celkový cholesterol – 2,9–5,0 mg/l, patologické hodnoty nad 5,0 mg/l, triglyceridy – 0,45–1,7 mmol/l, patologické hodnoty nad 1,7 mmol/l, lipoproteiny s vysokou hustotou – HDL – 1,2–2,7 mmol/l, patologické hodnoty pod 1,2 mmol/l, lipoproteiny s nízkou hustotou – LDL – 1,2–3,0 mmol/l, patologické hodnoty nad 3,0 mmol/l, jako dyslipidémie byl hodnocen alespoň jeden patologický nález), imunologické parametry (hladiny C3 a C4 složky komplementu – 0,98–1,97 g/l, resp. 0,12–0,4 g/l, patologické hodnoty nižší než 0,98 resp. 0,12 g/l, anti-dsDNA protilátky – pozitivní nad 20 UI/ml, antinukleozomální protilátky – ANUC – pozitivní nad 20 UI/ml). Všichni pacienti absolvovali ultrasonografické vyšetření karotického řečiště – hodnoceno jedním certifikovaným vyšetřujícím dle standardizovaného protokolu po 30 minutách klidového režimu. Byla měřena hodnota tloušťky intima media a přítomnost plátů. Hodnocena byla vrstva intimy 1 cm proximálně od bulbu karotidy, v místě bez přítomností plátů za EKG synchronizace, bylo provedeno pět vyšetření na každé straně a stanoven průměr. Přítomnost plátů byla hodnocena v celé délce karotického řečiště. V běžné populaci není jednoznačně stanovaná patologická hodnota IMT, nicméně většina prací a doporučení stanovuje patologickou hodnotu IMT nad 0,9 mm. Práce zaměřující se na věkové rozvrstvení populace a také Evropská kardiologická společnost udávají normální hodnoty respondentů mladších 40 let 0,6 mm (11, 12). K hodnocení distribuce jednotlivých dat byl použit Shapiro-Wilkův test normality. Byly hodnoceny následující modality: průměr, standardní odchylka, medián, minimální a maximální hodnota. Rozdíly mezi jednotlivými hodnocenými skupinami byly hodnoceny pomocí Mann-Whitneyho testu s korekcí. Korelace byly hodnoceny pomocí Spearmanova korelačního koeficientu. Hodnoty p < 0,05 byly považovány za statisticky významné. Ke zpracování byl použit statistický software Anova 2010.
Výsledky
Podle klinických projevů aktivity choroby (SLEDAI-2K) a imunologické aktivity (snížení komplementu, patologické hodnoty anti ds DNA) byli pacienti rozděleni do tří skupin – úplná remise (bez klinických projevů i imunologické aktivity – 8 pacientů), parciální remise (přítomnost maximálně jednoho klinického projevu hodnoceného dle SLEDAI 2K 1-4 body bez imunologické aktivity či pouze samotná imunologická aktivita – 18 pacientů) a aktivní onemocnění (klinické projevy i imunologická aktivita – 16 pacientů). Průměrná hodnota SLEDAI-2K 7,2 ± 7,3 a SLICC byla 1,2 ± 1,7. Lupusová nefritida byla prokázána u 22 nemocných. Postižení CNS vykazovalo 10 pacientů. Klasifikační hematologické projevy byly v době provedení studie přítomny u 14 nemocných a muskuloskeletární projevy v 32 případech.
Z vybraných komorbidit byla sledována přítomnost arteriální hypertenze (20 pacientů), diabetes melitus měli 4 pacienti a osteoporóza byla diagnostikována u 6 žen.
Kardiovaskulární příhody na podkladě aterosklerózy byly v anamnéze zjištěny u sedmi pacientů. Čtyři pacienti měli diagnostikovanou anginu pectoris, pět pacientů ischemickou mozkovou příhodu, u dvou pacientů byla anamnéza infarktu myokardu a u pěti srdečních selhání. Tři pacienti měli více než jednu kardiovaskulární příhodu.
V našem souboru byla průměrná délka užívání glukokortikoidů 91,6 ± 76,4 měsíců, průměrná kumulativní dávka 16,5 ± 15,7 g a průměrná denní dávka 7,9 ± 8,2 mg.
Z tradičních rizikových faktorů bylo hodnoceno BMI (průměr 24,7 ± 4,8 kg/m2), v mezích nadváhy a obezity bylo 13 pacientů (BMI nad 25 kg/m2, 30,9 %). Celkem kouřilo 13 pacientů (8 aktivních kuřáků, 19 %) a 5 exfumatorů (11,9 %), průměrná délka kouření byla 4 tzv. „kouřo-roky“ (každý den vykouřená 1 krabička – 20 cigaret po celý rok). Dyslipidémie byla přítomna u 31 pacientů (73,8 %) s hodnotou celkového cholesterolu 4,1 ± 1,4mmol/l a triglyceridů 1,7 ± 0,8 mmol/l. Diagnózu arteriální hypertenze mělo 20 respondentů (47,6 %). Hodnocení kardiovaskulárního rizika podle hsCRP bylo následující: vysoké riziko nad 5 mg/l mělo 6 pacientů (14,3 %) a stejný počet respondentů bylo ve středním riziku hsCRP 3–5 mg/l (9). Nízkou hladinu C3 složky komplementu mělo 27 pacientů (64,3 %, průměrná hodnota 0,89 ± 0,2 mg/l). Snížení C4 složky bylo zachyceno u 16 vyšetřených (38,1 %, průměrná hodnota 0,14 ± 0,06). Vysoké hladiny anti ds-DNA a antinukleozomálních protilátek byly naměřeny u 28 resp. 38 pacientů (71 %resp. 90,5 %, průměrná hodnota anti ds-DNA 70,7 ± 71UI/ml a ANUC 120,7 ± 69,9UI/ml). Profil souboru shrnuje tabulka 1.
Tab. 1. Sledované parametry souboru. 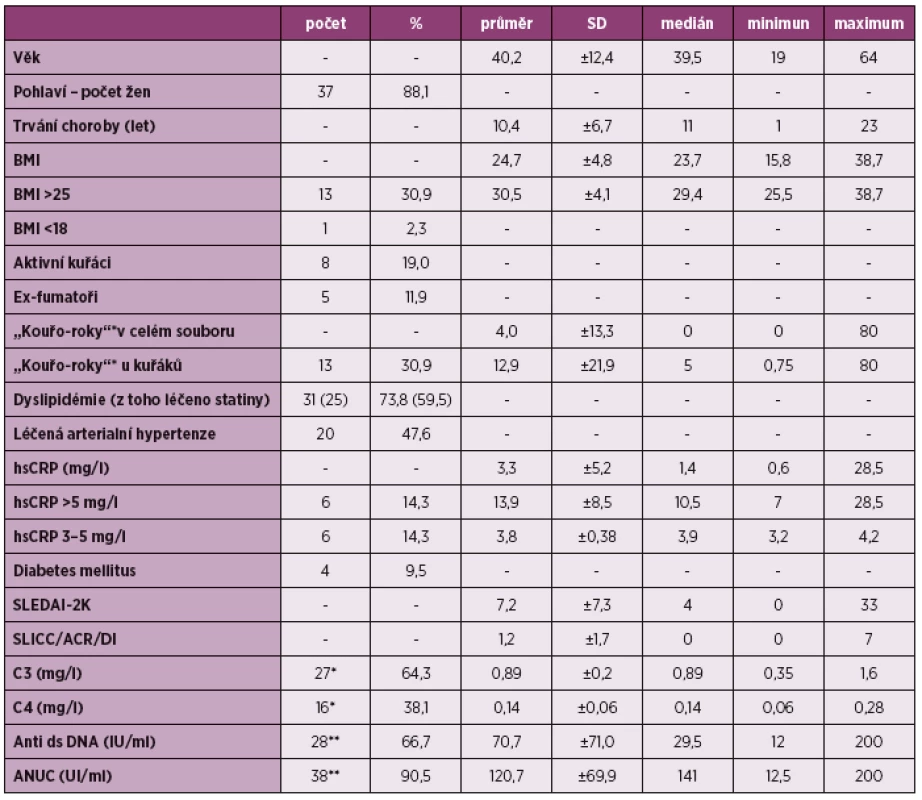
* “kouřo-roky” – počet let, kdy dotyčný kouří 20 cigaret/denně (1 krabičku) ** počet pacientů s hodnotami nižších než norma *** počet pacientů s hodnotami vyšších než norma SD – směrodatná odchylka, BMI – body mass index (hmotnostně-výškový index), hsCRP – vysoce rozlišujicí C-reaktivní protein, SLEDIA-2K – skórovací systém aktivity systémového lupusu (Systemic Lupus Erythematosus Disease Activity Index), SLICC/ACR/DI – skórovací systém hodnotící kumulativní poškození u pacientů se systémovým lupusem (Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index), C3 – složka komplementu, C4 – složka komplementu, anti ds DNA – protilátky proti dvoušroubovici DNA, ANUC – antinukleozomální protilátky Ultrasonografické měření IMT a přítomnosti plátů prokázalo nadhraniční hodnoty IMT (≥ 0,6 mm) u 10 pacientů (23,8 %) a detekované pláty u 7 respondentů (16,7 %). Přítomnost obou sledovaných parametrů byla u 3 pacientů (7,1 %). Ultrasonograficky detekovanou subklinickou aterosklerózu (přítomnost plátu či patologická hodnota IMT) jsme zjistili u 14 vyšetřených (33,3 %).
Ke statistickému zhodnocení jsme volili korelace IMT, přítomností plátů či minimálně jednoho z těchto markerů subklinické aterosklerózy s výše uvedenými parametry. Za statisticky významnou byla považována korelace s hodnotou p ≤ 0,05. Této hladiny významnosti bylo dosaženo v případě následujících porovnání:
IMT korelovalo s věkem (r = 0,61), věkem v době diagnózy (r = 0,62), délkou a intenzitou kouření „kouřoroky“ (r = 0,34), anamnézou ICHS (r = 0,38), anamnézou CMP (r = 0,37), indexem poškození SLICC (r = 0,33), hladinou trombocytů (r = -0,27), hladinou C3 (r = -0,38), antikardiolipinových protilátek IgG (r = 0,33) IgM (r=0,38) a sedimentace erytrocytů (r = 0,32). Přítomnost plátů korelovala s věkem (r = 0,40), věkem v době diagnózy (r = 0,33), délkou a intenzitou kouření „kouřoroky“ (r = 0,51), anamnézou ICHS (r = 0,50), indexem poškození SLICC (r = 0,30), hladinou trombocytů (r = -0,37).
Dalším krokem bylo zhodnocení významnosti subklinické aterosklerózy u kardiovaskulárních manifestací, které mají patofyziologický poklad právě aterosklerózu (tabulka 2). Byly zjištěny významné výskytem IMT a anginou pectoris (p = 0,005), CMP (p = 0,02), srdečním selhání (p = 0,04). Přítomnost plátů korelovala s anginou pectoris (p > 0,001). Přítomnost patologické IMT nebo plátů korelovala s anginou pectoris (p = 0,001), CMP (p = 0,008), infarktem myokardu (p = 0,02). Pokud jsme hodnotili pacienty s minimálně jednou kardiovaskulární příhodou, korelovaly obě hodnocení subklinické aterosklerózy s tím, že jejich kombinace vykazovala signifikanci velmi výraznou p = 0,009.
Tab. 2. Korelace IMT a přítomnosti plátů s kardiovaskulárními manifestacemi. Tabulka ukazuje počet pacientů s patologickou IMT (nad 0,6 mm) a přítomností plátů ve skupině s s/bez uvedených kardiovaskulárních příhod. Poslední řádek sumarizuje korelace přítomnosti subklinické aterosklerózy u 7 pacientů s anamnézou alespoň jedné kardiovaskulární příhody. 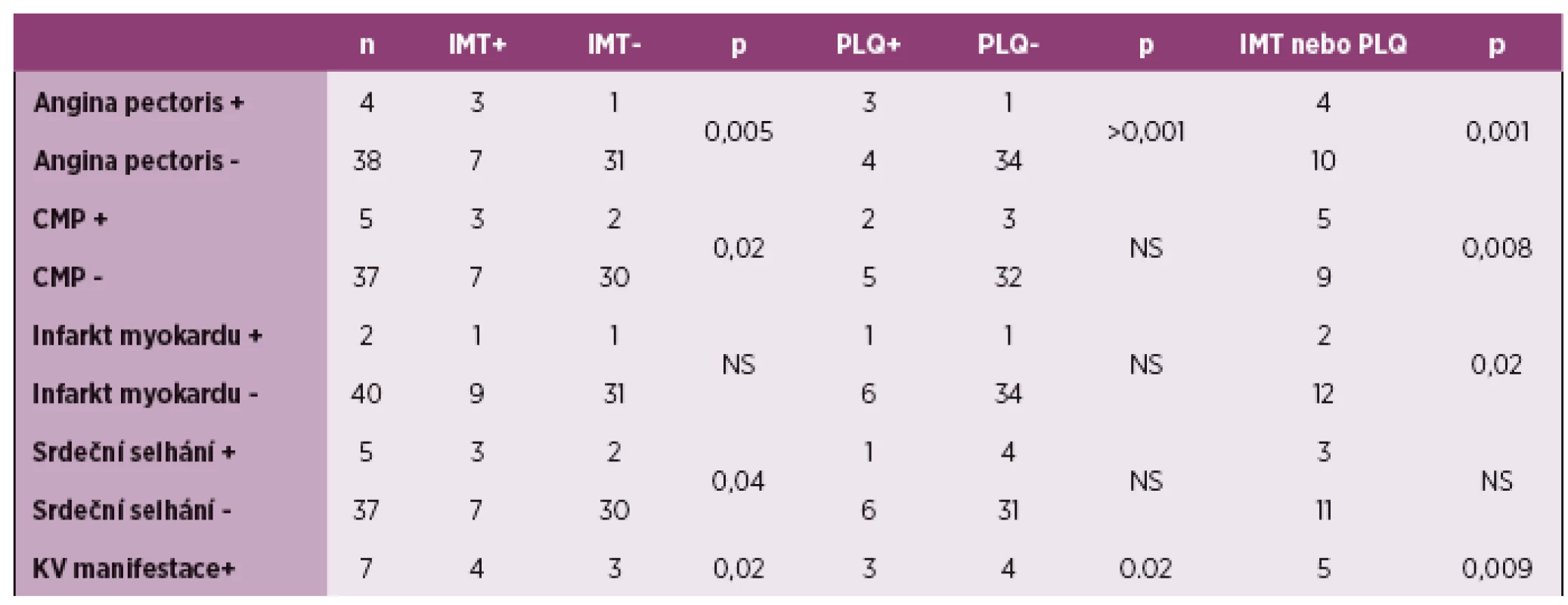
IMT – tloušťka intima media, PLQ – ateroslerotický plát, CMP – cévní mozková příhoda, KV – kardiovaskulární, NS – nesignifikantní Pacienti s kardiovaskulární příhodou měli v 71 % verifikovanou subklinickou aterosklerózu (hodnoceno alespoň jedním z parametrů). Naopak pacienti bez kardiovaskulární příhody měli v 21 % přítomnou subklinickou aterosklerózu (graf 2 a 3).
Graf 2. Přítomnost aterosklerózy dle měření tloušťky intima media či aterosklerotického plátu u pacientů se systémovým lupus erythematodes a kardiovaskulární příhodou. 
Graf 3. Přítomnost aterosklerózy dle měření tloušťky intima media či aterosklerotického plátu u pacientů se systémovým lupus erythematodes bez kardiovaskulární příhody. 
Diskuse
Ateroskleróza je závažný aspekt vedoucí k onemocněním s vysokou mortalitou a morbiditou pacientů. Je velmi důležité aktivně detekovat jak tradiční, tak specifické rizikové faktory aterosklerózy a zaměřovat se na prevenci jejího vzniku. Zánětlivá revmatická onemocnění, zvláště pak systémový lupus erythematodes mají vysoké riziko tzv. akcelerované aterosklerózy.
V roce 2016 byla publikovaná metaanalýza subklinické aterosklerózy u SLE zahrnující 80 studií, jednalo se o 6 085 pacientů s SLE a 4 794 zdravých kontrol (13). Z metaanalýzy vyplývá, že nemocní s SLE mají signifikantně vyšší hodnoty tloušťky intima media oproti zdravým kontrolám. Rozdíl činil v průměru 0,07 mm (p < 0,001). Pacienti s SLE také vykazovali častější výskyt aterosklerotických plátů, i když byly sledovány jen v 23 % klinických studií (4417 pacientů s SLE a 3528 zdravých kontrol). Četnost detekovaných plátů byla 23,6 % u pacientů s SLE a 13,0 % v kontrolní skupině. Poměr šancí (odd ratio, OR) činí 2,45 (95 % CI: 2,02, 2,97; p < 0,001).
Kouření je nejsilnějším tradičním rizikovým faktorem vedoucím k ateroskleróze. Kuřáci s SLE mají třikrát vyšší riziko kardiovaskulárních příhod (15). Zároveň kouření snižuje účinnost antimalarik (chlorochin a hydroxychlorochin), která působí částečně antiaterogenně (16). Vliv vysokého arteriálního tlaku na vznik a progresi aterosklerózy byl prokázána v dvojitě zaslepené studii s vysokým počtem pacientů (200 respondentů). Zvláště hodnoty systolického tlaku nad 120 mmHg korelovaly s přítomností aterosklerotických plátů, detekovaných ultrasonograficky a CT kalciovým skóre (17). Dyslipidémie, nejvíce hodnoty celkového cholesterolu, koreluje s kardiovaskulárními manifestacemi nejen v běžné populaci, ale i u pacientů s SLE (18). Na lipidový profil má navíc vliv užívaní glukokortikoidů, kdy dávky vyšší než 7,5 mg denně zvyšují celkový cholesterol (19). Glukokortikoidy také mění rozložení tuku na rizikové ukládání v abdominální oblasti a zvyšují také prevalenci metabolického syndromu, který je u SLE až 32 % (20). Aktivní onemocnění je rizikovým faktorem vzniku aterosklerózy. Byla prokázána např. souvislost s hladinou anti dsDNA protilátek (3).
V našem souboru jsme se zabývali významem měření subklinické aterosklerózy a její korelace s výskytem kardiovaskulárních příhod. Mladé ženy s SLE mají až 50krát častější výskyt infarktu myokardu než jejich zdravé vrstevnice (21). Od toho se odvíjí i častější hospitalizace pro diagnózu infarktu myokardu, která je u SLE pacientů celkově 2,27krát častější, než v běžné populaci. 3,8krát častěji mají pacienti s SLE městnavou srdeční slabost a 2,05krát častěji projevy cévní mozkové příhody (4). Relativní riziko vzniku infarktu myokardu je pak 10,1, pro manifestaci cévní mozkové příhody 7,9, celkové relativní riziko aterosklerózy u SLE je 7,1 (22).
Registr LUMINA (multicentrický, multietnický), sledující prospektivně 637 nemocných s SLE stanovil roční incidenci kardiovaskulárních onemocnění na 6,2 %, infarktů myokardu na 2 %, CMP na 2,8 % (23). Kanadská prospektivní kohorta 1 249 nemocných udává incidenci kardiovaskulárního onemocnění 5,7 %, IM 1,1 % a CMP 1,8 %. Rizikovými skupinami v obou kohortách byli nemocní pocházející z bílé populace, muži, pacienti s pozdějším věkem vzniku SLE, obézní, kuřáci, nemocní s hypertenzí a familiárním výskytem kardiovaskulárních onemocnění. Větší riziko se pojilo s pozitivitou antikardiolipinových protilátek, hs-CRP a vyšším indexem poškození (SLICC) při zařazení do studie (23, 24). Ve srovnání se všeobecnou populací je prevalence kardiovaskulárních projevů u SLE vysoká.
Překládaná práce navazuje na naši studii hodnotící kardiovaskulární příhody ve vztahu k dalším parametrů aktivity systémového lupusu (25). Hodnocení poukazuje na přítomnost kardiovaskulárních komorbidit u třetiny sledovaných pacientů, jednalo se však i o pacienty s tromboembolizační příhodou. Kardiovaskulární příhody korelovaly jak s tradičními rizikovými faktory (obezita, patologický obvod pasu a boků, kouření, s celkovým cholesterolem, LDL, poměrem celkového cholesterolu a HDL cholesterolu, apolipoproteiny A1 a B), tak s parametry aktivity onemocnění, jako SLEDAI, hsCRP, přítomnost kardiolipinových protilátek a lupus antikoagulans vykazovaly hraniční signifikanci (25).
V naši studii jsme prokázali významnou souvislost aterosklerózy s kardiovaskulárními komorbiditami. U pacientů s SLE s kardiovaskulárních příhodou se v 71 % jednalo o patologické hodnoty IMT nebo přítomnost plátů. Ve skupině bez kardiovaskulárních příhod se vyskytovala ateroskleróza v 21 %.
Detekce subklinické aterosklerózy naskýtá tedy velký prostor pro primární prevenci kardiovaskulárních komorbidit. Nutnost aktivního screeningu a prevence kardiovaskulárních manifestací u SLE reflektují také evropská i česká doporučení pro léčbu pacientů se systémovým lupus erythematodes (26). Při vstupní návštěvě a pak minimálně jedenkrát ročně se doporučuje cíleně detekovat kardiovaskulární příhody, hodnotit tradiční rizikové faktory, kompenzaci arteriální hypertenze, kontrola lipidového spektra a glykémie.
Grantová podpora:
MH CZ - DRO (FNOl, 00098892); MZ CR VES15-28659A
adresa pro korespondenci:
MUDr. Andrea Smržová
III. IK, FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
andrea.smrzova@fnol.cz
Zdroje
1. Zdravotnická ročenka České republiky 2015. http://uzis.cz/node/7693
2. Urowitz MB, Bookman AA, Koehler BE, et al. The bimodal mortality pattern of systemic lupus erythematosus. Am J Med 1976; 60 : 221–225.
3. Magder LS, Petri M. Incidence of and risk factors for adverse cardiovascular events among patients with systemic lupus erythematosus. Am J Epidemiol 2012; 176 : 708–719.
4. Esdaile JM, Abrahamowicz M, Grodzicky T, et al. Traditional Framingham risk factors fail to fully account for accelerated atherosclerosis in systemic lupus erythematosus. Arthritis Rheum 2001; 44 : 2331–2337.
5. Shah MA, Shah AM, Krishnan E. Poor outcomes after acute myocardial infarction in systemic lupus erythematosus. J Rheumatol 2009; 36 : 570–575.
6. Petri M, Orbai AM, Alarcon 6) GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64 : 2677–86.
7. Bombardier C, Gladman DD, Urowitz MB, et al. Derivation of the SLEDAI. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE. Arthritis Rheum 1992; 35 : 630–40.
8. Gladman DD, Goldsmith CH, Urowitz MB, et al. The Systemic Lupus International Collaborating Clinics/American College of Rheuma-tology (SLICC/ACR) Damage Index for Systemic Lupus Erythema-tosus International Comparison. J Rheumatol 2000; 27 : 373–276.
9. http://www.diab.cz/dokumenty/standard_labor_2012.pdf
10. Filipovský J, et al. Summary of 2013 ESH/ESC Guidelines for the management of arterial hypertension. Prepared by the Czech Society of Hypertension/Czech Society of Cardiology. Cor et Vasa 2014; 56: e494–e518.
11. https://www.escardio.org/Journals/E-Journal-of-Cardiology-Practice/Volume-13/Intima-media-thickness-Appropriate-evaluation-and-proper-measurement-described
12. Veller MG1, Fisher CM, Nicolaides AN, Renton S, Geroulakos G, Stafford NJ, Sarker A, Szendro G, Belcaro G. Measurement of the ultrasonic intima-media complex thickness in normal subjects. J Vasc Surg 1993; 17(4): 719–25.
13. Pearson TA, Mensah GA, Alexander RW et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centres for Disease Control and Prevention and the American Heart Association. Circulation 2003; 107(3): 499–511.
14. Wu GC, Liu HR, Leng RX, Li XP, Li XM, Pan HF, Ye DQ. Subclinical atherosclerosis in patients with systemic lupus erythematosus: A systemic review and meta-analysis. Autoimmun Rev 2016; 15(1): 22–37.
15. Urowitz MB, Gladman D, Ibañez D, et al. Clinical manifestations and coronary artery disease risk factors at diagnosis of systemic lupus erythematosus: data from an international inception cohort. Lupus 2007; 16 : 731–5.
16. Kreuter A, Gaifullina R, Tigges C, et al. Lupus erythematosus tumidus: response to antimalarial treatment in 36 patients with emphasis on smoking. Arch Dermatol 2009; 145 : 244–8.
17. Kiani AN, Post WS, Magder LS, et al. Predictors of progression in atherosclerosis over 2 years in systemic lupus erythematosus. Rheumatology (Oxford) 2011; 50 : 2071–79.
18. Wierzbicki AS. Lipids, cardiovascular disease and atherosclerosis in systemic lupus erythematosus. Lupus 2000; 9(3): 194–201.
19. Petri M, Lakatta C, Magder L, Goldman D. Effect of prednisone and hydroxychloroquine on coronary artery disease risk factors in systemic lupus erythematosus: a longitudinal data analysis. Am J Med 1994; 96(3): 254–9.
20. Urowitz MB et al. Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2010; 62(6): 881–7.
21. Urowitz MB et al. Atherosclerotic vascular events in a single large lupus cohort: Prevalence and risk factors. J Rheumatol 2007; 34 : 70–5.
22. Chung CP, Avalos I, Oeser A, et al. High prevalence of the metabolic syndrome in patients with systemic lupus erythematosus: association with disease characteristics and cardiovascular risk factors. Ann Rheum Dis 2007; 66 : 1542–43.
23. Urowitz MB et al. Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2010; 62(6): 881–7.
24. Toloza SM et al. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA). XXIII. Baseline predictors of vascular events. Arthritis Rheum 2004; 50(12): 3947–57.
25. Smržová A et al. Cardiovascular events in patients with systemic lupus erythematosus, Cor et Vasa 2014; 56: e144–e151.
26. Horák P, Tegzová D, Závada J, Olejárová M, Skácelová M, Smržová A, Žurek M. Doporučení ČRS pro léčbu nemocných se SLE. Čes Revmatol 2013; 21 : 3–14.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2017 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
Nejčtenější v tomto čísle- Současné možnosti terapie entezitid
- Vzdelávání všeobecných sester
- Nástin genetické architektury primární hyperurikémie a dny
- Kardiovaskulární komorbidity a ateroskleróza u systémového lupus erythematodes
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



