-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přesná diagnostika jednotlivých forem renální osteopatie v rámci minerálové a kostní nemoci při chronickém onemocnění ledvin
Accurate diagnosis of various forms of renal osteopathy in chronic kidney disease - mineral and bone disorder
Background:
Targeted and safe treatment of chronic kidney disease – mineral and bone disorder (CKD-MBD) can be determined on the basis of comprehensive histomorphometry of particular forms of bone disease with the presence of ordinary components. In patients with high cardiovascular risk both extreme forms of renal osteopathy (RO) can be expected in a relatively high percentage according to the rate of bone turnover with a fundamentally different therapy for each form.Objective:
The aim of this open, prospective pilot study is a comprehensive histomorphometry of renal osteopathy in chronic dialysis patients, assessment of the relationship between selected serum markers of bone resorption and formation and histomorphometric parameters of RO, and introduction of this method into routine practice in the high-risk group of patients with chronic renal insufficiency.Patients:
12 chronic dialysis patients (N-12, 8 women and 4 men, average age 74 years, average duration of dialysis treatment 38 months) with high cardiovascular calcification index (CCI).Methods:
Samples of bone tissue were obtained by trepanobiopsy and histomorphometrically evaluated using static and dynamic parameters of renal osteopathy. Static parameters include the determination of the volume and thickness of trabecular and spongiosa bone. Dynamic parameters were determined by identifying the tetracycline lines. Biochemical characteristics of the cohort included examination of serum markers related to bone formation and resorption. Other cohort characteristics comprised parathyroid gland volume, Z-score by DEXA examination, diagnosis of diabetes mellitus and duration of dialysis treatment.Results:
Statistically significant positive correlations (p<0.01) were demonstrated between the volume of bone trabeculae and type I procollagen and calcitonin, between the osteoid thickness and type I procollagen and the trabecular bone volume and serum osteocalcin. Furthermore, a statistically significant association was found between the Crosslaps, type I collagen C-telopeptides and Z-score using DEXA examination. An association between the tetracycline lines, bone volume and trabecular thickness was found, as well as between osteoid volume and the volume of bone trabeculae with the duration of dialysis treatment. Moreover, a relationship was demonstrated between the PT volume and type I procollagen.Conclusion:
Changes in calcium and phosphorus metabolism belong to the clinically and pathogenetically significant complications of chronic renal insufficiency. In complex cases and in patients at risk a bone biopsy with histomorphometrical examination for a comprehensive assessment of bone changes in CKD-MBD (K/ DOQi, ERA-EDTA recommendations) remain the gold standard.Klíčová slova:
minerálová a kostní nemoc při chronickém onemocnění ledvin, histomorfometrie kostní tkáně, chronická renální insuficience
Autoři: K. Žamboch 1; J. Zahálková 2; Z. Kosatíková 1; P. Skýpalová 3; J. Škarda 3; J. Zadražil 1
Působiště autorů: III. interní klinika-NRE, FN a LF UP v Olomouci 1; Nemocnice Šternberk, hemodialyzační oddělení, Středomoravská nemocniční, člen společnosti Agel, Šternberk 2; Ústav Patologie, FN a LF UP v Olomouci 3
Vyšlo v časopise: Čes. Revmatol., 20, 2012, No. 1, p. 20-28.
Kategorie: Původní práce
Souhrn
Východisko:
Cílenou a bezpečnou léčbu minerálové a kostní nemoci při chronickém onemocnění ledvin (MBD-CKD) je možné stanovit na základě komplexní histomorfometrie jednotlivých forem kostní choroby se zastoupením řadových složek. U pacientů s vysokým kardiovaskulárním rizikem lze očekávat v relativně vysokém procentu obě krajní formy renální osteopatie (RO) podle rychlosti kostního obratu, přičemž cílená léčba se zásadně liší.Cíl:
Cílem otevřené, pilotní prospektivní studie je komplexní histomorfometrie renální osteopatie u chronicky dialyzovaných pacientů, posouzení vztahu mezi vybranými sérovými markery osteoresorpce/osteonovotvorby k histomorfometrickým parametrům RO, zavedení metody do rutinní praxe u rizikové skupiny nemocných s CHRI.Soubor:
12 chronicky dialyzovaných pacientů (N-12, 8 žen, 4 muži, průměrný věk 74 let, průměrná délka dialyzačního léčení 38 měsíců) s vysokým kardiovaskulárním kalcifikačním indexem (CCI).Metodika:
Odběry kostní tkáně trepanobiopticky a její histomorfometrické zhodnocení se statickými a dynamickými parametry renální osteopatie. Statické parametry zahrnovaly stanovení objemu a síly složek trabekulární a spongiózní kosti. Dynamické parametry byly určeny identifikací tetracyklinových linií. Biochemická charakteristika souboru zahrnovala vyšetření sérových markerů ve vztahu k novotvorbě i osteoresorpci. Ostatní charakteristiky souboru tvořily objem příštitných tělísek, Z-skóre pomocí DEXA vyšetření, diagnóza diabetu mellitu a délka dialyzační léčby.Výsledky:
Pozitivní signifikantní korelace na 0,01 hladině významnosti byly prokázány mezi objemem kostního trámce a prokolagenem 1 a kalcitoninem, mezi sílou osteoidu a prokolagenem 1 a mezi objemem trabekulární kosti a sérovou hodnotou osteokalcinu. Statistická souvislost byla dále mezi Cross-laps, C-tel. kolagenu 1 a Z-skóre dle DEXA vyšetření. Byl prokázán vztah mezi tetracyklinovými liniemi, objemem kostní tkáně a sílou kostního trámce a mezi objemem osteoidu a objemem kostního trámce s délkou dialyzační léčby. Prokázaná souvislost byla i mezi objemem PT a prokolagenem 1.Závěr:
Mezi klinicky a patogeneticky významné komplikace CHRI (chronické renální insuficience) patří změny fosfokalciového metabolismu. Ve složitých případech a u rizikových pacientů zůstává zlatým standardem kostní biopsie s histomorfometrickým vyšetřením ke komplexnímu posouzení kostních změn MBD-CKD (doporučení K/DOQi, ERA-EDTA).Klíčová slova:
minerálová a kostní nemoc při chronickém onemocnění ledvin, histomorfometrie kostní tkáně, chronická renální insuficienceÚvod
Chronické selhání ledvin je významné onemocnění s řadou medicínských, sociálních a ekonomických důsledků. Mezi klinicky a patogeneticky významné komplikace provázející prakticky všechna stadia CHRI patří změny fosfokalciového metabolismu. Patofyziologii kostního metabolismu je v poslední době věnována velká pozornost pro její již prokázaný úzký vztah k cévním změnám a tedy ke kardiovaskulárním onemocněním. Onemocnění kostí při snížené funkci ledvin bývá značně heterogenní a rozsah postižení je ovlivněn celou řadou patogenetických faktorů, navíc pokročilost změn se může často dynamicky měnit, nejen v průběhu času či vlivem léčby, ale i zásahem řady dílčích více či méně známých činitelů (1). Dynamicky a stále se v čase měnící struktura kostní tkáně a nepřímé sérové ukazatele těchto složitých patogenetických mechanismů se následně stávají terapeutickým problémem, navíc při uvědomění si vzájemných interakcí dnes prokázaného spojení “ledvina-kost-céva”.
Hlavní pilíře prevence kostní nemoci zahrnují zejména správnou korekci koncentrací kalcia v extracelulární tekutině, opakovanou a cílenou korekci hyperfosfatémie, dále v indikovaných případech suplementaci aktivního vitaminu D za prevence rozvoje syndromu overtreatment, nemalou roli hraje i kontrola a eventuální normalizace metabolické acidózy. Léčba by měla zajistit také co možná nejmenší výskyt mimokostních komplikací a takové výstupní hodnoty ukazatelů fosfokalciového metabolismu, které by byly spojeny s nejnižší možnou morbiditou a mortalitou, zejména kardiovaskulární. Konečným cílem pro všechna léčebná opatření v léčbě MBD-CKD je dosažení takových parametrů vnitřního prostředí, zejména fosfokalciového metabolismu, které by umožnily co možná “normální” kostní metabolismus, tedy stav, kdy kost se svojí strukturou a schopností remodelace co nejvíce blíží zdravé tkáni člověka bez onemocnění ledvin. Samotná prevence MBD-CKD není tedy zaměřená jen na správnou léčbu kostní patologie, ale zohledňuje i přístup k prokázané souvislosti s poškozením kardiovaskulárního systému a patologicky probíhajících dějů v endokrinním systému. Nejdůležitějším preventivním faktorem je udržení vyrované bilance fosfátů, s omezením jejich příjmu, případně se snížením střevní resorpce pomocí fosfátových vazačů (1, 2, 3). Fosfor totiž hraje klíčovou roli na několika patogenetických mechanismech. Aby tato opatření byla účinná, musí být zahájena včas. Všechny ostatní známé léčebné prostředky již jen mírní následky rozvoje závažné choroby.
Renální osteopatie a její typy
Renální osteopatie (RO) termín, který byl dříve užíván jako obecné označení celého komplexu odchylek souvisejících s poruchou fosfokalciového metabolismu, zahrnujících nemoc kostí i příštítných tělísek, je dnes rezervován pouze pro popis kostních změn při této chorobě. Kostní komponenta MBD-CKD představuje heterogenní skupinu pěti základních forem postižení (osteitis fibrosa, mírná forma renální osteodystrofie, smíšená forma, osteomalacie, adynamická forma renální osteodystrofie) (2, 4), jejichž procentuální zastoupení se v průběhu let s vývojem diagnostiky a léčby MBD-CKD mění. Přibývá pozvolna pacientů s osteitis fibrosa, s osteomalacií a adynamickou formou, mění se denzita kostní tkáně. Jednotlivé typy RO se liší svým vztahem k závažným klinickým projevům, které ovlivňují nejen kvalitu života pacientů, ale především jejich prognózu. Současně ale prediktivní hodnota hlavních laboratorních ukazatelů kostního metabolismu a i dalších metod (hodnocení kostní denzity) není pro jednotlivé formy RO příliš vysoká. Kostní denzitometrie umožní sice posoudit případný stupeň ztráty kostního minerálu, vzhledem ale k patogenezi RO může, ale i nemusí být kostní minerál snížen. Hlavní nevýhodou hodnocení kostní denzity pomocí DEXA vyšetření je nemožnost rozlišení mezi trabekulární a kortikální kostí, přičemž při RO je relativně zachována trabekulární kost, zatímco kortikální kost je výrazně snížená. Proto při selhání ledvin riziko fraktur nekoreluje s výsledky měření kostní denzity pomocí DEXA vyšetření. U pacientů s CHRI se k posouzení míry úbytku kostní tkáně doporučuje, je-li provedeno DEXA vyšetření, používat Z-skóre (kostní denzita vztažená k věku, pohlaví, rase) a rozdělení kostní denzity do dvou kategorií, a to normální resp. vysoká kostní denzita a nízká kostní denzita (1). Kostní biopsie s kostní histomorfometrií tak zůstává zlatým standardem diagnostiky MBD-CKD (2).
RO je pouze jednou ze tří neoddělitelných složek MBD-CKD a její diagnózu lze určit jednoznačně pouze bioptickým vyšetřením, proto také KDIGO (Kidney Disease: Improving Global Outcome) skupina podmínila její stanovení výhradně histomorfometrickým průkazem (1, 2, 3). Rovněž stanovila TMV klasifikaci (tab. 1), při které jsou vyšetřovány tři parametry: kostní obrat, mineralizace a objem kostní hmoty. Kostní obrat je určen aktivitou osteoklastů a osteoblastů, mineralizace znamená ukládání vápníku a fosforu do vytvořené kostní matrix a kostní hmota je posuzována nejen podle objemu kosti, ale také podle síly kortikalis a současně podle porozity kosti. Každá z výše uvedených složek může být normální, zvýšená či snížená, resp. normální či abnormální (1). Bioptické vyšetření odvápněných i neodvápněných vzorků je zaměřeno zejména na stupeň demineralizace kostních trámců, relativní objem kostního trámce, objem trabekulární kosti, zhodnocení šířky kostních trabekul, stanovení počtu osteoklastů na jednotku spongiózní kosti, určení procenta osteoidních lemů, tloušťky kostního trámce a tloušťky osteoidu, dále i stanovení jak dynamických (při identifikaci tetracyklinových linií), tak i statických parametrů kostní choroby (4). RO zahrnuje různé podtypy choroby s podstatnými rozdíly v etiologii, klinickém obraze a zejména v přístupu k léčbě. V dlouhodobém horizontu dialyzovaných pacientů je výskyt jednotlivých typů RO prakticky 100%. Spektrum kostních změn u dialyzovaných pacientů je dáno celou řadou faktorů, zejména délkou dialyzačního léčení, věkem, přítomností diabetu mellitu, typem dialyzační techniky, farmakoterapií a dalšími doposud méně známými faktory (2, 5, 6). Bioptické vyšetření vzorků kostí, histomorfometrická diagnostika forem kostní choroby, umožňuje kvantifikovat jednotlivé složky i projevy kostní choroby, s možností stanovení přesných forem a zastoupení řadových složek, což je významné s ohledem na nastavení terapie, kterou dosud predikujeme pouze nepřímo, a bohužel někdy nepřesně, dle některých laboratorních výsledků.
Tab. 1. TMV klasifikace renální osteopatie. 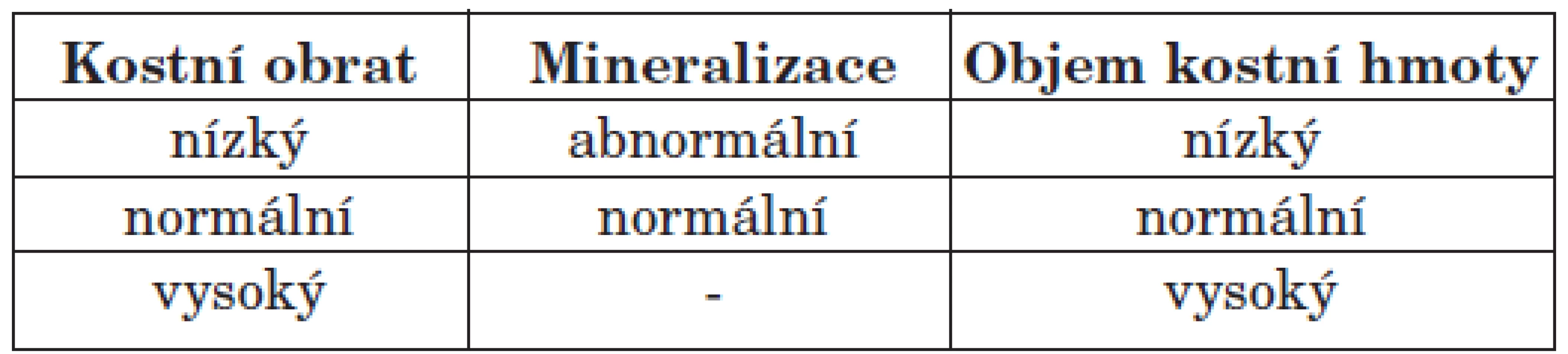
Kostní choroba s převahou změn typu fibrózní osteodystrofie vzniká v přímé souvislosti s hyperparathyreózou (HPT) sekundárního typu (7, 8). Charakterizuje ji různý stupeň osteoklastické resorpce s usurací kostních trámců až jejich rozrušením, se současně probíhající fibrotizací mezidřeňových prostor a kompenzatorní novotvorbou kostní tkáně. Patogeneze sekundární hyperparathyreózy (sHPT) je dána změněnou úlohou parathormonu (PTH) v organismu při pokročilé poruše funkce ledvin, který může ke korekci přítomné hypokalcemie využít jen kostní resorpci a současná hyperfosfatémie a nízká biologická dostupnost kalcitriolu vedou k rozvoji bludného kruhu opakovaně stimulující příštitná tělíska (PT) ke zvýšené tvorbě a sekreci PTH.
Druhou nejčastější formou kostní choroby je osteomalacie, pro kterou je typický nález osteoidních lemů na kostním povrchu jako obraz nemineralizované periferní části kostních trámců. Bioptické vyšetření vzorků kostí jednoznačně stanoví diagnostickou jednotku choroby s určením nejen kvalitativních a kvantitativních změn kostní tkáně, ale i statických (objem trabekulární kosti, povrch kostních trámců, šířka kostních trabekul) a dynamických parametrů (průměr kostní formace, frekvence aktivace, čas mineralizace) při předchozím dvojitém značení tetracyklinem.
U třetího typu RO, adynamické kostní choroby, nejenže chybějí osteoblasty a osteoklasty, ale není přítomen ani osteoid. Tetracyklinem se neoznačí prakticky žádné kostní povrchy, a proto se mluví o tzv. „mrtvé kosti“. Současná stoupající incidence adynamické formy nemoci je dávána do souvislosti s délkou dialyzačního léčení, nárůstem prevalence diabetu, nižšími koncentracemi PTH, věkem pacientů, vyšší zastoupení bývá též u pacientů léčených peritoneální dialýzou (5, 9), (tab. 2).
Tab. 2. Stavy s častějším výskytem adynamické kostní choroby (ABD). 
Nejčastější formou kostní nemoci je typ smíšený, vyskytující se až u 80% dialyzovaných nemocných, který je dán kombinací fibrózní osteodystrofie a osteomalacie.
Na úrovni buněčné a molekulární podstaty kostních změn má významnou úlohu systém RANK-RANKL, umožňující funkční interakci mezi oběma typy kostních buněk, tedy součinnost osteoklastů resorbujících a osteoblastů syntetizujících kostní matrix (1, 5). Spřažený vztah mezi základními kostními buňkami, tedy vazba jak na receptor tak na ligandu, může být pozměněn vlivem velkého množství určitých i dosud neznámých faktorů. K dlouhodobě studovaným látkám zasahujících do tohoto systému patří osteoprotegerin, který plní v buňkách hladké cévní svaloviny a v endoteliálních buňkách autokrinní funkci zajišťující přežívání buněk a jako fyziologicky se vyskytující decoy receptorů pro RANKL se podílí na vztahu k zabránění aktivace osteoklastů (10). Jeho zvýšené koncentrace při chronické renální insuficienci bývají dávány do souvislosti s adynamickou kostní chorobou. K dalším neméně významným složkám vstupujícím do změn kostní remodelace patří kostní morfogenní proteiny, faktory podobné inzulinu, celé spektrum a síť cytokinů (IL-1, IL-6, TNF), které ovlivňují počet i aktivitu obou typů kostních buněk (1, 6). Klíčovými faktory patogeneze MBD-CKD jsou deficit D hormonu, hyperfosfatémie a deficit kalcitriolu. V každém stupni CHRI je nutné myslet na probíhající kostní změny, často je monitorovat a dle tíže je buď ponechat v dispenzarizaci, či zahájit adekvátní terapii. Při opomenutí těchto změn dochází k poškození skeletu, cév a měkkých tkání.
Cévní složce kostní nemoci je v dnešní době věnována velká pozornost vzhledem k dominující problematice kardiovaskulárních komplikací u pacientů s CHRI. Je prokázáno, že samotné chronické onemocnění ledvin je spojeno s vysokou kardiovaskulární úmrtností mnohonásobně převyšující mortalitu populace bez renálního postižení, kterou nelze vysvětlit pouhou přítomností klasických komorbidit a rizikových faktorů (11, 12). Při klesající funkci ledvin se mění účinek hormonů a látek účastnících se řízení systémové a lokální regulace kostní remodelace. Výsledkem působení těchto složitých a často protichůdných dějů vzniká struktura kosti odrážející rychlost kostního obratu a ukazující na aktuální poměr mezi novotvorbou resp. odbouráváním. Kostní tkáň patogeneticky změněná vykazuje nedostatečnou schopnost kosti vyrovnávat změny tělesné bilance minerálů. V případě vysokoobratových forem renální osteopatie se nestačí rychle uvolněné fosfáty a kalcium zabudovávat zpět do kosti, na druhé straně při nízkoobratové osteopatii s resorpcí lehce převyšující osteomalacii chybí schopnost kosti ukládat minerální látky do kostní matrix. Homeostázu obou minerálů ovlivňuje dále množství fostátů a kalcia obsaženého v dietním příjmu, užití kalciových vazačů fosfátů či léčba sHPT. Tyto složky vedou k pozitivní bilanci fosfátů. Rovněž mnohdy dochází k přetěžování organismu i kalciem. Je to dáno zejména zvýšeným vstřebáváním kalcia ze zažívacího traktu nebo pozitivní intradialyzační bilancí. Výsledkem pak bývá kladná bilance fosfátů a kalcia, která v případě porušené kostní tkáně vede k depozici minerálů do jiných míst. Postižení cév pacientů se selháním ledvin je tedy multifaktoriální a zahrnuje nejen změny v důsledku depozice kalcia a fosforu, ale i souběžnou komplexní dysfunkci endotelu. Při klesající funkci ledvin dochází ke změně látek mající vztah ke kostní remodelaci a tím k atypickému poměru mezi novotvorbou a odbouráváním kostní tkáně. Nerovnováha bilance minerálů, zejména kalcia a fosforu, má za následek jejich ukládání na jiných místech, predilekčně v měkkých tkáních s rozvojem cévní komponenty minerálové a kostní nemoci, s ovlivněním funkčních kardiovaskulárních vlastností a významným zhoršením prognózy pacientů s chronickým onemocněním ledvin (11, 13, 14). Postižení cévní složky se při snížené renální funkci rozvíjí poměrně rychle a přítomnost kalcifikací tento proces ještě akceleruje (11, 15). Samotné tepenné kalcifikace se liší nejen svojí cévní a anatomickou lokalizací, ale jejich vznik je ovlivněn i věkem pacientů a stadiem CHRI. Zatímco pro aterosklerózu je typická fokální anatomická lokalizace s predilekčním postižením intimy a s distálními, ischemickými důsledky tohoto procesu, pro arteriosklerózu jsou příznačné difuzní anatomické lokalizace se změnami v medii cév, jejichž následkem pak bývá vyšší tuhost cév, nižší poddajnost cévní stěny a zvýšený afterload srdce. Podíl obou typů kalcifikací na celkovém obraze uremické vaskulopatie se u jednotlivých pacientů různí. Zatímco u mladších pacientů se setkáváme častěji s projevy arteriosklerózy, ve vyšším věku se přidávají dále změny aterosklerotické. Oběcně lze řící, že čím je pacient déle veden s diagnózou CHRI a má vyšší věk, tím více se u něj setkáme s kalcifikačními změnami cév (11, 12).
Klinický obraz a farmakologické možnosti renální osteopatie
Klinická manifestace renální osteopatie bývá často zcela bezpříznaková, může být ovlivněna řadou sekundárních změn, jakými jsou sekundární osteoporóza, amyloidóza nebo je modifikována souběžně přítomnou neuropatií, poruchami výživy či komorbiditami (1). Většina symptomů RO se objevuje v pozdější fázi choroby a je spojena s muskuloskeletálním systémem. Bolesti kostí se objevují zpravidla již na počátku onemocnění, obvykle mají neurčitý a difuzní charakter s častějším výskytem v bederní oblasti, pánvi a dolních končetinách. Někdy je pro pacienta obtížné bolest lokalizovat. Plně vyjádřený klinický obraz zahrnuje různé stupně intenzity bolesti kostí, hlavně difuzního charakteru, pruritus, svalovou slabost, opakované fraktury kostí, dále ruptury šlach, extraoseální kalcifikace či fenomén kalcifylaxe - zahrnující vaskulopatii arteriol s nekrózami kůže a podkoží (12). Klinický obraz jednotlivých typů RO je podobný.
Farmakoterapeutické možnosti doznaly v posledních letech nebývalého rozvoje při poznání detailů patogeneze kostní choroby a umožnily posunout léčbu až na úroveň ovlivňování funkce receptorů. Hlavní části léčby kostně cévní nemoci zasahují tedy nejen do jednotlivých složek této poruchy, ale i do jednotlivých patogenetických mechanismů, závisí a aktuálně se mění podle stupně poruchy renální funkce. Nejdůležitějšími terapeutickými cíli je zabránit úbytku kostní hmoty, omezit hyperplázii příštitných tělísek a zabránit vzniku kalcifikací, progresi aterosklerózy a dysfunkci kardiovaskulárního aparátu (1, 5). Základní léčebné prostředky ovlivňují jednotlivé složky fosfokalciového metabolismu - zvýšenou hodnotu fosfátů a parathormonu, deficit kalcitriolu a hypokalcémii.
Soubor a metodika
Cílem otevřené, pilotní, prospektivní studie byla komplexní histomorfometrie vysoce rizikových dialyzovaných pacientů, zavedení metody do rutinní praxe a posouzení RO k vybraným složkám MBD-CKD. Součástí metodiky bylo stanovení statických a dynamických parametrů histomorfometrie kostní tkáně. Vzorek kosti byl odebírán z hřebene kosti kyčelní speciálním trepanem. Tato oblast je přístupná odběru a představuje dobrý reprezentativní vzorek kostní tkáně. Odběr byl prováděn ambulantně v LA 2% Mesokainem, kdy po průniku kůži a podkožím byla tlakem na trepan navrtána kostní spongióza a poté kompakta, krouživým pohybem byla následně odříznuta kostní tkáň. Při odběru byl současně proveden roztěrový preparát krevních elementů ke zhodnocení poměrů v kostní dřeni u dialyzovaných pacientů. Vzorky kostní tkáně byly uchovávány ve Formalinu a byly odvápněny i neodvápněny. Důvodem je skutečnost, že pouze v histologických řezech zhotovených z neodvápněných vzorků je možno spolehlivě určit stupeň demineralizace kostních trámců a identifikovat tetracyklinové linie (po předchozím užívání dvou druhů tetracyklinových preparátů), které vypovídají o rychlosti kostního obratu (metodika-17). Odvápněný preparát byl nabarven dle Goldnera, z něj pomocí mikroskopu s objektivem Plan 10x pořízena dokumentace. Následně byly získané snímky hodnoceny s využitím software pro analýzu obrazu ACC 5.0. Bioptické vyšetření vzorků bylo zaměřeno zejména na určení relativního objemu kostního trámce (v %), relativního objemu osteoidu (v %), objemu trabekulární kosti (v %), frakčního objemu osteoidu k objemu trámce (v %), k určení povrchu trámce krytého osteomem (v %), tloušťky kostního trámce a tloušťky osteoidu (v mm) a dále také ke stanovení objemu trabekulární kosti k spongióze (% osteoidu). Bioptické vyšetření stanovilo i dynamické parametry histomorfometrie kostní tkáně a to prostřednictvím identifikace tetracyklinových linií (TTC linie). Jejich průkaz byl možný při předchozím užívání tetracyklinových tablet p.o., a to dvou druhů preparátů (Doxycyklin® a Minocyklin®) v odstupu 5 týdnů. V první fázi pacienti užívali 100 mg Doxycyklinu® p.o., po dobu 3 dnů, následně po 14denní pauze v druhé fázi užívali 2x50 mg Minocyklinu® p.o. opět po dobu 3 dnů. Kostní biopsie byly prováděny v odstupu 4-6 dnů po druhé fázi. Paralelně byla dále posouzena kostní histomorfometrie ve vztahu k laboratorní složce kostní choroby a to k novotvorbě i osteoresorpci kostní tkáně (tab. 3, obr. 1). Biochemická charakteristika souboru zahrnovala vyšetření sérových markerů: vápník celkový i vázaný (mmol/l), fosfáty (mmol/l), iPTH (ng/l), kostní izoenzym alkalické fosfatázy (μg/l), kalcitonin (ng/l), 1,25-hydroxyvitamin D (pg/ml), osteokalcin (μg/l) k posouzení aktivity kostní remodelace, C-telopeptid kolagenu 1 (μg/l), crosslaps (μg/l) a prokolagen 1 (μg/l). Biochemické znaky byly vyšetřeny v čase odběru kostní tkáně, resp. v den mimo pravidelnou dialyzační léčbu. Ostatní charakteristiky souboru pak tvořily: objem příštitných tělísek (sonograficky změřeny a sečteny objemy přítomných PT v ml), Z-skóre pomocí DEXA vyšetření (denzitometrické vyšetření dvouenergiovou rentgenovou absorpciometrií), diagnóza diabetu mellitu (standardně potvrzená diagnóza DM II. typu) a délka dialyzační léčby (měsíce).
Obr. 1. Histomorfometrie kostní tkáně (Goldner 10x, osteoid červeně, kostní trámce modře) 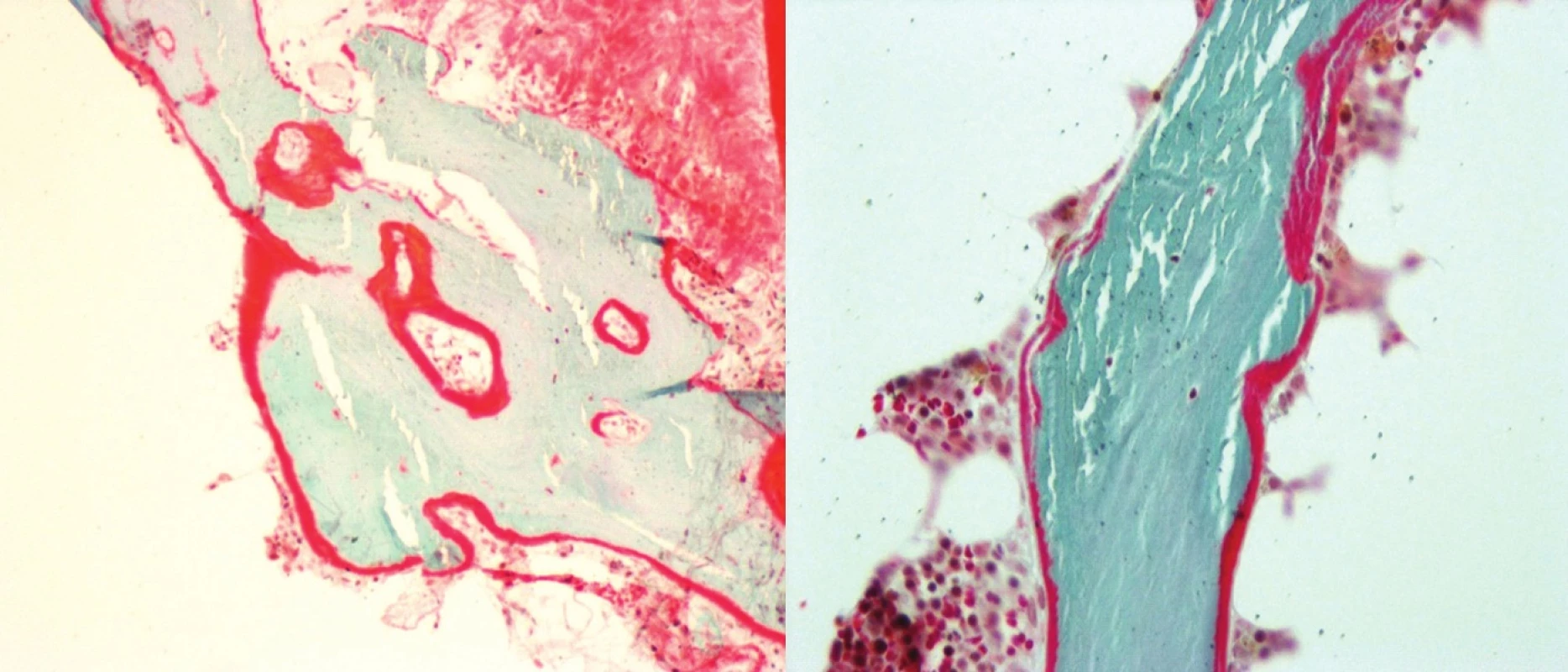
Tab. 3. Příklad histomorfometrického vyšetření kostní tkáně. 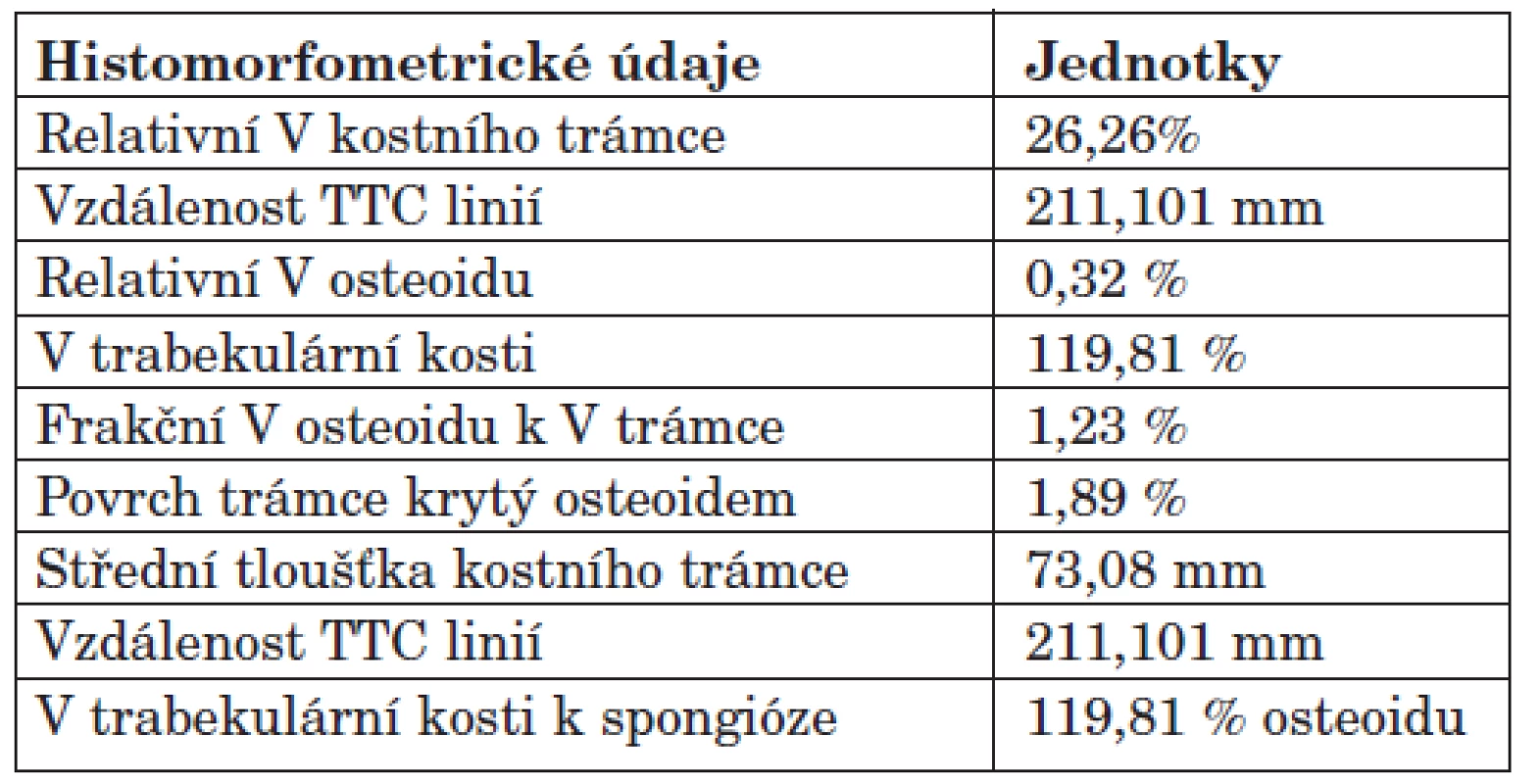
Soubor tvořilo 12 pacientů (N-12, 8 žen, 4 muži, průměrný věk 74 let, průměrná délka dialyzačního léčení je 38 měsíců). Jednalo se o chronicky dialyzované pacienty s vysokým kardiovaskulárním kalcifikačním indexem (CCI). U šesti pacientů byla prokázána kalcifikace srdečních chlopní pomocí echokardiovaskulárního vyšetření, u čtyřech pacientů kalcifikace abdominální aorty pomocí bočního snímku břicha a u dvou pacientů periferní mediokalcinóza na skiagramu s povšechnou komplikovanou aterosklerózou. Sedm pacientů mělo diabetes mellitus. Všichni pacienti podepsali informovaný souhlas s vyšetřením a splňovali kritéria pro histomorfometrické vyšetřením kostní tkáně v rámci doporučení K/DOQi a ERA-EDTA.
Statistické zpracování bylo provedeno prostřednictvím neparametrického Mann-Whitney testu, Wilcoxon testu a popisné statistiky. Byly stanoveny hodnoty korelačního koeficientu dle Spearmana (tab. 4, 5, 6). Jako pozitivní, statisticky významné signifikantní korelace, byly posuzovány hodnoty nižší než 0,05 hladina významnosti.
Tab. 4. Vztah mezi vybranými kostními znaky a sílou TTC linií (korelační koeficient Spearman, p<0,05). 
Tab. 5. Vztah mezi vybranými kostními znaky a Z-skóre dle DEXA vyšetření, délkou HD léčby (měsíce) a objemem příštitných tělísek (ml) (korelační koeficient Spearman, p<0,05). 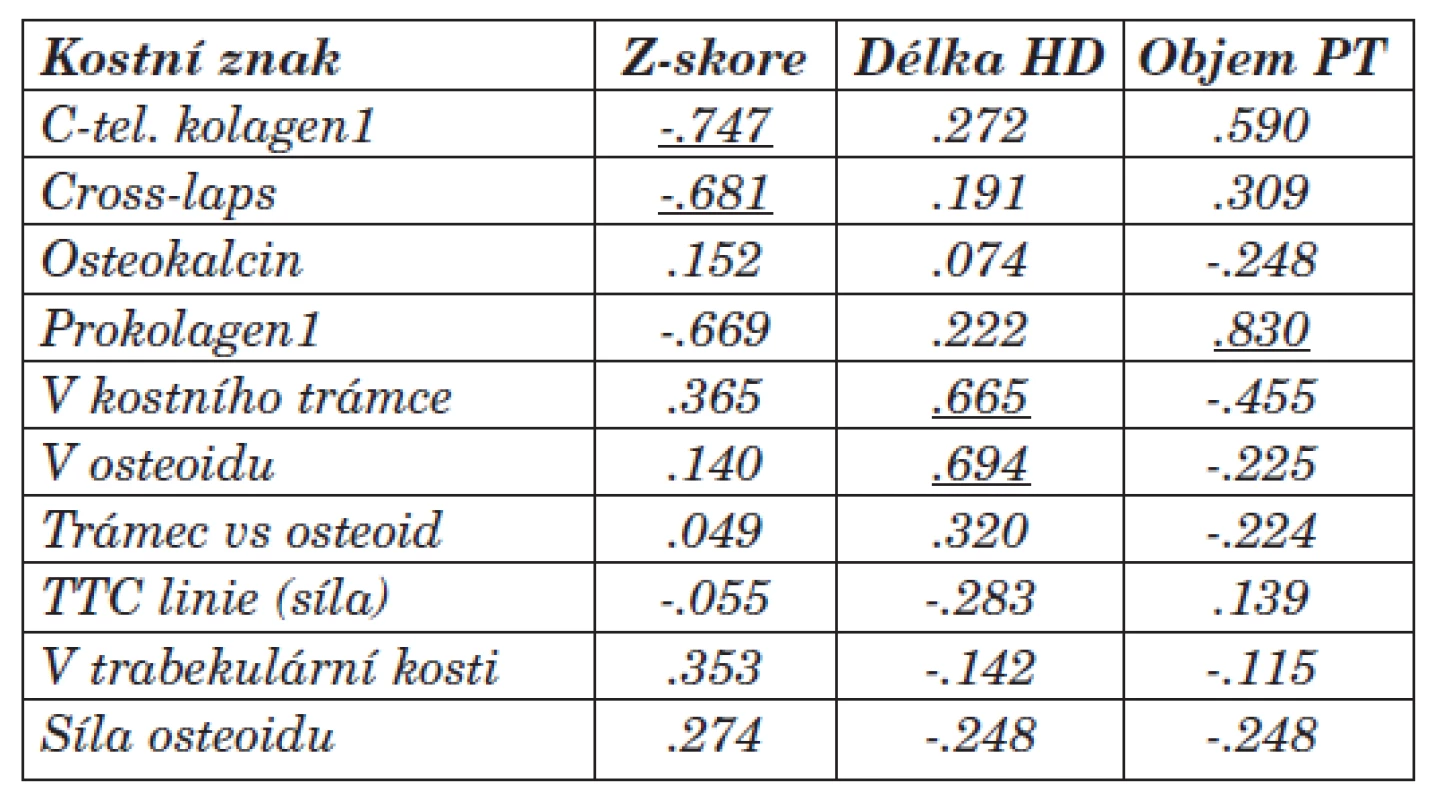
Tab. 6. Vztah mezi vybranými kostními a biochemickými znaky (korelační koeficient Spearman, p<0.05) 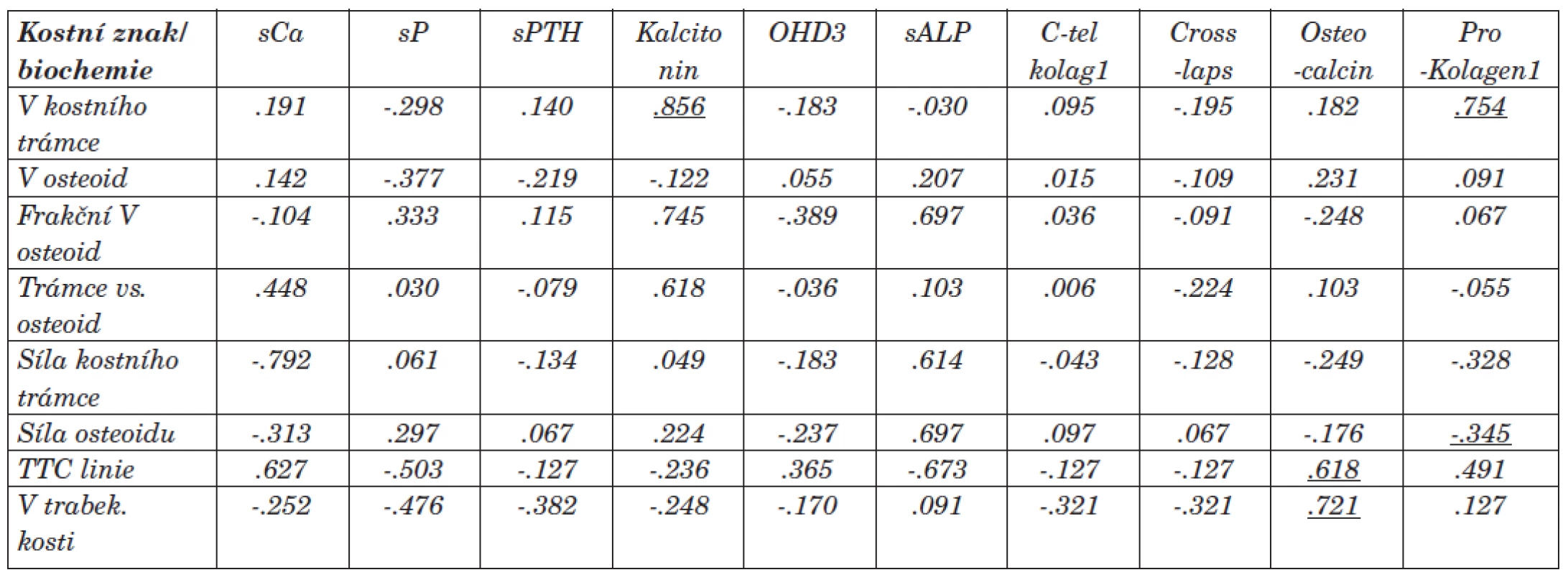
Výsledky
Prokázali jsme statistickou korelaci mezi objemem kostního trámce a prokolagenem1 a kalcitoninem [.754, resp. .856]. Dále mezi sílou osteoidu a prokolagenem1 [-.345]. Tyto sérové markery by mohly být ukazatelem k posouzení převahy vysokoobratové formy MBD. Vztah mezi frakčním objemem osteoidu, sílou kostního trámce, sílou osteoidu a sérovou hodnotou kostního izoenzymu alkalické fosfatázy [.697, resp. .614, resp. .697] byl v našem souboru nespecifickým znakem (korelace na 0,01 hladině neprokázána). V souboru se neprokázala v praxi často uváděná souvislost kostního izoenzymu ALP k aktivitě kostní tkáně. Příčinou může být nejednotnost a změna aktivity kostních buněk v rámci RO, a tedy nemožnost hodnocení aktivity kostní tkáně jako u nemocných bez anamnézy renální nedostatečnosti. Dále byl prokázán vztah mezi objemem trabekulární kosti a sérovou hodnotou osteokalcinu [.721]. Potvrdili jsme vztah mezi osteoblastickou aktivitou a nárůstem objemu trabekulární kosti.
Statistická souvislost byla mezi Cross-laps, C-tel. kolagenu1 a Z-skóre dle DEXA vyšetření [-.681, resp. -.747]. Tento vztah a nižší hodnoty byly statisticky významné (korelace signifikantní na 0,01 hladině) u skupiny s převahou adynamické kostní přestavby. Negativní resp. nízké hodnoty těchto markerů spolu s vyšetřením Z-skóre dle DEXA by mohly být ukazatelem převahy ABD, přesto bude ale kostní biopsie zůstávat nejpřesnějším ukazatelem převahy kostních změn (ABD a další typy RO, resp. i terén sekundární osteoporózy). Vztah mezi prokolagenem1 a Z-skóre dle DEXA [-.669] bude vyžadovat další sledování.
Jednoznačná signifikantní korelace byla mezi tetracyklinovými liniemi (TTC linie), objemem kostní tkáně a sílou kostního trámce [.705 resp. -.742] při histomorfometrickém měření. Prokázali jsme vztah mezi sílou TTC linií a sérovou hodnotou osteokalcinu [.618]. Síla TTC linií odpovídá rozsahu obratu kostní tkáně a je nejpřesnějším ukazatelem mezi hyperostózou a adynamickou formou BMD (ABD). Negativní korelace mezi sílou TTC linií a délkou dialyzační léčby se neprokázala [-.283]. Vztah mohl být ovlivněn nastavenou komplexní léčbou BMD.
Korelace byla dále prokázána mezi objemem osteoidu a objemem kostního trámce s délkou dialyzační léčby [.694, resp. .665]. Průkaz pozitivní souvislosti hodnotíme v návaznosti na adekvátní léčbu BMD. Výsledky se liší od literárních údajů, kde s délkou dialyzační léčby narůstá podíl ABD. Vztah mezi objemem PT (v ml) a prokolagenem1 rovněž koreloval u vysokoobratové formy [.830]. Může se tedy jednat o marker převahy fibrózní osteodystrofie či znak nárůstu kostní hmoty při vztahu k aktivitě a funkci PT.
U osmi pacientů jsme histomorfometrickým měřením prokázali smíšenou formu RO, z nich u šesti byla převaha vysokoobratových forem MBD, u dalších čtyř pacientů jsme prokázali ABD. Ostatní statisticky signifikantní korelace jsme neprokázali. Výstupy ze statistického hodnocení vztahů mezi sCa, sP, siPTH a kostními znaky jsme pro fluktující hodnoty těchto biochemických markerů u dialyzovaných pacientů nehodnotili. Přesto sérové koncentrace iPTH u pacientů s vysokoobratovou formou RO byly vyšší než koncentrace iPTH u pacientů s převahou ABD.
Diskuse a závěr
I přes nižší N souboru jsem prokázali statistickou závislost mezi některými biochemickými a histomorfometrickými parametry. Komplexním biochemickým vyšetřením obsahující parametry fosfokalciového metabolismu, alkalickou fosfatázu a některé markery osteoresorpce respektive novotvorby, znalostí funkce a morfologie PT a klinickou zkušeností s posouzením souvislostí a dynamiky lze předpokládat typ kostních změn v rámci MBD-CKD a indikovat správnou léčbu. Přesto ve složitých případech a u rizikových pacientů (nejednoznačné laboratorní nálezy, progredující cévní kalcifikace, neobjasněná hyperkalcémie, laboratorní nálezy neodpovídající sHPT) zůstává stále zlatým standardem kostní biopsie s histomorfometrickým vyšetřením ke komplexnímu posouzení kostních změn v rámci složité poruchy v rámci MBD-CKD (doporučení K/DOQi, ERA-EDTA). Cílenou a bezpečnou léčbu MBD-CKD je možné stanovit opět zcela přesně jen na základě komplexní histomorfometrie jednotlivých forem kostní choroby se zastoupením řadových složek (17), (tab. 7). U pacientů s vysokým kardiovaskulárním rizikem lze očekávat v relativně vysokém procentu obě krajní formy RO podle rychlosti kostního obratu, přičemž cílená léčba se zásadně liší. U pacientů s převahou adynamické formy RO, tedy nízkým kostním obratem a vysokým rizikem progrese mimokostních kalcifikací, je v léčbě třeba klást důraz na správnou bilanci kalcia cestou dialyzačního roztoku, vynechání preparátů kalcia a metabolitů či analogů vitaminu D, s udržením preferenčních koncentrací fosforu pomocí nekalciových vazačů. Při současné velmi nízké denzitě a při adynamii je nutné kontraindikovat bisfosfonáty. Na druhé straně u pacientů s dominující histomorfometrickou složkou osteitis fibrosa je základem správného terapeutického postupu kombinační léčba kalciovými preparáty a substituce vitaminu D. Pro pacienty s převahou osteomalacie představuje cílená léčba adekvátní suplementaci vitaminem D s komplexním účinkem a ovlivněním VDR. Přesná diagnostika MBD-CKD ovlivňuje tedy nejen rozdílné terapeutické postupy, ale i následnou prognózu pacientů.
Tab. 7. Indikace k histomorfometrickému vyšetření dle doporučení KDIGO. 
Chronickým onemocněním ledvin s poklesem glomerulární filtrace na polovinu normálních hodnot je postiženo přibližně 5% populace. Minerálová a kostní nemoc při chronickém onemocnění ledvin je tedy častá, s podstatným vztahem přes kosní tkáň k měkotkáňové složce, k postižení cév a ke kardiovaskulárním komplikacím, které stojí v popředí morbidity a mortality v populaci pacientů s chronickým onemocněním ledvin. Současné postupy kladou důraz na včasnou léčbu MBD-CKD s cílem předejít rozvoji pokročilých fází onemocnění. Kostní změny při selhání ledvin jsou vyjádřené vždy, avšak nikoliv jednotně. V rámci renální osteopatie je nejčastějším projevem smíšený typ kostní nemoci, vyskytující se až u 80% dialyzovaných nemocných, který je dán kombinací fibrózní osteodystrofie a osteomalacie. Opakem jsou potom ostatní krajní histologické obrazy, a to jednak kostní změny s vysokým kostním obratem s přímým vztahem k sHPT a kostní změny se sníženým kostním obratem. Tradiční název renální osteodystrofie se nyní omezuje jen na morfologický kostní nález. Plně rozvinuté formy se vyskytují až při pravidelném dialyzačním léčení. V poslední době značně narůstá incidence adynamické formy nemoci. Příčinou může být zejména vyšší věk pacientů na dialyzační léčbě, nárůst prevalence diabetu, prokázaný je i vztah k nižším hodnotám sPTH. Cévní složka MBD-CKD je významná pro svůj těsný vztah ke kardiovaskulárním komplikacím. Hyperfosfatémie a mimokostní kalcifikace jsou novými nezávislými rizikovými faktory kardiovaskulární morbidity a mortality (16, 18).
Základní komponenty léčebné strategie představují primárně úpravu sérové fosfatémie v krvi s jejím snížením k přijatelných hodnotám, tedy pod hranici 1,8 mmol/l. Sekundární terapeutický postup směřuje k zajištění aktivace receptoru pro vitamin D s užitím aktivátorů receptoru pro vitamin D (metabolity vitaminu D, analoga vitaminu D). Dalším léčebným krokem je pak zajištění aktivace receptoru pro kalcium s úpravou sekundární hypokalcémie a eventuálně užití kalcimimetik typu cinacalcetu. V současné době je prvním nutným krokem v léčbě korekce fosfatémie. Až pokud po korekci fosfatémie neklesá sPTH, pokračuje se další léčbou. Důvodem tohoto postupu je vliv FGF-23, fosfatoninu, jehož účinek je sice při fosfaturii shodný s PTH, ale působí opačně na tvorbu kalcitriolu, tedy ho výrazně snižuje.
V běžné klinické praxi je nutné zvážit základní klinické obtíže pacienta, pečlivě zhodnotit aktuální laboratorní parametry a jejich časovou posloupnost. Rovněž je nutné znát hodnoty sPTH, časový vývoj funkce příštitných tělísek a jejich morfologii, pátrat po cévní komponentě kostní choroby, po kalcifikacích a arterioskleróze. V indikovaných případech je nutné indikovat vyšetření ke stanovení jednotlivých subtypů kostní histomorfometrie. Přesto kostní choroba zůstává i při nyní známé patogenezi jdoucí téměř až na molekulární úroveň a bohaté, cílené farmakoterapii stále klinickým problémem, se kterým se v běžné klinické praxi každodenně setkáváme.
Poděkování
Studie je prováděna s finanční podporou České nefrologické společnosti Grant 2010/01 histomorfometrická diagnostika
MUDr. Kamil Žamboch
I.P.Pavlova 6
FN Olomouc, III. interní klinika-NRE
775 20 Olomouc,
e-mail: kamil-zamboch@seznam.cz
Zdroje
1. Dusilová-Sulková S. a kol. Renální osteopatie. Edice Farmakoterapie pro praxi, svazek 22 Maxdorf 2007 : 46-48, 53, 57, 124.
2. National Kidney Foundation. K/DOQI Clinical Practice Guidelines for Bone Metabolism and Disease in chronic kidney disease. Am J Kidney 2003; 42 : 10-154.
3. Sobotová D, Zharfbin A, Neobálková M, Svojanovský J, Souček M. Minerálově kostní porucha při chronickém onemocnění ledvin. Vnitř Lék 2007; 53 : 841-851.
4. Moe S, Druke T, Cunningham J, et al. Definition, evaulation and classification of renal osteodystrophy: a positron statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2006; 69 : 1946-63.
5. Cannata Andia JB. Pathogenesis, prevention and management for low bone turnover. Nephrol Dial Transplant 2006; 15 : 15-17.
6. Dusilová Sulková S, Kalousová M. Některé poznatky o poruše fosfokalciového metabolismu při selhání ledvin. Postgraduální medicína 2006; 8 : 120-126.
7. Hruska KA, Matjes S, Lund R, Qiu P, Pratt R. Hyperphosphatemia of chronic kidney disease. Kidney Int 2008; 74 : 148-157.
8. Silver J, Levi R. Regulation of PTH synthesis and secretion relevant to the management of secondary hyperparathyroidism in chronic kidney disease. Kidney Int Suppl 2005;15 : 4-8.
9. Coen G. Adynamic bone disease. J Nephrol 2005; 18 : 1 10-126.
10. Abedin M, Fintit Y, Demer L.. Vascular Calcification: Mechanisms and Clinical Ramifications. Arterioscler Tromb Vasc Biol 2004; 24 : 1161-1170.
11. Braun J. Extraosseous Calcification in patiens with chronic renal failure - no espace Nephrol Dial Transplant 2005; 20 : 2054-2059.
12. Zahálková J. Cévní postižení při minerálové a kostní nemoci u chronického onemocnění ledvin. Osteologický bulletin 2008; 13(4): 166-171.
13. Block GA, Maggi P, Bellasi A, et al. Mortality effect of coronary calcification and phosphate binder choice in incident hemodialysis patiens. Kidney Int 2007; 71 : 438-441.
14. Ketteler M, Giachelli C. Novel insights into vascular calcification. Kidney Int 2006; 70 : 54-62.
15. London GM. Cardiovascular calcification in uremic patiens: clinical impact on cardiovascular function. J Am Soc Nephrol 2003; 14: S305-309.
16. Schoppet M, Shanahn CM, Role for alkaline phosphatase as an inducer of vascular calcification in renal failure, Kidney Int 2008; 73 : 989-991.
17. Histomorphometric Measurements of Bone Turnover, Mineralization and Volume. Clin J Am Soc Nephrol 2008; 3: S151-156.
18. Tentori F, Mortality risk for dialysis patients with different levels of serum calcium, phosphorus and PTH: the Dialysis Outcomes and Practice Patterns Study. Am J Kidney Dis 2008; 52 : 519-530.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2012 Číslo 1- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy
- Přesná diagnostika jednotlivých forem renální osteopatie v rámci minerálové a kostní nemoci při chronickém onemocnění ledvin
- Zkrácený referát: Imunogenetické a hormonální predispoziční markery systémových revmatických onemocnění, zejména systémového lupusu erythematodu
- Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy
- Přesná diagnostika jednotlivých forem renální osteopatie v rámci minerálové a kostní nemoci při chronickém onemocnění ledvin
- Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy
- Zkrácený referát: Imunogenetické a hormonální predispoziční markery systémových revmatických onemocnění, zejména systémového lupusu erythematodu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




