-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Adrenokortikální insuficience
Adrenal insufficiency
Adrenal insufficiency (AI) is an endocrine disorder characterized by a decrease in cortisol secretion in adrenal cortex. AI even if properly diagnosed and treated is connected with a significant increase in morbidity and mortality and a decrease in quality of life. This review article summarizes basics of clinical presentation, diagnosis, differential diagnostic and treatment necessary for physicians of nearly all specialties and for improvement of the prognosis of patient suffering from AI.
Keywords:
pituitary, adrenal, cortisol, insufficiency
Autoři: Michal Kršek
Působiště autorů: 2. interní klinika 3. LF UK a FN Královské Vinohrady, Praha
Vyšlo v časopise: Čas. Lék. čes. 2017; 156: 252-257
Kategorie: Přehledový článek
Souhrn
Adrenokortikální insuficience (AI) je endokrinní porucha, která je charakterizována sníženou sekrecí kortisolu kůrou nadledvin. I v případech, kdy je AI správně diagnostikována a léčena, je spojena s významně zvýšenou morbiditou a mortalitou a s poklesem kvality života. Tento přehledový článek shrnuje základní poznatky o klinickém obrazu, diagnostice, diferenciální diagnostice a léčbě, které jsou nezbytné pro lékaře téměř všech specializací k tomu, aby bylo možné zlepšit prognózu pacientů s AI.
Klíčová slova:
hypofýza, nadledviny, kortisol, nedostatečnostÚvod
Adrenokortikální insuficiencí (AI) nazýváme onemocnění způsobené nedostatečnou produkcí a sekrecí hormonů kůry nadledvin a jejich nedostatečným působením na cílové buňky, tkáně a orgány lidského těla. Podle tíže deficitu a rychlosti rozvoje AI rozdělujeme na akutní a chronickou, parciální a totální nebo na absolutní a relativní. V užším slova smyslu rozumíme pod pojmem AI stavy spojené s nedostatečnou sekrecí a nedostatečným působením glukokortikoidů a mineralokortikoidů, případně androgenů.
Periferní (primární) AI poprvé popsal v roce 1855 Thomas Addison a toto onemocnění se nyní nazývá Addisonovou chorobou (1). Před zavedením přípravků glukokortikoidů do klinické praxe byla AI smrtelným onemocněním. V dnešní době dovedeme substituovat nedostatek glukokortikoidů i mineralokortikoidů a přiblížit tak život pacientů s AI a jeho kvalitu životu zdravých jedinců.
I přes tyto pokroky je však AI stále onemocněním, které je spojeno se statisticky významně zvýšenou morbiditou a mortalitou a se zkrácenou očekávanou dobou života (2). Příčin tohoto stavu je řada. Mezi hlavní patří, že i přes dodržování zásad glukokortikoidní léčby je část pacientů dlouhodobě mírně předávkována glukokortikoidy a tím se pravděpodobně zvyšuje jejich morbidita a mortalita, především kardiovaskulární. Na druhé straně je část pacientů vystavena riziku tzv. addisonské či hypokortikální krize tím, že je nedostatečně nebo pozdě zvýšena dávka glukokortikoidů v zátěžových situacích. V následujícím textu proto budou uvedeny základní poznatky o AI včetně rozboru zásad substituční léčby.
Etiologie a patogeneze
Podle úrovně, na které v regulační ose hypotalamus – hypofýza – nadledviny (HPA) dochází k poruše, rozdělujeme AI na častější primární (periferní), kdy dochází k poruše na úrovni kůry nadledvin, a sekundární (centrální), kdy dochází k poruše na úrovni hypotalamo-hypofyzární, a podkladem je tedy nedostatečná sekrece adrenokortikotropního hormonu (ACTH) a následně nedostatečná stimulace sekrece glukokortikoidů v kůře nadledvin.
Primární příčiny AI jsou nejčastější a v ekonomicky rozvinutých zemích je vedoucí příčinou autoimunitní destrukce kůry nadledvin. Podmínkou vzniku primární AI je destrukce kůry obou nadledvin a primární AI je charakterizována nedostatečnou sekrecí jak glukokortikoidů, tak mineralokortikoidů. Shrnutí příčin primární AI je uvedeno v tab. 1 (3).
Tab. 1. Příčiny primární adrenokortikální insuficience 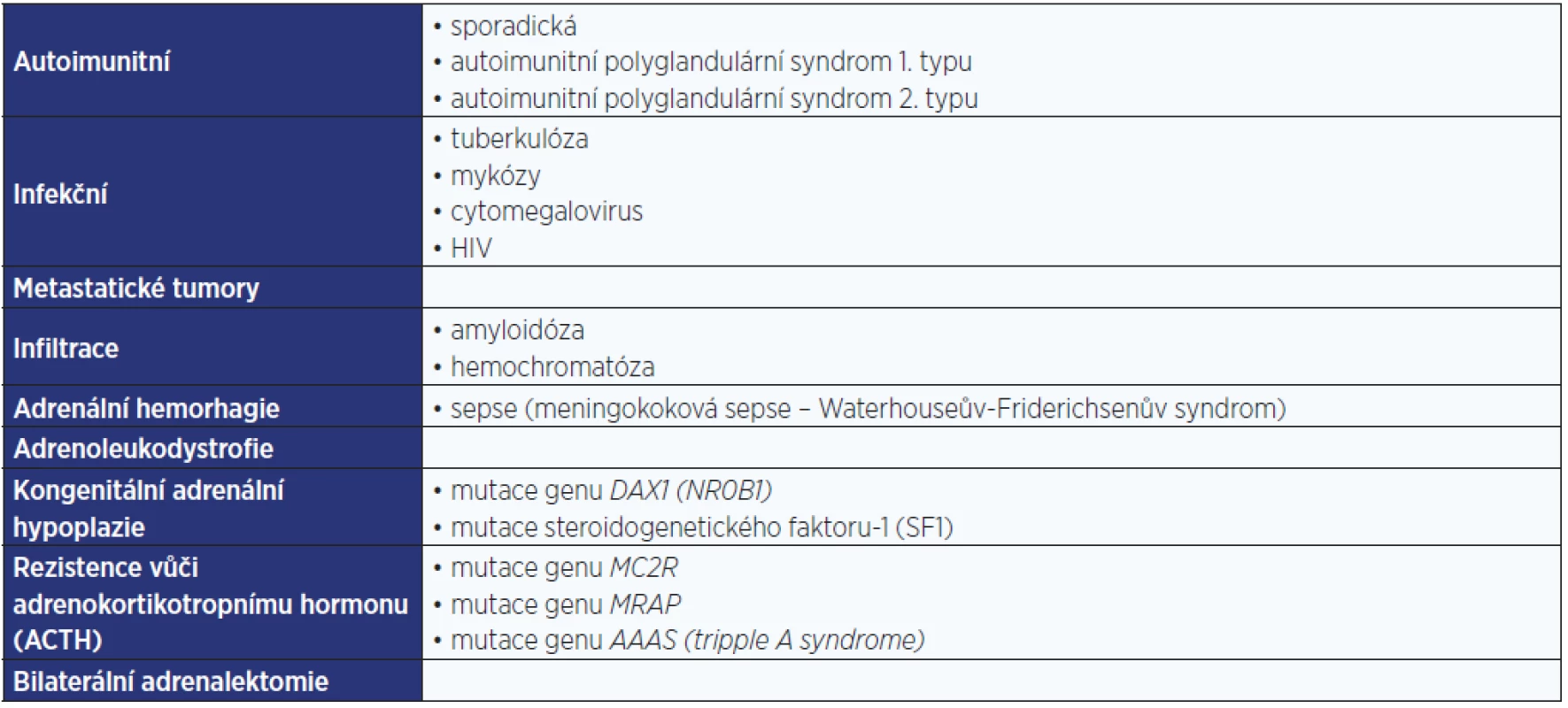
(upraveno dle: Stewart & Newell-Price, 2016) Sekundární příčiny AI jsou málo časté a prvotní je zde nedostatečná sekrece ACTH. Na klinickém obrazu se proto podílí především nedostatečná sekrece glukokortikoidů. Sekrece mineralokortikoidů, která je pod regulačním vlivem renin-angiotenzin-aldosteronového systému (RAS), je alterovaná jen minimálně. Shrnutí příčin sekundární AI je uvedeno v tab. 2 (3).
Tab. 2. Příčiny sekundární adrenokortikální insuficience 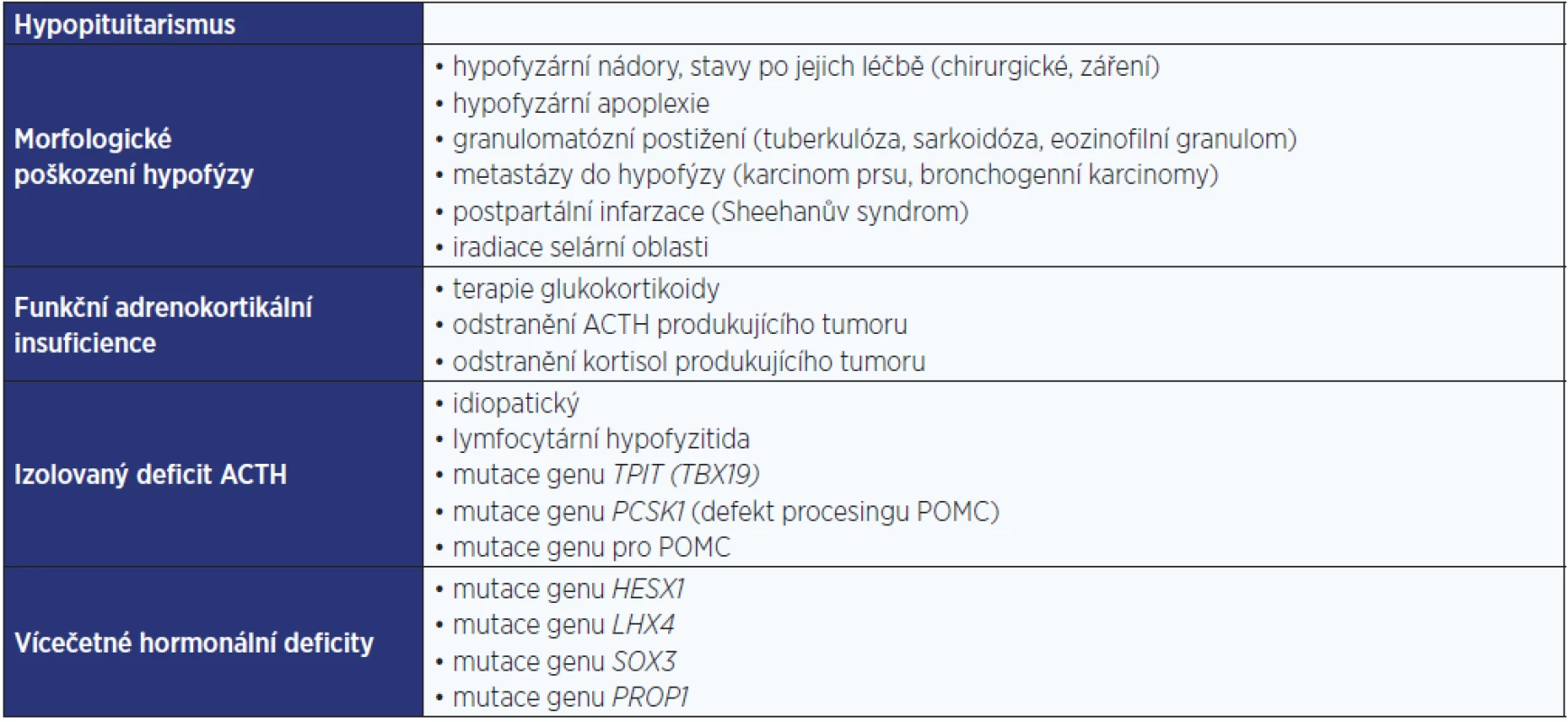
(upraveno dle: Stewart & Newell-Price, 2016) Klinický obraz
Addison ve své publikaci z roku 1855 příznaky AI velmi dobře popsal a dá se říci, že tato charakteristika platí až do dnešní doby: „anemie, celková malátnost a vyčerpanost, významná slabost srdeční činnosti, dráždivost žaludku a typická změna barvy kůže“ (1). Existují však rozdíly mezi chronickou a akutní a primární a sekundární AI.
Chronická adrenokortikální insuficience
Klinické příznaky AI se vyvíjejí zpravidla pomalu a nenápadně. Zpočátku jsou mírné a nespecifické, a pokud na AI nepomýšlíme nebo po ní cíleně nepátráme, zůstává dlouho nerozpoznána. Zpočátku je obvykle přítomná zvýšená únavnost a snížená výkonnost, později se připojuje nechutenství, nauzea či zvracení, hubnutí, bolesti břicha, zácpa (někdy ale i průjmy), posturální hypotenze, a pokud nemoc není léčena, stav může vyústit v klinický obraz akutní AI.
U primární AI se navíc objevují hyperpigmentace, charakteristicky v místech exponovaných slunečnímu záření, v palmárních rýhách (obr. 1), v oblasti linea alba, periareolárně, perigenitálně, v místech jizev a na sliznicích (tzv. grafitové skvrny). Hyperpigmentace jsou způsobené zvýšenou sekrecí molekuly proopiomelanokortinu (POMC), jejíž součástí je mj. ACTH a α-MSH (melanocyty stimulující hormon), které stimulují tvorbu pigmentu v melanocytech. U periferní AI autoimunitní etiologie mohou být hyperpigmentace kombinované s vitiligem (obr. 2). Klinické příznaky primární AI jsou shrnuty v tab. 3 (3).
Obr. 1. Dlaně s hyperpigmentovanými dlaňovými rýhami u pacientky s Addisonovou chorobou (z archivu autora) 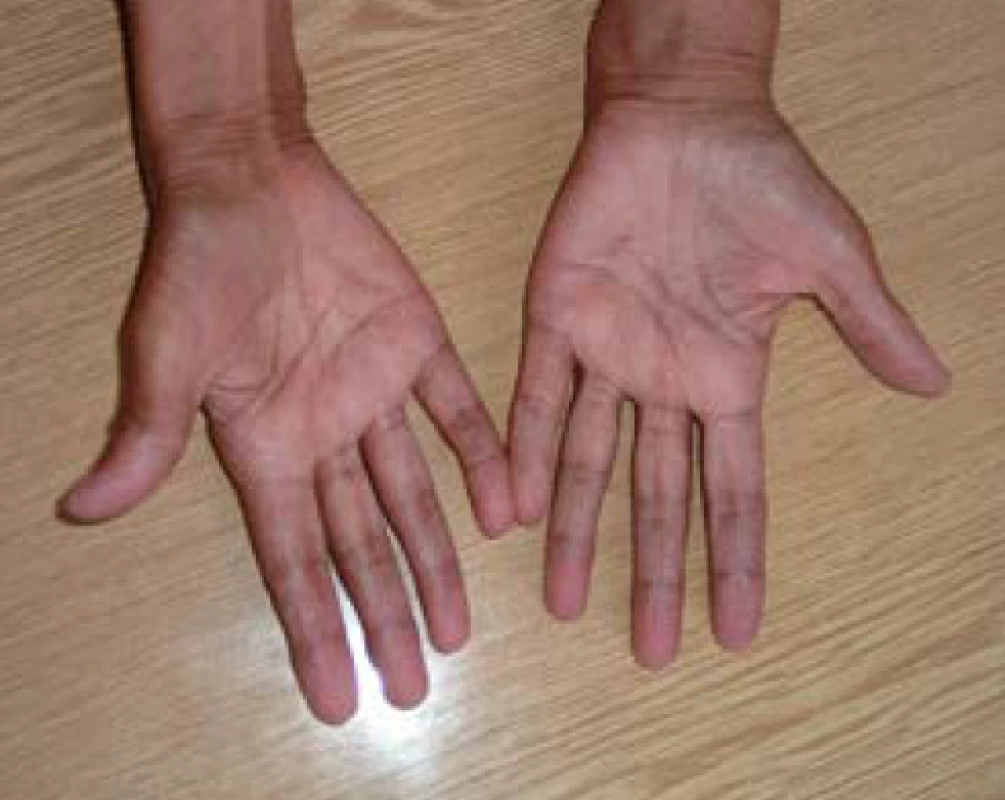
Obr. 2. Ruce pacienta s Addisonovou chorobou, resp. autoimunitním polyglandulárním syndromem 2. typu s viditelnými hyperpigmentacemi kontrastujícími s vitiligem (z archivu autora) 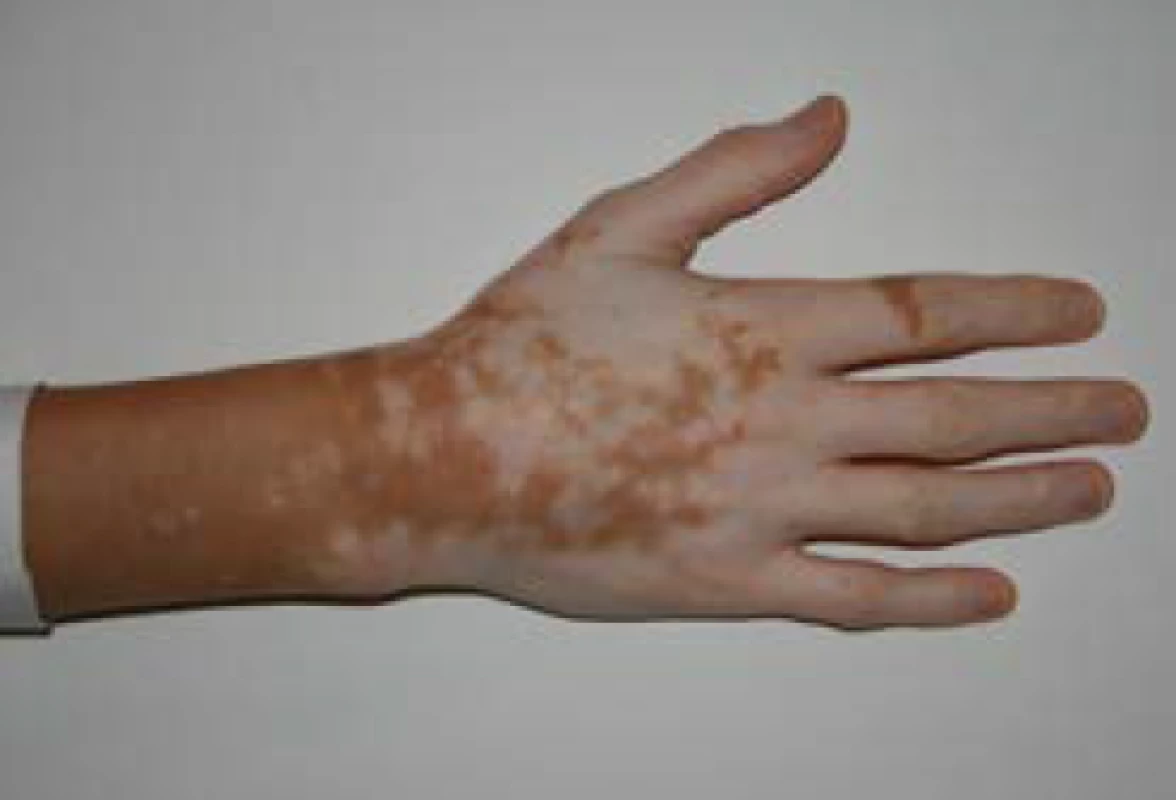
Tab. 3. Klinické příznaky chronické primární adrenokortikální insuficience 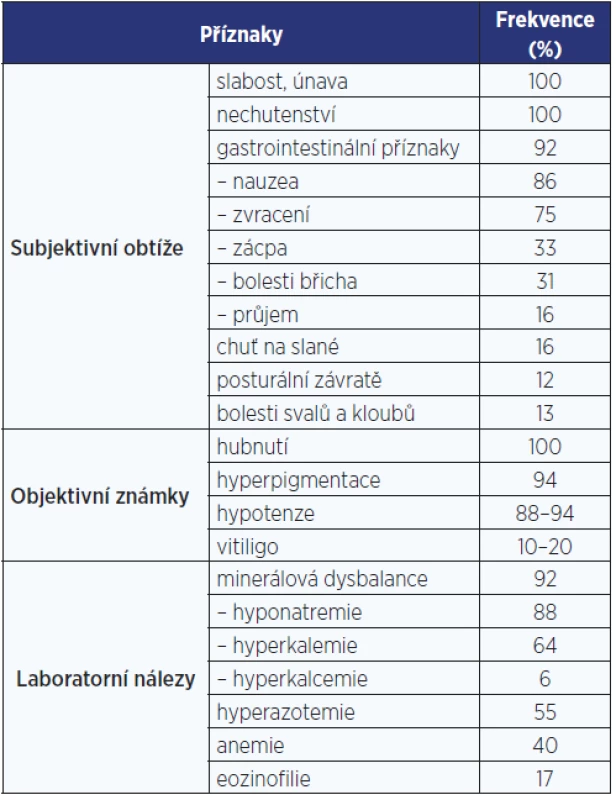
(upraveno dle: Stewart & Newell-Price, 2016) Klinický obraz sekundární AI se od primární liší tím, že nejsou přítomné hyperpigmentace (sekrece POMC, a tedy ACTH a α-MSH je nízká) a bývají méně a později vyjádřené příznaky mineralokortikoidního deficitu (funkce zona glomerulosa nadledvin a RAS je zachována).
Akutní adrenokortikální insuficience
Akutní adrenokortikální insuficience je někdy nazývána též adrenální (či adrenokortikální) krizí. Jedná se o život ohrožující stav charakterizovaný akutním nedostatkem glukokortikoidu kortisolu. Může být první manifestací AI nebo se vyvíjí u již známé AI v důsledku rychle se rozvíjejícího nepoměru mezi sekrecí a potřebou glukokortikoidů.
Ke klinickému obrazu akutní AI patří: extrémní slabost a únava, hypotenze a tachykardie s rozvojem šokového stavu, bolest břicha, nauzea a zvracení, zvýšená tělesná teplota, poruchy vědomí od zmatenosti a somnolence až po delirantní stav a koma. Laboratorně nacházíme hyponatremii, hyperkalemii, známky prerenální hyperazotemie, sklon k acidóze, hypoglykemii, u déletrvající předchozí AI normocytární anemii.
U pacientů s akutní AI můžeme často vystopovat precipitující faktor, který k jejímu rozvoji vedl. K takovým faktorům může patřit např. infekční onemocnění, úraz, chirurgický výkon a další zátěžové situace (4).
Diagnostika a diferenciální diagnostika
Prvním stupněm diagnostiky AI je průkaz snížené sekrece kortisolu. Základním testem je stanovení ranní koncentrace sérového nebo plazmatického kortisolu za podmínky, že pacient neužívá glukokortikoidy. U pacientů na substituční léčbě hydrokortisonem nebo kortisonem je doporučeno vysazení nejméně 24 hodin před odběrem krve. Koncentrace ranního kortisolu za těchto podmínek < 140 nmol/l svědčí pro AI, koncentrace > 500 nmol/l ji vylučují. U akutní AI je doporučeno odebrat krev na stanovení kortisolu před zahájením léčby glukokortikoidy, odběr však nesmí vést k oddálení zahájení léčby.
U pacientů s podezřením na AI je doporučeno provést konfirmační dynamický (stimulační) test. Americká The Endocrine Society doporučuje provedení zkráceného ACTH (synacthenového, cortrosynového, tetrakosaktidového) testu ve variantě s podáním 250 µg 1–24 ACTH i. v. Test s nižší dávkou (1 µg) je doporučen jen při nedostatku 1–24 ACTH (v klinické praxi jsou však používány častěji testy s nižší dávkou, 10 nebo 1 µg). Při normálních bazálních koncentracích kortisolu přesahují koncentrace ve 30. nebo 60. minutě po stimulaci hodnotu 500 nmol/l. Nižší hodnoty svědčí pro AI (5).
Dalším dynamickým stimulačním testem, který je považován za zlatý standard v posouzení funkce celé osy HPA, je test s inzulinovou hypoglykemií (inzulinový toleranční test). Principem je dosažení hypoglykemie (< 2,2 mmol/l), která je silným stimulem aktivity osy HPA. Hodnota glykemie < 2,2 mmol/l je důležitá pro spolehlivé fungování testu. Po bazálních odběrech na stanovení koncentrace kortisolu podáváme i. v. inzulin v dávce obvykle 0,1–0,2 IU/kg. Každých 10 minut po dobu 40 minut kontrolujeme glykemii a krev na stanovení kortisolu odebíráme po 30, 60 a 90 minutách od aplikace inzulinu. Za normální výsledek testu považujeme koncentrace kortisolu za 30 nebo 60 minutách po stimulaci > 500 nmol/l. Nižší hodnoty svědčí pro AI. Pro bezpečné provedení testu je důležité respektování kontraindikací (epilepsie, ischemická choroba srdeční) a přítomnost zdravotnického personálu (sestra, lékař), který má s testem zkušenosti (5).
K rozlišení primární a sekundární AI používáme stanovení plazmatických koncentrací ACTH. Vycházíme ze dvou nezávislých stanovení ráno nalačno, opět za podmínky, že pacient neužívá glukokortikoidy nebo že je v dostatečném předstihu vysadil. Zvýšené plazmatické koncentrace ACTH (dle použité diagnostické soupravy obvykle > 80 pg/ml) svědčí pro primární AI, hodnoty v mezích normy nebo snížené svědčí pro sekundární AI.
U primární AI následuje vyšetření k odhalení příčiny. Ačkoliv je nejčastější příčinou primární AI v rozvinutých zemích autoimunitní postižení nadledvin, je nutné vzít do úvahy i další, méně časté možnosti. Návrh algoritmu diferenciální diagnostiky primární AI je uveden na obr. 3 (7). Při zobrazení nadledvin je metodou první volby výpočetní tomografie (CT). Magnetická rezonance (MRI) má srovnatelnou výpovědní hodnotu, nepředstavuje zátěž rentgenovým zářením a nemá rizika reakce podání jodové kontrastní látky, je ovšem dražší a méně dostupná.
Diferenciální diagnostika sekundární AI začíná zobrazením hypotalamo-hypofyzární oblasti. Metodou první volby je MRI. CT používáme jen vzácně při kontraindikaci MRI, protože jeho výpovědní hodnota je výrazně nižší.
Obr. 3. Algoritmus diferenciální diagnostiky Addisonovy choroby (periferní AI) 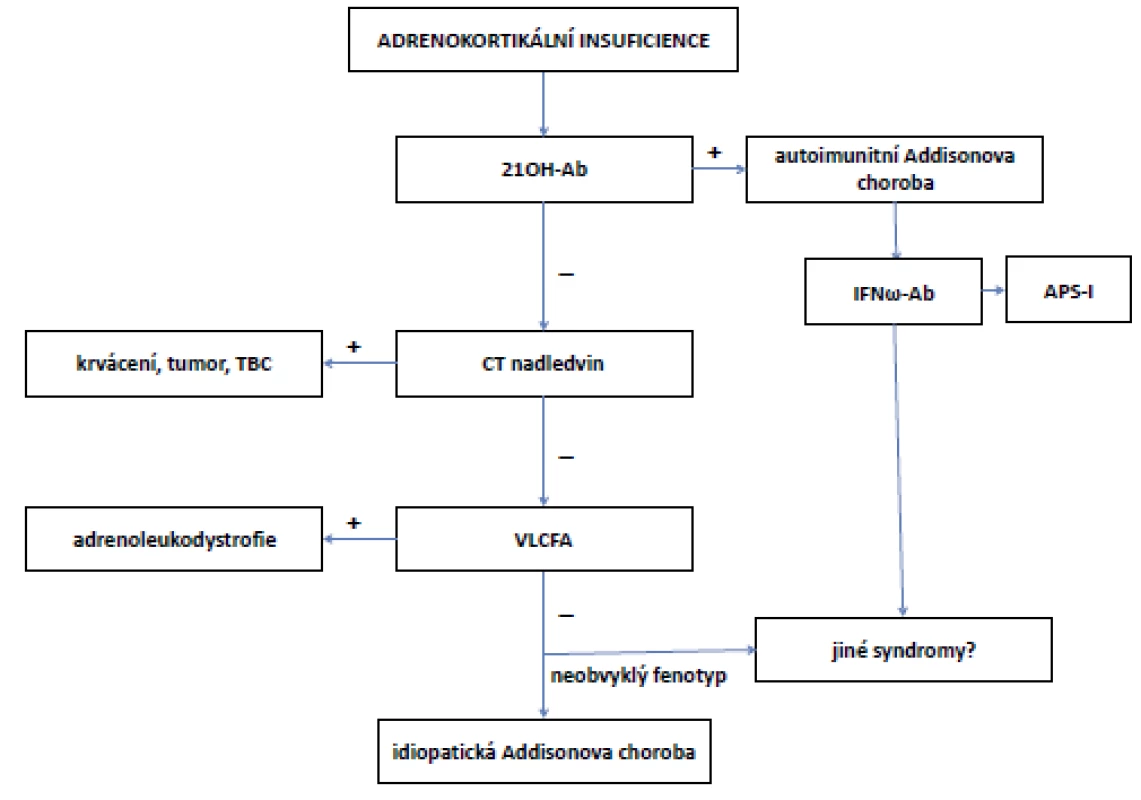
(upraveno dle: Husebye et al., 2014) Pozn.: 21OH-Ab = protilátky proti 21hydroxyláze; APS-I = autoimunitní polyglandulární syndrom 1. typu; CT = výpočetní tomografie; IFNω-Ab = protilátky proti interferonu ɯ; VLCFA = mastné kyseliny s velmi dlouhým řetězcem; TBC = tuberkulóza. Přidružené choroby
Nedílnou součástí diagnostiky a diferenciální diagnostiky je vyloučení přidružených poruch a chorob.
U autoimunitní Addisonovy choroby musíme myslet na možnost přítomnosti autoimunitních polyglandulárních syndromů (APS), APS-I a APS-II. Přehled APS a jejich součástí je uveden v tab. 4.
Tab. 4. Autoimunitní polyglandulární syndromy (APS) 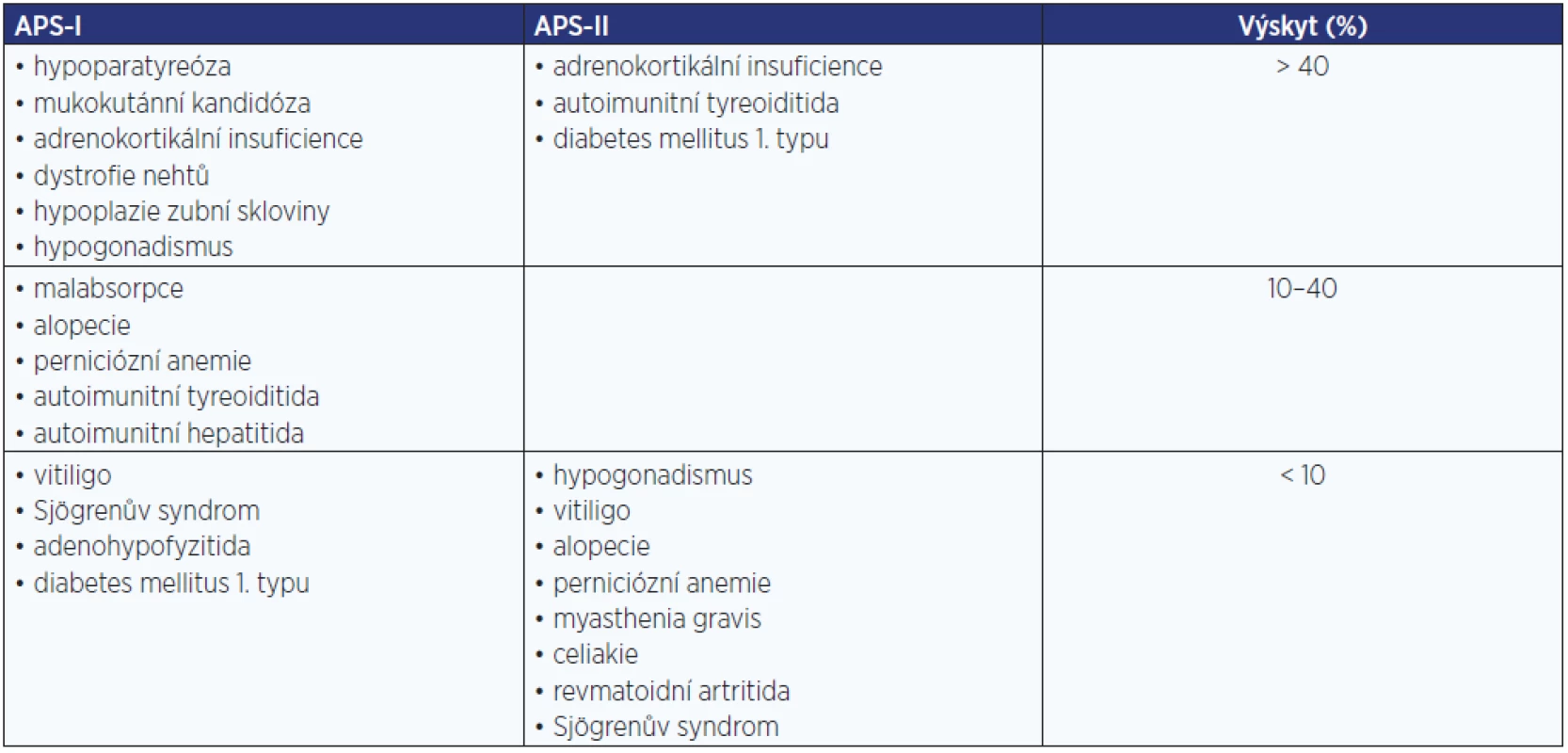
U sekundární AI musíme u pacienta vyšetřit případnou koincidenci s dalšími deficity hormonů předního laloku hypofýzy nebo i centrálním diabetem insipidem. Při morfologickém poškození hypofýzy je koincidence deficitní sekrece ACTH s dalšími deficity častá, protože v době vzniku deficitu ACTH je již obvykle přítomen deficit růstového hormonu, deficit gonadotropinů (hypogonadotropní hypogonadismus) a deficit sekrece tyreotropního hormonu (TSH) (centrální hypotyreóza). Pokud je přítomen selektivní deficit sekrece ACTH, musíme pomýšlet na možnost lymfocytární hypofyzitidy.
Léčba
Základem léčby AI je hormonální substituční léčba glukokortikoidy, u nás používáme syntetický kortisol (hydrokortison), v některých zemích se používá kortison-acetát. Bazální dávka hydrokortisonu (dostatečná k substituci za normálního klidového režimu) se u dospělých jedinců pohybuje mezi 10 a 25 mg denně a rozdělujeme ji do několika – zpravidla 3 – dílčích dávek: ráno (ihned po probuzení), v poledne (ve 12.00) a v podvečer (kolem 16. hodiny). Nejvyšší dávku podáváme ráno. Možné režimy hydrokortisonu jsou např. 15-5-5; 10-5-5; 10-5-2,5; 7,5-5-2,5 (v mg). Hormonální substituční léčba hydrokortisonem nesmí být nikdy přerušena a musí být zvyšována v zátěžových (stresových situacích).
Zátěžovými situacemi jsou koincidující onemocnění, zejména onemocnění provázená febriliemi, traumata, zvýšená fyzická zátěž apod. Při onemocněních provázených zvýšenou tělesnou teplotou dávky hydrokortisonu zdvojnásobujeme při teplotě do 38 °C, ztrojnásobujeme při teplotě mezi 38 a 39 °C, případně podáváme dávky 100–200 mg denně i. v. nebo i. m. u těžkých horečnatých stavů (nad 39 °C). Dalšími typickými zátěžovými situacemi jsou invazivní výkony; základní situace a doporučené dávky v těchto situacích jsou uvedeny v tab. 5 (7). U stavů spojených se zvracením a intenzivními průjmy je nutné parenterální podávání hydrokortisonu ve zvýšených dávkách a podání hydratačních infuzí.
Tab. 5. Dávky hydrokortisonu u chirurgických výkonů, stomatologických výkonů, při porodu a při dalších invazivních výkonech (upraveno dle: www.addisons.org.uk) 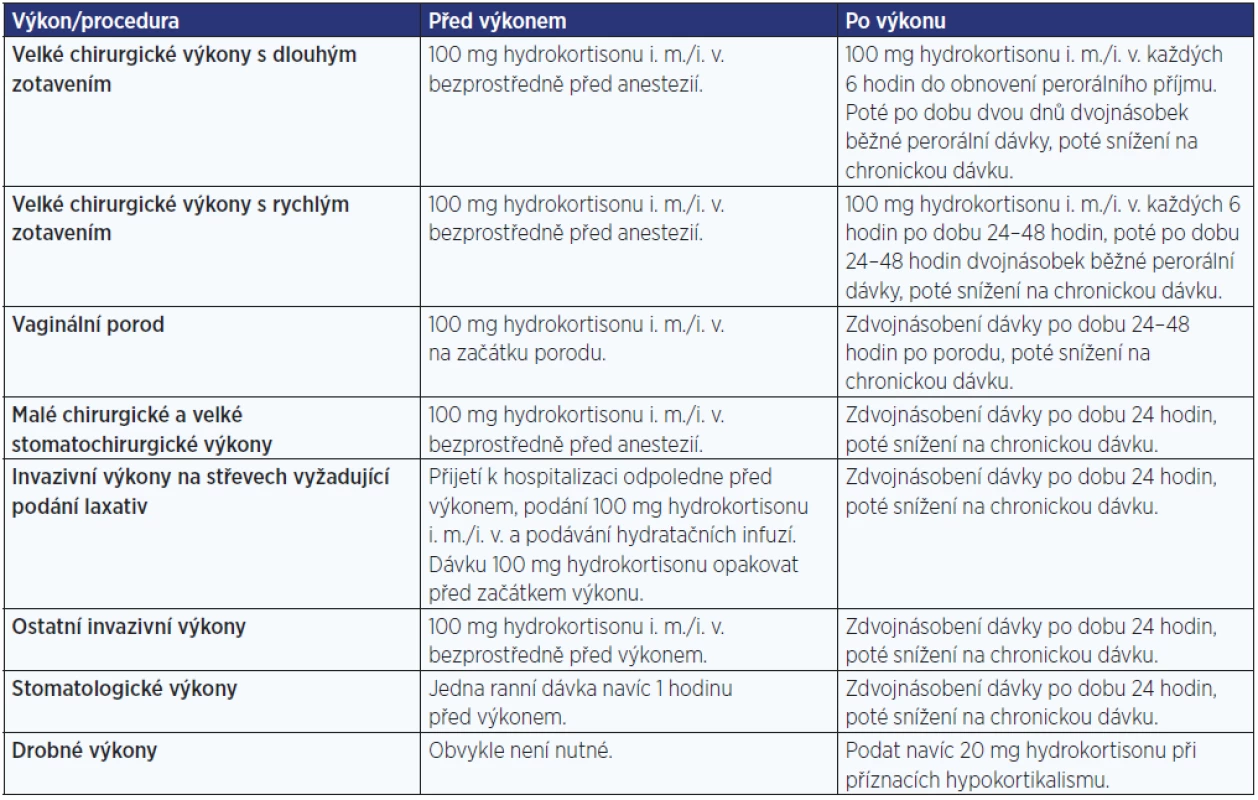
Pozn.: V tabulce jsou uvedená obecná doporučení dle jednoho z více zdrojů či doporučení. Jedná se o orientační doporučení s tím, že substituční dávka musí být individualizována na každého jedince a na každou specifickou situaci a průběh onemocnění. Pacient musí být důkladně edukován a vybaven průkazkou hypokortikálního pacienta se základními instrukcemi. Monitorování glukokortikoidní substituce je obtížné a neexistuje žádný spolehlivý parametr, podle kterého bychom mohli dávkování glukokortikoidů upravovat. Klíčové je posouzení klinického obrazu, neměly by být přítomné klinické známky hyperkortisolismu ani hypokortikalismu. Někteří autoři doporučují monitorování denního profilu sérového nebo slinného kortisolu (7). Vzhledem k tomu, že u sekundární AI je z velké části zachovalá produkce mineralokortikoidů, je možné v substituční léčbě pacientů se sekundární AI používat i selektivní glukokortikoidy (prednison či methylprednisolon) v ekvipotentní dávce.
Mineralokortikoidní léčba je nezbytná u primární AI s cílem udržení normálního arteriálního krevního tlaku a minerálové rovnováhy. Používáme syntetický mineralokortikoid 9α-fludrokortison, který podáváme v 1 denní (obvykle ranní) dávce pohybující se mezi 50 a 200 µg. Některé doporučené postupy doporučují zvýšení dávky v situacích spojených s vyššími ztrátami tekutin a minerálů, například při vysoké venkovní teplotě a namáhavých sportovních výkonech. Substituci mineralokortikoidů posuzujeme podle klinického obrazu, arteriálního krevního tlaku a mineralogramu (7).
Léčba androgeny by přicházela do úvahy u žen s kombinovanou AI a deficitem ovariálních androgenů. Současná doporučení však rutinní substituci androgenů u žen většinou nedoporučují. Potenciálním slabým androgenem vhodným pro podání ženám by byl dehydroepiandrosteron v dávce 10–50 mg denně (5, 7).
Léčba adrenokortikální krize (akutní AI) vzhledem k tomu, že se jedná o život ohrožující stav, vyžaduje monitorování základních životních funkcí a pobyt na jednotce intenzivní péče. Je indikované bezprostřední podání 100 mg hydrokortisonu i. v. nebo i. m. následované kontinuálním i. v. podáváním hydrokortisonu v celkové denní dávce 200 mg. Alternativně je možné podávat 50 mg hydrokortisonu každých 6 hodin. Zároveň musíme doplnit cirkulující volum infuzemi fyziologického roztoku 0,9% NaCl. Pacienti s akutní AI obvykle vyžadují podání 4–6 l během 24 hodin. Vzhledem ke sklonu k hypoglykemii je často indikované současné podávání glukózy. Hyperkalemie a acidóza se při této léčbě většinou spontánně dobře upravují. Při hyperkalemii bychom neměli společně s glukózou podávat inzulin (nebo jen velmi opatrně), protože pacienti s hyperkortisolismem jsou na něj zvýšeně citliví a hrozí nebezpečí těžké hypoglykemie. Zároveň s léčbou akutní AI musíme léčit precipitující onemocnění, pokud je známé (4).
Závěr
Adrenokortikální insuficience je závažným onemocněním, které je i přes současné možnosti substituční léčby spojené se zvýšenou morbiditou a mortalitou. Pacienti by proto měli být sledováni specialistou endokrinologem, nezbytná je podrobná edukace o zásadách substituční terapie a o tom, jak léčbu upravovat v konkrétních situacích. Zároveň je nutné pacienty vybavit kartičkou hypokortikálního pacienta se základními informacemi. Akutní adrenokortikální insuficience je život ohrožujícím stavem vyžadujícím komplexní léčbu na jednotce intenzivní péče. Zásady substituční léčby adrenokortikální insuficience musejí znát lékaři všech odborností.
Autor prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsem ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Adresa pro korespondenci:
prof. MUDr. Michal Kršek, CSc.
2. interní klinika 3. LF UK a FNKV
Šrobárova 1150/50
100 34 Praha 10
Tel.: 267 162 710
e-mail: michal.krsek@fnkv.cz
Zdroje
1. Addison T. On the constitutional and local effects of the supra-renal capsules. Samuel Highley, London UK, 1855.
2. Bensing S, Hulting AL, Husebye ES et al. Epidemiology, quality of life and complications of primary adrenal insufficiency: a review. Eur J Endocrinol 2016; 175: R107–116.
3. Stewart PM, Newell-Price JDC. The adrenal cortex. In: Melmed S, Polonsky KS, Reed Larsen P, Kronenberg HM (eds.). Williams Textbook of Endocrinology (13th ed.). Elsevier, Philadelphia, 2016 : 489–588.
4. Arlt W and Society for Endocrinology Clinical Committee. Emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect 2016; 5: G1–G3.
5. Bornstein SR, Allolio B, Arlt W et al. Diagnosis and treatment of primary adrenal insufficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2015; 101 : 364–389.
6. Yanase T, Tajima T, Katabami T et al. Diagnosis and treatment of adrenal insufficiency including adrenal crisis: a Japan Endocrine Society clinical practice guideline. Endocr J 2016; 63 : 765–784.
7. Husebye ES, Allolio B, Arlt W et al. Consensus statement on the diagnosis, treatment and follow-up of patients with primary adrenal insufficiency. J Intern Med 2014; 275 : 104–115.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek EditorialČlánek Léčba hypofyzárních adenomů
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- 120 let od narození profesora Josefa Charváta
- Editorial
- Nadměrný růst u dětí a dospělých: nový klinický pohled, nové geny, nové fenotypy
- Diagnostika a další péče o pacienty s tyreoidálními uzly: doporučení American Thyroid Association 2015 modifikované pro podmínky České republiky
- Adrenokortikální insuficience
- Hypogonadismus u mužů a jeho léčba
- Léčba hypofyzárních adenomů
- Biologické aspekty ADHD (hyperkinetické poruchy) a poruch chování v dětském a adolescentním věku, vybrané preventivní aspekty
- Shoda čistě náhodná – Josef Charvát a Ctibor Blattný
- Nikolaj Ivanovič Pirogov: myslitel
- Sto let od narození doc. MUDr. Adolfa Zeleného
- Prof. MUDr. Pavel Mareš, DrSc., osmdesátiletý
- Prof. MUDr. Jaromír Hradec, CSc., sedmdesátníkem
- Přednáškový sál Lékařského domu po rekonstrukci znovu otevřen
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hypogonadismus u mužů a jeho léčba
- Nadměrný růst u dětí a dospělých: nový klinický pohled, nové geny, nové fenotypy
- Adrenokortikální insuficience
- Diagnostika a další péče o pacienty s tyreoidálními uzly: doporučení American Thyroid Association 2015 modifikované pro podmínky České republiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



