-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba hypofyzárních adenomů
Treatment of pituitary adenomas
Pituitary adenomas are the most common tumours of the sellar region. A combination of neurosurgery, radiation and pharmacological approaches are applied for the treatment of pituitary adenomas. In certain cases, patient observation is another option. Neurosurgery is the first-choice treatment for acromegaly, Cushing´s disease and TSH secreting adenomas. Leksell gamma knife irradiation is used in the treatment of tumour residues. Until the effect of the irradiation is evident, pharmacological treatment must be administered. Large and/or growing non-functioning pituitary adenomas are operated. Irradiation is possible if there is sufficient distance between the margin of the adenoma and the optic pathway. The primary therapy for prolactinomas is pharmacological treatment with dopamine agonists. Multidisciplinary collaboration among endocrinologists, neurosurgeons and radiosurgeons is necessary in the treatment of pituitary adenomas.
Keywords:
pituitary adenoma, acromegaly, Cushing´s disease, prolactinoma, gamma knife, hypopituitarism
Autoři: Jana Ježková; Josef Marek; Manuela Vaněčková
Působiště autorů: Radiodiagnostická klinika 1. LF UK a VFN v Praze ; 3. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Vyšlo v časopise: Čas. Lék. čes. 2017; 156: 266-270
Kategorie: Přehledový článek
Souhrn
Hypofyzární adenomy jsou nejčastější tumory selární oblasti. V jejich terapii se kombinují postupy neurochirurgické, radiační a medikamentózní. Ve vybraných případech je možným přístupem i observace pacienta. U akromegalie, Cushingovy choroby a TSH produkujících adenomů je metodou volby neurochirurgický výkon. V léčbě rezidua adenomu se uplatňuje ozáření Leksellovým gama nožem, do nástupu účinku gama nože je podávána medikamentózní léčba. Velké a progredující afunkční adenomy necháváme operovat; pokud jsou dostatečně vzdálené od optických struktur, je možné jejich ozáření. U prolaktinomů je primární léčbou medikamentózní léčba dopaminergními agonisty. Při léčbě hypofyzárních adenomů je nezbytná mezioborová spolupráce endokrinologa, neurochirurga a radiochirurga.
Klíčová slova:
hypofyzární adenom, akromegalie, Cushingova choroba, prolaktinom, gama nůž, hypopituitarismusÚVOD
Hypofyzární adenomy jsou nejčastější expanzivní procesy, které se vyskytují v selární a supraselární oblasti. Prevalence výskytu hypofyzárních adenomů činí v pitevních souborech 14,4 %, v radiologických studiích (CT a MR) 22,5 % (1). Pokud se vychází z dat průřezových epidemiologických studií, pak se výskyt klinicky diagnostikovaných adenomů pohybuje mezi 57 a 94/100 000 obyvatel. Nejčastějším typem adenomu jsou prolaktinomy (57–66 %), následují klinicky afunkční adenomy (15–28 %), akromegalie (růstový hormon produkující adenomy) (11–13 %) a Cushingova choroba (ACTH produkující adenomy) (2–6 %). Výjimečně se vyskytují tyreotropinomy (TSH produkující adenomy) a funkční gonadotropinomy (LH a/nebo FSH produkující adenomy) (2, 3).
Z diagnostikovaných adenomů je nutné léčit adenomy s klinickými projevy. Patří k nim makroadenomy (adenomy ˃ 1 cm), jež ohrožují nebo by svým růstem mohly ohrozit okolní struktury (útlak zrakových nervů a drah s poruchou zorného pole, porušení funkce okohybných nervů s rozvojem diplopie a ptózy a poškození funkce zdravé hypofyzární tkáně s rozvojem hypopituitarismu různého stupně), a adenomy s hormonální nadprodukcí.
V léčbě hypofyzárních adenomů máme k dispozici postupy neurochirurgické, radiační a medikamentózní. Často je nutná vzájemná kombinace těchto léčebných modalit. Výjimkou jsou prolaktinomy s převažující léčbou medikamentózní.
Úspěšnost neurochirurgické léčby je ovlivněna několika faktory. Důležitá je velikost a lokalizace adenomu. Je známo, že 30 % adenomů hypofýzy roste invazivně. Rozhodující je vztah adenomu a kavernózního splavu, protože v případě kompletní propagace do kavernózního splavu není radikální resekce adenomu dosažitelná (4). Výsledek je ovlivněn zkušeností neurochirurga a technickým vybavením pracoviště. Za zkušeného je považován neurochirurg, který operuje alespoň 50 hypofyzárních adenomů ročně. Úspěšnost a radikalita operace je zlepšena při použití endoskopického endonazálního přístupu a intraoperační magnetické rezonance (iMRI).
V radiační léčbě se uplatňuje většinou stereotaktická léčba pomocí Leksellova gama nože, méně často lineární urychlovač (LINAC) nebo kybernetický nůž (CyberKnife). Léčba gama nožem je možná při splnění následujících podmínek: velikost adenomu je únosná pro ozáření gama nožem (průměr hormonálně aktivního adenomu do 2,5 cm, afunkčního adenomu do 3 cm), adenom není v kontaktu se zrakovou dráhou, je možné jej na magnetické rezonanci odlišit od zdravé hypofyzární tkáně a není cystický (5). Nejvíce obávanou komplikací léčby gama nožem je poškození zdravé hypofyzární tkáně. Rozvoji hypopituitarismu je možné předejít, pokud je ozařovací dávka na zdravou hypofýzu < 15 Gy a na hypofyzární stopku < 17 Gy (6).
PROLAKTINOMY
Adenomy se sekrecí prolaktinu se projevují u žen infertilitou, poruchami menstruačního cyklu a galaktoreou, u mužů poklesem libida a potence a infertilitou, výjimečně gynekomastií a vzácně galaktoreou. Makroprolaktinomy se manifestují i příznaky z lokální expanze.
Je nutné upozornit, že zvýšená hladina prolaktinu nemusí vždy znamenat diagnózu prolaktin secernujícího adenomu hypofýzy. Rozhodující je koncentrace prolaktinu. Hladina prolaktinu > 250 µg/l, pokud se nejedná o gravidní ženu, znamená téměř jistou diagnózu prolaktinomu, MRI se zaměřením na turecké sedlo adenom obvykle potvrdí. Pokud je hladina prolaktinu nižší, může se jednat buď o prolaktinom, nebo o afunkční expanzivní proces, tzv. pseudoprolaktinom, způsobující hyperprolaktinemii útlakem hypofyzární stopky. Jestliže na základě stanovení prolaktinu nelze odlišit prolaktinom od pseudoprolaktinomu (šedá zóna 100–250 µg/l), je na místě terapeutický test s podáním dopaminergních agonistů (DA). Rozlišení je důležité pro další léčebnou strategii: při podávání DA dochází u pravého prolaktinomu k normalizaci prolaktinemie, zmenšení tumoru v MRI obrazu a zlepšení nálezu na perimetru při poruše zorného pole.
Obr. 1. 28letý pacient s prolaktin secernujícím makroadenomem hypofýzy: před léčbou dopaminergními agonisty (a); zmenšení adenomu při léčbě DA po dobu 3 měsíců (b); další zmenšení při léčbě DA po dobu 1 roku (c) a 2,5 roku (d). 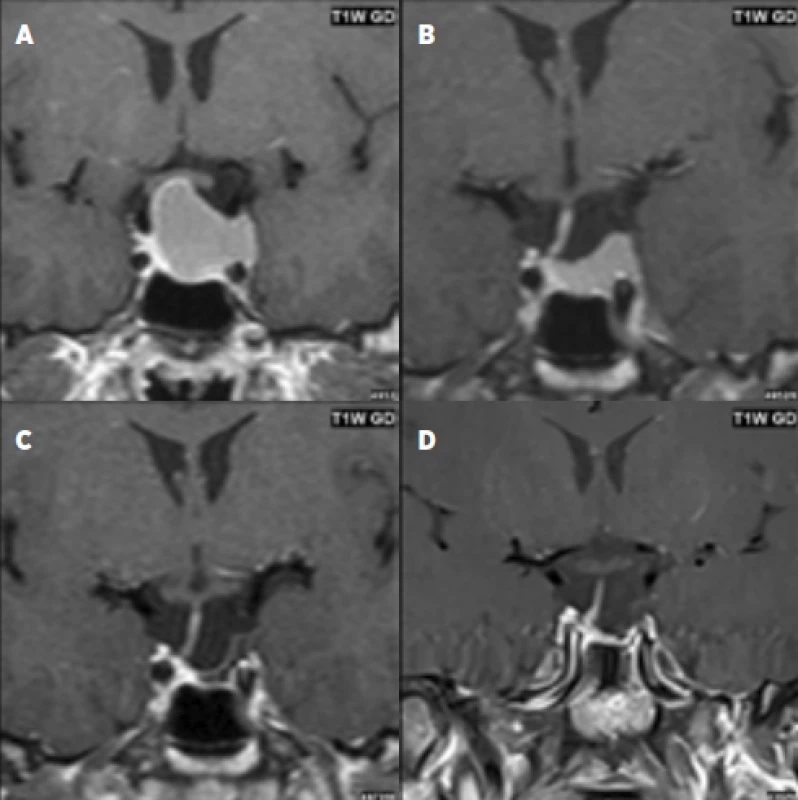
Vyskytnout se může i hyperprolaktinemie jiného než hypofyzárního původu při současné existenci drobné afunkční hypofyzární expanze (incidentalomu) nebo naopak drobný prolaktinom nemusí být na MRI detekovatelný.
Metodou volby u prolaktinomů (i makroprolaktinomů s útlakem zrakové dráhy) je medikamentózní léčba dopaminergními agonisty receptorů D2. V současné době máme v České republice k dispozici 3 přípravky v tabletové formě: bromokryptin (2,5 mg) s dobou trvání účinku 8–12 hodin, kabergolin (0,5 mg) s dobou trvání účinku delší než 168 hodin a chinagolid (pro úvodní léčbu 50 µg + 25 µg, dále 70 µg a 150 µg) s dobou trvání účinku 24 hodin. Dávky používané k léčbě prolaktinomů jsou individuální. S ohledem na dosažení dobré tolerance medikamentózní léčby je nutné podávání léku ve vzestupných dávkách, po jídle, zpravidla na noc. Z nežádoucích účinků se nejčastěji vyskytují nauzea až zvracení, ortostatická hypotenze, pocity slabosti, méně často bolesti hlavy, kongesce nosní sliznice, zácpa, psychické změny (úzkost, deprese), manifestace psychotických příznaků, poruchy spánku. Ve většině případů je léčba tolerována dobře. Léková intolerance je popisována u 12 % pacientů léčených bromokryptinem a pouze u 3 % léčených kabergolinem (7, 8).
Léčba kabergolinem vede k normalizaci prolaktinemie u 80–90 % mikroprolaktinomů a 80 % makroprolaktinomů (9–11). Při použití dostatečně vysokých dávek kabergolinu je rezistence prolaktinomů vzácná. U většiny adenomů dochází i k výraznému zmenšení velikosti prolaktinomu a u mikroprolaktinomů může dojít i k jejich vymizení (12, 13).
Asymptomatická hyperprolaktinemie u žen se neléčí. Ženy s mikroprolaktinomem ve fertilním věku se léčí podáváním dopaminergních agonistů. Pokud je žádoucí gravidita, musejí být hladiny prolaktinu přísně normální. U žen neplánujících graviditu je alternativou léčby dopaminergními agonisty podávání hormonální antikoncepce k úpravě hypogonadismu, s nutností pravidelného sledování hladin prolaktinu pro riziko růstu adenomu. U pacientů s makroprolaktinomy je léčba dopaminergními agonisty nezbytná.
U žen s mikroprolaktinomy se léčba dopaminergními agonisty v graviditě přerušuje. U žen s makroprolaktinomy je potřebné postupovat individuálně. Po graviditě vymizí přibližně 20 % mikroprolaktinomů.
U prolaktinomů se neurochirurgická léčba neuplatňuje jako metoda prvé volby. Je známo, že po operaci makroprolaktinomů se dosáhne dlouhodobé normoprolaktinemie pouze v 30 % případů (14). Neurochirurgická léčba je indikovaná při akutním větším krvácení do adenomu nebo při vzniku píštěle s likvoreou. U farmakorezistentních prolaktinomů nebo nemocných netolerujících medikamentózní léčbu volíme chirurgickou či radiační terapii.
AKROMEGALIE
Akromegalie je relativně vzácné onemocnění způsobené nejčastěji adenomem produkujícím růstový hormon. Zvýšená sekrece růstového hormonu a inzulinu podobného růstového faktoru (IGF-I – insulin-like growth factor I) zvyšuje morbiditu a mortalitu nemocných kardiovaskulárními, respiračními a metabolickými účinky.
Základem léčby akromegalie je terapie chirurgická. U intraselárních mikroadenomů vede neurochirurgická léčba k odstranění tumoru a normalizaci hormonální aktivity akromegalie v 75–95 % případů. U pacientů s neinvazivními makroadenomy (bez invaze do kavernózního splavu nebo kostních struktur) je to však pouze přibližně 40–68 % a tato úspěšnost se dále snižuje u tumorů o velikosti > 2 cm (15–17).
Pokud nedojde k úplné resekci tumoru a normalizaci hormonální aktivity, může být v závislosti na lokalizaci a velikosti rezidua indikovaná reoperace nebo radiační léčba.
V případě, že je neurochirurgický operační výkon kontraindikován nebo pacientem odmítnut, se radiochirurgická terapie uplatňuje jako primární. V některých indikacích, ke kterým patří závažná kardiální dekompenzace nebo obstrukce horních dýchacích cest, se doporučuje podávání medikamentózní léčby (analog somatostatinu) před operačním výkonem.
V radiační léčbě se používá především stereotaktická radioterapie pomocí Leksellova gama nože. Po ozáření rezidua tumoru hypofýzy je nutné počítat s tím, že k normalizaci hormonální aktivity dochází v průběhu několika let. V naší sestavě pacientů s akromegalií léčených gama nožem dosáhlo hormonální normalizace do 8 let po ozáření 85 % a u všech došlo k zástavě růstu nebo ke zmenšení tumoru hypofýzy, respektive jeho rezidua (18). Do uplatnění efektu ozáření je nutné podávání medikamentózní léčby.
V medikamentózní léčbě jsou k dispozici dopaminergní agonisté, analoga somatostatinu a antagonista růstového hormonu.
Z dopaminergních agonistů je v léčbě akromegalie účinný pouze kabergolin. Hormonální normalizace je u pacientů s nižší aktivitou akromegalie s hodnotami koncentrací IGF-I < 750 µg/l dosahováno ve 20–30 % případů (19, 20).
Většina STH produkujících adenomů si zachovává citlivost k inhibičnímu účinku somatostatinu. V současné době užívaná somatostatinová analoga jsou depotní formy oktreotidu a lanreotidu, které se váží a působí především prostřednictvím somatostatinových receptorů typu 2 a 5. Preparáty s pomalým uvolňováním podáváme obvykle jednou za 4 týdny, u lanreotidu v dávce 60–120 mg a u oktreotidu v dávce 20–30 mg (zřídka více). Mezi nežádoucí účinky patří především břišní diskomfort a průjem v prvních dnech po aplikaci, tyto obtíže však po několika aplikacích u většiny pacientů ustupují. Nejzávažnějším nežádoucím účinkem je vznik cholecystolitiázy (převážně sludge nebo mikrolitiáza) až u 30 % léčených pacientů (21). K normalizaci růstového hormonu a IGF-I dochází u 50–70 % nemocných, ke zmenšení tumoru hypofýzy u 66 % (22).
U 42–50 % pacientů rezistentních na samotná somatostatinová analoga může kombinace SSA s kabergolinem zlepšit výsledek léčby (19). U pacientů rezistentních k léčbě dopaminergními agonisty a somatostatinovými analogy je indikovaná léčba blokátorem receptorů pro růstový hormon – pegvisomantem – podává se buď samostatně nebo častěji v kombinaci se somatostatinovými analogy. Nejzávažnějším nežádoucím účinkem je hepatopatie s elevací jaterních enzymů, ve většině případů pouze tranzitorní (23).
ACTH PRODUKUJÍCÍ ADENOMY
Endogenní hyperkortisolismus je způsoben v 70 % případů nadprodukcí ACTH (adrenokortikotropní hormon) v hypofýze (Cushingova choroba), v absolutní většině případů adenomem (v 85 % mikroadenomem, vzácně hyperplazií kortikotropních buněk a velmi vzácně karcinomem).
Hyperkortisolismus je spojen s vysokou morbiditou a mortalitou, především na kardiovaskulární onemocnění v důsledku aterosklerotických změn.
Metodou volby léčby ACTH produkujících adenomů je neurochirurgické odstranění tumoru. Operační výkon vede k vyléčení 73–76 % mikroadenomů a 43 % makroadenomů (24), k recidivě však dochází v 15–66 % případů v období 5–10 let po operaci (25). Pokud neurochirurgická léčba nevede k hormonální normalizaci a magnetická rezonance prokáže reziduum, bývá dalším léčebným krokem radiační léčba, nejčastěji ozáření Leksellovým gama nožem. Do uplatnění efektu gama nože je podávána medikamentózní léčba. V naší skupině pacientů s Cushingovou chorobou léčených gama nožem dosáhlo hormonální normalizace 81 % (26).
K farmakologické léčbě jsou používány blokátory steroidogeneze metyrapon (250 mg) a ketokonazol. Metyrapon lze získat individuálním dovozem. K nežádoucím účinkům patří gastrointestinální obtíže, hepatopatie, u žen rozvoj hirsutismu a akné. U ketokonazolu je možná magistraliter příprava v lékárně. Z nežádoucích účinků se může projevit hepatotoxicita, u mužů pak v důsledku blokace tvorby androgenů pokles libida a gynekomastie. U části pacientů působí snížení sekrece ACTH z buněk tumoru kabergolin. Přímo na buňky hypofyzárního tumoru působí somatostatinový analog pasireotid. Jeho nejzávažnějším nežádoucím účinkem je vyvolání poruchy glukózové tolerance až rozvoj diabetu mellitu (27). Často je potřeba podávat kombinovanou medikamentózní léčbu.
Pokud se nedaří normalizovat hormonální aktivitu uvedenými způsoby, je možné indikovat (v současné době již vzácně) bilaterální adrenalektomii.
TSH SECERNUJÍCÍ ADENOMY
Jedná se o vzácné hypofyzární adenomy. Pro onemocnění jsou typické klinické příznaky hypertyreózy různého stupně. Metodou volby je neurochirurgický výkon. Před operací hypofýzy se doporučuje upravit hyperfunkční stav tyreostatiky. Symptomy je možné ovlivnit podáváním betablokátorů. Tyreotropinomy jsou obvykle velké adenomy, proto bývá úplného odstranění adenomu s dlouhodobou remisí dosaženo jen u 40 % nemocných (28), recentní studie však udávají úspěšnost až u 80 % pacientů (29, 30). V případě parciálního operačního výkonu nebo recidivy adenomu je doporučována reoperace, medikamentózní léčba nebo radioterapie.
Tyreotropinomy jsou obvykle velmi citlivé na léčbu depotními somatostatinovými analogy lanreotidem a oktreotidem. K hormonální normalizaci dochází v 85–95 % případů (31, 32), tedy podstatně častěji než u akromegalií. Ke zmenšení velikosti adenomu dochází v 50 % případů (33). Na našem pracovišti dáváme přednost ozáření pooperačních reziduí – pokud je to možné, tak Leksellovým gama nožem. Somatostatinová analoga užíváme v mezidobí mezi ozářením gama nožem a jeho účinkem. Podobně jako u jiných hypofyzárních adenomů je s ohledem na riziko recidivy onemocnění nutná dlouhodobá dispenzarizace.
KLINICKY AFUNKČNÍ ADENOMY
Přístup ke klinicky afunkčním adenomům je závislý na jejich velikosti, lokalizaci a růstu. K růstu mikroadenomu do velikosti makroadenomu dochází v 7–10 % případů, některé mikroadenomy se naopak zmenšují. U makroadenomů dochází k růstu v 7–51 %, rychlost zvětšování je velmi variabilní, u starších nemocných rostou adenomy 2,5× pomaleji (34, 35). Je nutné zmínit, že první klinickou známkou afunkčního hypofyzárního adenomu může být krvácení do adenomu, vyskytuje se až u 10 % makroadenomů (36).
Afunkční mikroadenomy, jež nejeví dynamiku růstu, pouze sledujeme. Indikací k léčebnému zásahu u makroadenomů jsou větší velikost s extraselárním, zejména supraselárním šířením s útlakem optických nervů nebo těsným vztahem k nim, bolesti hlavy a růst tumoru v průběhu sledování, případně rozvoj hypopituitarismu.
Operační léčba je indikovaná u adenomu v blízkosti zrakové dráhy a chiasmatu a u objemných tumorů. Ostatní adenomy lze ozářit Leksellovým gama nožem, pokud je splněno kritérium velikosti (adenom < 3 cm) a jsou-li dobře ohraničené na magnetické rezonanci. Léčen by měl být každý klinicky afunkční adenom ˃ 2 cm a i menší adenomy výrazně progredující v růstu. U pacientů s pooperačním reziduem je možné v 50 % případů očekávat nový růst, který může vzniknout i několik let od operace (37). Větší rezidua jsou indikovaná k ozáření gama nožem, menší je nutné dlouhodobě sledovat.
U afunkčních adenomů vede farmakologická léčba dopaminergními agonisty (kabergolinem) ke zmenšení tumoru ve 30 % případů, přínosná je především u rizikových pacientů vyššího věku neúnosných k operačnímu řešení (38). Afunkční makroadenomy je nutné sledovat celoživotně, protože k růstu může dojít i po mnoha letech.
Obr. 2. 67letý pacient s afunkčím makroadenomem se supraselární propagací s útlakem chiasmatu a panhypopituitarismem (a, b), 1. den po operaci (c, d) a 4 měsíce po operaci (e, f) – magnetická rezonance bez průkazu rezidua tumoru, po stránce hormonální došlo k úpravě panhypopituitarismu. 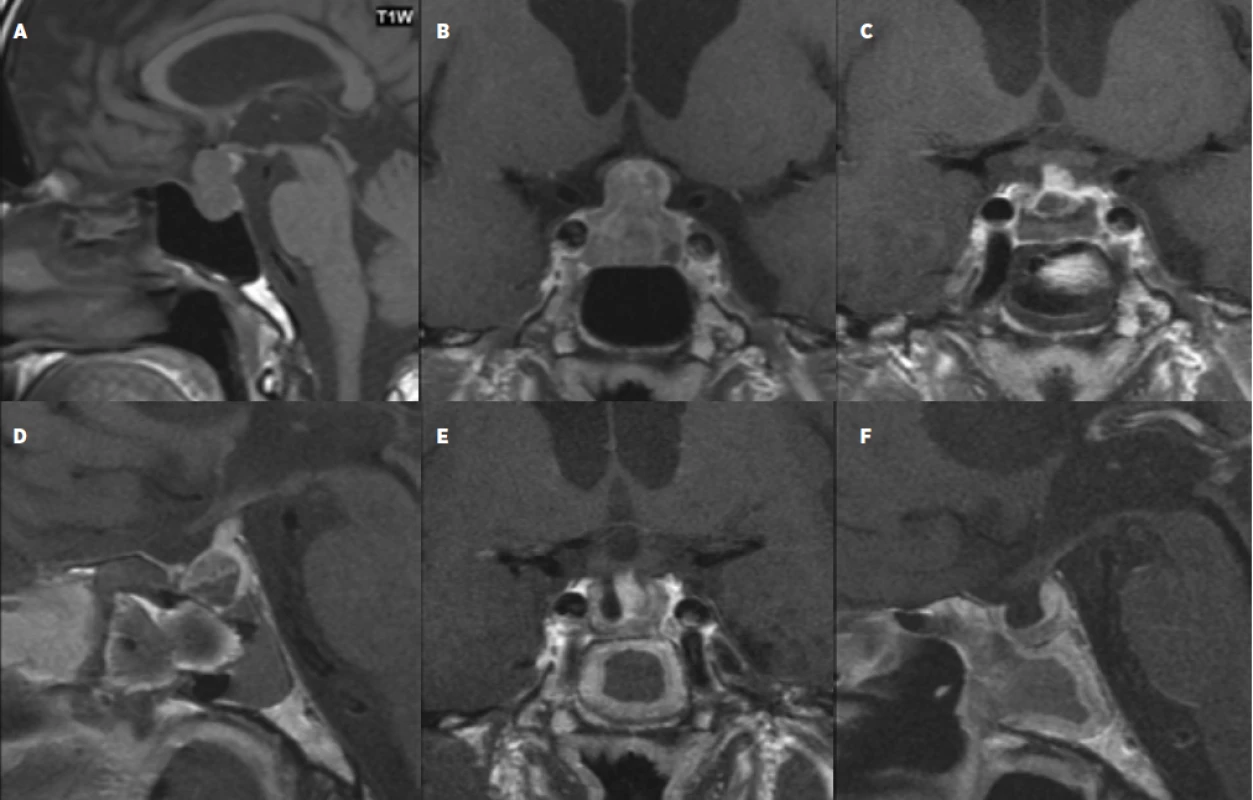
Seznam použitých zkratek
ACTH adrenokortikotropní hormon
DA dopaminergní agonisté
FSH folikulostimulační hormon
IGF-I inzulinu podobný růstový faktor 1
LH luteinizační hormon
MRI magnetická rezonance
SA somatostatinová analoga
STH somatotropní hormon
TSH tyreoideu stimulující hormon
Adresa pro korespondenci:
MUDr. Jana Ježková, Ph.D.
3. interní klinika 1. LF UK a VFN v Praze
U Nemocnice 1
128 00 Praha 2
Tel.: 224 966 695
e-mail: jana.jezkova@vfn.cz
Zdroje
1. Ezzat S, Asa SL, Couldwell WT et al. The prevalence of pituitary adenomas: a systematic review. Cancer 2004; 101 (3): 613–619.
2. Daly AF, Rixhon M, Adam C et al. High prevalence of pituitary adenomas: a cross-sectional study on the province of Liege, Belgium. J Clin Endocrinol Metab 2006; 91(12): 4769–4775.
3. Fernandez A, Karavitaki N, Wass JA. Prevalence of pituitary adenomas: a community-based, cross-sectional study in Banbury (Oxfordshire, UK). Clin Endocrinol 2010; 72(3): 377–382.
4. Netuka D, Masopust V, Beneš V. Léčba adenomů hypofýzy. Česk Slov Neurol N 2011; 74/107 (3): 240–253.
5. Liščák R. Adenom hypofýzy. In: Liščák R. (ed.). Radiochirurgie gama nožem. Grada Publishing, Praha, 2009 : 114–127.
6. Marek J, Ježková J, Hána V et al. Is it possible to avoid hypopituitarism after irradiation of pituitary adenomas by the Leksell gamma knife? Eur J Endocrinol 2011; 164 : 169–178.
7. Rains CP, Bryson HM, Fitton A. Cabergoline. A review of its pharmacological properties and therapeutic potential in the treatment of hyperprolactinemia and inhibition lactation. Drugs 1995; 49 : 255–279.
8. Webster J. A comparative review of the tolerability profiles of dopamine agonists in the treatment of hyperprolactinemia and inhibition lactation. Drug Saf 1996; 14 (4): 228–238.
9. Colao A, di Sarno A, Pivonello R et al. Dopamine receptor agonists for treating prolactinomas. Expert Opin Investig Drugs 2002; 11 : 787–800.
10. Webster J, Piscitelli G, Polli A et al. A comparison of cabergoline and bromocriptine in the treatment of hyperprolactinemic amenorrhea. Cabergoline comparative study group. N Engl J Med 1994; 331(14): 904–909.
11. Colao A, Di Sarno A, Sarnacchiaro F et al. Prolactinoma resistant to standard dopamine agonists respond to chronic cabergoline treatment. J Clin Endocrinol Metab 1997; 82(3): 876–883.
12. Colao A, Di Sarno A, Cappabianca P et al. Withdrawal of long-term cabergoline therapy for tumoral and nontumoral hyperprolactinemia. N Engl J Med 2003; 349 (21): 2023–2033.
13. Colao A, Di Sarno A, Landi ML et al. Long-term and low-dose treatment with cabergoline induces macroprolactinoma shrinkage. J Clin Endocrinol Metab 1997; 82 : 3574–3579.
14. Gillam MP, Molitch ME, Lombardi G, Colao A. Advances in the treatment of prolactinomas. Endocr Rev 2006; 27(5): 485–534.
15. Kaltsas GA, Isidori AM, Florakis D et al. Predictors of the outcome of surgical treatment in acromegaly and the value of the mean growth hormone day curve in assessing postoperative disease activity. J Clin Endocrinol Metab 2001; 86 : 1645–1652.
16. Nomikos P, Buchfelder M, Fahlbusch R. The outcome of surgery in 668 patients with acromegaly using current criteria of biochemical "cure". Eur J Endocrinol 2005; 152 : 379–387.
17. Ludecke DK, Abe T. Transsphenoidal microsurgery for newly diagnosed acromegaly: a personal view after more than 1.000 operations. Neuroendocrinology 2006; 83 : 230–239.
18. Ježková J, Marek J, Hána V et al. Gamma knife radiosurgery for acromegaly. Clin Endocrinol 2006; 64 : 588–595.
19. Sandret L, Maison P, Chanson P. Place of cabergoline in acromegaly: a meta-analysis. J Clin Endocrinol Metab 2011; 96 : 1327–1335.
20. Abs R, Verhelst J, Maiter D et al. Cabergoline in the treatment of acromegaly: a study in 64 patients. J Clin Endocrinol Metab 1998; 83 : 374–378.
21. Murray RD, Melmed S. A critical analysis of clinically available somatostatin analog formulations for therapy of acromegaly. J Clin Endocrinol Metab 2008; 93 : 2957–2968.
22. Giustina A, Mazziotti G, Torri V et al. Meta-analysis on the effects of octreotide on tumor mass in acromegaly. PLoS One 2012; 7: e36411.
23. Van der Lely AJ, Biller BM, Brue T et al. Long-term safety of pegvisomant in patients with acromegaly: comprehensive review of 1288 subjects in ACROSTUDY. J Clin Endocrinol Metab 2012; 97 : 1589–1597.
24. Alexandraki KI, Kaltsas GA, Isidori AM et al. Long-term remission and recurrence rates in Cushing's disease: predictive factors in a single-centre study. Eur J Endocrinol 2013; 168 : 639–648.
25. Aranda G, Ensenat J, Mora M et al. Long-term remission and recurrence rate in a cohort of Cushing's disease: the need for long-term surveillance. Clin Endocrinol 2005; 63 : 549–559.
26. Marek J, Ježková J, Hána V et al. Gamma knife radiosurgery for Cushing's disease and Nelson's syndrome. Pituitary 2015; 18 (3): 376–384.
27. Colao A, Petersenn S, Newell-Price J et al. A 12-month phase 3 study of pasireotide in Cushing's disease. N Engl J Med 2012; 366 : 914–924.
28. Beck-Peccoz P, Brucker-Davis F, Persani L et al. Thyrotropin-secreting pituitary tumors. Endocr Rev 1996; 17 : 610–638.
29. Yamada S, Fukuhara N, Horiguchi K et al. Clinicopathological characteristics and therapeutic outcomes in thyrotropin-secreting pituitary adenomas: a single-center study of 90 cases. J Neurosurg 2014; 121 : 1462–1473.
30. Kirkman MA, Jaunmutkane Z, Brandner S et al. Active and silent thyroid-stimulating hormone-expressing pituitary adenomas: presenting symptoms, treatment, outcomes, and recurrence. World Neurosurg 2014; 82 : 1224–1231.
31. Kuhn JM, Arlot S, Lefebvre H et al. Evaluation of the treatment of thyroid-secreting pituitary adenomas with a slow release of the somatostatin analog lanreotide. J Clin Endocrinol Metab 2000; 85 : 1487–1491.
32. Caron P, Arlot S, Bauters C et al. Efficacy of the long-acting octreotide formulation (octreotide –LAR) in patients with thyrotropin-secreting pituitary adenomas. J Clin Endocrinol Metab 2001; 86 : 2849–2853.
33. Beck-Peccoz P, Persani L. Medical management of thyrotropin-secreting pituitary adenomas. Pituitary 2002; 5 : 83–88.
34. Karavitaki N, Collinson K, Halliday J et al. What is the natural history of nonoperated nonfunctioning pituitary adenomas? Clin Endocrinol 2007; 67 : 938–943.
35. Dekkers OM, Hammer S, de Keizer RJ et al. The natural course of non-functioning pituitary macroadenomas. Eur J Endocrinol 2007; 156 : 217–224.
36. Wakai S, Fukushima T, Teramoto A et al. Pituitary apoplexy: its incidence and clinical significance. J Neurosurg 1981; 55 : 187–193.
37. Woollons AC, Hunn MK, Rajapakse YR et al. Non-functioning pituitary adenomas: indications for postoperative radiotherapy. Clin Endocrinol 2000; 53(6): 713–717.
38. Pivonello R, Matrone C, Filippella M et al. Dopamine receptor expression and function in clinically functioning pituitary tumors: comparison with the effectiveness of cabergoline treatment. J Clin Endocrinol Metab 2004; 89 : 1674–1683.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Editorial
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- 120 let od narození profesora Josefa Charváta
- Editorial
- Nadměrný růst u dětí a dospělých: nový klinický pohled, nové geny, nové fenotypy
- Diagnostika a další péče o pacienty s tyreoidálními uzly: doporučení American Thyroid Association 2015 modifikované pro podmínky České republiky
- Adrenokortikální insuficience
- Hypogonadismus u mužů a jeho léčba
- Léčba hypofyzárních adenomů
- Biologické aspekty ADHD (hyperkinetické poruchy) a poruch chování v dětském a adolescentním věku, vybrané preventivní aspekty
- Shoda čistě náhodná – Josef Charvát a Ctibor Blattný
- Nikolaj Ivanovič Pirogov: myslitel
- Sto let od narození doc. MUDr. Adolfa Zeleného
- Prof. MUDr. Pavel Mareš, DrSc., osmdesátiletý
- Prof. MUDr. Jaromír Hradec, CSc., sedmdesátníkem
- Přednáškový sál Lékařského domu po rekonstrukci znovu otevřen
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hypogonadismus u mužů a jeho léčba
- Nadměrný růst u dětí a dospělých: nový klinický pohled, nové geny, nové fenotypy
- Adrenokortikální insuficience
- Diagnostika a další péče o pacienty s tyreoidálními uzly: doporučení American Thyroid Association 2015 modifikované pro podmínky České republiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



