-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endoskopické optické zobrazovací metody v diagnostice nádorů hrtanu
Endoscopic optical imaging methods in the diagnostics of the laryngeal cancer
Endoscopic optical imaging methods for the detection of mucosal lesions in the ENT area have been developed for better and earlier detection of these changes. They can be divided into horizontal methods group - showing the surface of the mucous membrane (autofluorescence, photodynamic diagnosis, Narrow Band Imaging, magnifying and contact endoscopy) and vertical methods group - visualizing different layers of the mucosa (optical coherence tomography and confocal endomicroscopy). Some of them are routinely used in practice, others are used in experimental mode and their introduction into practice may be a matter of the near future. The authors present a comprehensive overview of available endoscopic optical imaging methods.
Keywords:
endoscopy, optical imaging methods, autofluorescence, photodynamic diagnosis, narrowband imaging, NBI, confocal endomicroscopy, optical coherence tomography
Autoři: Petr Lukeš; Eva Lukešová; Michal Zábrodský; Jaroslav Sýba; Vít Kratochvíl; Adam Kešner; Michal Votava; Jan Plzák
Působiště autorů: Katedra otorinolaryngologie IPVZ ; Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN Motol, Praha
Vyšlo v časopise: Čas. Lék. čes. 2017; 156: 192-196
Kategorie: Přehledové články
Souhrn
Endoskopické optické zobrazovací metody pro detekci slizničních lézí v ORL oblasti byly vyvinuty s cílem lepšího a časnějšího záchytu těchto změn. Dělí se na horizontální metody, zobrazující povrch sliznice (autofluorescence, fotodynamická diagnostika, úzkopásmové zobrazení – narrow band imaging, zvětšovací a kontaktní endoskopie), a metody vertikální, umožňující zobrazit různé vrstvy sliznice (optická koherentní tomografie a konfokální endomikroskopie). Některé z nich jsou rutinně využívané v praxi, ostatní se využívají v experimentálním režimu a jejich zavedení do praxe může být otázkou blízké budoucnosti. Autoři předkládají souhrnný přehled dostupných endoskopických optických zobrazovacích metod.
Klíčová slova:
endoskopie, optické zobrazovací metody, autofluorescence, fotodynamická diagnostika, úzkopásmové zobrazení, NBI, konfokální endomikroskopie, optická koherentní tomografieÚVOD
Nejčastějším maligním nádorem hrtanu je spinocelulární karcinom (1). Jedná se o nádor vycházející z buněk epitelu sliznice. Jeho růst je metabolicky náročný a je vždy doprovázen neovaskularizací, která je nádorem indukována – nádor si tímto způsobem zajišťuje dostatečný přísun živin pro svůj růst (2). Léčba karcinomu hrtanu může být chirurgická či onkologická (radioterapie nebo kombinace chemoterapie a radioterapie) (3). Zcela zásadní pro úspěšnost léčby karcinomu hrtanu je jeho časný záchyt, ideálně ještě v tzv. přednádorových stadiích (dysplazie, karcinom in situ). Chirurgická a onkologická léčba pokročilých tumorů může vést k výrazné mutilaci postižené osoby. U karcinomu hrtanu vede k výrazným funkčním obtížím, jako jsou např. poruchy polykání nebo ztráta fonační funkce (4).
Identifikace a rozlišení přednádorových stavů mohou být velice složité, proto byly do praxe zavedeny různé endoskopické optické zobrazovací metody zpřesňující možnosti diagnostiky (5). Důležitou součástí úspěšné terapie je přesné určení rozsahu postižení tak, aby bylo s jistotou dosaženo radikální resekce, pokud je onemocnění indikované k chirurgické léčbě (6). Další možností, kde se v budoucnu očekává uplatnění endoskopických optických zobrazovacích metod, je takzvaná předhistologická diagnostika (7, 8). Zejména u časného karcinomu glottis je výhodné provést radikální výkon v jedné době, dříve než je znám definitivní výsledek histologie. Některými autory je proto používán termín „optická biopsie“.
Cílem endoskopických resekcí pro nádor hrtanu je nejen radikální odstranění, ale zároveň maximální snaha o zachování funkce – tedy hlasu a polykání. Provedení probatorní excize glotického karcinomu s radikálním výkonem v druhé době s sebou nese riziko nutnosti provedení výkonu většího rozsahu vzhledem k tomu, že dojde k zajizvení tkání a následně může být složité odlišit skutečný nádor od jizvy. Rovněž bylo popsáno, že zhruba u 22 % nálezů, kde je provedena předchozí probatorní histologie, již není při dalším výkonu původní nádor nalezen, a dochází tedy ke zbytečné radikalizaci, která může vést ke zhoršení funkce hrtanu (9). Stejné riziko se teoreticky týká i pacientů léčených po provedení biopsie zevní radioterapií.
V současné době je používáno několik endoskopických optických zobrazovacích metod. Některé jsou již zcela běžné v rutinní praxi, další jsou využívány spíše v experimentálním režimu a jejich zavedení do praxe je otázkou budoucnosti. Endoskopické optické zobrazovací metody lze rozdělit na horizontální, zobrazující povrch sliznice, a vertikální, které dokáží zobrazit různé vrstvy sliznice (10). Na Klinice otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN Motol jsou rutinně používány narrow band imaging, zvětšovací, kontaktní endoskopie a autofluorescence. Ostatní metody uvádíme pro úplnost v přehledu.
HORIZONTÁLNÍ OPTICKÉ ZOBRAZOVACÍ METODY
Autofluorescence
Autofluorescenci k diagnostice tumorů hrtanu jako první použili Harries et al. v roce 1995 (11). Ve sliznici hrtanu se běžně nacházejí porfyriny, elastin, kolagen a nikotinamidadenindinukleotid (NADH) (12). Tyto molekuly mají schopnost fotoluminiscenčního záření, tzv. autofluorescence, a jsou nazývány fluorofory. V klidovém stavu neemitují žádné záření. Pokud jsou ozářeny světlem o krátké vlnové délce, např. ultrafialovým (UV), jejich elektrony jsou excitovány na vyšší energetickou hladinu. V tomto stavu jsou fluorofory nestabilní a rychle se navracejí do stabilnějšího stavu na nižší energetickou hladinu vyzářením tepla. Do základního stavu se poté dostávají vyzářením světla. Vzhledem k tomu, že část energie již byla uvolněna vyzářením tepla, emitované světlo má nižší energii a větší vlnovou délku než světlo, jímž byly fluorofory původně ozářeny. Tento jev lze za použití videoendoskopického systému se speciálními filtry zobrazit. Vzhledem k tomu, že koncentrace fluoroforů je rozdílná ve zdravé sliznici a ve sliznici nádorově změněné, dochází v případě nádorových změn k patrnému útlumu autofluorescence. Na tom se může podílet i zesílení vrstvy epitelu a zvýšené prokrvení u patologických lézí. Zdravá sliznice je zobrazována jasně zeleně a patologická sliznice pak modrofialově (13) (obr. 1B).
Obr. 1. Obr. 1 Porovnání zobrazení spinocelulárního karcinomu pravé hlasivky v bílém světle (A), v autofluorescenční (B) a PDD endoskopii (C). 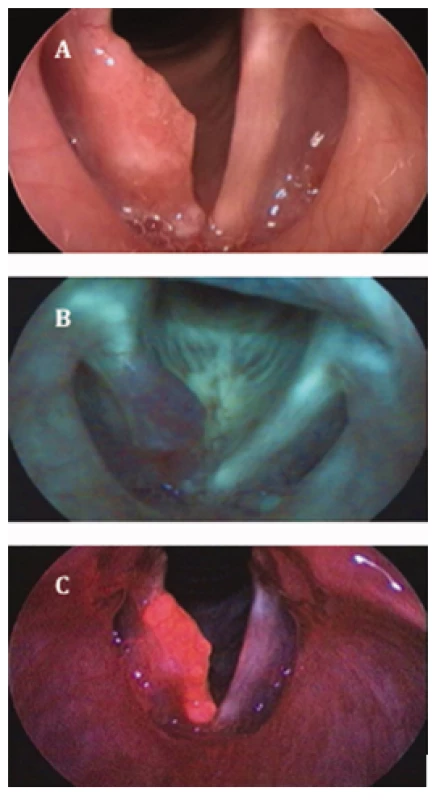
S laskavým svolením Christophera Arense (14). Metoda autofluorescence je rutinně využívána jak v ambulantním režimu, tak v průběhu direktních laryngoskopií v celkové anestezii (14). Umožňuje lepší detekci drobných lézí, které nemusejí být patrné v bílém světle, zároveň také umožňuje přesné určení rozsahu slizničních malignit (15).
Fotodynamická diagnostika (PDD)
Principem PDD je detekce vyzářeného fluorescenčního světla, podobně jako u autofluorescence, v tomto případě je však sliznice hrtanu předem ošetřena lokální aplikací kyseliny 5-aminolevulové (ALA), která vyvolává fluorescenci nádorových buněk. ALA sama o sobě není fluorofor, ale účastní se syntézy hemu. Dvě molekuly ALA kondenzují za vzniku porfobilinogenu, který je dále metabolizován na fluorofor-protoporfyrin IX (PTP). Začleněním železa vzniká hem, který již není fluoroforem. Neoplastické buňky akumulují PTP, protože jsou více propustné pro ALA, a zpomalují přeměnu na hem (16). Výsledkem aplikace ALA na nádorovou sliznici je oranžovo-červená fluorescence po jejím ozáření UV světlem. Zdravá sliznice naopak vyzařuje standardní zelenou autofluorescenci (14) (obr. 1C).
Tato metoda je využívána např. v urologii k detekci nádorů močového měchýře (17). Využití v laryngologii je limitováno velice obtížnou přípravou pacienta, kdy se ALA aplikuje ve formě inhalace a vyšetření je pak prováděno s dvouhodinovým odstupem (14). Rutinně proto v praxi není využívána.
Narrow band imaging (NBI)
Tato metoda využívá charakteristik světelného spektra ke zlepšení zobrazení povrchu sliznice a povrchových slizničních a podslizničních cév (18). Zobrazuje tedy nejen změny v kvalitě epitelu, ale rovněž změny ve slizniční vaskularizaci. To je důležité při zobrazování slizničních neoplazií, které jsou ve většině případů provázeny neovaskularizací (19). Při ní nejprve dochází k růstu, prodlužování a rozšiřování existujících kapilár. Pokračující progrese tumoru je provázena tvorbou nových cév, které postrádají původní organizaci, dochází tak ke ztrátě pravidelnosti uspořádání kapilár a v rozvinutých stadiích nádorového růstu k úplné ztrátě cévní mikroarchitektury (20).
Vyšetření je neinvazivní a lze jej provádět v ambulantním režimu, bez nutnosti sedace pacienta nebo celkové anestezie (21). Systém NBI se skládá ze světelného zdroje, kamerové jednotky a kamerové hlavy nebo čipem vybaveného flexibilního videoendoskopu. Dále obsahuje obrazový procesor a světelný zdroj se sadou filtrů, které propouštějí pouze světlo dvou vlnových délek: 400–430 nm (s maximem na 415 nm) a 525–555 nm (s maximem na 540 nm). Výsledný efekt je založen na různé hloubce průniku světla o definovaných vlnových délkách do hloubky sliznice. Světlo o vlnové délce 415 nm méně proniká do hlubších vrstev a je méně rozptylováno. Modrý filtr je definován tak, aby odpovídal absorpčnímu spektru hemoglobinu; tím dochází ke zlepšení zobrazení terminálních kapilár ve sliznici (IPCL – intraepithelial papillary capillary loops) (20). Světlo o vlnové délce 540 nm proniká do hlubších vrstev a zvýrazňuje hlubší cévní pleteně. Obraz je zachycen digitálním čipem a obrazovým procesorem je následně zpracován a zobrazen v arteficiálním barevném podání na monitoru a umožňuje zvýšit kontrast slizničních struktur (18) (obr. 2).
Obr. 2. Obr. 2 Konvenční (nezvětšovací) NBI endoskopie – spinocelulární karcinom hlasivky: A – přehledný snímek s exofytickou částí tumoru (šipka), B – detail s patrnou patologickou vaskularizací v okrajích tumoru (šipka). 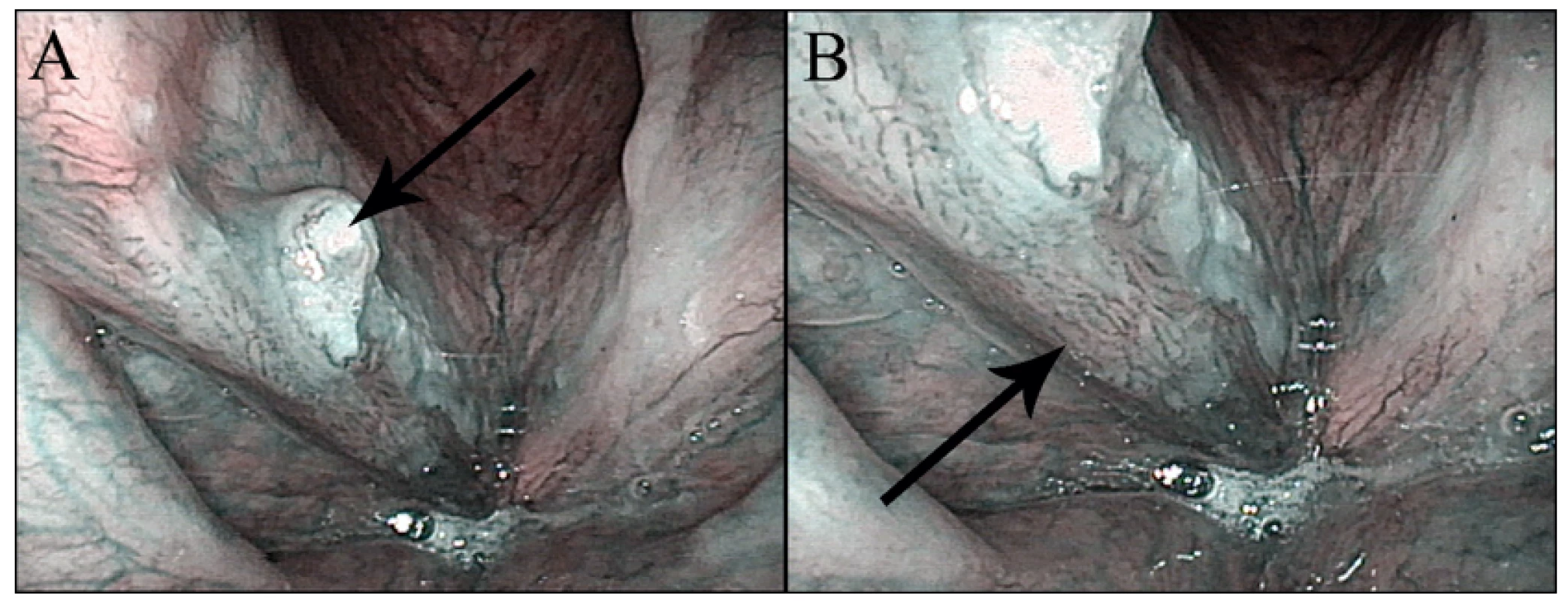
Autor: Petr Lukeš. Cévní struktury jsou zobrazeny s větším kontrastem oproti epitelu, než je tomu při použití bílého světla (22). Při zobrazení povrchových slizničních patologií (dysplazie, karcinom in situ, karcinom) je možné v NBI světle lépe pozorovat změny epitelu (zesílení, změny povrchu) a změny cévního uspořádání. Při neoangiogenezi jsou patrné nepravidelnosti IPCL (rozšiřování, změny tvaru). Tyto změněné IPCL jsou v NBI světle pozorovatelné jako „hnědé tečky“ nepravidelně rozmístěné v ohraničeném ložisku změněného epitelu (18). Díky tomu lze zaznamenat i léze o průměru několika milimetrů. Využitelnost této endoskopie je limitována dosaženým zvětšením a rozlišením. Pro zlepšení výtěžnosti vyšetření je vhodné použít NBI v kombinaci se zvětšovací či kontaktní endoskopií.
Zvětšovací endoskopie
Standardní (nezvětšovací) endoskopy nedovolují, aby mohly být změny ve vaskularizaci detailněji zobrazeny. K dokonalému zobrazení změn IPCL je nutné dosáhnout dostatečného rozlišení a zvětšení. To je umožněno použitím takzvané zvětšovací endoskopie (obr. 3), která umožňuje dosáhnout až 150násobného zvětšení (7) a v kombinaci s televizním obrazem o vysokém rozlišení (HDTV) (7) nebo ultravysokém rozlišení (4K) (23) dovoluje detailní zobrazení slizniční kapilární mikroarchitektury in vivo.
Obr. 3. Zvětšovací NBI endoskopie – stejný nález jako na obr. 2. Detail patologické vaskularizace v okraji tumoru. 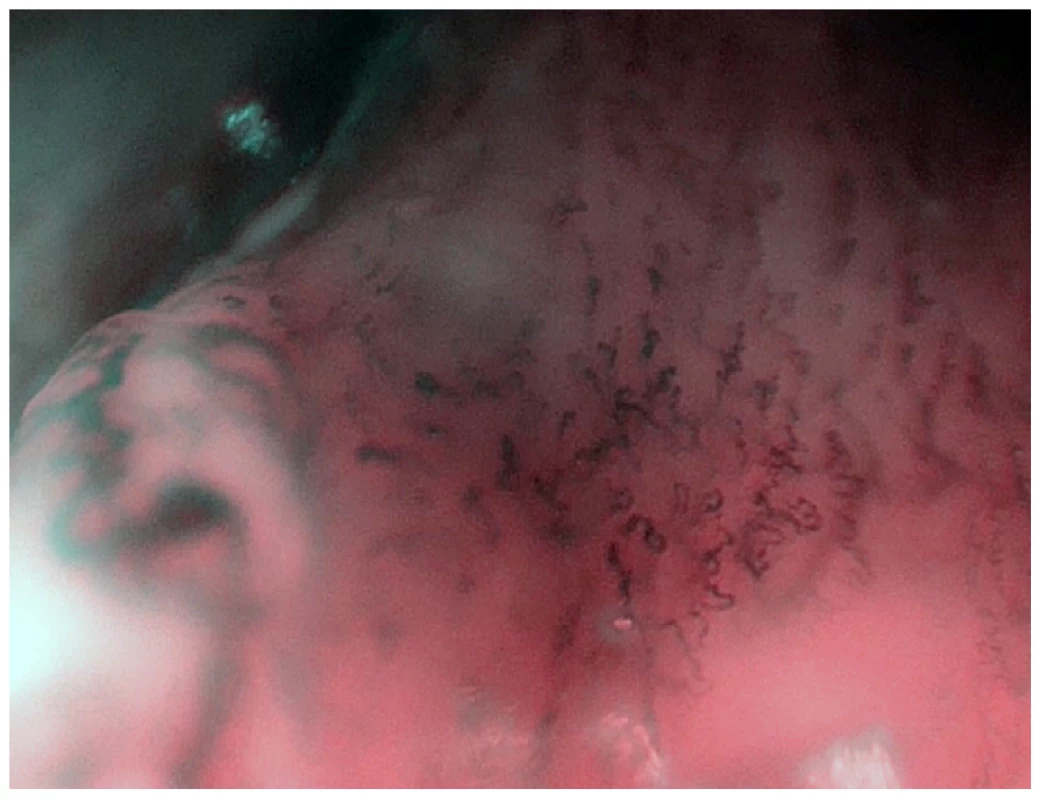
Autor: Petr Lukeš. Dosud byly maligní slizniční změny vždy diagnostikovány až na základě histologického vyšetření. Zvětšovací endoskopy, díky kterým lze pozorovat povrch sliznice ze vzdálenosti několika milimetrů, spolu s HDTV nebo 4K zobrazením umožňují určit malignitu s vysokou pravděpodobností ještě před stanovením histologické diagnózy (7).
Pro gastroenterologii jsou k dispozici zvětšovací flexibilní endoskopy vybavené zoomovacím systémem (24). Jejich rozměry však nedovolují použití při transnazálním vyšetření, které je nutností u ORL pacientů. Zvětšovací endoskopii lze tedy u ORL pacientů provádět pouze pomocí rigidních optik. Tím je toto vyšetření v ambulantním režimu limitováno na dutinu ústní a orofarynx. Vyšetření hrtanu a hypofaryngu musí být prováděno v celkové anestezii, kdy je rigidní endoskop zaváděn tubusem direktního laryngoskopu.
Při kombinaci zvětšovací a NBI endoskopie je dosahováno vysokého zvětšení, navíc je využito filtrovaného světla a zvýšení výsledného kontrastu mezi cévami a epitelem. Díky tomu lze přesněji pozorovat změny ve slizniční vaskularizaci a tím pádem i přesněji odlišit benigní změny od maligních (7).
Kontaktní endoskopie
Jedná se o endoskopickou optickou zobrazovací metodu, která umožňuje pozorovat sliznici in vivo s rozlišením na buněčné úrovni. Využívány jsou speciální rigidní endoskopy, které poskytují zvětšený obraz po přiložení přímo na povrch sliznice (25). Dosahované zvětšení je při použití endoskopické kamery a 24palcového monitoru až 1100násobné (obr. 4). Původně bylo nutné nejprve aplikovat intravitálně barvivo (methylenovou modř) na povrch sliznice a tím nabarvit buněčné struktury, zejména jádra. Hodnocení pak odpovídalo in vivo cytologii (25). To vše bylo časově náročné, navíc bylo nutné, aby byl vyšetřující zároveň zkušeným cytologem. V roce 2000 Wardrop et al. (26) popsali možnost rozlišení invazivního karcinomu pomocí identifikace změněných kapilár v lamina propria pod epitelem, který nese známky buněčných atypií. V současné době jsou kontaktní endoskopy v ORL oblasti používány v kombinaci s NBI systémem a hlavním cílem není pozorovat buněčné atypie, ale velice podrobné zobrazení cévních struktur (27). Dle stupně změn mikrovaskularizace lze odlišit léze charakteru hyperplazie, dysplazie, carcinoma in situ či invazivního karcinomu (28).
Obr. 4. Kontaktní NBI endoskopie – spinocelulární karcinom hlasivky. Uvnitř rozšířených kapilár jsou patrné jednotlivé erytrocyty (široká šipka), typické změny vaskularizace svědčící pro malignitu (úzká šipka). 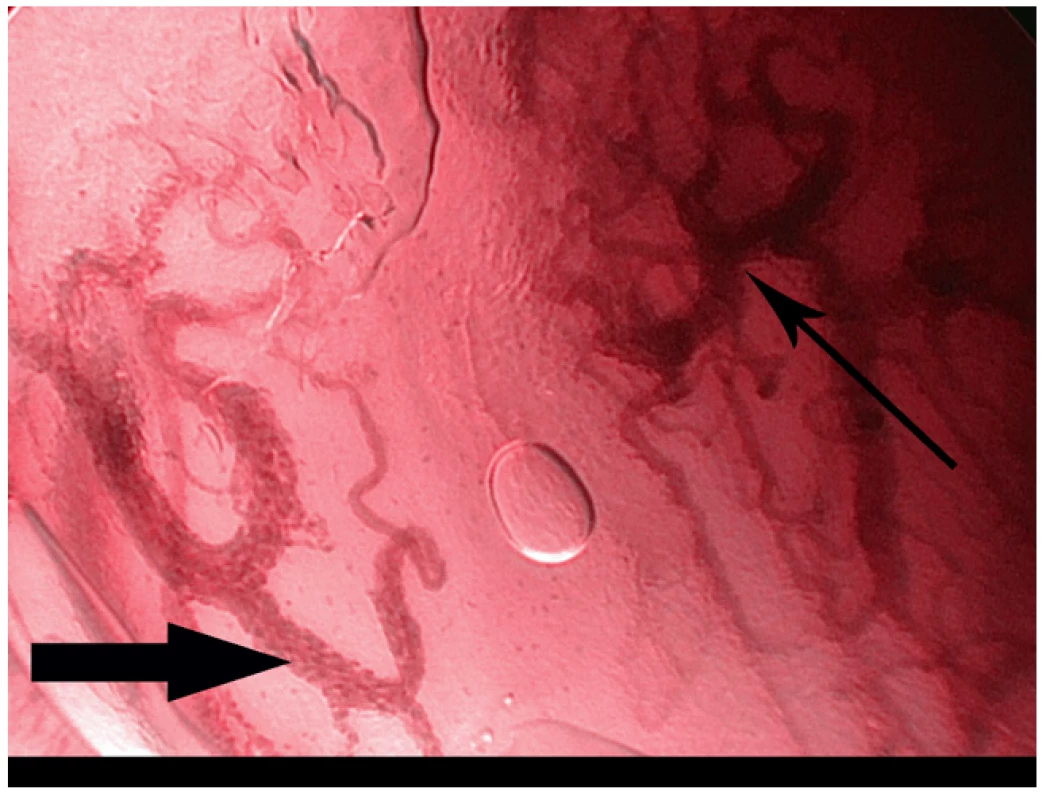
Autor: Petr Lukeš. VERTIKÁLNÍ OPTICKÉ ZOBRAZOVACÍ METODY
Konfokální endomikroskopie
Konfokální endomikroskopie umožňuje vyšetření sliznice ve 3 rozměrech in vivo a při dostatečném zvětšení (rozlišovací schopnost dosahuje 10 µm) (29) zobrazit histologické detaily nad bazální membránou (obr. 5B a C). Čočka objektivu zaostřuje světlo o vysoké intenzitě na velmi malou oblast v určité vrstvě sliznice (ohniskový bod), odsud je světlo odraženo zpět čočkou objektivu na konfokální detektor, který je umístěn za štěrbinou, jež odcloní světlo odrážené mimo ohniskový bod. Výsledkem je ostrý obraz buněk nacházejících se v ohniskovém bodě.
Konfokální endomikroskop velice rychle skenuje tkáň ve stejné hloubce (ohniskové rovině), zaznamenává obrazy z mnoha sousedních ohniskových bodů a vytváří dvourozměrný obraz. Změnou ohniskové roviny může vyšetřující pozorovat buňky v různých vrstvách sliznice bez ztráty kvality zobrazení až do vzdálenosti 250 µm od jejího povrchu. Prohlížením snímků vytvořených v různých rovinách v sérii lze zobrazit trojrozměrnou strukturu tkáně (30). V současné době jsou k dispozici miniaturizované sondy konfokálního endomikroskopu, které lze vsunout pracovním kanálem flexibilního endoskopu. Vyšetření je často kombinováno s topickým i intravenózním užitím barviv pro zvýraznění buněčných struktur, jako jsou např. buněčná jádra (29). Tato metoda byla vyvinuta pro gastroenterologii, v ORL je dosud používána pouze experimentálně.
Optická koherentní tomografie (OCT)
OCT je optický analog ultrazvuku. Sliznice je prosvětlována infračerveným světlem, které se zpětně odráží od hranic různých tkání (se změnou indexu lomu). Odražené světlo je zaznamenáno a zpracováno do výsledného obrazu průřezu sliznicí (analogicky jako u histologického řezu). Umožňuje zobrazení až do hloubky 2 mm. Lze tak zaznamenat všechny její vrstvy (31). První klinické aplikace OCT byly prováděny v oftalmologii a dermatologii (32, 33). Díky dosahovanému vysokému tkáňovému rozlišení lze metodu využít v laryngologii k peroperačnímu určení rozsahu slizničního postižení a rovněž k určení hloubky invaze léze do jednotlivých vrstev sliznice (34). Metoda je dosud užívána spíše v rámci experimentálních režimů.
Obr. 5. Optická koherentní tomografie (A) – léze hlasivky se zachovaným horizontálním vrstvením tkáně se silně zvýšenou tloušťkou epitelu (E – epitel, LP – lamina propria); konfokální laserová endomikroskopie (B) – obraz normální tkáně kontralaterální hlasivky; konfokální laserová endomikroskopie (C) – léze hlasivky; histopatologický obraz tkáňové biopsie barvené hematoxylin-eosinem z léze na hlasivce (D) – dysplazie vysokého stupně. 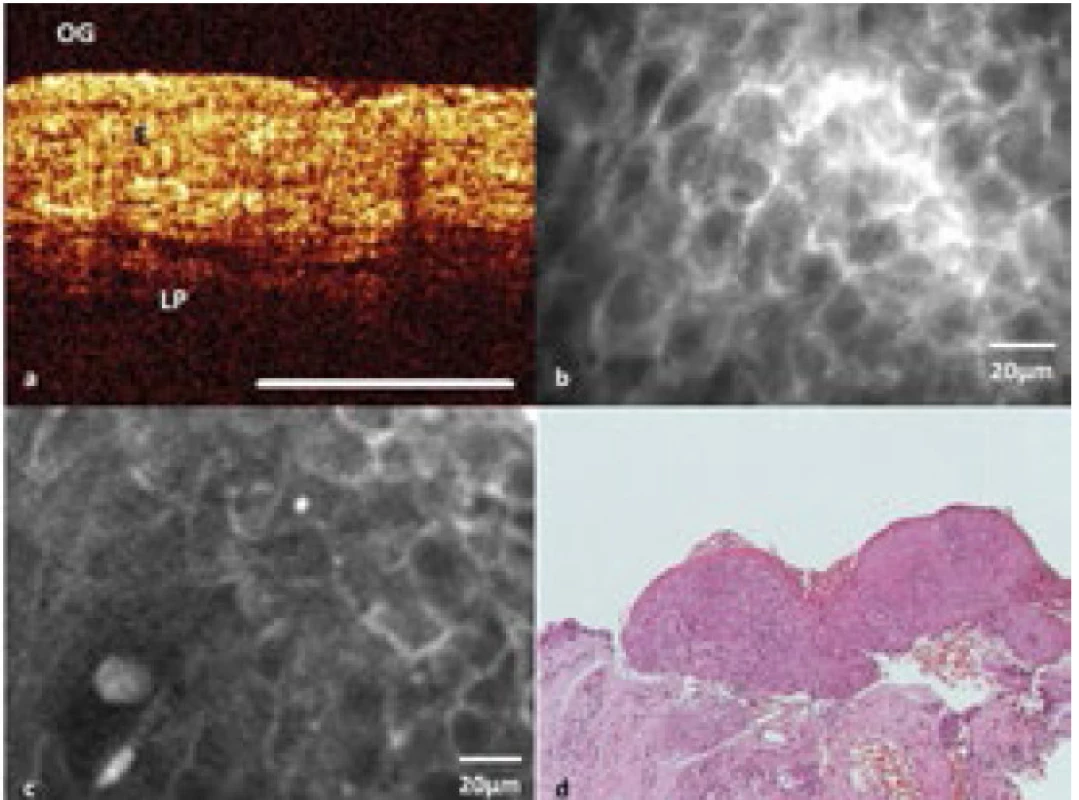
S laskavým svolením Veroniky Volgger (29). ZÁVĚR
Všechny uvedené metody směřují k dosažení předhistologické diagnostiky, to znamená k přesnému určení malignity při klinickém vyšetření dříve, než je dostupný výsledek histologie (někdy je používán i termín „optická biopsie”). Aby tohoto bylo dosaženo, bylo by nejvhodnější používat kombinaci některé z horizontálních a vertikálních metod. Jedná se však o metody s vysokými pořizovacími náklady a zároveň jsou náročné i časově. V rutinní praxi je proto nejčastěji používána NBI endoskopie, která je časově nenáročná a zároveň komerčně dobře dostupná. Možnosti tohoto vyšetření jsou výrazně zlepšeny kombinací se zvětšovací či kontaktní endoskopií.
Podpořeno grantovými projekty Progres Q27, UNCE 204013, AZV 15-28933A a MZ ČR – RVO, FN v Motole 00064203.
Adresa pro korespondenci:
as. MUDr. Petr Lukeš, Ph.D.
Klinika ORL a chirurgie hlavy a krku 1. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: petr.lukes@fnmotol.cz
Zdroje
1. Ridge JA, Glisson BS, Lango MN et al. Head and neck tumors. In Pazdur R, Camphausen KA, Wagman LD, Hoskins WJ (eds.). Cancer management: A multidisciplinary approach. Cmp United Business Media, 2008.
2. Bonhin RG, de Carvalho GM, Guimarães AC et al. Histologic correlation of VEGF and COX-2 expression with tumor size in squamous cell carcinoma of the larynx and hypopharynx. Ear Nose Throat J 2017; 96(4–5): 176–182.
3. Hamilton DW, Pedersen A, Blanchford H et al. A comparison of attitudes to laryngeal cancer treatment outcomes: a time trade-off study. Clin Otolaryngol 2017; doi: 10.1111/coa.12906.
4. de Boer MF, Pruyn JF, van den Borne B et al. Rehabilitation outcomes of long-term survivors treated for head and neck cancer. Head Neck 1995; 17(6): 503–515.
5. Hughes OR, Stone N, Kraft M, et al. Optical and molecular techniques to identify tumor margins within the larynx. Head Neck 2010; 32(11): 1544–1553.
6. Garofolo S, Piazza C, Del Bon F, et al. Intraoperative narrow band imaging better delineates superficial resection margins during transoral laser microsurgery for early glottic cancer. Ann Otol Rhinol Laryngol 2015; 124(4): 294–298.
7. Lukeš P, Zábrodský M, Lukešová E et al. The role of NBI HDTV magnifying endoscopy in the prehistologic diagnosis of laryngeal papillomatosis and spinocellular cancer. Biomed Res Int 2014; 2014 : 285486.
8. Staníková L, Šatanková J, Kučová H et al. The role of narrow-band imaging (NBI) endoscopy in optical biopsy of vocal cord leukoplakia. Eur Arch Otorhinolaryngol 2017; 274(1): 355–359.
9. Ansarin M, Zábrodský M, Bianchi L et al. Endoscopic CO2 laser surgery for early glottic cancer in patients who are candidates for radiotherapy: results of a prospective nonrandomized study. Head Neck 2006; 28(2): 121–125.
10. Betz CS, Kraft M, Arens C et al. [Optical diagnostic methods for early tumour diagnosis in the upper aerodigestive tract: Quo vadis?] HNO 2016; 64(1): 41–48.
11. Harries ML, Lam S, MacAulay C et al. Diagnostic imaging of the larynx: autofluorescence of laryngeal tumours using the helium-cadmium laser. J Laryngol Otol 1995; 109(2): 108–110.
12. Malzahn K, Dreyer T, Glanz H, Arens C. Autofluorescence endoscopy in the diagnosis of early laryngeal cancer and its precursor lesions. Laryngoscope 2002; 112(3): 488–493.
13. Arens C, Dreyer T, Glanz H, Malzahn K. Indirect autofluorescence laryngoscopy in the diagnosis of laryngeal cancer and its precursor lesions. Eur Arch Otorhinolaryngol 2004; 261(2): 71–76.
14. Arens C, Reussner D, Woenkhaus J, Leunig A et al. Indirect fluorescence laryngoscopy in the diagnosis of precancerous and cancerous laryngeal lesions. Eur Arch Otorhinolaryngol 2007; 264(6): 621–626.
15. Lukeš P, Zábrodský M, Foltýnová E, Betka J. Comparison of narrow band imaging with autofluorescence for endoscopic diagnostics of oropharyngeal cancer. 5th IFHNOS World Congress, New York, 2014. Dostupné na: http://epostersonline.com/ifhnos2014/content/petr-lukes
16. Abels C, Fritsch C, Bolsen K et al. Photodynamic therapy with 5-aminolaevulinic acid-induced porphyrins of an amelanotic melanoma in vivo. J Photochem Photobiol B 1997; 40(1): 76–83.
17. Brisuda A, Hrbáček J, Babjuk M. Využití fotodynamické diagnostiky a úzkopásmového zobrazení v diagnostice a léčbě svalovinu neinfiltrujících nádorů močovéh měchýře. Česká urologie 2013; 17(2): 79–87.
18. Sano Y, Kobayashi M, Hamamoto Y et al. New diagnostic method based on color imaging using narrowband imaging (NBI) endoscopy system for gastrointestinal tract. Gastrointestinal Endoscopy 2001; 53(5): AB125.
19. Murray JD, Carlson GW, McLaughlin K et al. Tumor angiogenesis as a prognostic factor in laryngeal cancer. Am J Surg 1997; 174(5): 523–526.
20. Fujii S, Yamazaki M, Muto M, Ochiai A. Microvascular irregularities are associated with composition of squamous epithelial lesions and correlate with subepithelial invasion of superficial-type pharyngeal squamous cell carcinoma. Histopathology 2010; 56(4): 510–522.
21. Lukeš P, Zábrodský M, Lukešová E et al. Narrow Band Imaging (NBI) – Endoskopická metoda pro diagnostiku karcinomů hlavy a krku. Otorinolaryngologie a foniatrie 2013; 62(4): 173–179.
22. Gono K. An introduction to high-resolution endoscopy and narrowband imaging. In: Cohen J (ed.). Advanced Digestive Endoscopy: Comprehensive Atlas of High Resolution Endoscopy and Narrowband Imaging. Blackwell Publishing, 2007 : 9–22.
23. Arens C, Betz C, Kraft M, Voigt-Zimmermann S. Narrow band imaging for early diagnosis of epithelial dysplasia and microinvasive tumors in the upper aerodigestive tract. HNO 2017; 65(Suppl. 1): 5–12.
24. Inoue H, Kaga M, Sato Y et al. Magnifying endoscopic diagnosis of tissue atypia and cancer invasion depth in the area of pharyngo-esophageal squamous epithelium by NBI enhanced magnification image: IPCL pattern classification. In: Cohen J (ed.). Advanced Digestive Endoscopy: Comprehensive Atlas of High Resolution Endoscopy and Narrowband Imaging. Blackwell Publishing, 2007 : 49–66.
25. Andrea M, Dias O, Santos A. Contact endoscopy during microlaryngeal surgery: a new technique for endoscopic examination of the larynx. Ann Otol Rhinol Laryngol 1995; 104(5): 333–339.
26. Wardrop PJ, Sim S, McLaren K. Contact endoscopy of the larynx: a quantitative study. J Laryngol Otol 2000; 114(6): 437–440.
27. Arens C, Voigt-Zimmermann S. [Contact endoscopy of the vocal folds in combination with narrow band imaging (compact endoscopy)]. Laryngorhinootologie 2015; 94(3): 150–152.
28. Puxeddu R, Sionis S, Gerosa C, Carta F et al. Enhanced contact endoscopy for the detection of neoangiogenesis in tumors of the larynx and hypopharynx. Laryngoscope 2015; 125(7): 1600–1606.
29. Volgger V, Girschick S, Ihrler S et al. Evaluation of confocal laser endomicroscopy as an aid to differentiate primary flat lesions of the larynx: A prospective clinical study. Head Neck 2016; 38(Suppl. 1): E1695–E1704.
30. Amos WB, White JG. How the confocal laser scanning microscope entered biological research. Biol Cell 2003; 95(6): 335–342.
31. Huang D, Swanson EA, Lin CP et al. Optical coherence tomography. Science 1991; 254(5035): 1178–1181.
32. Sattler E, Kastle R, Welzel J. Optical coherence tomography in dermatology. J Biomed Opt 2013; 18(6): 061224.
33. Sull AC, Vuong LN, Price LL et al. Comparison of spectral/Fourier domain optical coherence tomography instruments for assessment of normal macular thickness. Retina 2010; 30(2): 235–245.
34. Kraft M, Lüerssen K, Lubatschowski H et al. Technique of optical coherence tomography of the larynx during microlaryngoscopy. Laryngoscope 2007; 117(5): 950–952.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Přednáškové večery Spolku českých lékařů (září 2017)
- Úvodem
- Editorial
- Novorozenecký screening sluchu – význam, současný stav v ČR
- 30 let kochleárních implantací v České republice
- Rozumění řeči v šumu u presbyakuze
- Čich u pacientů podstupujících endonazální endoskopickou chirurgii
- Endoskopické optické zobrazovací metody v diagnostice nádorů hrtanu
- Poruchy dýchání ve spánku u dětí a dospělých z pohledu otorinolaryngologie
- Léčba bolesti v hrdle
- Americké zdravotnictví a nejistá budoucnost Obamovy reformy
- Mezinárodní kongres Evropský týden o biobankách
- Personální identifikátory výzkumných a vědeckých pracovníků a jejich význam
- Nikolaj Ivanovič Pirogov: chirurg a anatom
- Abebe Bikila Memorial Run
- 120. výročí narození profesora Ladislava Borovanského
- Zemřel profesor Vladimír Balaš
- Životní jubileum profesorky Kyry Michalové
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nikolaj Ivanovič Pirogov: chirurg a anatom
- Novorozenecký screening sluchu – význam, současný stav v ČR
- Léčba bolesti v hrdle
- Zemřel profesor Vladimír Balaš
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



