-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Transplantace Langerhansových ostrůvků v léčbě syndromu porušeného vnímání hypoglykemie. Vyhodnocení pilotního programu a porovnání s transplantací pankreatu
Islet transplantation as a treatment for hypoglycemia unawareness syndrome. Evaluation of the pilot program and comparison with pancreas transplantation
Islet transplantation (ITx) started in 2005 in IKEM as a potentially safer alternative to pancreas transplantation (PTx), which so far had represented the method of choice in type-1 diabetic patients with conservatively intractable hypoglycemia unawareness syndrome. The aim of the study was to compare these two methods with regard to severe hypoglycemia elimination and to frequency of complications.
Up to November 2015 a total number of 48 patients underwent ITx. The results from 22 patients with hypoglycemia unawareness were statistically analyzed. The mean number of transplanted islet equivalents was 12,096 (6,933−16,705) IEQ/kg administered percutaneously in local anesthesia under radiological control to the portal vein. 44 patients underwent PTx from 1996. We evaluated glycated hemoglobin(HbA1c), insulin dose, fasting and stimulated C-peptide, frequency of severe hypoglycemia and complications. Medians (interquartile range) were analyzed using the Wilcoxon signed-rank test.
One and two years after ITx, HbA1c decreased, C-peptide became significantly positive, insulin dose and frequency of severe hypoglycemia decreased and 18 % of ITx recipients were temporarily insulin-independent. Bleeding was present in 41 % of patients. One year after PTx, 73 % of patients were insulin and hypoglycemia-free, after two years 68 % of patients were insulin and hypoglycemia-free; graftectomy occurred in 20 % of recipients.
Both methods led to restoration of insulin secretion and severe hypoglycemia elimination. PTx made more recipients insulin-independent at the cost of serious complications.Keywords:
islet transplantation, pancreas transplantation, complications, hypoglycemia
Autoři: Martina Zahradnická 1; Peter Girman 1; Jan Kříž 1; Zuzana Berková 2; Tomáš Koblas 2; Ema Vávrová 1; Lucie Kosinová 2; David Habart 2; Eva Fábryová 2; Eva Dovolilová 2; Tomáš Neškudla 1; MUDr. Jan Peregrin 3; Jozef Kováč 3; Květoslav Lipár 4; Matěj Kočík 4; Lenka Németová 1; Jiří Svoboda 5; František Saudek 1
Působiště autorů: Klinika diabetologie, IKEM, Praha 1; Centrum experimentální medicíny IKEM, Praha 2; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha 3; Klinika transplantační chirurgie, IKEM 4; Oddělení datového centra IKEM, Praha 5
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 349-356
Kategorie: Původní práce
Souhrn
Transplantace Langerhansových ostrůvků (TxLO) byla v roce 2005 zavedena v Institutu klinické a experimentální medicíny (IKEM) jako potenciálně bezpečnější alternativa transplantace pankreatu (TxP), jež dosud představovala metodu volby u diabetiků 1. typu s konzervativně nezvládnutelným syndromem porušeného vnímání hypoglykemie. Cílem práce je porovnat schopnost obou metod eliminovat závažné hypoglykemie a další komplikace.
Transplantaci Langerhansových ostrůvků od zavedení metody v roce 2005 do listopadu 2015 podstoupilo celkem 48 pacientů. Výsledky jsme hodnotili u 22 z nich, u kterých byl přítomen syndrom porušeného vnímání hypoglykemie. Počet transplantovaných ostrůvkových ekvivalentů činil 12 096 (6933−16 705) IEQ/kg, byly podány v místním znecitlivění perkutánně pod radiologickou kontrolou do portální žíly. TxP podstoupilo od roku 1996 44 pacientů. Hodnotili jsme glykovaný hemoglobin (HbA1c), dávky inzulinu, C-peptid lačný a stimulovaný, frekvenci těžkých hypoglykemií a komplikace. Mediány (interquartile range) jsme porovnávali pomocí Wilcoxonova rank testu.
Po 1 i 2 letech od TxLO významně klesl HbA1c, byl měřitelný C-peptid, snížila se dávka inzulinu i frekvence hypoglykemií, 18 % příjemců bylo přechodně (maximálně 6 měsíců) bez potřeby inzulinu. Nejčastější komplikací bylo krvácení u 41 % pacientů. Jeden rok po TxP bylo 73 % pacientů bez potřeby inzulinu a hypoglykemií, 2 roky poté pak 68 % pacientů bez inzulinu a hypoglykemií, graftektomie proběhla u 20 % pacientů.
Transplantace Langerhansových ostrůvků i transplantace pankreatu vedly k obnově sekrece inzulinu a eliminovaly těžké hypoglykemie. TxP vedla častěji k nezávislosti na inzulinu za cenu závažnějších komplikací. TxLO je méně invazivní metoda, kterou je potřeba dále rozvíjet.Klíčová slova:
transplantace Langerhansových ostrůvků, transplantace pankreatu, komplikace, hypoglykemieÚvod
Transplantace pankreatu (TxP) byla dosud považována za metodu volby pro léčbu pacientů s diabetem 1. typu provázeným konzervativně nezvládnutelným (1−3) syndromem porušeného vnímání hypoglykemie s oslabením kontraregulačních mechanismů poklesu glykemie. V poslední době se podařilo obnovit endogenní sekreci inzulinu a normalizovat kontraregulační odpověď na hypoglykemii také pomocí transplantace Langerhansových ostrůvků (TxLO) (4). Přínosem obou metod může být mimo jiné stabilizace dlouhodobých komplikací diabetu (5−7) a případně ochrana současně transplantované ledviny před rekurencí diabetických lézí (8).
Se zlepšujícími se výsledky transplantací LO, nárůstem počtu pacientů nezávislých na inzulinu a poklesem frekvence komplikací (9) nastala diskuse ohledně vhodnosti transplantace pankreatu vzhledem k vyššímu riziku chirurgických komplikací orgánové transplantace (10). Cílem této práce je proto zhodnocení pilotního projektu a porovnání výsledků pacientů po transplantaci Langerhansových ostrůvků (LO) a pankreatu s ohledem na počet závažných hypoglykemií, potřebu inzulinu, ukazatele metabolické kompenzace a komplikace transplantace v našem centru.
Pacienti a metody
Transplantace LO
Od úplného začátku programu v roce 2005 do listopadu 2015 podstoupilo transplantaci LO celkem 48 pacientů; 22 pouze transplantaci samotných LO, 9 pacientů kombinovanou transplantaci LO společně s ledvinou nebo játry (ze stejného dárce), 8 pacientů dostalo ostrůvky po transplantaci ledviny a 9 pacientů prodělalo autotransplantaci LO izolovaných z vlastního pankreatu po jeho chirurgickém odstranění.
Hodnotili jsme pouze výsledky 22 pacientů s porušeným rozpoznáváním hypoglykemie po izolované transplantaci LO (n = 17) a po transplantaci LO po ledvině (n = 5), které byly provedeny v období od ledna 2006 do května 2014 a které bylo možné porovnat s výsledky pacientů po transplantaci pankreatu. Tito pacienti byli C-peptid negativní. Jednalo se o 12 mužů a 10 žen průměrného věku 44 (36−56) let (medián, interquartil range) s trváním diabetu 28 let (18−34) a BMI 23 kg/m2 (19−25,4) (viz tab. 1).
9 pacientů podstoupilo celkem tři transplantace LO, 6 pacientů dvě a 7 pacientů jednu TxLO s průměrným počtem 12 096 (6933−16 705) ostrůvkových ekvivalentů (IEQ)/kg/pacienta. 15 pacientů bylo hodnoceno 24 měsíců od poslední TxLO, u ostatních byla doba sledování kratší (viz tab. 2).
Tab. 1. Pacienti po transplantaci Langerhansových ostrůvků (LO) a pankreatu – demografické charakteristiky příjemců a dárců 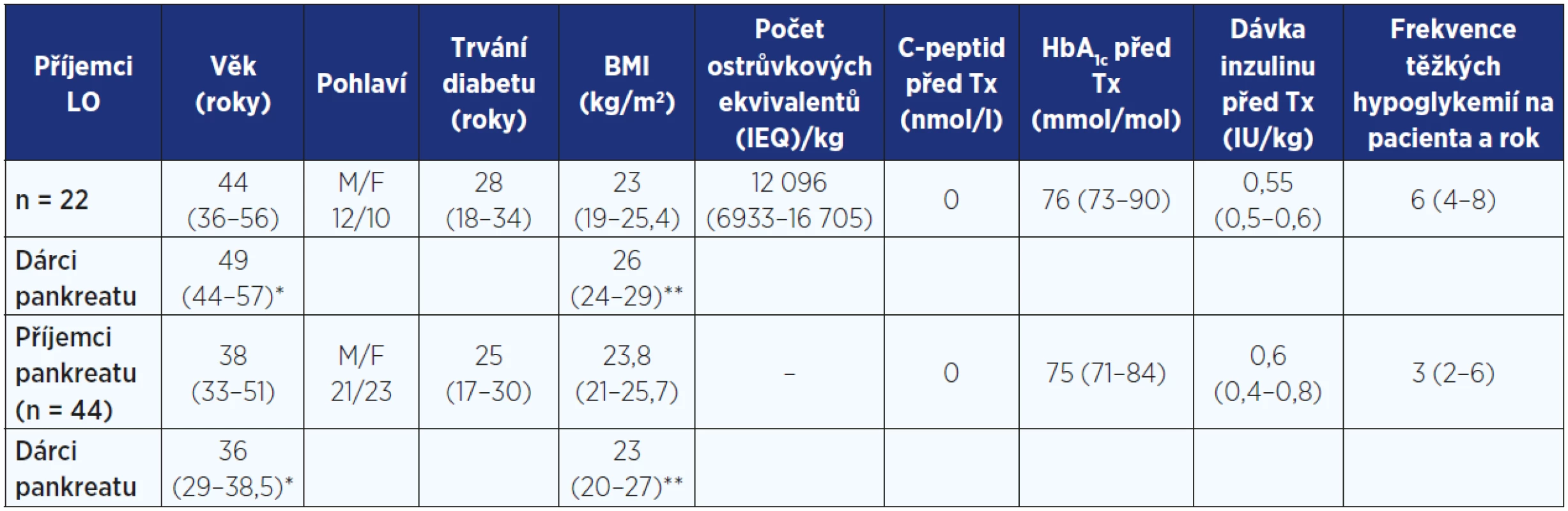
Pozn.: * p < 0,05; ** p = 0,00468 Tab. 2a Doba sledování od poslední TxLO a parametry metabolické kompenzace u neuremických příjemců LO 
Tab. 2b Parametry metabolické kompenzace u příjemců LO se sníženou renální funkcí 
Klíč: Skupina 1: HbA1c ≤ 53 mmol/mol a potřeba inzulinu ≤ 10 IU/den. Skupina 2: HbA1c ≤ 60 mmol/mol a potřeba inzulinu ≤ 20 IU/den. Skupina 3: HbA1c > 61 mmol/mol a potřeba inzulinu > 20 IU/den. * Označení pacienti neměli v době sledování těžké hypoglykemie. Φ Označení pacienti mají neměřitelný C-peptid. Žádný pacient ze skupiny 1 neměl po dobu nejlepší funkce těžké hypoglykemie. Izolace probíhala za použití enzymu Collagenase NB1 Premium (Serva, Německo) podle modifikovaného Edmontonského protokolu. Celý tento postup byl již podrobněji popsán v Časopisu lékařů českých v roce 2011 (11). Po purifikaci, sběru tkáně a kultivaci o délce maximálně 24 hodin proběhla infuze perkutánně transhepatálním přístupem v místním znecitlivění pod radiologickou kontrolou do větve vena portae, pokud štěp obsahoval alespoň 300 000 IEQ.
Z Imunosuprese byly podávány jako indukční terapie antithymocytární globulin a methylprednisolon. Dlouhodobá imunosupresivní léčba zahrnovala u všech pacientů kombinaci takrolimu společně se sirolimem. V období časně po transplantaci LO byly podávány heparin a inzulin kontinuálně nitrožilně a poté ještě týden nízkomolekulární heparin dle doporučení recentně publikovaných protokolů (12).
Věk dárců pankreatu byl 49 let (44−57), BMI 26 kg/m2 (24−29), nejčastější příčinou smrti bylo intrakraniální krvácení (v 78 % případů) a průměrná doba studené ischemie činila 4,5 hodiny (2,6−7,4).
U příjemců LO jsme prospektivně hodnotili ukazatele metabolické kompenzace (HbA1c, potřebu inzulinu a variabilitu glykemií), C-peptid nalačno i stimulovaný před poslední TxLO (s maximálním počtem ostrůvkových ekvivalentů) a 1, 3, 6, 12 a 24 měsíců od ní, počet těžkých hypoglykemií (s bezvědomím a/nebo nutností pomoci druhé osoby) dle Clark/Gold skóre pro hodnocení poruchy rozpoznávání hypoglykemií (13, 14) před TxLO, 12 a 24 měsíců od transplantace, a dále komplikace po TxLO. Stimulovaný C-peptid byl měřen metodou meal-testu (podání standardního pokrmu se známým složením: sacharidy 60 g, proteiny 12,5 g, lipidy 12,6 g); C-peptid byl hodnocen ve 120. minutě.
Hodnocením výsledků kontinuálního měření glykemie v podkoží (záznam CGM − Dexcom senzor) byly posuzovány variabilita glykemií, tzv. MAGE (mean amplitude of glycemic excursions) (15) a procento času strávené v hypoglykemii (glykemie < 3,5 mmol/l), normglykemii (glykemie 3,5−7,2 mmol/l) a hyperglykemii (glykemie > 7,2 mmol/l). Pro statistické hodnocení byly použity pouze výsledky pacientů s dobrou renální funkcí; příjemci s vyšším stupněm renální insuficience před TxLO (viz tab. 2b) jsou hodnoceni zvlášť. Data jsou uvedena jako medián (interquartil range), hodnocení MAGE je průměr ± směrodatná odchylka, statistické hodnocení pomocí Wilcoxonova signed-rank testu.
Základním úkolem bylo zjistit, u jakého podílu studovaného souboru se podaří za 6 a za 12 měsíců po poslední transplantaci dosáhnout tzv. kompozitních kritérií, která zahrnují současně pozitivitu C-peptidu (koncentrace > 0,2 nmol/l), snížení dávky inzulinu oproti stavu před transplantací o více než 30 %, nepřítomnost závažných hypoglykemií (vyžadujících pomoc druhé osoby nebo hospitalizaci) a dosažení hodnoty glykovaného hemoglobinu ≤ 53 mmol/mol. Za úspěch léčebné metody je považováno dosažení kompozitního ukazatele alespoň u poloviny léčených osob a jednotlivých součástí kompozitního ukazatele ve více než 70 % případů.
Transplantace pankreatu
Od dubna 1996 do ledna 2014 podstoupilo transplantaci pankreatu 44 pacientů, celkově se jednalo o 50 zákroků (u 6 pacientů byl pankreas transplantován opakovaně). Jednalo se o 21 mužů a 23 žen průměrného věku 38 let (33−51) s trváním diabetu 25 let (17−30), BMI 23,8 kg/m2 (21−25,7) (viz tab. 1).
U prvních 19 pacientů (1996−2004) byl štěp pankreatu uložen extraperitoneálně v pravé jámě kyčelní s drenáží exokrinní sekrece pankreatu do močového měchýře. V roce 2004 byla zavedena enterální drenáž exokrinního pankreatu s extraperitoneálním uložením štěpu (u 14 pacientů), jak jsme podrobněji popsali dříve (16). Od roku 2011 (u 11 pacientů) byla používána technika intraperitoneálního uložení štěpu pankreatu s žilní anastomózou do vena portae, arteriální na arteria iliaca communis a s drenáží exokrinní sekrece štěpu pankreatu do ilea příjemce.
Z imunosupresiv byly podávány jako indukční terapie antithymocytární globulin, methylprednisolon a dále prednison 20 mg s postupným vysazením do 6 týdnů od Tx. Dlouhodobá imunosupresivní léčba zahrnovala u všech pacientů kombinaci takrolimu společně s mykofenolátem mofetilem.
Průměrný věk dárců pankreatu činil 36 let (29−38,5), průměrný BMI 23 kg/m2 (20−27), nejčastější příčinou smrti bylo intrakraniální krvácení (v 65 % případů), studená ischemie trvala 5,2 hodiny (4−6,5).
U příjemců pankreatu jsme retrospektivně hodnotili ukazatele metabolické kompenzace: HbA1c, potřebu inzulinu a přítomnost těžkých hypoglykemií. Stimulovaný C-peptid byl hodnocen metodou orálního glukózového tolerančního testu (oGTT) se 75 g glukózy s odběrem C-peptidu ve 120. minutě 12 a 24 měsíců od Tx. Dále jsme hodnotili komplikace transplantace. Data jsou uvedena jako medián (interquartil range), ke statistickému hodnocení ukazatelů metabolické kompenzace před a po Tx byl použit Wilcoxonův signed-rank test.
Výsledky
Před transplantací LO byl HbA1c 76 mmol/mol (73−90) medián (interquartile range) (viz obr. 1), C-peptid byl nedetekovatelný (viz obr. 2 a 3), denní potřeba inzulinu činila 0,55 (0,5−0,6) IU/kg (viz obr. 4) a těžkých hypoglykemií bylo v průměru 6 na pacienta a rok (4−8) (viz obr. 5).
Obr. 1. Hodnoty glykovaného hemoglobinu před a po TxLO 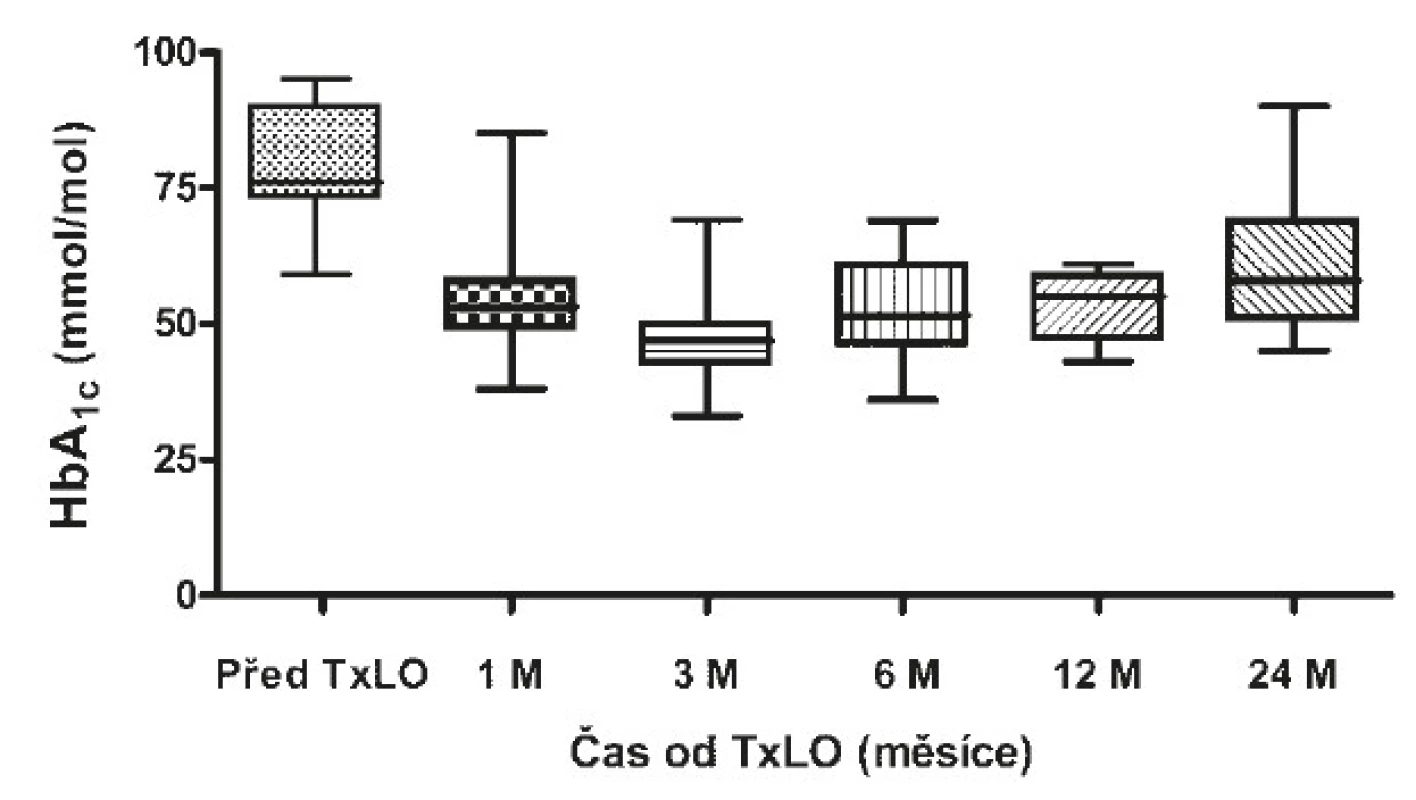
Obr. 2. Hodnoty C-peptidu nalačno před a po TxLO 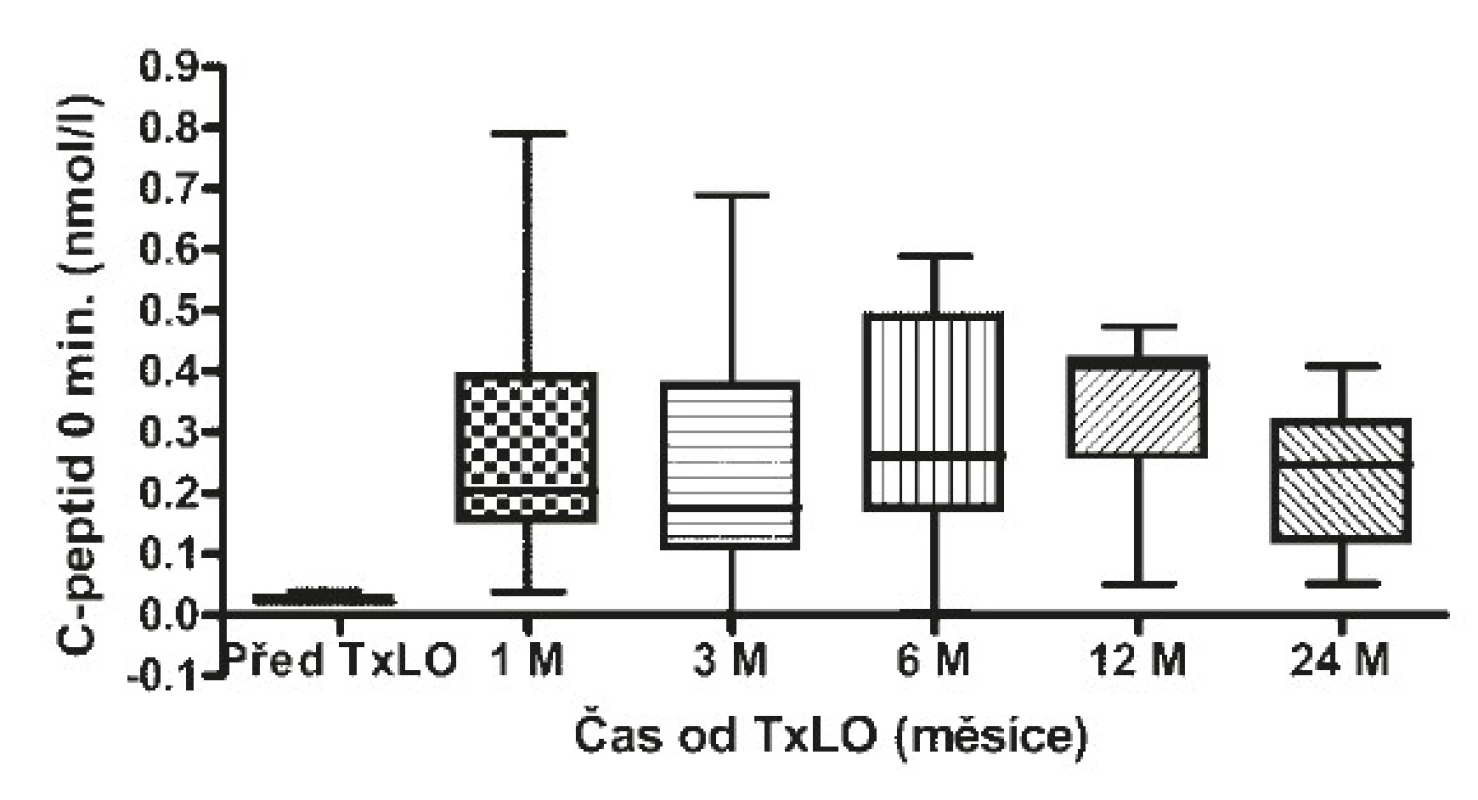
Obr. 3. Hodnoty C-peptidu po stimulaci před a po TxLO 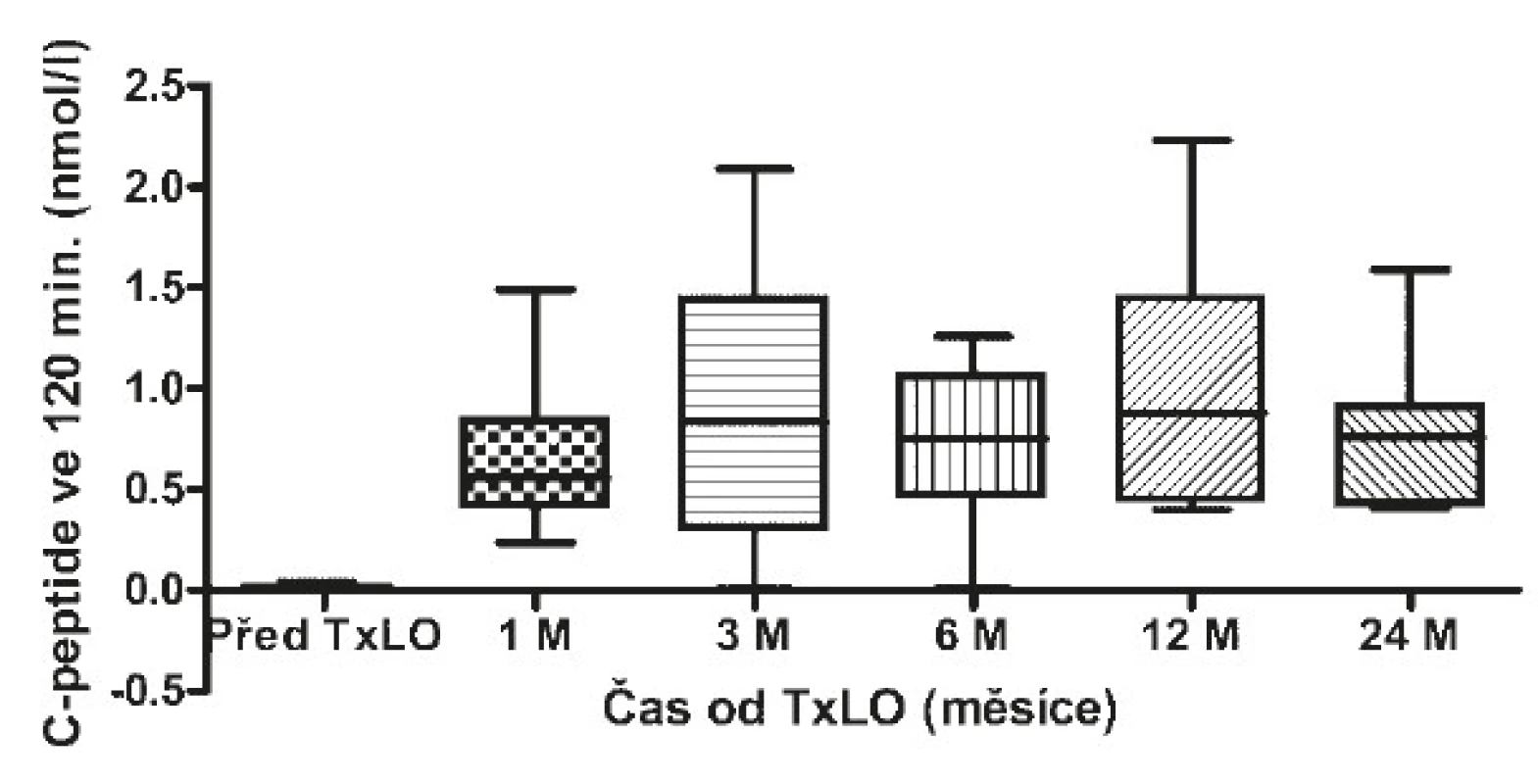
Obr. 4. Potřeba inzulinu před a po TxLO 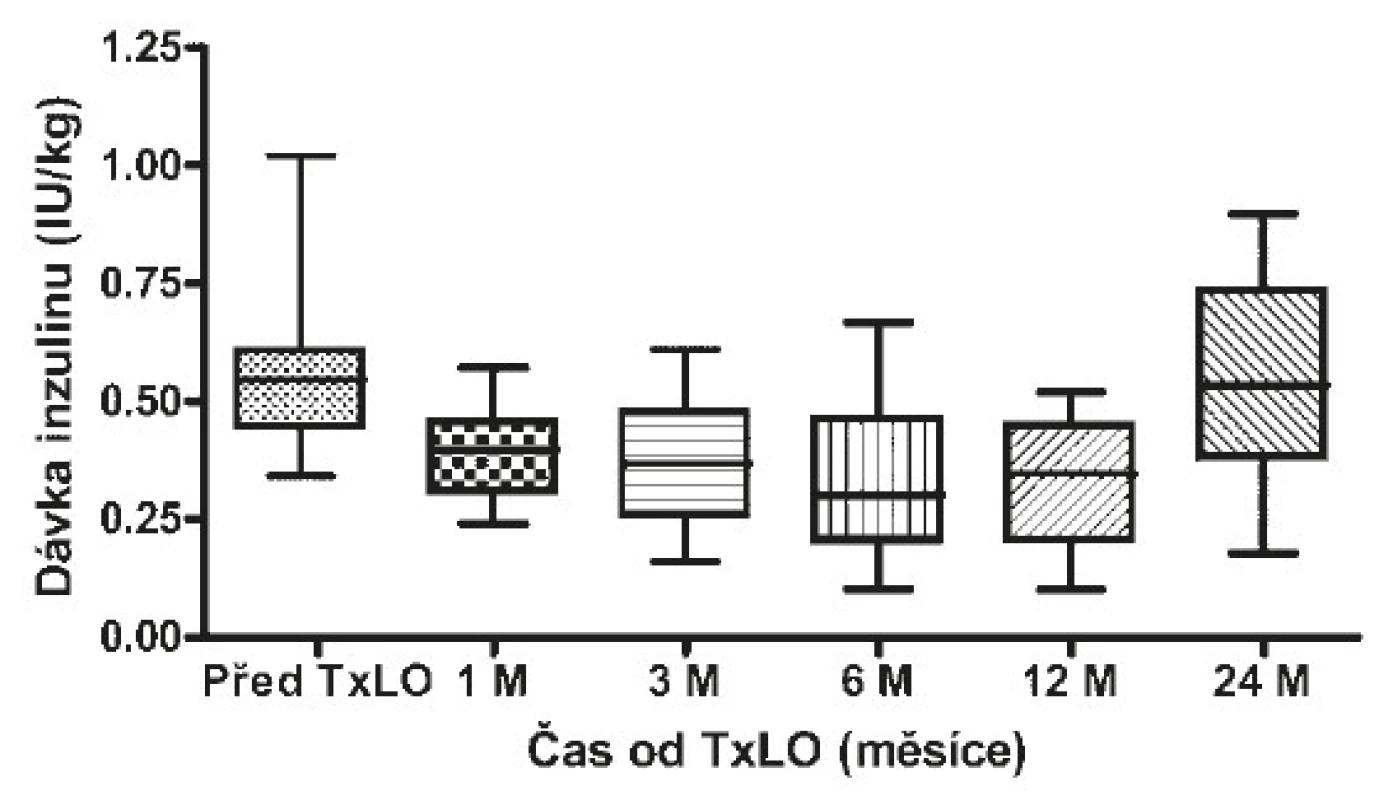
Obr. 5. Frekvence těžkých hypoglykemií před a po TxLO 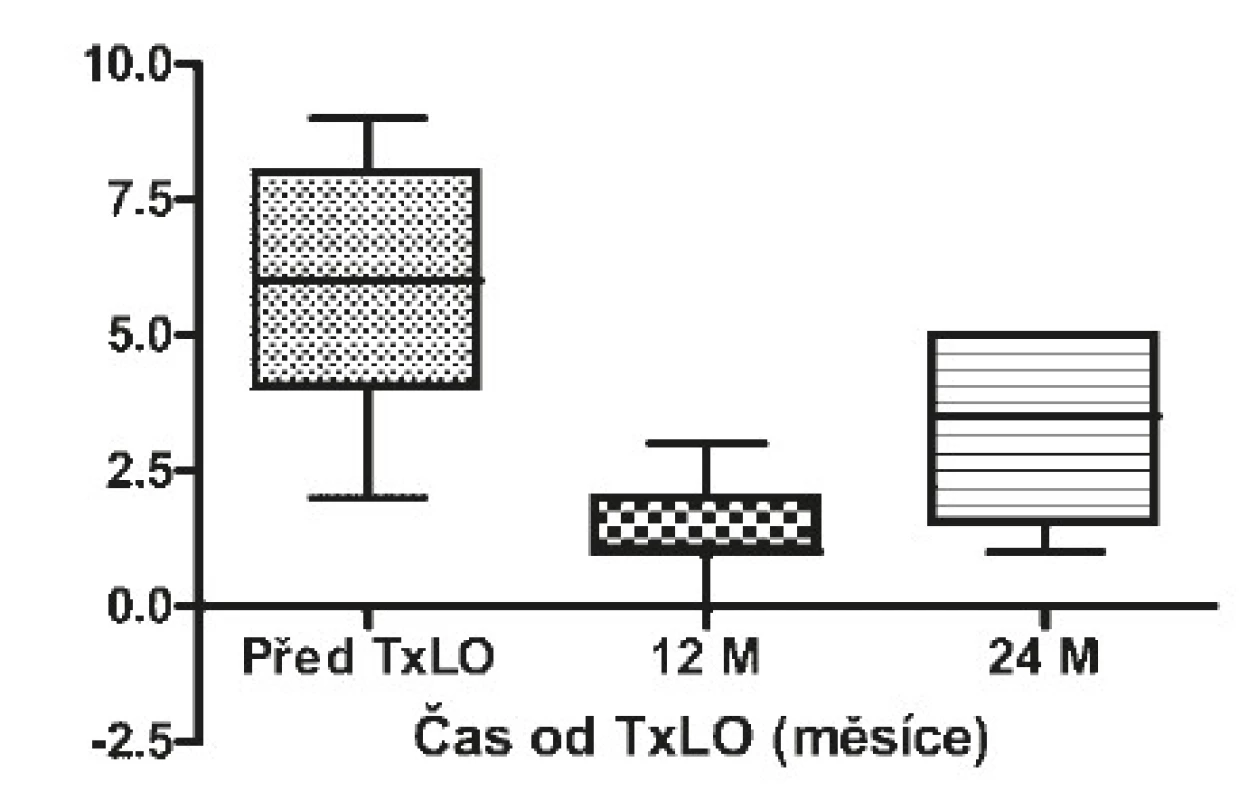
Za měsíc po TxLO klesl HbA1c na 53 mmol/mol (50−58) (p = 0,00015), C-peptid nalačno činil 0,2 nmol/l (0,16−0,34) (p = 0,00015) a stimulovaný ve 120. minutě 0,56 nmol/l (0,42−0,76), dávka inzulinu se snížila na 0,4 IU/kg (0,3−0,5) (p = 0,01923). 3 měsíce po TxLO dosahoval HbA1c 47 mmol/mol (43−48) (p = 0,00015), C-peptid nalačno 0,176 nmol/l (0,121−0,334) (p = 0,00015) a stimulovaný ve 120. minutě 0,84 nmol/l (0,315−1,3), dávka inzulinu byla redukována na 0,4 IU/kg (0,3−0,5) (p = 0,02938). 6 měsíců po TxLO činil HbA1c 52 mmol/mol (48−58) (p = 0,00048), C-peptid nalačno 0,26 nmol/l (0,2−0,42) (p = 0,00074) a stimulovaný ve 120. minutě 0,75 nmol/l (0,51−0,97), dávka inzulinu byla 0,3 IU/kg (0,2−0,4) (p = 0,01539). 12 měsíců po TxLO dosahoval HbA1c 55 mmol/mol (50−58) (p = 0,00169), C-peptid nalačno 0,41 nmol/l (0,3−0,42) (p = 0,00169) a stimulovaný ve 120. minutě 0,88 nmol/l (0,5−1,4), dávka inzulinu byla 0,3 IU/kg (0,2−0,4) (p = 0,00379) a počet těžkých hypoglykemií se snížil na jednu na pacienta ročně (1−2) (p = 0,00256). 24 měsíců po TxLO činil HbA1c 58 mmol/mol (53−67) (p = 0,01618), C-peptid nalačno 0,2 nmol/l (0,16−0,28) (p = 0,00256), stimulovaný ve 120. minutě 0,76 nmol/l (0,49−0,85), dávka inzulinu byla 0,5 IU/kg (0,4−0,7) (p = 0,40129) a proběhly 4 těžké hypoglykemie/pacienta/rok (3−5) (p = 0,02938 (viz tab. 3).
6 pacientů od poslední transplantace LO nemělo těžkou hypoglykemii, u 5 pacientů byl naopak neměřitelný C-peptid, žádný pacient neměl po dobu nejlepší funkce LO těžké hypoglykemie (viz tab. 2), 4 pacienti (18 %) byli přechodně nezávislí na inzulinu (viz tab. 3).
Tab. 2. Ukazatele metabolické kompenzace po transplantaci Langerhansových ostrůvků 
Pozn. *18% pacientů po TxLO bylo po přechodnou dobu nezávislých na inzulinu Hodnocením záznamů z kontinuálního měření glykemie v podkoží (CGM) jsme zjistili, že pacienti před TxLO strávili v hypoglykemii průměrně 4 % (2,8−5,3) doby, v normoglykemii 42 % (31−52) doby a v hyperglykemii 54 % (46−67) doby (viz obr. 6). 1 měsíc po TxLO byla hypoglykemie zaznamenána ve 3 % (2−5) doby (p = 0,0537), normoglykemie ve 44 % (37−53) doby (p = 0,41294) a hyperglykemie v 53 % (32−59) doby (p = 0,02018) (viz obr. 7). 3 měsíce po TxLO byla hypoglykemie zaznamenána ve 2 % (1,7−5) doby (p = 0,04947), normoglykemie v 59 % (46−60) doby (p = 0,02018) a hyperglykemie v 39 % (33−52) doby (p = 0,0048) (viz obr. 8). 6 měsíců po TxLO byly hypoglykemie zaznamenány v 1 % (0,9−1,9) doby (p = 0,04746), normoglykemie v 68 % (48−71) doby (p = 0,03673) a hyperglykemie v 31 % (27−41) doby (p = 0,00798) (viz obr. 9).
Obr. 6. Hodnocení CGM záznamu před TxLO 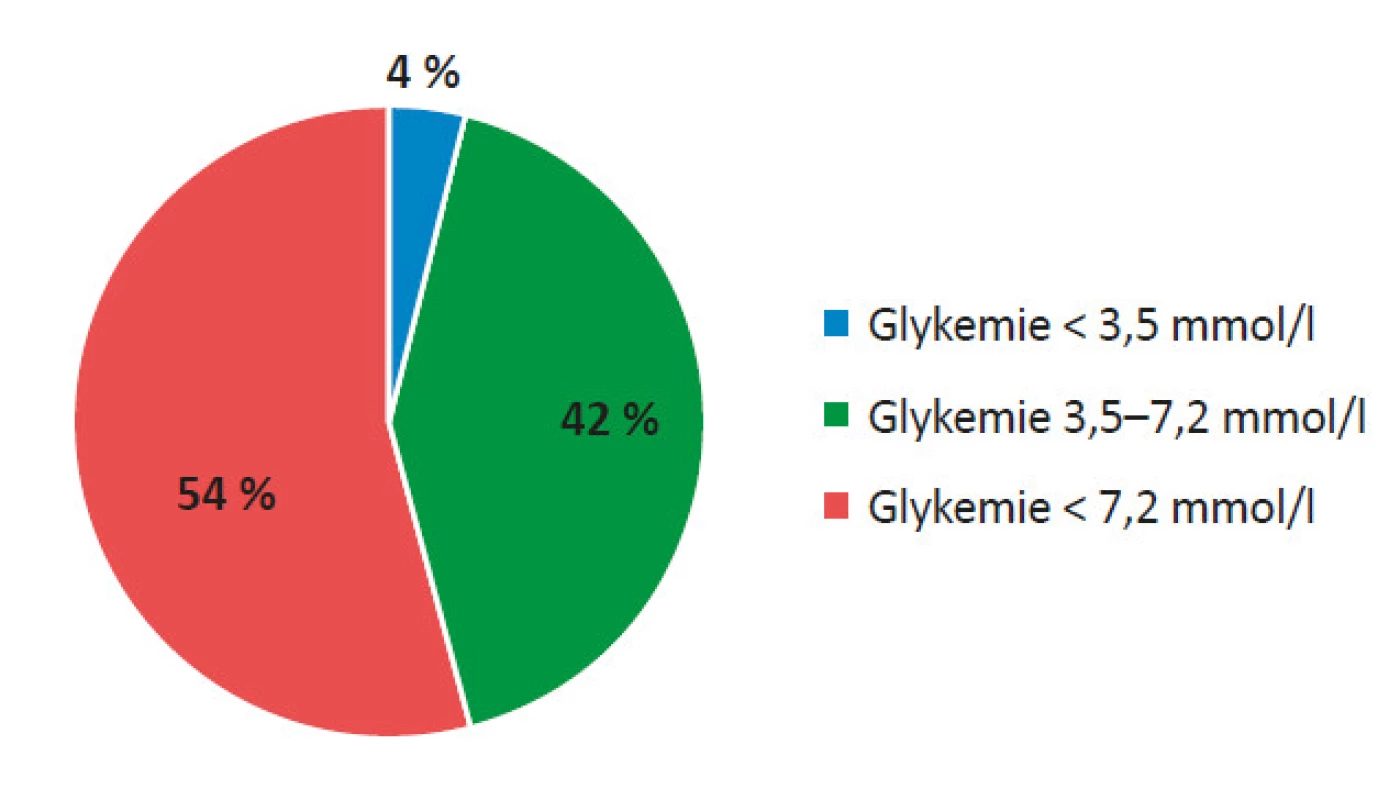
Obr. 7. Hodnocení CGM záznamu 1 měsíc od TxLO 
Obr. 8. Hodnocení CGM záznamu 3 měsíce od TxLO 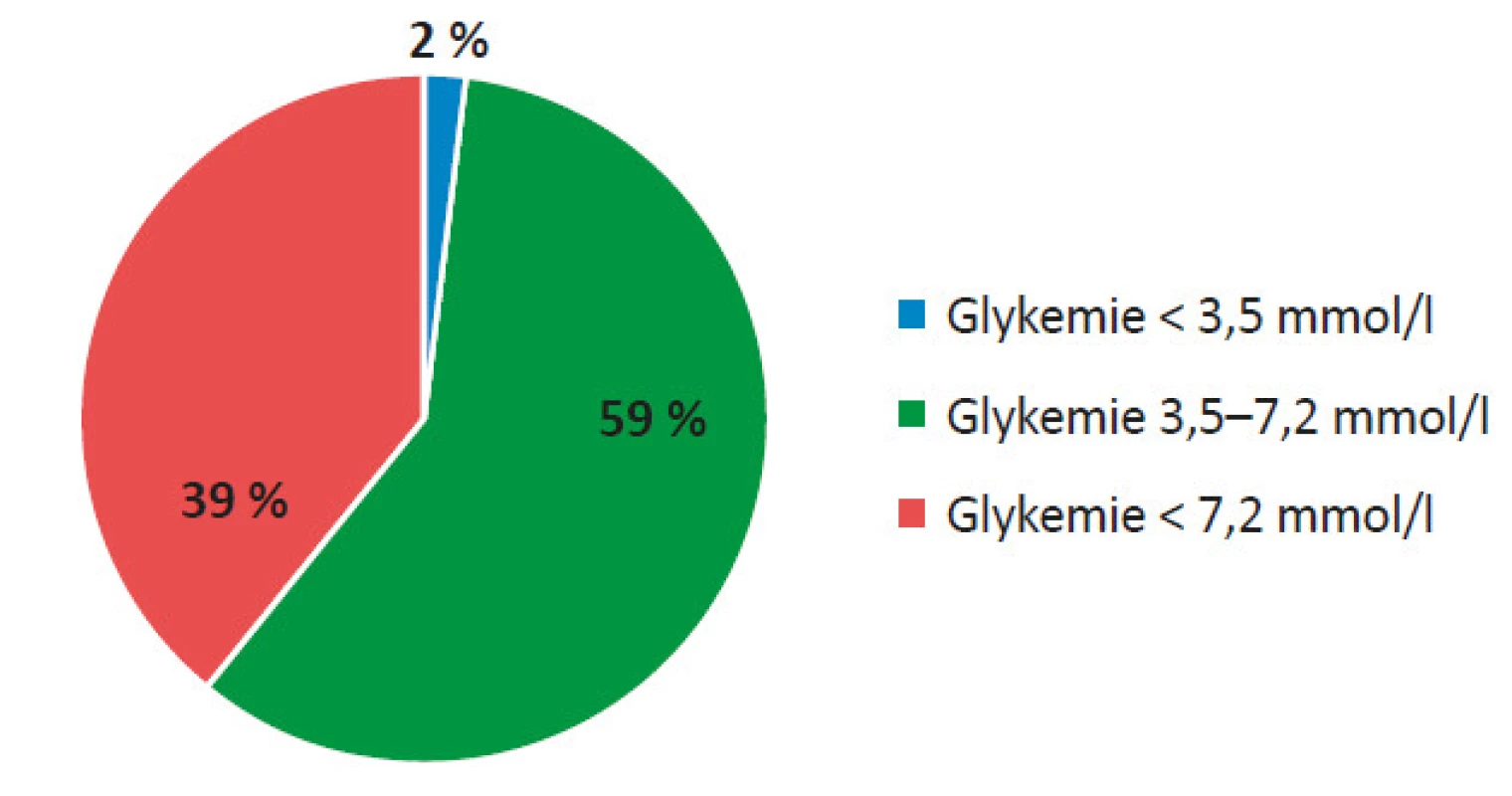
Obr. 9. Hodnocení CGM záznamu 6 měsíců od TxLO 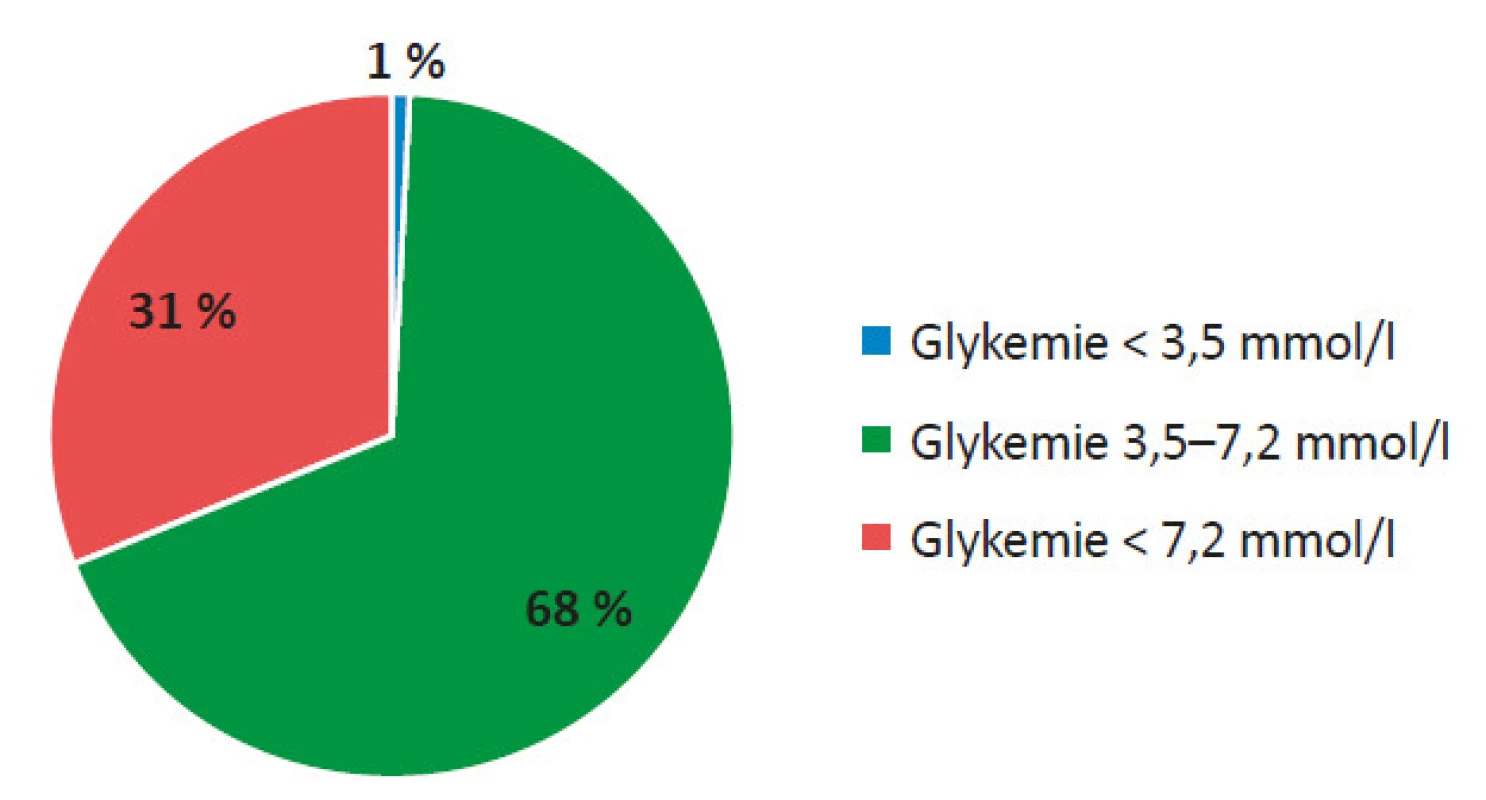
Hodnocení lability diabetu proběhlo pomocí výpočtu mean amplitude of glycemic excursions (MAGE), která dosahovala před TxLO 7,4 ± 3,9 mmol/l, 1 měsíc od TxLO 6 ± 0,6 mmol/l (p = 0,23576), 3 měsíce po TxLO 5,1 ± 1,1 mmol/l (p = 0,01831) a 6 měsíců od TxLO 5 ± 0,8 mmol/l (p = 0,01786) (viz obr. 10).
Obr. 10. Hodnocení lability diabetu (pomocí výpočtu MAGE – mean amplitude of glycemic excursions) u pacientů před a po TxLO 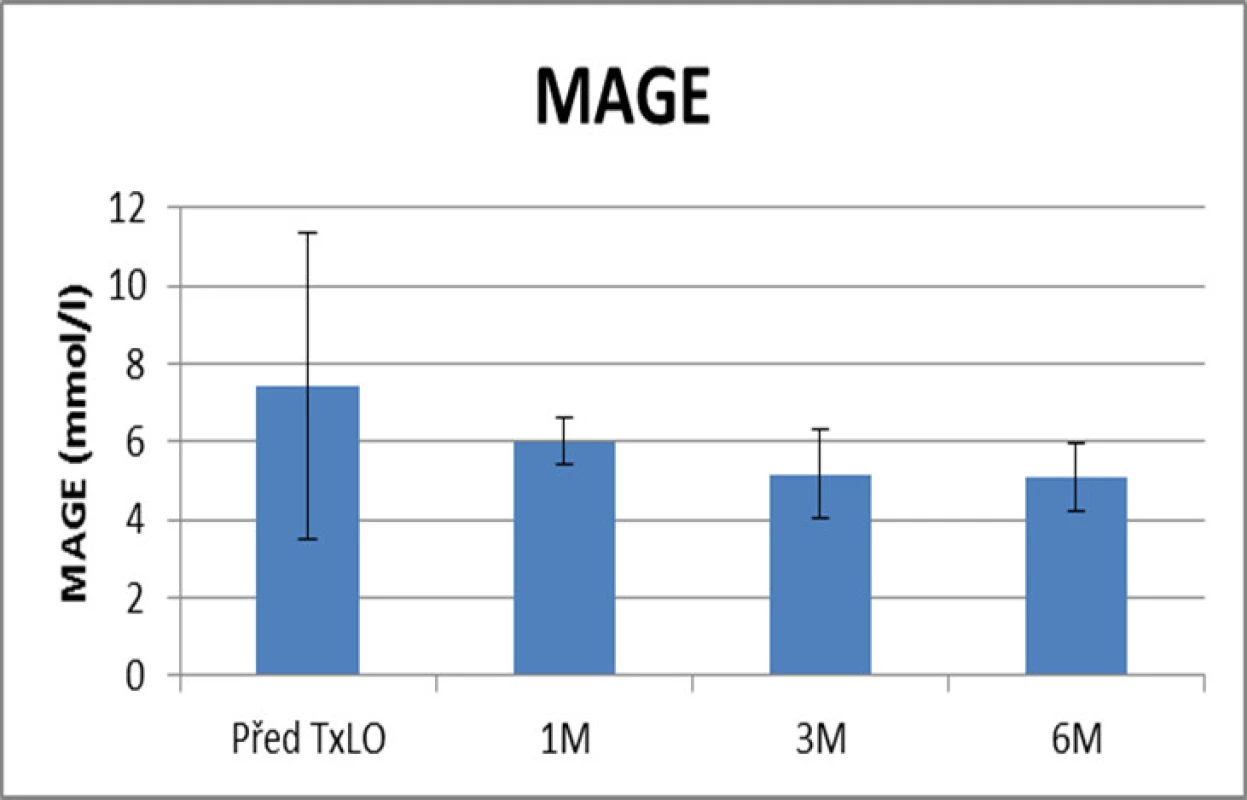
Z komplikací TxLO bylo nejčastěji přítomno krvácení v oblasti vpichu u 9 pacientů (41 %), u 11 transplantací z celkového počtu 46 (24 %), z toho operační revize proběhla u 6 pacientů (27 %). Dále se vyskytl 1× ortostatický kolaps, 1× cholecystitida, 2× poranění žlučových cest a 2× intrahepatální hematom léčený konzervativně s příznivým vývojem.
Před transplantací pankreatu dosahoval HbA1c 75 mmol/mol (71–84) (viz obr. 11), C-peptid byl nedetekovatelný (viz obr. 12 a 13), denní potřeba inzulinu činila 0,6 IU/kg (0,4–0,8) u všech pacientů a počet těžkých hypoglykemií byl 3 na pacienta za 1 rok (2–6) u 40 pacientů (91 %). 1 rok od transplantace pankreatu dosahovala hodnota HbA1c 37 mmol/mol (34–55) (p < 0,00001), 73 % pacientů bylo bez nutnosti aplikace inzulinu, u 2 pacientů byla potřeba inzulinu ≤ 20 IU/den a HbA1c ≤ 60 mmol/mol, u 10 (22 %) pacientů došlo k afunkci a/nebo proběhla explantace štěpu. Hodnoty C-peptidu nalačno činily 1,03 nmol/l (0,76–1,39) a stimulovaného ve 120. minutě 1,96 nmol/l (1,14–2,39). 8 pacientů (18 %) mělo 2 (1–4) těžké hypoglykemie na pacienta a rok. Všichni tito pacienti byli ze skupiny selhavších. 2 roky od transplantace pankreatu dosahoval HbA1c 38 mmol/mol (36–58) (p < 0,00001), 30 pacientů (68 %) bylo nadále bez nutnosti aplikace inzulinu, u 3 pacientů byla potřeba inzulinu ≤ 20 IU/den a HbA1c ≤ 60mmol/mol a u 11 (25 %) pacientů došlo k afunkci štěpu. C-peptid nalačno byl 0,79 nmol/l (0,6–1,03) a stimulovaný ve 120. minutě 1,51 nmol/l (1,0–2,1) (tab. 3). Sedm pacientů (16 %) ze skupiny s afunkcí štěpu mělo 4 (2–5) těžké hypoglykemie na pacienta za jeden rok. Nejčastější příčinou selhání štěpu pankreatu byla akutní celulární rejekce, a to u 8 pacientů, chronická rejekce u 1 pacienta, u 2 pacientů nebyla příčina zjištěna.
Obr. 11. Hodnoty glykovaného hemoglobinu před a po TxP 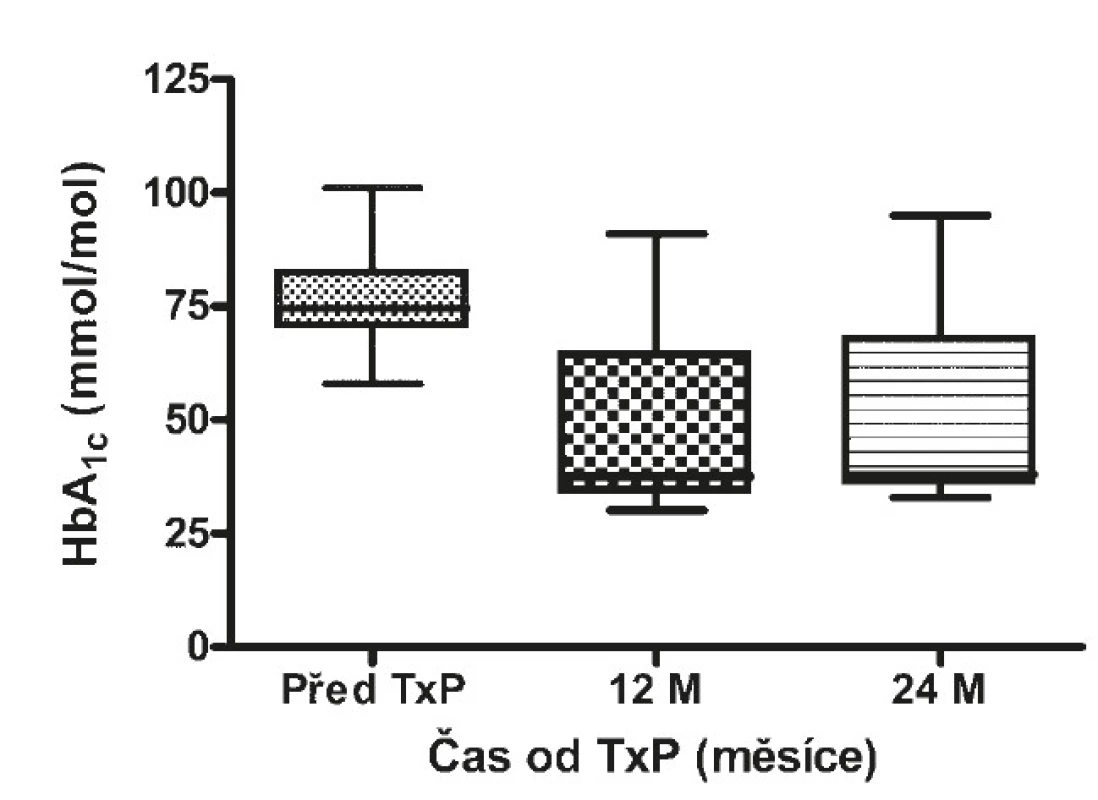
Obr. 12. Hodnoty C-peptidu nalačno před a po TxP 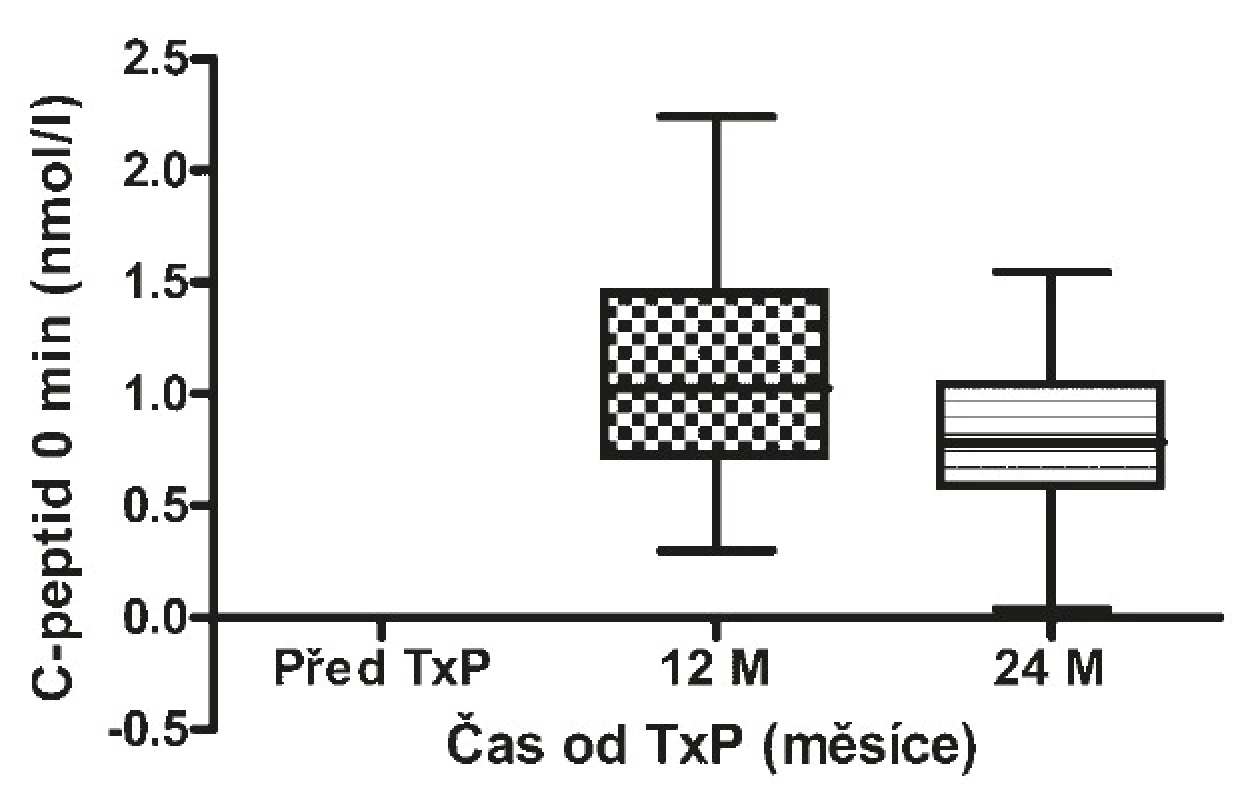
Obr. 13. Hodnoty C-peptidu po stimulaci po TxP 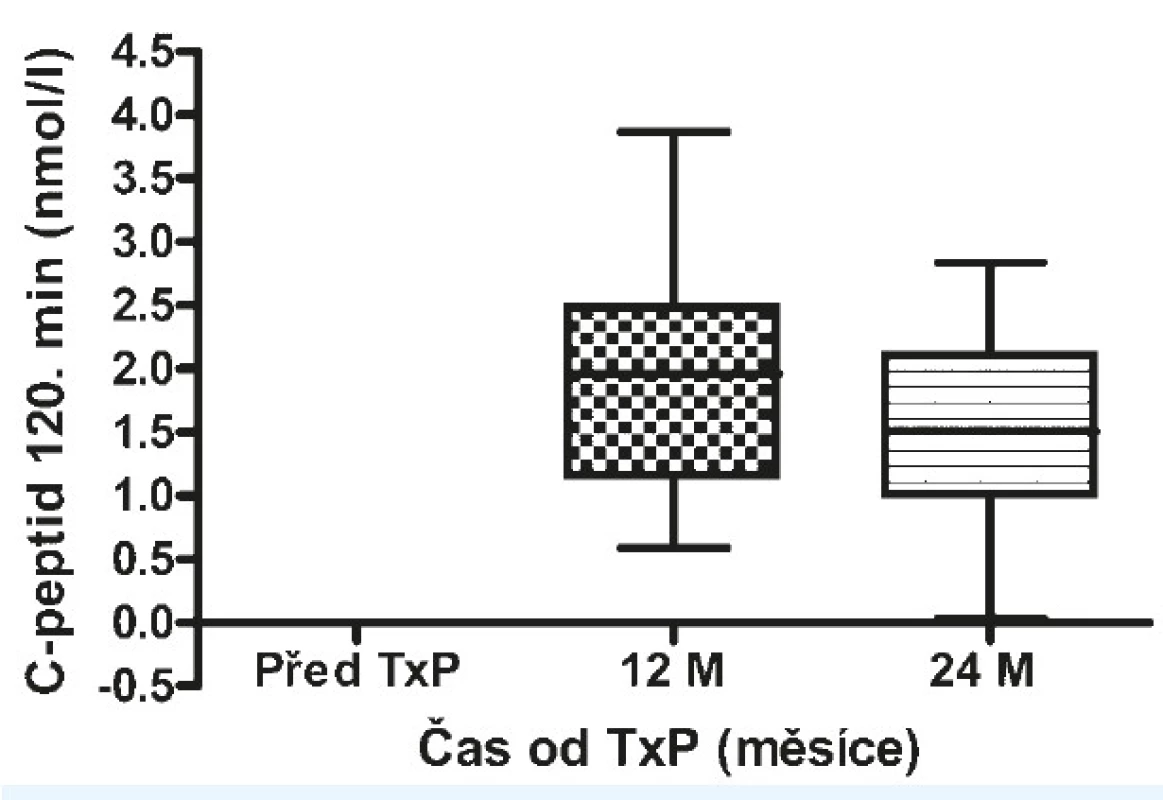
Z celkového počtu 50 transplantací pankreatu proběhlo 10 pankreatektomií (20 %) v časném potransplantačním období, 4 pacienti poté následně podstoupili retransplantaci. Mezi příčiny explantace štěpu patřily 1× nekrotizující pankreatitida, 5× trombóza vena lienalis a/nebo vena portae štěpu, 2× krvácení, 2× infekce. K nejčastějším příčinám chirurgické revize v časném potransplantačním období (n = 10) patřila infekce v oblasti štěpu pankreatu a/nebo krvácení. Porovnáním jednotlivých chirurgických technik bylo zjištěno, že v 1. období (1996−2004) proběhla graftektomie a/nebo revize u 9 pacientů z 19 (47 %), ve 2. období (2004−2011) u 8 pacientů ze 14 (57 %) a ve 3. období (od roku 2011) u 3 pacientů z 11 (27 %).
Renální funkce byla u většiny pacientů po TxP stabilní, s přechodnou elevací kreatininu o ≥ 30 % u 4 pacientů.
Diskuse
V prvním roce od transplantace Langerhansových ostrůvků došlo k významnému vzestupu hladiny C-peptidu, poklesu glykovaného hemoglobinu, redukci výskytu těžkých hypoglykemií i významnému poklesu dávky inzulinu. Ve druhém roce přetrvával významný nárůst hladiny C-peptidu, snížení HbA1c i redukce počtu těžkých hypoglykemií, dávka inzulinu již nebyla významně nižší než před TxLO. Dle hodnocení záznamu z kontinuálního senzoru glykemie došlo po TxLO k výrazné stabilizaci diabetu.
Primární kompozitní ukazatel 6 a 12 měsíců od poslední transplantace LO splnilo 45 % pacientů. Jednotlivé součásti kompozitního ukazatele splnilo 6 a 12 měsíců od transplantace pro C-peptid 77 % pacientů, redukci dávky inzulinu o ≥ 30 % jsme pozorovali u 72 % pacientů, nepřítomnost závažných hypoglykemií jsme zaznamenali u 68 % a HbA1c ≤ 53 mmol/mol u 60 % pacientů. Nejčastější komplikací transplantace LO bylo krvácení.
V prvním roce po transplantaci pankreatu měla většina pacientů výbornou funkci štěpu pankreatu bez nutnosti aplikace inzulinu, u 22 % pacientů však štěp selhal na podkladě rejekce či chirurgických komplikací s nutností jeho následného odstranění. Dva roky od transplantace pankreatu bylo 68 % pacientů stále bez potřeby inzulinu. Z chirurgických komplikací byly nejčastější infekce v oblasti štěpu pankreatu a/nebo krvácení. Po zavedení nové chirurgické techniky intraperitoneálního uložení štěpu došlo k výraznému poklesu četnosti komplikací s nutností chirurgické revize.
Transplantace Langerhansových ostrůvků nebo pankreatu jsou v obou případech léčebnou metodou pro diabetiky 1. typu s poruchou rozpoznávání hypoglykemií po selhání možností, které poskytuje intenzifikovaná inzulinová léčba. Ta dnes kromě strukturované a na hypoglykemie zaměřené edukace zahrnuje také použití moderních technologických postupů, jako jsou inzulinové pumpy a kontinuální monitorování hladiny glukózy v podkoží, i když jejich dostupnost zůstává zatím omezená (1−3).
Klinické hodnocení úspěšnosti transplantace LO by mělo vycházet z tzv. kompozitního ukazatele (kterým jsou nejčastěji zároveň měřitelný C-peptid, významné zlepšení hodnoty HbA1c a nepřítomnost těžkých hypoglykemií) (17, 18), zatímco po transplantaci pankreatu bývá kritériem úspěchu nezávislost na inzulinu. Po transplantaci pankreatu dosáhlo v našem centru nezávislosti na inzulinu 73 %, resp. 68 % pacientů po 12 a 24 měsících od transplantace, přechodné nezávislosti na inzulinu po TxLO dosáhlo jen 18 % pacientů. Porovnáním s recentními světovými výsledky, kde po jednom roce od TxP dosahovalo nezávislosti na inzulinu 93 % pacientů a 90 % příjemců TxLO bylo po jednom roce rovněž bez potřeby inzulinu (19), máme zvláště u transplantací LO ještě mnoho rezerv.
Prvním a nejdůležitějším krokem je nutnost zlepšit techniku izolací Langerhansových ostrůvků a zvýšit tak výtěžnost izolačního procesu. Dalším prostorem ke zlepšení by mohla být alokace mladších dárců pankreatu k izolaci LO. Ti byli v naší sledované kohortě signifikantně starší v porovnání s těmi určenými k transplantaci pankreatu, a to 49 let (44−57) versus 36 let (29−38,5) (p < 0,05). Měli rovněž vyšší BMI ve srovnání s dárci určenými k orgánové transplantaci (viz tab. 1), a to 26 kg/m2 (24−29) vs. 23 kg/m2 (20−27) (p = 0,00468). Naše výsledky podporují závěry, jež publikovali Niclaussová a její spolupracovníci (20), kteří popsali lepší klinické výsledky transplantací LO ve skupině pacientů, kde byl dárce pankreatu mladší 45 let.
Cílem transplantace Langerhansových ostrůvků zůstává především stabilizace diabetu bez nutnosti dosažení nezávislosti na inzulinu. Její výhoda spočívá v podstatně menší zátěži pro pacienta, zvláště pokud přidružené komorbidity činí operační výkon vysoce rizikovým, a v nižším výskytu komplikací, jež bývají lehčí než u transplantace pankreatu.
V současné době si transplantace LO a pankreatu nekonkurují, ale spíše se doplňují (21). Indikace k transplantaci pankreatu nebo LO se děje na základě posouzení celkového stavu pacienta, očekávaného cíle a významnou roli hraje také pacientovo přání. Transplantace LO je stále nová metoda, charakteristika příjemců LO se liší od příjemců transplantace pankreatu (většinou jde o starší pacienty, u nichž by byl operační výkon velmi rizikový, nebo se naopak jedná o mladé aktivní pacienty, kteří si větší chirurgický výkon nepřejí).
Světově významná centra (např. Ženeva či Edmonton) se specializují pouze na transplantaci LO a orgány si pro izolaci LO pečlivě vybírají. V našem centru je již dlouhodobě (od roku 1985) zavedená orgánová transplantace pankreatu s výbornými výsledky a nejlepší orgány jsou většinou určené k transplantaci pankreatu. V neposlední řadě se liší i financování obou typů výkonů. Transplantace pankreatu je hrazena z prostředků zdravotního pojištění podobně jako transplantace ledviny. U transplantace LO je hrazena ze zdravotního pojištění pouze hospitalizace, ostatní úkony včetně celého procesu izolace LO jsou v současné době financované pouze z grantových prostředků. Počet transplantací (a izolací) LO je tak výrazně limitován.
Ke zlepšení výsledků transplantací LO by tedy pomohlo zvýšení výtěžnosti počtu ostrůvků během izolace, dále alokace mladších dárců pankreatu srovnatelných s těmi pro orgánovou transplantaci a v neposlední řadě pokrytí nákladů na izolaci LO z prostředků zdravotního pojištění, jako je tomu např. ve Velké Británii (22), Švýcarsku a nověji i ve Francii (21).
Určité riziko také představuje možnost krvácení. Jeho nebezpečí jsme snížili zavedením nové metody s použitím fibrinového lepidla (Avitene Collagen Hemostat, Davol, A Bard Company, USA) aplikovaného do punkčního kanálu. Pokud by existovalo zvýšené riziko krvácení, je možné rovněž aplikovat ostrůvky laparotomicky malým řezem do dolní mezenterické žíly, podobně jako při současné transplantaci ledviny a LO, a vpich ošetřit suturou. Oproti perkutánní transhepatální aplikaci představuje tento postup menší riziko z hlediska vzniku krvácení do dutiny břišní a rozvoje intraparenchymového hematomu jater (23).
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s registračním číslem NT 14020-3/2013. Veškerá práva podle předpisů na ochranu duševního vlastnictví vyhrazena.
Studie byla před zahájením schválena místní etickou komisí v rámci žádosti o udělení grantu. V souvislosti s tématem, vznikem a publikací tohoto článku nedochází ke střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Seznam použitých zkratek
BMI body mass index
IEQ islet equivalents (počet tzv. ostrůvkových ekvivalentů slouží k upřesnění počtu ostrůvků získaných izolací a použitých k transplantaci)
MAGE mean amplitude of glycemic excursions
oGTT orální glukózový toleranční test
TxLO transplantace Langerhansových ostrůvků
TxP transplantace pankreatu
Adresa pro korespondenci:
MUDr. Martina Zahradnická, Ph.D.
Klinika diabetologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
Tel.: 261 362 299
e-mail: martina.zahradnicka@ikem.cz, mamd@ikem.cz
Zdroje
1. Choudhary P, Rickels MR, Senior PA et al. Evidence-informed clinical practice recommendations for treatment of type 1 diabetes complicated by problematic hypoglycemia. Diabetes Care. 2015; 38(6): 1016–1029.
2. Saudek F. Transplantace pankreatu a pankreatických ostrůvků v léčbě diabetu. Postgraduální medicína 2012; 14 : 11–18.
3. Mindlová M, Saudek F. Autonomní selhání způsobené recidivujícími hypoglykémiemi, jeho klinické hodnocení a terapie. Praktický lékař 2007; 87(1): 52–57.
4. Rickels MR. Recovery of endocrine function after islet and pancreas transplantation. Curr Diab Rep 2012; 12(5): 587–596.
5. Fioretto P, Steffes MW, Sutherland DER et al. Reversal of lesions of diabetic nephropathy after pancreas transplantation. N Engl J Med 1998; 339(2): 69–75.
6. Kennedy WR, Navarro X, Goetz FC et al. Effects of pancreatic transplantation on diabetic neuropathy. N Engl J Med 1990; 322(15): 1031–1037.
7. Lee TC, Barshes NR, O’Mahony CA et al. The effect of pancreatic islet transplantation on progression of diabetic retinopathy and neuropathy. Transplant Proc 2005; 37(5): 2263–2265.
8. Kleinclauss F, Fauda M, Sutherland DE et al. Pancreas after living donor kidney transplants in diabetic patients: impact on long-term kidney graft function. Clin Transplant. 2009; 23(4): 437–446.
9. Barton FB, Rickels MR, Alejandro R et al. Improvement in outcomes of clinical islet transplantation: 1999–2010. Diabetes Care 2012; 35 : 1436–1445.
10. Lehmann R, Graziano J, Brockmann J et al. Glycemic control in simultaneous islet-kidney versus pancreas-kidney transplantation in type 1 diabetes: a prospective 13-year follow-up. Diabetes Care 2015; 38(5): 752–759.
11. Saudek F, Girman P, Kříž J et al. Léčba diabetu transplantací izolovaných Langerhansových ostrůvků. Časopis lékařů českých 2011; 150 : 49–55.
12. Koh A, Senior P, Salam A et al. Insulin-heparin infusions peritransplant substantially improve single-donor clinical transplant success. Transplantation 2010; 89 : 465–471.
13. Clarke WL, Cox DJ, Gonder-Frederick LA et al. Reduced awareness of hypoglycemia in adults with IDDM. A prospective study of hypoglycemic frequency and associated symptoms. Diabetes Care 1995; 18(4): 517–522.
14. Gold AE, MacLeod KM, Frier BM. Frequency of severe hypoglycemia in patients with type I diabetes with impaired awareness of hypoglycemia. Diabetes Care 1994; 17(7): 697–703.
15. Service FJ, Molnar GD, Rosevear JW et al. Mean amplitude of glycemic excursions, a measure of diabetic instability. Diabetes 1970; 19(9): 644–655.
16. Girman P, Saudek F. The IKEM pancreas and islet transplant program as part of healthcare for type 1 diabetes patients: retrospective analysis of outcome from 1983 to 2010. Rev Diabet Stud. 2011; 8(1): 35–43.
17. Tiwari JL, Schneider B, Barton F, Anderson SA. Islet cell transplantation in type 1 diabetes: an analysis of efficacy outcomes and considerations for trial designs. Am J Transplant. 2012; 12(7): 1898–1907.
18. Alejandro R, Barton FB, Hering B, Wease S. The CITR investigators. 2008 update from the collaborative islet transplant registry. Transplantation 2008; 86(12): 1783–1788.
19. Moassesfar S, Masharani U, Frassetto LA et al. A comparative analysis of the safety, efficacy, and cost of islet versus pancreas transplantation in nonuremic patients with type 1 diabetes. Am J Transplant 2016; 16(2): 518–526.
20. Niclauss N, Bosco D, Morel P et al. Influence of donor age on islet isolation and transplantation outcome. Transplantation. 2011; 91(3): 360–366.
21. Niclauss N, Morel P, Berney T. Has the gap between pancreas and islet transplantation closed? Transplantation 2014; 98(6): 593–599.
22. Forbes S, McGowan NW, Duncan K et al. Islet transplantation from a nationally funded UK centre reaches socially deprived groups and improves metabolic outcomes. Diabetologia 2015; 58(6): 1300–1308.
23. Marada T, Lipár K, Adamec M et al. Simultánní transplantace ledviny a Langerhansových ostrůvků. Rozhledy v chirurgii 2011; 90(2): 111–113.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Přednáškové večery Spolku českých lékařů v Praze (leden 2017)
- Editorial
- Osteoporóza u mužů
- Transplantace Langerhansových ostrůvků v léčbě syndromu porušeného vnímání hypoglykemie. Vyhodnocení pilotního programu a porovnání s transplantací pankreatu
- Sekulární trend v tělesné výšce a hmotnosti dospělé populace v České republice
- Klinické hodnocení poruch acidobázické rovnováhy: Hendersonův-Hasselbalchův, nebo Stewartův-Fenclův přístup?
- Nekódující RNA – od nepotřebných po nepostradatelné
- Správný postup při indikaci a provádění pitev v České republice
- Nástrahy diagnostického procesu aneb „zamyšlení nad myšlením lékařů“
- Druhá transatlantická konference o personalizované medicíně
- David Hunter Hubel (1926–2013)
- Jubilanti
- O psychologických souvislostech porodních bolestí
- Antidiabetika – historie, současnost a perspektivy
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sekulární trend v tělesné výšce a hmotnosti dospělé populace v České republice
- Správný postup při indikaci a provádění pitev v České republice
- Klinické hodnocení poruch acidobázické rovnováhy: Hendersonův-Hasselbalchův, nebo Stewartův-Fenclův přístup?
- Nástrahy diagnostického procesu aneb „zamyšlení nad myšlením lékařů“
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



