-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nekódující RNA – od nepotřebných po nepostradatelné
Non-coding RNA – from useless to essential
Whole-genome sequencing analyses revealed that the majority of the human genome is transcribed and identified thousands of protein non-coding transcripts. Non-coding RNAs (ncRNAs) are divided into two main groups: small and long ncRNAs. This review is focused on the regulatory ncRNAs mainly on microRNAs and long ncRNAs. These ncRNAs regulate gene expression at the transcriptional and post-transcriptional levels. In this context, ncRNAs are involved in the regulation of most cellular processes and their deregulation has serious impacts on the phenotype. Hundreds of studies have implicated ncRNAs in the pathogenesis of many diseases ranging from metabolic disorders to diseases of organ systems as well as various types of cancers.
Clinically, ncRNAs belong to a new generation of diagnostic and prognostic biomarkers with a great potential. Due to high tissue specificity and ability to regulate multiple genes often within one signaling pathway, ncRNAs represent attractive therapeutic targets. Increasing knowledge about a wide spectrum of ncRNA actions demonstrate a pivotal role of these transcripts in expression regulation. Many aspects of the ncRNA biology are still unclear and their understanding will provide us a new perspective on the complexity of the regulatory network.Keywords:
non-coding RNA, gene expression regulation, miRNA, lncRNA
Autoři: Hana Votavová; Radim Brdička
Působiště autorů: Oddělení genomiky, Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 370-376
Kategorie: Přehledové články
Souhrn
Celogenomové sekvenační analýzy odhalily, že převážná část lidského genomu je transkribována, a identifikovaly tisíce protein nekódujících transkriptů. Nekódující RNA (ncRNA) se dělí na dvě hlavní skupiny: malé a dlouhé ncRNA. Tento přehledový článek je zaměřen na ncRNA s regulační funkcí, a to především na mikroRNA a dlouhé ncRNA. Tyto ncRNA regulují genovou expresi na transkripční a posttranskripční úrovni. V tomto kontextu ncRNA zasahují do regulace většiny buněčných procesů a jejich deregulace má vážné dopady na fenotyp. Již stovky studií prokázaly zapojení ncRNA do patogeneze mnoha onemocnění, od metabolických poruch přes onemocnění orgánových systémů až po různé typy nádorů.
Z klinického hlediska patří ncRNA do nové generace diagnostických a prognostických biomarkerů s velkým potenciálem. Vzhledem k vysoké tkáňové specifciitě a schopnosti regulovat více genů často v rámci jedné signální dráhy představují ncRNA i atraktivní terapeutické cíle. Narůstající poznatky o širokém spektru působení ncRNA ukazují na klíčovou roli těchto transkriptů v regulaci exprese. Řada aspektů z biologie ncRNA ještě není objasněna a jejich pochopení nám poskytne nový pohled na komplexnost regulační sítě.Klíčová slova:
nekódující RNA, regulace genové exprese, miRNA, lncRNAÚVOD
Náš pohled na informační obsah lidského genomu prodělal mnoho změn, které byly dány stupněm našeho poznání a s tím souvisejícím vytvářením kategorií genetických informací. Nejstarší pohled vycházel z fenotypu, objevení nukleových kyselin a jejich kódovacích schopností dalo původně virtuálním jednotkám dědičnosti hmotný základ. Jednoduchý proces realizace genetické informace vedl od genu (DNA) přes RNA k proteinům, kterých byl znám velký počet; proto jsme se domnívali, že počet genů bude podobný.
Když se ukázalo, že jeden gen může obsahovat informace pro větší počet proteinů, a že převažující část genomu je dokonce pro syntézu proteinů nevyužita, usoudili jsme, že jde zbytečný balast a že počet proteiny kódujících genů, přesahující jen nepatrně 20 tisíc, je dostatečný pro realizaci všech biologických procesů. Avšak další analýzy genomu nám ukázaly, že za geny lze považovat i mnoho genetických elementů, jejichž realizace nekončí vznikem proteinů, ale které jsou funkční na úrovni RNA.
NEKÓDUJÍCÍ RNA
Pokrok ve vývoji vysokokapacitních technologií a bioinformatických nástrojů umožnil detailní průzkum transkriptomu lidských buněk. V rámci projektu ENCODE (projekt encyklopedie DNA elementů, www.encodeproject.org) byl vytvořen detailní přehled funkčních elementů v lidském genomu, ať už působí na úrovni RNA či proteinů. Data z tohoto projektu ukázala, že k 80 % DNA lze přiřadit nejméně jednu biochemickou funkci. Podle koordinátorů projektu zřejmě až 19 % genomu kóduje transkripty, které nenesou informaci pro tvorbu proteinu, ale mají funkci regulační. Takto vysoký podíl regulačních RNA překračuje veškerá naše očekávání. Sekvenační analýzy ukázaly, že populace nekódujících RNA (ncRNA) se skládá ze dvou frakcí: malých (krátkých) a dlouhých ncRNA.
MALÉ NEKÓDUJÍCÍ RNA
Malé nekódující RNA (sncRNA, ~20 až 30 nukleotidů) představují klíčovou složku procesu RNA interference (RNAi), což je evolučně starý mechanismus pro regulaci genové exprese na posttranskripční úrovni. Tento původně obranný mechanismus je využíván jak primitivními organismy (např. kvasinkami), tak i rostlinami, houbami a živočichy. Podle délky, biogeneze a mechanismu regulace cílových molekul lze regulační sncRNA rozdělit do 3 hlavních skupin: mikroRNA, malé interferující RNA a RNA interagující s PIWI proteiny (viz tab. 1).
Tab. 1. Charakteristika hlavních kategorií ncRNA s regulační funkcí 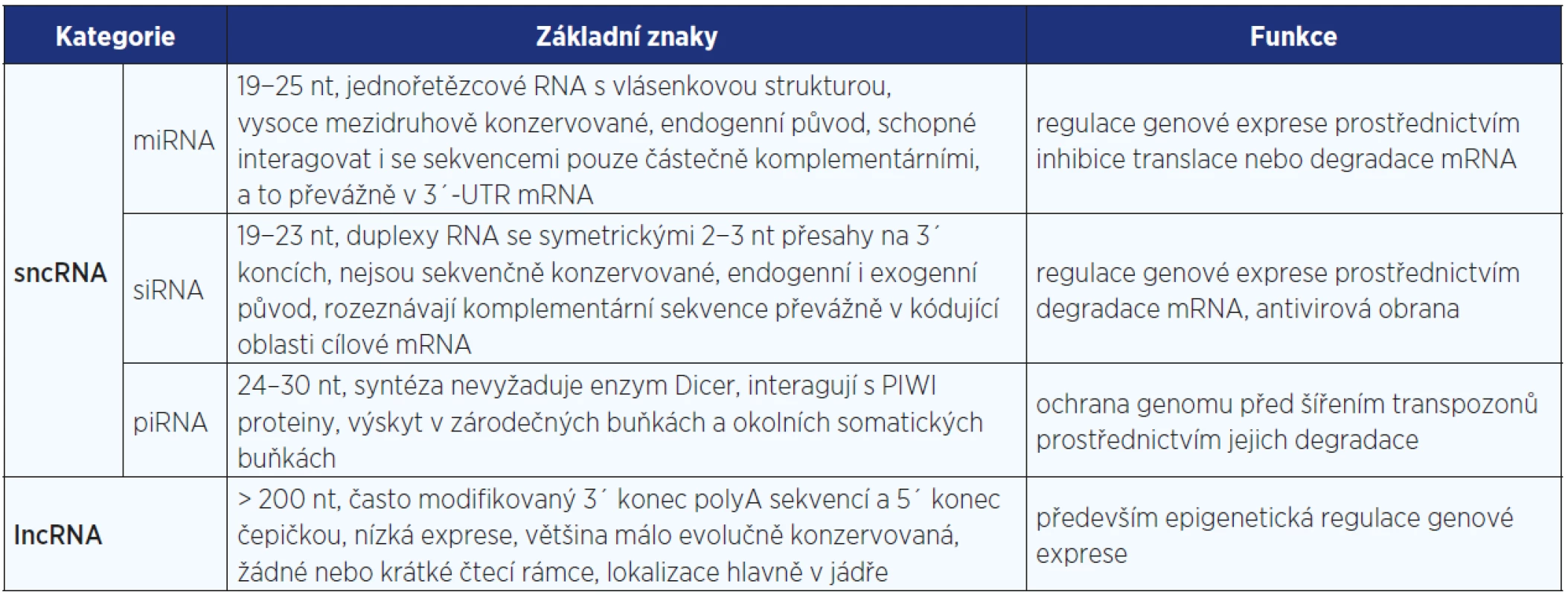
MikroRNA
MikroRNA (miRNA) jsou jednořetězcové molekuly RNA o velikosti většinou 22 nukleotidů (nt), jejichž základní charakteristikou je vlásenková struktura a vysoká mezidruhová konzervovanost. Geny pro miRNA jsou roztroušeny po celém genomu, přičemž polovina z nich se nachází v mezigenových oblastech, dále je lze nalézt v intronech a vzácně i v exonech. miRNA negativně regulují genovou expresi prostřednictvím degradace cílové mediátorové RNA (mRNA) nebo inhibují její translaci, což je majoritní mechanismus probíhající u živočichů.
Vzhledem ke stále narůstajícímu počtu nově identifikovaných miRNA byly vytvořeny databáze shromažďující informace o jejich sekvenci, prekurzorech, funkcích, atd. Mezi nejvíce používané databáze patří miRBase (www.mirbase.org; miRBase 21 v současné době obsahuje údaje o 2603 zralých lidských molekulách miRNA), miRWalk (www.umm.uni-heidelberg.de/apps/zmf/mirwalk/index.html), případně PhenomiR (http://mips.helmholtz-muenchen.de/phenomir/index.gsp) a miRandola (http://atlas.dmi.unict.it/mirandola/index.html). Vedle tkáňových miRNA byly objeveny i extracelulární miRNA cirkulující v tělních tekutinách a informace o nich lze nalézt například v databázi ExcellmiRDB (www.excellmirdb.brfjaisalmer.com).
Biogeneze efektorových miRNA začíná v jádře, kde jsou miRNA geny transkribovány RNA polymerázou II jako dlouhé primární transkripty (pri-miRNA). Tyto transkripty jsou štěpeny proteinovým komplexem obsahujícím ribonukleázu Drosha za vzniku prekurzorové miRNA (pre-miRNA) o délce přibližně 70 nukleotidů. Tento prekurzor je následně transportován do cytoplazmy, kde je štěpen endonukleázou označovanou jako Dicer a vzniká duplex miRNA o délce 22 nukleotidů. Jedno vlákno duplexu je degradováno a druhé vlákno (tzv. vedoucí) se asociuje ke komplexu RISC (RNA-induced silencing complex), který zprostředkovává represi cílového genu (1). MiRNA intereaguje se sekvencemi v 3´ UTR (untranslated region) oblasti cílových mRNA a při úplné komplementaritě dochází k degradaci mRNA. Avšak mnohem častěji se jedná o neúplnou komplementaritu, která vede k inhibici translace.
Studium regulace genů prostřednictvím miRNA je ztíženo faktem, že jedna miRNA může ovládat více různých mRNA. Pro usnadnění vyhledávání cílových genů byly vytvořeny webové aplikace, které na základě shody v sekvenci mezi seed oblastí miRNA a 3´ UTR mRNA vytipují potenciální mRNA − příkladem jsou Targetscan (www.targetscan.org), Pictar (www.pictar.org), RNA22 (https://cm.jefferson.edu/rna22), microRNA.org (www.microrna.org/microrna/home.do), Diana-microT (http://diana.imis.athena-innovation.gr/DianaTools/index.php?r=microT_CDS/index).
miRNA jsou zapojeny do základních buněčných procesů (diferenciace, proliferace, apoptóza atd.) a jejich deregulace má ve většině případů vážné dopady na fenotyp (velmi často dochází k maligní transformaci). Vystává tedy otázka, jak jsou regulovány samotné miRNA a jaké jsou kontrolní mechanismy jejich syntézy. miRNA geny mají podobné regulační elementy (promotory a enhancery) jako protein kódující geny. V některých případech dokonce miRNA geny (většinou intronové) využívají promotorovou sekvenci hostitelského genu. Na promotorové sekvence se váží transkripční faktory, které aktivují či potlačují expresi dané miRNA. Například u různých malignit transkripční faktor MYC indukuje expresi klastru miR-19-92 a faktor STAT3 stimuluje expresi miR-21, miR-155 a miR-181b (2, 3). Promotorové oblasti některých miRNA (miR-34b, miR-127) dále podléhají epigenetické regulaci, kdy úroveň methylace určuje míru exprese daného miRNA genu. Další regulátory zasahují do samotné biogeneze miRNA, například RNA-vazebný protein LIN28 blokuje zpracování primárního transkriptu let-7 v embryonálních buňkách (4) nebo vlastní složky (např. argonautové proteiny) mikroprocesorového aparátu regulují tvorbu zralé miRNA. Mezi všemi uvedenými regulačními prvky a miRNA existují zpětnovazebné interakce, které udržují správnou hladinu miRNA v buňce.
V souvislosti s onkogenezí fungují miRNA analogicky buď jako onkogeny (oncomiRNA, jejich cílovými geny jsou tumor supresorové geny), nebo jako tumor supresorové geny (snižují expresi genů s onkogenní aktivitou). Některé miRNA jsou označovány jako metastamiR, neboť se uplatňující v tvorbě metastáz (např. miR-200, miR-148). Mechanismy deregulace miRNA zahrnují chromosomální aberace (delece, amplifikace), mutace, polymorfismy a epigenetické modifikace (methylaci či deacetylaci histonů) (5).
První studie, která prokázala kauzální úlohu miRNA v lidské onkogenezi, pochází z roku 2002. Calin a jeho spolupracovníci (6) analyzovali genový obsah delece 13q14 vyskytující se u cca 50 % pacientů s chronickou lymfocytovou leukemií a zjistili, že tato delece neobsahuje tumor supresorový gen, jak očekávali, ale dvě miRNA (miR-15a a miR-16-1) exprimované ve stejné polycistronní RNA. Na základě tohoto zjištění stejná pracovní skupina zmapovala všechny doposud známé miRNA a potvrdila lokalizaci mnoha z nich v chromosomálních lokusech, jež jsou s vysokou frekvencí deletovány či amplifikovány u nádorů (7). V následujících letech stovky publikací potvrdily souvislost mezi miRNA a vznikem různých nádorů (viz tab. 2). Tomuto tématu je věnována rozsáhlá domácí monografie Slabého a kol. (8). Na tomto místě bychom pro ilustraci uvedli pouze několik chorob spojených s neurodegenerativními změnami − Alzheimerovu chorobu (9), Parkinsonovu chorobu (10) nebo schizofrenii (11).
Tab. 2. Příklady ncRNA vykazujících deregulaci u širokého spektra různých onemocnění (zpracováno podle databází PhenomiR 2.0 a lncRNADisease: 55−57) 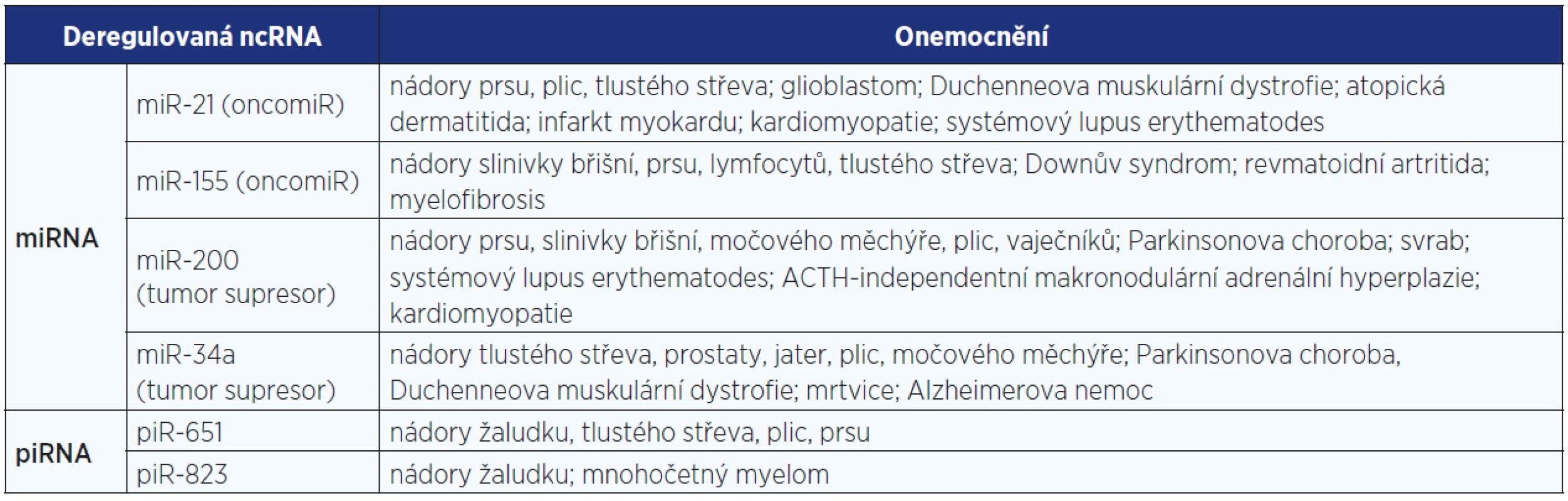
Identifikace miRNA nastartovala vývoj technologií a vysokokapacitních platforem pro analýzy miRNA, které díky své délce a struktuře skýtaly určité komplikace. Rozvoj se ubíral směrem od kvantitativní PCR s vlásenkovými (stem-loop) nebo LNA (locked nucleic acid) primery (12) přes mikročipy (13), mikročástice analyzované průtokovou cytometrií (14) až po nejnovější sekvenování nové generace (15), které umožňuje detekci nejen deregulovaných miRNA, ale také identifikaci nových miRNA a jejich izoforem. Celogenomové aplikace pro stanovení miRNAomu (miRNA transkriptom = soubor všech miRNA exprimovaných specifickým genomem) ukázaly, že expresní profily miRNA rozlišují různé typy patologických stavů s větší přesností než profily mRNA (14,16), a to zejména díky vyšší stabilitě miRNA molekul v různých podmínkách, za kterých jsou dlouhé mRNA degradovány.
Tato stabilita a omezený počet předurčily miRNA pro roli robustních biomarkerů jak diagnostických, tak prognostických (17). Zejména miRNA cirkulující v tělních tekutinách jsou snadno přístupné pro analytické metody (18). Podle současných poznatků je víceméně každé onemocnění asociováno se specifickými miRNA, jejichž míra exprese určuje typ/podtyp onemocnění, jeho stupeň/stadium, prognózu jeho dalšího vývoje či predikci odpovědi na léčbu. Z oblasti diagnostického použití miRNA lze uvést například miR-141, jejíž zvýšená exprese v séru je charakteristická pro nádory prostaty (19). Jako prognostické ukazatele délky přežití u pacientů s nádorem tlustého střeva slouží miR-21 a miR-34b/c (20, 21). V praxi již probíhají klinické studie (např. u karcinomu prsu a plic), které ověřují spolehlivost nalezených miRNA biomarkerů, a je jen otázkou času, kdy budou zařazeny mezi používané.
Jelikož miRNA mají významnou úlohu v patogenezi mnoha onemocnění a jsou schopné regulovat více genů, často v rámci jedné signální dráhy, staly se tyto molekuly atraktivními terapeutickými cíli. Strategie terapeutických přístupů se přímo zaměřují na výkonnou miRNA a snaží se o korekci její abnormální hladiny. V případě zvýšené exprese miRNA jsou používány inhibiční molekuly (anti-miR), které vazbou na miRNA blokují její funkci. Naopak pokud je funkce miRNA snížená, nebo dokonce došlo zcela k její ztrátě, jsou do buněk vnášeny expresní konstrukty (např. adenovirové vektory obsahující miRNA gen) zajištující náhradní produkci dané miRNA nebo jsou aplikovány přímo krátké dvouřetězcové oligonukleotidy (tzv. miRNA mimics) se shodnou sekvencí. Cílem nepřímých terapeutických strategií jsou faktory regulující expresi či syntézu patologické miRNA.
Ačkoliv vyhlídky aplikovatelnosti cílené terapie pomocí miRNA jsou optimistické, zbývá ještě řada problémů, které jsou postupně řešeny (stabilita a specificita molekul, cílený přenos do poškozené tkáně, vedlejší účinky, vylučování močí atd.). V běhu jsou již klinické studie testující vyvinuté léky. Příkladem může být antivirotikum miravirsen (Santaris Pharma/Roche) určené pro léčbu hepatocelulárního karcinomu, který je vyvolán virem hepatitidy typu C. Tento lék je antagonistou miR-122, jež je exprimovaná v jaterních buňkách a je nezbytná pro replikaci viru (22).
Malé interferující RNA
Malé interferující RNA (small interfering RNA, siRNA) jsou krátké dvouřetězcové molekuly RNA o délce 21−22 nt s charakteristickými přesahy 2 nt na 3´ koncích. Na rozdíl od endogenních miRNA, které regulují expresi vlastních genů, siRNA mohou být rovněž exogenního původu a působí i proti cizorodým molekulám, např. virovým, jež by mohly narušit integritu vlastního genomu. siRNA většinou vznikají transpozicí či replikací virů, ale mohou být odvozeny i z mRNA či heterochromatinu. Dlouhé dvouřetězcové prekurzory RNA (dsRNA) jsou zpracovávány v cytoplazmě (zatímco část syntézy miRNA probíhá v jádře) enzymem Dicer, který je štěpí na krátké duplexy. Tyto duplexy jsou inkorporovány do komplexu RISC a po rozvolnění duplexu antisense řetězec rozpoznává homologní mRNA, jež je rozštěpena. siRNA rozpoznávají komplementární sekvence především v kódujících oblastech cílové mRNA, zatímco miRNA se váží na 3´ konec mRNA, který navíc nemusí být plně komplementární.
Princip působení krátkých regulačních dsRNA byl popsán v roce 1998, kdy Andrew Fire a Craig Melo pozorovali sekvenčně specifické utlumení genové exprese pomocí těchto molekul u háďátka Caenorhabditis elegans (23). První endogenní siRNA v lidských buňkách byla identifikována v jednom z retrotranspozonů L1 patřících do skupiny LINE (long interspersed nuclear element) repetitivních oblastí genomu (24). Obousměrný přepis z L1 lokusu vede ke vzniku dsRNA, která je dále rozštěpena na siRNA pomocí ribonukleázy Dicer1. Endogenní siRNA také byly nalezeny v myších oocytech (25) a pocházejí z dlouhých dsRNA odvozených z transkritpů transpozonů nebo z hybridizace mezi transkripty genů a pseudogenů. Příkladem exogenních siRNA jsou RNA odvozené z virového genomu (tzv. vsiRNA), který v buňce realizuje svou replikaci a produkuje dlouhé dsRNA. Tyto dsRNA jsou enzymem Dicer rozštěpeny na siRNA, jež jsou zatím nejasným mechanismem zapojeny do rychlé a efektivní antivirové odpovědi (26).
V oblasti funkční genomiky jsou siRNA hojně využívány pro cílenou inaktivaci různých genů a představují tak i vhodný nástroj pro genovou terapii. Avšak u somatických buněk savců dsRNA delší než 30 bp aktivují antivirovou obranu a nespecifickou inhibici translace. Tento fakt se obchází přímým vnášením krátkých siRNA do buněk. Aplikace siRNA však naráží na jiné problémy, jako je málo účinný přechod přes buněčnou membránu kvůli polyaniontové povaze nebo rychlá degradace v krvi a tkáních. Pro zvýšení stability jsou siRNA molekuly chemicky modifikovány např. 2′-O-methylem či cholesterolem. Strategie přenosu siRNA do buněk lze rozdělit na metody fyzikální (např. elektroporace – tvorba pórů v buněčné membráně pomocí elektrického pulzu), chemické (zvýšení propustnosti membrány chemickými činidly nebo navození fúze s membránou pomocí např. polyethylenglykolu či liposomů) a biologické (používají se retrovirové či adenovirové partikule, které si zachovávají schopnost průniku do buňky). Mezi nejvíce zavedené postupy v genové terapii patří použití lipidových a polymerních přenašečů. Pozornost farmaceutických firem ovšem přitahují i nové materiály s unikátními vlastnostmi, jako jsou zlaté nanočástice a uhlíkové nanotrubičky (27).
V klinické praxi byly testovány siRNA nebo jejich prekurzory (tzv. short hairpin RNA, shRNA) pro léčbu hepatocelulárního karcinomu (28), hypercholesterolemie pomocí siRNA označované jako TKM-ApoB (PRO-040201) a snižující expresi ApoB (Tekmira Pharmaceuticals Corporation), rakoviny jater pomocí siRNA označované ALN-VSP02 (Alnylam Pharmaceuticals), pokročilých solidních nádorů pomocí siRNA Atu027 namířené proti proteinové kináze N3 (Silence Therapeutics), astmatu pomocí siRNA pod názvem Excellair, jejíž cílovou molekulou je Syk mRNA (ZaBeCor Pharmaceuticals), a mnoha dalších onemocnění (29).
RNA interagující s PIWI proteiny
Poslední identifikovanou skupinou malých regulačních ncRNA byly RNA interagující s PIWI (P-element induced wimpy testis) proteiny (piRNA) o délce 24−30 nt, které se nacházejí především v zárodečných buňkách živočichů. Prvně byly tyto ncRNA nalezeny u drosofily při studiu malých RNA v různých vývojových stadiích (30) a většina z nich byla mapována do repetitivních oblastí genomu nebo do transpozonů, proto byly původně pojmenovány jako repeat-associated small interfering RNA (rasiRNA). Později byly rasiRNA detekovány v gonádách mnoha dalších živočichů a ukázalo se, že se váží na PIWI proteiny (podrodina argonautových proteinů), a proto byly přejmenovány na piRNA.
Na rozdíl od miRNA a siRNA vznikají piRNA přímo z dlouhého jednořetězcového RNA prekurzoru (jehož sekvence odpovídá transpozonu) bez působení nukleázy Dicer. Biogeneze piRNA je nejvíce prostudovaná u drosofily (primární biosyntetická cesta probíhající především v somatických folikulárních buňkách a tzv. ping-pongová replikační cesta fungující výhradně v zárodečných liniích), avšak přesný mechanismus a do něho zapojené faktory jsou stále předmětem výzkumu (31).
Hlavní funkcí piRNA je ochrana genomu pohlavních buněk před šířením transpozonových RNA, které může vést k nestabilitě genomu a následné neplodnosti. piRNA v komplexu s PIWI proteiny rozpoznávají molekuly RNA odvozené od transpozonů a degradují je. Další regulační funkce piRNA objevená u savců spočívá v epigenetické modifikaci (methylaci) DNA transpozonů, která vede k potlačení jejich transkripce (32). Důležitost působení piRNA/PIWI potvrdily mutační analýzy, při kterých ztráta funkce piRNA či PIWI proteinů (nebo jejich analogů) vedla k těžkým defektům gametogeneze nebo úplné sterilitě v důsledku expanze transpozonů (33).
DLOUHÉ NEKÓDUJÍCÍ RNA
Většina protein nekódujících transkriptů patří do skupiny dlouhých ncRNA (lncRNA) o délce > 200 nt (mohou dosahovat délky až 100 kb). Pro většinu lncRNA je charakteristická lokalizace v jádře, nízká exprese, nízká evoluční konzervovanost, žádné nebo krátké čtecí rámce, často mají modifikovaný 3´ konec polyA sekvencí a 5´ konec čepičkou (viz tab. 1). Doposud byla charakterizovaná jen malá část lncRNA, ale jako jejich hlavní funkce se jeví regulace genové exprese na úrovni transkripce a posttranskripčních úprav. Vedle transkripce se lncRNA se podílí na regulaci biologických procesů, jako je imprinting, kompenzace dávky genů, alternativní sestřih, buněčný cyklus a diferenciace buněk (34).
LncRNA mohou být klasifikovány podle své lokalizace vzhledem k protein kódujícím genům na sense a antisense (transkribované ze sense nebo antisense vlákna protein kódujícího genu, často obsahují exony z tohoto genu, které se sekvenčně překrývají), obousměrné (transkripce lncRNA a sousedního protein kódujícího genu na protilehlém řetězci probíhá současně), intronové (kódované v rámci intronů protein kódujících genů) a mezigenové (kódované v oblastech mezi protein kódujícími geny) (35). Mezi další skupiny definované jinými autory patří například lncRNA asociované s telomerami, tzv. TERRA (telomeric repeat-containing RNA, transkribované z oblastí bohatých na konstitutivní heterochromatin), nebo s vysoce konzervovanými oblastmi genomu, tzv. T-UCR (transcribed ultraconserved regions, přepisované z UCR oblastí mezi geny i uvnitř genů), pseudogenové RNA (nefunkční kopie genů) (36). Podrobné informace o sekvenci lncRNA, expresi, funkci či roli v patogenezi lze nalézt v různých databázích, jako je NONCODE (www.noncode.org), lncRNAdb (www.lncrnadb.org), lncRNADisease (http://210.73.221.6/lncrnadisease).
Biogeneze lncRNA se intenzivně studuje. Většina lncRNA je transkribována jako komplexní síť překrývajících se sense a antisense transkriptů (37) a studie prokázaly zapojení RNA polymerázy II či III. Některé z primárních transkriptů podléhají sestřihu a jiné zase nikoliv. Řada lncRNA má modifikované konce 3’ polyA sekvencí a 5’ čepičkou. Navíc některé z lncRNA také mohou sloužit jako primární transkripty pro tvorbu krátkých RNA, což komplikuje kategorizaci těchto transkriptů. Na rozdíl od malých ncRNA neregulují lncRNA genovou expresi prostřednictvím jednotného společného mechanismu, ale ovlivňují ji různými způsoby, jako je inhibice RNA polymerázy II, remodelace chromatinu, blokace sestřihových míst u cílové mRNA, inaktivace miRNA, epigenetická modifikace genů atd. (viz obr. 1) (36).
Obr. 1. Příklady mechanismů působení lncRNA (upraveno podle: 36) 1. Aktivace či inhibice transkripce vazbou lncRNA na RNA polymerázu II nebo transkripční faktory; 2. indukce remodelace chromatinu; 3. regulace alternativního sestřihu vazbou lncRNA na místa pre-mRNA rozpoznávaná spliceosomem; 4. z dvouřetězcových transkriptů mohou vznikat endogenní siRNA; 5. regulace aktivity proteinu navázáním lncRNA; 6. změna lokalizace proteinu; 7. komplex lncRNA s proteinem může sloužit jako strukturní složka ribonukleoproteinových komplexů; 8. regulace translace prostřednictvím stabilizace/destabilizace mRNA; 9. vazba lncRNA na miRNA a jejich titrace z cílových mRNA (tzv. mechanismus sponge); 10. transkript lncRNA může sloužit jako prekurzor pro malé RNA. 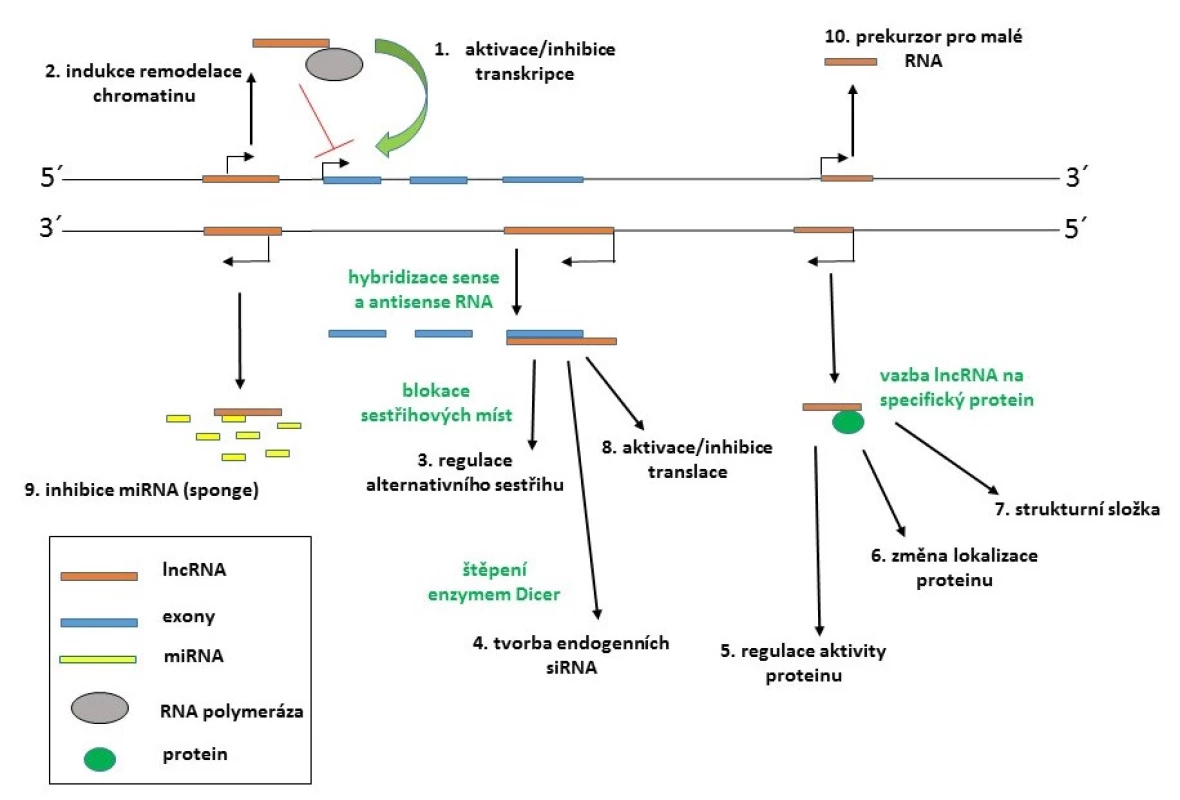
Mnohé lncRNA fungují jako „průvodci“ pro enzymatické komplexy zajišťující epigenetickou modifikaci cílových genů. Mezi nejlépe popsané lncRNA patří Xist (X-inactive specific transcript), jež je nezbytná pro inaktivaci chromosomu X. Tento transkript patří do skupiny dlouhých mezigenových ncRNA, tzv. lincRNA (long intergenic non-coding RNA), které se vyznačují typickou methylací specifických oblastí a vysokou mezidruhovou konzervovaností (na rozdíl od ostatních lncRNA). lincRNA zajišťují navázaní chromatin modifikujících komplexů na specifické lokusy genomu a ovlivňují tak epigenetický status genů. Xist RNA funguje jako doprovodný faktor pro navázání epigenetického komplexu Polycomb 2 (PRC2) a jeho zacílení do Xic oblasti na chromosomu X, což je centrum inaktivace řídící celý proces. Xist je zpětnovazebně regulována dalšími lncRNA, a to jak negativně (např. antisense Tsix), tak i pozitivně (např. Jpx) (34). Mezi dobře charakterizované lincRNA patří také HOTAIR (HOX antisense intergenic RNA) lokalizovaná mezi geny klastru HOXC na chromosomu 2, které hrají důležitou roli v embryonálním vývoji. Tato RNA interaguje s komplexem PRC2 a směřuje ho do cílových lokusů genů HOXD, kde ovlivňuje formaci heterochromatinu (38).
Zapojení lcnRNA do genomového imprintingu lze demonstrovat na lincRNA H19 (H19, imprinted maternally expressed transcript), která je vysoce exprimována z maternální alely v průběhu embryogeneze, ale po narození je její exprese utlumena (s výjimkou srdce a hematopoetických buněk). Proces imprintingu je založen na methylaci DNA a H19 vazbou na specifickou hydrolázu blokuje její funkci, což ve výsledku ovlivňuje methyltransferázy zodpovědné za methylaci (39). Dále bylo prokázáno, že tato lincRNA může sloužit jako prekurzor pro miR-675, která inhibuje růst placenty (40).
Regulace transkripce prostřednictvím lncRNA je založena na jejich vazbě na transkripční aktivátory a inhibitory, na tvorbě komplexu s transkripčním aparátem nebo lncRNA fungují jako kofaktory transkripčních faktorů a regulují jejich aktivitu. Například lncRNA exprimovaná z promotoru genu DHFR (dihydrofolate reductase) tvoří stabilní hybridní molekulu RNA/DNA a brání tak navázání transkripčního kofaktoru TFIID (41). Několik lncRNA je zapojeno i do regulace buněčného cyklu a apoptózy. lincRNA-p21 funguje jako represor p53-dependentní transkripční odpovědi. Tato lincRNA se váže na ribonukleoproteinový komplex hnRNP-K a tato vazba je nezbytná pro jeho správné umístění na reprimované geny (42).
Stejně jako u malých ncRNA zasahuje deregulace lncRNA významně do fenotypu a podílí se na patogenezi mnoha onemocnění, zejména těch nádorových (36) (viz tab. 2). Z již uvedených lncRNA lze jmenovat zvýšenou expresi HOTAIR spojenou s tvorbou metastáz u pacientů s rakovinou děložního čípku, osteosarkomem či nádorem plic (43−45). Další lncRNA vykazující deregulaci u širokého spektra nádorů je MALAT1 (metastasis-associated lung adenocarcinoma transcript 1), která je zapojena do alternativního sestřihu, a to regulací hladin aktivních sestřihových faktorů (46). Její zvýšená exprese vede k vyšší proliferaci a migraci buněk například u nádorů plic, tlustého střeva a slinivky břišní (47−49).
Z hlediska diagnostického a léčebného použití patří lncRNA také do nové generace biomarkerů a terapeutických cílů s velkým potenciálem. V diagnostice mají lncRNA oproti protein kódujícím genům určité přednosti. I když tyto RNA mohou vyžadovat pro svou funkci posttranskripční modifikace, zralá molekula lncRNA je konečný funkční produkt a měření jeho exprese přímo odpovídá hladině účinné molekuly. Na rozdíl od toho hladiny mRNA nepřímo vypovídají o úrovni jejich funkčního produktu (neboli proteinu), a proto úroveň exprese lncRNA vykazuje vyšší korelace s jednotlivými stadii nádorových onemocnění. LncRNA také většinou mají vyšší buněčnou specificitu než protein kódující geny a umožňují tak odhad buněčného složení nádoru či vymezení specifické populace buněk (např. nádorových kmenových buněk) (50). Navíc ncRNA jsou stabilní v tělních tekutinách a umožňují tak neinvazivní postupy. Například lncRNA PCA3 (prostate cancer antigen 3) je vysoce asociována s nádorem prostaty a je rutině používána pro stanovení rizika tohoto onemocnění ze vzorků moči bez nutnosti biopsie (51). Jako prognostický biomarker je dále používána MALAT1 pro nádory zmíněné v předešlém odstavci, přičemž její vyšší hladina poukazuje na pokročilé stadium onemocnění a riziko metastáz (52).
Vzhledem k vysoké buněčné/tkáňové specificitě lncRNA asociovaných s nádory představují tyto RNA vhodné cíle terapeutických postupů. Například do nádorů se zvýšenou expresí H19 byl úspěšně injikován plazmid obsahující difterický toxin pod kontrolou H19 promotoru. Tato strategie byla úspěšně použita u pacientů s nádorem vaječníků, močového měchýře, slinivky břišní a vedla k redukci velikosti nádorů (53). Obdobná strategie byla použita pro snížení hladin MALAT1 u nádorových buněk děložního čípku prostřednictvím expresního plazmidu nesoucího siRNA proti této lncRNA (54).
ZÁVĚR
Několik desítek let byl pojem „gen“ synonymem pro část genomu, která obsahovala informaci pro syntézu proteinu. Zbývající část genomu byla označovaná jako tzv. junk DNA a byla považována za nepotřebnou. Avšak objev regulačních RNA a následná identifikace dalších typů protein nekódujících transkriptů ukázaly, že i tato část genomu byla evolučně uchována z důvodu funkčnosti a nikoliv jako pasivní genetické pozadí.
Řada studií již potvrdila, že ncRNA jsou plnohodnotnými regulátory genové exprese a představují důležitý mezičlánek mezi ostatními regulačními elementy. Intenzivní průzkum transkriptomu stále odhaluje nové funkce ncRNA včetně jejich podílu na vzniku mnoha onemocnění. Již v současné době jsou některé ncRNA využívány v diagnostice a pro cílenou terapii a bude jich určitě přibývat s rostoucími poznatky o jejich působení. NcRNA jsou důkazem toho, že i přes dostupnost moderních technologií naše znalosti o lidském genomu nejsou úplné a stále můžeme objevovat věci nepoznané.
Autoři děkují Ing. Michaele Dostálové Merkerové, Ph.D., za kritické připomínky k rukopisu.
Práce byla podpořena granty Agentury pro zdravotnický výzkum České republiky 16-33485A a 16-33617A.
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam použitých zkratek
DNA deoxyribonukleová kyselina
lncRNA dlouhá nekódující RNA
lincRNA dlouhá mezigenová nekódující RNA
mRNA mediátorová RNA
miRNA mikroRNA
ncRNA nekódující RNA
nt nukleotid
piRNA RNA interagující s PIWI proteiny
RNA ribonukleová kyselina
sncRNA malá nekódující RNA
siRNA malá interferující RNA
UTR untranslated region
Adresa pro korespondenci:
RNDr. Hana Votavová, Ph.D.
Oddělení genomiky
Ústav hematologie a krevní transfuze
U nemocnice 1
128 20 Praha 2
Tel.: 221 977 306
e-mail: hana.votavova@uhkt.cz
Zdroje
1. Carthew RW, Sontheimer EJ. Origins and mechanisms of miRNAs and siRNAs. Cell 2009; 136 : 642–655.
2. Chang TC, Yu D, Lee YS et al. Widespread microRNA repression by Myc contributes to tumorigenesis. Nat Genet 2008; 40 : 43–50.
3. Cao Q, Li YY, He WF et al. Interplay between microRNAs and the STAT3 signaling pathway in human cancers. Physiol Genomics 2013; 45 : 1206–1214.
4. Viswanathan SR, Daley GQ, Gregory RI. Selective blockade of microRNA processing by Lin28. Science 2008; 320 : 97–100.
5. Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, pimonitoring and therapeutics. A comprehensive review. EMBO Mol Med 2012; 4 : 143–159.
6. Calin GA, Dumitru CD, Shimizu M et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci U S A. 2002;99 : 15524-15529.
7. Calin GA, Sevignani C, Dumitru CD et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci U S A 2004; 101 : 2999–3004.
8. Slabý O, Svoboda M a kol. MikroRNA v onkologii. Galén, Praha, 2012.
9. Roth W, Hecker D, Fava E. Systems biology approaches to the study of biological networks underlying Alzheimer's disease: role of miRNAs. Methods Mol Biol 2016; 1303 : 349–377.
10. Saghazadeh A, Rezaei N. MicroRNA machinery in Parkinson's disease: a platform for neurodegenerative diseases. Expert Rev Neurother 2015 : 1–27 [Epub ahead of print].
11. Yu AD, Wang Z, Morris KV. Long noncoding RNAs: A potent source of regulation in immunity and disease. Immunol Cell Biol 2015; 93 : 277–283.
12. Beneš V, Castoldi M. Expression profiling of microRNA using real-time quantitative PCR, how to use it and what is available. Methods 2010; 50 : 244–249.
13. Yin JQ, Zhao RC, Morris KV. Profiling microRNA expression with microarrays. Trends Biotechnol 2008; 26 : 70–76.
14. Lu J, Getz G, Miska EA et al. MicroRNA expression profiles classify human cancers. Nature 2005; 435 : 834–838.
15. Farazi TA, Horlings HM, Ten Hoeve JJ et al. MicroRNA sequence and expression analysis in breast tumors by deep sequencing. Cancer Res 2011; 71 : 4443–4453.
16. Volinia S, Calin GA, Liu CG et al. A microRNA expression signature of human solid tumors defines cancer gene targets. Proc Natl Acad Sci U S A 2006; 103 : 2257–2261.
17. Osaki M, Takeshita F, Ochiya T. MicroRNAs as biomarkers and therapeutic drugs in human cancer. Biomarkers 2008; 13 : 658–670.
18. Hruštincová A, Votavová H, Dostálová Merkerová M. Circulating microRNAs: methodological aspects in detection of these biomarkers. Folia Biol (Praha) 2015; 61 : 203–218.
19. Mitchell PS, Parkin RK, Kroh EM et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci U S A 2008; 105 : 10513–10518.
20. Schetter AJ, Leung SY, Sohn JJ et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma. JAMA 2008; 299 : 425–436.
21. Hiyoshi Y, Schetter AJ, Okayama H et al. Increased microRNA-34b and -34c predominantly expressed in stromal tissues is associated with poor prognosis in human colon cancer. PLoS One 2015; 10: e0124899.
22. van der Ree MH, van der Meer AJ, van Nuenen AC et al. Miravirsen dosing in chronic hepatitis C patients results in decreased microRNA-122 levels without affecting other microRNAs in plasma. Aliment Pharmacol Ther 2016; 43 : 102–113.
23. Fire A, Xu S, Montgomery MK et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998; 391 : 806–811.
24. Yang N, Kazazian HH jr. L1 retrotransposition is suppressed by endogenously encoded small interfering RNAs in human cultured cells. Nat Struct Mol Biol 2006; 13 : 763–771.
25. Watanabe T, Totoki Y, Toyoda A et al. Endogenous siRNAs from naturally formed dsRNAs regulate transcripts in mouse oocytes. Nature 2008; 453 : 539–543.
26. Marques JT, Wang JP, Wang X et al. Functional specialization of the small interfering RNA pathway in response to virus infection PLoS Pathog 2013; 9: e1003579.
27. Higuchi Y, Kawakami S, Hashida M. Strategies for in vivo delivery of siRNAs: recent progress. BioDrugs 2010; 24 : 195–205.
28. Varshosaz J, Farzan M. Nanoparticles for targeted delivery of therapeutics and small interfering RNAs in hepatocellular carcinoma. World J Gastroenterol 2015; 21 : 12022–12041.
29. Burnett JC, Rossi JJ, Tiemann K. Current progress of siRNA/shRNA therapeutics in clinical trials. Biotechnol J 2011; 6 : 1130–1146.
30. Aravin AA, Lagos-Quintana M, Yalcin A et al. The small RNA profile during Drosophila melanogaster development. Dev Cell 2003; 5 : 337–350.
31. Iwasaki YW, Siomi MC, Siomi H. PIWI-interacting RNA: its biogenesis and functions. Annu Rev Biochem 2015; 84 : 405–433.
32. Di Giacomo M, Comazzetto S, Saini H et al. Multiple epigenetic mechanisms and the piRNA pathway enforce LINE1 silencing during adult spermatogenesis. Mol Cell 2013; 50 : 601–608.
33. Juliano C, Wang J, Lin H. Uniting germline and stem cells: the function of PIWI proteins and the piRNA pathway in diverse organisms. Annu Rev Genet 2011; 45 : 447–469.
34. Lee JT, Bartolomei MS. X-inactivation, imprinting, and long noncoding RNAs in health and disease. Cell 2013; 152 : 1308–1323.
35. Ponting CP, Oliver PL, Reik W. Evolution and functions of long noncoding RNAs. Cell 2009; 136 : 629–641.
36. Šána J, Faltejsková P, Svoboda M, Slabý O. Novel classes of non-coding RNAs and cancer. J Transl Med 2012; 10 : 103.
37. Zhang Y, Liu XS, Liu QR, Wei L. Genome-wide in silico identification and analysis of cis natural antisense transcripts (cis-NATs) in ten species. Nucleic Acids Res 2006; 34 : 3465–3475.
38. Tsai MC, Manor O, Wan Y et al. Long noncoding RNA as modular scaffold of histone modification complexes. Science 2010; 329 : 689–693.
39. Zhou J, Yang L, Zhong T et al. H19 lncRNA alters DNA methylation genome wide by regulating S-adenosylhomocysteine hydrolase. Nat Commun 2015; 6 : 10221.
40. Keniry A, Oxley D, Monnier P et al. The H19 lincRNA is a developmental reservoir of miR-675 that suppresses growth and Igf1r. Nat Cell Biol 2012; 14 : 659–665.
41. Martianov I, Ramadass A, Serra Barros A et al. Repression of the human dihydrofolate reductase gene by a non-coding interfering transcript. Nature 2007; 445 : 666–670.
42. Huarte M, Guttman M, Feldser D et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response. Cell 2010; 142 : 409–419.
43. Huang L, Liao LM, Liu AW et al. Overexpression of long noncoding RNA HOTAIR predicts a poor prognosis in patients with cervical cancer. Arch Gynecol Obstet 2014; 290 : 717–723.
44. Wang B, Su Y, Yang Q et al. Overexpression of long non-coding RNA HOTAIR promotes tumor growth and metastasis in human osteosarcoma. Mol Cells 2015; 38 : 432–440.
45. Loewen G, Jayawickramarajah J, Zhuo Y, Shan B. Functions of lncRNA HOTAIR in lung cancer. J Hematol Oncol 2014; 7 : 90.
46. Tripathi V, Ellis JD, Shen Z et al. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation. Mol Cell 2010; 39 : 925–938.
47. Guo F, Yu F, Wang J et al. Expression of MALAT1 in the peripheral whole blood of patients with lung cancer. Biomed Rep 2015; 3 : 309–312.
48. Xu C, Yang M, Tian J, Wang X, Li Z. MALAT-1: a long non-coding RNA and its important 3′ end functional motif in colorectal cancer metastasis. Int J Oncol 2011; 39 : 169–175.
49. Pang EJ, Yang R, Fu XB, Liu YF. Overexpression of long non-coding RNA MALAT1 is correlated with clinical progression and unfavorable prognosis in pancreatic cancer. Tumour Biol 2015; 36 : 2403–2407.
50. Cabili MN, Trapnell C, Goff L et al. Integrative annotation of human large intergenic noncoding RNAs reveals global properties and specific subclasses. Genes Dev 2011; 25 : 1915–1927.
51. de la Taille A. Progensa PCA3 test for prostate cancer detection. Expert Rev Mol Diagn 2007; 7 : 491–497.
52. Wu Y, Lu W, Xu J et al. Prognostic value of long non-coding RNA MALAT1 in cancer patients. Tumour Biol 2016; 37(1) :897–903.
53. Smaldone MC, Davies BJ. BC-819, a plasmid comprising the H19 gene regulatory sequences and diphtheria toxin A, for the potential targeted therapy of cancers. Curr Opin Mol Ther 2010; 12(5): 607–616.
54. Guo F, Li Y, Liu Y et al. Inhibition of metastasis-associated lung adenocarcinoma transcript 1 in CaSki human cervical cancer cells suppresses cell proliferation and invasion. Acta Biochim Biophys Sin (Shanghai) 2010; 42 : 224–229.
55. Ruepp A, Kowarsch A, Schmidl D et al. PhenomiR: a knowledgebase for microRNA expression in diseases and biological processes. Genome Biology 2010, 11: R6.
56. Chen G, Wang Z, Wang D et al. LncRNADisease: a database for long-non-coding RNA-associated diseases. Nucleic Acids Research 2013; 41(Database issue): D983–D986.
57. Han Li C, Chen Y. Small and long non-coding RNAs: novel targets in perspective cancer therapy. Curr Genomics 2015; 16 : 319–326.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Přednáškové večery Spolku českých lékařů v Praze (leden 2017)
- Editorial
- Osteoporóza u mužů
- Transplantace Langerhansových ostrůvků v léčbě syndromu porušeného vnímání hypoglykemie. Vyhodnocení pilotního programu a porovnání s transplantací pankreatu
- Sekulární trend v tělesné výšce a hmotnosti dospělé populace v České republice
- Klinické hodnocení poruch acidobázické rovnováhy: Hendersonův-Hasselbalchův, nebo Stewartův-Fenclův přístup?
- Nekódující RNA – od nepotřebných po nepostradatelné
- Správný postup při indikaci a provádění pitev v České republice
- Nástrahy diagnostického procesu aneb „zamyšlení nad myšlením lékařů“
- Druhá transatlantická konference o personalizované medicíně
- David Hunter Hubel (1926–2013)
- Jubilanti
- O psychologických souvislostech porodních bolestí
- Antidiabetika – historie, současnost a perspektivy
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sekulární trend v tělesné výšce a hmotnosti dospělé populace v České republice
- Správný postup při indikaci a provádění pitev v České republice
- Klinické hodnocení poruch acidobázické rovnováhy: Hendersonův-Hasselbalchův, nebo Stewartův-Fenclův přístup?
- Nástrahy diagnostického procesu aneb „zamyšlení nad myšlením lékařů“
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



