-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vyšetření mutačního statutu genu KRAS jako součást algoritmu léčby metastatického kolorektálního karcinomu
KRAS mutation testing in therapeutic algorithm for treatment of metastatic colorectal carcinoma
Targeted therapy has become an integral part of treatment procedures of malignant tumors. Colorectal carcinomas are frequently targeted with monoclonal anti-EGFR antibodies (cetuximab and panitumumab). Activating somatic mutations in codons 12 and 13 of the exon 2 of KRAS gene are considered negative predictive factors of response to anti-EGFR therapy in patients with metastatic colorectal cancer. In the Czech Republic, evaluation of mutational status of KRAS gene is performed in several referral laboratories. In 2009, these laboratories performed 2580 tests of the KRAS mutational status – out of these, 60.2% cases reported non-mutated, wild-type KRAS. In one of the referral laboratories, we demonstrate the logistics of KRAS testing procedure. Stratification of patients with metastatic colorectal tumors based on their KRAS mutational status has evolved to a standard procedure. Laboratories performing these methods shall therefore adhere to the recommendations of the professional and accredited societies.
Key words:
k-ras, colorectal carcinoma, targeted therapy, anti-EGFR therapy, predictive molecular oncology, standardization of diagnostic procedure.
Autoři: Lenka Dubská 1; Martina Vyskočilová 1; Rudolf Nenutil 1; Dalibor Valík 1; Dana Knoflíčková 1; Pavel Fabian 1; Ilona Kocáková 1; Regina Demlová 1; Martin Beránek 2; Monika Drastíková 2; Hana Vošmiková 2; Arpád Bóday 3; Kateřina Horká 3; Jarmila Šímová 4; Jiří Drábek 5; Jiří Ehrmann ml. 5; Marián Hajdúch 5; Milada Matějčková 6; Radek Šíma 7; Daniel Tvrdík 8; Ctibor Povýšil 8; Aleš Ryška 9
Působiště autorů: Masarykův onkologický ústav, Brno 1; Univerzita Karlova v Praze, Lékařská fakulta Hradec Králové, Ústav klinické biochemie a diagnostiky FN 2; P & R LAB a. s., Nový Jičín 3; CGB laboratoř a. s., Ostrava 4; Univerzila Palackého v Olomouci, Ústav molekulární a translační medicíny LF 5; Fakultní Thomayerova nemocnice s poliklinikou v Praze, Oddělení patologie a molekulární medicíny 6; Bioptická laboratoř s. r. o., Plzeň 7; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav patologie VFN 8; Univerzita Karlova v Praze, Lékařská fakulta Hradec Králové, Fingerlandův ústav patologie FN 9
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 321-326
Kategorie: Přehledový článek
Souhrn
Cílená léčba se stává součástí standardních terapeutických postupů zhoubných nádorů. V případě karcinomu tlustého střeva a konečníku je to nejčastěji terapie pomocí monoklonálních anti-EGFR protilátek (cetuximab a panitumumab). Aktivační somatické mutace v kodonech 12 a 13 exonu 2 genu KRAS jsou negativním prediktivním faktorem léčebné odpovědi na anti-EGFR terapii u pacientů s metastatickým kolorektálním karcinomem. V České republice se provádí vyšetření genu KRAS v několika referenčních laboratořích. V roce 2009 bylo v těchto laboratořích provedeno 2580 vyšetření mutačního statutu genu KRAS, z nichž bylo 60,2 % případů nemutovaných, tedy wild-type KRAS. Na příkladu jedné laboratoře je demonstrována logistika vyšetřování mutačního statutu genu KRAS. Stratifikace pacientů s metastatickým kolorektálním karcinomem zvažovaných pro cílenou anti-EGFR terapii na základě přítomnosti mutací v kodonech 12 a 13 genu KRAS je dnes standardním postupem. Laboratoř provádějící toto vyšetření by měla postupovat v souladu s doporučeními odborných společností.
Klíčová slova:
k-ras, kolorektální karcinom, cílená léčba, anti-EGFR terapie, prediktivní molekulární onkologie, standardizace diagnostických procesů.ÚVOD
Zhoubné onemocnění tlustého střeva (dg. C18), rektosigmoideálního spojení (C19) a konečníku (C20) je jednou z nejčastějších malignit v České republice. Nejčastější léčebnou modalitou u kolorektálního karcinomu je kurativní resekce nádoru. Pacientům s karcinomem tlustého střeva klinického stadia II „high risk“ podskupiny a stadia III je indikována po odstranění nádoru adjuvantní chemoterapie. U karcinomu rekta stadia II a III je u lokálně pokročilého onemocnění indikována neoadjuvantní chemoradioterapie a chemoterapie či konkomitantní chemoradioterapie v adjuvanci. Pro terapii metastatického onemocnění stadia IV a lokálně pokročilého inoperabilního onemocnění se využívá kombinace chemoterapie s cílenou léčbou (případně cílená léčba v monoterapii), a to především monoklonálními protilátkami proti VEGF (bevacizumab) a anti-EGFR mAb (cetuximab, panitumumab).
Zhoubné nádory tlustého střeva a konečníku mají v některých případech hereditární či familiární výskyt (1), nicméně velká většina kolorektálních nádorů je sporadické etiologie vznikající z adenomatózních polypů. V genetickém modelu kumulace alterací vedoucích ke vzniku maligní buňky z epitelu kolorekta se popisuje především mutace nádorových supresorů APC (adenomatous polyposis coli) a p53 a onkogenu KRAS (2). Gen KRAS (Ki-ras2 – Kirsten rat sarcoma virus oncogene homolog) je onkogen, který kóduje malý protein s GTPázovou aktivitou podílející se na intracelulární signalizaci. Proteinový produkt tohoto genu se účastní regulace buněčného dělení přenosem signálu z vnějšku buňky do buněčného jádra; jeho aktivní forma s navázaným GTP má centrální úlohu v transdukci mitogenních signálů.
GEN KRAS
Gen KRAS (OMIM 190070) patří spolu se strukturně a funkčně homologními geny HRAS a NRAS do skupiny onkogenů RAS (3). Gen KRAS leží na chromozomu 12 v oblasti 12p12.1 a kóduje dvě izoformy A a B (obr. 1), z nichž výrazněji převažuje sestřihová varianta KRASB (4).
Obr. 1. Onkogenní mutace genu KRAS. Gen se skládá z 6 exonů označovaných v literatuře 1, 2, 3, 4, 5, 6 (4), případně -1, 1, 2, 3, 4A a 4B (25). V současné terminologii používané v souvislosti s testováním onkogenních mutací u pacientů s kolorektálním karcinomem převažuje označení 1–6. Exon 1 není překládán (prázdný box), šedě označené exony 5 a 6 podléhají alternativnímu sestřihu se značnou převahou izoformy KRASB (KRAS4B) s translací exonu 6 bez exonu 5. Exony 2–4 jsou invariantní kódující exony. Boxy s písmeny znázorňují funkční oblasti proteinu v kontextu jejich uspořádání v genu: (a) místo vazby GTP, (b) místo vazby efektorů, (c) switch I: interakce efektorů a GAP, (d) switch II: interakce s GEF. Černé body představují kodony, u jejichž mutací byl popsán onkogenní potenciál; u kodonů 12 a 13 jsou mimo aminokyseliny kódované nemutovaným tripletem uvedeny také aminokyseliny zařazované následkem mutace. 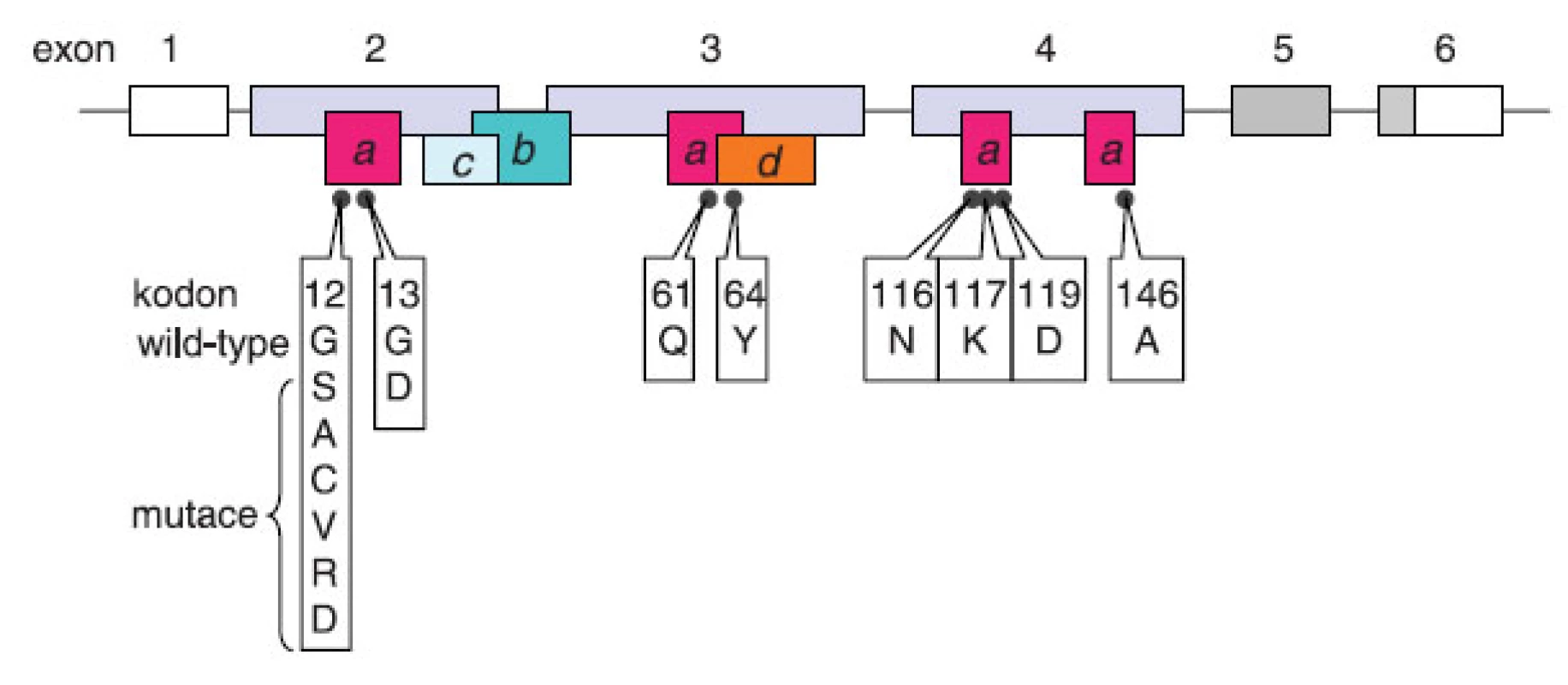
Vazba GTP na k-ras a tedy jeho aktivita je regulována pomocí RasGAP (GAP – GTPase activating protein), které urychlují hydrolýzu GTP na GDP, a tedy přechod proteinu ras do inaktivní formy (5). Do aktivní formy se protein ras dostává působením proteinů RasGEF (GEF – guanine nucleotide exchange factor), které navozují disociaci GDP, které je nahrazeno GTP, a protein tak přechází do aktivního stavu (6). Aktivační mutace genu KRAS znemožňují hydrolýzu GTP na GDP, a tím přechod aktivní formy proteinu ras na neaktivní. Onkogenní mutace genu KRAS se zpravidla vyskytují v oblastech ovlivňujících hydrolýzu GTP, např. mutace v kodonu 12 vedoucí k záměně glycinu za aminokyselinu s postranním řetězcem má za následek sterickou interferenci s hydrolýzou GTP navozenou GAP (7); glutamin v pozici 61 umožňuje vazbu s GAP p120 a následnou hydrolýzu GTP (7–9). Díky onkogenním somatickým mutacím získává buňka konstitutivně aktivní protein k-ras bez ohledu na aktivační nebo deaktivační signály přicházející z membránových receptorů, které jsou v aktivační kaskádě hierarchicky postaveny nad proteinem k-ras. Typickým příkladem receptoru aktivujícího protein k-ras je receptor pro epidermální růstový faktor EGFR. K aktivaci (fosforylaci) intracelulární tyrozinkinázové domény EGFR dochází na základě navázání ligandu na receptor a RasGEF pak zprostředkují aktivaci proteinu k-ras (10).
Terapeutická inhibice receptoru EGFR se v posledních letech využívá v léčbě celé řady epiteliálních nádorových onemocnění. Klinicky nejčastěji používané inhibitory jsou monoklonální protilátky (anti-EGFR mAb, cetuximab a panitumumab) nebo nízkomolekulární inhibitory tyrozinkinázové domény EGFR (TKI – erlotinib, gefitinib a lapatinib). Míra imunohistochemicky stanovené exprese EGFR u kolorektálního karcinomu se neukázala být prediktorem léčebné odpovědi na anti-EGFR mAb (11–13).
Testování genu KRAS má zásadní klinický význam u pacientů s metastatickým kolorektálním karcinomem. Dvě velké klinické studie CRYSTAL a OPUS hodnotily benefit z přidání cetuximabu k režimu FOLFIRI (leukovorin, 5-fluorouracil, irinotecan), respektive FOLFOX (leukovorin, 5-fluorouracil, oxaliplatina), v první linii u pacientů s metastatickým kolorektálním karcinomem (mCRC). Z metaanalýzy těchto studií vyplynulo, že mutační status genu KRAS může být prediktorem odpovědi na léčbu anti-EGFR protilátkami (14, 15). Analýzou těchto klinických hodnocení a dalších retrospektivních studií bylo prokázáno, že aktivační somatické mutace v kodonech 12 a 13 exonu 2 genu KRAS jsou negativním prediktivním faktorem léčebné odpovědi na cetuximab u pacientů s mCRC (16–20). Z těchto studií také vycházejí doporučení ASCO (American Society of Clinical Oncology; www.asco.org), NCCN (National Comprehensive Cancer Network; www.nccn.org) a CAP (College of American Pathologists; www.cap.org) týkající se testování mutací genu KRAS u pacientů s mCRC zvažovaných k terapii anti-EGFR mAb. Tyto organizace doporučují testování genu KRAS u všech kandidátů pro léčbu anti-EGFR terapií a konkrétně v USA výhradně v laboratořích postupujících podle CLIA (Clinical Laboratory Improvement Amendments, www.cms. gov/clia, zákonný předpis stanovující normy na zajištění kvality v klinických laboratořích v USA). V případě záchytu mutace v kodonech 12 a 13 by pacient s mCRC neměl dostat terapii anti-EGFR mAb jako součást standardní léčby (21). Testování právě těchto substitucí vyplývá především z faktu, že mutace v kodonech 12 a 13 představují 90 % alterací v genu KRAS zachycených u kolorektálního karcinomu (22). V souvislosti s dalšími onkogenními mutacemi genu KRAS (viz obr. 1) někteří autoři navrhují testování genu KRAS rozšířit o testování kodonů 61 a 146 (23, 24), což bude předmětem retrospektivních studií hodnotících prediktivní hodnotu těchto mutací (24, 25). Z dalších studií vyplývá prediktivní hodnota mutace genu BRAF u mCRC v souvislosti s anti-EGFR terapií. Cytoplazmatická serin/threonin kináza B-raf je součástí intracelulární signalizace (RAS-RAF--MEK-ERK-MAPK) (28). Nejčastější mutací (90 %) v tomto genu je transverze T na A vedoucí k zařazení glutamové kyseliny místo valinu (V600E) a mnohonásobně vyšší kinázové aktivitě proteinu B-raf a indukci buněčné proliferace a transformace (27, 28). Mutace BRAF V600E se zpravidla vzájemně vylučuje s mutací v genu KRAS a testování této mutace může dále stratifikovat skupinu pacientů wild-type KRAS mCRC z hlediska pravděpodobné odpovědi na anti‑EGFR mAb (29).
TESTOVÁNÍ
Pro testování genu KRAS je vyšetřovaným materiálem nádorová tkáň pocházející zpravidla z resekátu v rámci kurativního odstranění primárního tumoru. Standardním zpracováním takovéto tkáně pro diagnostické účely je fixace ve formaldehydu a zalití do parafínového bločku (FFPE – formalin-fixed parafin-embedded). Správné zpracování nádorového materiálu je zásadní pro získání kvalitní DNA pro detekci mutací. Kvalita DNA izolované z fixovaného materiálu je závislá na celé řadě faktorů, především na typu fixativa, jeho pH a délce fixace. Formaldehyd, účinná složka formalínu, reaguje s nukleovými kyselinami a proteiny a vede k tvorbě křížových kovalentních vazeb (cross-link) uvnitř DNA mezi sousedními bázemi a mezi DNA a ostatními molekulami. Současnými metodami nejsou crosslinky DNA-DNA zcela efektivně odstranitelné. Crosslinky nezpůsobují problém při izolaci DNA, ale blokují amplifikaci DNA pomocí PCR. Sterická inhibice DNA polymerázy může v průběhu PCR výrazně ovlivnit účinnost amplifikace DNA získané z tkáně fixované formaldehydem. Důsledkem podmínek procesu fixace, např. extrémně nízké pH, dochází k fragmentaci nukleových kyselin. Prodlužování fixační doby tak může vést k výraznému snižování kvality DNA spojené zejména se zmenšením velikosti amplifikovatelných fragmentů (30). Doporučuje se proto provést krátkodobou fixaci v neutrálním formaldehydu nebo přípravku RNAlater.
DETEKCE
Pro detekci mutací genu KRAS je využívána celá řada molekulárních metod, např. metody založené na přímém sekvenování (Sangerovo sekvenování a pyrosekvenování), na polymorfismu délky restrikčních fragmentů (RFLP – restriction fragment length polymorphism), na alelově specifických sondách (ASO – allele-specific oligonucleotide), na analýze teplot křivek tání s vysokým rozlišením (HRMA – high-resolution melting analysis), na modifikaci alelově specifické PCR (ARMS – amplification refractory mutation system) a na denaturační vysokoúčinné kapalinové chromatografii (DHPLC – denaturing high performance liquid chromatography). Výhodou přímého sekvenování je záchyt všech mutací v sekvenovaném úseku DNA. Hlavní nevýhodou sekvenování je nízká citlivost záchytu mutací na pozadí nemutovaného genu z nádorových i nenádorových buněk. U Sangerova sekvenování se uvádí možnost detekce mutace, pokud je zastoupena minimálně v 10–30 %. Pyrosekvenování poskytuje vyšší citlivost záchytu mutace (5–10 % mutovaného genu KRAS na pozadí nemutovaného genu), v současnosti se ale nejedná o laboratorní technologii běžně rozšířenou a dostupnou k rutinnímu testování mutací. Výhodou real time PCR je její snadná proveditelnost, krátké časy odezvy, uzavřený systém snižující pravděpodobnost kontaminace a vysoká senzitivita (1%) záchytu mutací na pozadí nemutovaného genu. Nevýhodami alelově specifického přístupu jsou vyšší cena a vyšetření pouze testem limitovaných mutací (31).
STANDARDIZACE PROCESŮ
Klíčové oblasti standardizace procesů v klinických laboratořích jsou odborná způsobilost pracovníků laboratoře, dokumentovaná a faktická standardizace postupů, kontrola kvality laboratorních výsledků a akreditace laboratoří dle relevantní normy (např. ČSN EN ISO15189, ČSN EN ISO17025). Doporučení pro standardizaci diagnostických postupů, ze kterých mohou laboratoře vyšetřující gen KRAS vycházet, jsou ASCO Provisional Clinical Opinion (21) odkazující na CAP POET (Perspectives on Emerging Technologies) aktualizované na http://www.cap.org/POET, doporučení NCCN týkající se testování genu KRAS (www.nccn.org), a doporučení European Society of Pathology (http://esp-pathology.org, (32)). Z doporučení těchto autorit vyplývá, že:
- Vzorky nádorové tkáně všech pacientů s metastatickým kolorektálním karcinomem, u nichž je zvažována terapie anti-EGFR protilátkami, by měly být testovány na přítomnost mutace v genu KRAS.
- Vyšetřovaným materiálem může být čerstvý, čerstvě zmražený nebo FFPE vzorek primárního tumoru nebo vzdálené metastázy.
- Oblast vzorku, ze které bude provedena izolace DNA, určuje vždy kvalifikovaný patolog, a to tak, aby vyšetřovaným materiálem byly nádorové buňky. Vhodné je rovněž kvantifikovat relativní zastoupení nádorových buněk. Minimální nutné zastoupení maligních buněk ve vyšetřovaném vzorku závisí na použité metodě detekce, v optimálním případě by to mělo být 70 % a více.
- Laboratoř provádějící molekulární vyšetření by měla volit nejlepší dostupnou metodu nebo kombinaci metod s ohledem na správnost, specificitu a senzitivitu stanovení.
- Mutační analýza genu KRAS by měla zahrnovat minimálně sedm nejčastějších mutací v kodonech 12 a 13.
Nejpoužívanějšími testy jsou metody založené na real time PCR nebo přímém sekvenování exonu 2. V Evropě jsou v současnosti komerčně dostupné certifikované kity TheraScreen (DxS): K-RAS Mutation Kit pro použití na LightCycler® 480 Instrument II (Roche) a KRAS LightMix (TIB MolBiol) založené na alelově specifické real time PCR; PyroMark KRAS Kit (Qiagen) na principu pyrosekvenování; StripAssay PGX‑Kras (ViennaLab) založený na hybridizaci PCR produktu na detekčním proužku; a SURVEYOR® Scan K-RAS Mutation Detection Kit CE IVD (Transgenomic) pro detekci mutací pomocí DHPLC.
Pokud laboratoř provádí vyšetření pomocí komerční soupravy bez CE certifikace nebo vlastní vyvinutou tzv. home-brew metodou, měla by mít metodu doložitelně validovanou z hlediska její správnosti a reprodukovatelnosti. Klíčové organizace zabývající se zajištěním kvality v klinických laboratořích začínají poskytovat programy na externí kontrolu kvality analýzy genu KRAS. V programu CAP proficiency testing je k dispozici testování genu KRAS od roku 2010; program pro rok 2010 má dva cykly, vyšetřovaným materiálem jsou tři nebarvené řezy tkáně z parafínového bločku jednoho nádoru, které jsou doplněny o dvě skla s tkání barvenou hematoxylinem, podle níž patolog určí oblast řezu pro izolaci DNA obsahující nádorové buňky. Podle výsledků CAP proficiency testing z roku 2010, kterého se účastnilo 134 laboratoří, většina participantů využívá komerčně dostupnou soupravu (37 %) nebo Sangerovo sekvenování (38 %) a metodou získání nádorových buněk pro analýzu je dominantně makrodisekce (51 %) a manuální mikrodisekce (28 %). Kodon 61 vyšetřuje 19 % účastníků CAP proficiency testing. Ve fázi pilotních programů je od roku 2009 externí hodnocení kvality organizované ESP (European Society of Pathology) KRAS European Quality Assurance Program (http://kras.eqascheme.org/) a UK NEQAS (United Kingdom National External Quality Assessment Service; http://www.ukneqas-molgen.org.uk). Od roku 2010 organizuje externí hodnocení kvality pro mutace v genu KRAS také německý Referenzinstitut für Bioanalytik.
VYŠETŘENÍ GENU KRAS V ČESKÉ REPUBLICE
V České republice se provádí vyšetření genu KRAS v několika laboratořích komplexních onkologických center: Všeobecná fakultní nemocnice a Fakultní Thomayerova nemocnice s poliklinikou v Praze, Fakultní nemocnice v Hradci Králové, Masarykův onkologický ústav v Brně, Fakultní nemocnice v Olomouci a v nestátních akreditovaných laboratořích: Bioptická laboratoř s.r.o. v Plzni, P & R LAB a.s. v Novém Jičíně a CGB laboratoř a.s. v Ostravě. Vyšetřování genu KRAS je v České republice prováděno od poloviny roku 2008 s výraznějším vzestupem počtu testů v říjnu 2008. Celkově bylo za posledních 6 měsíců roku 2008 provedeno v České republice 418 vyšetření genu KRAS. V roce 2009 bylo provedeno v České republice 2580 vyšetření mutačního statutu genu KRAS, tj. průměrně 215 vyšetření za měsíc. Všechny laboratoře vyšetřují aktivační mutace v kodonech 12 a 13 uvedené na obrázku 1. Z celkového počtu vyšetřených vzorků bylo interpretovaných jako wild-type KRAS 60,2 %, a to bez výrazného rozptylu mezi laboratořemi; pracoviště s nejvyšším záchytem wild-type forem KRAS vykazovalo 66,5 % nemutovaných a pracoviště s nejnižším záchytem mutací vykazovalo 55,2 % wild-type (obr. 2). Přítomnost somatických mutací u metastatického kolorektálního karcinomu zachycených v České republice tak odpovídá údajům z klinických hodnocení OPUS a CRYSTAL (14, 15). Celkové pořadí četnosti mutací vyšetřovaných na všech pracovištích je G12D (11,9 % všech výsledků), G12V (8,8 %), G13D (5,8 %), G12C (3,3 %), G12A (2,8 %), G12S (2,0 %), G12R (1,0 %). Jedna laboratoř vyšetřuje kodon 13 na přítomnost dalších záměn s tímto výsledkem záchytu: G13S a G13A nezachyceny, G13R a G13V – 0,1 %, G13C – 0,3 %. Žádné pracoviště neuvedlo testování mimo kodony 12 a 13 genu KRAS.
Obr. 2. Souhrnné výsledky analýzy genu KRAS v České republice v roce 2009. Sloupce znázorňují celkový záchyt v jednotlivých kategoriích v %. Boxy vyznačují nejvyšší a nejnižší záchyt jednotlivých výsledků reportovaných českými pracovišti. 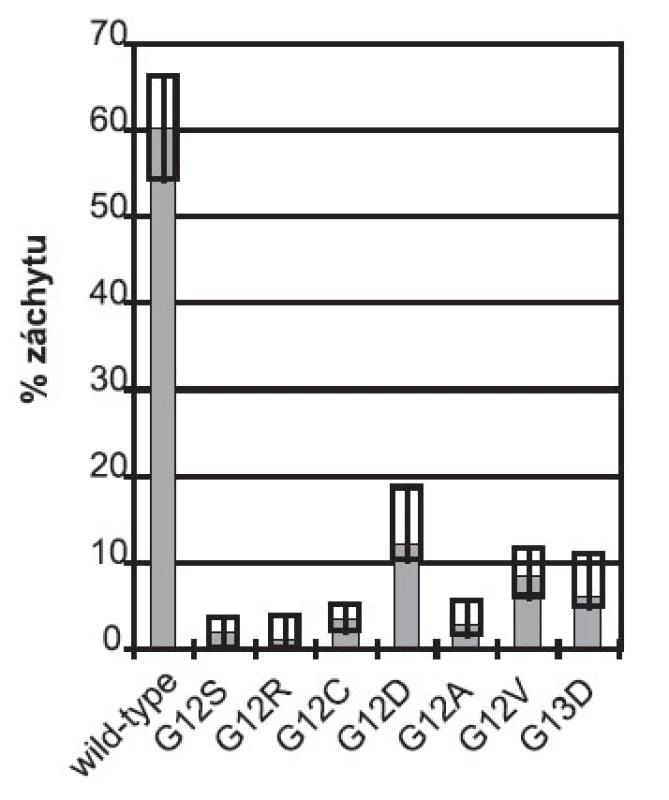
V Masarykově onkologickém ústavu se provádí stanovení mutací genu KRAS od druhé poloviny roku 2008. Postup vyšetřování je popsán algoritmem na obrázku 3. Zpracování tkáně provádí Oddělení onkologické a experimentální patologie a část tkáně pro izolaci DNA pak převezme Laboratoř prediktivní onkologie Oddělení laboratorní medicíny, které reportuje výsledek žadateli. Vyšetření mutačního statutu genu KRAS je akreditováno dle ČSN EN ISO15189 (35) a provádí se metodou real time PCR (kit TheraScreen, DxS); záložní metodou je hybridizace PCR produktu na detekčním proužku (PGX-Kras, ViennaLab). Externí hodnocení kvality je prováděno v programu CAP proficiency testing (www.cap.org). Analýza času odezvy metody v MOÚ (obr. 3) ukazuje, že časově nejnáročnější jsou činnosti spojené se zpracováním tkání, především vyžádání a následné dodání tkání z pracovišť mimo Masarykův onkologický ústav. Doba odezvy se výrazně prodlouží, pokud není izolovaná DNA dostatečně kvalitní a je třeba vyžádat nový vzorek tkáně, případně provést biopsii dostupného metastatického ložiska. Z tohoto důvodu byla do logistiky vyšetřování genu KRAS zařazena možnost izolace a zjištění kvality nádorové DNA v předstihu před provedením vlastního vyšetření. Tato alternativa je ke zvážení především u pacientů po kurativní resekci kolorektálního karcinomu zatížených vysokým rizikem relapsu onemocnění – tedy klinické stadium III a stadia II „high risk“ podskupiny (32). Z výtěžné archivované DNA je pak možnost provést vyšetření ve velmi krátké době (obr. 3C).
Obr. 3. Algoritmus vyšetřování genu KRAS v MOÚ a z něj vyplývající časy odezvy vyšetření. Požadavky o vyšetření mutačního statutu genu KRAS přicházejí na žádankách na Oddělení onkologické a experimentální patologie (OOEP) MOÚ, kde je také zadán požadavek do elektronického nemocničního informačního systému pro Oddělení laboratorní medicíny (OLM). Lékař MOÚ požadující vyšetření genu KRAS zadává požadavek pro OOEP (KRAS a vyšetření EGFR) a pro OLM. Pokud nebyla resekce nádoru provedena v MOÚ je vyžádán parafínový bloček z histopatologického pracoviště, kde byla tkáň zpracována. U získaného bločku je provedeno imunohistochemické vyšetření exprese genu EGFR, patolog označí oblast tkáně, kde se nacházejí nádorové buňky se zachovalou morfologií, bez nekróz, optimálně v zastoupení 70 % a více. Přibližně 10–14 mg tkáně je z bločku vyjmuto punkční jehlou pro izolaci DNA, případně je vypunktováno více vzorků. Pokud je lokalizace obtížnější, je z bločku zhotoven a vyšetřen kontrolní řez. Vzorek tkáně je dodán na OLM, kde je provedena deparafinizace, izolace DNA a je zjištěna kvalita izolátu kontrolní amplifikací (real time PCR). Pokud je DNA v dostatečné kvalitě, následuje vlastní testování mutačního statutu genu KRAS. Pokud izolace není úspěšná, je na patologii připraven nový vzorek tkáně, a to buď z původního bločku, nebo je vyhledán/vyžádán bloček nový. Izolace DNA se opakuje, jak bylo popsáno výše. Pokud je izolace DNA opakovaně neúspěšná a/nebo ji není možné opakovat kvůli nedostatku materiálu, je reportována indikujícímu lékaři nemožnost provést vyšetření. Možností volby v takovém případě je pro onkologa biopsie metastáz a vyšetření genu KRAS z tohoto vzorku. 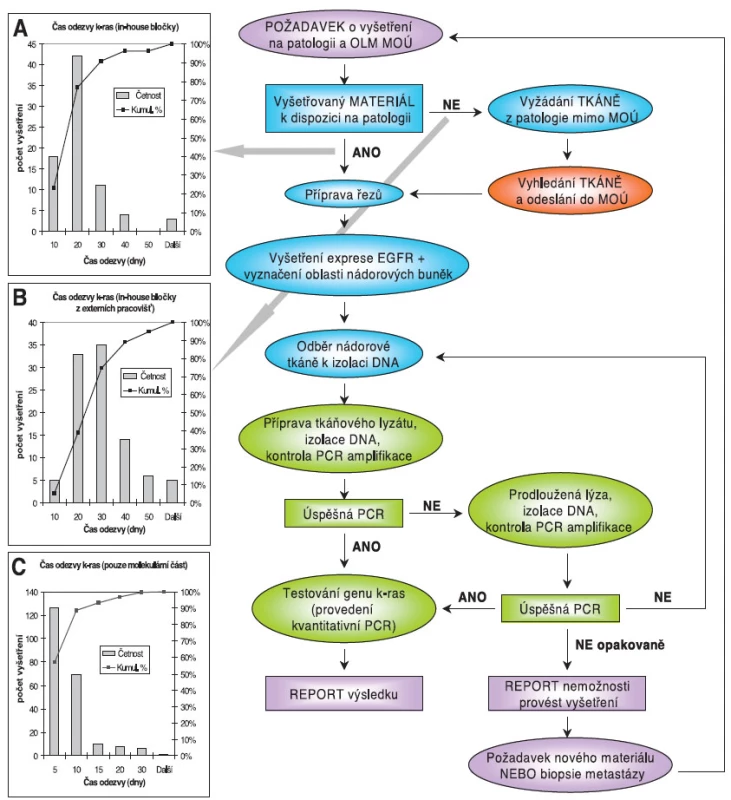
Graf A-B: doba od požadavku o vyšetření mutačního statutu genu KRAS po report výsledku. V grafech je uvedena doba do reportu výsledku (čas odezvy) u výtěžných vzorků, tj. vzorků, u kterých bylo možné reportovat výsledek. Doba zahrnuje: získání bločku, imunohistochemické stanovení EGFR, určení oblasti tkáně s nádorovými buňkami, výběr nádorové tkáně, izolaci DNA, kontrolu izolace, provedení testu a report výsledku. Pokud je bloček k dispozici na patologii MOÚ (A), je 80 % vyšetření provedeno do 20 dnů od vzniku požadavku. Pokud je třeba bloček vyžádat na externím pracovišti (B), je 74 % vyšetření provedeno do 30 dnů a 89 % do 40 dnů. Graf C: doba provedení molekulární analýzy. V grafu je uveden čas odezvy molekulární části analýzy genu KRAS u výtěžných vzorků. Čas odezvy zahrnuje: příjem vzorků na OLM, izolaci DNA, kontrolu izolace, provedení testu a report výsledku; v některých případech včetně opakované izolace. ZÁVĚR
Testování mutací v kodonech 12 a 13 genu KRAS je dnes standardním postupem v léčebném algoritmu u pacientů s metastatickým kolorektálním karcinomem. V blízké budoucnosti se patrně ukáže, zda se pacienti s kolorektálním karcinomem budou pro predikci odpovědi na anti-EGFR terapii dále stratifikovat na základě přítomnosti mutace v genu BRAF, případně dosud rutině nevyšetřovaných oblastí genu KRAS s popsanými onkogenními mutacemi. Z hlediska pacienta je zásadní, aby vyšetření mohlo být a bylo provedeno správně v co možná nejkratším čase. Podstatnou roli hraje nejen analyticky kvalitní a standardizovaný postup molekulárního vyšetření (od izolace DNA po vlastní vyšetření), ale zásadně také pracoviště, které připravuje vzorek tkáně po kurativním chirurgickém zákroku, a standardizovaný postup hodnocení tkáně patologem. Laboratoř provádějící vyšetření by měla dosahovat vysoké úspěšnosti při extrakci nádorové DNA, volit robustní vyšetřovací metodu s dostatečnou citlivostí záchytu mutované DNA a správnost poskytovaných výsledků opírat o externí hodnocení kvality případně mezilaboratorní srovnání.
Zkratky
ARMS – amplification refractory mutation system
ASCO – American Society of Clinical Oncology
ASO – allele-specific oligonucleotide
CAP – College of American Pathologists
CLIA – Clinical Laboratory Improvement Amendments
DHPLC – denaturing high performance liquid chromatography
EGFR – epidermal growth factor receptor
FFPE – formalin-fixed parafin-embedded
ESP – European Society of Pathology
GAP – GTPase activating protein
GEF – guanine nucleotide exchange factor
HRMA – high-resolution melting analysis
Ki-ras2 – Kirsten rat sarcoma virus oncogene homolog
NCCN – National Comprehensive Cancer Network
POET – Perspectives on Emerging Technologies
RFLP – restriction fragment length polymorphism
TKI – tyrosin kinase inhibitor
UK NEQAS – United Kingdom National External Quality Assessment Service
Práce vznikla za podpory výzkumného záměru FUNDIN MZMOU2005, Evropského fondu pro regionální rozvoj pro RECAMO (CZ.1.05/2.1.00/03.0101) a BIOMEDREG (CZ.1.05/2.100/01.0030), a MŠMT pro BBMRI_CZ (LM2010004).
Adresa pro korespondenci:
RNDr. Lenka Dubská, PhD.
Oddělení laboratorní medicíny, Masarykův onkologický ústav
Žlutý kopec 7, 656 53 Brno
fax: +420 543 136 721, e-mail: dubska@mou.cz
Zdroje
1. Jasperson KW, et al. Hereditary and familial colon cancer. Gastroenterology 2010; 138 : 2044–2058.
2. Vogelstein B, et al. Genetic alterations during colorectal-tumor development. N Engl J Med 1988; 319(9): 525–532.
3. Malumbres M, Barbacid M. RAS oncogenes: the first 30 years. Nat Rev Cancer 2003; 3(6): 459–465.
4. Carta C, et al. Germline missense mutations affecting KRAS Isoform B are associated with a severe Noonan syndrome phenotype. Am J Hum Genet 2006; 79(1): 129–135.
5. Karnoub AE, Weinberg RA. Ras oncogenes: split personalities. Nat Rev Mol Cell Biol 2008; 9(7): 517–531.
6. Bernards A, Settleman J. GEFs in growth factor signaling. Growth Factors 2007; 25(5): 355–361.
7. Scheffzek K, et al. The Ras-RasGAP complex: structural basis for GTPase activation and its loss in oncogenic Ras mutants. Science 1997; 277(5324): 333–338.
8. Krengel U, et al. Three-dimensional structures of H-ras p21 mutants: molecular basis for their inability to function as signal switch molecules. Cell 1990; 62(3): 539–548.
9. Ahmadian MR, et al. Confirmation of the arginine-finger hypothesis for the GAP-stimulated GTP-hydrolysis reaction of Ras. Nat Struct Biol 1997; 4(9): 686–689.
10. Moroni M, et al. Gene copy number for epidermal growth factor receptor (EGFR) and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol 2005; 6(5): 279–286.
11. Saltz LB, et al. Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor. J Clin Oncol 2004; 22(7): 1201–1208.
12. Italiano A, et al. Cetuximab shows activity in colorectal cancer patients with tumors for which FISH analysis does not detect an increase in EGFR gene copy number. Ann Surg Oncol 2008; 15(2): 649–654.
13. Chung KY, et al. Cetuximab shows activity in colorectal cancer patients with tumors that do not express the epidermal growth factor receptor by immunohistochemistry. J Clin Oncol 2005; 23(9): 1803–1810.
14. Bokemeyer C, et al. KRAS status and efficacy of first-line treatment of patients with metastatic colorectal cancer (mCRC) with FOLFOX with or without cetuximab: The OPUS experience (abstract 4000). J Clin Oncol 2008; 26 : 4000.
15. Van Cutsem E, et al. KRAS status and efficacy in the first-line treatment of patients with metastatic colorectal cancer (mCRC) treated with FOLFIRI with or without cetuximab: The CRYSTAL experience (abstract 2). J Clin Oncol 2008; 26 : 2.
16. Lievre A, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66(8): 3992–3995.
17. Lievre A, et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J Clin Oncol 2008; 26(3): 374–379.
18. Di Fiore F, et al. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by Cetuximab plus chemotherapy. Br J Cancer 2007; 96(8): 1166–1169.
19. Khambata-Ford S, et al. Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab. J Clin Oncol 2007; 25(22): 3230–3237.
20. De Roock W, et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008; 19(3): 508–515.
21. Allegra CJ, et al. American Society of Clinical Oncology provisional clinical opinion: testing for KRAS gene mutations in patients with metastatic colorectal carcinoma to predict response to anti-epidermal growth factor receptor monoclonal antibody therapy. J Clin Oncol 2009; 27(12): 2091–2096.
22. Forbes SA, et al. COSMIC (the Catalogue of Somatic Mutations in Cancer): a resource to investigate acquired mutations in human cancer. Nucleic Acids Res 2010; 38 (Database issue): D652–657.
23. Loupakis F, et al. KRAS codon 61, 146 and BRAF mutations predict resistance to cetuximab plus irinotecan in KRAS codon 12 and 13 wild-type metastatic colorectal cancer. Br J Cancer 2009; 101(4): 715–721.
24. Lopez-Crapez E, et al. KRAS status analysis and anti-EGFR therapies: is comprehensiveness a biologist’s fancy or a clinical necessity? Br J Cancer 2010; 102(6): 1074–1075; author reply 1076–1077.
25. Smith G, et al. Activating K-Ras mutations outwith ‘hotspot’ codons in sporadic colorectal tumours - implications for personalised cancer medicine. Br J Cancer 2010; 102(4): 693–703.
26. Barbacid M. ras oncogenes: their role in neoplasia. Eur J Clin Invest 1990; 20(3): 225–235.
27. Davies H, et al. Mutations of the BRAF gene in human cancer. Nature 2002, 417(6892): 949–954.
28. Wan PT, et al. Mechanism of activation of the RAF-ERK signaling pathway by oncogenic mutations of B-RAF. Cell 2004; 116(6): 855–867.
29. Wellbrock C, et al. The RAF proteins take centre stage. Nat Rev Mol Cell Biol 2004; 5(11): 875–885.
30. Greer CE, et al. PCR amplification from paraffin-embedded tissues. Effects of fixative and fixation time. Am J Clin Pathol 1991; 95(2): 117–124.
31. Monzon FA, et al. The role of KRAS mutation testing in the management of patients with metastatic colorectal cancer. Arch Pathol Lab Med 2009; 133(10): 1600–1606.
32. van Krieken JHJM, et al. KRAS mutation testing for predicting response to anti-EGFR therapy for colorectal carcinoma: proposal for an European quality assurance program. Virchows Archiv 2008; 453 : 417–431.
33. ČSN EN ISO 15189 : 2007 (85 5101) Zdravotnické laboratoře – Zvláštní požadavky na kvalitu a způsobilost.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Janskolázeňské sympoziumČlánek Problémy s impakt faktoremČlánek KnihyČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
-
Všechny články tohoto čísla
- Idiopatické střevní záněty – predikce průběhu a včasná léčba*
- Vyšetření mutačního statutu genu KRAS jako součást algoritmu léčby metastatického kolorektálního karcinomu
- Plánované akce odborných složek ČLS JEP
- Vliv víry na prožívání nemoci u seniorů, dotazníky spirituality
- Tuberkulóza v České republice v roce 2009
- Plánované akce odborných složek ČLS JEP
- Onemocnění vyvolané Clostridium difficile u geriatrických nemocných
- Alkohol, tabák a jiné návykové látky a reprodukční rizika
- Variabilita hlubokých žil stehna
- Sto let od založení první psychologické laboratoře v českých zemích
- Janskolázeňské sympozium
- Problémy s impakt faktorem
- Knihy
- 15. hradecké gastroenterologické a hepatologické dny
- Konference Human Genome Meeting 2011
- XXXII. imunoanalytické dny, XI. mezinárodní konference CECHTUMA (Central European Tumor Markers) a II. workshop prediktivní, preventivní a personalizované medicíny
- Profesor MUDr. František Boudík, DrSc. (1927–2011)
- K životnímu jubileu prof. MUDr. Jany Pařízkové, DrSc.
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Variabilita hlubokých žil stehna
- Onemocnění vyvolané Clostridium difficile u geriatrických nemocných
- Vyšetření mutačního statutu genu KRAS jako součást algoritmu léčby metastatického kolorektálního karcinomu
- Alkohol, tabák a jiné návykové látky a reprodukční rizika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



