-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinické projevy a výsledky metabolických a molekulárně genetických analýz u jedenácti dětí s tyrosinémií typu I
Autoři: Alžběta Vondráčková 1; Markéta Tesařová 1; Martin Magner 1; Dagmar Dočekalová 1; Petr Chrastina 2; Dagmar Procházková 3; Jiří Zeman 1; Tomáš Honzík 1
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta, Klinika dětského a dorostového lékařství VFN 1; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav dědičných metabolických poruch VFN 2; Masarykova Univerzita v Brně, Lékařská fakulta, Dětská interní klinika FN 3
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 411-416
Kategorie: Původní práce
Souhrn
Východisko.
Tyrosinémie typ I je metabolické onemocnění způsobené poruchou aktivity fumarylacetoacetáthydrolázy, které se projevuje rychle progredujícím poškozením jater a ledvin a vysokým rizikem rozvoje hepatocelulárního karcinomu. Cílem našeho sdělení je analýza klinických příznaků, biochemických a molekulárně genetických vyšetření u 11 dětí, u kterých jsme v letech 1982–2006 diagnostikovali tyrosinémii typ I.Metody a výsledky.
Onemocnění se u devíti dětí manifestovalo mezi 1,5–7. měsícem nechutenstvím, opakovaným zvracením, neprospíváním a hepatopatií, u čtyř z nich se rozvinulo akutní selhání jater. U jednoho pacienta s jaterní cirhózou byla diagnóza stanovena v 5,5 letech a jeden klinicky zdravý chlapec byl diagnostikován po potvrzení diagnózy u sestry. V době diagnózy měli všichni pacienti laboratorní projevy hepatopatie a hypofosfatemické křivice, vysokou hladinu tyrosinu a α1-fetoproteinu v krvi a zvýšené vylučování sukcinylacetonu. U 8/8 pacientů byla zvýšená i hladina kyseliny δ-aminolevulové. Dva pacienti narození před rokem 1988 zemřeli na hepatocelulární karcinom a jeden na jaterní selhání. U osmi žijících pacientů (věk 10,7 ± 8,3 let) byla diagnóza tyrosinémie typ I potvrzena mutační analýzou genu FAH, při které byly nalezeny i tři nové mutace c.579C>A, c.680G>T a c.1210G>A. Zdravotní stav šesti pacientů je na nízkobílkovinné dietoterapii a Orfadinu®, který blokuje syntézu toxického sukcinylacetonu, uspokojivý, ale u dvou pacientů po dvou-, respektive desetileté terapii začala stoupat hladina α1‑fetoproteinu jako projev rozvoje hepatocelulárního karcinomu. Jeden pacient je po úspěšné transplantaci jater, druhý je na čekací listině.Závěry.
Pro zlepšení prognózy pacientů s tyrosinémií typ I je nezbytná včasná diagnostika pomocí rozšířeného novorozeneckého screeningu dědičných poruch metabolismu. Nedávné zavedení molekulární diagnostiky tyrosinémie typ I v České republice umožňuje v postižených rodinách nabízet i prenatální diagnostiku.Klíčová slova:
tyrosinémie, jaterní selhání, křivice, sukcinylaceton, fumarylacetoacetáthydroláza, gen FAH.Úvod
Tyrosinémie typ I (HT1) je způsobena poruchou aktivity enzymu fumarylacetoacetáthydrolázy (FAH), který je nejvíce exprimován v játrech (90 %) a ledvinách (10 %). Je nejzávažnější ze všech tří typů tyrosinémií (1). Výskyt tyrosinémie typ I se v naší populaci odhaduje na 1 : 100 000–120 000 živě narozených dětí a dědičnost onemocnění je autozomálně recesivní (2). Incidence je však v některých oblastech světa jako například ve Finsku a v části Quebecu vyšší (1 : 63 000, 1 : 2000 respektive) díky efektu zakladatele (3). V organismu nemocných dětí se hromadí kromě aminokyseliny tyrosinu i velmi toxické metabolity sukcinylaceton (SAA), maleylacetoacetát (MAA) a fumarylacetoacetát (FAA), které vedou k poškození a zániku především jaterních buněk a tubulárních buněk ledvin (4). Druhotně je ovlivněný metabolismus syntézy hemu s hromaděním kyseliny δ-aminolevulové (5‑ALA) způsobující příznaky podobné těm, které vídáme u dětí s akutní porfyrií (5).
Klinické příznaky tyrosinémie typ I se manifestují většinou již v novorozeneckém a mladším kojeneckém věku, ale výjimkou není ani nástup prvních příznaků v dospělosti. Rozdílné klinické příznaky jsou dokonce popisovány i u sourozenců v jedné rodině (6, 7). Příčinou mírnějšího fenotypu je pravděpodobně „spontánní“ oprava kauzální mutace v jaterních buňkách. Podstata mechanismu této reverzní mutace však není dosud známa (8–12). Podle věku nástupu prvních projevů onemocnění rozlišujeme typ „akutní“ s manifestací pod 6 měsíců věku, typ „subakutní“ s projevy mezi 6. měsícem a jedním rokem života a typ „chronický“ s prvními projevy u dětí starších jednoho roku. U akutní formy tyrosinémie typ I se onemocnění manifestuje většinou pod obrazem akutního jaterního selhání. Rovněž u subakutního typu dominují příznaky jaterního onemocnění s rozvojem závažné hepatopatie, hepatomegalie a koagulopatie s možnou progresí až do jaterní cirhózy a/nebo hepatocelulárního karcinomu. Vyjádřeno je však již i ledvinné postižení s rozvojem křivice, patrné jsou neprospívání a svalová hypotonie. U chronického typu se setkáváme s projevy pomalu progredujícího jaterního a ledvinného postižení s možností rozvoje kardiomyopatie, ale i příznaků podobných akutní porfyrii (zejména bolesti dolních končetin při neuropatii). Postižení jaterních funkcí u pacientů s tyrosinémií typ I vede k významné nemocnosti a velmi vysoké úmrtnosti. Ledvinné onemocnění se projeví zejména dysfunkcí proximálních tubulárních buněk vedoucí k projevům křivice a k metabolické acidóze v rámci renální tubulární acidózy, může být přítomna i nefrokalcinóza (13–16).
Diagnostika tyrosinémie typ I vychází z typických laboratorních projevů postižení jaterních a ledvinných funkcí (hepatopatie, hypoalbuminémie, koagulopatie, hyperfosfáturie, glukosurie, hyperaminoacidurie až charakteru Fanconiho syndromu). Hladina α1-fetoproteinu (AFP) je důležitý laboratorní marker možného rozvoje hepatocelulárního karcinomu. Zvýšená hladina aminokyseliny tyrosinu v séru a zvýšené vylučování sukcinylacetonu a δ-aminolevulové kyseliny močí stanoví diagnózu na biochemické úrovni (17, 18). Definitivně je diagnóza potvrzena analýzou aktivity enzymu fumarylacetoacetáthydrolázy ve fibroblastech a molekulárně genetickým vyšetřením genu FAH.
Základem léčby je nízkobílkovinná dieta, která snižuje příjem aminokyseliny tyrosinu ve stravě, suplementovaná preparátem esenciálních aminokyselin bez fenylalaninu a tyrosinu. Revoluční změnu do terapie a prognózy dětí s tyrosinémií typu I přinesl rok 1992, kdy byl zaveden Orfadin® (NTBC neboli 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyklohexanedion). Jedná se o lék, který zabraňuje tvorbě toxických metabolitů (SAA, MAA, FAA) inhibicí enzymu 4-hydroxyfenylpyruvátdioxygenázy (HPPD), který katalyzuje přeměnu 4-hydroxyfenylpyruvátu na kyselinu homogentisovou. U dětí, kde i přes léčbu (dietní + Orfadin®) jaterní onemocnění progreduje, je nutné provést jaterní transplantaci (19–21).
Předmětem našeho sdělení je analýza klinických příznaků, biochemických a molekulárně genetických vyšetření a výsledků dlouhodobého sledování jedenácti dětí, u kterých jsme na našem pracovišti mezi roky 1982–2006 diagnostikovali tyrosinémii typ I.
Soubor nemocných a použité metody
Soubor tvoří jedenácti dětí (pět chlapců – P3, P4, P5, P8, P11; šest dívek – P1, P2, P6, P7, P9, P10) z deseti nepříbuzných rodin, u kterých jsme na našem pracovišti v letech 1982–2006 prokázali na biochemické úrovni tyrosinémii typ I. Molekulárně genetické vyšetření a stanovení genotypu FAH bylo provedeno u osmi doposud žijících pacientů v letech 2008–2009. Tři pacienti (P1–3) již zemřeli (ve věku 6 měsíců, téměř 8 let a 11,5 roku), průměrný věk dosud žijících pacientů (P4-11) je 10,7 ± 8,3 (průměr r, směrodatná odchylka SD) roku s rozmezím 3–27 let.
Biochemické analýzy
Hladina tyrosinu v plazmě a séru a kyseliny δ-aminolevulové v moči byla stanovena na automatickém analyzátoru AAA Ingos 400 metodou iontově-výměnné chromatografie s kolorimetrickou detekcí ninhydrinem při 440 nm (aminokyseliny se sekundární aminoskupinou), resp. při 570 nm (aminokyseliny s primární aminoskupinou). Aminokyseliny byly identifikovány podle retenčních časů.
Hladina sukcinylacetonu v moči byla stanovena enzymovou fotometrickou metodou s využitím inhibičního působení sukcinylacetonu na aktivitu δ-aminolevulinátdehydratázy z krevního hemolyzátu. Aktivita δ-aminolevulinátdehydratázy byla stanovena na základě množství vytvořeného porfobilinogenu, který byl po reakci s dimetylaminobenzaldehydem detekován při 555 nm.
Molekulárně-genetické analýzy
Celková genomová deoxyribonukleová kyselina (DNA) a ribonukleová kyselina (RNA) byly izolovány z leukocytů z periferní krve. Pro izolaci genomové DNA byla použita metoda fenol-chloroformové extrakce. Celková RNA byla izolována pomocí TriReagent® podle doporučení výrobce (MRC, Velká Británie). 1000 ng celkové RNA bylo přepsáno do cDNA pomocí reverzní transkriptázy SuperScript III (Invitrogen) a Oligo(dT) primeru (Promega). cDNA genu FAH byla následně amplifikována pomocí polymerázové řetězové reakce (PCR) ve třech překrývajících se úsecích a sekvenována na genetickém analyzátoru ABI 3100 Avant (Applied Biosystems). V závislosti na typu a lokalizaci patologické mutace pak byly sekvenovány odpovídající exony a k nim přilehlé intronové oblasti genu FAH z genomové DNA. Přítomnost všech mutací byla potvrzena pomocí PCR-RFLP s využitím vhodných restikčních endonukleáz. Přítomnost odpovídajících mutací byla rovněž vyšetřována i u rodičů všech pacientů. Jedinečnost nově identifikovaných mutací v genu FAH byla potvrzena enzymatickou restrikcí na souboru 100 kontrolních DNA.
Výsledky
Tři pacienti narozeni mezi roky 1982–1988 již zemřeli. Dva pacienti se manifestovali akutním jaterním selháním. Dívka (P1) narozená v roce 1985 následně na jaterní selhání ve věku 6 měsíců umírá. Dívka (P2) narozená v roce 1988 jaterní selhání sice přežila, ale umírá pro rozvoj hepatocelulárního karcinomu ve věku téměř 8 let. U chlapce (P3) narozeného v roce 1982 se onemocnění tyrosinémie typ I potvrdilo až ve věku 5,5 let při náhodně objevené hepatosplenomegalii. RTG vyšetření již dokumentovalo rozvinutou křivici, jaterní biopsie prokázala jaterní fibrózu. Chlapec zemřel pro rozvoj hepatocelulárního karcinomu ve svých 11,5 letech.
U dvou stále žijících pacientů (P4–5) se tyrosinémie typ I také manifestovala jaterním selháním s ascitem ve věku 2–7 měsíců. U P4 narozeného v roce 2006 se podařilo jaterní funkce stabilizovat, ale pro rozvoj hepatocelulárního karcinomu bylo nutné indikovat ve věku 31 měsíců transplantaci jater. P5 je v současné době 6,5letý a je klinicky v pořádku. U dalších pěti dětí s tyrosinémií typ I (P6–P10) se onemocnění projevilo odmítáním stravy, neprospíváním a zvracením po zavedení umělé mléčné formule mezi 2.–7. měsícem života. U P11 byla diagnóza stanovena ve 3 měsících věku při stanovení diagnózy u jeho sestry (P10), klinicky byl zdráv. Průměrný věk stanovení diagnózy byl u těchto šesti dětí 6 měsíců (s rozmezím 2–18 měsíců). U P10 byly v době stanovení diagnózy (18. měsíc života) již přítomny klinické projevy křivice.
Hepatopatie (ALT 1,0 ± 0,9, AST 1,4 ± 0,9 μkat/l, r ± SD), vysoká hladina α1-fetoproteinu (medián 79 959 μg/l pro naměřené hodnoty 19,2–509 705 μg/l) a laboratorní známky hypofosfatemické křivice (ALP 17 ± 7 μkat/l, fosfor 1,2 ± 0,36mmol/l) byly přítomny u všech včasně diagnostikovaných pacientů. U P3 diagnostikovaného až ve věku 5,5 let nebyla hladina AFP zvýšena. Vysoká hladina tyrosinu v krvi (650 ± 258 μmol/l), SAA (335 ± 170 μmol/l) a 5-ALA (155 ± 119 mg/g kreat.) v moči stanovily diagnózu tyrosinémie typ I na biochemické úrovni. Pro potvrzení diagnózy tyrosinémie typ I u pacientů diagnostikovaných před rokem 2000 bylo ve spolupráci se zahraničním pracovištěm provedeno enzymatické vyšetření aktivity fumarylacetoacetáthydrolázy v lymfocytech (< 2 % kontrol).
Ihned po stanovení diagnózy byla u všech dětí zahájena nízkobílkovinná dieta (0,5 ± 0,1 g/kg/den) se suplementací směsi esenciálních aminokyselin bez fenylalaninu, tyrosinu a L-karnitinu. Léčba NTBC (1 mg/kg/den) byla zahájena ihned při stanovení diagnózy u P4–6 a P10–11, u P7 s odstupem 4 měsíců. U nejstarších pacientů P8 a P9 (v současnosti 20,5 a 27 let respektive) byla léčba NTBC zahájena až v 11 a 18 letech. U P1–3, kteří zemřeli do roku 1995, nebylo možné léčbu NTBC zahájit. U pěti pacientů léčených od začátku dietou a NTBC dochází k normalizaci vylučování 5-ALA již za 6 ± 4 dny a SAA za 11 ± 8 dnů, hladiny fosfátů v krvi za 10 ± 7 týdnů, aktivity alkalické fosfatázy za 1,5 ± 1,3 měsíce a k úpravě koagulopatie za 2,3 ± 1,2 měsíce. Pouze u čtyř pacientů (P5–7, P11) se normalizují jaterní testy (14 ± 5 měsíců po zahájení léčby). Hodnota AFP sice prudce klesá okamžitě po zavedení léčby (obr. 1A), ale pouze u P5 a P6 léčených dietou a NTBC okamžitě od stanovení diagnózy dochází k její úplné normalizaci (za 15,5 ± 0,5 měsíce). U P4 nedošlo k úplné normalizaci jaterních testů včetně hladiny AFP a pro rozvoj jaterního karcinomu byla ve věku 31 měsíců indikována transplantace jater. Transplantace byla úspěšná a v současné době je chlapec bez dietního omezení a se sníženou dávkou NTBC na 10 %. U P7 léčené zprvu dietou (od 5 měsíců věku) sice dochází již po dvou týdnech k normalizaci vylučování SAA a k detekci jen stopového množství 5-ALA, ale k prudkému poklesu AFP dochází až po zavedení léčby NTBC (z hodnoty 3396 μg/l ve věku 8 měsíců na 42 μg/l ve věku 14 měsíců). U P8, u kterého byla stanovena diagnóza v roce 1989 ve věku 4 měsíců, ještě v 10 a 11 letech zaznamenáváme i přes dobře vedenou dietu intermitentně vysoké hodnoty vylučování SAA do moče (220 ± 90 μmol/l). Zavedení léčby NTBC v 11 letech však již nezabránilo rozvoji karcinomu jater s indikací k jaterní transplantaci (nyní je pacient ve věku 20,5 let na čekací listině). Dynamika změn hladiny AFP u P8 je demonstrována na obrázku 1B. Vzestup hladin AFP při rozvoji hepatocelulárního karcinomu jsme zaznamenali rovněž u dvou pacientů, kteří na tuto komplikaci zemřeli (tisícové hodnoty při manifestaci karcinomu do hodnot statisícových těsně před exitem). U P9 (t.č. 27 let) byla hladina SAA zvýšená při léčbě jen dietou (dosahující hodnoty 149 μmol/l v 5 letech života (1987), v době kdy byla zavedena metodika měření SAA v moči). I přesto, že léčba NTBC (a definitivní normalizace SAA) u P9 byla zavedena až v 18 letech života, je jeho aktuální zdravotní stav dobrý.
Obr. 1A. Sérové hladiny α1-fetoproteinu (AFP) v průběhu dlouhodobého sledování u pěti dětí s tyrosinémií typ I s včasně zahájenou léčbou Orfadinem (NTBC) (P4–6, P10–11) 
Obr. 1B. Vzestup hladiny α1-fetoproteinu v průběhu dlouhodobého sledování při rozvoji jaterního karcinomu u chlapce s tyrosinémií typ I (P8) 
Současný klinický stav a relevantní laboratorní parametry osmi žijících pacientů s tyrosinémií typ I (P4–11) jsou uvedeny v tabulce 1. Parametry fosfokalciového metabolismu a koagulační funkce jsou u všech pacientů v normě. 5-ALA a SAA v moči nejsou dlouhodobě detekovány u žádného pacienta.
Tab. 1. Současný klinický stav a výsledky laboratorních a metabolických vyšetření 8 dětí s tyrosinémií typ I 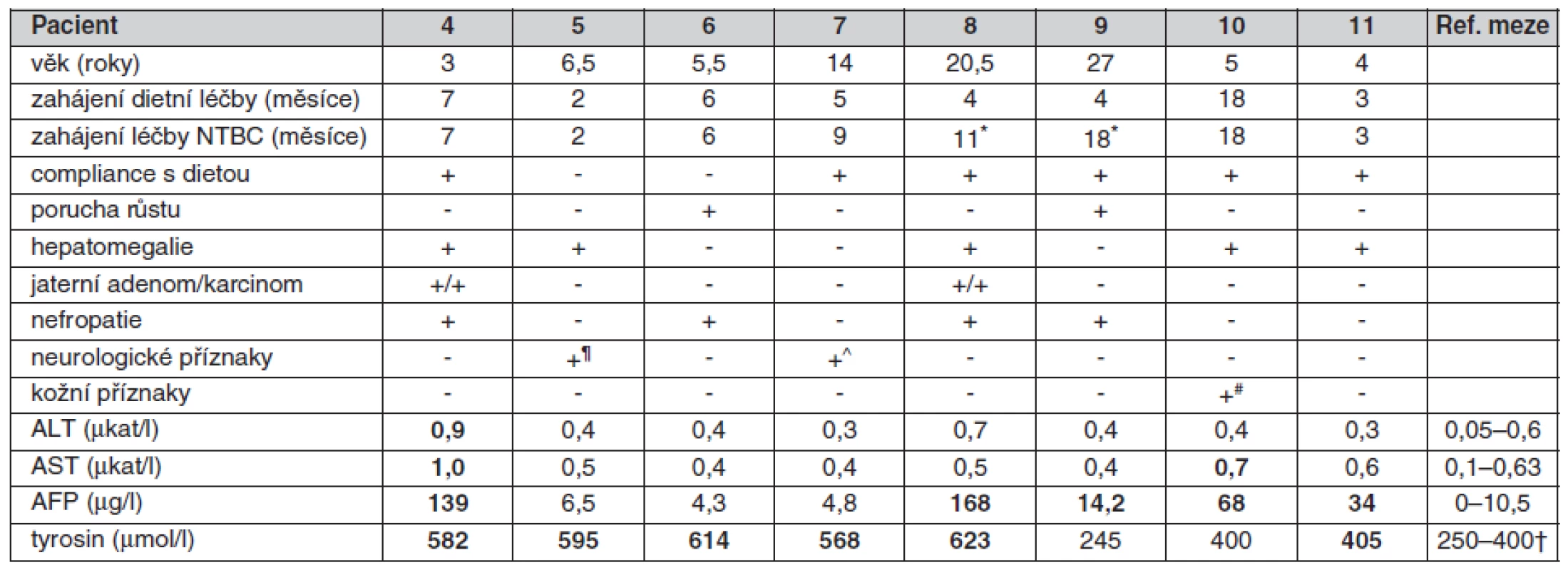
* léčba NTBC zahájena v 11 a 18 letech respektive ¶ stav po rozvoji nejasné polyneuropatie ve věku 3,5 let s následnou úpravou ^ ADHD – porucha pozornosti a hyperaktivita, dysgrafie # dermatitis herpetiformis Duhring † doporučené meze pro děti s tyrosinémií na dietě ALT – alaninaminotransferéza, AST – aspartátaminotransferáza, ALP – alkalická fosfatáza, AFP – α1-fetoprotein, SAA – sukcinylaceton, 5-ALA – δ-aminolevulová kyselina, NTBC – 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyklohexanedion U všech osmi ještě žijících pacientů jsme identifikovali mutace v genu FAH (tab. 2). P10–11 jsou homozygoté pro mutaci c.554-1G>T, P7 pro mutaci c.1062+5G>A. Ostatní pacienti jsou složenými heterozygoty (viz tab. 2). Byly nalezeny tři doposud nepopsané mutace: mutace c.579C>A vedoucí k vytvoření předčasného stop-kodónu C193X, mutace c.680G>T vedoucí k záměně G227V a mutace c.1210G>A vedoucí k záměně G404S. Tyto tři mutace nebyly přítomné v souboru 100 kontrolních DNA.
Tab. 2. Identifikované mutace a genotyp* 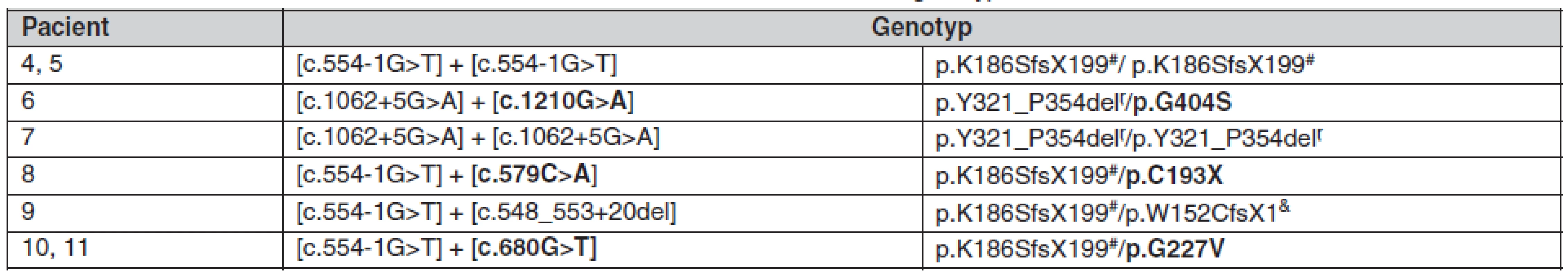
* tučně jsou zvýrazněny nově identifikované mutace # dále vznikají produkty p.S185fsX229 a p.S185CfsX2 ŗ dále vzniká produkt p.Z355VfsX6 & dále vzniká produkt p.D183GfsX32 Diskuze
Tyrosinémie typ I, vzácná porucha metabolismu aminokyseliny tyrosinu způsobená deficitem fumaryloacetoacetáthydrolázy, byla na našem pracovišti během posledních 27 let identifikována u 11 pacientů z deseti nepříbuzných rodin z České republiky. Onemocnění bylo potvrzeno jak na biochemické, tak i molekulárně genetické úrovni. Cílem našeho sdělení bylo popsat klinický průběh onemocnění našich pacientů s tyrosinémií typ I, shrnout naše zkušenosti s efektem léčby a prezentovat tři nové dosud nepopsané mutace v genu FAH.
Enzym FAH, aktivní ve formě homodimeru, je cytosolický protein. Monomer FAH, který je tvořen 419 aminokyselinami, je strukturně a funkčně rozčleněn na N-terminální a C-terminální doménu. C-terminální doména vytváří aktivní místo enzymu, N-terminální doméně je přisuzována regulační funkce. V aktivním místě proteinu jsou lokalizovány ionty Mn2+ a Na+ (22) nezbytné pro jeho správnou strukturu a funkci (23, 24). Myší a lidský enzym FAH vykazují 88% sekvenční identitu, přičemž aminokyselinové zbytky vytvářející aktivní místo jsou přísně mezidruhově konzervované. Gen FAH se nachází na chromozomu 15q23–25 a skládá se ze 14 exonů (25). V genu FAH bylo doposud identifikováno 43 různých patogenních mutací (26).
V našem souboru jsme nalezli tři doposud nepopsané mutace. Mutace C193X (c.579C>A) vede k vytvoření předčasného stop-kodónu a ztrátě aktivního místa proteinu FAH. Mutace G227V se nachází v blízkosti Asp233, který se podílí na ukotvení obou iontů aktivního místa. Záměna G227V pravděpodobně primárně narušuje sterické poměry aktivního místa jedné podjednotky a prostřednictvím nevazebných interakcí rovněž ovlivňuje i aktivní místo druhé podjednotky homodimeru FAH. Mutace G404S pravděpodobně podmiňuje změnu konformace N-terminální domény, která reguluje aktivitu enzymu. Obě pozice 227 a 404 jsou mezidruhově konzervované pro aminokyselinu glycin. Mutace E6/I6del26 byla zatím charakterizována pouze na úrovni genomové DNA (27). Analýza PCR produktů amplifikovaných z cDNA od P9 s genotypem [c.554-1G>T]+[c.548_553+20del] ukázala, že mutace c.548_553+20del pravděpodobně narušuje sestřihové místo intronu 6, protože v cDNA zůstal začleněn zbývající úsek intronu 6 zkrácený o prvních 20 bp.
Tyrosinémie typ I je charakterizována u naprosté většiny pacientů časným začátkem s poškozením jater a ledvin (28, 29) a atakami neuropatických krizí (30). Věk manifestace tyrosinémie typ I (v rozmezí 1,5–7 měsíců) u našich pacientů je v korelaci se zahraničními zkušenostmi (31), P3 byl diagnostikován pozdě (ve věku 5,5 let) již s rozvinutou jaterní cirhózou. Postižení ledvin bylo přítomno v době stanovení diagnózy u 55 % našich pacientů. Akutním jaterním selháním se však manifestovalo pouze 36 % dětí (čtyři z jedenácti), což kontrastuje s 75 % a 43 % dětí v sestavě pacientů s tyrosinémií typ I ve studii van Spronsena et al. (29) a S. Santra et al. (31). Ataky neurogenních krizí nebyly v naší skupině pacientů vůbec pozorovány, u P5 se rozvinula ve věku 3,5 let náhle periferní neuropatie s ústupem po několika měsících bez prokázané etiologie.
Prognóza onemocnění byla do roku 1992, kdy byla zavedena léčba preparátem Orfadin® (NTBC), velmi nepříznivá. Pravděpodobnost přežití do 2 let věku byla u dětí s časným začátkem onemocnění (pod 2 měsíce) pouhých 29 % (29). Hlavní příčina úmrtí byla jaterní insuficience a rozvoj hepatocelulárního karcinomu. Po zavedení léčby preparátem Orfadin® (NTBC, nitisinon) do klinické praxe (20) se prognóza dětí s tyrosinémií typ I dramaticky zlepšila. Jeho podání u pacientů s tyrosinémií typ I s projevy akutního jaterního selhání vedlo v 90 % případů ke zlepšení jaterních funkcí a koagulopatie již do 1 týdne po zavedení léčby, je dokumentován rychlejší pokles hladin AFP (32) a úprava ledvinných tubulárních funkcí (31) s normalizací v průměru do 12. měsíce věku. Po zahájení léčby se většinou nerozvine nefrokalcinóza, která byla přítomna až u 33 % pacientů s tyrosinémií typ I před érou léčby NTBC (31). Patrné je téměř úplné vymizení atak neurogenních krizí (33). Při zahájení podávání NTBC do 2. roku života se snižuje riziko rozvoje hepatocelulárního karcinomu u pacientů s tyrosinémií typ I více než 3× (34, 35).
V České republice je léčba NTBC možná od roku 1996. Tři pacienti narození mezi roky 1982–1988 zemřeli před možným zahájením léčby NTBC. Včasná léčba NTBC byla zahájena u šesti našich pacientů. U všech včasně léčených pacientů jsme pozorovali, ve shodě s literaturou, rychlou úpravu hladin 5-ALA a SAA v moči, koagulační parametry a tubulární porucha ledvin se upravily. Pouze u čtyř pacientů poklesly jaterní testy a u dvou dětí hladina AFP zcela do normy. I přes včasnou diagnózu a brzkou léčbu se u P4 (jednoho ze šesti) rozvinul hepatocelulární karcinom s nutností provedení jaterní transplantace. Podobný osud postihl i P8 léčeného NTBC až od 11 let života, kde se rozvinul hepatocelulární karcinom ve věku 20 let. Zatím zůstává nevyřešená otázka, proč se u P4 rozvinul hepatocelulární karcinom již mezi 2. až 3. rokem života i přes dobře vedenou veškerou možnou léčbu, u P8 až ve věku 20 let se zavedenou léčbou NTBC v 11 letech a naše nejstarší pacientka (P9) léčená NTBC až od 18 let života je laboratorně v pořádku a v klinicky dobrém stavu. Přitom aktivita fumarylacetoacetáthydrolázy je u P8 a P9 výrazně deficitní (pod 1 % kontrol). Předpokládá se však role zevních faktorů, rozdílného genetického pozadí a epigenetických mechanismů.
Závěr
Tyrosinémie typ I se manifestuje zejména jaterním a ledvinným postižením. I když se v současné době prognóza přežití pacientů s tyrosinémií typ I prudce zvýšila díky kombinované dietní léčbě s podáváním NTBC, může se u pacientů rozvinout hepatocelulární karcinom s nutností jaterní transplantace. Jedinou možností jak snížit riziko závažných komplikací pacientů s tyrosinémií typ I je včasná diagnostika pomocí rozšířeného novorozeneckého screeningu dědičných poruch metabolismu. Do roku 2008 byla diagnóza pacientů s tyrosinémií typ I stanovována pouze na biochemické úrovni bez možnosti nabídnutí genetického poradenství a prenatální diagnostiky. V současné době je molekulárně genetické vyšetření na našem pracovišti k dispozici.
Zkratky
- AFP – α1-fetoprotein
- ALP – alkalická fosfatáza
- ALT – alaninaminotransferáza
- AST – aspartátaminotransferáza
- DNA – deoxyribonukleová kyselina
- FAA – fumarylacetoacetát
- FAH – fumarylacetoacetáthydroláza
- HPPD – hydroxyfenylpyruvátdioxygenáza
- MAA – maleylacetoacetát
- NTBC – 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyklohexandion
- P – pacient
- PCR – polymerázová řetězová reakce
- 5-ALA – kyselina δ-aminolevulová
- r – průměr
- RFLP – délkový polymorfismu restrikčních fragmentů
- RNA – ribonukleová kyselina
- SAA – sukcinylaceton
- SD – směrodatná odchylka
Práce byla podpořena výzkumným záměrem MZ0VFN2005 a MSM0021620806.
Adresa pro korespondenci:
MUDr. Tomáš Honzík, Ph.D.
Klinika dětského a dorostového lékařství 1. LF UK a VFN
Ke Karlovu 2, 121 00 Praha 2
fax: +420 224 967 113, e-mail: tomas.honzik@lf1.cuni.cz
Zdroje
1. Lindblad B, Lindstedt S, Steen G. On the enzymic defects in hereditary tyrosinemia. Proc Natl Acad Sci USA 1977; 74 : 4641–4645.
2. Scott CR. The genetic tyrosinemias. Am J Med Genet C Semin Med Genet 2006; 142C: 121–126.
3. De Braekeleer M, Larochelle J. Genetic epidemiology of hereditary tyrosinemia in Quebec and in Saguenay-Lac-St-Jean. Am J Hum Genet 1990; 47 : 302–307.
4. Kubo S, Sun M, Miyahara M, Umeyama K, Urakami K, Yamamoto T, et al. Hepatocyte injury in tyrosinemia type 1 is induced by fumarylacetoacetate and is inhibited by caspase inhibitors. Proc Natl Acad Sci USA 1998; 95 : 9552–9557.
5. Russo PA, Mitchell GA, Tanguay RM. Tyrosinemia: a review. Pediatr Dev Pathol 2001; 4 : 212–221.
6. Poudrier J, Lettre F, Scriver CR, Larochelle J, Tanguay RM. Different clinical forms of hereditary tyrosinemia (type I) in patients with identical genotypes. Mol Genet Metab 1998; 64 : 119–125.
7. Poudrier J, Lettre F, St-Louis M, Tanguay RM. Genotyping of a case of tyrosinaemia type I with normal level of succinylacetone in amniotic fluid. Prenat Diagn 1999; 19 : 61–63.
8. Phaneuf D, Lambert M, Laframboise R, Mitchell G, Lettre F, Tanguay RM. Type 1 hereditary tyrosinemia. Evidence for molecular heterogeneity and identification of a causal mutation in a French Canadian patient. J Clin Invest 1992; 90 : 1185–1192.
9. Kvittingen EA, Rootwelt H, Berger R, Brandtzaeg P. Self-induced correction of the genetic defect in tyrosinemia type I. J Clin Invest 1994; 94 : 1657–1661.
10. Kvittingen EA, Rootwelt H, Brandtzaeg P, Bergan A, Berger R. Hereditary tyrosinemia type I. Self-induced correction of the fumarylacetoacetase defect. J Clin Invest 1993; 91 : 1816–1821.
11. Jonkman MF. Revertant mosaicism in human genetic disorders. Am J Med Genet 1999; 85 : 361–364.
12. Demers SI, Russo P, Lettre F, Tanguay RM. Frequent mutation reversion inversely correlates with clinical severity in a genetic liver disease, hereditary tyrosinemia. Hum Pathol 2003; 34 : 1313–1320.
13. Noble-Jamieson G, Jamieson N, Clayton P, Bailey S, Ryalls M, Barnes ND. Neurological crisis in hereditary tyrosinaemia and complete reversal after liver transplantation. Arch Dis Child 1994; 70 : 544–545.
14. Forget S, Patriquin HB, Dubois J, Lafortune M, Merouani A, Paradis K, et al. The kidney in children with tyrosinemia: sonographic, CT and biochemical findings. Pediatr Radiol 1999; 29 : 104–108.
15. Mention K, Lahoche-Manucci A, Bonnevalle M, Pruvot FR, Declerck N, Foulard M, et al. Renal function outcome in pediatric liver transplant recipients. Pediatr Transplant 2005; 9 : 201–207.
16. Arora N, Stumper O, Wright J, Kelly DA, McKiernan PJ. Cardiomyopathy in tyrosinaemia type I is common but usually benign. J Inherit Metab Dis 2006; 29 : 54–57.
17. Matern D, Tortorelli S, Oglesbee D, Gavrilov D, Rinaldo P. Reduction of the false-positive rate in newborn screening by implementation of MS/MS-based second-tier tests: the Mayo Clinic experience (2004–2007). J Inherit Metab Dis 2007; 30 : 585–592.
18. la Marca G, Malvagia S, Pasquini E, Innocenti M, Fernandez MR, Donati MA, et al. The inclusion of succinylacetone as marker for tyrosinemia type I in expanded newborn screening programs. Rapid Commun Mass Spectrom 2008; 22 : 812–818.
19. van Spronsen FJ, Bijleveld CM, van Maldegem BT, Wijburg FA. Hepatocellular carcinoma in hereditary tyrosinemia type I despite 2-(2 nitro-4-3 trifluoro-methylbenzoyl)-1, 3-cyclohexanedione treatment. J Pediatr Gastroenterol Nutr 2005; 40 : 90–93.
20. Lindstedt S, Holme E, Lock EA, Hjalmarson O, Strandvik B. Treatment of hereditary tyrosinaemia type I by inhibition of 4-hydroxyphenylpyruvate dioxygenase. Lancet 1992; 340 : 813–817.
21. Lock EA, Ellis MK, Gaskin P, Robinson M, Auton TR, Provan WM, et al. From toxicological problem to therapeutic use: the discovery of the mode of action of 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC), its toxicology and development as a drug. J Inherit Metab Dis 1998; 21 : 498–506.
22. Bateman RL, Ashworth J, Witte JF, Baker LJ, Bhanumoorthy P, Timm DE, et al. Slow-onset inhibition of fumarylacetoacetate hydrolase by phosphinate mimics of the tetrahedral intermediate: kinetics, crystal structure and pharmacokinetics. Biochem J 2007; 402 : 251–260.
23. Timm DE, Mueller HA, Bhanumoorthy P, Harp JM, Bunick GJ. Crystal structure and mechanism of a carbon–carbon bond hydrolase. Structure 1999; 7 : 1023–1033.
24. Bateman RL, Bhanumoorthy P, Witte JF, McClard RW, Grompe M, Timm DE. Mechanistic inferences from the crystal structure of fumarylacetoacetate hydrolase with a bound phosphorus-based inhibitor. J Biol Chem 2001; 276 : 15284–15291.
25. Phaneuf D, Labelle Y, Berube D, Arden K, Cavenee W, Gagne R, et al. Cloning and expression of the cDNA encoding human fumarylacetoacetate hydrolase, the enzyme deficient in hereditary tyrosinemia: assignment of the gene to chromosome 15. Am J Hum Genet 1991; 48 : 525–535.
26. Stenson PD, Mort M, Ball EV, Howells K, Phillips AD, Thomas NS , et al. The Human Gene Mutation Database: 2008 update. Genome Med 2009; 1 : 13.
27. Arranz JA, Pinol F, Kozak L, Perez-Cerda C, Cormand B, Ugarte M, et al. Splicing mutations, mainly IVS6-1(G>T), account for 70% of fumarylacetoacetate hydrolase (FAH) gene alterations, including 7 novel mutations, in a survey of 29 tyrosinemia type I patients. Hum Mutat 2002; 20 : 180–188.
28. Russo P, O’Regan S. Visceral pathology of hereditary tyrosinemia type I. Am J Hum Genet 1990; 47 : 317–324.
29. van Spronsen FJ, Thomasse Y, Smit GP, Leonard JV, Clayton PT, Fidler V, et al. Hereditary tyrosinemia type I: a new clinical classification with difference in prognosis on dietary treatment. Hepatology 1994; 20 : 1187–1191.
30. Mitchell G, Larochelle J, Lambert M, Michaud J, Grenier A, Ogier H, et al. Neurologic crises in hereditary tyrosinemia. N Engl J Med 1990; 322 : 432–437.
31. Santra S, Preece MA, Hulton SA, McKiernan PJ. Renal tubular function in children with tyrosinaemia type I treated with nitisinone. J Inherit Metab Dis 2008; 31 : 399–402.
32. Holme E, Lindstedt S. Nontransplant treatment of tyrosinemia. Clin Liver Dis 2000; 4 : 805–814.
33. Gibbs TC, Payan J, Brett EM, Lindstedt S, Holme E, Clayton PT. Peripheral neuropathy as the presenting feature of tyrosinaemia type I and effectively treated with an inhibitor of 4–hydroxyphenylpyruvate dioxygenase. J Neurol Neurosurg Psychiatry 1993; 56 : 1129–1132.
34. Perez-Cerda C, Merinero B, Sanz P, Castro M, Gangoiti J, Garcia MJ, et al. Liver transplantation in nine Spanish patients with tyrosinaemia type I. J Inherit Metab Dis 1995; 18 : 119–122.
35. McKiernan PJ. Nitisinone in the treatment of hereditary tyrosinaemia type 1. Drugs 2006; 66 : 743–750.
Štítky
Adiktologie Alergologie a imunologie Anesteziologie a resuscitace Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská dermatologie Dětská gastroenterologie Dětská gynekologie Dětská chirurgie Dětská kardiologie Dětská nefrologie Dětská neurologie Dětská onkologie Dětská otorinolaryngologie Dětská pneumologie Dětská psychiatrie Dětská radiologie Dětská revmatologie Dětská urologie Diabetologie Endokrinologie Farmacie Farmakologie Fyzioterapie Gastroenterologie a hepatologie Genetika Geriatrie a gerontologie Gynekologie a porodnictví Hematologie a transfuzní lékařství Hygiena a epidemiologie Hyperbarická medicína Chirurgie cévní Chirurgie hrudní Chirurgie plastická Chirurgie všeobecná Infekční lékařství Intenzivní medicína Kardiochirurgie Kardiologie Logopedie Mikrobiologie Nefrologie Neonatologie Neurochirurgie Neurologie Nukleární medicína Nutriční terapeut Obezitologie Oftalmologie Onkologie Ortodoncie Ortopedie Otorinolaryngologie Patologie Pediatrie Pneumologie a ftizeologie Popáleninová medicína Posudkové lékařství Praktické lékařství pro děti a dorost Protetika Psychologie Radiodiagnostika Radioterapie Rehabilitační a fyzikální medicína Reprodukční medicína Revmatologie Sestra Sexuologie Soudní lékařství Stomatologie Tělovýchovné lékařství Toxikologie Traumatologie Urgentní medicína Urologie Laboratoř Domácí péče Foniatrie Algeziologie Zdravotnictví Dentální hygienistka Student medicíny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- Klinické projevy a výsledky metabolických a molekulárně genetických analýz u jedenácti dětí s tyrosinémií typu I
- Nová jednoduchá metoda stanovení viscerálního a trunkálního tuku pomocí bioelektrické impedance: srovnání s magnetickou rezonancí a duální rentgenovou absorpciometrií u českých adolescentů
- Alternativní metody měření mikrovolt alternans T-vlny u pacientů s dysfunkcí levé srdeční komory
- Nakupování jako problém: oniománie (nezdrženlivé nakupování, shopping addiction)
- Význam p63 cyklu při progresi epidermálních buněk
- Forenzní rizika při poskytování léčebně-preventivní péče
- Cetkovská P, Pizinger K, Štork J.: KOŽNÍ ZMĚNY U INTERNÍCH ONEMOCNĚNÍ
- Poškození nemocných v nemocnicích
-
25. česko-slovenské pracovné dni o dedičných metabolických poruchách
Trenčianske Teplice, 5.–7. máj 2010 -
45. sjezd biochemických laborantů – Biolab
Hradec Králové, 30. května až 1. června 2010 -
XIV. pracovní den klinické farmacie
Praha, 4. června 2010 -
XV. andrologické sympozium
Český Krumlov, 4.–5. června 2010 -
XV. pracovní sympozium České společnosti intervenční radiologie
Lipno, 3.–5. června 2010 -
XXI. kongres České lékařské společnosti J. E. Purkyně byl letos věnován personalizované medicíně
Praha, 8. června 2010 -
Výroční setkání dětských urologů a nefrologů
Dříteč, 10.–12. června 2010 - Osobní zprávy
- Krize českého zdravotnictví má jediné řešení – reformu!
- François Jacob
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nová jednoduchá metoda stanovení viscerálního a trunkálního tuku pomocí bioelektrické impedance: srovnání s magnetickou rezonancí a duální rentgenovou absorpciometrií u českých adolescentů
- Klinické projevy a výsledky metabolických a molekulárně genetických analýz u jedenácti dětí s tyrosinémií typu I
- Nakupování jako problém: oniománie (nezdrženlivé nakupování, shopping addiction)
- Forenzní rizika při poskytování léčebně-preventivní péče
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



