-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ABSTRAKTA
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 588-592
Kategorie: Abstrakta
Pracovní den Centra in vitro fertilizace v ÚPMD Ústav pro péči o matku a dítě 20. června 2008
V měsíci reprodukčního zdraví, který se v červnu slaví na celém světě, již tradičně pořádalo Centrum in vitro fertilizace dne 20. června 2008 v Ústavu pro péči o matku a dítě den otevřených dveří, spojený s přednáškami na dané téma.
Asistovaná reprodukce v léčbě neplodnosti a práce centra IVF-ÚPMD
MUDr. Jitka Řezáčová
V ekonomicky vyspělých zemích má problémy s početím 15 – 20 % partnerských párů.
V České republice zůstává bezdětných 15–20 % žen a průměrný věk prvorodiček je 26,3 roku. Celá pětina mladých lidí plánuje pouze jedno dítě a 3 % nechtějí mít děti vůbec. Průměrný věk žen, které vyhledají pomoc v některém centru asistované reprodukce, je 32 let. V roce 2007 byla u nás úhrnná plodnost 1,44 dítěte na ženu, přičemž tak zvanou „záchovnou mezí“ nutnou pro přežití dané populace je 2,1 dítěte na ženu.
V loňském roce se v České republice narodilo 113 478 dětí, z toho po léčbě neplodnosti přibližně 7 %, tedy 7943, a po asistované reprodukci (AR) asi 3 %, tedy 3404 dětí.
V současnosti je u nás registrováno 30 center AR, jen v Praze 7 (3 státní a 4 nestátní). Od ledna 2007 je povinností vyplňovat národní registr AR, který umožní kontrolu výsledků a srovnání s dalšími evropskými pracovišti.
Co označujeme jako metody asistované reprodukce?
Jsou to veškeré léčebné postupy a techniky, při kterých manipulujeme s gametami (oocyty a spermiemi).
První známé úspěšné umělé oplodnění vykonal a popsal John Hunter již v roce 1799, kdy vpravil semeno hypospadického muže ženě do pochvy. Nejznámější je však nepochybně první dítě „ze zkumavky“ (IVF-ET – in vitro fertilitace a embryotransfer), Luise Brown, která v letošním roce slaví své třicáté narozeniny. Narodila se ve Velké Británii a jejími vědeckými otci byli prof. R. Edwards a prof. P. Steptoe. U nás se první dítě po IVF-ET narodilo v roce 1984. Česká republika je známa evropskou prioritou porodu chlapce v roce 1982 po metodě GIFT, při které se laparoskopicky zavádějí gamety do vejcovodu ženy.
První dítě po zavedení rozmražených embryí (KET – kryoembryotransfer) se narodilo v roce 1983 v Anglii (u nás v roce 1995) a první dítě po zavedení spermie přímo do ooplazmy (ICSI – intracytoplazmatická injekce spermie) v Belgii v roce 1992 (u nás v roce 1996). V roce 1997 byl u nás zahájen program darovaných oocytů a embryí a od roku 2001 se začíná využívat genetické vyšetření embrya před zavedením do dělohy (PGD – preimplantační genetická diagnostika).
V současnosti nejvíce využívané techniky AR jsou IUI (intrauterinní inseminace) a IVF-ET. Mikromanipulační metody, které se při IVF-ET běžně používají, jsou ICSI, AH (asistovaný hatching) a KET. Při mužské azoospermii lze získat spermie z nadvarlete (MESA – mikrochirurgická aspirace spermií) nebo z varlete (TESE – testikulární extrakce).
Indikací pro léčbu poruch plodnosti medodami AR jsou u ženy: tubární faktor, ovariální faktor, endometrióza, imunologické a idiopatické příčiny; u mužů: patologický spermiogram, který může být způsoben hormonálně, bakteriální či virovou infekcí, imunologicky, geneticky, varikokélou či pozdě řešeným kryptorchismem. V řadě případů zůstává příčina mužské patospermie, při které je nutná AR, nejasná.
V České republice hradí pojišťovny ženám od 21 do 39 let (při absolutním tubárních faktoru sterility od 18 let) 3 cykly IVF-ET. Zdravotní pojišťovny nehradí ICSI, AH, prodlouženou kultivaci embryí, kryokonzervaci gamet a embryí, KET, MESA a TESE.
IVF v ÚPMD bylo prvním centrem asistované reprodukce v Praze, a to od roku 1986 do roku 1995. Nové centrum vzniklo v roce 2005.
Výhody našeho státního zařízení spatřujeme především v komplexnosti péče o pacienty. ÚPMD plně zajišťuje mezioborovou spolupráci, která je nutná při péči o partnerský pár s poruchou plodnosti (gynekolog, genetik, imunolog, internista, endokrinolog, sexuolog, androlog), laboratorní a operační zázemí, péči o těhotné po AR do porodu i v průběhu šestinedělí a neonatologickou péči o narozené děti.
Naše pracoviště rovněž spolupracuje s onkology ve snaze zachovat reprodukci onkologickým pacientům.
MUDr. Jitka Řezáčová, vedoucí centra IVF-ÚPMD
Ústav pro péči o matku a dítě
Podolské nábřeží 157, 147 00 Praha 4
e-mail: jitka.rezacova@seznam.cz
Kontrolovaná ovariální hyperstimulace v asistované reprodukci (KOH)
MUDr. Jitka Řezáčová
Farmakologickým potlačením atrézie vznikají mnohočetné zralé tzv. kodominantní folikuly. Cílem KOH je získat punkcí při IVF větší počet oocytů, následně větší počet embryí k embryotransferu, eventuálně ke kryokonzervaci.
Více než 80 let trval výzkum a dalších 50 let výroba léků k indukci ovulace. V současnosti používané jsou antiestrogeny (Clomifen citrate), inhibitoty aromatáz (Letrozol) a gonadotropiny. Nejúčinnější k navození KOH se ukázaly gonadotropiny.
První gonadotropiny hMG se získávaly z moči menopauzálních žen a pod firemním názvem Pergonal (FSH + LH 1 : 1) se začaly užívat k léčebným účelům od roku 1957 (nyní Merional, pouze FSH – Fostimon), k vyvolání ovulace se od roku 1958 používá těhotenský gonadotropin hCG pod názvem Profasi (nyní Pregnyl). Následovaly menopauzální vysoce čištěné gonadotropiny (Menopur) a konečně zlatý standard současné KOH a indukce ovulace – rekombinantní FSH (Gonal pen, Puregon pen), rekombinantní LH (Luveris) a rekombinantní hCG (Ovitrelle).
Při uspokojivém hormonálním navození růstu a zrání folikulů zůstával problém s jejich předčasnou luteinizací. Ten byl poměrně úspěšně vyřešen v roce 1982, kdy se v praxi začaly používat agonisté GnRh, vyvolávající supresi endogenních pulzů LH. Nejdříve se podávaly nazální preparáty (Synarel), později depotní injekční formy (Decapeptyl, Zoladex dep, Diferelin).
V roce 1991 se začaly klinicky využívat i antagonisté GnRH (Cetrotid, Orgalutran).
Při hormonální přípravě před asistovanou reprodukcí je na lékaři, aby zvolil způsob stimulace, doporučil pacientovi nejvhodnější gonadotropiny a určil jejich dávky.
Přípravu před IVF lze rozdělit na cykly nativní (punce jednoho folikulu), modifikované nativní (punkce 1–2 folikulů), mírně hormonálně stimulované (punkce 2–7 folikulů) a konvenčně stimulované (8 a více folikulů).
Stimulační protokol volí lékař na základě předchozího vyšetření pacientky. Důležitými kritérii je její věk, hormonální hladiny, ultrazvukové vyšetření a zkušenost z dřívější stimulace.
Nejběžnějšími jsou stimulace s gonadotropiny s využitím agonistů (krátký a dlouhý stimulační protokol) a s využitím antagonistů. Rekombinantní gonadotropiny jsou zlatým standardem pro minimální riziko alergické reakce, snadnou aplikaci a vyšší šanci na početí při nízkých dávkách. Přesto se v praxi stále využívají močové preparáty, jejichž výroba je výrazně levnější a jsou plně hrazené pojišťovnou.
Během vlastní stimulace musí být sledován růst folikulů a výška endometria vaginální ultrazvukovou sondou. V indikovaných případech se sledují hladiny estradiolu v krvi. Ovulace se časuje aplikací hCG (Ovitrelle, Pregnyl). Za 34–36 hodin po aplikaci hCG se provádí odběr oocytů transvaginálně pod UZ kontrolou v krátkodobé celkové narkóze. Embryotransfer jednoho, maximálně dvou embryí následuje za 48–120 hodin po odběru oocytů.
Nejdůležitějšími riziky KOH je ovariální hyperstimulační syndrom a vícečetné těhotenství. K minimalizaci těchto rizik se doporučuje mírný stimulační protokol, rekombinantní gonadotropiny, antagonisté GnRH a transfer maximálně dvou embryí.
Preimplantační genetická diagnostika: přínosy, rizika
RNDr. Jana Rutarová, Ph.D.
Preimplantační genetická diagnostika (PGD) je metoda založená na vyšetření časného stadia embrya na úrovni jedné buňky. Přímo navazuje na metodiku IVF, samostatně ji provádět nelze. Vyšetřují se především páry, u kterých hrozí riziko přenosu geneticky podmíněné choroby. Cílem je výběr embrya bez prokázané genetické vady ještě před jeho zavedením do dělohy pacientky. Embrya, u kterých je detekována genetická abnormalita, jsou vyřazena.
Pro vyšetření vyvíjejícího se plodu můžeme použít řadu metod (např. amniocentézu, odběr choriových klků, ultrazvuk), metodika PGD nám však umožňuje molekulární a cytogenetickou analýzu ještě před počátkem těhotenství. Během kultivace embryí v médiu lze analyzovat genetický materiál z odebraných pólových těles nebo z blastomer vícebuněčného embrya, eventuálně z buněk trofoblastu blastocyty. Nejčastěji je používaná technika biopsie 1–2 blastomer u 3 dny starého embrya (8 buněk) (obr. 1).
Obr. 1. Osmibuněčné embryo 72 hodin po oplození 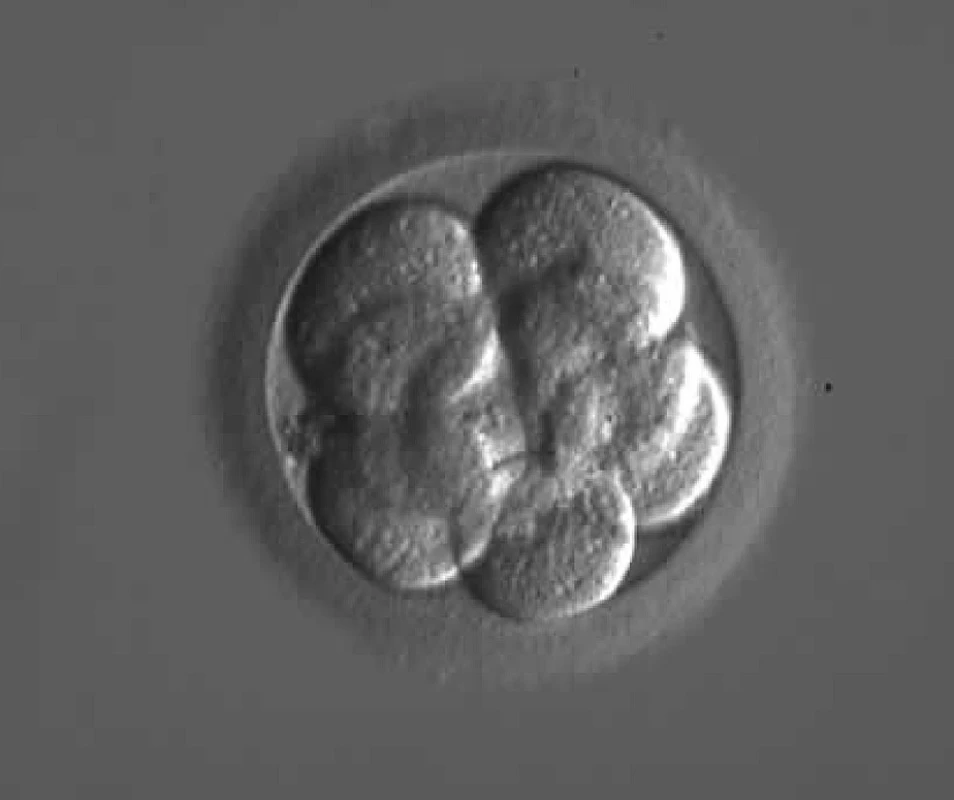
Kromě PGD rozlišujeme PGS (preimplantační genetický skrínink), kdy analyzujeme chromozómy zodpovědné za nejnebezpečnější aneuploidie slučitelné se životem (chromozómy č. 21, 18, 13, X, Y). Tato metoda je používaná pro výběr „zdravých“ embryí pro transfer u neplodných párů. Indikacemi pro PGD/PGS je vyšší věk pacientky (nad 35 let), prokázaná translokace nebo jiná chromozómová aberace u jednoho z páru, genetická vada plodu v předchozí graviditě, opakované potraty v časném stadiu těhotenství, opakovaně neúspěšné IVF atd. Prvním krokem pro pár s indikací pro PGD/PGS je pohovor s klinickým genetikem, který rozhodne, zda je vyšetření embryí pro daný pár vhodné. Následuje běžná hormonální stimulace vaječníků a odběr oocytů, které jsou oplozeny spermiemi metodou ICSI (intracytoplazmatická injekce spermií). Třetí den po oplození jsou vybrána embrya s 6–8 buňkami a provedena biopsie 1–2 blastomer mikromanipulační technikou. Blastomery se fixují na sklíčko a odesílají do genetické laboratoře, kde se vizualizují chromozómy, a provádí vlastní genetická analýza. Čtvrtý až pátý den po oplození se vybraná embrya podle výsledků genetického vyšetření transferují do dělohy pacientky.
Mezi nejčastěji vyšetřované aberace patří aneuploidie pohlavních chromozómů (Klinefelterův nebo Turnerův syndrom, popř. různé mozaiky) a trizomie somatických chromozómů č. 21, 18 a 13, (obr. 2). Při PGD lze detekovat monogenní choroby vázané na X (selekce pohlaví), např. hemofilie, syndrom fragilního X, Duchenneova muskulární dystrofie, nebo choroby autozomálně dominantní (myotonická dystrofie, Huntingtonova chorea) či recesivní (cystická fibróza, talasémie, srpkovitá anémie). Aneuploidie se obecně analyzují technikou FISH (fluorescenční in situ hybridizace), při které jsou chromozómy inkubované s komerčně vyráběnou značenou sondou a odečítány pod fluorescenčním mikroskopem. Pro diagnostiku některých monogenních chorob nebo mutací se využívá metoda PCR (polymerázová řetězová reakce), při níž je namnožen a vizualizován konkrétní úsek DNA.
Obr. 2. FISH chromozómů 13, 18 a 21 (3 × 21) 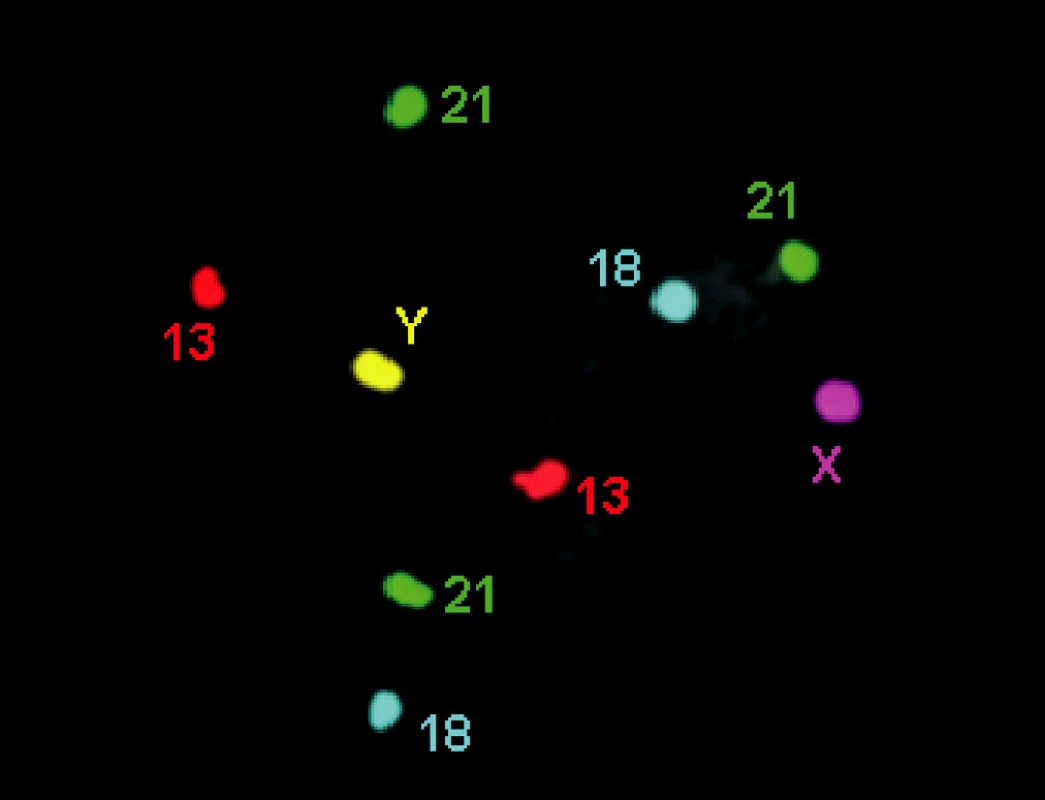
Metoda PGD je velmi technicky náročná, přináší řadu rizik a nevýhod. Během biopsie a fixace blastomer může dojít k jejich ztrátě. Osmibuněčné embryo je pluripotentní a dokáže kompenzovat ztrátu několika buněk, ale může být poškozeno a nebude se vyvíjet. Problémem je také častý mozaicismus lidských embryí, takže výsledek z jedné buňky nemusí dávat obraz o celém embryu. Zatím dokážeme analyzovat jen omezené množství chromozómů. Nemáme žádné informace o zbylých chromozómech embrya. Během analýzy FISH a hlavně při PCR může dojít ke kontaminaci vzorku a obtížná je i interpretace výsledků z jedné buňky. V neposlední řadě musíme vzít v úvahu i etickou stránku věci (výběr pohlaví, HLA typizace, výběr určitých vlastností) a náboženské rozdíly.
Přes všechny nevýhody je PGD přínosnou metodou, neboť snižuje riziko narození dítěte s genetickým postižením a umožňuje donosit dítě pacientkám s opakovanými aborty z genetických příčin. I když PGD nemůže nahradit amniocentézu, předvídá alespoň její výsledek, a snižuje tak stres pacientky. Zatím je to jediná metoda, která nám umožňuje nahlédnout do embrya před začátkem těhotenství, a pro některé páry jediná možnost jak počít a porodit biologicky vlastní zdravé dítě.
Děkuji především RNDr. Marcele Kosařové, Ph.D. (sanatorium Pronatal) za poskytnutí informací a obrazového materiálu.
Komplikace v IVF
MUDr. Markéta Bahníková
Mezi nejčastější komplikace v IVF zařazujeme: ovariální hyperstimulační syndrom, pelveoperitonitis po odběru oocytů, mnohočetné těhotenství, mimoděložní těhotenství, stavy zhoršující se v graviditě, časné těhotenské ztráty, torzi adnex, rupturu cysty a ovariální tumory.
Ovariální hyperstimulační syndrom
Jedná se o iatrogenní onemocnění vyvolané hormonální indukcí ovulace, antiestrogeny či gonadotropiny. Dochází k růstu a dozrávání většího počtu kodominantních folikulů se zvýšenou produkcí estradiolu, následně dochází k abnormálně vysokému počtu žlutých tělísek s nadbytkem hCG. Klinické příznaky se objevují uprostřed luteální fáze jako důsledek hCG podaného k vyvolání ovulace, nebo na začátku těhotenství jako výsledek uplatnění endogenního hCG.
Tři kritéria (postačuje splnění alespoň jednoho z nich):
E2 > 4000 pg/ml, počet folikulů > 35, E2 více než 2000 pg/ml a počet folikulů ≥ 20.
Hyperstimulační syndrom dělíme na: 1. časný OHSS – 3–7 dní po preovulační aplikaci HCG, koreluje s koncentrací E2 a věkem ženy a 2. pozdní OHSS – 12–17 dní po injekci HCG, souvisí s počtem vzniklých těhotenských váčků.
Mezi rizikové faktory OHSS zařazujeme: nižší věk, anovulační oligomenorea, PCO, hyperestrinismus, četné drobné folikuly v době aplikace hCG, užití analogů GnRH, hMG, hCG, vznik koncepce, zejména vícečetné těhotenství
Frekvence: 1. st: 20–40 % , 2. st: 2–5 %, závažné: pod 1 %.
Příznaky: zvětšená ovaria, ascites, hydrothorax, perikadiální výpotek, anasarka, hypovolémie, hemokoncentrace, arteriální hypotenze, hyperkinetická cirkulace, oligurie. Kompenzační mechanismy: zvýšená aktivita systému renin – angiotenzin – aldosteron, zvýšení hladiny noradrenalinu, zvýšení hladiny antidiuretického hormonu, VK, omezený průtok krve ledvinami, zvýšení hladiny prostaglandinů (PGE2, PGI2), VD, hyperkoagulační stav, projevy útlaku orgánů výpotkem (srdce, plíce, dutina břišní), zvýšení jaterních testů, zvýšená hladina 17-ß-estradiolu, poruchy metabolismu elektrolytů.
Klinické obtíže provází pelvialgie, nauzea, vomitus, diarrhoe, dyspnoe.
Etiologie onemocnění není dosud zcela objasněna. Vznik je podmíněn užitím hCG, hMG, GnRH analog ve stimulaci ovulace, za rozhodující je považován vliv nadbytečného hCG a porucha permeability kapilár (zvýšená propustnost pro proteiny, elektrolyty, únik tekutin do extravaskulárního prostoru).
Za příčinný se považuje faktor pocházející z ovarií tzv. VEGF – zvyšuje permeabilitu krevních kapilár, podporuje proliferaci endoteliálních buněk a angiogenezi, dimérický glykoproteid vyskytující se ve 4 izoformách, jeho exprese se zvyšuje při ovulaci souběžně s transformací deciduy.
OHSS diagnostikujeme na základě znalosti stimulace ovarií, užití gonadotropinů/antiestrogenů + LH pík/hCG k indukci ovulace. Pacientka má bolesti břicha, dyspnoe; UZ: zvětšená ovaria 10–15 cm mnoha cystami velikosti 3–6cm, ascites, laboratorně vzestup hematokritu, mírná leukocytosu. Tento stav většinou vzniká 2–3 dny po OPU/ovulaci, až týden po ovulaci.
V rámci diferenciální dg. odlišujeme: ovariální tumor – odlišná anamnéza, infekce po odběru oocytů – febrilie 1. až 2. den!!! a jiná závažná choroba – appendicitis, perforace duodenálního vředu.
Rozdělení dle závažnosti: Golanova klasifikace (1989).
mírný: ovaria 5–10 cm
stupeň 1: abdominální tenze a dyskomfort 8–23 %
stupeň 2: dtto + nauzea, zvracení, průjem
střední: ovaria větší než 10 cm
stupeň 3: + UZ ascites 0,5–1 %
těžký: ovaria větší než 12 cm
stupeň 4: + klinicky zjevný ascites/pleurální výpotek, dypnoe
stupeň 5: + hemokoncentrace, zvýšená viskozita krve, poruchy elektrolytového metabolismu, renální selhání
HTC: více 4 5% nebo 30 % nad výchozí hodnotu, leu více 15 tis. Ql, clearence kreatininu více = 50 ml/min, oligurie.
Kritická forma OHSS dle Navota: Ohrožen život pacientky.
HTC: více 55 %, leu více 35 tis./ql, clearance kreatininu méně 50 ml/min, ledvinné selhání, příznaky tromboembolie, sy respiračního distress dospělých (ARDS), velikost ovarií není rozhodujícím kritériem.
Cílem léčby je předcházení vzniku kritického OHSS a závažných komplikací.
Přínosné léčebné postupy:
mírný + střední stupeň OHSS odezní spontánně, 2 až 3 týdny, nevyžaduje hospitalizaci, PN, klid na lůžku, pitný režim, antiemetika, analgetika.
těžký stupeň: konzervativní léčba při hospitalizaci, UZ malé pánve, KO, TA, urea, kreatinin, celkové bílkoviny, koagulační parametry, clearence kreatininu při výrazné oligurii, tělesná váha, obvod břicha, P + V tekutin denně, kontrola krevních stanovení 1–2× týdně, analgetika, elektrolyty, albumin, plazma, plazmaexpandery 500–1000 ml/24 hod., heparin/nízkomolekulární hepariny k prevenci trombózy, dostatek tekutin – p.o x infuze vedou ke zvýšenému úniku tekutin do 3. prostoru, roztoky bez kalia (oligurie!) – během celého dne, sledujeme mineralogram, CAVE: ne Ringerův roztok s laktátem!!!, analgetika, antiemetika, dieta s bílkovinnými přídavky šetřící játra, hepatoprotektiva, paracentéza: vaginálně/transabdominálně, 1–2 litry, 30–40 g/l ascitu, až v případě těžkých subjektivních stesků pacienta, nejedná se o kauzální způsob léčby, ascites se většinou objeví za 1 až 2 dny v původním rozsahu, retransfundace punktované ascitické tekutiny zpět do žíly pacientky.
Zbytečné či škodlivé postupy: Operujeme jen z vitální indikace/torze, rpt. ovaria, GEU, nepodáváme warfarin × gravidita! Nepodáváme diuretika (zhoršují hypovolémii a hemokoncentraci, zhoršení renálních funkcí), neslaná dieta, časté UZ kontroly ovarii + ascitu × váha + objem břicha pacientky, Inhibitory syntézy prostaglandinů (eliminace kompenzačního dilatačního působení na krevní průtok ledvinami).
CAVE: reálné riziko přehlédnutí GEU či koincidence IUG + GEU!!!
Prognóza: OHSS se upraví za 2–3 týdny u všech pacientek. Vzácně popisovány případy úmrtí v důsledku embolizace při hyperkoagulačním stavu.
Prevence: monitorování efektu stimulace (FSH, hMG, klomifen) od 5., resp. 7. dne: UZ folikulometrie, hladina 17 ß E2. Zajímáme se o hyperstimulace v předcházejícím cyklu, PCOs formace 8 a více drobných časných antrálních folikulů.
Step down dávky gonádotropínů, při OPU – 100 ml 20% Alb i.v., nepodání HCG k indukci ovulace, „coasting“ – vysazení stimulace gonadotropiny při nálezu příliš mnoha rostoucích foliklů, odlehčovací punkce z jednoho ovaria, dokončení cyklu odběrem oocytů pro IVF (po předchozí aplikaci HCG indukční dávky) + kryokonzervace všech embryí, 6 dní před odběrem oocytů a 2 dny po odběru nechráněný pohlavní styk! Výhledově podání LH namísto HCG k indukci dozrání oocytů (kratší poločas). K podpoře nidace nepodávat HCG, ale progesteron (mikronisované gestageny).
Těhotenství po asistované reprodukci
MUDr. Pavel Darebný
Moderní doba s sebou kromě mnohých vymožeností přináší i některé stinné stránky. Narůstající počet párů s poruchou plodnosti k nim bezpochyby patří. Jeden z 5 párů trpí během svého života poruchou plodnosti. Poruchy plodnosti mohou mít různou etiologii. Základní dělení rozlišuje poruchy plodnosti ženské etiologie (tubární, ovariální dysfunkce, endometrióza a další), mužské etiologie, kombinované etiologie a nejasné příčiny.
Mezi metody asistované reprodukce, které v léčbě neplodnosti používáme, řadíme časovaný pohlavní styk, intrauterinní inseminaci (IUI), in vitro fertilizaci (IVF) s následným ebryotransferem (ET), IVF s dárcovskými oocyty či spermiemi.
Výsledkem našeho úsilí je pak 7 % těhotenství, která vzniknou díky léčbě neplodnosti, a z toho 3 % přímo po asistované reprodukci. Mezi prognostické faktory úspěšnosti léčby neplodnosti řadíme na prvním místě věk matky, dále pak věk otce, expozici matky tabákovému kouři, obezitu, podvýživu, předchozí těhotenství a porod, kvalitu transferovaných embryí.
Ke vzniku klinické gravidity dojde v průměru po 1/3 ET, KET. Z toho 70 % končí porodem zdravého dítěte, 20 % abortem, 6 % ektopickou graviditou, do zbylých 4 % řadíme indukované aborty, porod mrtvého plodu atd.
Standardní diagnostika těhotenství, které vznikne po asistované reprodukci, probíhá tak, že po IUI stanovujeme 18. den hladinu hCG, za další týden provádíme dg. UZ vaginální vyšetření. Po ET stanovujeme hladinu hCG 14. den, a rovněž za týden provádíme dg. UZ vaginální vyšetření.
Mezi časné komplikace těhotenství po IVF řadíme jednak spontánní abort, který je 2× častější než po přirozené koncepci, extrauterinní graviditu (12× častější než při přirozené koncepci) a vícečetnou graviditu (1 : 5 vs. 1 : 80 u spontánních gravidit). Mezi pozdní komplikace řadíme VVV plodu, preeklampsii, těhotenstvím indukovanou hypertenzi, GDM, placenta praevia, předčasný porod, porod s.c. Mezi VVV po asistované reprodukci řadíme zejména u vícečetných gravidit rozštěpy neurální trubice, atrézie GIT, dále po metodách ICSI pro male factor sterility hypospadii.
Problematika předčasného porodu po asistované reprodukci úzce souvisí s četností gravidity. Jednočetné gravidity v 85–90 % trvají déle než 37 týdnů. U dvojčetných gravidit trvá 40–45 % gravidit déle než 37 týdnů, 25 % z dvojčetných gravidit trvá méně než 34 týdnů.
Rovněž četnost porodů císařským řezem je u gravidit po asistované reprodukci vyšší. Více než 90 % vícečetných gravidit končí porodem císařským řezem, u jednočetných gravidit končí císařským řezem 25–30 %.
Průběh těhotenství po asistované reprodukci se částečně liší od průběhu spontánního těhotenství. V období do 10 týdnů těhotenství provádíme vaginální UZ jednou za 7–10 dní. Ve 13. týdnu je standardně prováděn kombinovaný skrínink, tak jako u spontánních gravidit. Přibližně do 13. týdne je podávána hormonální podpora pacientkám po asistované reprodukci. V 16 týdnu těhotenství provádíme triple test, ve 21 týdnu těhotenství standardní UZ skrínink, ve 24 týdnu těhotenství OGTT, ve 30 týdnů těhotenství UZ skrínink.
Závěrem tedy většina těhotenství po IVF jsou nekomplikovaná těhotenství, která končí narozením zdravého dítěte, ale těhotenství po asistované reprodukci jsou asociována s větším množstvím porodnických a perinatologických komplikací, s větším rizikem kongenitálních abnormalit, většina porodnických a pediatrických komplikací, souvisejících s IVF, jsou důsledkem vícečetných těhotenství.
Centrum asistované reprodukce ÚPMD Podolí nabízí unikátně komplexní péči o pacientky. Centrum zahrnuje dvě prenatální ambulance pro pacientky po IVF. V ÚPMD mají těhotné po asistované reprodukci k dispozici konziliární vyšetření internistou-diabetologem, standardní prenatální diagnostiku (vč. CVS, AMC, genetika), komplexní laboratorní zázemí, vedení porodu, špičkovou perinatologickou péči.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Galektiny v dlaždicových karcinomech hlavy a krku
- KNIHY
- Hiátová hernie a Barrettův ezophagus, četnost výskytu příznaků poruchy a komplikací
- Funkce eozinofilního granulocytu
- Sumoylizace v regulaci genové exprese
- Nejstarší pleiomorfní hormon – melatonin
- Dendritické buňky ve virové infekci
- Primárny B-bunkový non-Hodgkinov lymfóm Burkittovského typu: popis prípadu s typickými klinickými prejavy
- Spolek lékařů českých v Praze
- Patogeneticky komplikovaný případ osteoporózy u mladého muže
- Průvodní list k pitvě na soudním lékařství
- Z historie „jubilejního pavilonu“ v pražské všeobecné nemocnici
- Spolek lékařů v Plzni
- Racionalita a iracionalita v medicíně a v životě
- Udělení Cen předsednictva čLS JEP za nejlepší knižní publikace a odborné články v roce 2007
- ABSTRAKTA
- Bochdalkův den
- Zemřel doc. MUDr. Pavel Fiala, CSc.
- MVDr. Radslav Kinský 1928–2008
- LAUREÁTI NOBELOVY CENY
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zemřel doc. MUDr. Pavel Fiala, CSc.
- Průvodní list k pitvě na soudním lékařství
- ABSTRAKTA
- Galektiny v dlaždicových karcinomech hlavy a krku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



