-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ateroskleróza – indikátor liečby pacienta s diabetes mellitus 2. typu
Atherosclerosis – indicator for treatment of patient with type 2 diabetes mellitus
Knowledge of physiological and pathophysiological processes in the regulation of glucose levels has brought new treatment options and new antidiabetics: glucagon-like peptide 1 receptor agonists (GLP1 RA) and sodium glucose cotransporter 2 (SGLT2i) inhibitors. Recently published prospective randomized studies have demonstrated their significant cardiovascular benefits without the risk of hypoglycemia and with a decrease or neutral effect on weight. The results of these studies were the reason for the publication of the new consensus of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). When choosing antidiabetic treatment, the ADA/EASD places special emphasis on reducing cardiovascular (CV) risk and body weight, low risk of hypoglycemia, but also on reducing the progression of renal complications. The position of metformin as a first-line medication does not change, as there is currently insufficient scientific evidence that metformin should not be the drug of the first choice. However, in patients at very high risk of CHD, combination therapy with SGLT2i or GLP1 RA with metformin should be initiated immediately.
Keywords:
Body weight – glucagon-like peptide 1 receptor agonists – hypoglycemia- macrovascular complications – sodium- glucose cotransporter 2 inhibitors – type 2 diabetes
Autoři: Katarína Rašlová 1,2
Působiště autorů: Metabolické centrum MUDr. Kataríny Rašlovej s. r. o., Bratislava 1; Koordinačné centrum pre familiárne hyperlipoproteinémie, SZU v Bratislave 2
Vyšlo v časopise: AtheroRev 2021; 6(2): 90-94
Kategorie: Přehledové práce
Souhrn
Poznatky o fyziologických a patofyziologických procesoch v regulácii hladiny glukózy prinieslo nové možnosti liečby a nové antidiabetiká: agonisty receptora glucagon-like peptide 1 (GLP1 RA) a inhibítory sodium-glukózového kotransportéra 2 (SGLT2i). Nedávno publikované prospektívne randomizované štúdie preukázali ich významné kardiovaskulárne benefity bez rizika hypoglykémie a s poklesom alebo neutrálnym efektom na hmotnosť. Výsledky týchto štúdií boli dôvodom publikovania nových odporúčaní American Diabetes Association (ADA) a European Association for Study Diabetes (EASD). Pri výbere antidiabetickej liečby dáva konsenzus ADA/EASD špeciálny dôraz práve na zníženie kardiovaskulárneho (KV) rizika a hmotnosti, nízke riziko hypoglykémie, ale aj na pokles progresie obličkových komplikácií. Postavenie metformínu ako lieku prvej línie sa nemení, lebo v súčasnosti nie sú dostatočné vedecké dôkazy o tom, že metformín nemá byť liekom prvej volby. Avšak u pacientov s veľmi vysokým KV-rizikom sa má rovno začať kombinovaná liečba SGLT2i alebo GLP1 RA spolu s metforminom.
Klíčová slova:
agonisty receptora glucagon-like peptide 1 – diabetes mellitus 2. typu – hmotnosť -hypoglykémia – inhibítory sodium-glukózového kotransportéra 2 – makrovaskulárne komplikácie
Úvod
Diabetes mellitus 2. typu (DM2T) je ochorenie, ktorého základnou patofyziologickou poruchou je inzulínová rezistencia v pečeni a svaloch a s tým súvisiace zlyhanie funkcie B-buniek pankreasu. Významnú úlohu pri vývoji DM2T predstavujú akcelerovaná lipolýza v tukovom tkanive, porucha funkcionality enteroendokrinných buniek (EEB), ktoré sa nachádzajú pozdĺž celého gastrointestinálneho traktu, alfa-bunky pankreasu, ktoré zvýšene produkujú glukagón, obličky a mozog [1].
Epidémia DM2T narastá celosvetovo a súvisí to hlavne so stúpajúcim výskytom obezity. Podľa odhadov International Diabetes Federation (IDF) do roku 2045 dosiahne počet diabetikov 2. typu 629 miliónov [2].
Nedostatočne kompenzovaný DM2T je spojený s rizikom mikrovaskulárnych komplikácií a závažný zdravotnícky problém predstavujú komplikácie makrovaskulárne. Pacienti s DM2T majú viac ako 2-násobné riziko mozgovej a 2 - až 4-násobne vyššie riziko infarktu myokardu (IM) ako osoby bez diabetu [3].
Včasné zahájenie liečby u DM2T zlepšuje celkovú metabolickú kontrolu a prevenciu v rozvoji mikro - a makrovaskulárnych komplikácií [4].
Kardiovaskulárne riziko u diabetes mellitus 2. typu
Prospektívne populačné štúdie z rôznych krajín sveta presvedčivo ukázali, že DM2T možno považovať za ekvivalent ischemickej (koronárnej) choroby srdca (ICHS). Počas päťročného sledovania viac ako 91-tisíc mužov lekárov v USA mali diabetici bez potvrdenej ICHS na začiatku štúdie rovnaké riziko úmrtia z KV-príčin ako tí muži, ktorí diabetes nemali a už prekonali infarkt myokardu. Rovnaké výsledky ukázali štúdie z Fínska, Dánska a Škótska [5–8].
Komplexné informácie o vysokej KV-mortalite a morbidite u DM2T boli príčinou toho, že Food and Drug Administration (FDA) od r. 2008 žiada potvrdenie KV-bezpečnosti pre novo registrované antidiabetiká. Z toho dôvodu je povinnosťou farmaceutického priemyslu robiť morbiditno-mortalitné štúdie.
Využitie poznatkov o fyziologických a patofyziologických procesoch v regulácii hladiny glukózy prinieslo nové možností liečby a nové antidiabetiká: agonisty receptora glucagon-like peptide 1 (GLP1 RA) a inhibítory sodium-glukózového kotransportéra 2 (SGLT2i).
Nedávno publikované prospektívne randomizované štúdie preukázali ich významné KV-benefity bez rizika hypoglykémie a s poklesom alebo neutrálnym efektom na hmotnosť. Výsledky týchto štúdií boli dôvodom publikovania nových odporúčaní American Diabetes Association (ADA) a European Association for Study Diabetes (EASD). Ich konsenzus dáva špeciálny dôraz pri výbere antidiabetickej liečby práve na zníženie KV-rizika a hmotnosti, nízke riziko hypoglykémie, ale aj na pokles progresie obličkových komplikácií [9,10].
Postavenie metformínu ako prvolínovej liečby sa nezmenilo z viacerých dôvodov:
kardiovaskulárna protektivita metformínu je podporená 3 randomizovanými štúdiami a množstvom observačných dát
početné potenciálne mechanizmy účinku podporujú koncepciu kardiovaskulárnej ochrany
súčasná liečba metformínom môže zvýšiť účinok inkretínových terapií na KV-ochorenie (KVO)
metformín sa môže kombinovať s akýmkoľvek iným antidiabetikom [11]
Dve najmladšie skupiny antidiabetík GLP1 RA a SGLT2i zaraďuje konsenzus ako liečbu, ktorá by mala byť pridaná k metformínu hneď v druhej línií.
Inhibítory sodium-glukózového kotransportéra 2 (SGLT2i)
Obličky majú kľúčovú úlohu v zabezpečení homeostázy glukózy. Produkujú glukózu v procese glukoneogenézy, využívajú glukózu ako zdroj energie a v proximálnom tubule dochádza k jej spätnej reabsorbcii. Obličky filtrujú približne 180 g glukózy denne a takmer celé toto množstvo sa u zdravého človeka spätne reabsorbuje pomocou SGLT2, ktorý sa až v 90 % podieľa na spätnej reabsorbcii sodíka. SGLT2i znižujú hladinu glukózy tým, že zvyšujú jej exkréciu močom. Ich účinok závisí na koncentrácii glukózy v krvi a glumerulárnej filtrácii. Rovnomerne s účinkom liečby a tým ako poklesom hladiny glukózy v krvi dochádza tiež ku zníženiu jej vylučovania močom. Mohlo by sa tiež povedať, že SGLT2i majú samoregulujúci efekt na hladinu glukózy v krvi, čím sa vysvetľuje, prečo majú tieto lieky nízke riziko hypoglykémie [12].
Anti-aterosklerotické efekty SGLT2i sa študovali na experimentálnych modeloch ApoE-/ - myši, Ldlr-/ - myši a králika. Štúdie na modeli ApoE-/ - myši ukázali, že kanagliflozín a empagliflozín redukovali proces aterosklerózy znížením hladiny MCP1 (Monocyte Chemoattractant Protein 1) a VCAM1 (Vascular Cell Adhesion Molecule 1), empagliflozín tiež znížil ICAM1 (Intercellular Cell Adhesion Molecule 1), TNFα (Tumor Necrosis Factor alpha ) a NADPH oxidázové subjednotky (Nicotinamide Adenine Dinucleotide PHosphat), čím sa znížila endotelová dysfunkcia.
Po liečbe empagliflozínom došlo ku zmenšeniu aterosklerotického plaku a zníženiu infiltrácie tukového tkaniva zápalovými bunkami. Ateroprotektivita sa dosiahla aj inhibíciou systému renin-aldosteron a sympatikovej aktivity [13].
Klinické štúdie, ktoré sledovali vplyv liečby SGLT2i na KV-morbiditu a mortalitu
Prospektívne štúdie s SGLT2i ukázali ich významný vplyv na zníženie rizika srdcového zlyhania a aterosklerózou podmienených kardiovaskulárnych komplikácií.
V roku 2015 boli publikované výsledky prvej štúdie s SGLT2i – EMPA-REG OUTCOME, ktorá porovnávala efekt empagliflozínu voči placebu na výskyt a úmrtnosť na KV-príhody u diabetikov 2. typu [14].
Primárnym cieľom bolo hodnotenie vplyvu liečby na KV-mortalitu, nefatálny srdcový infarkt a nefatálnu mozgovú cievnu príhodu (3P MACE), pričom empagliflozín znížil toto riziko o 14 %.
Empagliflozín v porovnaní s placebom významne znížil KVmortalitu o 38 % ako aj počet hospitalizácií z dôvodu srdcového zlyhania o 35 %. Celková mortalita v skupine pacientov liečených empagliflozínom klesla o 32 %. Táto liečba mala priaznivý efekt na pokles hmotnosti, krvného tlaku a nebola spojená s rizikom hypoglykémií.
V roku 2020 bola publikovaná zaujímavá analýza, ktorá sa pozrela na vplyv liečby empagliflozínom nielen na prvé príhody, ale na ich výskyt počas celej štúdie (4P MACE) [15]. Celkový počet príhod bol signifikantne nižší pri liečbe empagliflozínom (RR 0,78 [95% CI 0,67–0,91]; p = 0,0020), rovnako fatálny alebo nefatálny IM (RR 0,79 [95% CI 0,62–0,998]; p = 0,049;) aj kompozitný fatálny alebo nefatálny IM alebo koronárna revaskularizácia (RR 0,80 [95% CI 0,67–0,95]; p = 0,012).
Kardiovaskulárne benefity boli potvrdené tiež s kanagliflozínom v programe CANVAS [16]. Prehľad je uvedený v tab. 1.
Tab. 1. Výsledky prospektívnych placebom kontrolovaných štúdií s SGLT2i 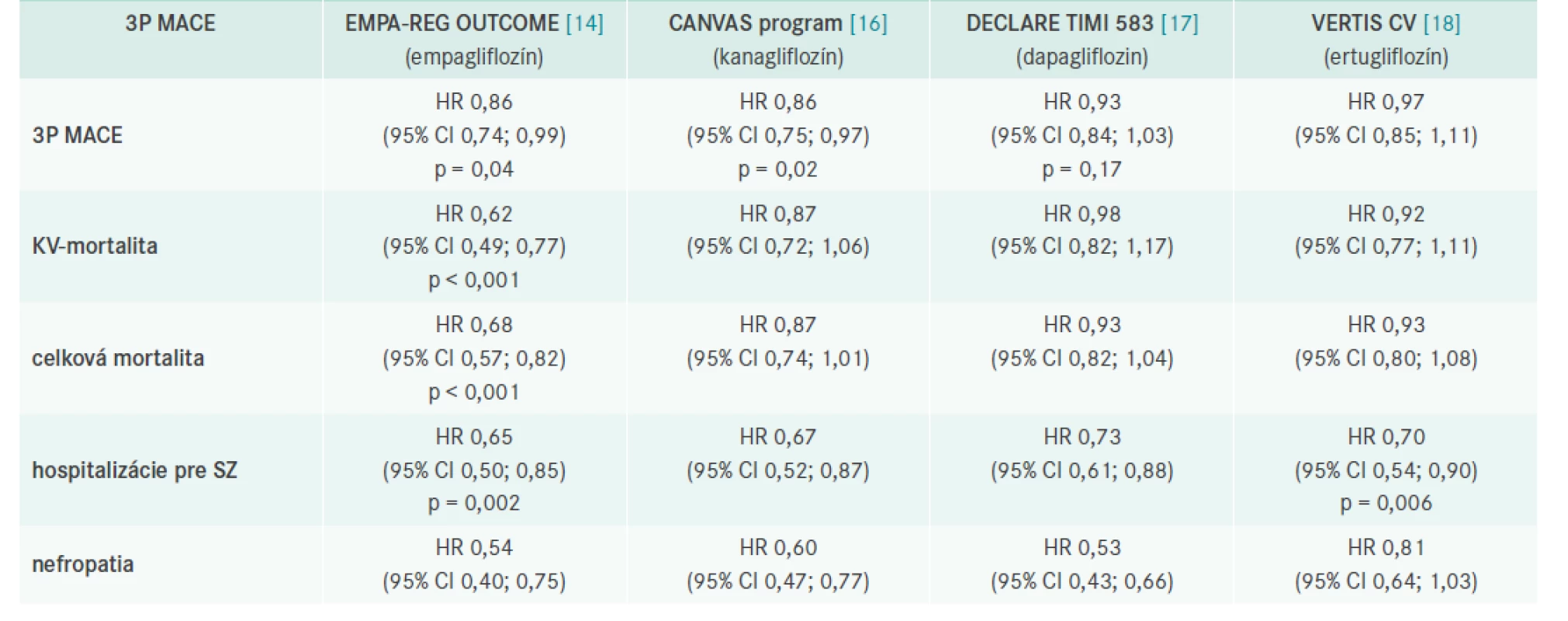
CI – interval spoľahlivosti/Confidence Interval HR – pomer rizík/Hazard Ratio Metaanalýza 3 štúdií (EMPA-REG OUTCOME, CANVAS, DECLARE), ktorá hodnotila 34 322 pacientov, ktorej cieľom bolo analyzovať, či rozdiely v základných charakteristikách týchto štúdií sú príčinou rozdielov v účinku na KV - a obličkové ochorenia, ukázala zaujímavé výsledky. SGLT2i znížili výskyt 3P MACE o 11 % (HR 0,89 [95% CI 0,83–0,96], p = 0,0014), pričom benefit bol zistený iba u tých diabetikov, ktorí už prekonali KV-príhodu. SGLT2i znížili riziko KV mortality alebo hospitalizácie pre srdcové zlyhanie o 23 % (0,77 [0,71–0,84], p < 0,0001) avšak rovnako profitovali pacienti s manifestným KV - ochorením alebo anamnézou srdcového zlyhania ako tí, ktorí tieto príhody neprekonali. SGLT2i významne znížili progresiu renálneho ochorenia o 45 % (0,55 [0,48–0,64], p < 0,0001) bez ohľadu na výskyt KV ochorenia pri zaradení do štúdie [19].
GLP1-receptorové agonisty
GLP1-receptorové agonisty (GLP1 RA) majú mechanizmus účinku, ktorý sa zakladá na poznaní funkcie inkretínových hormónov GLP1 a GIP (inzulínotropný polypeptid závislý od glukózy). Tieto hormóny sa vylučujú z tenkého čreva ako odpoveď na príjem potravy a veľmi komplexne ovplyvňujú metabolizmus glukózy: stimulujú sekréciu a syntézu inzulínu z B-buniek pankreasu v závislosti od perorálne prijatej glukózy, spomaľujú vyprázdňovanie žalúdka a znižujú chuť do jedla ovplyvnením GLP1 v mozgu, silne inhibujú sekréciu glukagónu, stimulujú natriurézu, čo má za následok spomalenie progresie nefropatie. Prirodzený GLP1 má veľmi krátke trvanie účinku (asi 2 minúty), lebo je enzymaticky rozkladaný pomocou enzýmu dipeptidyl peptidázy 4 (DPP4). GLP1 RA napodobňujú prirodzený GLP1 a sú odolné voči DPP4 enzymatickému rozkladu [20].
Charakteristika GLP1-receptorových agonistov
Od roku 2005, kedy FDA zaregistrovala exenatid ako prvý zo skupiny GLP1 RA, pribudli rýchlo ďalšie molekuly: liraglutid, semaglutid, lixisenatid, dulaglutid a albiglutid.
Podľa dĺžky účinku sa delia GLP1 RA na molekuly s krátkym alebo dlhým účinkom. Dĺžka účinku je daná predovšetkým tým, ako je molekula podobná prirodzenému GLP1, pomalou absorpciou z miesta podania, väzbou na albumín alebo integráciou v mikrokapsulách a odolnosťou voči DPP4. Pôsobenie krátko - aj dlhopôsobiacich GLP1 RA na metabolizmus glukózy sa líši mierou účinku. Pankreas je hlavným cieľovým orgánom pre pôsobenie GLP1 RA pri liečbe DM2T. Funkčné účinky v pankrease zahŕňajú na glukóze závislé uvoľňovanie inzulínu, ktoré nastáva rýchlo po orálnom príjme potravy, ako aj zvýšenie biosyntézy inzulínu, glukokinázy a glukózových transportérov. Znížením sekrécie glukagónu dochádza ku poklesu glukoneogenézy v pečeni. Na dlhodobo efektívnej liečbe diabetu sa tiež podieľa antiapoptotický účinok, zníženie stresu v endoplazmatickom retikule, prevencia oxidatívneho stresu a zníženie toxického účinku pôsobením mastných kyselín [21].
GLP1 RA s krátkym účinkom
Do tejto skupiny GLP1 RA patria exenatid a lixisenatid.
Základom molekuly exenatidu je peptid exendin 4, ktorý bol izolovaný z jaštera Gila monster a je zložený z 39 aminokyselín. Molekula exendin 4 je v 50 % identická s ľudským GLP1. Exenatid je syntetická verzia exendinu 4. Pre krátky polčas účinku sa podáva 2-krát denne pred jedlom.
Základom molekuly lixisenatidu je exendin 4, rovnako ako u exenatidu. Molekula lixisenatidu je zložená zo 44 aminokyselín a je modifikovaná zámenou prolinu za lyzín, čím sa dosiahne významná rezistencia voči štiepeniu cestou DPP4. Preto má lixisenatid dlhší účinok ako exenatid a môže sa podávať 1-krát denne [21].
GLP1 RA s dlhým účinkom
Patria sem liraglutid, semaglutid, dulaglutid, albiglutid a exenatid QW. Molekuly prvých štyroch uvedených sú v 90–97 % homologické s prirodzeným ľudským GLP1.
Liraglutid je analóg GLP1 s 97% sekvenčnou homológiou s ľudským GLP1, ktorý sa viaže na receptor GLP1 a aktivuje ho. Profil predĺženého účinku podmieňujú predovšetkým tieto mechanizmy: samoviazanie vedúce k pomalej absorpcii, naviazanie na albumín, vyššia enzymatická stabilita voči DPP4 a neutrálnej endopeptidáze, ktorá katalyzuje degradáciu viacerých peptidových hormónov a ovplyvňuje dlhý polčas premeny v plazme [22].
Semaglutid je analóg GLP1 s 94% sekvenčnou homológiou s ľudským GLP1. Podáva sa subkutánne 1-krát týždenne. Modifikáciou molekuly GLP1 formou optimálnych mastných kyselín a väzobných kombinácií sa dosiahla dlhá a revezibilná väzba na albumín, čo umožňuje subkutánne podávanie 1-krát za týždeň [22]. V súčasnosti končia klinické štúdie s perorálne podávaným semaglutidom.
Dulaglutid je agonista receptora GLP1, ktorého molekula obsahuje 2 identické disulfidovým mostíkom spojené reťazce. Každý reťazec obsahuje modifikovanú ľudskú sekvenciu GLP1 RA, ktorá je kovalentne naviazaná na fragment ťažkého reťazca Fcy – modifikovaného ľudského imunoglobulínu IgG4 prostredníctvom malého peptidového linkera. GLP1-analógová časť dulaglutidu je približne na 90 % homologická s prirodzeným ľudským GLP1. V dôsledku týchto chemických vlastností vzniká rozpustná zmes s predĺženým polčasom 4,7 dňa, čo umožňuje jej subkutánne podávanie raz týždenne. Okrem toho bola molekula dulaglutidu navrhnutá tak, aby zabránila imunitnej odpovedi závislej od Fcγ -receptora a aby znižovala jeho imunogénny potenciál [23].
Exenatid QW má predĺžený účinok, ktorý sa dosiahol tým, že molekula exenatidu sa nachádza v mikrokapsulách, ktoré po subkutánnom podaní podliehajú spontánnej hydrolýze. Počas tohto procesu sa aktívne liečivo pomaly uvoľňuje do obehu, čím sa zabezpečuje možnosť podávania 1-krát týždenne. Exenatid QW má rovnaké farmakologické vlastnosti, ako exenatid s krátkym účinkom, čo sa potvrdilo v 8 štúdiách DURATION 1–8 [23].
Klinické štúdie, ktoré sledovali vplyv liečby GLP1 RA na KV-morbiditu a mortalitu
Liraglutid, semaglutid, albiglutid a dulaglutid – dlhoúčinkujúce GLP1 RA , ktoré boli hodnotené v prospektívnych kardiovaskulárnych štúdiách, potvrdili, že u pacientov s DM2T štatisticky významne znižujú kombinované riziko úmrtia z KV-príčin, nefatálneho infarktu myokardu a nefatálnej cievnej mozgovej príhody (3-Point Major Adverse Cardiovascular Events – 3P MACE) v porovnaní s komparátorom placebom [24–26].
Prvá KV-prospektívna štúdia s GLP1 RA liraglutidom – LEADER ukázala, že diabetici, ktorí dostali liečbu liraglutidom, mali o 13 % nižšie riziko úmrtia na KV-príhodu alebo prekonania nefatálnej srdcovej alebo mozgovej príhody ako pacienti v placebovom ramene a štatisticky významne o 22 % nižšie riziko KV-mortality [27].
Všetky CVOT (CardioVascular Outcome Trial) štúdie s GLP1 RA potvrdili KV-bezpečnosť a významný pokles glykémie a HbA1c bez rizika hypoglykémie spojený s poklesom telesnej hmotnosti (tab. 2).
Tab. 2. Výsledky prospektívnych placebom kontrolovaných štúdií s GLP1 RA 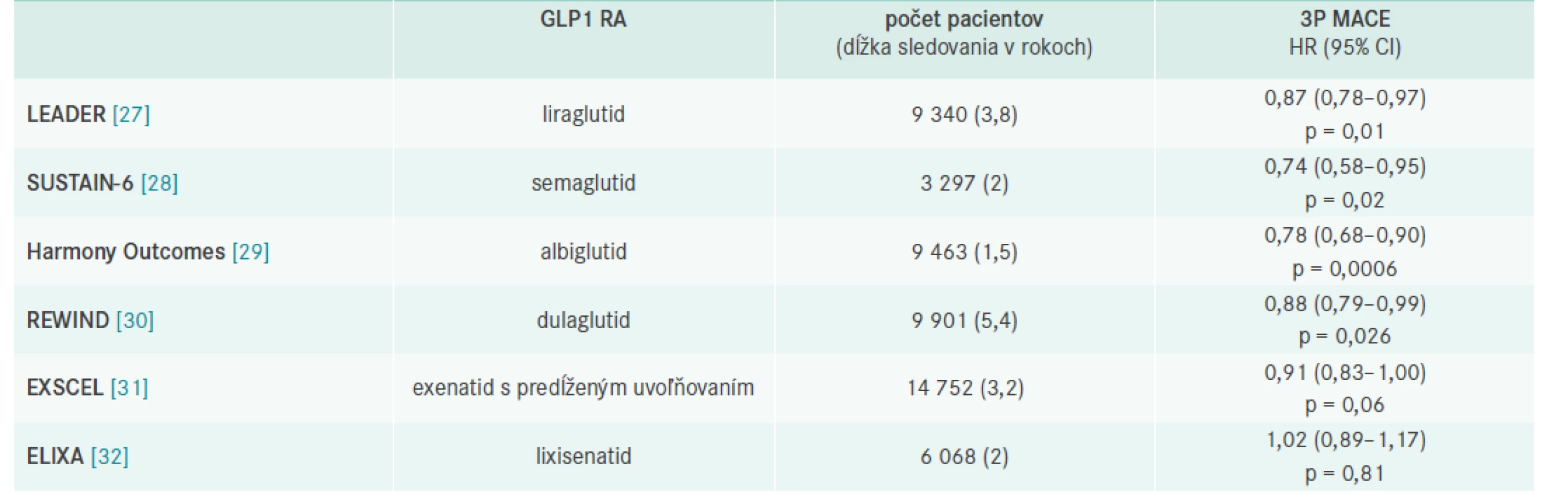
HR – pomer rizík/Hazard Ratio Štúdie s dlhoúčinkujúcimi GLP1 RA: LEADER (liraglutid), SUSTAIN-6 (semaglutid), REWIND (dulaglutid) a HARMONY (albiglutid) ukázali superioritu voči placebu a štatisticky významné zníženie rizika primárneho endpointu, ktorým bol 3P MACE (-13 %; -26 %; -12 % a -22 %, resp) [27–30].
Štúdie Exscel (exenatid s predlženým uvoľňovaním) a Elixa (lixisenatid) potvrdili KV-bezpečnosť [31,32]. Prehľad je uvedený v tab. 2.
Záver
Manažment DM2T predstavuje narastajúci komplex terapeutických možností, ktoré ovplyvňujú nielen glykémiu. Komplexný, ale aj individualizovaný prístup zameraný na ovplyvnenie KV-rizika je zásadnou podmienkou pre ovplyvnenie komplikácií DM a kvalitu života pacienta. CVOT-študie s SGLT2i a GLP1 RA pridávali skúšanú liečbu ku antidiabetickej teraHR pii (ak nebol konkrétny liek exklúznym kritériom) a väčšina pacientov užívala ICAM1 metformín. Konsenzy ADA/EASD 2018, 2019 a ESC guidelines 2019 sa líšia v názoroch autorov k tomu, či má byť metformín stále liekom prvej línie, alebo to majú byť nové skupiny antidiabetík s potvdreným KV-benefitom. Tieto postoje sú predmetom bohatých a inšpiratívnych diskusií, lebo v súčasnosti nie sú dostatočné EBM o tom, že metformín nemá byť liekom prvej volby. Avšak konsenzus ADA/EASD hovorí o tom, že u pacientov s veľmi vysokým KV-rizikom sa má rovno začať kombinovaná liečba SGLT2i alebo GLP1 RA spolu s metformínom.
doc. MUDr. Katarína Rašlová, CSc.
www.szu.sk
Doručeno do redakce | Doručené do redakcie | Received 9. 5. 2021
Přijato po recenzi | Prijaté po recenzii | Accepted 2. 6. 2021
Zdroje
1. DeFronzo RA. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009; 58(4): 773–795. Dostupné z DOI: .
2. IDF Diabetes Atlas. 8th Edition 2017. Dostupné z WWW: .
3. Informace dostupné z WWW: .
4. Ray KK, Wilde MI, Sivakumaran R et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials. Lancet 2009; 373(9677): 1765–1772. Dostupné z DOI: .
5. Lotufo PA, Gaziano JM, Chae CU et al. Diabetes and all-cause and coronary heart disease mortality among US male physicians. Arch Intern Med 2001; 161(2): 242–247. Dostupné z DOI: .
6. Juutilainen A, Lehto S, Rönnemaa T et al. Type 2 diabetes as a „coronary heart disease equivalent“: an 18-year prospective population-based study in Finnish subjects. Diabetes Care 2005; 28(12): 2901–2907. Dostupné z DOI: .
7. Schramm T K, Gislason GH, Køber L et al. Diabetes patients requiring glucose - lowering therapy and nondiabetics with a prior myocardial infarction carry the same cardiovascular risk: a population study of 3.3 million people. Circulation 2008; 117(15): 1945–1954. Dostupné z DOI: .
8. Whiteley L, Padmanabhan S, Hole D et al. Should diabetes be considered a coronary heart disease risk equivalent?: results from 25 years of follow-up in the Renfrew and Paisley survey. Diabetes Care 2005; 28(7): 1588–1593. Dostupné z DOI: .
9. Davies MJ, D‘Alessio DA, Fradkin J et al. Management of Hyperglycaemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018; 41(12): 2669–2701. Dostupné z DOI: .
10. Buse JB, Wexler DJ, Tsapas A et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2020; 43(2): 487–493. Dostupné z DOI: .
11. Zilov AV. Mechanisms of action of metformin with special reference to cardiovascular protection. Diabetes Metab Res Rev 2019; 35(7): e3173. Dostupné z DOI: .
12. Norton I, Shannon CE, Fourcaudot M et al. Sodium glucose transporter an d glucose transporter expression in the kidney. of type 2 diabetic subjects. Diabetes Obes Metab 2017; 19(9): 1322–1326. Dostupné z DOI: .
13. Liu Z, Ma X, Ilyas I et al. Impact of sodium glucose cotransporter 2 (SGLT2) inhibitors on atherosclerosis: from pharmacology to pre-clinical and clinical therapeutics. Theranostics 2021; 11(9): 4501–4515. Dostupné z DOI: .
14. Zinman B, Wanner C, Lachin JM et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373(22): 2117–2128. Dostupné z DOI: .
15. McGuire DK , Zinman B, Inzucchi SE et al. Effects of empagliflozin on first and recurrent clinical events in patients with type 2 diabetes and atherosclerotic cardiovascular disease: a secondary analysis of the EMPA-REG OUTCOME trial. Lancet Diabetes Endocrinol 2020; 8(12): 949–959. Dostupné z DOI: .
16. Neal B, Perkovic V, Mahaffey KW et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377(7): 644–657. Dostupné z DOI: .
17. Wiviott SD, Raz I, Marc P. Bonaca MP et al. [DECLARE–TIMI 58 Investigators]. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2019; 380(4): 347–357. Dostupné z DOI: .
18. Cannon CP, Pratley R, Dagogo-Jack S et al. for the VERTIS CV Investigators. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. N Engl J Med 2020; 383(15): 1425–1435. Dostupné z DOI: .
19. Zelniker TA, Wiviott SD, Raz I et al. et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2019; 393(10166): 31–39. Dostupné z DOI: .
20. Smith EP, An Z, D’Alessio DA et al. The role of β cell glucagon-like peptide - 1 signaling in glucose regulation and response to diabetes drugs. Cell Metab 2014; 19(6): 1050–1057. Dostupné z DOI: .
21. Drucker DJ. Mechanisms of Action and Therapeutic.Application of Glucagon - like Peptide-1. Cell Metabolism 27(4); 2018 : 740–756. Dostupné z DOI: .
22. Knudsen LB and Lau J. The Discovery and Development of Liraglutide and Semaglutide. Front Endocrinol (Lausanne) 2019; 10: Article 155. Dostupné z DOI: .
23. Cornell S. A review of GLP-1 receptor agonists in type 2 diabetes: A focus on the mechanism of action of once-weekly agents J Clin Pharm Ther 2020; 45(Suppl 1): 17–27. Dostupné z DOI: .
24. Schubert M, Hansen S, Leefmann J et al. Repurposing Antidiabetic Drugs for Cardiovascular Disease. Front Endocrinol (Lausanne) 2020; 11: Article 568632. Dostupné z DOI: .
25. Kristensen SL, Rorth R, Jhund PS et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol 2019; 7(10): 776–785. Dostupné z DOI: .
26. Drucker DJ. The ascending GLP-1 road from clinical safety to reduction of cardiovascular complications. Diabetes 2018; 67(9): 1710–1719. Dostupné z DOI: .
27. Marso SP, Daniels GH, Brown-Frandsen K et al. Liraglutide and cardio - vascular outcomes in type 2 diabetes. N EnglJMed 2016; 375(4): 311–322. Dostupné z DOI: .
28. Marso SP, Bain SC, Consoli A et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375(19): 1834–1844. Dostupné z DOI: .
29. Hernandez AF, Green JB, Janmohamed S et al. [Harmony Outcomes committees and investigators]. Albiglutide and cardiovascular outcomes in patients with type 2 diabetes and cardiovascular disease (Harmony Outcomes): a double-blind, randomised placebo-controlled trial. Lancet 2018; 392(10157): 1519–1529. Dostupné z DOI: .
30. Gerstein HC, Colhoun HM, Dagenais GR et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo - controlled trial. Lancet 2019; 394(10193): 121–130. Dostupné z DOI: .
31. Holman RR, Bethel MA, Mentz RJ et al. [EXCEL Study group]. Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med; 2017; 377(13): 1228–1239. Dostupné z DOI: .
32. Marc A. Pfeffer, M.D., Ph.D., Brian Claggett, Ph.D., Rafael Diaz, M.D., et al. for the ELIXA Investigators. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med 2015; 373(23): 2247–2257. Dostupné z DOI: .
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospělé
Článek vyšel v časopiseAthero Review
Nejčtenější tento týden
2021 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Nový způsob podávání alirokumabu: 300 mg každé 4 týdny
- Rešerše zajímavých článků ze zahraniční literatury
- 24. virtuálny kongres XI. škola lipidológie a XXIX. nové trendy v prevencii aterosklerózy 2021
- EDITORIAL
- Hypolipidemická léčba zlepšuje prognózu diabetiků. Proč ji tak málo využíváme?
- Inzulinová rezistence a její ovlivnění v klinické praxi
- Inhibitory SGLT2 a ateroskleróza na pozadí účinků gliflozinů u srdečního selhání
- Číslo LDL žije!
- Ateroskleróza – indikátor liečby pacienta s diabetes mellitus 2. typu
- Reziduálne zápalové kardiovaskulárne riziko – diagnostická i terapeutická výzva
- Pohybová aktivita v léčbě a prevenci se zaměřením na rizikové faktory kardiovaskulárních onemocnění
- Athero Review
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pohybová aktivita v léčbě a prevenci se zaměřením na rizikové faktory kardiovaskulárních onemocnění
- Inzulinová rezistence a její ovlivnění v klinické praxi
- Inhibitory SGLT2 a ateroskleróza na pozadí účinků gliflozinů u srdečního selhání
- Číslo LDL žije!
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



