-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dyslipidemie u pacientů s chronickým onemocněním ledvin
Dyslipidemia in patients with chronic kidney disease
Chronic kidney disease (CKD) is a very common complication in patients with diabetes mellitus, arterial hypertension and dyslipidemia. Worldwide prevalence of CKD reaches about 15 %. However, this estimation is biased due to frequently asymptomatic signs in early stages of the disease. Dyslipidemia is a constant metabolic complication of CKD, even from its early stages. The patients are on higher risk for death from cardiovascular disease or complications in comparison to those without present kidney disease. One of current problems represents the modalities for influencing cardiovascular risk. Hypolipidemic therapy is unequivocally indicated at early stages of kidney disease; nevertheless, with decreased glomerular filtration rate, the pharmacotherapy options change as well as the recommendations for hypolipidemic therapy, particularly in patients with end stage renal disease who are dependent on some form of renal replacement therapy (RRT).
Keywords:
familial hypercholesterolemia – LDL-cholesterol – cardiovascular risk – chronic kidney disease – renal replacement therapy
Autoři: Magdaléna Dušejovská 1,2; Marek Vecka 2; Ivan Rychlík 3; Aleš Žák 2
Působiště autorů: Dialyzační středisko Fresenius NephroCare, Praha Vinohrady 1; IV. interní klinika 1. LF UK a VFN v Praze 2; I. interní klinika 3. LF UK a FNKV, Praha 3
Vyšlo v časopise: AtheroRev 2019; 4(3): 153-158
Kategorie: Hlavní téma
Souhrn
Chronické onemocnění ledvin (Chronic Kidney Disease – CKD) je velmi častou komplikací pacientů s diabetes mellitus (DM), arteriální hypertenzí a dyslipidemií. V celosvětovém měřítku se CKD vyskytuje přibližně u 12–15 % dospělé populace. Toto číslo však přesně neodpovídá reálným datům vzhledem k tomu, že v časných stadiích je onemocnění ledvin většinou asymptomatické. Dyslipidemie se u CKD vyskytuje jako konstantní metabolická komplikace, a to již od časných stadií. Pacienti s CKD mají vyšší riziko úmrtí na kardiovaskulární onemocnění a jejich komplikace než pacienti bez přítomnosti onemocnění ledvin. Aktuálním problémem zůstávají možnosti ovlivnění kardiovaskulárního rizika u CKD. Hypolipidemická terapie je jednoznačně indikována již při časných stadiích onemocnění ledvin, ale s klesající glomerulární filtrací se mění možnosti farmakoterapie i doporučení týkající se hypolipidemické terapie, obzvláště pak u pacientů s terminálním selháním ledvin závislých na některé formě náhrady funkce ledvin.
Klíčová slova:
: dyslipidemie – HDL-cholesterol – hypolipidemická terapie – LDL-cholesterol – náhrada funkce ledvin
Úvod
Chronické onemocnění ledvin (Chronic Kidney Disease – CKD) je definováno jako poškození struktury či funkce ledvin přetrvávající alespoň 3 měsíce, ze kterého plynou závažné důsledky pro zdravotní stav pacienta. Klasifikace CKD dle současných doporučení v sobě zahrnuje zhodnocení příčiny, která vedla k poškození ledvin, tíži albuminurie a snížení glomerulární filtrace (tab. 1) [1].
Tab. 1. CKD klasifikace a riziko progrese dle GF a albuminurie. Upraveno podle [1] ![CKD klasifikace a riziko progrese dle GF a albuminurie. Upraveno podle [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/abcd37534bc44e70fc19c6e10ec220f7.png)
riziko progrese CKD: černé pole – nízké riziko, šedé pole – středně zvýšené riziko, světlé modrozelené pole – vysoké riziko, tmavě modrozelené pole – velmi vysoké riziko
GF – glomerulární filtraceChronické onemocnění ledvin je v populaci velmi častým onemocněním nebo komplikací jiných onemocnění, jako je diabetes mellitus (DM) a arteriální hypertenze (AH): v České republice (ČR) je téměř 1 milion diabetiků a 4 miliony pacientů s AH. Podle světových statistik tedy lze predikovat, že v ČR je přibližně 1 500 000 pacientů s CKD, z toho 5 990 pacientů dospělo v roce 2018 do fáze konečného stadia onemocnění ledvin (End Stage Renal Disease – ESRD) a musela u nich být zahájena některá z náhrad funkce ledvin (hemodialýza, peritoneální dialýza, transplantace ledviny) nebo se rozhodli pro konzervativní řešení svého ESRD [2]. V počátečních stadiích onemocnění ledvin jsou pacienti asymptomatičtí a málokdy vyhledají lékařskou pomoc. Neexistuje o nich tedy přesná evidence a populační data jsou tak v této fázi CKD nekonzistentní. K lékaři se pacienti dostanou většinou až v pozdních fázích onemocnění ledvin, kdy již mají plně rozvinuté různé komplikace základního onemocnění.
Pacienti s CKD mají také akcelerovanou aterosklerózu a ve zvýšené míře umírají na kardiovaskulární onemocnění (CardioVascular Disease – CVD). Vedle tradičních (Framinghamských) rizikových faktorů aterosklerotického postižení se na jejich zvýšeném riziku úmrtí na CVD podílí i řada netradičních rizikových faktorů či komplikací vyplývajících z CKD (renální anémie, porucha kalcio-fosfátového metabolizmu, hyperhydratace, srdeční selhání, malnutrice), tab. 2. Často se jedná o jejich vzájemné ovlivnění.
Tab. 2. Konvenční a nové rizikové faktory podílející se na etiopatogenezi aterosklerotických změn u pacientů s CKD 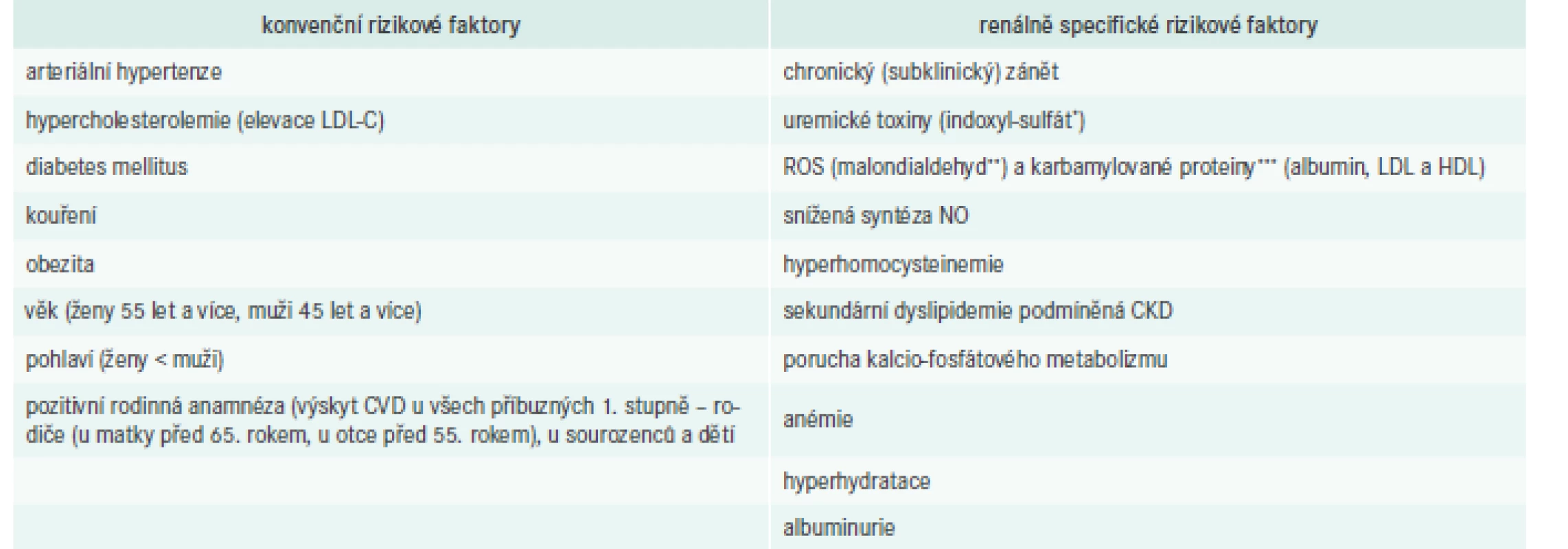
*indoxyl-sulfát je uremickým toxinem syntetizovaným ve střevě z bílkovin působením střevního mikrobiomu, který je indikátorem oxidačního stresu, současně je nefrotoxinem, up-reguluje cytoadhezní molekuly a inhibuje proliferaci endotelu
**malondialdehyd je vedlejším produktem peroxidace polynenasycených mastných kyselin, je využíván jako marker výskytu ROS, jeho hladina bývá pravidelně zvýšená u pacientů s CKD; LDL modifikovaná malondialdehydem je považována za indikátor koncentrace oxidovaného LDL
***karbamylované proteiny (albumin, LDL, HDL) vznikají posttranslační modifikací proteinů prostřednictvím urey; modifikace proteinů mění jejich strukturu, fyzikální a chemické vlastnosti, může ovlivnit jejich funkci a působit jako neoantige a indukovat tvorbu protilátek
ROS – reaktivní sloučeniny kyslíkuDyslipidemie se i u pacientů s CKD vyskytuje jako primární nebo sekundární porucha metabolizmu lipidů. Dyslipoproteinemie je u pacientů s CKD téměř konstantním znakem, zatímco ostatní, renálně specifické rizikové faktory – malnutrice, anémie a další se mohou vyskytovat nepravidelně [3]. Lipidový metabolizmus je narušen již při poklesu glomerulární filtrace < 0,9 ml/s (54 ml/min). Vzhledem k časnému rozvoji poruchy metabolizmu lipidů u pacientů s CKD je potřeba terapeuticky zasáhnout včas. Mnoho odborných skupin se zabývá mimo jiné i problematikou poruch metabolizmu lipidů s cílem najít společný prediktivní marker u pacientů s CKD (nejlépe i terapeuticky ovlivnitelný), který by pacienty s nefropatiemi stratifikoval, ev. indikoval k hypolipidemické terapii. Cílem možných intervencí je co nejvíce snížit kardiovaskulární (KV) riziko a následné komplikace vyplývající z CVD, a zlepšit tak kvalitu života pacientů s CKD.
Patofyziologie dyslipidemie u pacientů s nefropatií
Porucha metabolizmu lipidů a lipoproteinů je u pacientů s CKD komplexní povahy (nutriční a metabolické). V ledvinách se její důsledky projevují buď nepřímo prostřednictvím ovlivnění hemodynamiky v glomerulech (stenóza renální arterie a další), nebo přímo vlivem ektopického ukládání tuků a lipotoxicitou. V recentní práci Nishi popisuje propojení lipotoxického působení a progrese CKD. Dále se práce věnuje souvztažnosti extrarenálních komplikací, jako je renální anémie, srdeční selhání a sarkopenie s lipotoxicitou [3].
Ledviny se skládají z více typů specializovaných buněk (endotelie, vas afferens, vas efferens, tubulární buňky), které jsou vystaveny velkému objemu cirkulující krve a působkům obsažených v primární moči. Navíc, ledviny jsou také vystaveny působení mastných kyselin (Fatty Acid – FA), které ovlivňují jednotlivé typy ledvinných buněk, přičemž výsledný účinek závisí na množství komplexních lipidů, resp. mastných kyselin, které jsou jejich složkou, typu mastných kyselin a akumulaci lipidů v dané buňce [4]. Základními patogenetickými mechanizmy, které se uplatňují v patogenezi CKD, jsou stres endoplazmatického retikula, aktivace zánětu a oxidační stres. V lipotoxickém působení může svou roli sehrát i albuminurie doprovázející již počáteční stadia CKD. Sérové FA jsou vázány na albumin, v komplexu s FA můžou vyvolat i tubulointersticiální poškození [5]. Weinberg ve své práci z roku 2006 uvádí, že v buňkách proximálních tubulů může docházet u pacientů s albuminurií k intracelulárnímu hromadění lipidových depozit [6]. V konečném důsledku jsou tedy ledviny ovlivněny dyslipidemií, akumulací FA a endokrinními změnami (změny koncentrace adipokinu), které mění metabolizmus a složení lipidů krevní plazmy [7].
Pacienti s CKD mají typický lipoproteinový fenotyp charakterizovaný zvýšením koncentrace lipoproteinů o velmi nízké hustotě (Very Low Density Lipoprotein – VLDL) a lipoproteinů o intermediální hustotě (Intermediate Density Lipoprotein – IDL). Ve frakci VLDL je přítomen apoB48, což svědčí pro přítomnost remnantních chylomikronů. Vzestup koncentrací triacylglycerolů (TAG) je spojen s poklesem koncentrace cholesterolu v lipoproteinu o vysoké hustotě (HDL-cholesterol/High Density Lipoprotein – HDL-C); částice HDL jsou zároveň bohatší na TAG než u zdravých jedinců. Hladiny lipoproteinových částic o nízké hustotě (LDL-cholesterol/Low Density Lipoprotein – LDL-C) mívají tito pacienti často ve fyziologickém rozmezí nebo snížené s převahou malých denzních LDL (small dense LDL – sdLDL), které jsou schopny proniknout do cévní stěny, v níž ve zvýšené míře podléhají oxidační modifikaci [8]: tyto sdLDL jsou odpovědné za narušení endotelu. Po jeho poškození se váží na proteoglykany extracelulární matrix v arteriální intimě [9]. Koncentrace apoCII klesají, koncentrace apoCIII mají opačný trend. Další změnou v lipoproteinovém metabolizmu jsou vyšší koncentrace lipoproteinu(a) – Lp(a). Zvýšené koncentrace Lp(a) u pacientů s CKD jsou pravděpodobně zapříčiněny jeho zpomaleným katabolizmem, který probíhá v ledvinách. Po úspěšné transplantaci štěpu ledviny se koncentrace Lp(a) snižují [10]. Zvýšené plazmatické koncentrace Lp(a) u pacientů s ESRD korelují s parametry chronického zánětu – vysoce senzitivního CRP (hs-CRP – high sensitivity CRP) a interleukinu 6 (IL6) [11]. Mezi další změny lipoproteinového metabolizmu u pacientů s CKD patří modifikace HDL-částic. HDL-částice jsou v populaci pacientů bez CKD považovány za kardioprotektivní a mají pleiotropní působení. Primárně hrají důležitou funkci v reverzním transportu cholesterolu, dále působí protizánětlivě, antitrombogenně a antioxidačně. U pacientů s CKD jsou všechny funkce HDL narušeny. HDL-částice obsahují akumulované oxidované lipidy, které následně vedou k inhibici antioxidačních enzymů lokalizovaných na HDL (zejména paraoxonázy 1), mění strukturu apoAI, a tím zpomalují reverzní transport cholesterolu zprostředkovaný HDL. Ty přispívají k tvorbě oxidovaně modifikovaných LDL a k vaskulárnímu zánětu [12]. Snížení aktivit enzymů – paraoxonázy 1 (PON1), syntázy oxidu dusnatého (NO) a lecitin-cholesterol-acyltransferázy (LCAT) prohlubuje další dysfunkci HDL-částic u pacientů s CKD. Tyto dysfunkční HDL jsou ve zvýšené míře odpovědné za oxidaci fosfolipidů, akumulaci sérového amyloidu A (SAA) a CRP s následnou indukcí produkce cytokinů monocyty a dendritickými buňkami. Současně dojde v HDL k výměně apoAI za SAA; volný apoAI je katabolizován ledvinami. Částice HDL ochuzené o apoAI mají nižší schopnost vázat cholesterol v periferních tkáních, čímž je ochromena počáteční fáze reverzního transportu cholesterolu [13–14].
Kromě výše popsaných změn se u pacientů s CKD uplatňuje „cholesterolový paradox“; u běžné populace koreluje KV-mortalita pozitivně s hladinami celkového cholesterolu (Total Cholesterol – TC), zatímco u pacientů s CKD (obzvláště s ESRD) je tento vztah opačný. Tento inverzní vztah je dáván do souvislosti s chronickým zánětem ve spojení s malnutricí (syndrom MIA: malnutrition, inflammation, anorexia). Podstatná část dialyzovaných pacientů má syndrom MIA spojený s vaskulárními kalcifikacemi (syndrom MIAC: malnutrition, inflammation, anorexia, calcification) [15]. Chronický zánět je důsledkem oxidačního stresu. Na něm se podílejí nejen poruchy antioxidačních enzymů, ale i působení uremických toxinů a sekundární dyslipoproteinemie. Modifikované lipoproteinové částice změnou koncentrace, dysfunkcí či lipotoxickým působením přispívají k prohloubení chronického zánětu. Dále se na alteraci antioxidačního potenciálu podílí nedostatek stopových prvků (selen, zinek, měď) jako kofaktorů antioxidačních enzymů; významným zdrojem reaktivních forem kyslíku a dusíku je i kontakt krevních elementů s hemodialyzační membránou u pacientů s ESRD.
Specifika terapie dyslipidemie u pacientů s chronickým onemocněním ledvin
Režimová opatření
Režimová opatření při dyslipidemiích jsou u pacientů s pokročilým CKD značně omezená. Většina pacientů má v predialyzačním stadiu dietu s omezením bílkovin. V dialyzačním stadiu se doporučuje pokračovat v dietě s omezením draslíku, fosforu a tekutin. Speciální doporučení se týkají nemocných s CKD a přítomným DM. Řada pacientů má v rámci diabetické diety restrikci sacharidů, tedy dieta s omezením cholesterolu se dostává do pozadí. Fyzická aktivita je možná jen u pacientů, kteří jsou v dobré fyzické kondici. Většina pacientů v pokročilé fázi renálního onemocnění má řadu komorbidit a z nich vyplývajících symptomů, které jim fyzickou aktivitu znemožňují (dušnost, slabost, křeče, bolesti kloubů a další).
Farmakoterapie
Statiny
Statiny (dle účinnosti rosuvastatin, atorvastatin, simvastatin, lovastatin, fluvastatin) jsou heterogenní skupinou látek, které kompetitivně inhibují 3-hydroxy-3-metylglutaryl-CoA (HMG-CoA) reduktázu. Snížení intracelulární koncentrace cholesterolu v játrech zvyšuje expresi LDL-receptorů, což způsobí zvýšené vychytávání LDL a dalších lipoproteinů (LP) obsahujících apoB (IDL, VLDL). Statiny jsou indikovány u všech typů DLP se zvýšenými koncentracemi LDL-C (LDL-C > 3,40 mmol/l), tj. u izolované hypercholesterolemie a smíšené dyslipidemie. U smíšené hyperlipidemie je předpokladem vhodnosti statinu jako léku první volby koncentrace TAG < 5,17 mmol/l. Statiny se liší farmakokinetikou (absorpce, biologická dostupnost, vazba na bílkoviny, jaterní biotransformace cestou cytochromu P450). Mezi nežádoucí účinky patří myopatie (u 5–10 % léčených), elevace jaterních testů (< 2 %) a zvýšené riziko DM (10 %). Prospěch z léčby statiny na globální KV-riziko je zhruba 9krát vyšší než KV-riziko asociované s DM. Cílem léčby statiny je dosažení cílové koncentrace LDL-C podle kategorie rizika pro CVD, nebo alespoň 50% pokles LDL-C při podávání maximálně tolerovatelné dávky. V KV-prevenci mají významnou úlohu i pleiotropní účinky statinů – pozitivní ovlivnění endoteliální dysfunkce, antioxidační, antiinflamatorní, antiproliferační a antitrombogenní působení.
Pokud jde o typy statinů a renální funkce, zdá se, že atorvastatin je výhodnější než rosuvastatin [16–17]. Crouse v randomizované kontrolní studii (METEOR) popisuje, že větev pacientů s rosuvastatinem prokázala větší redukci lipidového profilu a současně vykazovala signifikantní snížení odhadované glomerulární filtrace (estimated Glomerular Filtration Rate – eGFR) ve srovnání se skupinou pacientů zařazených do větve s atorvastatinem [17]. S tímto faktem je tedy nutné u pacientů s CKD počítat a v hypocholesterolemické léčbě preferovat atorvastatin. Pokud je nutné použít rosuvastatin, je třeba začít terapii nízkými dávkami. U pacientů s pokročilým poklesem eGFR < 30 ml/min/1,73 m² (CKD ³ 4) rosuvastatin není doporučen vůbec. Při terapii rosuvastatinem je rovněž potřeba počítat s lékovými interakcemi, zejména s inhibitory protonové pumpy. Tyto jsou v chronické medikaci pacientů s nefropatií ve velké míře zastoupeny. Su a Zhang provedli v roce 2016 metaanalýzu 54 studií, která zhodnotila podávání statinů pacientům s různými stadii CKD. Závěrem této práce bylo shrnutí, že léčba statinem nezhoršuje riziko výskytu selhání ledvin u dospělých s CKD, kteří nejsou dependentní na pravidelné dialyzační léčbě (PDL). Statiny mohou mírně snížit proteinurii a rychlost progrese CKD. Kromě toho léčba statinem významně snížila riziko KV-příhod o 31 % u pacientů s CKD [18]. Fluvastatin je preferenčně využíván, pokud primární renální diagnóza vyžaduje použití imunosupresiv. Fluvastatin je metabolizován přes cytochromy CYP 2C9, 3A4, 2D6 a 2C8. Je nejméně účinný v oblasti KV-prevence, nicméně v této indikaci má své opodstatnění vzhledem k minimálním lékovým interakcím (imunosuprese, antibiotická a antimykotická terapie). V současné době zatím platí pro hypolipidemickou terapii doporučení pracovní skupiny Lipid Work Group KDIGO iniciativy (Kidney disease: Improving Global Outcomes) z roku 2013, která doporučují lékařům pečujícím o pacienty s CKD G3–5 terapii statiny nebo kombinační terapii statin/ezetimib zachovat. U pacientů v PDL navrhují hypolipidemickou terapii nezahajovat. Pokud však léčba byla zahájena v méně pokročilých stadiích CKD, doporučuje se v léčbě pokračovat [19].
Fibráty
Fibráty (fenofibrát, ciprofibrát) jsou lékem první volby u nemocných s TAG > 5,20 mmol/l. Snižují koncentrace TAG o 20–50 %, zvyšují koncentrace HDL-C a mají variabilní účinek na hladinu LDL-C. Jsou to agonisté nukleárních receptorů PPARa. Modulují expresi četných genů, které řídí lipidový a glycidový metabolizmus. Jejich hypolipidemický účinek je důsledkem urychleného katabolizmu lipoproteinů bohatých TAG (TAG-Rich Lipoproteins – TRL) v důsledku aktivace LPL a snížené exprese apo C-III v kombinaci s potlačením syntézy TAG. Podávání fibrátů příznivě ovlivňuje lačnou i postprandiální hypertriacylglycerolemii (HTAG), zvyšuje HDL-C a snižuje zastoupení sdLDL. V primárně a sekundárně preventivních studiích měly největší prospěch z podávání fibrátů osoby s HTAG, poklesem HDL-C a poměrem LDL-C/HDL-C > 5,0, včetně nemocných s aterogenní dyslipidemií. U pacientů s CKD měla terapie fenofibrátem za následek zvýšení hladin kreatininu v séru a sníženou rychlost glomerulární filtrace v primární prevenci [20]. Proto je nutno během podávání fibrátů pravidelné sledování renálních funkcí. Existuje několik hypotéz týkajících se mechanizmů, na nichž je založena nefrotoxicita spojená s fenofibrátem. Fenofibrát může zhoršit tvorbu vazodilatačních prostaglandinů, což vede k převaze vazokonstrikce aferentní arterioly; výsledkem jsou změny intraglomerulárního tlaku a pokles GFR [21]. Alternativně může fenofibrát kompetitivně inhibovat sekreci kreatininu v proximálním tubulárním lumen [22–24] nebo zvýšit produkci endogenního kreatininu [25]. Ukazuje se, že podávání fibrátů oddaluje u DLP vývoj porušené glukózové tolerance a vznik diabetes mellitus 2. typu (DM2T). Fenofibrát snižuje albuminurii u DM2T a brání rozvoji diabetické retinopatie. Mezi nežádoucí účinky fibrátů se řadí dyspepsie (< 5 %), zarudnutí kůže (< 2 %), myopatie, zvl. u nemocných s CKD (< 5,5 %) a cholelitiáza. Z laboratorních ukazatelů jsou s léčbou fibráty spojeny elevace plazmatických koncentrací kreatininu a homocysteinu [26]. Terapie fenofibrátem není vhodná u pacientů s CKD G4,5.
Ezetimib
Ezetimib je selektivním inhibitorem absorpce cholesterolu v tenkém střevě. V kartáčovém lemu enterocytů blokuje transportní protein Niemann-Pick C1-like protein 1 (NPC1L1), blokádou dochází ke sníženému vstřebávání cholesterolu do enterohepatální cirkulace. Na pokles cholesterolu v portální krvi reaguje hepatocyt zvýšenou expresí LDL-receptoru následovanou poklesem LDL-C. Ezetimib není vhodný v monoterapii hypercholesterolémie, neboť zpětnovazebnými mechanizmy je akcentována intracelulární syntéza cholesterolu. Rovněž není vhodný pro těhotné a děti, neboť je v 95 % vstřebáván z enterocytu do enterohepatální cirkulace. Pro pacienty s CKD je vhodný do kombinační terapie (simvastatin/ezetimib); studie SHARP potvrdila významné snížení velkých aterosklerotických KV-příhod o 17 %. V konečném stadiu onemocnění ledvin u pacientů závislých na dialýze se ukazuje, že změny v metabolizmu cholesterolu a fytosterolů jsou spojeny s vyšší absorpcí cholesterolu a narušením lipoproteinového metabolizmu. Tento fakt by mohl podpořit terapii ezetimibem zaměřenou právě na blokádu absorpce cholesterolu v enterocytu [4].
PCSK9-inhibitory
PCSK9-inhibitory (alirokumab, evolukomab), tedy inhibitory proprotein konvertázy subtilizin/kexin typu 9 (Proprotein Convertase Subtilisin/Kexin type 9 – PCSK9) patří do skupiny serinových proteáz. PCSK9 je exprimován v hepatocytech, enterocytech, ledvinách i mozečku. PCSK9 vytváří komplex s LDL-receptorem, který po navázání LDL-částice vede k internalizaci komplexu do cytosolu buňky, v lyzosomu je následně degradován celý komplex LDL-receptor – LDL-částice – PCSK9. LDL-receptor již dále není recyklován a zpětně exprimován na membráně buněk. Aktuálně jsou od roku 2018 v České republice k dispozici 2 preparáty – alirokumab a evolukomab. Pro pacienty s CKD jsou prozatím indikovány do stadia CKD3a, pokud nedosahují cílových hodnot LDL-C na maximální tolerované terapii statinem či kombinační terapii (statin/ezetimib) [27]. Nicméně v ČR je znám kazuistický případ pacienta s ESRD, s familiární hypercholesterolemií a statinovou myopatií, který byl indikován v sekundární prevenci k aplikaci PCSK9-inhibitorů – zatím s velmi dobrou tolerancí terapie.
Závěr
Chronické onemocnění ledvin je jedním z hlavních rizikových faktorů aterosklerotického CVD. Akcelerace aterosklerózy vede v počátečních stádiích CKD k časné manifestaci komplikací aterosklerózy a pacienti v této fázi umírají spíše na CVD a jejich komplikace než na primární nefrologické onemocnění [28]. Pacienti s CKD jsou kategorizováni do skupiny s velmi vysokým KV-rizikem a jejich hypolipidemická léčba má svá specifika. V ambulantní praxi by tedy měla být od časných stadií CKD mimo jiné snaha o důslednou prevenci progrese rizikových faktorů CVD, včetně spolupráce nefrologa s lipidologem. Dohoda o maximálně účinné hypolipidemické terapii (včetně kombinační léčby či indikace PCSK9-inhibitorů) by měla být vedena s cílem v co největší míře snížit riziko komplikací vyplývajících z CVD, a tak zlepšit kvalitu života pacientů s CKD.
Práce byla podpořena granty RVO-VFN64165 a PROGRES Q25/LF1/2.
MUDr. Magdaléna Dušejovská, Ph.D.
MAGDALENA.DUSEJOVSKA@FMC-AG.COM
Doručeno do redakce 2. 10. 2019
Přijato po recenzi 11. 10. 2019
Zdroje
- [KDIGO 2012]. Summary of Recommendation Statements. Kidney Int Suppl 2013; 3(1): 5–14. Dostupné z DOI: <http://dx.doi.org/10.1038/kisup.2012.77>.
- Rychlík I, Lopot F. Statistická ročenka dialyzační léčby v ČR 2018. Dostupné z WWW: <http://www.nefrol.cz/odbornici/dialyzacni-statistika>.
- Nishi H, Higashihara T, Inagi R. Lipotoxicity Kidney, Heart, and Skeletal Muscle Dysfunction. Nutrients 2019; 11(7). pii: E1664. Dostupné z DOI: <http://dx.doi.org/10.3390/nu11071664>.
- Vecka M, Dušejovská M, Staňková B et al. Non-cholesterol sterols and fatty acids in chronic hemodialysis patients. Nutr Metab Cardiovasc Dis (in print).
- Dupont B, Oberfield SE, Smithwick EM et al. Close genetic linkage between HLA and congenital adrenal hyperplasia (21-hydroxylase deficiency). Lancet 1977; 2(8052–8053): 1309–1312. Dostupné z DOI: <http://dx.doi.org/10.1016/s0140–6736(77)90362–2>.
- Weinberg JM. Lipotoxicity. Kidney Int 2006; 70(9): 1560–1566. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.ki.5001834>.
- Upadhyay A, Earley A, Lamont JL et al. Lipid-lowering therapy in persons with chronic kidney disease: A systematic review and meta-analysis. Ann Intern Med 2012; 157(4): 251–262. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–157–4-201208210–00005>.
- Kotani K, Tsuzaki K, Traniguchi N et al. LDL particle size and reactive oxygen metabolites in dyslipidemic patients. Int J Prev Med 2012; 3(3): 160–166.
- Galeano NF, Al-Haideri M, Keyserman F et al. Small dense low density lipoprotein has increased affinity for LDL receptor-independent cell surface binding sites: a potential mechanism for increased atherogenicity. J Lipid Res 1998; 39(6): 1263–1273.
- Kronenberg F, Kuen E, Ritz E et al. Lipoprotein(a) serum concentrations and apolipoprotein(a) phenotypes in mild and moderate renal failure. J Am Soc Nephrol 2000; 11(1): 105–115.
- Žák A, Zeman M. Sekundární dyslipidémie. In: Svačina Š (ed). Poruchy metabolismu a výživy. Galén: Praha 2010 : 271–288. ISBN 978–80–7262–676–2.
- Dodani S, Grice DG, Joshi S. Is HDL function as important as HDL quantity in the coronary artery disease risk assessment? J Clin Lipidol 2009; 3(2): 70–77. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacl.2009.02.001>.
- Weichhart T, Kopecký C, Kubíček M et al. Serum amyloid A in uremic HDL promotes inflammation. J Am Soc Nephrol 2012; 23(5): 934–947. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2011070668>.
- Dušejovská M, Rychlík I, Žák A et al. Lipid Metabolism in Patients with End-Stage Renal Disease: A Five Year Follow-up Study. Curr Vasc Pharmacol 2018; 16(3): 298–305. Dostupné z DOI: <http://dx.doi.org/10.2174/1570161115666170530104143>.
- Tesař V. Metabolické aspekty nemoci ledvin. In: Svačina Š (ed). Poruchy metabolismu a výživy. Galén: Praha 2010 : 137–150. ISBN 978–80–7262–676–2.
- de Zeeuw D, Anzalone DA, Cain VA et al. Renal effects of atorvastatin and rosuvastatin in patients with diabetes who have progressive renal disease (PLANET I): a randomised clinical trial. Lancet Diabetes Endocrinol 2015; 3(3): 181–190. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–8587(14)70246–3>.
- Crouse JR, Raichlen JS, Riley WA et al. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR trial. JAMA 2007; 297(12): 1344–1353. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.297.12.1344>.
- Su X, Zhang L, Lv J et al. Effect of Statins on Kidney Disease Outcomes: A Systematic Review and Meta-analysis. Am J Kidney Dis 2016; 67(6): 881–892. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2016.01.016>.
- [Kidney Disease: Improving Global Outcomes (KDIGO) Lipid Work Group]. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Kidney Int Suppl 2013; 3(3): 259–305. Dostupné z DOI: <http://dx.doi.org/10.1038/kisup.2013.27>.
- Kim S, Ko K, Park S et al. Effect of Fenofibrate Medication on Renal Function. Korean J Fam Med 2017; 38(4): 192–198. Dostupné z DOI: <http://dx.doi.org/10.4082/kjfm.2017.38.4.192>.
- McQuade CR, Griego J, Anderson J et al. Elevated serum creatinine levels associated with fenofibrate therapy. Am J Health Syst Pharm 2008; 65(2): 138–141. Dostupné z DOI: <http://dx.doi.org/10.2146/ajhp070005>.
- Lipscombe J, Lewis GF, Cattran G et al. Deterioration in renal function associated with fibrate therapy. Clin Nephrol 2001; 55(1): 39–44.
- Ritter JL, Nabulsi S. Fenofibrate-induced elevation in serum creatinine. Pharmacotherapy 2001;21(9): 1145–1149. Dostupné z DOI: <http://dx.doi.org/10.1592/phco.21.13.1145.34623>.
- Ansquer JC, Dalton RN, Caussé E et al. Effect of fenofibrate on kidney function: a 6-week randomized crossover trial in healthy people. Am J Kidney Dis 2008; 51(6): 904–913. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2008.01.014>.
- Hottelart C, El Esper N, Rose F et al. Fenofibrate increases creatininemia by increasing metabolic production of creatinine. Nephron 2002; 92(3): 536–541. Dostupné z DOI: <http://dx.doi.org/10.1159/000064083>.
- Zeman M, Žák A, Vecka M et al. Treatment of hypertriglyceridemia with fenofibrate, fatty acid composition of plasma and LDL, and their relations to parameters of lipoperoxidation of LDL. Ann N Y Acad Sci 2002; 967 : 336–341. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1749–6632.2002.tb04289.x>.
- Toth PP, Dwyer JP, Cannon CP et al. Efficacy nad safety of lipid lowering by alirocumab in chronic kidney disease. Kidney Int 2018; 93(6): 1397–1408. Dostupné z DOI: <http://dx.doi.org/10.1016/j.kint.2017.12.011>.
- Coresh J, Selvin E, Stevens LA et al. Prevalence of chronic kidney disease in the United States. JAMA 2007; 298(17): 2038–2047. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.298.17.2038>.
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospělé
Článek vyšel v časopiseAthero Review
Nejčtenější tento týden
2019 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Editorial
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019
- Specifika léčby postižení cévního systému u pacientů s chronickým onemocněním ledvin
- Ľubomíra Fábryová, Pavol Holéczy a kolektív. Diabezita. Diabetes a obezita: nerozlučné dvojičky
- Vliv statinů na podocyty u nefrotického syndromu
- Dyslipidemie u pacientů s chronickým onemocněním ledvin
- Apolipoprotein L1 – etnicky specifický determinant renálního a srdečního selhání
- Observační studie léčby dyslipidemie v České republice
- Deficience lyzosomální kyselé lipázy: jedna z možných příčin dyslipidemie a hepatopatie
- Vitamín D a koronárne riziko detekované výpočtovou tomografiou
- Desatero použití ezetimibu aneb stručný průvodce jeho použitím v současnosti
- Strategie kardiovaskulární prevence: to je oč tu běží!
- Strategie kardiovaskulární prevence: to je oč tu běží!
- Rešerše zajímavých článků ze zahraniční literatury
- Fellowship ČSAT: German Heart Center Munich – Technical University Munich 18. 2. 2019–17. 8. 2019
- Šobrův den 2019: Lipidologie opět na výsluní
- Athero Review
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Desatero použití ezetimibu aneb stručný průvodce jeho použitím v současnosti
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019
- Specifika léčby postižení cévního systému u pacientů s chronickým onemocněním ledvin
- Dyslipidemie u pacientů s chronickým onemocněním ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



