-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Důležitost a možnosti peroperačního hodnocení nocicepce
The importance and options of peroperative evaluation of nociception
The main objective of anaesthetic care is to ensure safe and adequate anaesthesia and analgesia during surgery. By „safe” we mean full reversibility of the induced arteficial state while maintaining full integrity of the organism (in which the crucial role is represented by the maintenance of adequate supply of oxygen and organ perfusion). The term „adequate” refers to the goal of effective suppression of consciousness and nociception while minimizing adverse side effects of anaesthetics and analgesics, i.e. using the minimum effective dose of anaesthetic and analgesic. For such defined qualities, the authors propose the concept of euanaesthesia and euanalgesia. One of the main goals of perioperative anaesthetic care is to achieve effective supression of consciousness and nociception using the lowest effective doses of anaesthetics and analgesics. While monitoring of depth of anaesthesia has gone through a lot of progress and now allows routine targeted dosing of anaesthetics, reliable monitoring of nociception is still waiting for a major breakthrough. This article summarizes the importance of an individualized approach in anaesthetic care and provides an overview of currently available methods used for objective measure of nociception.
Keywords:
anaesthesia – analgesia – Nociception – monitoring – euanaesthesia – euanalgesia
Autoři: V.- Rogozov 1 4; T. Vaněk 1,2
Působiště autorů: Kardiochirurgická klinika, Fakultní nemocnice Královské Vinohrady, Praha 1; 3. lékařská fakulta, Univerzita Karlova, Praha 2; Department of Anaesthesia, Leeds Teaching Hospitals, Leeds 3; School of Medicine, University of Leeds, Leeds 4
Vyšlo v časopise: Anest. intenziv. Med., 31, 2020, č. 5, s. 225-232
Kategorie: Přehledové články
Souhrn
Hlavním posláním anesteziologa je zajistit bezpečnou a přiměřenou anestezii a analgezii v průběhu operačního výkonu. Pojmem „bezpečnou“ rozumíme plnou reverzibilitu uměle navozeného stavu při zachování plné integrity organismu (v čemž hraje zásadní úlohu udržení adekvátní dodávky kyslíku a orgánového prokrvení). Termínem „přiměřenou“ vyjadřujeme takový cíl, kdy dojde k účinnému útlumu vědomí a nocicepce při minimalizaci nežádoucích vedlejších účinků anestetik a analgetik, tedy s použitím minimální efektivní dávky anestetika a analgetika. Pro takto definované kvality autoři navrhují pojem euanestezie a euanalgezie. Jedním ze základních cílů peroperační anesteziologické péče je tedy dosáhnout účinného útlumu vědomí a nocicepce při použití co nejmenších efektivních dávek anestetik a analgetik. Zatímco v monitorování hloubky anestezie bylo dosaženo velikého pokroku a nyní již umožňuje rutinní cílené zpětnovazebné dávkování anestetik, spolehlivá monitorace nocicepce na svůj zásadní průlom v použitelnosti stále čeká. Tento článek shrnuje důležitost individualizovaného přístupu v anesteziologické praxi a podává přehled v současnosti dostupných metod používaných k objektivnímu měření nocicepce.
Klíčová slova:
anestezie – analgezie – nocicepce – monitorace – euanestezie – euanalgezie
Euanestezie, euanalgezie
Důležitost monitorace hloubky anestezie a kvality analgezie
Chirurgický výkon představuje pro organismus zátěž v podobě vlastního chirurgického traumatu a současně v podobě reakce organismu na toto trauma. Výrazné nociceptivní dráždění vyvolává sympatoadrenální stresovou odpověď, která může být sama o sobě pro úspěšné provedení výkonu limitující. V počátcích klinické anestezie sestávala anesteziologická praxe z inhalace celkových anestetik bez současného použití analgetik. Anesteziolog tak sice uvedl pacienta do bezvědomí, neustále však balancoval mezi nedostatečným potlačením stresové reakce na jedné straně a mezi velmi hlubokou intoxikací, která vedla k výrazné depresi oběhového a respiračního systému na straně druhé. Operováni proto mohli být pouze zdatní jedinci, jejichž kardiovaskulární a respirační systém měl předpoklady jak pro úspěšné překonání peroperační stresové reakce, tak pro depresivní účinky anestezie samotné.
Používání potentních opioidních analgetik v průběhu celkové anestezie představovalo jeden ze základních pilířů anesteziologické péče směrem k větší bezpečnosti a efektivnosti. I v současné době jsou opioidy a způsob jejich dávkování u velkých výkonů, kde nelze využít výhod regionální anestezie, hlavním prostředkem k dosažení adekvátní peroperační analgezie/modulace nocicepce (v dalším textu se nevěnujeme situacím, kdy je možné použít některou z technik regionální anestezie).
Přes nesporné pokroky v možnostech měření hloubky anestezie zůstává okamžité peroperační měření nocicepce do značné míry nezodpovězenou výzvou. Na rozdíl od anestetik proto dávkování agonistů opioidních receptorů stále zůstává založeno na zkušenosti anesteziologa a na jeho schopnosti vyhodnotit klinické známky mělké/nedostatečné analgezie. Přitom – podobně jako s anestetiky – jak poddávkování, tak předávkování opioidů může vést k řadě negativních důsledků.
Při poddávkování opioidů může dojít k nedokonalému potlačení stresové odpovědi s negativním dopadem na hemodynamiku a modulaci systémové zánětlivé reakce [1]. Při jejich předávkování může dojít k prodloužení zotavení, prodloužení umělé plicní ventilace, pobytu na jednotce resuscitační péče, hyperalgezii a řadě dalších souvisejících potenciálních komplikací.
Euanestezie, euanalgezie, monitorace hloubky anestezie a míry nocicepce
Jedním ze základních cílů peroperační anesteziologické péče je dosáhnout účinného útlumu vědomí (v textu používáme termín „anestezie“ v užším slova smyslu, tedy pro vyjádření celkového útlumu činnosti centrální nervové soustavy a potlačení vědomí) a útlumu nocicepce (v textu používáme pojem „analgezie“ k vyjádření principu potlačení nociceptivní stimulace) při použití co nejmenších efektivních dávek anestetik a analgetik. Základní cíl peroperační anesteziologické péče by se tedy mohl definovat jako dosažení euanalgezie a euanestezie (obr. 1).
Obr. 1. Schematický vztah mezi anestezií a analgezií, euanestezií a eu‑ analgezií (autor V. Rogozov) 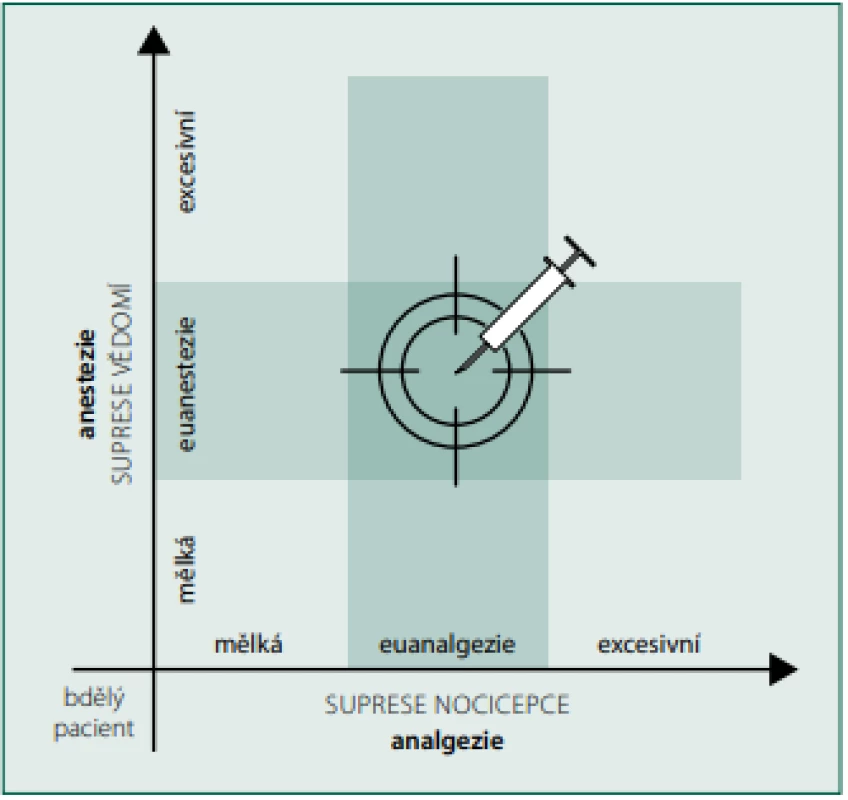
Euanestezii můžeme definovat jako reverzibilní útlum centrální nervové činnosti, který právě zajistí dostatečně hluboké bezvědomí a amnézii, euanalgezii pak jako stav, kdy dojde právě k potlačení nociceptivní odpovědi na aktuální chirurgickou stimulaci.
Toho, co lze jednoduše definovat, však lze často velmi obtížně dosáhnout. Důsledky aktuálního předávkování nebo poddávkování anestetik a/nebo analgetik v aktuálním čase a klinické situaci je něco, s čím se musí ve své denní praxi potýkat každý anesteziolog.
Pokud přihlédneme k rozvoji a pokrokům v ostatních monitorovacích metodách v medicíně, je až zarážející, nakolik je i dnes – 174 let od uvedení anestezie do klinické praxe – dosažení euanestezie a euanalgezie založeno na zkušenostech a individuálním přístupu konkrétního anesteziologa – místo aby se jednalo o exaktní zpětnovazebný systém založený na sofistikované monitoraci, podobně jako například dávkování vazopresorů dle požadované hodnoty krevního tlaku nebo myorelaxancií dle monitorované hloubky svalové relaxace.
Na tomto místě je možné s potěšením konstatovat, že otázka přístrojového měření hloubky anestezie je již technicky dostatečně uspokojivě vyřešena a na řadě pracovišť (včetně našeho) se rutinně používá. Je tedy jistě jen otázkou času a ekonomické dostupnosti, kdy se monitorace hloubky anestezie stane samozřejmostí u každého pacienta v celkové anestezii. A již nyní jsme též svědky i dalšího rozšiřování metody mimo operační sál, směrem k monitoraci hloubky sedace v intenzivní péči.
Zatímco monitorace hloubky anestezie a tedy i zpětnovazebné dávkování anestetik je technicky možné a dostupné, je zpětnovazebné dávkování analgetik na základě spolehlivé monitorace nocicepce stále nedostatečně uspokojivě prozkoumáno a uchopeno. Anesteziolog stále dávkuje opioidy na základě průběžného vyhodnocování vegetativní reaktivity a celkového stavu pacienta v kontextu okamžité klinické situace.
Důvodů pro toto historické technologické zpoždění je celá řada. Tím nejpodstatnějším je zřejmě komplexnost zkoumaného patofyziologického substrátu. Nocicepce je velmi komplexní funkcí nervového systému, probíhá na řadě úrovní – od periferních nervových zakončení po mozkovou kůru. Reakce na nocicepci je též komplexní. Fyziologickou a humorální odpověď lze sice poměrně dobře monitorovat, vegetativní projevy jsou však za prvé málo specifické a za druhé se velmi obtížně v reálném čase kvantifikují tak, aby umožňovaly okamžité zpětnovazebné dávkování analgetik.
Dalším faktorem je skutečnost, že hloubka anestezie a analgezie se navíc vzájemně ovlivňují. Vyšší koncentrace anestetika umožňuje nižší efektivní koncentraci analgetika a naopak vyšší dávka opioidů snižuje dávku inhalačního nebo intravenózního anestetika k dosažení definované monitorované hladiny útlumu mozkové činnosti. Tento vztah mezi efektivní dávkou anestetika a analgetika však není lineární a má své limity – anestetika mají minimální analgetickou potenci a na druhé straně pouze s pomocí opioidů nelze dosáhnout efektivního útlumu vědomí.
Dalším faktorem ztěžujícím monitoraci a následnou reakci na nocicepci je velká proměnlivost intenzity chirurgické stimulace. Ta se v průběhu výkonu výrazně mění, a proto i aktuální dávka analgetika k zajištění euanalgezie by ideálně měla kolísání intenzity nocicepce odrážet.
Dalším úskalím je množství proměnných, které mohou ovlivňovat farmokokinetiku a farmakodynamiku opioidů a tím i jejich efektivní plazmatickou koncentraci – věk, pohlaví, váha, výška, BMI, teplota, plazmatické bílkoviny, lékové interakce, up/down regulace opioidních receptorů apod. Existuje mnoho farmokinetických modelů, které například při TCI (Target Controlled Infusion) použití umožňují s určitou pravděpodobností dávkování opioidu s cílem dosáhnout určité plazmatické/efektivní koncentrace, vždy však jde o zjednodušení a hodnotu predikovanou. Efektivita potlačení nociceptivní reakce při zvolené definované plazmatické hladině opioidu navíc vždy záleží též na aktuální intenzitě chirurgické stimulace.
Vzhledem ke všem výše uvedeným úskalím se tedy jeví zřejmé, že ideální a jedinou spolehlivou cestou k dosažení dynamické euanalgezie (při použití v čase proměnlivého dávkování opioidů) je spolehlivé objektivní měření aktuálního stavu nociceptivní odpovědi v reálném čase.
Fakt, že zatím neexistuje spolehlivá metoda objektivního hodnocení nocicepce v reálném čase, je jistě zdrojem profesionální a intelektuální frustrace mnoha anesteziologů na celém světě.
Bolest a nocicepce
Bolest je definována jako veličina subjektivní a u efektivně anestezovaného pacienta v bezvědomí je proto neměřitelná. Nocicepce naproti tomu je objektivně existující entita představovaná komplexním fyziologickým procesem zpracování informací od periferních nervových zakončení až po centrální nervový systém.
Zatímco Montreolská deklarace jednoznačně postuluje právo na úlevu od bolesti jako jedno ze základních lidských práv, je peroperační modulace nocicepce řadou autorů pojímána méně jednoznačně – jak například dokládá koncept bezopioidové anestezie, který vychází z předpokladu, že důležitá je kontrola symptomů vyvolaných nocicepcí, nikoli kontrola nocicepce jako takové [2].
Autoři tohoto textu zastávají názor, že ovlivnění nocicepce v průběhu anestezie (a bezvědomí obecně) je jedním ze základních cílů anesteziologické péče o nemocného, a to jak z důvodů patofyziologických, tak humanitních. Nemodulovaná nocicepce provokuje řadu potenciálně negativních patofyziologických důsledků. Zároveň jsme přesvědčeni, že člověk v bezvědomí má stejná práva na efektivní potlačení excesivní nocicepce, jako člověk při vědomí.
Následující text se dále již nezabývá patofyziologickou nebo filozofickou problematikou modulování peroperační nocicepce, ale soustředí se na současné možnosti její monitorace.
Monitorace nocicepce
Ideální monitor nocicepce
Základní definice ideálního monitoru nocicepce je poměrně jednoduchá. Jedná se o zařízení, které neinvazivní metodou, kontinuálně a v reálném čase snímá, spolehlivě vyhodnocuje a zobrazuje odpověď organismu na nociceptivní dráždění.
Použití takového zařízení ke zpětnovazebnému dávkování analgetik v minimální efektivní koncentraci (euanalgezie) by umožňovalo nejenom efektivní potlačení stresové reakce na chirurgické trauma, ale umožnilo by zároveň minimalizovat nežádoucí účinky opioidů.
Byl by to důležitý krok k zpětnovazebné automatizaci postupů jak v anesteziologii, tak v intenzivní péči.
Přímé měření intenzity nociceptivního dráždění zůstává do značné míry nezodpovězenou výzvou, žádná technologie k spolehlivému měření nocicepce není zatím dostupná. Cesta k prakticky použitelnému zařízení bude proto ještě dlouhá a její směr zůstává zamlžený.
Přesto již existují komerčně vyráběné přístroje, které se snaží nociceptivní odpověď pacienta v reálném čase vyhodnocovat. Většina používaných metod je založena na hodnocení vegetativní odpovědi na nocicepci – vzestupu aktivity sympatiku a poklesu aktivity parasympatiku. Projevy změn v balanci vegetativních systémů v závislosti na chirurgické stimulaci jsou základem většiny v současnosti dostupných monitorovacích systémů.
Hodnocení klinických známek fyziologické odpovědi na nocicepci
Fyzikální vyhodnocování aktuálního stavu pacienta je nedílnou součástí kontinuální monitorace pacienta při operaci. Peroperační zvýšení srdeční frekvence, periferní cévní rezistence, dilatace zornic a pocení patří mezi klasické známky aktivace sympatiku a jsou tedy pravděpodobnými známkami probíhající aktivace nocicepce a nedostatečné analgezie.
Hodnocení kardiovaskulární odpovědi na stres má však samozřejmě řadu významných omezení. Mnoho léků a aktuální stav hemodynamických determinant mohou sympatickou reakci mimikovat nebo zcela zastírat – například betablokátory, vazodilatancia, vagolytika, sympatomimetika, kardiostimulace, hypovolémie, srdeční selhání, vazoplegie a podobně.
Hodnocení humorální odpovědi na nocicepci
Bylo opakovaně prokázáno, že míra farmakologické suprese nocicepce koreluje s humorální odpovědí na peroperační stres. Pokud dojde vlivem neadekvátní analgezie k aktivaci sympatikoadrenální odpovědi, dojde k vzestupu plazmatických hladin kortizolu, noradrenalinu, adrenalinu, adrenokortikotropního hormonu a jiných. Zvýšená plazmatická hodnota těchto látek koreluje s výskytem některých perioperačních komplikací. Laboratorní analýza plazmatických hladin však není kvůli své časové prodlevě pro zpětnovazebné dávkování opioidů v reálném čase použitelná [3, 4, 5].
Analgesia Nociception Index
Analgesia Nociception Index je technologie vyvinutá a vyráběná výrobcem Mdoloris Medical System, Lille, Francie. Pod zkratkou počátečních písmen ANI je prezentována bezjednotková hodnota vyjádřená číselnou řadou od 0 do 100. Index je derivován z kontinuální analýzy pulzové variability v průběhu respiračního cyklu, která se snaží kvantifikovat relativní změny parasympatického tonu. Výrobce deklaruje, že vyšší ANI skóre odpovídá vyšší parasympatomimetické aktivitě, tedy i menší odpovědi na stres, a tedy i nižšímu nociceptivnímu dráždění. Cílenou hodnotou je ANI nad 50 [6].
Metoda byla zkoušena na pacientech anestezovaných, sedovaných i na pacientech při vědomí, její praktické využití je však limitováno malou specificitou a senzitivitou.
V jedné studii byla nalezena poměrně vysoká negativní prediktivní hodnota pro pooperační bolest, kdy ANI skóre nad 57 s 86% senzitivitou a specificitou predikovalo absenci intenzivní bolesti (více než 3 body v 10stupňové analogové škále bolesti) [7]. I další studie provedená u pacientů v intenzivní péči ukázala silnou negativní prediktivní hodnotu ANI, kdy hodnota indexu nad 43 vylučovala přítomnost intenzivní bolesti [8].
Několik následných studií však souvislost mezi hodnotou ANI a hladinou pooperační bolesti již neprokázaly [9, 10, 11].
V jiné studii u dobrovolníků při vědomí pak ANI selhal v rozlišení reálného a předstíraného nociceptivního stimulu. Ukázalo se, že ANI je zřejmě velmi ovlivnitelný současně probíhajícími emocemi [12].
Skóre ANI navíc mohou ovlivňovat arytmie, apnoe či bradypnoe. Jedna studie pak prokázala vyšší ANI skóre u hypnotizovaných dospělých dobrovolníků oproti plně vědomému stavu [13].
Co se týče hodnocení nocicepce u anestezovaných pacientů, několik studií porovnávalo ANI s klasickým hodnocením změn hemodynamické odpovědi [14].
Přestože některé výsledky potvrdily mírnou reaktivitu ANI v souvislosti s nocicepcí, celková výpovědní hodnota tohoto indexu byla „přinejmenším stejně dobrá“ jako sledování změn krevního tlaku a pulzu [16].
Zklamáním bylo i studium ANI ve schopnosti předpovědět hemodynamické změny v průběhu operace. Dle jedné práce se prediktivní schopnost ANI blížila pravděpodobnosti hodu mincí [17].
Peroperační použití ANI jako zpětnovazebné metody k dávkování analgetik přineslo též nejednoznačné výsledky. Ačkoliv v jedné práci použití ANI vedlo k mírnému snížení dávky opioidů [18], jiné práce neprokázaly souvislost mezi dávkováním opioidů řízeného dle ANI a výskytem nežádoucích účinků opioidů [19, 20].
I zpětná analýza dat dosud provedených randomizovaných studií (v počtu 12) ukázala, že zpětnovazebné dávkování opioidů dle indexu ANI nevedlo ke statisticky významnému rozdílu v dávce použitých opioidů. Většina zahrnutých studií však byly monocentrické, s malým počtem pacientů a značnou variabilitou v operacích i anesteziologických technikách [21].
Použití a úloha ANI v predikci hemodynamických změn a hodnocení nociceptivní stimulace v průběhu operace zůstávají tedy velmi nejednoznačné. Jakkoli se podařilo u pacientů při vědomí prokázat, že hodnota ANI nad 50 má negativní prediktivní hodnotu pro absenci akutní pooperační bolesti a také bolesti u pacientů na jednotce intenzivní péče, v současnosti neexistuje relevantní důvod pro použití této metody v klinické anesteziologické praxi.
Změny kožní vodivosti
Skin conductance technologie je produktem společnosti MedStorm Innovations, Oslo, Norsko.
Princip metody je známý již dlouho. Aktivita potních žlázek dlaní a chodidel je úměrná sympatomimetickému tonu a změna kožní vodivosti proto může být známkou jeho měnící se aktivity. Změny kožní vodivosti v závislosti na stresu jsou již dlouho využívány například u tzv. „detektoru lži“, který umožňuje stanovit časové body, kdy došlo k aktivaci sympatiku. Ani u této metody nejde tedy o přímé měření nocicepce, ale o měření jednoho z projevů aktivity sympatiku. Monitory založené na tomto principu měří změny kožní vodivosti mezi elektrodami umístěnými na dlaň u dospělých nebo na chodidlo u dětí. Výstupním parametrem je počet mikro-fluktuací kožní vodivosti za sekundu, tzv. NFSC (skin conductance fluctuations per second). Hodnota NFSC může korelovat s výraznou pooperační bolestí, zároveň však také může být ovlivněna úzkostí a hlukem [22]. Co se týče monitorace peroperační nocicepce, byla prokázaná korelace stresové odpovědi s aktuální hodnotou NFSC [23].
Hodnota NFSC však může být také ovlivněna současnou neadekvátně mělkou anestezií a navíc nereflektuje prohloubení analgezie po podání fentanylu. Další limitací metody je to, že hodnotu NFSC ovlivňuje hypotermie [24].
V současnosti tedy není evidence, která by prokazovala klinický přínos měření kožní vodivosti v monitoraci peroperační nocicepce. Zajímavé je snad to, že se tento princip stal součástí multimodálního parametru NOL index (viz níže).
Pupilometrie
Pupilometrie je metodou využívanou přístrojem AlgiScan společnosti IDMed z Marseille ve Francii. Opět tedy nejde o monitoraci nocicepce jako takové, ale o vegetativní projevy. Zornice jsou výrazně ovlivňovány rovnováhou mezi sympatickým a parasympatickým tonem. Změny průměru zornic a variabilita změn jsou proto též zkoušeny jako metoda peroperační predikce nocicepce nebo pooperační bolesti. Dle výrobce se za signifikatní změnu považuje změna průměru zornice o více než 30 %. Data z jedné studie například prokázala, že pokud bylo peroperační dávkování remifentanilu během gynekologických operací zpětnovazebně řízeno dle pupilometrie, vedla tato technika ke snížení použité dávky remifentanilu. Zároveň však tato skupina vyžadovala vyšší peroperační dávkování antihypertenziva nicardipinu. Vedlejším zajímavým nálezem studie pak bylo, že 3 měsíce po operaci měla skupina pacientů s pupilometrií menší incidenci pooperační bolesti oproti kontrolní skupině (13 % oproti 51 %) [25].
Pupilometrie byla zkoušena i v intenzivní péči, kde například potvrdila určitou prediktivní hodnotu reakce na endotracheální odsávání. I přes její schůdně použití v podmínkách intenzivní péče však výsledky použití této metody v predikci nocicepce zatím nejsou jednoznačně přesvědčivé [26, 27].
Peroperační pupilometrie má v hodnocení nociceptivní odpovědi a kvality peroperační analgezie samozřejmě řadu limitací. Jednou z nich je například to, že zornice je ovlivňována i hloubkou anestezie, nikoli pouze úrovní analgezie [28].
Ti starší z nás si jistě ještě vzpomínají na Guedelovo schéma hloubky anestezie, kde stav zornic byl jedním z hodnocených klinických kritérií. Metodu ovlivňuje i vlastní vliv opioidů na zornici a tento fakt peroperační použití pupilometrie ještě více zamlžuje.
Celkově lze shrnout, že data hodnotící metodu pupilometrie v monitoraci nocicepce jsou objemově malá a nekonzistentní. I pro tuto metodu tedy můžeme uzavřít, že pro její klinické použití k monitoraci peroperační nocicepce zatím neexistuje dostatečná evidence.
Kardiovaskulární hodnocení hloubky analgezie, kardiovaskulární index
Cardiovascular depth of analgesia je technologie používaná přístrojem CARDEAN, který je vyráběný firmou Alpha-2 v Lyonu ve Francii. Podstatou technologie je analýza reakce tepové frekvence na zvýšení krevního tlaku. V podmínkách vegetativní rovnováhy dojde i po malém zvýšení krevního tlaku vlivem kardiálního baroreflexu ke snížení tepové frekvence měřitelné prodloužením R-R intervalu. Pokud je malé zvýšení krevního tlaku naopak následováno zkrácením R-R intervalu, usuzují autoři technologie, že došlo k potlačení kardiálního reflexu a vzrůstá pravděpodobnost peroperačního pohybu pacienta. Technologie Cardean využívá pro analýzu monitoraci EKG a neinvazivně snímanou pulzovou křivku. Hodnota indexu nad 60 dle výrobců znamená inhibici kardiálního baroreflexu.
Co se týče peroperačního použití této metody, existuje pouze velmi limitovaná evidence. Hned první studie například prokázala, že dávkování opioidů dle monitoru Cardean výrazně snížilo incidenci pohybů pacienta (o 51 %). Práce však měla řadu metodologických slabin [29].
Jiná studie zkoumala reaktivitu přístroje Cardean na kožní incizi u dvou skupin pacientů lišících se podávanou dávkou remifentanilu (2 ng/ml versus 4 ng/ml). Zatímco ve skupině s nižší dávkou opioidu Cardean index stoupl signifikantně, ve skupině s vyšší dávkou k signifikantnímu nárůstu nedošlo [30].
I tato technologie má však řadu limitací v použití, protože je ovlivněna přítomností arytmií, vazokonstrikce nebo hypovolémie.
Nocicepční flekční reflex (Nociception Flexion Reflex)
Další komerčně vyráběný přístroj zkoušený k monitoraci nocicepce je NFTS Paintracker, jež produkuje firma Dolosys sídlící v Berlíně. Technologie využívá existence nocicepčního flekčního reflexu, který je také znám jako tzv. RIII reflex. Jedná se o polysynaptický míšní reflex, který je vyvolán po aktivaci nociceptivních A delta aferentních vláken. Kvantifikační kalibrace pro vyvolání reflexu se provádí vyhodnocením elektromyografické aktivity musculus biceps femoris během aplikace elektrických stimulů různé intenzity na nervus suralis. Intenzita stimulace potřebná k vyvolání NFR reflexu je potom brána jako práh vyvolání nociceptivní odpovědi [31].
Koncept prahu pro NFR se liší od ostatních metod založených na hodnocení příznaků změny tonu vegetativního nervového systému a potenciálně tedy nabízí zajímavou alternativu, která je nezávislá na řadě faktorů spoluovlivňujících sympatomimetické a parasympatomimetické projevy. Technicky je však metoda daleko náročnější než ostatní metody a navíc vyžaduje přístup k pacientově noze.
Práh pro vyvolání NFR se může zvyšovat po prohloubení analgezie a bylo též prokázáno, že může predikovat náhlý pohyb jako odpověď na nociceptivní stimulus. Nicméně pravděpodobnost této predikce nebyla opět o mnoho větší než pravděpodobnost hodu mincí [32].
Existují sice i další studie zabývající se touto metodou v klinických podmínkách, jejich počet je však omezený, počet pacientů malý a výsledky diskutabilní. Ani tato metoda proto v současnosti nepředstavuje použitelnou klinickou alternativu měření nocicepce a zůstává spíše metodou experimentální s nutností dalšího ověřování jejího použití.
Chirurgický pletysmografický index (Surgical Pleth Index)
Chirurgický pletysmografický index, Surgical Pleth Index, SPI, je technologie společnosti GE Healthcare, Helsinky, Finsko. Parametr SPI je derivován z amplitudy pulzové křivky pulzového intervalu, veškerá data jsou proto jednoduše získávána z analýzy křivky pulzní oxymetrie. Jedná se v podstatě o kombinaci hodnocení periferní vazokonstrikce a srdečního autonomního tonu. Výrobcem publikovaná rovnice výpočtu indexu je následující SPI = 100 – (0,7 × PPGAnorm + 0,3 × HBInorm), kde PPGAnorm je normalizovaná amplituda pulzové vlny a HBInorm je normalizovaný pulzový interval. SPI se pohybuje v rozmezí 0 až 100 a nižší hodnoty by měly indikovat nižší peroperační stres. Výrobce doporučuje udržovat tento index v průběhu operace pod hodnotou 50. V řadě prací bylo rozmezí indexu 20–50 popsáno jako akceptovatelná hladina analgezie.
Evidence pro požadované rozmezí SPI indexu v hodnotách 20–50 však není robustní. Dvě studie stanovily, že ideální požadovaná hladina SPI může být výrazně ovlivněna věkem, a že by měla být pravděpodobně nižší, tj. 30 a méně. Dostačující analgezie tak může pravděpodobně odpovídat nižším skóre SPI [33, 34].
V průběhu operace změny SPI reflektují změnu stimulace, aktuální klinický přínos však zůstává nevyjasněný. Při totální intravenózní anestezii použití SPI řízené analgezie snížilo dávku použitého propofolu a zkrátilo dobu probouzení [35]. Na druhou stranu tento efekt nebyl pozorován při použití plynných anestetik [36]. U dětí navíc analgezie řízená dle hodnot SPI (ve srovnání se standardní praxí) vedla pooperačně k větší agitaci a vyšší spotřebě opioidů [37].
Nedávná metaanalýza zahrnující celkem 463 pacientů sice vedla k závěrům, že analgezie řízená dle SPI vedla k významně nižší spotřebě opioidů a k urychlení extubace, nicméně se jednalo o analýzu pouze malého počtu prací (šest) s velkou heterogenitou použitých anesteziologických technik a výsledky tak jsou diskutabilní [38].
Zajímavé výsledky přinesla nedávná studie skupiny pacientů s polytraumatem. Z analýzy vyplývá, že jak potřeba vazopresorů, tak potřeba opioidů byla nižší, pokud byla analgezie řízena kombinací parametrů SPI a Entropy (i když z výsledků není zcela jisté, který z parametrů byl za výsledek více zodpovědný) [39]. V podmínkách probouzení po operaci nebo při vědomí nemá tento index jako nociceptivní nebo bolest monitorující parametr žádnou výpovědní hodnotu. Výrobce použití SPI u bdělých pacientů nedoporučuje [40].
Lze tedy shrnout, že SPI je zajímavou metodou, která (při použití GE monitoru) nevyžaduje žádný spotřební materiál. Existuje určitá evidence, že SPI řízená analgezie může snížit spotřebu opioidů a zkrátit čas intubace. Existují však i nejednoznačné výsledky, a pro přesnější určení úlohy SPI v rutinním klinickém použití je proto potřeba její další studium.
Index qNOX
Nedávno byl uveden na trh přístroj se zajímavým konceptem pod názvem CONOX společnosti Quantium Medical, Mataro, Španělsko. Přístroj pomocí jedné elektrody snímá EEG a EMG signál z oblasti čela a spánku. Obrazovka přístroje pak zobrazuje dva bezjednotkové indexy, jež mají oba rozsah od 0 do 99. Prvním indexem je qCON, což je procesovaný derivát EEG vln a je deklarován jako ukazatel hloubky anestezie. Při srovnání s jinými přístroji monitorace hloubky anestezie koreluje qCON s ostatními technologiemi poměrně dobře [41]. Index qNOX by měl být naproti tomu odrazem hloubky analgezie. Je derivován pomocí matematického modelu z EEG a EMG (obličejových svalů) a měl by odrážet pravděpodobnost motorické odpovědi na nociceptivní stimulus. Dle výrobce je pravděpodobnost odpovědi na nociceptivní stimulus velmi málo pravděpodobná, pokud je qNOX pod 40, málo pravděpodobná při qNOX v rozmezí 40–60 a více pravděpodobná při qNOX nad 60. V jedné studii zkoumající odpověď pacientů ve vztahu k indexu qNOX při zajištění dýchacích cest (laryngeální maska, přímá laryngoskopie, tracheální intubace) byla použita totální intravenózní anestezie bez signifikantních rozdílů v plazmatické koncentraci remifentanilu a propofolu v místě účinku. Pacienti, kteří na anesteziologickou manipulaci v dýchacích cestách reagovali, měli signifikantně vyšší qNOX skóre než ti, kteří na stimulaci nereagovali: LM 62,5 oproti 45,2, ETI 58,7 oproti 41,4, laryngoskopie 54,1 oproti 41,0 [41].
V jiné studii se 140 pacienty se podařilo doložit, že oba indexy qCON a qNOX nebyly identické, reagovaly na jiné podněty a v jiných časových souvislostech. Autoři práce uzavírají, že oba tyto indexy by skutečně mohly odrážet vztah k různým veličinám – anestezii a analgezii [42].
Celkově se tedy dá shrnout, že qNOX je zajímavou alternativou měření pravděpodobnosti nociceptivní odpovědi, protože technologie není založena na měření projevů autonomní nervové aktivity.
Nezodpovězenou otázkou zůstává, nakolik bude EMG složka indexu ovlivněna při současném použití svalových relaxancií. K definitivnímu popisu úlohy indexu qNOX při monitoraci nocicepce v klinické praxi bude ještě zapotřebí daleko více relevantní evidence.
Index NOL
Technologie NOL izraelské společnosti Medasense nabízí oproti ostatním metodám skutečnou multimodální metodu. V současné době se jedná o jediný komerčně vyráběný přístroj, který je určen ke skórování nocicepce a/nebo bolesti pomocí multimodálního snímače. Snímač se v podobě klipu umísťuje na prst (podobně jako u pulzní oxymetrie) a umožňuje snímat čtyři parametry: fotopletysmografii, galvanickou vodivost kůže, teplotu a akcelerometrii. Firemní algoritmus potom všechny údaje zpracuje do koncového bezrozměrného indexu v rozmezí od 0 do 100. Práce publikovaná v roce 2015 prokázala, že při totální intravenózní anestezii reaguje index NOL na nociceptivní podněty citlivěji než změny pulzu nebo středního arteriálního tlaku [43].
Autoři zároveň doporučili, že hodnota indexu NOL v rozmezí 10–25 byla adekvátní úrovní pro udržování analgezie infuzí remifentanilu v průběhu celkové anestezie. I následný výzkum potvrdil, že index NOL reaguje na nocicepci citlivěji než tepová frekvence a střední arteriální tlak [44].
V roce 2018 byly uveřejněny dvě práce studující technologii indexu NOL. První práce porovnávala reakci anestezovaných pacientů na kožní řez a doložila, že index NOL stoupl méně u pacientů se současnou epidurální analgezií, než už pacientů bez epidurální analgezie (o 5,4 bodu oproti 13,9 bodu) [45]. V dalším výzkumu byl pak index NOL srovnáván s ANI a „klasickými“ hemodynamickými známkami v hodnocení odpovědi na nocicepci při anestezii desfluranem a remifentanilem. NOL a ANI se ukázaly být mírně citlivější než změny pulzu nebo tlaku [46].
Pouze jediná studie zatím srovnávala zpětnovazebné podávání opioidů dle indexu NOL (cílová hladina 10–25) oproti standardní technice podávání založené na hodnocení hemodynamické odpovědi. Tato práce prokázala snížení dávky remifentanilu o 28 % a větší hemodynamickou stabilitu, pokud byl remifentanil dávkován zpětnovazebně dle indexu NOL [47].
Je tedy možné shrnout, že technologie NOL představuje zajímavou komerčně vyráběnou alternativu měření nocicepce v průběhu anestezie. Její význam pro klinické použití však zůstává stále nejasný a bude vyžadovat další a na výrobci plně nezávislý výzkum.
Shrnutí
Na závěr tedy můžeme shrnout, že v současnosti již existuje řada komerčně dostupných metod, které se snaží hodnotit úroveň nocicepce u pacientů v celkové anestezii objektivním přístrojovým měřením fyziologických funkcí (tab. 1).
Tab. 1. Přehled dostupných přístrojových metod hodnocení nocicepce 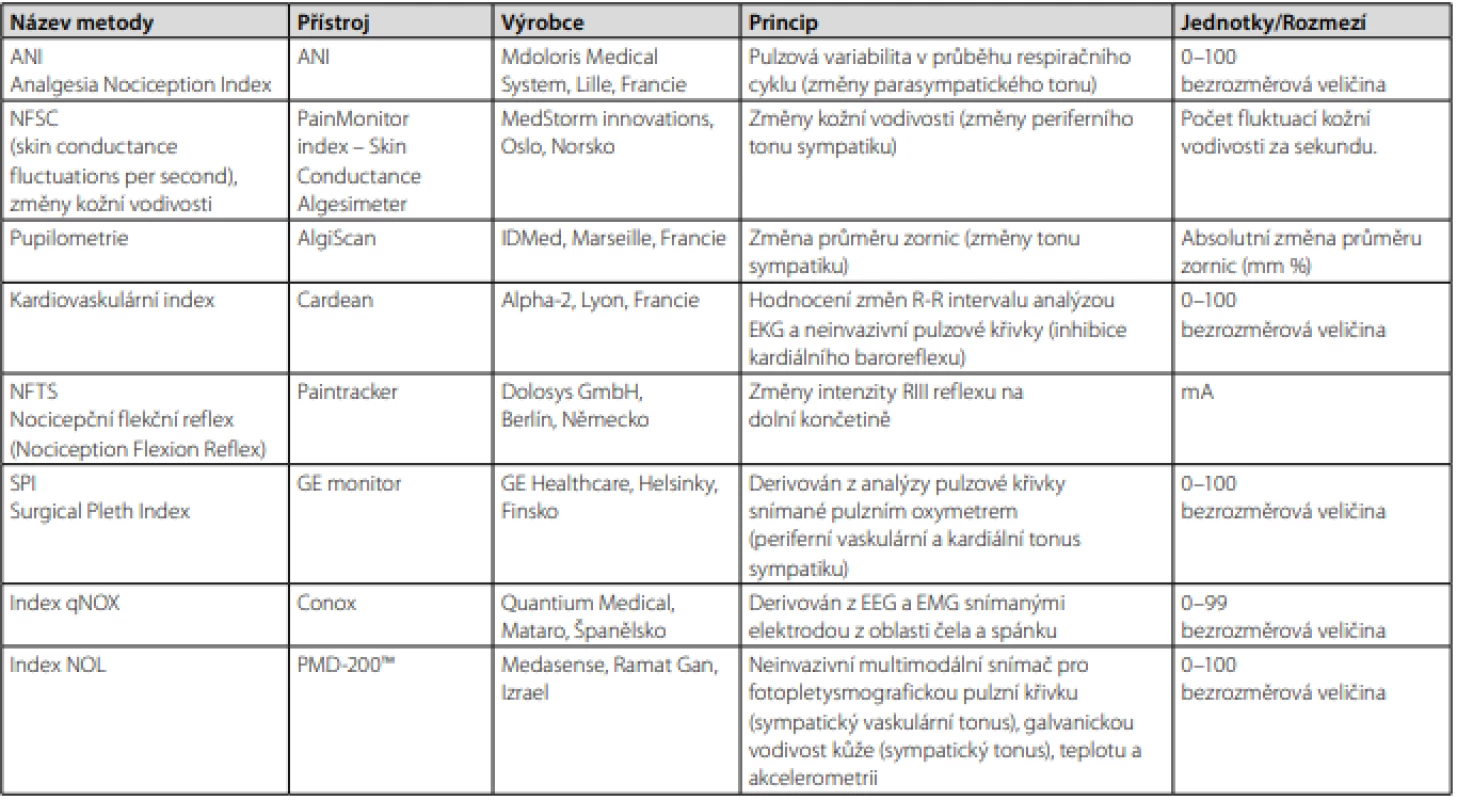
Metaanalýza sedmi randomizovaných klinických studií publikovaná před třemi lety nenašla významný vliv použití existující monitorace nocicepce na peroperační spotřebu opioidů [48].
Naproti tomu výsledky metaanalýzy z loňského roku zahrnující deset klinických studií používajících ANI, SPI nebo pupilometrii podpořily předpoklad, že zpětnovazebně (pomocí monitoru) řízená analgezie snižuje dávku použitého opioidu (statisticky prokazatelně pro SPI) oproti dávkování klasickým klinickým hodnocením vegetativní odpovědi [49].
Přestože tedy řada prací deklaruje určitý přínos existujících technologií monitorace nocicepce oproti průběžnému vyhodnocování „klasických“ známek aktivace sympatického systému, na potvrzení jejich skutečného přínosu pro klinickou praxi zatím stále čekáme.
Je navíc velmi pravděpodobné, že cestu ke spolehlivému monitoru nocicepce ukáže až zcela jiná technologie. Neexistence dostatečně specifické a senzitivní technologie měření nocicepce je proto stále limitujícím faktorem i pro koncept objektivní individualizované euanalgezie.
PROHLÁŠENÍ AUTORŮ:
Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Střet zájmů: Autoři uvádějí, že článek je napsán v rámci postgraduálního studia, jehož součástí je výzkumný projekt podpořený Specifickým vysokoškolským výzkumem (260530/SVV/2020) a UNCE (UNCE /MED/002).
Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. Článek vytvořil korespondující autor, spoluautor článek připomínkoval.
Financování: Žádné.
KORESPONDENČNÍ ADRESA AUTORA:
Článek přijat redakcí: 6. 8. 2020;
Článek přijat k tisku: 14. 10. 2020;
MUDr. Vladislav Rogozov,
Cit. zkr: Anest intenziv Med. 2020; 31(5): 225–232
Zdroje
1. Naguib AN, Tobias JD, Hall MW, Cismowski MJ, Yongjie M, N´diris B, et al. The role of different anesthetic techniques in altering the stress response during cardiac surgery in children: a prospective, double-blinded, and randomized study. Pediatr Crit Care Med. 2013; 14(5): 481–490. doi:10.1097/PCC.0b013e31828a742c
2. Forget P. Opioid-free anaesthesia. Why and how? A contextual analysis. Anaesth Crit Care Pain Med. 2019; 38(2): 169–172. doi:10.1016/j.accpm.2018.05.002
3. Rogozov V, Matloch Z. Sufentanil reduces the stress response measured by levels of plasma cortisol in the pre-bypass phase in adult patients undergoing cardiac surgery. European Journal of Anaesthesiology 2005; 22 : 36–37.
4. Winterthaler M, Brandl K, Rahe-Meyer N, Osthaus A, Hecker H, Hagl C, et al. Endocrine stress response and inflammatory activation during CABG surgery. A randomized trial comparing remifentanil infusion to intermittent fentanyl. Eur J Anaesthesiol. 2008; 25(4): 326–335. doi:10.1017/S0265021507003043
5. Winterthaler M, Brandl K, Rahe-Meyer N, Osthaus A, Hecker H, Hagl C, et al. Comparing the Effects of Isoflurane-Sufentanil Anesthesia and Propofol-Sufentanil Anesthesia on Serum Cortisol Levels in Open Heart Surgery with Cardiopulmonary Bypass. Anesth Pain Med. 2016; 6(6): e42066. Published 2016 Nov 21. doi:10.5812/aapm.42066
6. Jeanne M, Clément C, De Jonckheere J, Logier R, Tavernier B. Variations of the analgesia nociception index during general anaesthesia for laparoscopic abdominal surgery. J Clin Monit Comput. 2012; 26(4): 289–294. doi:10.1007/s10877-012-9354-0
7. Boseli E, Daniela-Ionescu M, Bégou G, Bouvet L, Dabouz R, Magnin C, et al. Prospective observational study of the non-invasive assessment of immediate postoperative pain using the analgesia/nociception index (ANI). Br J Anaesth. 2013; 111(3): 453–459. doi:10.1093/bja/aet110
8. Chanques G, Tarri T, Ride A, Prades A, De Jong A, Carr J, et al. Analgesia nociception index for the assessment of pain in critically ill patients: a diagnostic accuracy study. Br J Anaesth. 2017; 119(4): 812–820. doi:10.1093/bja/aex210
9. Ledowski T, Tiong WS, Lee C, Wong B, Fiori T, Parker N. Analgesia nociception index: evaluation as a new parameter for acute postoperative pain. Br J Anaesth. 2013; 111(4): 627–629. doi:10.1093/bja/aet111
10. Yan Q, An HY, Feng Y. Pain assessment in conscious healthy volunteers: a crossover study evaluating the analgesia/nociception index. Br J Anaesth. 2017; 118(4): 635–636. doi:10.1093/bja/aex061
11. Issa R, Julien M, Décary E, Verdonck O, Fortier LP, Drolet P, et al. Evaluation of the analgesia nociception index (ANI) in healthy awake volunteers. Évaluation de l’indice ANI (analgesia nociception index) chez des volontaires sains éveillés. Can J Anaesth. 2017; 64(8): 828–835. doi:10.1007/s12630-017-0887-z
12. Jess G, Pogatzki-Zahn EM, Zahn PK, Meyer-Frießem CH. Monitoring heart rate variability to assess experimentally induced pain using the analgesia nociception index: A randomised volunteer study. Eur J Anaesthesiol. 2016; 33(2): 118–125. doi:10.1097/EJA. doi: 0000000000000304
13. Boselli E, Musellec H, Bernard F, Guillou N, Hugot P, Augris-Mathieu C, et al. Effects of conversational hypnosis on relative parasympathetic tone and patient comfort during axillary upper limb surgery:A Quasiexperimental Pilot Study. Int J Clin Exp Hypn. 2018; 66(2): 134–146. doi:10.1080/00207144.2018.1421355
14. Jeanne M, Clément C, De Jonckheere J, Logier R, Tavernier B. Variations of the analgesia nociception index during general anaesthesia for laparoscopic abdominal surgery. J Clin Monit Comput. 2012; 26(4): 289–294. doi:10.1007/s10877-012-9354-0
15. Yan Q, An HY, Feng Y. Pain assessment in conscious healthy volunteers: a crossover study evaluating the analgesia/nociception index. Br J Anaesth. 2017; 118(4): 635–636. doi:10.1093/bja/aex061
16. Kommula LK, Bansal S, Umamaheswara Rao GS. Analgesia Nociception Index Monitoring During Supratentorial Craniotomy. J Neurosurg Anesthesiol. 2019; 31(1): 57–61. doi:10.1097/ANA.0000000000000464
17. Ledowski T, Averhoff L, Tiong WS, Lee C. Analgesia Nociception Index (ANI) to predict intraoperative haemodynamic changes: results of a pilot investigation. Acta Anaesthesiol Scand. 2014; 58(1): 74–79. doi:10.1111/aas.12216
18. Deccache G, Caspersen E, Pegoix M, Monthé-Sagan K, Berger L, Fletcher D, et al. A targeted remifentanil administration protocol based on the analgesia nociception index during vascular surgery. Anaesth Crit Care Pain Med. 2017; 36(4): 229–232. doi:10.1016/j. accpm.2016.08.006
19. Le Gall L, David A, Carles P, Leuillet S, Chastel B, Fleureau C, et al. Benefits of intraoperative analgesia guided by the Analgesia Nociception Index (ANI) in bariatric surgery: An unmatched case-control study. Anaesth Crit Care Pain Med. 2019; 38(1): 35–39. doi:10.1016/j. accpm.2017.09.004
20. Szental JA, Webb A, Weeraratne C, Campbell A, Sivakumar H, Leong S. Postoperative pain after laparoscopic cholecystectomy is not reduced by intraoperative analgesia guided by analgesia nociception index (ANI®) monitoring: a randomized clinical trial. Br J Anaesth. 2015; 114(4): 640–645. doi:10.1093/bja/aeu411
21. Meijer FS, Niesters M, Velzen M, Martini CH, Olofsen E, Edry R, et al. Does nociception monitor-guided anesthesia affect opioid consumption? A systematic review of randomized controlled trials. J Clin Monit Comput. 2020; 34(4): 629–641. doi:10.1007/s10877-019-00362-4
22. Ledowski T, Ang B, Schmarbeck T, Rhodes J. Monitoring of sympathetic tone to assess postoperative pain: skin conductance vs surgical stress index. Anaesthesia. 2009; 64(7): 727–731. doi:10.1111/j.1365-2044.2008.05834.x
23. Gjerstad AC, Storm H, Hagen R, Huiku M, Qvigstad E, Raeder J. Comparison of skin conductance with entropy during intubation, tetanic stimulation and emergence from general anaesthesia. Acta Anaesthesiol Scand. 2007; 51(1): 8–15. doi:10.1111/j.1399-6576.2006.01189.x
24. Ledowski T, Pascoe E, Ang B, Schmarbeck T, Clarke MW, Fuller C, et al. Monitoring of intra-operative nociception: skin conductance and surgical stress index versus stress hormone plasma levels. Anaesthesia. 2010; 65(10): 1001–1006. doi:10.1111/j.1365-2044.2010.06480.x
25. Sabourdin N, Barrois J, Louvet N, Rigouzzo A, Guye ML, Dadure C, et al. Pupillometry-guided Intraoperative Remifentanil Administration versus Standard Practice Influences Opioid Use: A Randomized Study. Anesthesiology. 2017; 127(2): 284–292. doi:10.1097/ ALN.0000000000001705
26. Paulus J, Roquilly A, Beloeil H, Théraud J, Asehnoune K, Lejus C. Pupillary reflex measurement predicts insufficient analgesia before endotracheal suctioning in critically ill patients. Crit Care. 2013; 17(4): R161. Published 2013 Jul 24. doi:10.1186/cc12840
27. Wildemeersch D, Gios J, Jorens PG, Hans GH. Objective Nociceptive Assessment in Ventilated ICU Patients: A Feasibility Study Using Pupillometry and the Nociceptive Flexion Reflex. Journal of Visualized Experiments: Jove. 2018 Jul(137). doi: 10.3791/57972.
28. Sabourdin N, Peretout JB, Khalil E, Guye ML, Louvet N, Constant I. Influence of Depth of Hypnosis on Pupillary Reactivity to a Standardized Tetanic Stimulus in Patients Under Propofol-Remifentanil Target-Controlled Infusion: A Crossover Randomized Pilot Study. Anesthesia and Analgesia. 2018 Jan; 126(1): 70–77. doi: 10.1213/ane.0000000000001802.
29. Martinez JY, Wey PF, Lions C, Cividjian A, Rabilloud M, Bissery A, et al. A beat-by-beat cardiovascular index, CARDEAN: a prospective randomized assessment of its utility for the reduction of movement during colonoscopy. Anesth Analg. 2010; 110(3): 765–772. doi:10.1213/ANE.0b013e3181cc9ebe
30. Rossi M, Cividjian A, Fevre MC, Oddoux ME, Carcey J, Halle C, et al. A beat-by-beat, on - -line, cardiovascular index, CARDEAN, to assess circulatory responses to surgery: a randomized clinical trial during spine surgery. J Clin Monit Comput. 2012; 26(6): 441–449. doi:10.1007/s10877-012-9372-y
31. Rhudy JL, France CR. Defining the nociceptive flexion reflex (NFR) threshold in human participants: a comparison of different scoring criteria. Pain. 2007; 128(3): 244–253. doi:10.1016/j.pain.2006.09.024
32. Jakuscheit A, Posch MJ, Gkaitatzis S, Neumark L, Hackbarth M, Schneider M, et al. Utility of nociceptive flexion reflex threshold and bispectral index to predict movement responses under propofol anaesthesia. Somatosens Mot Res. 2017; 34(2): 139–144. doi:10.1 080/08990220.2017.1343189
33. Ledowski T, Sommerfield D, Slevin L, Conrad J, von Ungern-Sternberg BS. Surgical pleth index: prediction of postoperative pain in children?. Br J Anaesth. 2017; 119(5): 979 – 983. doi:10.1093/bja/aex300
34. Ledowski T, Burke J, Hruby J. Surgical pleth index: prediction of postoperative pain and influence of arousal. Br J Anaesth. 2016; 117(3): 371–374. doi:10.1093/bja/aew226
35. Bergmann I, Göhner A, Crozier TA, Hesjedal B, Wiese CH, Popov AF, et al. Surgical pleth index-guided remifentanil administration reduces remifentanil and propofol consumption and shortens recovery times in outpatient anaesthesia. Br J Anaesth. 2013; 110(4): 622–628. doi:10.1093/bja/aes426
36. Gruenewald M, Willms S, Broch O, Kott M, Steinfath M, Bein B. Sufentanil administration guided by surgical pleth index vs standard practice during sevoflurane anaesthesia: a randomized controlled pilot study. Br J Anaesth. 2014; 112(5): 898–905. doi:10.1093/bja/aet485
37. Park JH, Lim BG, Kim H, Lee IO, Kong MH, Kim NS. Comparison of Surgical Pleth Index-guided Analgesia with Conventional Analgesia Practices in Children: A Randomized Controlled Trial. Anesthesiology. 2015; 122(6): 1280–1287. doi:10.1097/ALN.doi:10.1097/ ALN.0000000000000650
38. Won YJ, Lim BG, Kim YS, Lee M, Kim H. Usefulness of surgical pleth index-guided analgesia during general anesthesia: a systematic review and meta-analysis of randomized controlled trials. J Int Med Res. 2018; 46(11): 4386–4398. doi:10.1177/0300060518796749
39. Rogobete AF, Sandesc D, Cradigati CA, Sarandan M, Papurica M, Popovici SE, et al. Implications of Entropy and Surgical Pleth Index-guided general anaesthesia on clinical outcomes in critically ill polytrauma patients. A prospective observational non-randomized single centre study [retracted in: J Clin Monit Comput. 2020 Jun; 34(3): 619]. J Clin Monit Comput. 2018; 32(4): 771–778. doi:10.1007/s10877-017-0059-2
40. Ledowski T, Burke J, Hruby J. Surgical pleth index: prediction of postoperative pain and influence of arousal. Br J Anaesth. 2016; 117(3): 371–374. doi:10.1093/bja/aew226
41. Jensen EW, Valencia JF, López A, Anglada T, Agustí M, Ramos Y et al. Monitoring hypnotic effect and nociception with two EEG-derived indices, qCON and qNOX, during general anaesthesia. Acta Anaesthesiol Scand. 2014; 58(8): 933–941. doi:10.1111/aas.12359
42. Melia U, Gabarron E, Agustí M, Souto N, Pineda P, Fontanet J, et al. Comparison of the qCON and qNOX indices for the assessment of unconsciousness level and noxious stimulation response during surgery. J Clin Monit Comput. 2017; 31(6): 1273–1281. doi:10.1007/ s10877-016-9948-z
43. Martini CH, Boon M, Broens SJ, Hekkelman EF, Oudhoff LA, Buddeke AW, et al. Ability of the nociception level, a multiparameter composite of autonomic signals, to detect noxious stimuli during propofol-remifentanil anesthesia. Anesthesiology. 2015; 123(3): 524–534. doi:10.1097/ALN.0000000000000757
44. Edry R, Recea V, Dikust Y, Sessler DI. Preliminary Intraoperative Validation of the Nociception Level Index: A Noninvasive Nociception Monitor. Anesthesiology. 2016; 125(1): 193–203. doi:10.1097/ALN.0000000000001130
45. Bollag L, Jelacic S, Delgado Upegui C, Wu C, Richebe P. The nociception level index (NOL) response to intubation and incision in patients undergoing video-assisted thoracoscopic surgery (VATS) with and without thoracic epidural analgesia. A pilot study. F1000Res. 2018; 7 : 875. Published 2018 Jun 22. doi:10.12688/f1000research.15279.1
46. Stöckle PA, Julien M, Issa R, Décary E, Brulotte V, Drolet P, et al. Validation of the PMD100 and its NOL Index to detect nociception at different infusion regimen of remifentanil in patients under general anesthesia. Minerva Anestesiol. 2018; 84(10): 1160–1168. doi:10.23736/ S0375-9393.18.12720-9
47. Meijer FS, Martini CH, Broens S, Boon M, Niesters M, Aarts L, et al. Nociception-guided versus Standard Care during Remifentanil-Propofol Anesthesia: A Randomized Controlled Trial. Anesthesiology. 2019; 130(5): 745–755. doi:10.1097/ALN.0000000000002634
48. Gruenewald M, Dempfle A. Analgesia/nociception monitoring for opioid guidance: meta-analysis of randomized clinical trials. Minerva Anestesiol. 2017; 83(2): 200–213. doi:10.23736/S0375-9393.16.11602-5
49. Jiao Y, He B, Tong X, Xia R, Zhang C, Shi X. Intraoperative monitoring of nociception for opioid administration: a meta-analysis of randomized controlled trials. Minerva Anestesiol. 2019; 85(5): 522–530. doi:10.23736/S0375-9393.19.13151-3
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2020 Číslo 5- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Pandemie COVID-19: ještě neskončila, ale co z ní lze využít již nyní…
- Blok distální části nervus ischiadicus nízkým objemem (LVDSB) – srovnání s aplikací tekutiny do distální části adduktorového kanálu na zdravém dobrovolníku
- Změny výšky vrstvy endoteliálního glykokalyx po náhlé zástavě oběhu s kardiopulmonální resuscitací na experimentálním modelu srdeční zástavy u prasete domácího
- Ovlivňuje hloubka celkové inhalační anestezie jednoletou pooperační mortalitu rizikových seniorů?
- Fentanyl – 60 let od syntézy, historie opioidních analgetik
- Důležitost a možnosti peroperačního hodnocení nocicepce
- Současné i budoucí spektrum plicní fibrózy
- Odmítnutí převzetí pacienta z přednemocniční péče cílovým poskytovatelem akutní lůžkové péče
- Dva případy rocuroniem navozené anafylaxe/ anafylaktického šoku úspěšně léčené sugammadexem
- Využití rotační tromboelastometrie v perioperační medicíně a její porovnání se standardními koagulačními testy
- Využití pouhého vysokého přívodu kyslíku nebo v kombinaci s odsáváním z dýchacích cest pro úspěšnou dekanylaci?
- Ke 110. výročí založení zdravotnického záchranného sboru v Olomouci
- Stanovisko výboru ČSARIM 13/2020 Rozhodování u pacientů v intenzivní péči v situaci nedostatku vzácných zdrojů
- Příloha 1: Právní rozbor situace nedostatku vzácných zdrojů v systému zdravotní péče
- Zvláštnosti syndromu akutní dechové tísně dospělých u pacientů s COVID-19
- American Heart Association (AHA) vydává a elektronicky volně rozšiřuje dnem 15. října 2020 Highlights of the American Heart Association s názvem: GUIDELINES FOR CPR AND ECC – The Most Updated Science From the Leaders in Resuscitaion
- Zajímavosti, tipy a triky, informace z jiných oborů
- Autopiloti na operačním sále – významný nový prvek
- Dynamické proměnné pro perioperační management tekutin
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití rotační tromboelastometrie v perioperační medicíně a její porovnání se standardními koagulačními testy
- Odmítnutí převzetí pacienta z přednemocniční péče cílovým poskytovatelem akutní lůžkové péče
- Důležitost a možnosti peroperačního hodnocení nocicepce
- Fentanyl – 60 let od syntézy, historie opioidních analgetik
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



