-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prometheus – nová možnost léčby jaterního selhání u dětí
Prometheus – a new therapeutic option in liver failure in children
Acute liver failure is a rare but potentially fatal condition with mortality reaching 80–90 %. Dialysis, haemoperfusion and countinuous renal replacement therapy are currently the methods of choice in patients with this critical condition.
Prometheus has been recently introduced in our PICU. This liver replacement device is designed to eliminate toxins produced during the liver failure state. So far two critically ill children – aged 7 years and 15 months – have been treated with Prometheus. Although unfortunately both the patients died of brain oedema, we witnessed a good elimination efficiency of the system. Ideal timing of the initiation of the therapy appears to be a crucial factor.Keywords:
acute liver failure – child – critical state – Prometheus – King’College Criteria
Autoři: Hladík Michal 1,2; Zaoral Tomáš 1; Čáp Jiří 3
Působiště autorů: Klinika dětského lékařství Fakultní nemocnice Ostrava 1; Fakulta zdravotních studií, Ostravská univerzita, Ostrava 2; Klinika anesteziologie, resuscitace a intenzivní péče, Transplantcentrum, IKEM 3
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 4, s. 207-212
Kategorie: Kazuistiky
Souhrn
Akutní jaterní selhání je u dětí vzácný, ale velmi závažný stav s 80–90% úmrtností. K jeho léčbě se dosud používají metody eliminace, které jsou zaměřené na selhání ledvin (dialýza), otrav (hemoperfuze) a komplexní očišťování organismu u kritických stavů (kontinuální eliminační metody).
Naše pracoviště je vybavené přístrojem Prometheus, který je konstruován k cílené eliminaci toxinů při jaterním selhání. Dosud jsme léčili dvě děti ve věku 7 let a 15 měsíců. Obě zemřely pro mozkový edém.
Prokázali jsme dobrou eliminační schopnost systému. Pro výsledek léčby má zásadní význam vhodné načasování jejího zahájení.Klíčová slova:
akutní jaterní selhání – dítě – kritický stav – Prometheus – King’s College CriteriaÚvod
Akutní selhání jater je syndrom způsobený devastací jaterního parenchymu z různých příčin s následným zhroucením funkce jater. Jeho výskyt v dětském věku je vzácný. Přitom ale děti tvoří výrazně rizikovou skupinu, ve které je selhání jater obtížně terapeuticky ovlivnitelné.
Při selhání jater dochází především k poruše proteosyntézy (důsledkem je hypoalbuminémie a koagulopatie) a k poruše jejich exkreční a detoxifikační funkce.
Akutní selhání jater může proběhnout od počátku onemocnění velmi rychle (během dnů až týdnů), ale také za delší časový interval (týdny až měsíce). Může vyústit do multiorgánového selhání s letálním zakončením. Klasifikace akutního jaterního selhání z roku 1993 vychází z časového intervalu rozvoje klinických a laboratorních projevů od počátku onemocnění. Rozděluje se na hyperakutní (do 7 dnů), akutní (7–28 dnů) a subakutní (za 3–6 měsíců). Při akutním selhání jater dochází ve více než 50 % případů k současnému selhání ledvin.
Fulminantní selhání jater je charakterizováno náhlým nástupem závažné jaterní dysfunkce u jedince bez předchozího onemocnění jater, rychlým rozvojem žloutenky, jaterní encefalopatie a koagulopatie. Většinou není možná specifická léčba. Výjimkou je selhání jater při otravě paracetamolem. Rizikové faktory, které mohou vést k fulminantnímu selhání jater, uvádí tabulka 1. Úmrtnost se u dětí při fulminantním jaterním selhání pohybuje mezi 80–90 % [1].
Tab. 1. Příčiny akutního selhání jater u dětí 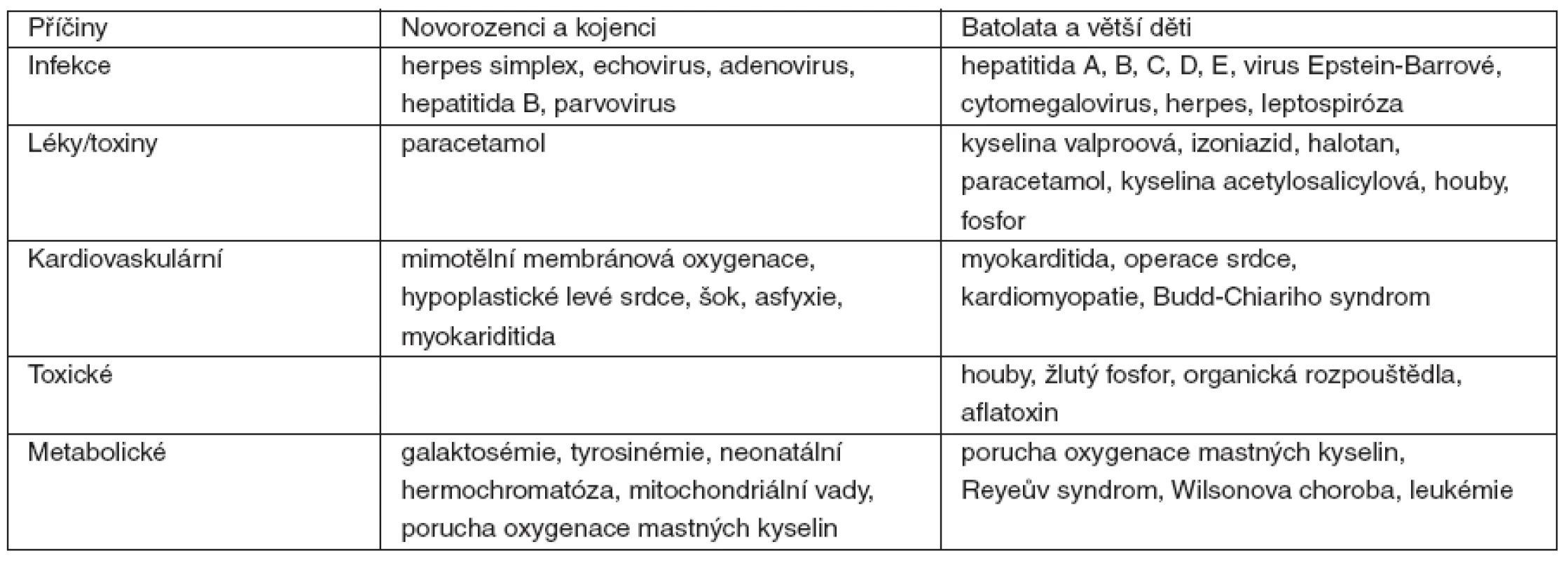
Nové terapeutické možnosti při selhání jater
Přes pokroky v konzervativní léčbě akutního selhání jater nejsou terapeutické výsledky uspokojivé. Pokud neproběhne u pacientů s akutním selháním jater urgentní transplantace, pohybuje se úmrtnost kolem 60 %. U fulminantního jaterního selhání je ještě vyšší a dosahuje až 80 %.
V posledních letech se zkoušela řada terapeutických postupů, které měly za cíl odstranit z organismu předpokládané toxiny. Přístroje používané k náhradě jaterních funkcí využívaly princip hemodialýzy, hemofiltrace, plazmaferézy a hemoperfuze s použitím uhlí nebo sorbentů na bázi polymerů. U všech byl ale výsledný efekt poměrně malý [2].
Hlavním cílem současné přístrojové náhrady jaterních funkcí je nejen odstranění volných toxinů z krve, ale především toxinů vázaných na albumin, které nelze odstranit dialýzou nebo hemoperfuzí (tab. 2) [3].
Tab. 2. Hydrofobní metabolity* 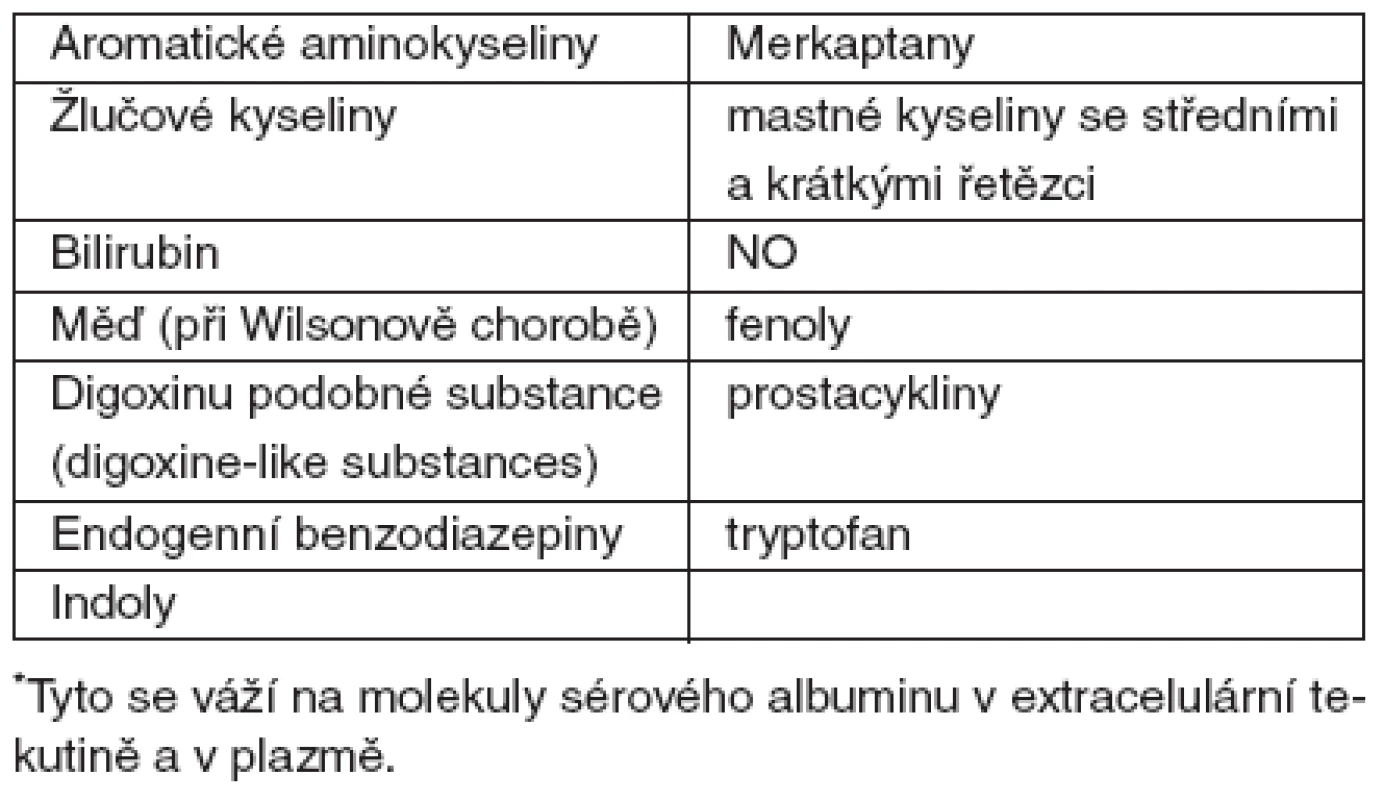
Perspektivní směr nastoupil v roce 1999 Falkenhagen et al. Jednalo se o nový typ očišťování organismu od potenciálních toxinů vázaných na albumin metodou frakcionované separace a adsorpce plazmy (fractionated plasma separation and adsorption – FPSA). V tomto systému je zařazen v mimotělním oběhu filtr, který propouští látky o molekulární velikosti 250 000 daltonů (pro srovnání – propustnost klasického filtru používaného k plazmaferéze je 3000 000 daltonů). Z krve pacienta odfiltruje albumin s navázanými toxiny a směřuje ho ke speciálním adsorpčním kolonám, kde se očistí od toxinů a bilirubinu a vrací se zpět do krve v mimotělním systému. Následně je krev ještě high flux dialýzou očištěna od solubilních látek a pak se vrací zpět do organismu. Právě propojení FPSA a high-flux dialýzy je principem systému Prometheus [4]. Systém používá citrátovou antikoagulaci, která minimalizuje riziko krvácivých komplikací (obr. 1) [2, 5].
Obr. 1. Schéma zapojení a funkce přístroje Prometheus 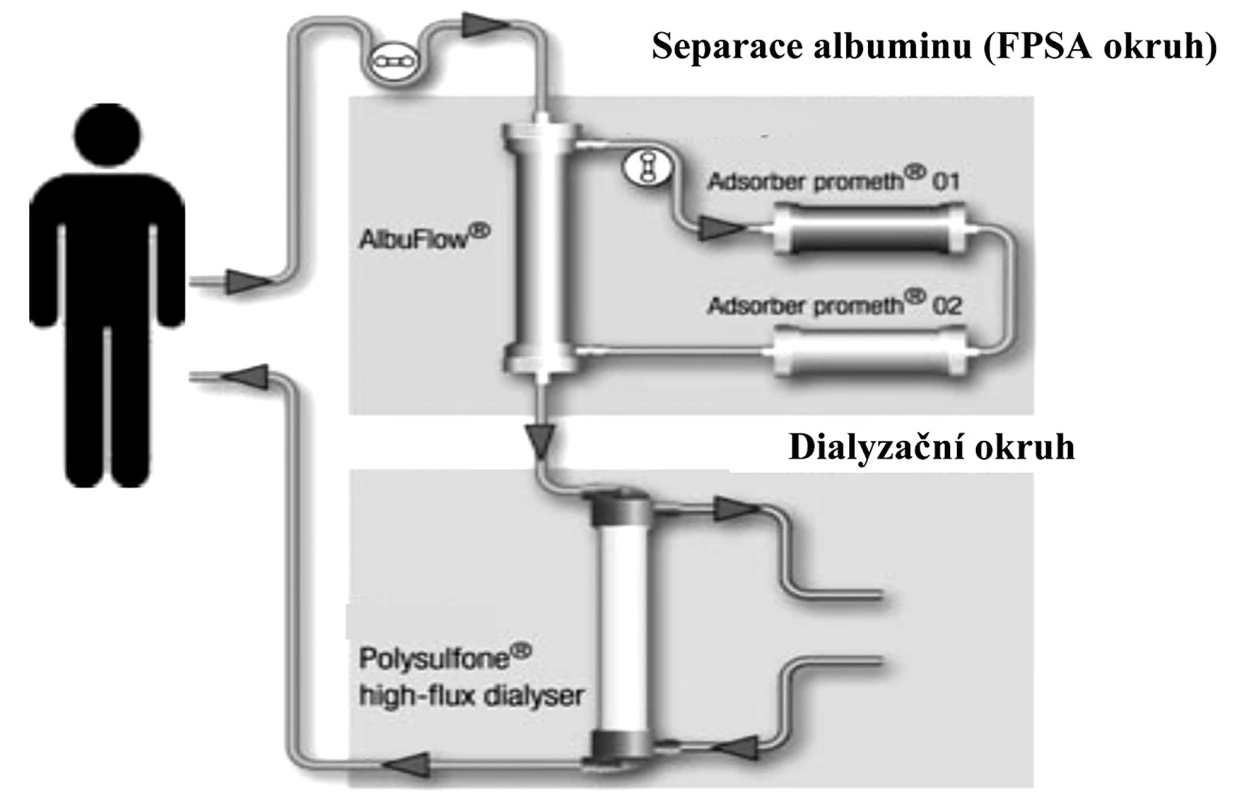
King’s College Criteria
Ke včasnému stanovení kritické prognózy u pacientů s jaterním selháním byla v r. 1989 stanovena King’s College Criteria (KCC) nebo také King’s College Hospital Criteria. Kritéria byla stanovena pro 2 skupiny nemocných: pro pacienty se selháním jater při intoxikaci paracetamolem a pro selhání jater non-paracetamolové etiologie. Každá skupina má totiž odlišnou prognózu a při rozhodování k léčbě odlišná kritéria.
- Selhání jater při intoxikaci paracetamolem – u intoxikovaných pacientů je kritická prognóza při:
1. arteriálním pH < 7,3 40 minut po úspěšné resuscitaci, nebo
2. při přítomností tří ukazatelů, které se vztahují ke koagulopatii, postižení ledvin a postižení mentálního stavu: INR (International Normalizated Ratio) vyšší než 6,5, kreatinin v séru nad 300 µmol/l a přítomnost encefalopatie III.–IV. stupně [6]. - Selhání jater z non-paracetamolové příčiny – u této skupiny korelují se špatnou prognózou:
1. INR vyšší než 6,5, nebo
2. pozitivita tří z pěti kritérií: věk nemocného pod 10 let nebo nad 40 let, kreatinin v séru nad 300 µmol/l, doba nástupu ikteru do 7 dní, INR nad 3,5 a výrazná hepatotoxicita vyvolávajících látek.
Uvedená kritéria se významně podílejí na rozvaze o léčebném postupu. Jejich pozitivní prediktivní hodnota pro letální prognózu se pohybuje mezi 70 a 100 %. Metaanalýza provedená kanadskými autory, která se zabývala validitou řady prognostických ukazatelů zjistila, že specificita King’sCollege kritérií v predikci mortality dosahuje 100 % a senzitivita 69 %. Proto American Society for Study of Liver Diseases doporučila KCC jako užitečný časný ukazatel pro stanovení indikace akutní transplantace jater.
Pokud není k dispozici dárce, stávají se KCC orientačním kritériem pro zahájení podpůrné orgánové terapie [7, 8].
Na Oddělení pediatrické resuscitační a intenzivní péče Kliniky dětského lékařství FN Ostrava jsme dosud léčili systémem Prometheus dvě děti. Uvádíme jejich kazuistiky.
Kazuistiky
Kazuistika 1
Pacientka přijata v srpnu 2008 – sedmiletá dívka se nešťastnou náhodou otrávila pokrmem připraveným z muchomůrky zelené (Amanita phalloides). Rodiče ingesci hub při opakovaných ambulantních vyšetřeních, kam přicházeli pro nevolnost a zvracení, i přes cílené dotazy popřeli. Proto byla dívka hospitalizovaná až po 48 hodinách, kdy se již rozvinuly klinické známky těžké intoxikace (snížený stav vědomí, periferní cyanóza, profuzní zvracení). Při přijetí byl stav vědomí hodnocený Glasgow Coma Scale (GCS) 10 body. Byla subikterická, diuréza byla hraniční. CT vyšetření neprokázalo známky edému mozku, CT jater zobrazilo jejich zvětšení, s výrazně sníženou denzitou. V laváži střev byly prokázány spóry muchomůrky zelené. Zahájili jsme obvyklou léčbu (megadávky benzylpenicilinu, Sylibin, hemostatika, substituce koagulačních faktorů, carbo medicinalis, masivní infuzní léčba krystaloidy, vysoká klyzmata). Do 7 hodin od přijetí se vědomí zhoršilo na GCS 7 bodů a zhoršovala se terapeuticky obtížně ovlivnitelná oběhová nestabilita. Pacientka byla zaintubovaná a napojena na umělou plicní ventilaci. Kontinuálně jsme podávali inotropika a vazopresory. Podle laboratorních výsledků i kliniky splňoval stav kritéria KCC. Stav jsme konzultovali s Transplantačním centrem IKEM Praha k přípravě urgentní transplantace jater a pacientku jsme napojili na přístroj Prometheus (obr. 2). Před napojením zavedl neurochirurg intrakraniální čidlo. Od počátku byly snímané hodnoty intrakraniálního tlaku extrémně vysoké, mezi 90 a 100 cm H2O. Během několika hodin se objevuje fixovaná mydriáza. Eliminace probíhá po dobu 12 hodin, a až na oběhové kolísání je klidná. Po jejím zakončení ale rychle nastupuje bradyarytmie s nepravidelnou srdeční akcí a klesá krevní tlak, který je rezistentní na vysoké dávky dobutaminu, dopaminu a noradrenalinu. Za 36 hodin po přijetí pacientka umírá. Základní příčinou úmrtí byl při pitvě stanoven edém mozku. Dynamiku laboratorních parametrů uvádí tabulka 3.
Obr. 2. Sedmiletá pacientka na přístroji Prometheus 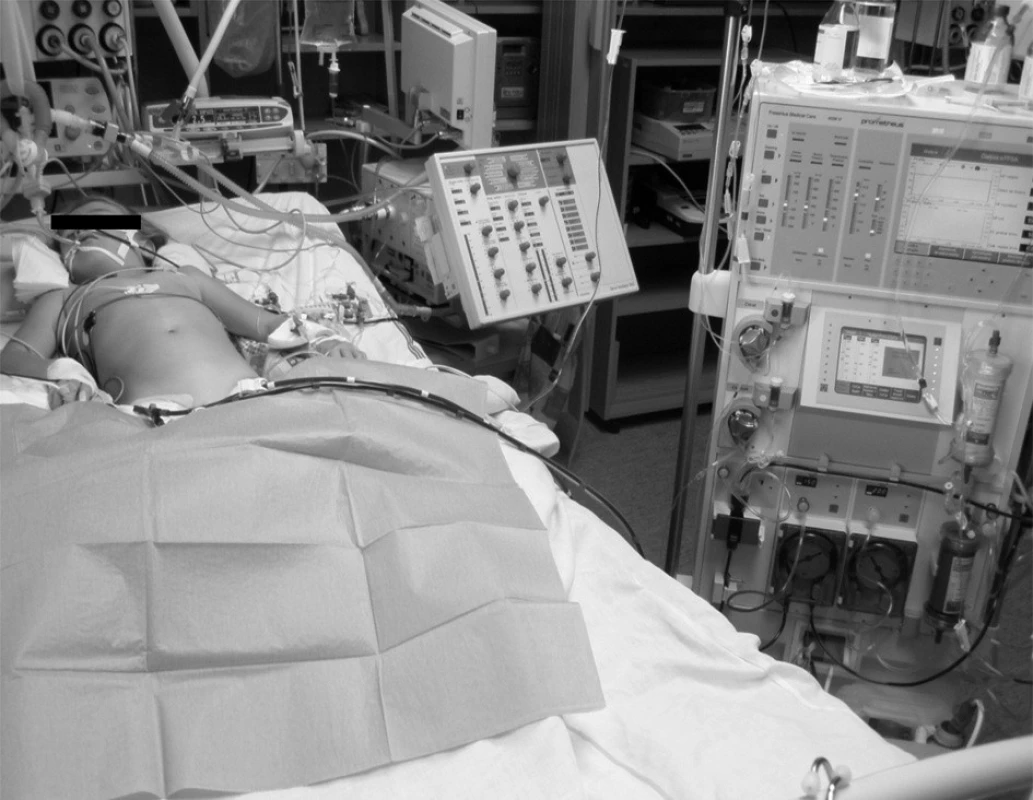
Tab. 3. Dynamika laboratorních parametrů u 7leté pacientky s akutním jaterním selháním 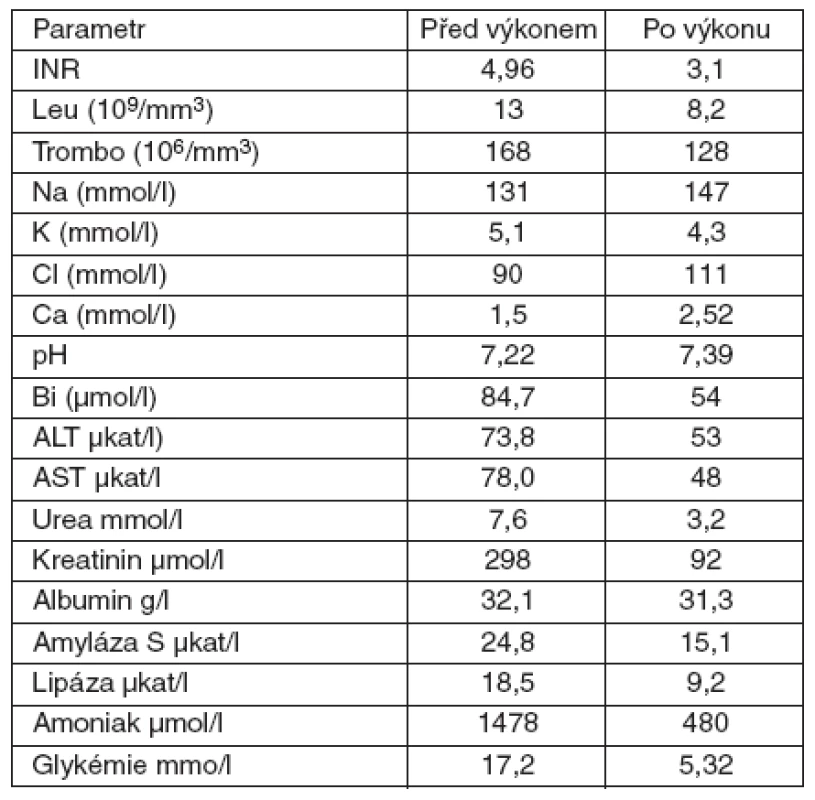
Kazuistika 2
Pacientka přijata v dubnu 2009 – 15měsíční děvče bylo přijato do nemocnice z dětského domova, kam bylo umístěno ze sociálních důvodů. V posledních třech dnech u ní docházelo ke kvalitativně-kvantitativním změnám vědomí s atakami, zvýšené dráždivosti a naopak somnolence. V dětském domově zjistili vysokou hodnotu ALT 25 µkat/l, hypoglykémii 2 mmol/l a hyperbilirubinémii. Při přijetí na klinické pracoviště bylo GCS hodnoceno 14–15 body, zornice byly izokorické, byl výrazný ikterus. Fyzikální vyšetření až na mírné zarudnutí orofaryngu bylo v normě. Játra a slezina nebyly hmatné. Během 2 dnů stoupá APTT ze 46,2 na 65 s, INR ze 4,4 na 6,86. Amoniak stoupá z 24 na 117 µmol/l. Sérologickým vyšetřením byly vyloučeny infekční hepatitidy, virus Ebstein-Barrové, cytomegalovirus, rubeola, hantaviry, leptospiróza a toxoplazmóza. Orientační vyšetření zaměřené na vrozené metabolické vady bylo negativní. Prohlubuje se bezvědomí s dechovou insuficiencií. Třetí den hospitalizace byla po zajištění dýchacích cest a napojení na umělou plicní ventilaci letecky přeložena na naše pracoviště. I přes časovou prodlevu jsme doplnili toxikologické vyšetření se zaměřením na paracetamol, které bylo negativní. Dítě jsme napojili na kontinuální venovenózní hemodiafiltraci (CVVHD) a vzhledem ke splnění KCC následně na přístroj Prometheus (obr. 3). Před zahájením výkonu neurochirurg zavedl intrakraniální čidlo k monitorování nitrolebního tlaku, který byl v normě. Po prvním 12hodinovém výkonu došlo však ke krvácení do mozku, které vyřešila neurochirurgická intervence. Vzhledem k celkovému stavu a neurochirurgické komplikaci není dítě po konzultaci s IKEM Praha indikováno k transplantaci jater. Dále pokračujeme v CVVHD, ale vzhledem k nepříznivému vývoji laboratorních parametrů napojujeme opět na Promethea. Dochází však k vzestupu intrakraniálního tlaku a objevuje se fixovaná mydriáza. Dítě umírá 96 hodin po přijetí na naše resuscitační pracoviště. Pitva stanovila jako příčinu smrti edém mozku a povšechnou hemoragickou diatézu. Na játrech nebyly popsány patologické změny a příčina jaterního selhání zůstává nejasná. Dynamiku laboratorních parametrů uvádí tabulka 4.
Obr. 3. Patnáctiměsíční pacientka na přístroji Prometheus 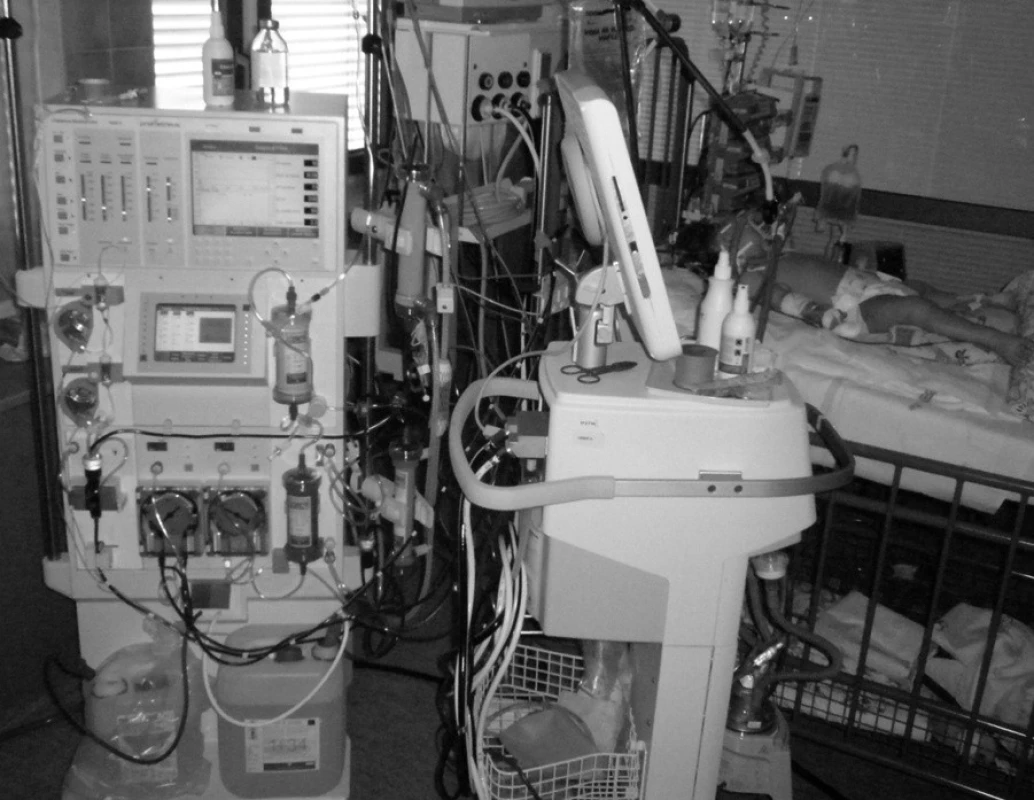
Tab. 4. Dynamika laboratorních parametrů u 15 měsíční pacientky s akutním jaterním selháním 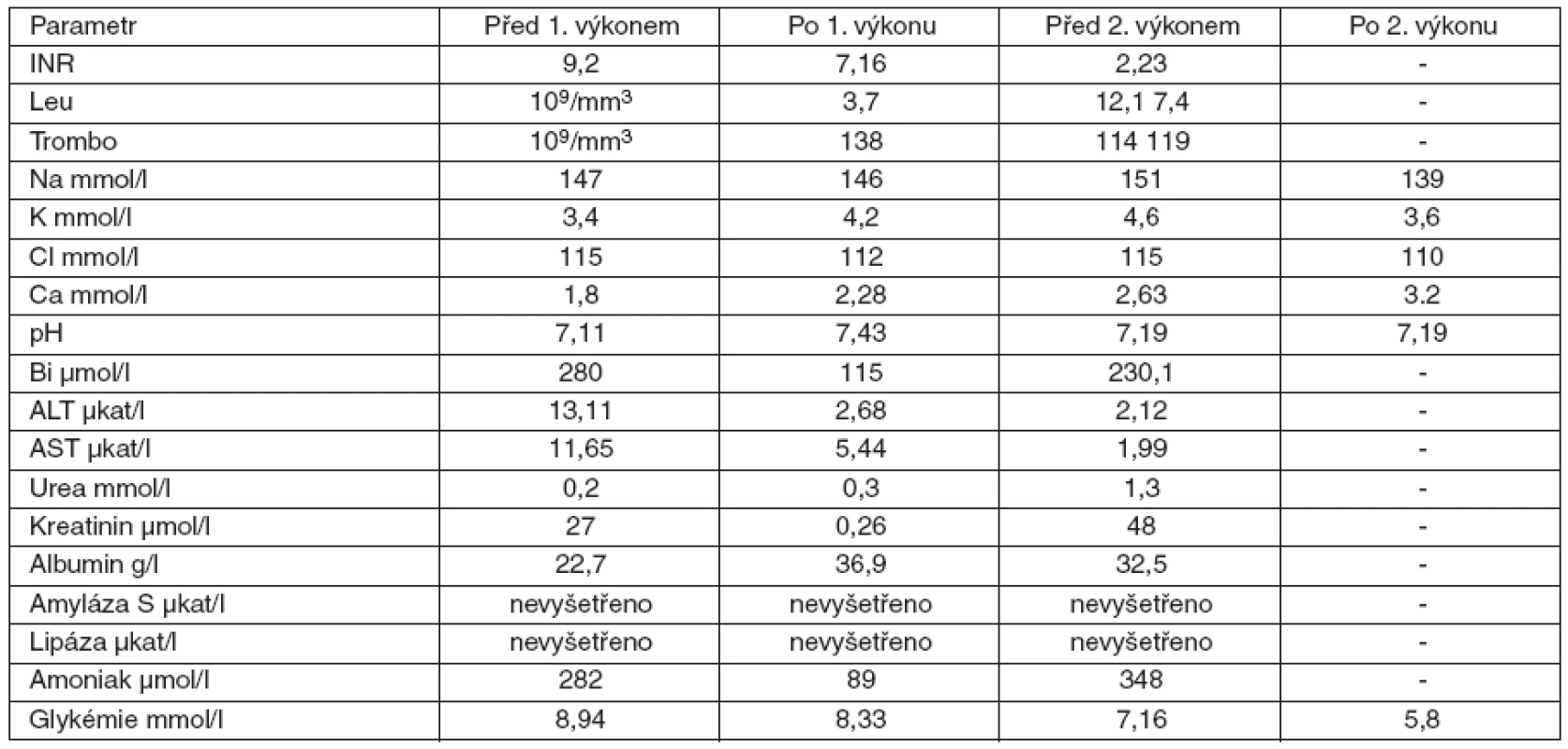
Diskuse
První kazuistika rozebírá případ otravy muchomůrkou zelenou. K léčbě této otravy jsou zavedené algoritmy, které mohou těžký a fatální průběh onemocnění zvrátit. V řadě postupů panuje shoda. Patří sem časná evakuace a výplach žaludku, vysoké klyzma i 3–5 dnů po ingesci hub, podávání živočišného uhlí, časná hemoperfuze, vysoké objemy infuze krystaloidů. Nejednotný názor je ale na aplikaci benzylpenicilinu. V USA je u otravy muchomůrkou zelenou léčba penicilinem standardním postupem. Benzylpenicilin ruší vazbu amanitinu na plazmatické proteiny a umožňuje jeho vylučování ledvinami. Dále inhibuje vstup amanitinu do enterocytů. Působí také proti střevním bakteriím produkujícím kyselinu gamaaminobutyrovou (GABA), která se tvoří v játrech jako inhibiční neurotransmiter a v experimentu akcentuje jaterní encefalopatii. Vliv penicilinu ale není prokázán na průběh jaterní encefalopatie u člověka. Podávání vysokých dávek benzylpenicilinu má však také rizika. Mezi ně patří neurotoxické symptomy, křeče a v 1–10 % případů závažné alergické projevy. Přes všechny kontroverze jsou ale výsledky aplikace benzylpenicilinu při intoxikaci muchomůrkou zelenou pozitivní. V posledních 20 letech je při otravě amanitinem benzylpenicilin nejčastěji aplikovaným lékem [9].
V Evropě je při terapii otravy muchomůrkou zelenou lékem volby Sylibin. Má hepatoprotektivní efekt a přerušuje enterohepatální oběh. Inhibuje průnik amanitinu do hepatocytů. V USA ale není registrován a není zde součástí léčebného schématu.
Ostatní používané léčebné postupy zahrnují aplikaci N-acetylcysteinu, kyseliny thioktové, cimetidinu, cytochromu C a hyperbarickou oxygenaci [10, 11].
U naší první pacientky jsme použili standardní způsob konzervativní léčby otravy muchomůrkou zelenou v kombinaci s FPSA eliminací.
U druhé pacientky došlo k jaternímu selhání z neznámé příčiny, kterou se nepodařilo zjistit ani při pitvě a následném vyšetření jaterní tkáně. Přestože bylo orientační vyšetření metabolických vad negativní, nelze vzhledem k průběhu onemocnění, laboratorním hodnotám a pitevnímu nálezu zcela vyloučit možnost vrozeného metabolického onemocnění.
Závěr
Klinické použití metody FPSA se zapojením Promethea bylo poprvé popsáno v roce 2003 [12]. U dětí jsou k léčbě „umělými játry“ uváděny pouze sporadické zmínky formou kazuistik, kam patří např. popis léčby Wilsonovy choroby u 2 dětí systémem MARS. Jednalo se ale o albuminovou dialýzu [13], která pracuje na jiném principu eliminace toxinů vázaných na albumin než FSPA.
V České republice poprvé použili k léčbě jaterního selhání FSPA systém Prometheus v roce 2005 v IKEM Praha u 35letého pacienta s Budd-Chiariho syndromem. Pacienta se podařilo dovést k úspěšné transplantaci [14]. U dětí uplatnilo přístroj Prometheus při léčbě jaterního selhání v ČR poprvé naše pracoviště.
Podle posledních metaanalýz u dospělých (u kterých ovšem souběžně probíhají komplikující závažné komorbidity) se pohybuje úmrtí při konzervativní léčbě selhání jater mezi 51 % a 85 % [15]. Zveřejněné soubory a výsledky léčby náhradou jaterní funkce u dospělých jsou však i u dospělých malé. Rifai uvádí, že ve skupině dospělých léčených metodou FSPA pro akutní selhání jater přežily po dobu tří měsíců 3 z 11 pacientů [2]. U dětí podobné údaje zcela chybí. I při multicentrické studii bude statistické hodnocení výsledků léčby selhání jater vzhledem k jejich nízkému počtu vždy problematické.
Děti, které jsme léčili, nezemřely v souvislosti s eliminačním výkonem. Jsme si ovšem vědomi rizik, která jsou s ním spojena a přistupujeme k němu pouze v případech, kdy jsou splněna kritéria k eliminaci a prognosticky není šance na zvrácení selhání jater konzervativním postupem. Považujeme ho za ultimum refugium po vyčerpání ostatních léčebných postupů. Je nutné mít na paměti rizika léčby selhání jater v rámci akutního multiorgánového selhání, která jsou nepoměrně vyšší než u terminálního selhání jater chronického pacienta s hepatálním onemocněním.
Časový faktor je při léčbě fulminantního selhání jater rozhodující a transplantace jater vede k jeho definitivnímu vyřešení. Základním předpokladem je ovšem dostupnost vhodného dárce. Přístrojová náhrada jaterní funkce je přemostěním k definitivnímu řešení. Nejvhodnější je převoz pacienta do transplantačního centra ve stabilizovaném stavu, kde proběhne komplexní léčba. I my jsme byli u obou dětí v kontaktu s transplantačním centrem. V prvním případě jsme k léčbě „umělými játry“ přistoupili pro rychlou progresi selhání jater se závažnou oběhovou nestabilitou, která znemožnila transport. Ve druhém případě k nám bylo dítě cíleně přeloženo z jiného klinického pracoviště k eliminační léčbě vzhledem k zaměření a zkušenostem našeho pracoviště.
Adresa pro korespondenci:
Doc. MUDr. Michal Hladík, Ph.D.
Havlíčkova 465
742 83 Klimkovice
e-mail: michal.hladik@fno.cz
Zdroje
1. Thompson, A. E. Liver Failure in Infants and Children. p. 1027–1039. In: Wheeler, D. S., Wong, H. R., Shanley, T. P. (eds.) Pediatric Critical Care Medicine-Basic Science and Clinical Evidence. Springen.Verlag London, 2007, 1805 s.
2. Rifai, K., Ernst, T., Kreschmer, U., Bahr, M. J., Schneider, A., Hafer, C., Haller, H., Manns, M. P., Fliser, D. Prometheus – a new extracorporeal systém for the treatment of liver failure. J. Hepatol., 2003, 39, 6, p. 984–990.
3. Evenepoel, P., Laleman,W., Wilmer, A., Claes, K., Maes, B., Kuypers, D., Bammens, B., Nevens, F.,Vanrenterghem,Y. Detoxyfiing Capacity and Kinetics of Prometheus – A New Extracorporeal System for the Treatment of Liver Failure. Blood Purif, 2005, 23, p. 349–358.
4. Falkenhagen, D., Strobl, W., Vogt, G., Schrefl, A., Linsberger, I., Gerner, F. J. Fractionated plasma separation and adsorption system: a novel system for blood purification to remove albumin bound substances. Artif. Organs, 1999, 23, p. 81–86.
5. Kjaergard, L. L., Liu, J., Als-Nielsen, B., Gluud, C. Artificial and bioartificial support systems for acute and acute-on-chronic liver failure. JAMA, 2003, 289, p. 217–222.
6. Bailey, B., Amre, D., Gaudreault, P. Fulminant hepatic failure secondary to acetaminophen poisoning: a systematic review and meta-analysis of prognostic criteria determining the need for liver transplantation. Crit. Care Med., 2003, 31, 1, p. 299–305.
7. Anand, A., Nightingale, P., Neuberger, J. Early indicators of prognosis in fulminant hepatic failure: an assessment of the King’s criteria. J. Hepatol., 1997, 26, 1, p. 62–68.
8. Shakil, A., Kramer, D., Mazariegos, G., Fung, J., Rakela, J. Acute liver failure: clinical features, outcome analysis, and applicability of prognostic criteria. Liver Transpl., 2000, 6, 2, p. 163–169.
9. Enjalbert, F., Rapior, S. et al. Treatment of Amatoxin Poisoning – 20-Year Retrospective analysis. Journal of toxicology, 2002, 40, 6, p. 715–757.
10. Broussard, C. N., Aggarwal, A., Lacey, S. R. et al. Mushroom poisoning – from diarrhea to liver transplantation. Am. J. Gastroenterol., 2001, 96, p. 3195–3198.
11. Soysal, D., Çevik, C., Saklamaz, A., Yetimalar, Y., Ünsal, B. Coagulation disorders secondary to acute liver failure in Amanita phalloides poisoning. The Turkish Journal of Gastroenterology, 2006, 17, p. 198–200.
12. Kramer, L., Bauer, E., Schenk, P. et al. Successful treatment of refractory cerebral oedema in ectasy/cocaine-induced fulminant hepatic failure using a new high-efficacy liver detoxification device (FPSA-Prometheus). Wien Klin. Wochenschr., 2003, 115, p. 559–603.
13. Marcus, K. H., Kim, H. S., Beste, M. Removal of Metabolites, Cytokines and Hepatic Growth Factors by Extracorporeal Liver Support in Children. Journal of Pediatric Gastroenterology and Nutrition, 2005, 40, p. 54–55.
14. Kieslichová, E., Ročeň, M., Trunečka, P., Janoušek, L., Šperl, J., Petrášek, J., Vítko, Š. Úspěšná léčba akutního renálního selhání jater pomocí přístrojové podpůrné terapie s následnou transplantací jater. Prakt. Lék., 2006, 86, 5, p. 275–277.
15. Lee, W. Liver Failure and Liver Support. Seminars in Liver Disease. 2008, 28, 2, p. 135–136.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2010 Číslo 4- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- K (našim) volbám
- Pooperační bolesti v krku
- Dexmedetomidin v premedikaci před laparoskopickou cholecystektomií – prospektivní randomizovaná studie
- Fascie brachiálního plexu
- Frakcionovaná plazmatická separace a adsorpce neovlivňuje hemodynamické parametry u experimentálního akutního selhání jater
- Terapie přístrojem Prometheus u pacientů s akutním jaterním selháním – vliv terapie na markery zánětu a regenerace
- Prometheus – nová možnost léčby jaterního selhání u dětí
-
7. mezinárodní sympozium o historii anestezie
Heraklion, Kréta, Řecko 1.–3. 10. 2009
-
Výborová schůze ČSARIM
Praha 27. 1. 2010
-
Výborová schůze ČSARIM
Mladá Boleslav, 16. 2. 2010
- Návrh České lékařské společnosti J. E. Purkyně na novelizaci vyhlášky č. 185/2009 Sb., o specializačním vzdělávání lékařů
- Konsensuální návrh České lékařské společnosti J. E. Purkyně
-
Zápis z jednání výboru č. 1/2010
Ostrava 26. 1. 2010
-
Zápis z jednání výboru č. 2/2010
Praha 17. 3. 2010
-
Danie Nalosl, Dušan Mach a kolektiv:
Periferní nervové blokády pro klinickou praxi včetně ultrazvukového navádění
-
Thomas L. Petty
(24. 12. 1932–12. 12. 2009)
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pooperační bolesti v krku
- Terapie přístrojem Prometheus u pacientů s akutním jaterním selháním – vliv terapie na markery zánětu a regenerace
- Prometheus – nová možnost léčby jaterního selhání u dětí
- Fascie brachiálního plexu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



