-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostika a léčba získané hemofilie – konsenzuální doporučení Českého národního hemofilického programu (ČNHP)
Autoři: J. Blatný 5; B. Blažek 6; Z. Čermáková 1; Z. Černá 7; P. Ďulíček 8; J. Hak 9; A. Hluší 4; R. Hrdličková 1; V. Komrska 10; P. Ovesná 11; D. Pospíšilová 12; D. Procházková 13; P. Smejkal 2; J. Šlechtová 3; P. Timr 14; J. Ullrychová 15; I. Vonke 16; L. Walterová 17; M. Penka 2; J. Zavřelová 2; J. Gumulec 1; Z. Kořístek 1; Z. Hajšmanová 3
Působiště autorů: Klinika hematoonkologie a Krevní centrum, Fakultní nemocnice Ostrava 1; Oddělení klinické hematologie, Fakultní nemocnice Brno 2; Ústav klinické biochemie a hematologie, Fakultní nemocnice Plzeň 3; Hemato-onkologická klinika FN Olomouc 4; Oddělení dětské hematologie, Fakultní nemocnice Brno 5; Klinika dětského lékařství, Fakultní nemocnice Ostrava 6; Dětská klinika, Fakultní nemocnice Plzeň 7; IV. Interní hematologická klinika, Fakultní nemocnice Hradec Králové 8; Dětská klinika, Fakultní nemocnice Hradec Králové 9; Klinika dětské hematologie a onkologie, Fakultní nemocnice v Motole, Praha 10; Institut biostatistiky a analýz Lékařské fakulty, Masarykova univerzita, Brno 11; Dětská klinika, Fakultní nemocnice, Olomouc 12; Dětská klinika, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem 13; Dětské oddělení, Nemocnice České Budějovice 14; Oddělení klinické hematologie, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem 15; Oddělení klinické hematologie, Nemocnice České Budějovice 16; Oddělení klinické hematologie, Krajská nemocnice Liberec 17
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 2, p. 101-109.
Kategorie: Doporučené postupy
*Pracovní skupina ČNHP pro standardy
**Jménem Koordinační rady a Výkonné rady ČNHPPREAMBULE
Ačkoli doporučení a informace obsažené v následujícím textu jsou formulovány v dobré víře a na základě znalostí aktuálně dostupných v době zveřejnění dokumentu, autoři, ČNHP (Český národní hemofilický program) ani žádná ze zainteresovaných odborných společností ani vydavatel tohoto doporučení nenesou žádnou právní zodpovědnost za obsah tohoto textu.
STRUČNÁ CHARAKTERISTIKA STANDARDU
Cílem standardu je stanovit základní diagnostická a terapeutická doporučení v péči o pacienty se získanou hemofilií (AHA – Acquired Haemophilia A).
A. Epidemiologie a patogeneze
(Z. Čermáková, R. Hrdličková)
Incidence AHA je přibližně 0,2–4/milion obyvatel/rok. Onemocnění osciluje ve dvou věkových kategoriích: u žen mezi 20.–40. rokem v souvislosti s graviditou a obdobím 1 roku po porodu; druhý věkový vrchol je u osob starších 65 let [1]. Podstatou onemocnění je vznik inhibitoru a jeho vazba na některé z funkčních míst FVIII. Ačkoliv je AHA často asociována se základní diagnózou (solidní tumory, lymfoproliferace), graviditou, eventuálně indukována léky, téměř u 50 % nemocných se nepodaří příčinu odhalit [2, 3].Mortalita na krvácivé komplikace se zlepšením dia-gnostiky a dostupností léčby v posledních le-tech klesá, na druhou stranu roste mortalita způ-sobená komplikacemi léčby zejména infekčními, a progresí základního onemocnění [3, 4]. Výskyt inhibitorů ostatních koagulačních faktorů je vzácný.
Klinické projevy
V krvácivých projevech dominují rozsáhlé podkožní hematomy, krvácení do měkkých tkání, svalů a sliznic, hematurie, závažné krvácení do gastrointestinálního traktu (GIT) a centrálního nervového systému (CNS). Výskyt těžkého a život ohrožujícího krvácení je častý (víc než 70 %), přesto existuje skupina pacientů (6–33 %), kteří nekrvácí, případně mají jen minimální příznaky, nevyžadují léčbu a jediným projevem onemocnění jsou patologické hodnoty výsledků laboratorních vyšetření [2, 3, 5].
B. Doporučení k diagnostice a monitorování získané hemofilie [6, 7, 8]
(J. Zavřelová, P. Smejkal, Z. Čermáková)
Diagnostika AHA a její odlišení od ostatních koagulačních abnormalit vyžaduje speciální vyšetření, která by měla být prováděna v centrech péče o pacienty s krvácivými chorobami, což jsou centra komplexní péče (Comprehensive Care Centre – CCC) a hemofilická centra (Haemophilia Treatment Centre – HTC).
Typickým laboratorním nálezem u AHA (přítomnost inhibitoru FVIII) je prodloužení koagulačního času aktivovaného parciálního tromboplastinového testu (aPTT), které není korigováno normální plazmou bezprostředně nebo po inkubaci. Laboratorní diagnostika AHA probíhá v několika krocích:
1. Screening (protrombinový test, aktivovaný parciální tromboplastinový test, fibrinogen)
Vzhledem k možnému současnému výskytu i jiných koagulopatií je doporučeno provádět všechny základní koagulační testy, nejen aPTT. V případě nálezu abnormálních koagulačních časů je u pacientů s krvácivými projevy nutno vyloučit vliv antikoagulační terapie včetně přímých inhibitorů (anti-IIa, anti-Xa).
2. Průkaz inhibitoru (směsné korekční testy s inkubací na principu aPTT)
Vzhledem k časové a teplotní závislosti inhibitoru FVIII je nutno provádět korekční testy s inkubací 2 hod. při 37 °C, výsledky korekčních testů vyhodnotit porovnáním koagulačních časů směsí vyšetřované a normální plazmy s časem normální a vyšetřované plazmy před inkubací a po inkubaci. Pro přítomnost inhibitoru svědčí žádná nebo jen částečná korekce výsledků abnormálních testů.
3. Průkaz specifity inhibitoru (vyšetření specifických faktorů)
Specifitu inhibitoru je doporučeno konfirmovat průkazem snížení funkční aktivity FVIII. Snížení FVIII může být výrazné (< 1 %), ale setkáváme se i s hladinami v rozsahu 1–10 % a eventuálně vyššími. Vyšetření funkční aktivity FVIII lze provádět jednofázovou koagulační metodou na principu aPTT, anebo dvoufázovou fotometrickou metodou.
4. Kvantifikace inhibitoru
Specifitu inhibitoru je doporučeno konfirmovat kvantitativním průkazem inhibitoru Bethesda metodou. Principem testu je vyhodnocení zbytkové aktivity FVIII po 2hodinové inkubaci titrované vyšetřované plazmy s normální plazmou. Výsledky inhibitoru jsou vyjadřovány v Bethesda jednotkách (BU/ml), kde 1 BU/ml je definována jako množství inhibitoru, které inaktivuje 50 % nabídnutého faktoru po dvouhodinové inkubaci při 37 °C.
Problémy Bethesda metody:
- a) Vzhledem k tomu, že se jedná o inkompletně neutralizující inhibitor (reakční kinetika typu II), může docházet v případě nízkých titrů inhibitoru (1–10 BU/ml) k podhodnocení, v případě vysokých titrů (> 20–50 BU/ml) naopak k jeho nadhodnocení. Doporučuje se proto odečítat v ředění vyšetřované plazmy, které je nejblíže 50% inhibici FVIII po 2 hodinách inkubace.
- b) V případě hladiny FVIII > 10 % ve vyšetřované plazmě je nutno odečítat zbytkovou aktivitu ve vyšších titrech nebo nejlépe inaktivovat FVIII při 56 °C po dobu 30 min. nebo déle.
Další metodou detekce specifického inhibitoru FVIII je ELISA metoda, která umožňuje kvantitativní stanovení protilátek. Tato metoda dete-kuje neutralizující i neneutralizující protilátky, a proto má význam pro výzkum, nikoliv pro klinickou praxi.
5. Vyloučení jiných koagulopatií
- a) vrozených i získaných (např. při hepatopatii)
V některých případech může silný inhibitor FVIII interferovat s vyšetřením jiných faktorů (mohou být např. sníženy všechny faktory vnitřní cesty). Jedná se o artefakt způsobený neutralizací FVIII ve faktor-deficitních plazmách. V těchto případech se doporučuje použít sériové ředění vyšetřované plazmy (1 : 10, 1 : 20,…1 : 80), které vyvolá korekci nespecificky redukovaných faktorů, zatímco specificky snížený faktor zůstane nízký (tab. 1).
Tab. 1. Diferenciální laboratorní diagnostika získané hemofilie 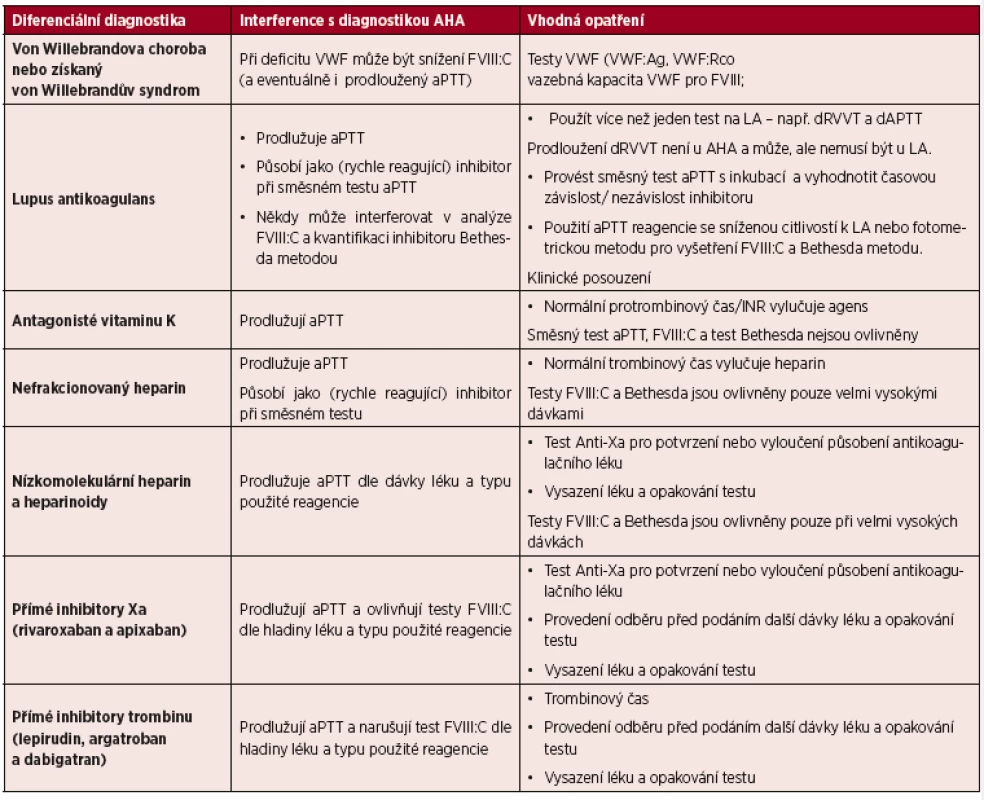
Legenda: AHA – získaná hemofilie A; VWF – von Willebrandův faktor; FVIIIC – prokoagulační aktivita faktoru VIII; aPTT – aktivovaný parciální tromboplastinový test; VWF:Ag – antigen von Willebrandova faktoru; VWF:Rco – aktivita ristocetinového kofaktoru; LA – lupus antikoagulans; dRVVT – diluční test s jedem Russellovy zmije (dilute Russell Viper Venom test); dAPTT – diluční aktivovaný parciální tromboplastinový test; INR – mezinárodní normalizovaný poměr. - b) přítomnost dalších typů inhibitorů
Lupus antikoagulans (LA) by měl být vyloučen v případě snížení hladiny koagulačních faktorů u pacientů bez krvácení. LA prodlužuje aPTT, které není korigováno normální plazmou bez časové závislosti. LA interferuje v průkazu specifity a kvantity inhibitoru. Sériové ředění při vyšetření faktorů vnitřní cesty není pro eliminaci vlivu LA dostačující, a proto se doporučuje použití aPTT reagencií se sníženou citlivostí k LA a eventuálně ředění nebo použití fotometrické metody.
K odlišení obou typů inhibitorů se využívá jednak časová závislost inhibitoru (tato je typická pro specifický inhibitor a většinou se u LA nevyskytuje), dále testy prokazující zaměření inhibitoru (tj. snížení jednoho koagulačního faktoru u specifického inhibitoru a neutralizace prodlouženého aPTT nadbytkem fosfolipidů u LA) a prodloužení dRVVT (diluční test s jedem Russellovy zmije – dilute Russell Viper Venom test – není pozitivní u inhibitoru FVIII a může, ale nemusí být prokazatelný u LA).
Testy k odlišení specifického inhibitoru a LA však nemusí poskytovat jednoznačné výsledky. Současný výskyt obou typů inhibitorů je rovněž možný.
6. Laboratorní monitorování pacientů se získanou hemofilií
Po nasazení léčby je doporučeno monitorovat aPTT, funkční aktivitu faktorů a hladinu specifického inhibitoru do jeho vymizení (normalizace faktorů nemusí vzhledem k nelineární kinetice znamenat nepřítomnost inhibitoru). Také po dosažení remise onemocnění je nutné pravidelně kontrolovat aPTT a hladinu faktorů.
Doporučení:
- Pacienti s AHA by měli být léčeni v CCC nebo HTC centru, které má s touto léčbou zkušenosti.
- Na diagnózu AHA by se mělo myslet v případech akutního nebo neočekávaného krvácení, které je spojeno s nevysvětlitelným prodloužením APTT.
- Na přítomnost získaných inhibitorů jiných koagulačních faktorů by se mělo myslet v případech akutního nebo neočekávaného krvácení, které je spojeno s nevysvětlitelným prodloužením aPTT nebo PT, které se při korekci normální plazmou nezkracuje.
C. Léčba
Léčba pacientů s AHA se odvíjí ve dvou krocích:
- Léčba krvácení
- Eradikace inhibitoru
1. Léčba krvácení
(Z. Čermáková, R. Hrdličková)
U některých méně závažných krvácení, zejména subkutánních hematomů, lze postupovat pouze konzervativně s ohledem na zvýšené riziko trombotických komplikací v souvislosti s použitím bypassové léčby u starších pacientů s komorbiditami.
Krvácivé projevy u pacientů se závažným krvácením a/nebo s inhibitorem ≥ 5 BU/ml se léčí faktory s bypassovou aktivitou [6, 9, 10]. V současné době jsou dostupné dva tyto faktory – rekombinantní aktivovaný faktor VII (rFVIIa – Novoseven®, Novo Nordisk A/S, Dánsko) a plazmatický koncentrát aktivovaného protrombinového komplexu (aPCC – FEIBA®, Baxalta Inc., USA). Doporučené dávkování rFVIIa je 90 mg/kg každé 2–3 hodiny do zástavy krvácení [6, 11]; aPCC (FEIBA) se podává ve zvyklé dávce 50–100 IU/kg v intervalu 8–12 hodin, přičemž by neměla být překročena dávka 200 IU/kg/den [6].
K zabránění relapsu závažných forem krvácení je možná udržovací léčba bypassovými přípravky. Je možno použít buď rFVIIa v dávce obdobné jako při léčbě vrozené hemofilie A s inhibitorem s nižší frekvencí podávání, anebo aPCC s doporučenou dávkou 30 IU/kg/den do poklesu hladiny inhibitoru o více než 50 % [12, 13]. Jestliže je terapeutická odpověď na bypassový preparát použitý v první linii nedostatečná a jsou známky pokračujícího krvácení, je doporučena jeho výměna [10]. Účinnost léčby oběma přípravky je vysoká (kolem 90 %) a srovnatelná [13, 14].
Hemostatického efektu je v závislosti na místě a závažnosti krvácení většinou dosaženo do 72 hodin. V případě neúspěšnosti léčby bypassovými přípravky uvedenými výše je vhodné zvážit použití rekombinantního porcinního faktoru VIII (rFVIIIp – OBIZUR®, Baxalta Inc, USA). Léčba rFVIIIp se zahajuje dávkou 200 IU/kg, následné dávky a frekvence podání se řídí klinickou odpovědí a naměřenou aktivitou FVIII [15].
Rizikem léčby u všech bypassových přípravků jsou trombotické komplikace. Procento výskytu těchto komplikací je podle Evropského registru získané hemofilie (European Acquired Haemophilia Registry, EACH2) 2,6–4,8 % [6, 16]. Z důvodu zvýšení rizika trombotické příhody (starší lidé, často již primárně s vyšším rizikem tromboembolických komplikací a konkomitantními onemocněními) se nedoporučují léčebné režimy kombinující rFVIIa a aPCC [17], kromě stavů život ohrožujícího krvácení a léčby po selhání ostatních léčebných režimů [18]. Nedoporučuje se také podávání antifibrinolytik současně s léčbou aPCC (SPC FEIBA). Mezi podáním obou přípravků je doporučen minimálně 6hodinový odstup [6].
Pro titr inhibitoru < 5 BU/ml, pokud není přítomno závažné krvácení, jsou doporučovány vysoké dávky FVIII [19, 20]. Použití vysokých dávek lidského plazmatického nebo rekombinantního FVIII je případně možné pouze u akutního krvácení v souvislosti se získanou hemofilii s velmi nízkým titrem inhibitoru a nedostupností preparátu s bypassovou aktivitou. Nevýhodou je nemožnost predikce hemostatického účinku, nutnost pečlivého monitorování plazmatické aktivity FVIII (opakované krevní odběry mohou provokovat krvácení) a riziko anamnestické odpovědi [6, 9, 10].
Užitečnou doplňkovou léčbou je zejména při slizničním krvácení kyselina tranexamová (EXACYL®, Sanofi-Aventis, Francie). Je doporučeno zvážit její podání u všech krvácení s výjimkou hematurie z horních močových cest s rizikem obstrukce v dávce 10–15 mg/kg i. v. 3krát denně nebo 20–25 mg 3krát denně per os s redukcí dávky při renálním selhání.
2. Eradikace inhibitoru
(J. Gumulec, Z. Kořístek)
Riziko krvácení trvá po celou dobu přítomnosti inhibitoru, a proto má být léčba s cílem odstranit inhibitor zahájena co možná nejdříve [3, 10, 21]. Pozdní zahájení eradikační léčby sice prodlužuje období zvýšeného rizika krvácení, ale není důvodem pro eskalaci imunosuprese [1]. Léčba vedoucí k odstranění inhibitoru je indikována vždy i přes skutečnost, že byly popsány případy spontánního vymizení inhibitoru (postpartální, polékové) [6, 10, 21, 22]. Imunosupresivní terapie bývá spojena se závažnými nežádoucími účinky [21]. Nejvýznamnějšími a nejčastějšími jsou infekce, neutropenie, steroidní diabetes mellitus a psychiatrické poruchy navozené kortikoterapií [23]. Závažné infekce jsou hlavní příčinou úmrtí pacientů s AHA léčených imunosupresí [24]. Imunosupresivní protokoly mají být přizpůsobeny věku, celkové kondici a přidruženým onemocněním pacientů s cílem vybalancovat výhody eradikace s riziky nežádoucích účinků terapie [25]. Vysoký věk a přidružená nádorová onemocnění jsou rizikové faktory zvyšující mortalitu [2, 16]. Naopak nízký titr inhibitoru (< 16–20 BU), respektive aktivita FVIII nad 1 % v době diagnózy, jsou spojeny s vyšší pravděpodobností dobré a rychlé léčebné odpovědi na imunosupresivní léčbu [3, 4]. Někteří autoři preferují u těchto pacientů režimy spojené s menším výskytem závažných nežádoucích účinků (např. monoterapii kortikosteroidy spíše než kombinaci kortikosteroidů s cyklofosfamidem nebo rituximabem) [4, 26]. Významné autority upozorňují na nedostatek spolehlivých důkazů o bezpečnosti tohoto přístupu a nabádají ke zdrženlivosti [6].
Během imunosupresivní terapie a následného sledování, kdy lze předpokládat trvání imunodeficitu, má být každý pacient pečlivě klinicky monitorován s cílem včasného záchytu zejména infekčních komplikací [6]. V tomto duchu má být také adekvátně a opakovaně edukován. K odstranění inhibitoru se nejčastěji používají kortikosteroidy, cyklofosfamid a rituximab [6, 10, 21]. Je možno použít i jiná imunosupresiva, přičemž nejvíce publikovaných zkušeností je s cyklosporinem A nebo takrolimem v monoterapii nebo v kombinaci s kortikosteroidy [23, 27–31]. Naopak IVIG (intravenózní imunoglobuliny) nemají v eradikaci inhibitoru dostatečně velkou a dlouhou účinnost a nejsou indikované v první linii terapie ani samostatně, ani v kombinaci s jinými imunosupresivy [2, 3, 6, 24, 32]. Možné je jejich použití v rámci imunotoleranční léčby nebo plazmaferézy/imunoadsorpce [33]. V platných britských doporučeních jsou IVIG doporučovány jako doplněk komplexní hemostatické terapie u pacientů se získanými inhibitory koagulačních faktorů v situacích život nebo končetinu ohrožujícího krvácení při selháním standardní léčby [6].
Frekvence léčebné odpovědi a toxicity imunosupresivních režimů 1. linie jsou uvedeny v tabulce 2.
Tab. 2. Léčebná odpověď a toxicita imunosupresivních režimů 1. linie 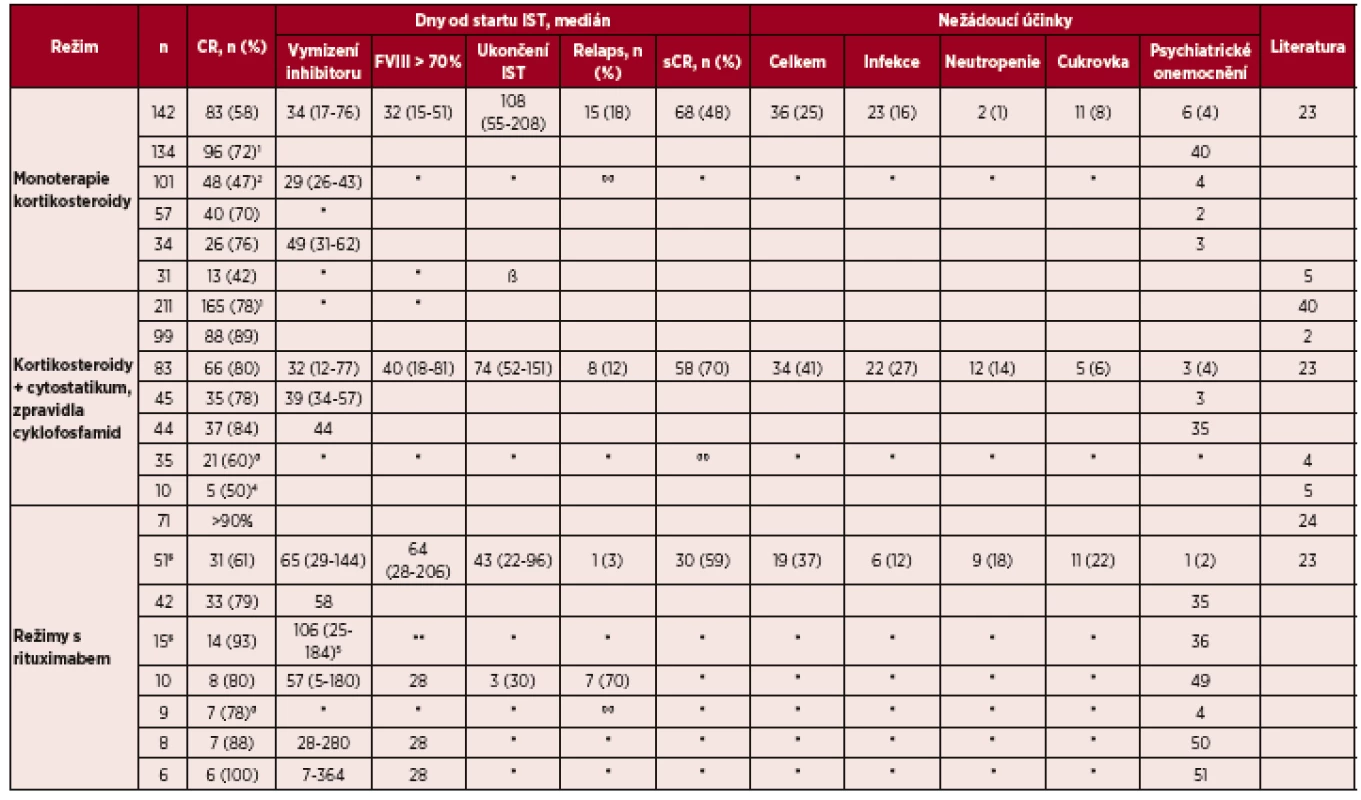
* chybí data ** žádný z těchto pacientů nedostal všechny 4 plánované infuze rituximabu °° ve studii dosáhlo sCR 49 (48%) pacientů s trváním sledování v mediánu 403 dní 1 souhrnná data z 25 malých souborů pacientů s AHA 2 hodnoceno dosažení PR 3 heterogenní skupina pacientů rituximabem v monoterapií nebo v kombinaci s jinými léky 4cyklofosfamid byl přidán k terapií prednisonem nebylo-li po třech týdnech dosaženo odpovědi 5 u pacientů s kombinací imunosupresiv včetně rituximabu 346 (120-580) Chybí výsledky metaanalýzy (k dispozici jen abstrakt, kde je hodnoceno 359 pacientů, z nichž CR dosáhlo 94 % při kombinované chemoterapii, 82 % při duální imunosupresi a 68 % při monoterapií kortikoidy) [16] Legenda: IST – imunosupresivní terapie; CR – kompletní odpověď; sCR – stabilní kompletní odpověď; AHA – získaná hemofilie A; PR – parciální odpověď. Hodnocení léčebné odpovědi
Hodnocení léčebné odpovědi má být standardizované. Kompletní remise (CR) je definovaná stavem s nedetekovatelným inhibitorem a FVIII > 70 % u pacienta s ukončenou imunosupresivní terapií [23]. Jinou definicí CR je normalizace aktivity FVIII a nedetekovatelný inhibitor nebo titr inhibitoru < 1 BU/ml bez krvácení [32]. Stabilní CR (sCR) je CR bez relapsu ve sledovaném časovém úseku [23]. Parciální remise (PR) znamená pokles titru inhibitoru o > 50 % a aktivita FVIII > 25 % u pacienta bez známek krvácení [34]. Laboratorní monitorování léčebného efektu má být pravidelné, v průběhu léčby zpravidla jednou týdně. Četnost kontrol je třeba upravit podle klinické situace a zvoleného eradikačního protokolu.
Kortikosteroidy a cyklofosfamid
Kombinace kortikosteroidu (nejčastěji prednison v dávce 1 mg/kg/den) s cyklofosfamidem (nejčastěji per os v dávce 2 mg/kg/den) je účinnější než monoterapie kortikosteroidy (častější dosažení sCR) [2, 3, 16, 23].
Nežádoucí účinky monoterapie kortikosteroidy se objevují u 25 % pacientů s AHA (infekce u 16 % pacientů, méně často cukrovka a psychiatrické potíže). Kombinace imunosupresiv vede k vyššímu výskytu nežádoucích účinků (až u 41 % léčených), přičemž infekce se objevují u 27 % pacientů a 55 % osob s infekčními komplikacemi má současně neutropenii. Frekvence infekčních komplikací u pacientů léčených perorální či parenterální formou cyklofosfamidu je srovnatelná (41, resp. 44 %) [23].
Imunosupresivní léčba by měla být zahájena prednisonem v dávce 1 mg/kg/den samostatně nebo v kombinaci s cyklofosfamidem 1–2 mg/kg/den per os [6]. U křehkých pacientů s nízkým titrem inhibitoru (< 16–20 BU/ml), s aktivitou FVIII >1 % a klinicky mírným průběhem je na zvážení preference monoterapie kortikosteroidy před kombinací imunosupresiv [4, 23, 26].
Medián doby od zahájení imunosupresivní léčby do dosažení remise je 5 týdnů [3, 23]. Není-li během 3–5 týdnů dosaženo CR nebo zřetelného trendu k poklesu titru inhibitoru a vzestupu aktivity FVIII, je nutno uvažovat o léčbě druhé linie [6, 21].
Terapie druhé linie
Pacienti, kteří v první linii neodpověděli na monoterapii kortikoidy, mají dostat kombinaci kortikoi-dů s cyklofosfamidem nebo rituximabem. V případě selhání kombinace kortikosteroidu s cyklofosfamidem je doporučován režim na bázi rituximabu nebo cyklosporinu A. Pokud selže rituximab podaný v rámci první linie terapie, má být ve druhé linii podán kortikosteroid s cyklofosfamidem [6, 23].
Rituximab
Režimy na bázi rituximabu (zpravidla v kombinaci s jinými imunosupresivy) jsou nejčastější modalitou léčby druhé linie [6]. Doposud totiž nebyla publikovaná data dokumentující větší účinnost (výskyt CR nebo sCR) rituximabu vůči kombinaci kortikosteroidů s cyklofosfamidem, respektive proti jiné léčebné modalitě, která by opravňovala jeho použití v první linii terapie [23, 24, 35]. Efekt léčby rituximabem nastupuje navíc později [23, 36]. Zatím není dostatek důkazů pro preferenci rituximabu ani v rámci léčby pacientů s vysokým titrem inhibitoru [6, 26].
Rituximab může být zvažován jako lék první volby u pacientů, u nichž jsou ostatní imunosupresiva kontraindikována [6]. Standardní dávkování je 375 mg/m2 v i. v. infuzi v týdenních intervalech celkem čtyřikrát. Je třeba respektovat skutečnost, že v monoterapii je účinek na eradikaci inhibitoru menší a rozvíjí se později [23].
Imunotoleranční léčba
Jaká je funkce FVIII v imunotoleranční léčbě? Exogenní FVIII má stimulovat buňky produkující protilátky, a zvýšit tak jejich citlivost na současně podávanou cytotoxickou kombinaci cyklofosfamidu, vinkristinu a kortikosteroidu. Léčebná odpověď tohoto režimu je dostatečně účinná a zdá se být rychlá. Role FVIII však není úplně jasná, protože intenzita imunosuprese je podstatně větší než v jiných studiích [37, 38]. Jiný typ imunotolerančního protokolu kombinuje FVIII s parenterálně podávaným cyklofos-famidem a methylprednisolonem s 93% úspěšností CR s mediánem 4,6 týdnů do dosažení odpovědi srovnatelném s jinými méně náročnými režimy [39]. Režimy na bázi vysoko dávkovaných koncentrátů FVIII s kombinací imunosupresiv jsou tedy alternativou pro pacienty s AHA a těžkým život nebo končetinu ohrožujícím krvácením refrakterním na standardní léčbu první linie [40].
Zhruba 10–20 % pacientů s AHA, kteří dosáhli CR, během 7,5 měsíce (1 týden až 14 měsíců) relabuje [3, 23]. Pacienti po dosažení CR proto mají být nejméně 6 měsíců klinicky a laboratorně monitorováni v intervalu asi jednoho měsíce a dále podle vývoje stavu. Podrobné vyšetření adekvátní anamnéze AHA musí předcházet všechny intervenční výkony [6].
Většina relabujících pacientů (70 %) dosáhne druhé CR po léčbě druhou linií léků (viz výše). Část pacientů však vyžaduje dlouhodobou udržovací terapii [6, 23].
3. Imunoadsorpce (IA)
(R. Hrdličková, Z. Čermáková)
Pro technickou a ekonomickou náročnost se v sou-časné době nejedná o léčbu první volby, ale o alternativu, která by měla být zavčas zvážená především u pacientů s život či končetinu ohrožujícím krvácením (krvácení do CNS, GIT, kompartment syndrom), s vysokým titrem inhibitoru, před chirurgickým výkonem a v případech, kde standardní léčba není účinná, nebo jsou její vedlejší účinky pro pacienta nepřijatelné. IA s ošetřením 2,5–3,0 plazmatického objemu pacienta každých 24 hodin vede během 24 až 48 hodin k rychlé kontrole krvácení [41], k rychlému poklesu hladiny inhibitoru a výraznému zkrácení doby imunosupresivní terapie se snížením rizika infekčních komplikací. U pacientů léčených modifikovaným Bonn-Malmö protokolem (zahrnuje kromě IA à 24 hod. po dobu 5 dnů i substituci intravenózními imunoglobuliny, kombinovanou imunosupresivní léčbu cyklofosfamid + prednison a vysoké dávky FVIII) bylo dosaženo kompletní remise u 88,5 % všech pacientů a u 97 % pacientů bez doprovodného onkologického onemocnění v mediánu 3,9 týdnů léčby (rozmezí 3,2–4,5 týdnů) [41].
Náklady na adsorpční kolony mohou být velmi rychle kompenzovány redukovaným počtem dnů, kdy je nutno pacienta léčit bypassovými přípravky [41, 42, 43].
D. Postpartální získaná hemofilie
(R. Hrdličková, Z. Čermáková)
AHA je velmi vzácná komplikace gravidity, jejíž incidence v České republice není známa, ve Velké Británii je udáván 1 případ na 350 000 porodů. U pacientek s postpartální AHA sledovaných v EACH2 registru se objevila první krvácivá epizoda v mediánu 2,5 měsíce po porodu a u 25 % se iniciální krvácivá epizoda objevila mezi 4. a 10. měsícem po porodu. Nicméně u 19 % gravidních žen sledovaných v EACH2 se příznaky korelující s diagnózou AHA objevily již před porodem. U těchto žen je riziko transplacentárního přenosu protilátek inhibující aktivitu FVIII i na plod s rizikem krvácivých komplikací u novorozence [44, 45]. Léčba krvácivých epizod u postpartální AHA je stejná jako u ostatních pacientů se získanou hemofilií. U fertilních žen je trend upřednostňovat v bypassové terapii 1. linie rFVIIa ve snaze eliminovat i teoretické riziko přenosu krví přenosných chorob.
Ačkoliv jsou u postpartální AHA popisované také spontánní remise, je doporučeno zahájit imunosupresivní léčbu eradikací inhibitoru ve snaze zkrátit období, kdy je pacientka v riziku krvácivých komplikací [46, 47]. Při výběru imunosupresivní terapie je nutno zohlednit i potenciální komplikace a vedlejší účinky této léčby s ohledem na fertilitu. V 1. linii léčby je doporučena monoterapie kortikoidy a pokud možno bez cyklofosfamidu a dalších alkylačních léků. Je popsáno úspěšné podání rituximabu u peripartální AHA, ale chybí důkazy podporující jeho nadřazenost jiným léčebným možnostem [48]. U pacientek s vysokým titrem inhibitoru a/nebo závažnými krvácivými epizodami lze uvažovat i o imunoadsorpci s cílem urychlit eliminaci inhibitoru a zkrátit dobu podávání vysoko dávkované imunosuprese.
Ženy s anamnézou peripartální AHA je nutno informovat o riziku možného relapsu v následující graviditě. Je doporučeno každé následující těhotenství těchto pacientek pečlivě monitorovat ve spolupráci s hematologem, specializovaným na hemostázu, s cílem časného záchytu relapsu a rychlejšího zahájení léčby.
Podíl autorů na přípravě doporučení
ČZ, HR, SP, ZJ, GJ, KZ, HZ, PJ – v rámci pracovní skupiny ČNHP pro získanou hemofilii připravili a napsali doporučení a podíleli se na jeho revizi.
BJ – podílel se na revizi a finální verzi doporučení.
Prohlášení o konfliktu zájmů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 23. 3. 2017.
doc. MUDr. Zuzana Čermáková, Ph.D.
Krevní centrum FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
email: zuzana.cermakova@fno.cz
Zdroje
1. Knoebl P, Marco P, Baudo F, et al. Demographic and clinical data in aquired hemophilia A: reults from the European Acquired Haemophilia Registry (EACH2). J Thromb Haemost 2012;10(4):622–631.
2. Delgado J, Jimenez-Yuste V, Hernandez-Navarro F, Villar A. Acquired haemophilia: review and meta-analysis focused on therapy and prognostic factors. Br J Haematol 2003;121(1):21–35.
3. Collins PW, Hirsch S, Baglin TP, et al. Acquired hemophilia A in the United Kingdom: a 2-year national surveillance study by the United Kingdom Haemophilia Centre Doctors’ Organisation. Blood 2007;109(5):1870–1877.
4. Tiede A, Klamroth R, Scharf RE, et al. Prognostic factors for remis-sion of and survival in acquired hemophilia A (AHA): results from the GTH-AH 01/2010 study. Blood 2015;125(7):1091–1097.
5. Green D, Rademaker AW, Briet E. A prospective, randomized trial of prednisone and cyclophosphamide in the treatment of patients with factor VIII autoantibodies. Thromb Haemost 1993;70(5):753–757.
6. Collins P, Chalmers E, Hart D, et al. Diagnosis and management of acquired coagulation inhibitors: a guideline form UKHCDO. Br J Haematol 2013;162 : 758–773.
7. Tiede A, Werwitzke S, Scharf RE. Laboratory diagnosis of acquired hemophilia A. Semin Thromb Hemost 2014;40 : 803–811.
8. Keeling D, Mackie I, Moore GW, Greer IA, Greaves M. British Committee for Standard in Haematology. Guideline on the investigation and management of antiphospholipid syndrome. Br J Haematol 2012;157 : 47–58.
9. Franchini M, Mannucci PM. Acquired haemophilia A: a 2013 update. Thromb Haemost 2013;110(6):1114–1120.
10. Huth-Kühne A, Baudo F, Collins P, et al. International recommendations on the diagnosis and treatment of patients with acquired hemophilia A. Haematologica 2009;94 : 566–575.
11. Sborov D, Rodgers M. How I manage patients with acquired haemophilia A. Br J Haematol 2013;161 : 157–165.
12. Zanon E, Milan M, Gamba G, et al. Activated prothrombin complex concentrate (FEIBA®) for the treatment and prevention of bleeding in patients with acquired haemophilia: A sequential study. Thromb Res 2015;136(6):1299–1302.
13. Tiede A, Amano K, Ma A, et al. The use of recombinant activated factor VII in patients with acquired haemophilia. Blood Rev 2015;29(S1):S19–S25.
14. Baudo F, Collins P, Huth-Kühne A, et al. Management of bleeding in acquired hemophilia A: results from the European Acquired Haemophilia (EACH2) Registry. Blood 2012;120 : 39–46.
15. Kruse-Jarres R, St-Louis J, Greist A, et al. Efficacy and safety of OBI-1, an antihaemophilic factor VIII (recombinant), porcine sequence, in subjects with acquired haemophilia A. Haemophilia 2015;21(2):162–170.
16. Bitting RL, Bent S, Li Y, Kohlwes J. The prognosis and treatment of acquired hemophilia: a systematic review and meta-analysis. Blood Coagul Fibrinolysis 2009;20(7):517–523.
17. Ingerslev J, Sorensen B. Parallel use of by-passing agents in haemophilia with inhibitors: a critical review. Br J Haematol 2011;155 : 256–262.
18. Teitel J, Belliveau D, Blanchette A, et al. A Canadian survey of self-infusion practice in persons with haemophilia A. Haemophilia 2012;18(6):e403-e405.
19. Franchini M, Gandini G, Di Paolantonio T, Mariani G. Acquired hemophilia A: a concise review. Am J Hematol 2005;80(1):55–63.
20. Ma AD, Carrizosa D. Acquired factor VIII inhibitors: pathophysiology and treatment. Hematology 2006 : 432–437.
21. Collins P, Baudo F, Huth-Kuhne A, et al. Consensus recommenda-tions for the diagnosis and treatment of acquired hemophilia A. BMC Res Notes 2010;3 : 161.
22. Lottenberg R, Kentro TB, Kitchens CS. Acquired hemophilia. A natural history study of 16 patients with factor VIII inhibitors receiving little or no therapy. Arch Intern Med 1987;147(6):1077–1081.
23. Collins P, Baudo F, Knoebl P, et al. Immunosuppression for acquired hemophilia A: results from the European Acquired Haemophilia Registry (EACH2). Blood 2012;120(1):47–55.
24. Franchini M, Lippi G. Acquired factor VIII inhibitors. Blood 2008;112(2):250–255.
25. Kessler CM, Knobl P. Acquired haemophilia: an overview for clinical practice. Eur J Haematol 2015;95(Suppl 81):36–44.
26. Aggarwal A, Grewal R, Green RJ, et al. Rituximab for autoimmune haemophilia: a proposed treatment algorithm. Haemophilia 2005;11(1):13–19.
27. Pardos-Gea J, Altisent C, Parra R, Vilardell-Tarres M, Ordi-Ros J. Acquired haemophilia A. First line treatment with calcineurin inhibitors and steroid pulses: a 10-year follow-up study. Haemophilia 2012;18(5):789–793.
28. Pfliegler G, Boda Z, Harsfalvi J, et al. Cyclosporin treatment of a woman with acquired haemophilia due to factor VIII:C inhibitor. Postgrad Med J 1989;65(764):400–402.
29. Au WY, Lam CC, Kwong YL. Successful treatment of acquired factor VIII inhibitor with cyclosporin. Haemophilia 2004;10(1):98–100.
30. Haj M, Dasani H, Kundu S, Mohite U, Collins PW. Acquired haemophilia A may be associated with clopidogrel. Br J Haematol 2004;329(7461):323.
31. Schulman S, Langevitz P, Livneh A, Mortinowitz U, Seligsohn U, Varon D. Cyclosporine therapy for acquired factor VIII inhibitor in a patient with systemic lupus erythematosus. Thromb Haemost 1996;76(3):344–346.
32. Schwartz RS, Gabriel DA, Aledort LM, Green D, Kessler CM. A prospective study of treatment of acquired (autoimmune) factor VIII inhibitors with high-dose intravenous gammaglobulin. Blood 1995;86(2):797–804.
33. Franchini M, Targher G, Manzato F, Lippi G. Acquired factor VIII inhibitors in oncohematology: a systematic review. Crit Rev Oncol Hematol 2008;66(3):194–199.
34. Barcellini W, Zanella A. Rituximab therapy for autoimmune haematological diseases. Eur J Intern Med 2011;22(3):220–229.
35. Sperr WR, Lechner K, Pabinger I. Rituximab for the treatment of acquired antibodies to factor VIII. Haematologica 2007;92(1):66–71.
36. Boles JC, Key NS, Kasthuri R, Ma AD. Single-center experience with rituximab as first-line immunosuppression for acquired hemophilia. J Thromb Haemost 2011;9(7):1429–1431.
37. Lian EC, Villar MJ, Noy LI, Ruiz-Dayao Z. Acquired factor VIII inhibitor treated with cyclophosphamide, vincristine, and prednisone. Am J Hematol 2002;69(4):294–295.
38. Lian EC, Larcada AF, Chiu AY. Combination immunosuppressive therapy after factor VIII infusion for acquired factor VIII inhibitor. Ann Intern Med 1989;110(10):774–778.
39. Nemes L, Pitlik E. New protocol for immune tolerance induction in acquired hemophilia. Haematologica 2000;85(10 Suppl):64–68.
40. Collins PW. Management of acquired haemophilia A. J Thromb Haemost 2011;9(Suppl 1):226–235.
41. Zeitler H, Ulrich-Merzenich G, Panek D, et al. Immunoadsorption in the treatment of acquired haemophilia. Atheroscler Suppl. 2009;10(5):122–125.
42. Freedman J, Rand ML, Russell O, et al. Immunoadsorption may provide a cost-effective approach to management of patients with inhibitors to FVIII. Transfusion 2003;43(11):1508–1513.
43. Jansen M, Schmaldienst S, Banyai S, et al. Treatment of coagulation inhibitors with extracorporeal immuno-adsorption (Ig-Therasorb). Br J Haematol 2001;112 : 91–97.
44. Tengborn L, Baudo F, Huth-Kühne A, et al. Pregnancy-associated acquired haemophilia A: results from the European Acquired Haemophilia (EACH2) registry. BJOG. 2012;119(12):1529–1537.
45. Ries M, Wölfel D, Maier-Brandt B. Severe intracranial hemorrhage in a newborn infant with transplacental transfer of an acquired factor VIII:C inhibitor. J Pediatr. 1995;127(4):649–650.
46. Michiels JJ. Acquired haemophilia A in women post-partum: clinical manifestations, diagnosis and treatment. Clin Appl Thromb Haemost 2000;6 : 82–86.
47. Hauser I, Schneider B, Lechner K. Postpartum factor VIII inhibitors. A review of the literature with special reference to the value of steroid and immunosuppressive treatment. Thromb Haemost 1995;73 : 1–5.
48. Bonfanti C, Crestani S, Frattini F, et al. Role of rituximab in the treatment of postpartum acquired haemophilia A: a systematic review of the literature. Blood Transfus 2015;13;396–400.
49. Stasi R, Brunetti M, Stipa E, Amadori S. Selective B-cell depletion with rituximab for the treatment of patients with acquired hemophilia. Blood 2004;103(12):4424–4428.
50. Singh AG, Hamarneh IS, Karwal MW, Lentz SR. Durable responses to rituximab in acquired factor VIII deficiency. Thromb Haemost 2011;106(1):172–174.
51. Onitilo AA, Skorupa A, Lal A, et al. Rituximab in the treatment of acquired factor VIII inhibitors. Thromb Haemost 2006;96(1):84–87.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie Chirurgie všeobecná Intenzivní medicína Kardiologie Urgentní medicína Laboratoř
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Diagnostika a léčba získané hemofilie – konsenzuální doporučení Českého národního hemofilického programu (ČNHP)
- Výběr z tisku a zprávy o knihách
- Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe
- Interferón alfa v liečbe Ph negatívnej myeloproliferatívnej neoplázie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 2., rok 2017
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Interferón alfa v liečbe Ph negatívnej myeloproliferatívnej neoplázie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 2., rok 2017
- Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe
- Diagnostika a léčba získané hemofilie – konsenzuální doporučení Českého národního hemofilického programu (ČNHP)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



