-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Subkutánní belimumab v léčbě systémového lupusu
14. 4. 2025
Pacienti s aktivním systémovým lupusem erythematodes (SLE) mají již déle než 10 let k dispozici cílenou terapii specificky vyvinutou právě pro toto onemocnění. Monoklonální protilátka belimumab, která blokuje přežití B lymfocytů, vykázala v klinických hodnoceních vysokou účinnost a příznivý bezpečnostní profil. Od 1. dubna 2025 je v Česku z veřejného zdravotního pojištění hrazená také subkutánní forma přípravku. Jaké jsou s touto formou belimumabu zkušenosti z klinických studií i dosavadní praxe a kteří pacienti z ní mohou nejvíce profitovat? Nejen o těchto otázkách se diskutovalo na Setkání center biologické léčby pro SLE a LN (lupusové nefritidy), konaném ve dnech 20.–21. 3. 2025 v Praze.
Subkutánní belimumab v klinickém hodnocení
Účinnost a bezpečnost podkožního podání belimumabu u pacientů se SLE byla hodnocena v randomizované klinické studii fáze III BLISS-SC.1 Účastnilo se jí 836 pacientů (průměrný věk 39 let, 94 % žen) se středně těžkým až těžkým SLE, tedy se skóre ≥ 8 na škále SELENA-SLEDAI (Safety of Estrogens in Lupus Erythematosus National Assessment – SLE Disease Activity Index). Účastníci byli v poměru 2 : 1 randomizováni k přidání belimumabu 200 mg s.c. nebo placeba 1× týdně ke standardní terapii.
Primárním sledovaným parametrem ve studii bylo dosažení klinické odpovědi dle SLE Responder Index (SRI4) v 52. týdnu. SRI4 je složený parametr, pro jehož dosažení musí být splněna následující kritéria: snížení skóre SELENA-SLEDAI o ≥ 4 body, žádné nové postižení orgánového systému dle BILAG A (British Isles Lupus Assesment Group), ne více než 2 nová postižení dle BILAG B a zhoršení dle celkového hodnocení lékařem (PGA) maximálně o 0,3 bodu. Sekundární sledované parametry zahrnovaly snížení denní dávky perorálních kortikosteroidů o ≥ 25 % v týdnech 40–52 a dobu do těžkého vzplanutí onemocnění.1
InzerceVýsledky studie BLISS-SC
Klinické odpovědi SRI4 dosáhlo 61,4 % pacientů s belimumabem vs. 48,4 % s placebem (poměr šancí [OR] 1,68; 95% interval spolehlivosti [CI] 1,25–2,25; p = 0,0006). Snížení denní dávky kortikosteroidů na ≤ 7,5 mg se podařilo dosáhnout u 18,2 % pacientů na belimumabu vs. 11,9 % z kontrolní skupiny. V rameni s belimumabem bylo pozorováno statisticky signifikantní snížení rizika vzplanutí onemocnění (poměr rizik [HR] 0,78; 95% CI 0,65–0,93; p = 0,0061), v případě těžkého relapsu bylo relativní riziko s belimumabem nižší téměř o polovinu (HR 0,51; 95% CI 0,35–0,74; p = 0,0004) (viz obr. 1).1
Obr. 1 Pravděpodobnost těžkého vzplanutí SLE ve studii BLISS-SC1
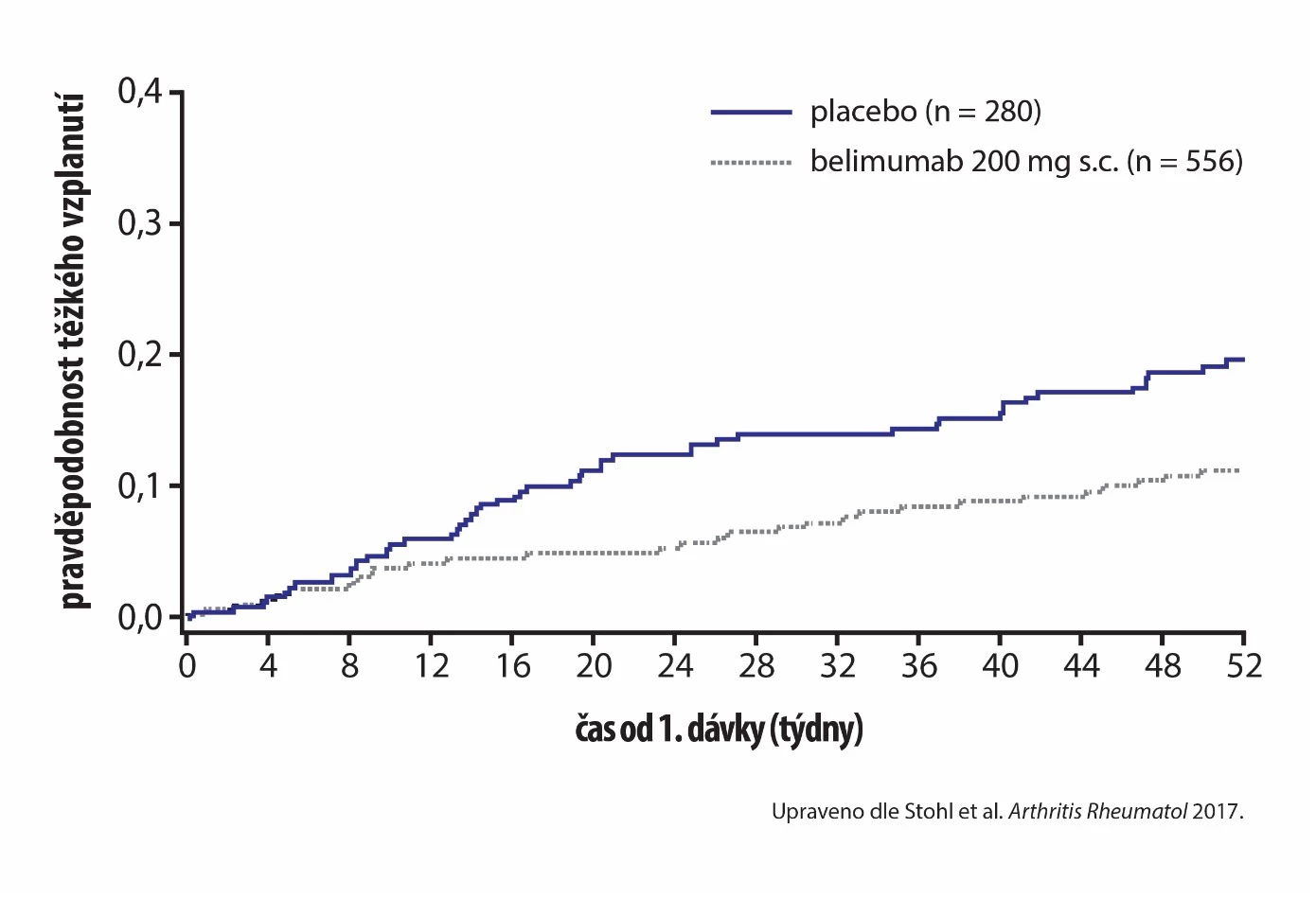
Po ukončení dvojitě zaslepené fáze mohli účastníci studie vstoupit do 6měsíčního otevřeného prodloužení, v rámci něhož bylo všem pacientům ke standardní léčbě SLE přidáno 200 mg belimumabu s.c. 1× týdně.2 V otevřeném prodloužení pokračovalo 206 pacientů z kontrolní skupiny a 456 léčených belimumabem. Efektivita léčby zůstala zachována, odpovědi SRI dosáhlo 16,1 % pacientů původně dostávajících placebo a 76,3 % z ramene s belimumabem.2
Bezpečnostní profil
Výskyt nežádoucích příhod byl v obou ramenech srovnatelný, nejčastěji se jednalo o běžné infekce a infestace. Infekce Herpes zoster se vyskytla u 3,2 % pacientů z ramene s belimumabem a 4,6 % z kontrolní skupiny. Závažné nežádoucí účinky byly hlášeny u 10,8 % pacientů na belimumabu a u 15,7 % z ramene s placebem, nejčastěji šlo o infekce a infestace, ledvinné a močové poruchy a poruchy nervové soustavy. Lokální reakce v místě vpichu (mírné či střední intenzity) se vyskytly u 6,1 % nemocných léčených belimumabem a 2,5 % na placebu, četnost hypersenzitivních reakcí byla v obou ramenech srovnatelná.1
I přes rozdílnou expozici belimumabu (24 vs. 76 týdnů) byl v otevřeném prodloužení studie BLISS-SC podíl pacientů s nejméně 1 nežádoucí příhodou mezi skupinami srovnatelný (51,5 % u nemocných z původně placebové větve vs. 48,2 % kontinuálně léčených belimumabem), což platilo i pro závažné nežádoucí příhody (6,8 vs. 5,5 %). Většina nežádoucích příhod byla mírné či střední intenzity a bezpečnostní profil byl konzistentní s předchozími pozorováními.2
Subkutánní, nebo intravenózní?
K dispozici je nepřímé porovnání účinnosti belimumabu i.v. se subkutánní formou. Byla provedena sdružená analýza dat z výše popsané studie BLISS-SC a 3 randomizovaných studií fáze III s intravenózním belimumabem s celkovým počtem 1892 pacientů s pozitivitou autoprotilátek a vysokou aktivitou nemoci. Analýza prokázala srovnatelnou účinnost belimumabu oproti placebu bez ohledu na formu podání.3 Srovnatelnou účinnost i bezpečnost s.c. formy přípravku potvrdila také bayesovská síťová metaanalýza 5 randomizovaných studií s celkem 3460 pacienty.4
Farmakokinetické modelování na souboru dat ze 2 studií fáze I provedených s celkem 134 zdravými dobrovolníky ukázalo, že při podávání belimumabu v dávce 200 mg s.c. 1× týdně je expozice léčivu srovnatelná s podáním 10 mg/kg i.v. formy každé 4 týdny. Ze simulované akumulace belimumabu při každotýdenní subkutánní aplikaci vyplynulo, že podání nasycovací dávky v tomto případě není nutné.5
Jak na s.c. belimumab v praxi?
Subkutánní belimumab dostupný na českém trhu se podává pomocí jednorázového předplněného pera do kožní řasy na břiše nebo přední straně stehna. Doporučené dávkování u pacientů se SLE je 200 mg s.c. 1× týdně. U nemocných s aktivní lupusovou nefritidou (LN) se první 4 týdny podává 400 mg s.c. 1× týdně (ve dvou 200mg injekcích) a poté se pokračuje s dávkou 200 mg s.c. 1× týdně. V případě LN se přípravek má používat jako indukční léčba v kombinaci s kortikosteroidy a mykofenolátem či cyklofosfamidem nebo jako udržovací léčba s mykofenolátem či azathioprinem.6
Při převádění pacienta léčeného i.v. formou přípravku na subkutánní podávání se má první s.c. injekce podat 1–4 týdny po poslední i.v. dávce. V případě LN se tento interval zkracuje na 1–2 týdny a k převedení má dojít kdykoliv po dokončení prvních 2 intravenózních dávek (viz obr. 2).
Obr. 2 Schéma podávání belimumabu s.c.6

Stanovení úhrady pro subkutánní belimumab
Od 1. 4. 2025 je belimumab s.c. hrazen z veřejného zdravotního pojištění jako přídatná léčba u dospělých pacientů s aktivním SLE s pozitivními autoprotilátkami proti dsDNA a/nebo antinukleárními protilátkami a nízkou hladinou komplementu, kteří navzdory obvyklé terapii SLE sestávající z kortikoidů, antimalarik a dalších imunosupresiv setrvávají v klinicky aktivním onemocnění (SELENA-SLEDAI ≥ 10). Léčba belimumabem se ukončí, pokud nedojde po 24 týdnech od jejího zahájení k poklesu skóre SELENA-SLEDAI alespoň o 4 body. Účinnost léčby belimumabem se následně vyhodnocuje každých 6 měsíců, a pokud dojde ke zvýšení SELENA-SLEDAI skóre na ≥ 10 bodů, bude ukončena.7
Shrnutí a závěr
Subkutánní forma belimumabu umožňuje pacientům se SLE méně invazivní podání léčiva v domácím prostředí8 s účinností srovnatelnou s intravenózní aplikací a s příznivým bezpečnostním profilem.3
Na Setkání center biologické léčby pro SLE a LN se sešli přední odborníci s dlouholetými zkušenostmi s vedením terapie pacientů se SLE. Svoje zkušenosti se subkutánní formou belimumabu sdílela MUDr. Martina Skácelová, Ph.D., ze III. interní kliniky LF UP a FN Olomouc, která prezentovala kazuistiku pacientky s komplikovaným průběhem onemocnění SLE, jíž byla s.c. forma nasazena z důvodu problematického žilního přístupu.9 Kazuistiku i podněty z následující diskuse si můžete přečíst v následujícím článku.
(este)
Zdroje:
1. Stohl W., Schwarting A., Okada M. et al. Efficacy and safety of subcutaneous belimumab in systemic lupus erythematosus: A fifty-two-week randomized, double-blind, placebo-controlled Study. Arthritis Rheumatol 2017; 69 (5): 1016–1027, doi: 10.1002/art.40049.
2. Doria A., Bass D., Schwarting A. et al. A 6-month open-label extension study of the safety and efficacy of subcutaneous belimumab in patients with systemic lupus erythematosus. Lupus 2018; 27 (9): 1489–1498, doi: 10.1177/0961203318777634.
3. Ramachandran S., Parks D., Kurtinecz M. et al. An indirect comparison of intravenous and subcutaneous belimumab efficacy in patients with SLE and high disease activity. J Comp Eff Res 2018; 7 (6): 581–593, doi: 10.2217/cer-2017-0085.
4. Lee Y. H., Song G. G. Comparative efficacy and safety of intravenous or subcutaneous belimumab in combination with standard therapy in patients with active systemic lupus erythematosus: a Bayesian network meta-analysis of randomized controlled trials. Lupus 2018; 27 (1): 112–119, doi: 10.1177/0961203317713143.
5. Yapa S. W., Roth D., Gordon D., Struemper H. Comparison of intravenous and subcutaneous exposure supporting dose selection of subcutaneous belimumab systemic lupus erythematosus Phase 3 program. Lupus 2016; 25 (13): 1448–1455, doi: 10.1177/0961203316642309.
6. SPC Benlysta 200MG INJ SOL PEP 4X1ML. Dostupné na: www.ema.europa.eu/cs/documents/product-information/benlysta-epar-product-information_cs.pdf
7. Rozhodnutí BENLYSTA ze 3.3. 2025, Sp. zn. SUKLS233457/2024, č.j. sukl78673/2025.
8. Mašková E., Kubová K. Subkutánní aplikace léčiv – přehled a výhody podání. Remedia 2014; 24 : 503–509.
9. Skácelová M. Novinka v biologické léčbě SLE: SC forma belimumabu. Setkání center biologické léčby pro SLE a LN, Praha, 20. 3. 2025.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Nefrologie Revmatologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




