-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úloha signální dráhy transformačního růstového faktoru β v hemopoéze a studie nových inhibitorů této dráhy pro léčbu nízkorizikového myelodysplastického syndromu
Role of the transforming growth factor (TGF)-β signal pathway in haematopoiesis and studies of new inhibitors of this pathway in the treatment of lower-risk myelodysplastic syndrome
Transforming growth factor (TGF)-β is a cytokine originally named for its ability to transform normal fibroblasts in culture. TGF-β was subsequently found to inhibit growth of epithelial and lymphoid cells. The cellular response to TGF-β depends on the cell type and cell microenvironment. The TGF-β family includes TGF-β1, TGF-β2, TGF TGF-β3, activins A and B, nodal, myostatin, different growth differentiation factors (GDFs), the bone morphogenetic proteins (BMPs) and the anti-Műllerian hormone (AMH). More than thirty of these ligands use a far smaller number of receptors and down-stream intracellular signalling molecules. TGF-β receptor activation and phosphorylation is associated with the myelosuppression and ineffective erythropoiesis in myelodysplastic syndrome (MDS). Anaemia is the predominant cause of poor quality of life and morbidity in patients with lower-risk MDS (LR-MDS). Lenalidomide was approved only for the treatment of del(5q) MDS after failure of erythropoiesis stimulating agents (ESAs), also known as erythropoiesis stimulating proteins (ESPs). Other patients with LR-MDS have very limited therapy options after failure of ESPs and are dependent on red blood cell transfusions. Targeted inhibition of the TGF-β signalling pathway in preclinical and clinical studies showed promising results. Sotatercept and its later analogue luspatercept stimulated erythropoiesis in postmenopausal women with osteoporosis and were also efficient in a specific group of MDS patients with ring sideroblasts who had lost their response to ESPs. Luspatercept is the first TGF-β pathway inhibitor intended for the stimulation of late stage of erythroid differentiation and for the treatment of anaemia awaiting approval on the basis of promising results of phase III studies, namely MEDALIST in RL-MDS and BELIEVE in transfusion-dependent β-thalassemia.
Keywords:
erythropoietin – myelodysplastic syndrome – ring sideroblasts – anaemia – TGF-β signal pathway – growth differentiation factor 11 – sotatercept – luspatercept – galunisertib – vactosertib
Autoři: O. Fuchs; R. Bokorová
Působiště autorů: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 4, p. 310-318.
Kategorie: Souhrnné/edukační práce
Souhrn
Transformační růstový faktor beta (TGF-β) je cytokin pojmenovaný podle schopnosti transformovat normální fibroblasty v kultuře. Později bylo zjištěno, že TGF-β inhibuje růst epiteliálních a lymfoidních buněk. Rodina TGF-β zahrnuje TGF-β1, TGF-β2, TGF-β3, aktiviny A a B, nodal, myostatin, různé růstové diferenciační faktory (GDF), kostní morfogenetické proteiny (BMP) a anti-Müllerian hormon (AMH). Velký počet těchto ligand (více než třicet) se váže k daleko menšímu počtu specifických transmembránových receptorů na povrchu buněk a vnitrobuněčných signálních molekul. Aktivace receptorů pro TGF-β a jejich fosforylace je spojena s myelosupresí a neefektivní erytropoézou u myelodysplastického syndromu (MDS). Anémie je převládající příčinou špatné kvality života a úmrtnosti pacientů s nízkorizikovým MDS (LR-MDS). Lenalidomid byl schválen jen pro léčbu nízkorizikových del(5q) MDS po selhání účinku látek stimulujících erytropoézu (ESA), označovaných také jako erytropoézu stimulující proteiny (ESP). Ostatní pacienti s LR-MDS bez této delece jsou odkázáni po selhání účinku ESP na transfuze červených krvinek. Cílená inhibice signální dráhy TGF-β v preklinických a klinických studiích ukázala slibné výsledky. Sotatercept a jeho pozdější a účinější analog luspatercept stimulovaly erytropoézu u žen po menopauze léčených na osteoporózu a byly také účinné u specifické skupiny pacientů s MDS s prstenčitými sideroblasty, kteří přestali reagovat na ESP. Luspatercept je první inhibitor dráhy TGF-β, určený pro stimulaci pozdní fáze erytroidní diferenciace a zmírnění či odstranění anémie, který je těsně před schválením na základě slibných výsledků studií fáze III MEDALIST u LR-MDS a BELIEVE u β-thalasemie.
Klíčová slova:
myelodysplastický syndrom – prstenčité sideroblasty – erytropoetin – anémie – signální dráha TGF-β – růstový diferenciační faktor 11 – sotatercept – luspatercept – galunisertib – vactosertib
ÚVOD
Myelodysplastický syndrom (MDS) představuje velmi heterogenní skupinu klonálních chorob hematopoetických kmenových buněk spojených s dysplazií myeloidních buněk, neefektivní hemopoézou a rizikem transformace do akutní myeloidní leukemie (AML) [1, 2]. MDS je detekován na základě cytopenie při vyšetření periferní krve a následného vyšetření morfologie a buněčnosti kostní dřeně [1, 2]. Jedná se o chorobu vyskytující se převážně u starších jedinců nad 60 let a spíše u mužů než žen. Dalšími rizikovými faktory kromě věku a pohlaví je obezita, kouření a předchozí vystavení radioterapii nebo chemoterapii [3]. Bohužel většina genetických mutací není specifická pro MDS, a tak zatím se do klasifikace MDS dostala jen del(5q) a mutace SF3B1 [4]. Prognostický význam má i řada dalších mutací v genech TP53, RUNX1 a EZH2 [5]. Mutace SF3B1 je přítomna asi v 80 % MDS s prstenčitými sideroblasty (MDS-RS) a je spojena s delším přežitím, zatím co mutace v genech TP53, RUNX1 a EZH2 s kratším přežitím. V mezinárodních skórovacích systémech IPSS [6] a IPSS-R [7] s větším zahrnutím výsledků cytogenetického vyšetření pro stanovení prognózy u nově zachycených pacientů s MDS však uvedené mutace nejsou zatím zařazeny i když ovlivňují prognózu. Pro volbu terapie je dnes stále používán systém IPSS a pacienti s MDS jsou podle něho rozděleni na MDS s nižším rizikem (LR-MDS) a vyšším rizikem (HR-MDS).
Terapie u pacientů s LR-MDS je založena na potřebě transfuzí červených krvinek. Pacienti bez potřeby transfuzí jsou obvykle pouze sledováni, než se stanou závislí na transfuzích. Pacienti závislí na transfuzích červených krvinek mají obvykle chronickou anémii s průměrnou hodnotou hemoglobinu nižší než 9 g/dl a mají nižší kvalitu života, únavu, přetížení organismu železem z transfuzí a související nebezpečí kardiotoxicity. Pro pacienty s LR-MDS, kteří jsou závislí na transfuzích, jsou nejprve zkoušeny ESP [8, 9]. Podkožní injekce erytropoetinu (EPO)/ESP jsou běžně používány. ESP mohou být použity i dříve než se pacienti s LR-MDS stanou závislí na transfuzích [10, 11]. Odpověď na ESP je dosažena přibližně u 50–60 % pacientů s LR-MDS a trvá asi 17–24 měsíců. Pacienti s LR-MDS bez del(5q), jejichž anémie přetrvala bez snížení počtu potřebných transfuzí červených krvinek, a tedy neodpověděli na podání ESP, nebo jejichž odpověď je kratší než 6 měsíců mají větší riziko progrese onemocnění a transformace do AML [12].
Lenalidomid byl schválen americkou FDA (Food and Drug Administration) i evropskou EMA (European Medicine Agency) agenturou pro léčbu pacientů s LR--MDS a s del(5q) [13–16]. Tito pacienti obvykle neodpovídají na ESP nebo jejich odpověď je krátká. Pacienti s LR--MDS a s del(5q) mají často mutace v genu TP53 a právě tyto mutace jsou často spojeny s progresí onemocnění a rezistencí na lenalidomid [17, 18].
Experimentálně je ve studiích lenalidomid používán i v terapii pacientů s LR-MDS bez delece na dlouhém raménku chromozomu 5 [19–21]. Zatímco u pacientů s LR-MDS a s del(5q) je lenalidomid účinný u 60–70 % pacientů, u pacientů s LR-MDS bez del(5q) je jeho účinnost pouze 20–30 %.
U vybraných skupin pacientů s LR-MDS a s del(5q) se v terapii používají i další látky. Stimulátory receptoru pro trombopoetin (romiplostim a eltrombopag) potlačují trombocytopenii [8]. Immunosupresivní terapie pomocí antithymocytárního globulinu (ATG) v kombinaci s cyklosporinem je používána u hypoplastické formy MDS s buněčně chudou kostní dření, při zvýšené expresi antigenu HLA-DR15 třídy II HLA, při přítomnosti klonu PNH (paroxysmální noční hemoglobinurie) a trizomii chromozomu 8 [22, 23]. Alemtuzumab je monoklonální protilátka proti antigenu CD-52, která byla také použita v terapii u hypoplastické formy MDS [24]. Neutropenie je obvykle potlačena podáním faktoru stimulujícího růst kolonií granulocytů (G-CSF) [8].
ANÉMIE JAKO HLAVNÍ PROBLÉM U LR-MDS
Anémie je nejčastějším druhem cytopenie u MDS a je přítomná u 89 % případů v registrech [8]. Při terapii pacientů s LR-MDS jsou používány ESP. Nejčastěji je z nich používán EPO. Skupina ESP obsahuje erytropoetiny (erytropoetin alfa, beta, zeta, a theta) a darbepoetin-α (rekombinantní erytropoetin-α s pomalejším odbouráváním v organismu a tím delším působením a vyšší účinností). Teprve v březnu roku 2017 byla první látka ze skupiny ESP, erytropoetin-α, schválena Francouzským zdravotnickým úřadem (National Security Agency for Medicine and Health Products) pro terapii symptomatické anémie u dospělých s LR-MDS s nízkou hladinou erytropoetinu v séru (< 200 mU/ml) na základě studie EPO-ANE (NCT01362140 a NCT01381809). Již dlouho před tím byly v roce 1989 erytropoetin-α a v roce 2001 darbepoetin-α schváleny FDA pro terapii pacientů s chronickým onemocněním ledvin. I když pro MDS nebyly látky skupiny ESP schváleny ani FDA ani EMA, byly již 20 let používány v terapii na základě doporučení vypracovaného odbornými společnostmi NCCN (National Comprehensive Cancer Network), ESMO (European Society of Medical Oncology) a evropskou sítí pro leukemie (European LeukemiaNet) [8].
Odpověď pacientů s LR-MDS na terapii pomocí ESP lze vysvětlit dvěma navrženými mechanismy. ESP inhibují apoptózu a stimulují produkci erytrocytů. ESP zvyšují životnost erytroidních prekurzorů, jejich proliferaci a zrání. Druhý mechanismus předpokládá, že ESA stimulují polyklonální erytropoézu tím, že podporují přežití erytroidních prekursorů s normálním karyotypem [8].
REGULACE ERYTROPOÉZY
Hematopoetické buňky jsou tvořeny z malé populace pluripotentních kmenových buněk, které produkují buňky specializovaných hematologických linií. Erytroidní linie zahrnuje v rané fázi vývoje buňky BFU-E (“burst-forming unit-erythroid“), které pomalu proliferují a diferencují do rychle se dělících CFU-E buněk (“colony-forming unit-erythroid“). CFU-E buňky jsou již závislé na erytropoetinu. Další diferenciací se zmenšuje velikost erytroidních buněk, dochází ke kondenzaci chromatinu a tvorbě hemoglobinu [25, 26]. Erytropoetin stimuluje erytropoézu na stadiu buněk CFU-E a proerytroblastů a potom již klesá exprese receptoru pro erytropoetin.
SIGNÁLNÍ DRÁHA RODINY TGF-β
Více než třicet cytokinů rodiny TGF-β se váže k daleko menšímu počtu specifických transmembránových receptorů na povrchu buněk a vnitrobuněčných signálních molekul (proteinů Smad) [27]. Přenos signálu rodiny cytokinů TGF-β z membrány do jádra je schematicky znázorněn na obrázku 1. Ligandy (cytokiny rodiny TGF-β ) se váží k receptorům typu II a typu I (transmembránové serin/threonin proteinkinázy). Typ II receptoru je konstitutivní kinázou na rozdíl od receptoru typu I, který je inaktivní v nepřítomnosti ligandu. Receptory typu II jsou autofosforylovány a fosforylují receptory typu I na serinových a threoninových zbytcích. Receptory typu I fosforylují transkripční faktory Smad na serinových zbytcích. Transkripční faktory Smad se potom hromadí v jádře a regulují transkripci cílových genů.
Obr. 1. Schematické znázornění signální dráhy cytokinů rodiny TGF-β
Ligandy (cytokiny rodiny TGF-β ) se váží k receptoru typu II a typu I (transmembránové serin/threonin proteinkinázy). Typ II receptoru je konstitutivní kinasou na rozdíl od receptoru typu I, který je inaktivní v nepřítomnosti ligandu. Receptory typu II jsou autofosforylovány a fosforylují receptory typu I na serinových a threoninových zbytcích. Receptory typu I fosforylují transkripční faktory Smad na serinových zbytcích. Transkripční faktory Smad se potom hromadí v jádře a regulují transkripci cílových genů.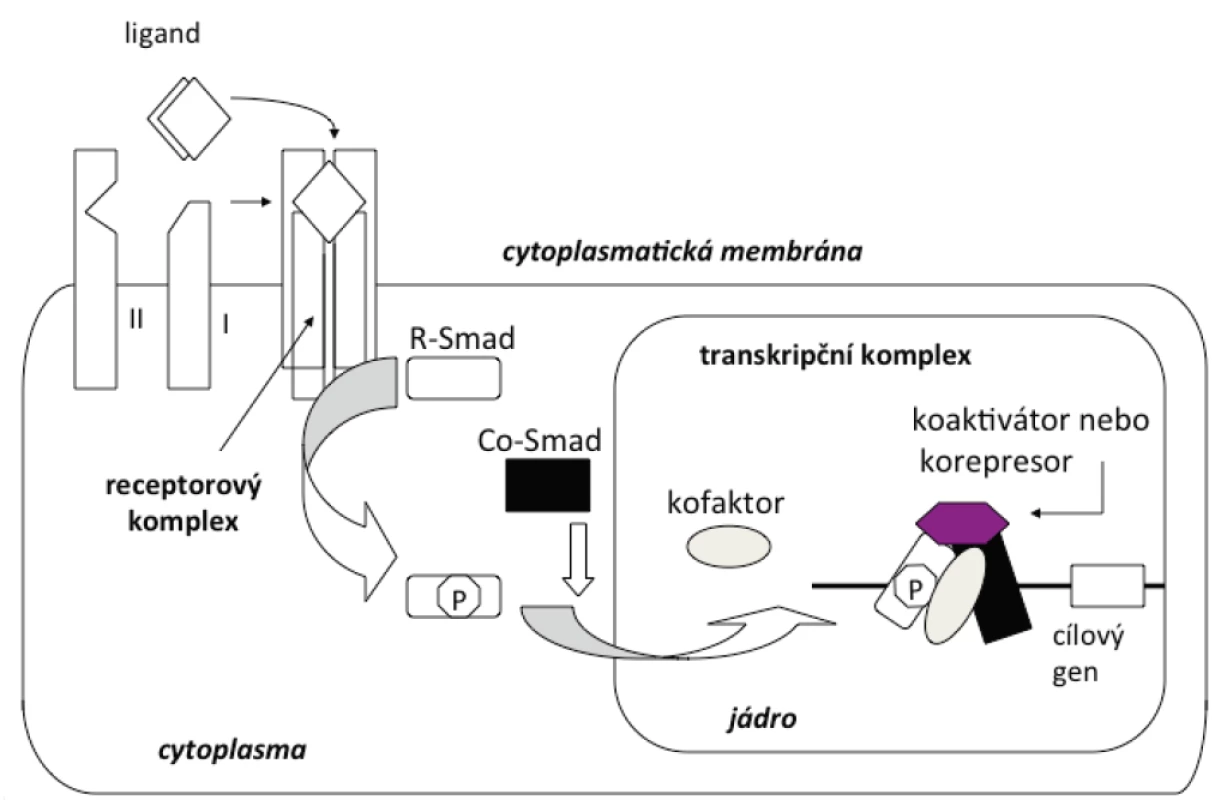
Přenos signálu cytokinů rodiny TGF-β (TGF-β, BMP, aktiviny) přes receptory II. a I. typu na proteiny Smad je ukázán na obrázku 2. Receptory II. a I. typu jsou před vazbou ligandu monomery, homodimery a heterodimery. Ligandy stabilizují tetramerickou interakci dvou molekul receptoru typu II. a dvou molekul receptoru typu I.
Obr. 2. Přenos signálu TGF-β, aktivinů a BMP
Receptory typu I (ALK3, ALK4, ALK5 a ALK6) jsou označeny dvěma způsoby. Smad 4β byl nalezen pouze u žáby Xenopus laevis, kde učinkuje v raném vývoji. U člověka existuje jako Co-Smad pouze Smad 4.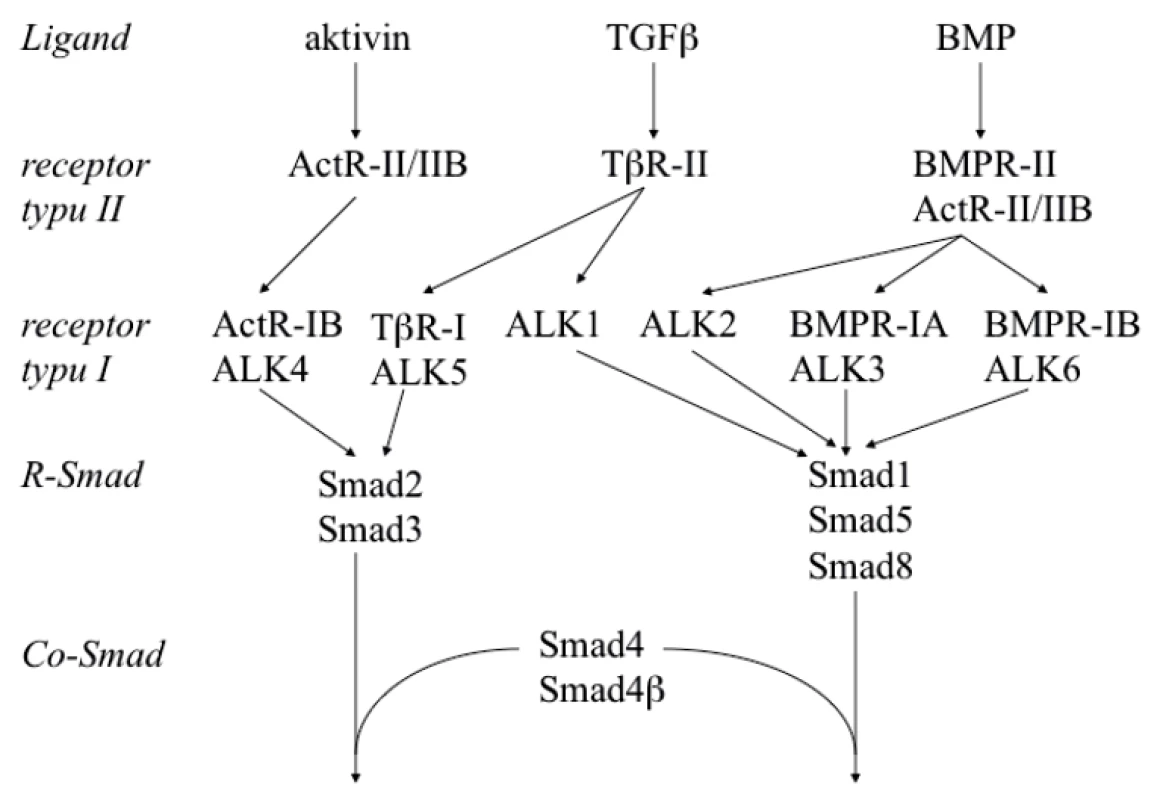
Receptorů regulovaných proteinů Smad (R-Smad) je pět (Smad 1–3, Smad 5 a Smad 8 – také označovaný Smad 9). Smad 4 (Co-Smad) je společným mediátorem pro cytokiny rodiny TGF-β. Fosforylované R-Smad tvoří heteromerní komplex s Co-Smad. Tento komplex se přemístí do jádra a reguluje transkripci cílových genů (obr. 1). Vedle R-Smad a Co-Smad existuje třetí skupina tzv. inhibičních Smad (Anti--Smad), kterou tvoří Smad 6 a Smad 7. Označení Smad vzniklo spojením názvů příbuzných genů Sma („small body size“) u C. elegans a Mad („mothers against decapentaplegic“) u D. melanogaster. Proteiny Smad nevykazují enzymatickou aktivitu a svou funkci v přenosu signálu vykonávají pomocí interakcí protein-protein a protein-DNA.
ÚLOHA RODINY TGF-β V REGULACI ERYTROPOÉZY
Signální dráha TGF-β má jak stimulační, tak inhibiční vliv na erytropoézu podle stupně diferenciace. TGF-β1 inhibuje proliferaci buněk BFU-E, prodlužuje trvání G1 fáze buněčného cyklu a podporuje diferenciaci BFU-E na CFU-E [28-30]. Popsaná signální dráha TGF-β, kdy aktivované proteiny Smad 2/3 v interakci se Smad 4 přenáší signál TGF-β, inhibuje proliferaci erytroidních progenitorů. Přenos signálu proteinů Smad 2/3 může probíhat také bez účasti Smad 4, kdy výsledkem je naopak stimulace diferenciace erytroidních buněk [31].
SIGNÁLNÍ DRÁHA RODINY TGF-β U LR-MDS
Signální dráha TGF-β vykazuje změny u RL-MDS a přispívá k patogenezi této choroby [32–38]. Neefektivní hemopoéza je charakteristická pro MDS a souvisí se zvýšenou aktivitou signální dráhy TGF-β [37, 38].
Během posledních pěti let byla důkladně studována úloha růstového diferenciačního faktoru GDF11 v regulaci erytropoézy [32, 34–36, 39–42]. GDF11 je podobně jako další členi rodiny TGF-β produkován proteolytickým štěpením prekurzoru a uvolněním z latentního komplexu. Sekvence aminokyselin u GDF je na 90 % shodná se sekvencí myostatinu. Signální dráha GDF11-ActRIIB/TGFBR1 (také nazývaný ALK5)-Smad 2/3 je důležitým regulačním mechanismem proliferace a zrání erytroidních prekurzorů. Výsledky ukázaly, že GDF11 působí negativně na pozdní fázi erytroidní diferenciace.
V plazmě pacientů s LR-MDS bylo nalezeno zvýšené množství GDF 11 ve srovnání s plazmou zdravých jedinců. Množství GDF 11 v plazmě stoupalo v průběhu onemocnění společně s neefektivní erytropoézou, přetížením železem a erytroidní hyperplazií.
KLINICKÉ STUDIE NA VYUŽITÍ INHIBITORŮ SIGNÁLNÍ DRÁHY RODINY TGF-β V TERAPII LR-MDS BEZ DELECE NA CHROMOzOMU 5q NEREAGUJÍCÍCH NA ERYTROPOETIN
Klinické studie byly provedeny s několika nadějnými inhibitory (sotatercept, luspatercept, galunisertib a vactosertib) signální dráhy TGF-β u LR-MDS.
Sotatercept
Sotatercept (ACE-011) je rozpustný fúzní protein vytvořený z mimobuněčné domény receptoru typu II pro aktivin (ActRIIA) stabilizované vazbou k Fc oblasti lidského IgG 1. Sotatercept vychytává ligandy ActRIIA, hlavně GDF 11 a activin B (obr. 3). Inhibice GDF 11 vede k rychlému odstranění bloku pozdních stadií erytroidní diferenciace a brání neefektivní erytropoéze, mírní anémii a přetížení železem.
Obr. 3. Mechanismus působení sotaterceptu (ACE-011) na hematopoetickou progenitorovou buňku a erytroidní progenitorovou buňku diferencující na erytrocyty inhibicí signální dráhy GDF 11 a aktivinu B ve stromální buňce mikroprostředí (niche)
Sotatercept zvyšuje expresi angiotensinu II a IGFBP 2 ve stromálních buňkách kostní dřeně a stimuluje erytroidní progenitorové buňky. Naopak, sotatercept snižuje expresi VEGF, onkostatinu M, BMP 2 a IL-6. VEGF je inhibitorem erytroidní diferenciace. IGFB – vazebný protein pro insulinový růstový faktor; VEGF – vaskulární endoteliální růstový faktor; onkostatin M (OSM) – cytokin z rodiny IL-6 s četnými funkcemi (hematopoéza, zánět, nervový systém), BMP – kostní morfogenetické proteiny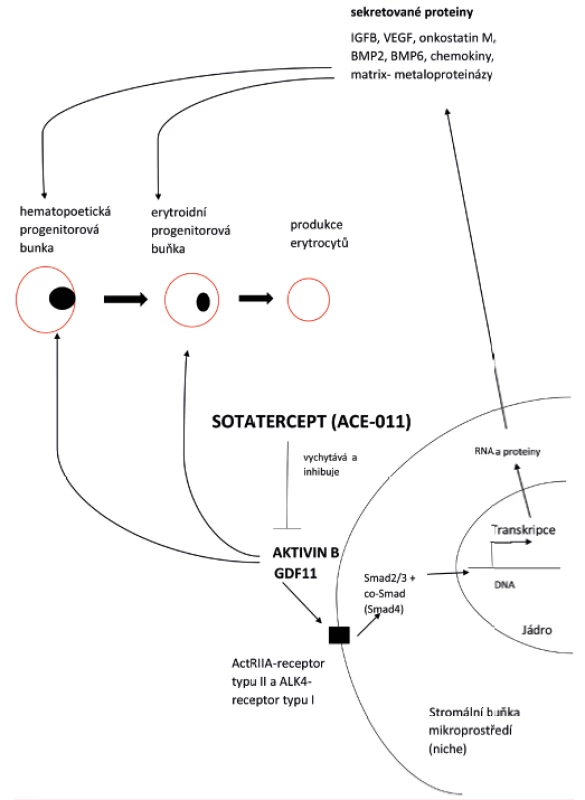
Sotatercept byl proto nejprve použit u žen po menopauze léčených na osteoporózu (studie fáze I, NCT0070709540) a již zde stimuloval erytropoézu, zvýšil hematokrit a hladinu hemoglobinu [43].
Studie fáze II (NCT01736683), registrovaná v Evropě pod číslem 2012-002601-22, byla provedena v 11 centrech USA a Francie na LR-MDS (nízké riziko a střední riziko 1 podle IPSS) s anémií vyžadující transfuze červených krvinek a nereagující na ESA [44]. Pacienti s del(5q) MDS nebyli do studie zahrnuti. Tito pacienti byli zahrnuti do této studie jen v případě, když bylo jasně prokázáno jejich selhání na terapii lenalidomidem. Hematologické zlepšení (erytroidní) a zmírnění či odstranění anémie bylo pozorováno u skoro poloviny (49 %) ze 74 ve studii sledovaných pacientů. Nezávislosti na transfuzích erytrocytů nejméně po dobu 8 týdnů bylo dosaženo u 27 % pacientů. Nejlepší výsledky byly získány u skupiny pacientů s více než 15 % prstenčitých sideroblastů (69 % pacientů v této studii). Zde bylo dosaženo erytroidního zlepšení u 59 % pacientů ve srovnání s pacienty s méně než 15 % prstenčitých sideroblastů, kde bylo dosaženo erytroidní zlepšení jen u 15 % pacientů.
Sotatercept také zmírnil anémii ve studii (NCT01571635) pacientů s β-thalasemií, jak transfuzně závislých, tak i bez potřeby transfuzí [45]. Sotatercept byl také studován u anémie vyvolané chemoterapií a u myelofibrózy [46].
Luspatercept
Luspatercept (ACE-536) je rekombinantní fúzní protein vytvořený z mimobuněčné domény receptoru typu II pro aktivin (ActRIIB) stabilizované vazbou k Fc oblasti lidského IgG 1. Mimobuněčná oblast ActRIIB byla specificky modifikována záměnou jedné aminokyseliny (L79D), odnětím čtyř aminokyselin na N-konci a tří aminokyselin na C-konci [32]. Účinek luspaterceptu je znázorněn na obrázku 4.
Obr. 4. Mechanismus působení luspaterceptu (ACE-536) na signální dráhu GDF-11 a erytroidní diferenciaci
Luspatercept váže GDF11 s větší specificitou než sotatercept a naopak slabě váže aktivin. CFU-E – “colony forming unit-erythroid” – nezralá krevní kmenová buňka předurčená k vývoji červené krvinky; BFU-E – “burst forming unit-erythroid” – velmi časná fáze vývoje červené krvinky; ProE – proerytroblast; BasoE – basofilní erytroblast; PolyE – polychromatofilní erytroblast; OrthoE – ortochromatický erytroblast; Retik – retikulocyt; Eryt – erytrocyt.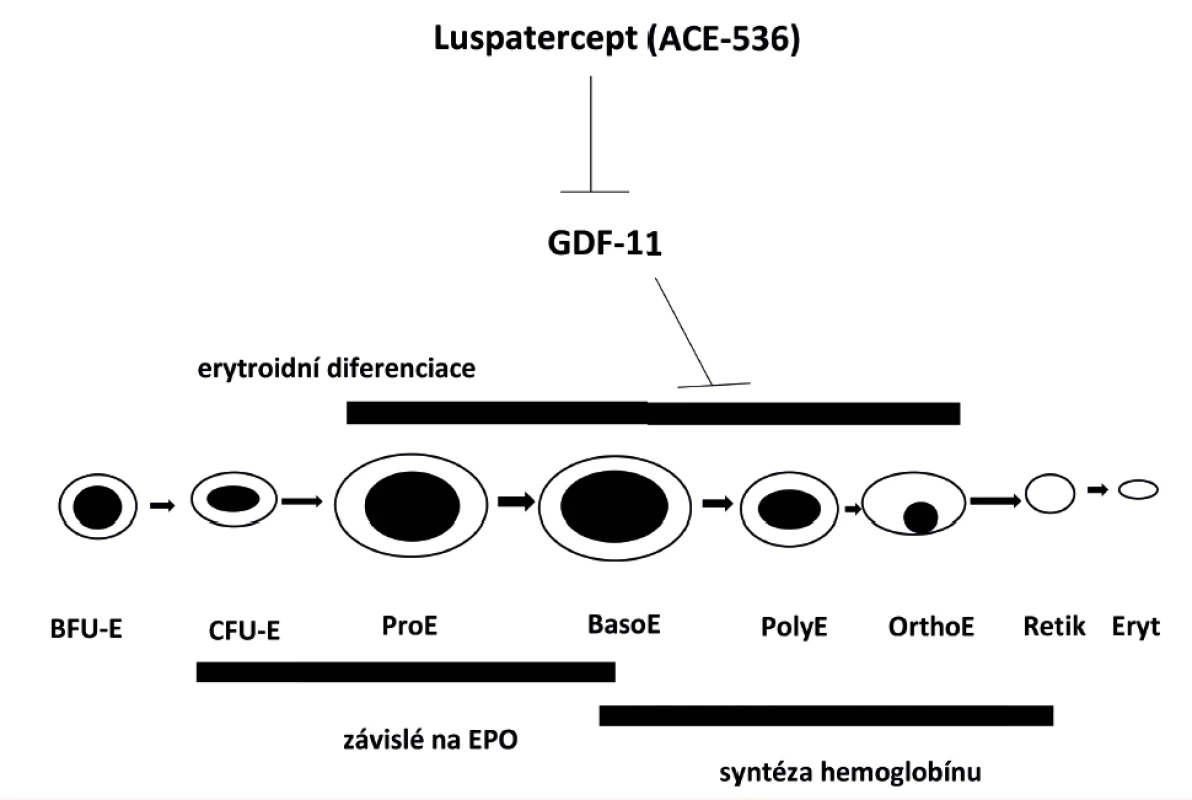
Studie fáze I zkoumala účinek luspaterceptu u zdravých žen po menopauze a ukázala vzestup hladin hemoglobinu, který započal 7 dní po zahájení terapie a trval několik týdnů [47].
Klinická studie fáze II byla zaměřena na bezpečnost a účinnost luspaterceptu u anemických pacientů s LR-MDS (NCT1749514 a NCT02268383) [35]. Studie byla provedena v devíti centrech v Německu na 58 anemických pacientech s LR-MDS. Luspatercept byl aplikován pacientům podkožními injekcemi každé 3 týdny v pěti cyklech a v dávce buď 0,125–0,5 mg/kg, nebo 0,75–1,75 mg/kg). Pacienti byli před začátkem terapie silně závislí na transfuzích (více než 4 jednotky erytrocytů během osmi týdnů) nebo méně závislí (méně než 4 jednotky erytrocytů během osmi týdnů). Pacienti byli dále děleni podle zastoupení prstenčitých sideroblastů a podle prokázané mutace v genu SF3B1 nebo její nepřítomnosti. Erytroidní zlepšení bylo pozorováno u 63 % pacientů z těch, co obdrželi vyšší dávkou luspaterceptu a u 22 % s nižší dávkou. Erytroidní zlepšení bylo definováno jako souvislá odpověď během 8 týdnů se sníženou potřebou požadovaných jednotek erytrocytů pro transfuze nejméně o 4 jednotky nebo vzrůstem hladiny hemoglobinu nejméně o 15 g/l během 8 týdnů podávání luspaterceptu. Podobné erytroidní zlepšení dosáhli pacienti bez rozdílu, zda podstoupili předchozí terapií pomocí ESA, nebo ji neabsolvovali. Lépe na terapii odpovídali pacienti s nižší koncentrací erytropoetinu před podáním luspaterceptu. Erytroidního zlepšení bylo dosaženo u 76 % pacientů s koncentrací erytropoetinu pod 200 IU/l, 58 % s 200–500 IU/l a 43 % s více než 500 IU/l. Více pacientů s prstenčitými sideroblasty dosáhlo erytroidního zlepšení (69 %) ve srovnání s 43 % pacientů bez prstenčitých sideroblastů. Pacienti s prokázanou mutací v genu SF3B1 a současně s prstenčitými sideroblasty a dysplazií v jedné řadě (MDS-RS-SLD) nejlépe odpovídali na terapii luspaterceptem. Luspatercept byl pacienty dobře tolerován. Komplikace stupně 3 (svalová bolest u jednoho pacienta a vzrůst počtu blastů spojený s progresí onemocnění u jiného pacienta) se vyskytly jen u dvou z 58 pacientů léčených luspaterceptem v této studii. Úplnou nezávislost na transfuzích po dobu nejméně 8 týdnů dosáhlo 38 % pacientů. Tento výsledek je lepší než použití lenalidomidu ve studiích s LR-MDS bez del(5q), kde se dosáhlo transfuzní nezávislosti jen u 20–30 % pacientů [19–21].
Luspatercept je účinnější než sotatercept, protože váže GDF11 s větší specificitou v porovnání s aktivinem. Účinek luspaterceptu byl proto dále studován u pacientů s LR-MDS. Klinická tudie fáze III (MEDALIST) u 229 transfuzně závislých MDS-RS. Tito pacienti měli různě vysokou hladinu erytropoetinu v séru (138 pacientů mělo méně než 200 IU/l, 58 pacientů mělo 200 až 500 IU/l a 32 pacientů více než 500 IU/l). Před podáním luspaterceptu bylo 218 pacientů léčeno pomocí ESA. Mutaci v genu SF3B1 mělo 206 (90 %) pacientů. Pacienti s LR-MDS obdrželi buď vyšší dávku luspaterceptu (1,0 až 1,75 mg/kg každé 3 týdny po dobu nejméně 24 týdnů; 153 pacientů) nebo placebo (76 pacientů). Ze 153 pacientů, kteří obdrželi luspatercept, 58 (37,9 %) pacientů dosáhlo nezávislosti na transfuzích po dobu nejméně 8 týdnů a 43 (28,1 %) po dobu nejméně 12 týdnů. Ze 76 pacientů na placebu dosáhlo transfuzní nezávislosti po dobu nejméně 8 týdnů jen 10 (13,2 %) pacientů a 6 (7,9 %) po dobu nejméně 12 týdnů [48].
Luspatercept zvýšil hladinu hemoglobinu u pacientů s β-thalasemií, transfuzně závislých i bez potřeby transfuzí, ve studiích (NCT01749540 a NCT02268409) [49]. Účinek luspaterceptu ve formě samotného léku nebo v kombinaci s ruxolitinibem byl studován u myelofibrózy (studie fáze II, NCT03194542) [36].
Galunisertib
Galunisertib (LY2157299 monohydrate) je nízkomolekulární látka podávaná orálně, která inhibuje aktivaci Smad 2/3 v signální dráze TGF-β a stimuluje hematopoézu u pacientů s MDS [50]. Galunisertib je selektivní inhibitor receptorů TGFBR1 (ALK5) a ACVR1B (ALK4). Krystalografická analýza ukázala, že galunisertib se váže do ATP-místa těchto receptorů a inhibuje jejich fosforylaci a aktivaci. Galunisertib ve studii fáze II (NCT02008318) u pacientů s LR-MDS měl nižší účinnost než luspatercept a sotatercept, protože jen 26 % pacientů dosáhlo erytroidního zlepšení, definovaného snížením potřeby transfuzí erytrocytů o 4 jednotky během 8 týdnů terapie galunisertibem nebo zvýšení hladiny hemoglobinu nejméně o 15 g/l během 8 týdnů podávání galunisertibu [50].
Vactosertib
Vactosertib (TEW-7197) je nízkomolekulární látka (odvozená od pyridinylimidazolu o molekulární hmotnosti 399,42) podávaná orálně, která inhibuje selektivně podobně jako galunisertib receptory TGFBR1 (ALK5) a ACVR1B (ALK4) a tím signální dráhu TGF-β. V současné době probíhá studie fáze I/II (NCT03074006) u pacientů s LR-MDS.
Podíl autorů na přípravě rukopisu
OF, RB – příprava a schválení konečné verze rukopisu
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu, zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce vznikla s podporou grantu MZČR pro koncepční rozvoj vědecké organizace číslo 00023736 (ÚHKT).
Do redakce doručeno dne 14. 5. 2019.
Přijato po recenzi dne 14. 8. 2019.
Ing. Ota Fuchs, CSc.
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: Ota.Fuchs@uhkt.cz
Zdroje
1. Montalban-Bravo G, Garcia-Manero G. Myelodysplastic syndromes: 2018 update on diagnosis, risk-stratification and management. Am J Hematol 2018;93 : 129–147.
2. Weinberg OK, Hasserjian RP. The current approach to the diagnosis of myelodysplastic syndromes. Semin Hematol 2019;56(1):15–21.
3. Zeidan AM, Shallis RM, Wang R, et al. Epidemiology of myelodysplastic syndromes: Why characterizing the beast is a prerequisite to taming it. Blood Rev 2019;34 : 1–15.
4. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision on the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016;127(20):2391–2405.
5. Nazha A. The MDS genomics-prognosis symbiosis. Hematology. American Society of Hematology. Education Program 2018;270–276.
6. Greenberg P, Cox C, LeBeau MM, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997;89(6):2079–2088.
7. Greenberg PL, Tuechler H, Schanz J, et al. Revised International prognostic scoring system for myelodysplastic syndromes. Blood 2012;120(12):2454–2465.
8. Santini V. Treatment of low-risk myelodysplastic syndromes. Hematology. American Society of Hematology. Education Program 2016;462–469.
9. Park S, Greenberg P, Yucel A, et al. Clinical effectiveness and safety of erythropoietin-stimulating agents for the treatment of low - and intermediate-1-risk myelodysplastic syndrome: a systematic literature review. Br J Haematol 2019;184(2):134–160.
10. Park S, Kelaidi C, Sapena R, et al. Early introduction of ESA in low risk MDS patients may delay the need for RBC transfusion: a retrospective analysis on 112 patients. Leuk Res 2010;34(11):1430–1436.
11. Messa E, Gioia D, Masiera E, et al. Effects of erythropoiesis-stimulating agents on overall survival of International Prognostic Scoring System low/intermediate-1 risk, transfusion-independent myelodysplastic syndrome patients: a cohort study. Haematologica 2019;104(1):e4–e8.
12. Almeida A, Fenaux P, List AF, et al. Recent advances in the treatment of lower-risk non-del(5q) myelodysplastic syndromes (MDS). Leuk Res 2017;52 : 50–57.
13. List A, Dewald G, Bennett, et al. Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion. N Engl J Med 2006;355 : 1456–1465.
14. Jonášová A, Červinek L, Bělohlávková P, et al. První české zkušenosti s lenalidomidem v terapii anemických nemocných s myelodysplastickým syndromem s delecí dlouhého ramene 5. chromozomu. Vnitř Lék 2015; 61(12):1028–1033.
15. Talati C, Sallman D, List A. Lenalidomide: myelodysplastic syndromes with del(5q) and beyond. Semin Hematol 2017;54(3):159–166.
16. Jonasova A, Neuwirtova R, Polackova H, et al. Lenalidomide treatment in lower risk myelodysplastic syndromes. The experience of a Czech hematology center. (Positive effect of erythropoietin ± prednisone addition to lenalidomide in refractory or relapsed patients). Leuk Res 2018;69 : 12–17.
17. Jädersten M, Saft L, Smith A, et al. TP53 mutations in low-risk myelodysplastic syndromes with del(5q) predict disease progression. J Clin Oncol 2011;29(15):1971–1979.
18. Saft L, Karimi M, Ghaderi M, et al. p53 protein expression independently predicts outcome in patients with lower-risk myelodysplastic syndromes with del(5q). Haematologica 2014;99(6):1041–1049.
19. Raza A, Reeves JA, Feldman EJ, et al. Phase 2 study of lenalidomide in transfusion-dependent low-risk, and intermediate-1 risk myelodysplastic syndromes with karyotypes other than deletion 5q. Blood 2008;111(1):86–93.
20. Santini V, Almeida A, Giagounidis A, et al. The effect of lenalidomide on health-related quality of life in patients with lower-risk non-del(5q) myelodysplastic syndromes: Results from the MDS-005 study. Clin Lymphoma Myeloma Leuk 2018;18(2):136–144.
21. Shallis RM, Zeidan AM. Lenalidomide in non-deletion 5q lower-risk myelodysplastic syndromes: a glass quarter full of three quarters empty? Leuk Lymphoma 2018;59(9):2015–2017.
22. Jonášová A, Neuwirtová R, Ćermák J, et al. Cyclosporin A therapy in hypoplastic MDS patients and certain refractory anemias without hypoplastic bone marrow. Br J Haematol 1998;100(2):304–309.
23. Čermák J. Myelodysplastický syndrom v roce 2016. Onkologie 2016;10(3):114–119.
24. Neukirchen J, Platzbecker U, Sockel K, et al. Real life experience with alemtuzumab treatment of patients with lower-risk MDS and a hypocellular bone marrow. Ann Hematol 2014;93(1):65–69.
25. Hattangadi SM, Wong P, Zhang L, et al. From stem cell to red cell: regulation of erythropoiesis at multiple levels by multiple proteins, RNAs, and chromatin modifications. Blood 2011;118(24):6258–6268.
26. Liang R, Ghaffari S. Advances in understanding the mechanisms of erythropoiesis in homeostasis and disease. Br J Haematol 2016;174(5):661–673.
27. Budi EH, Duan D, Derynck R. Transforming growth factor-β receptors and Smads: regulatory complexity and functional versatility. Trends Cell Biol 2017;27(9):658–672.
28. Zhao M, Perry JM, Marshall H, et al. Megakaryocytes maintain homeostatic quiescence and promote post-injury regeneration of hematopoietic stem cells. Nat Med 2014;20(11):1321–1326.
29. Krystal G, Lam V, Dragowska W, et al. Transforming growth factor beta-1 is an inducer of erythroid differentiation. J Exp Med 1994;180(3):851–860.
30. Zermati Y, Fichelson S, Valensi F, et al. Transforming growth factor inhibits erythropoiesis by blocking proliferation and accelerating differentiation of erythroid progenitors. Exp Hematol 2000;28(8):885–894.
31. Gao X, Lee HY, Lummertz da Rocha E, et al. TGF-β inhibitors stimulate red blood cell production by enhancing self-renewal of BFU-E erythroid progenitors. Blood 2016;128(23):2637–2641.
32. Suragani RNVS, Cadena SM, Cawley SM, et al. Transforming growth factor-β superfamily ligand trap ACE-536 corrects anemia by promoting late-stage erythropoiesis. Nat Med 2014;20(4):408–414.
33. Blank U, Karlsson S. TGF-β signaling in the control of hematopoietic stem cells. Blood 2015;125(23):3542–3550.
34. Mies A, Platzbecker U. Increasing the effectiveness of hematopoiesis in myelodysplastic syndromes: erythropoiesis-stimulating agents and transforming growth factor-β superfamily inhibitors. Semin Hematol 2017;54(3):141–146.
35. Platzbecker U, Germing U, Götze KS, et al. Luspatercept for the treatment of anaemia in patients with lower-risk myelodysplastic syndromes (PACE-MDS): a multicentre, open-label phase 2 dose--finding study with long-term extension study. Lancet Oncol 2017;18(10):1338–1347.
36. Fenaux P, Kiladjian JJ, Platzbecker U. Luspatercept for the treatment of anemia in myelodysplastic syndromes and primary myelofibrosis. Blood 2019;133(8):790–794.
37. Bataller A, Montalban-Bravo G, Soltysiak KA, Garcia-Manero G. The role of TGFβ in hematopoiesis and myeloid disorders. Leukemia 2019;33(5):1076–1089.
38. Bewersdorf JP, Zeidan AM. Transforming growth factor (TGF)-β pathway as a therapeutic target in lower risk myelodysplastic syndromes. Leukemia 2019;33 : 1303–1312.
39. Rochette L, Zeller M, Cottin Y, Vergely C. Growth and differentiation factor 11 (GDF11): functions in the regulation of erythropoiesis and cardiac regeneration. Pharmacol Ther 2015;156 : 26–33.
40. Zhang Y, Wei Y, Liu D, et al. Role of growth differentiation factor 11 in development, physiology and disease. Oncotarget 2017;8(46):81604–81616.
41. Jamaiyar A, Wan W, Janota DM, et al. The versatility and paradox of GDF11. Pharmacol Ther 2017;175 : 28–34.
42. Iancu-Rubin C, Mosoyan G, Wang J, et al. Stromal cell-mediated inhibition of erythropoiesis can be attenuated by sotatercept (ACE-011), an activin receptor type II ligand trap. Exp Hematol 2013;41(2):155–166.
43. Ruckle J, Jacobs M, Kramer W, et al. Single-dose, randomized, double-blind, placebo-controlled study of ACE-011 (ActRIIA-IgG1) in postmenopausal women. J Bone Miner Res 2009;24(4):744–752.
44. Komrokji R, Garcia-Manero G, Ades L, et al. Sotatercept with long-term extension for the treatment of anemia in patients with lower-risk myelodysplastic syndromes: a phase 2, dose-ranging trial. Lancet Hematol 2018;5(2):e63–e72.
45. Cappellini MD, Porter J, Origa R, et al. Sotatercept, a novel transforming growth factor β ligand trap, improves anemia in β-thalassemia: a phase II, open-label, dose-finding study. Haematologica 2019;104(3):477–484.
46. Bose P, Alfayez M, Verstovsek S. New concepts of treatment for patients with myelofibrosis. Curr Treat Options Oncol 2019;20(1):5.
47. Attie KM, Allison MJ, McClure T, et al. A phase 1 study of ACE-536, a regulator of erythroid differentiation, in healthy volunteers. Am J Hematol 2014;89(7):766–770.
48. Fenaux P, Platzbecker U, Mufti G, et al. The Medalist trial: Results of a phase 3, randomized, double-blind, placebo-controlled study of luspatercept to treat anemia in patients with very low-, low-, or intermediate-risk myelodysplastic syndromes (MDS) with ring sideroblasts (RS) who require red blood cell (RBC) transfusions. Blood 2018;132(Suppl 1):1.
49. Piga A, Perrotta S, Gamberini MR, et al. Luspatercept improves hemoglobin levels and blood transfusion requirements in a study of patients with β-thalassemia. Blood 2019;133(12):1279–1289.
50. Valcarel D, Verma A, Platzbecker U, et al. Phase 2 study of monotherapy galunisertib (LY157299 monohydrate) in very low-, low-, and intermediate-risk patients with myelodysplastic syndromes. Blood 2015;126(Suppl 1):1669.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie Praktické lékařství pro dospělé
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Úloha signální dráhy transformačního růstového faktoru β v hemopoéze a studie nových inhibitorů této dráhy pro léčbu nízkorizikového myelodysplastického syndromu
- Denosumab a bisfosfonáty u mnohočetného myelomu v roce 2019
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Odběry kostní dřeně pro alogenní transplantaci – zhodnocení desetileté zkušenosti se zaměřením na využití autotransfuzí u dárců
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



