-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hluboká žilní trombóza a plicní embolie v těhotenství
Deep vein thrombosis and pulmonary embolism in pregnancy
Pulmonary embolism (PE) is the leading cause of maternal mortality in the developed world. During gravidity the incidence of deep vein thrombosis (DVT) is five to seven times higher and can be increased by other risk factors. Despite concerns for foetal teratogenicity and oncogenicity and maternal risks associated with diagnostic testing, and potential adverse effects of pharmacological treatment, an accurate diagnosis of pulmonary embolism and a timely therapeutic intervention are crucial. Compression ultrasonography is a non-invasive test with high sensitivity for the diagnosis of symptomatic deep vein thrombosis. For the diagnosis of pulmonary embolism, D-Dimer testing has only limited diagnostic value in gravidity. V/Q scans are generally preferred because of lower radiation dose to the mother, on the other hand, CT pulmonary angiography is the first-line test to detect PE in the haemodynamically unstable pregnant women. Low-molecular-weight heparin is currently the therapy of choice for venous thromboembolism. Thrombolysis is reserved for massive life-threatening pulmonary embolism with haemodynamic compromise. The peripartum management of pulmonary embolism in pregnant women is always a great challenge for the multidisciplinary team. When venous thromboembolism (VTE) is diagnosed near term, consideration should be given to the placement of a retrievable inferior vena cava (IVC) filter. Reversal of anticoagulation without IVC filter protection is strongly discouraged in the 2-week period after VTE diagnosis. If the therapy of pulmonary embolism is started earlier, planned delivery with induction of labour or Caesarean Section at term with short-term discontinuation of low-molecular-weight heparin minimizes the risk of bleeding and permits neuroaxial anaesthesia / analgesia.
Keywords:
pregnancy – venous thromboembolism – diagnosis - treatment – peripartum management
Autoři: J. Mannová 1; M. Penka 2; P. Štourač 3
Působiště autorů: Anesteziologicko resuscitační oddělení, Nemocnice Havlíčkův Brod 1; Oddělení klinické hematologie, Fakultní nemocnice Brno, Lékařská fakulta Masarykovy univerzity, Brno 1,2; Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno, Lékařská fakulta Masarykovy univerzity, Brno 3
Vyšlo v časopise: Anest. intenziv. Med., 28, 2017, č. 2, s. 93-100
Kategorie: Anestezie v gynekologii a porodnictví - Přehledový článek
Plicní embolie je v současnosti ve vyspělých zemích nejčastější příčinou mateřské mortality. Během gravidity je samotné riziko hluboké žilní trombózy zvýšeno 5–7krát a narůstá v případě přítomnosti dalších rizikových faktorů. V těhotenství při volbě diagnostických a terapeutických postupů je důležité jejich správné a včasné zahájení, i když jsou vždy zvažována i rizika pro matku a plod. V diagnostice hluboké žilní trombózy se uplatňuje žilní ultrazvukové vyšetření, které má dobrou výpovědní hodnotu. V rámci diagnostiky plicní embolie vyšetření D-dimerů má jen limitovanou výpovědní hodnotu. CT plicní angiografie je preferovanou metodou u hemodynamicky nestabilní pacientky, u ostatních těhotných žen bývá upřednostňována ventilačně perfuzní scintigrafie z důvodu nižšího rizika pro matku. V terapii žilní trombembolické nemoci jsou indikovány přednostně nízkomolekulární hepariny. Trombolýza, jakožto terapie s vyššími riziky, je určena pro léčbu masivní plicní embolie (PE) s hemodynamickou nestabilitou.
Souhrn
Plicní embolie je v současnosti ve vyspělých zemích nejčastější příčinou mateřské mortality. Během gravidity je samotné riziko hluboké žilní trombózy zvýšeno 5–7krát a narůstá v případě přítomnosti dalších rizikových faktorů. V těhotenství při volbě diagnostických a terapeutických postupů je důležité jejich správné a včasné zahájení, i když jsou vždy zvažována i rizika pro matku a plod. V diagnostice hluboké žilní trombózy se uplatňuje žilní ultrazvukové vyšetření, které má dobrou výpovědní hodnotu. V rámci diagnostiky plicní embolie vyšetření D-dimerů má jen limitovanou výpovědní hodnotu. CT plicní angiografie je preferovanou metodou u hemodynamicky nestabilní pacientky, u ostatních těhotných žen bývá upřednostňována ventilačně perfuzní scintigrafie z důvodu nižšího rizika pro matku. V terapii žilní trombembolické nemoci jsou indikovány přednostně nízkomolekulární hepariny. Trombolýza, jakožto terapie s vyššími riziky, je určena pro léčbu masivní plicní embolie (PE) s hemodynamickou nestabilitou. Peripartální management u žen s terapií plicní embolie je vždy výzvou a multioborovou záležitostí. Pokud je plicní embolie diagnostikována krátce před porodem, mělo by se zvážit zavedení kaválního filtru. Pokud zaveden není, přerušení antikoagulační terapie se zásadně nedoporučuje během prvních dvou týdnů od PE. U ostatních těhotných žen s terapií LMWH se zdá být racionálním opatřením plánovaný porod (indukce nebo císařský řez) a krátkodobé přerušení podávání LMWH snižující riziko krvácení během porodu a zároveň umožňující volbu anestezie a analgezie.
Klíčová slova:
těhotenství – trombembolická nemoc – diagnostika – léčba – peripartální managementÚVOD
Za nejčastější příčinu úmrtí rodiček ve vyspělých zemích jsou považovány těhotenské komplikace – krvácení, infekce a eklampsie, ale v současnosti se na první místo příčin mateřské mortality dostala plicní embolie [1–3]. Pravděpodobně to více souvisí se zdokonalením terapeutických postupů řešení těhotenských komplikací a lepší diagnostikou než s nárůstem incidence hluboké žilní trombózy a s ní související plicní embolie (PE) [1–3]. Počet případů hluboké žilní trombózy v těhotenství je udáván jako jeden až dva případy na 1 000 těhotenství a v případě neléčené hluboké žilní trombózy je 15–24 % případů komplikováno plicní embolií [2]. Plicní embolie následně může být fatální asi u 15 % pacientek a u 66 % z nich dochází k úmrtí během prvních 30 minut od embolické komplikace [2]. Tato data svědčí o závažnosti plicní embolie jako smrtelné komplikace v těhotenství, a proto včasná diagnostika a terapie hluboké žilní trombózy a plicní embolie nesmí být podceňována. Lékař musí správně indikovat diagnostické a terapeutické postupy, a činit tak se zvážením jejich benefitů a rizik, které přinášejí pro matku i plod.
DIAGNOSTIKA HLUBOKÉ ŽILNÍ TROMBÓZY (HŽT) V TĚHOTENSTVÍ
Klinická diagnóza
Během gravidity je třeba počítat s tím, že samotné riziko hluboké žilní trombózy je zvýšeno (5–7krát) pro navozený prokoagulační stav (stoupá koagulační a klesá fibrinolytická aktivita), zpomalený průtok žilním řečištěm a po porodu ještě následkem endoteliálního poranění cév [1–5]. I když období před porodem a po něm je považováno za nejvíce rizikové pro hlubokou žilní trombózu, současné studie ukazují, že 16–33 % případů žilního tromboembolismu (VTE) je diagnostikováno v prvním trimestru [2]. Vlastní diagnostika hluboké žilní trombózy je v těhotenství ztížena. Je to dáno tím, že některé příznaky svědčící pro klinické podezření na hlubokou žilní trombózu (otok končetiny, bolest končetiny) se vyskytují u těhotných žen i bez souvislosti s VTE, a tak mohou být přehlédnuty nebo podceněny s tím, že jsou dávány do souvislosti s fyziologickou graviditou či jinými těhotenskými komplikacemi (preeklampsie).
Na míru pravděpodobnosti hluboké žilní trombózy u gravidních žen lze usuzovat nejen z klinické symptomatologie, ale i z přítomnosti či nepřítomnosti jednoho nebo více rizikových faktorů v anamnéze ženy. Anamnestické údaje mohou významně přispět k podezření na hlubokou žilní trombózu, zvláště u žen, které již měly v minulosti trombotickou komplikaci, mají pozitivní rodinnou anamnézu, zjištěnou trombofilní poruchu, jsou vyššího věku nebo mají vysoký BMI (tab. 1) [1, 4]. Na vyšší riziko VTE je třeba myslet i u žen, u nichž se objevily těhotenské komplikace (zvracení, preeklampsie, HELLP syndrom, růstová retardace plodu, opakované aborty) a porod byl komplikovaný, nebo bylo třeba provést ukončení těhotenství císařským řezem [1, 4–13].
Tab. 1. Rizikové faktory hluboké žilní trombózy 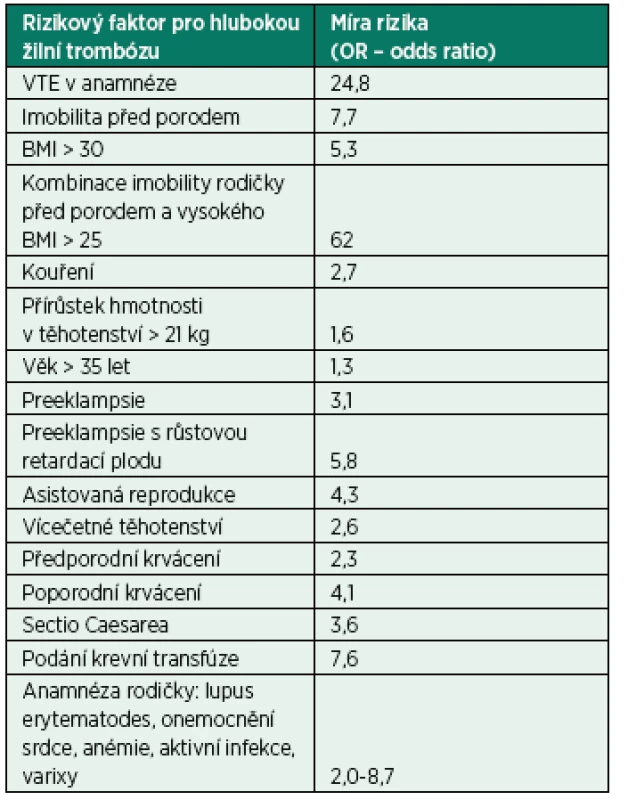
VTE – žilní tromboembolismus, BMI – body mass index (podle [4]) Klinická diagnóza vychází z příznaků jednostranné bolesti dolní končetiny, otoku končetiny, tachypnoe, dyspnoe, bolesti na hrudi, hemoptýzy a v případě postižení pánevních tepen se může objevit bolest břicha. Nápomocna pro včasnou diagnostiku může být i lokalizace klinických příznaků. U těhotných žen je hluboká žilní trombóza častěji lokalizována na levé noze (85 % trombóz je u gravidních žen na levé noze ve srovnání s 55 % trombóz na levé noze u netěhotných žen) [1]. Postižení levé dolní končetiny souvisí s kompresí žil zvětšenou dělohou a útlakem levé ilické žíly pravou ilickou arterií v těhotenství. Mnohem častěji se rovněž VTE vyskytuje u těhotných žen v proximálnější lokalizaci. U 72 % těhotných je trombóza diagnostikována na úrovni ileofemorální žíly oproti 9 % výskytu ileofemorálních trombóz u netěhotných žen [1]. Rovněž je v těhotenství vyšší riziko plicní embolie a rozvoje posttrombotického syndromu [1].
Diagnostiku HŽT při objevení příznaků je třeba zahájit okamžitě i s vědomím, že tyto příznaky se mohou vyskytovat během gravidity bez souvislosti s žilní trombózou. I když je hluboká žilní trombóza následně potvrzena jen asi u 10 % žen s podezřením na VTE, vyšetření je nutné provést, protože v případě pozitivního nálezu je třeba neprodleně zahájit terapii [1].
Zobrazovací metody
Diagnostika HŽT má být vždy prováděna s ohledem na těhotenství. Prvním krokem je vyšetření hlubokého žilního systému dolní končetiny komplexním ultrazvukovým vyšetřením (UZ) s dobrou výpovědní hodnotou. U žen s negativním UZ vyšetřením mělo pouze 1,1 % následně potvrzenou hlubokou žilní trombózu [1]. V prospektivní kohortové studii, kde bylo vyšetřeno 200 žen s podezřením na VTE, kompresivní duplexní ultrasonografie měla negativní prediktivní hodnotu 99,5 % [14]. U žen s negativním UZ vyšetřením, u kterých ale přetrvává vysoké podezření na VTE, je doporučeno zopakování UZ vyšetření 3. a 7. den [4, 15].
V případě série ultrazvukových vyšetření (0., 3. a 7. den), která jsou negativní v kombinaci s normálními hodnotami D-dimerů a nízkým klinickým rizikem, může být hluboká žilní trombóza vyloučena [15].
DIAGNOSTIKA PLICNÍ EMBOLIE V TĚHOTENSTVÍ
Při podezření na plicní embolii se u pacientek při stanovení diagnózy může využít určení klinické pravděpodobnosti plicní embolie za použití různých skórovacích systémů (skóre podle Wellse, revidované Geneva skóre – RGS, PE severity index). Tyto skórovací systémy vycházejí z demografických údajů, přidružených onemocnění pacienta a klinických známek (puls, systolický tlak, dechová frekvence, tělesná teplota, alterace vědomí, saturace). Ovšem v těhotenství je možnost jejich využití malá a žádný z těchto skórovacích systémů nebyl shledán u gravidních žen jednoznačně efektivní [3].
Z ostatních neradiodiagnostických metod bývá indikováno EKG a laboratorní vyšetření, přičemž obě tyto metody mají limitovanou výpovědní hodnotu [3]. Stejně jako vyšetření D-dimerů používané v diagnostice PE má v těhotenství jen malou využitelnost. Hladina D-dimerů u těhotných progresivně stoupá a je zvýšená ve většině nekomplikovaných těhotenství, navíc narůstá u komplikací souvisejících s těhotenstvím. Přesto v ESC guidelines pro management kardiovaskulárních onemocnění v těhotenství a rovněž v ESC guidelines pro diagnózu a management akutní plicní embolie je jejich stanovení zvažováno i u těhotných pacientek s možností využití jejich negativní hodnoty k vyloučení diagnózy plicní embolie [15]. V této souvislosti se ale upozorňuje na nutnost stanovení jiných cut-off hladin v případě těhotných žen, protože hodnota D-dimerů stoupá přibližně o 39 % v každém trimestru těhotenství ve srovnání s předchozí hodnotou [15]. Někteří autoři proto navrhují jiné dolní hraniční hodnoty D-dimerů v těhotenství s ohledem na trimestr gravidity (750 ng/ml 1. trimestr, 1000 ng/ml 2. trimestr a 1250 ng/ml pro 3. trimestr, přičemž jako standardní cut-off hladiny jsou brány 500 ng/ml) [17]. Jiní autoři vyšetření D-dimerů v těhotenství shledávají kontroverzním [1, 2, 4, 16].
Dále je možno provést laboratorní vyšetření markerů myokardiálního poškození a přetížení (troponin T a I, BNP a NT-proBNP) a krevních plynů, i když hlavní v diagnostice PE jsou zobrazovací metody [3, 17].
Zobrazovací metody
Při indikování diagnostické metody pro podezření na plicní embolii je vždy pečlivě zvažována nejen její samotná indikace, ale i volba zobrazovací metody s ohledem na možný teratogenní a onkogenní účinek rentgenového záření. Na základě současných údajů je zatížení 0,1 Gy bráno jako hranice, od které již hrozí vývojové abnormality plodu. U onkogenního účinku rentgenového záření není přesná dávka záření stanovena, riziko onkogenního účinku je nutno zvažovat vždy při každém vystavení plodu záření. Například při vystavení plodu intenzitě záření 0,01 Gy nad normální hranicí se zvyšuje pravděpodobnost malignity před 20. rokem věku z 0,03 % na 0,04 % [3].
Pokud se tedy kalkuluje zatížení plodu při RTG vyšetření hrudníku matky, ventilačně perfuzním scanu a CT plicní angiografii, je celková expozice záření přibližně podle nastavení přístrojů 0,004 Gy, tedy velmi nízká [3]. Je však třeba brát v úvahu i riziko pro těhotnou ženu a zvýšení rizika karcinomu prsu. Na druhou stranu ale oproti těmto rizikům pro matku a plod stojí riziko mortality spojené s neléčenou plicní embolií, které daleko převyšuje potenciální onkogenní a teratogenní riziko rentgenového záření.
Ze zobrazovacích metod je proto k průkazu PE indikována buď ventilačně perfuzní scintigrafie (V/Q scan), nebo CT plicní angiografie (CTPA) – obrázek 1, přičemž obě tyto metody nabízejí rodičce a plodu určité výhody a na druhou stranu i nevýhody [3, 15, 16].
Obr. 1. Diagnostika plicní embolie v těhotenství u hemodynamicky stabilní pacientky PE – plicní embolie, HŽT – hluboká žilní trombóza 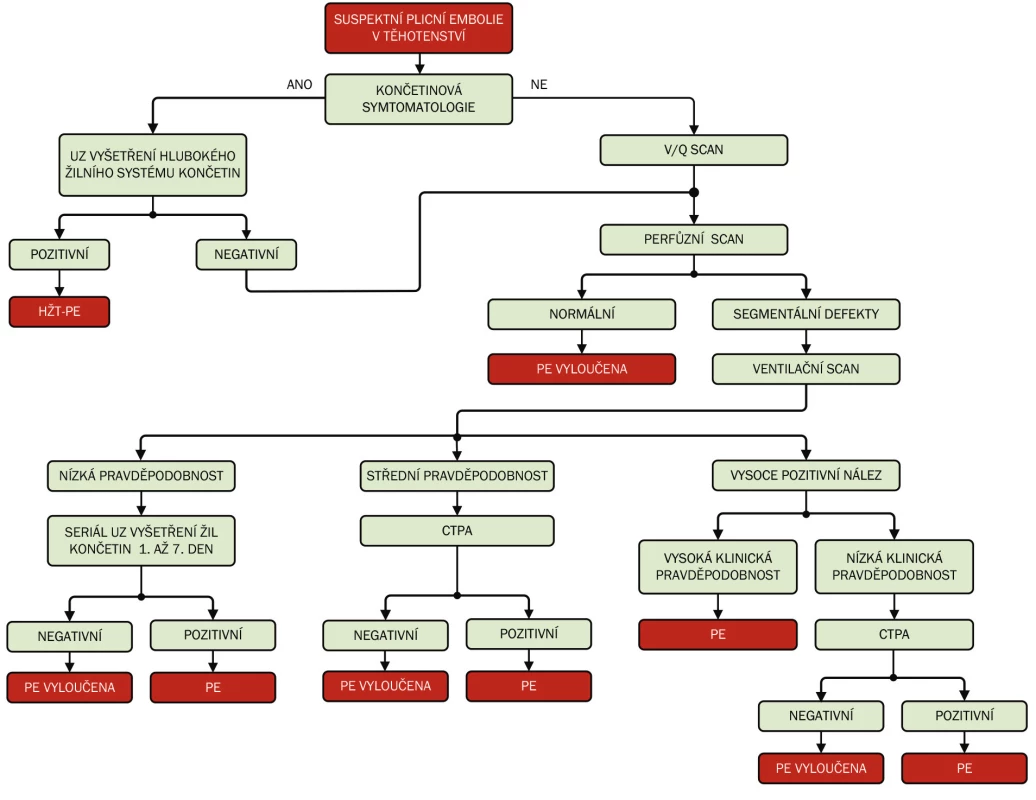
PE – plicní embolie, HŽT – hluboká žilní trombóza U hemodynamicky stabilních těhotných žen bývá častěji upřednostňován při diagnostice plicní embolie ventilačně perfuzní plicní scan (V/Q scan) před CT plicní angiografií. Ventilačně perfuzní scintigrafie má vysoce negativní predikční hodnotu, ale často se vyskytují falešně pozitivní výsledky. Výpovědní hodnota u pozitivního výsledku perfuzního scanu je u běžné populace závislá na posouzení klinické pravděpodobnosti PE. V případě pozitivního výsledku scanu při současně vysoké klinické pravděpodobnosti plicní embolie je výpovědní hodnota scanu kolem 96 %, ale jen 56 % při nízké klinické pravděpodobnosti [3]. Navíc u těhotných žen je pozitivní prediktivní hodnota výsledku ještě nižší než u ostatní části populace. Na druhou stranu při vyšetření těhotných žen pro podezření na PE normální nález na ventilačně perfuzním scanu mívá asi 70 % těhotných, což činí toto vyšetření užitečným [3]. Výhodou ventilačně perfuzního scanu může být i to, že ventilační část V/Q scanu může být někdy vynechána s cílem minimalizovat zatížení plodu. Při indikaci V/Q scintigrafie je třeba ale počítat s tím, že u 21 % žen jsou výsledky scanu obtížně interpretovatelné a vyžadují další vyšetření [3].
Druhá metoda CT – plicní angiografie (CTPA) – je metoda s vysokou senzitivitou i specificitou. Další její nespornou výhodou je i případné vyloučení jiných diagnóz, jako např. disekce aorty. Tato metoda je v první linii v diagnostice plicní embolie u netěhotných žen, u těhotných je její indikace více zvažována. U stabilní pacientky bývá indikována zejména až v případě abnormálního nálezu na RTG hrudníku nebo nejednoznačného nálezu při provedení ventilačně perfuzního scanu. Studie srovnávající CT angiografii s ventilačně perfuzním scanem pro diagnostiku plicní embolie u gravidních žen prokázaly stejnou negativně predikční výpovědní hodnotu obou vyšetření, tedy vyloučení plicní embolie na 99–100 % [1]. Při srovnání CTPA a ventilačně perfuzní scintigrafie z hlediska správného stanovení diagnózy PE se za úspěšnější metodu považuje CTPA. V randomizované studii u netěhotných pacientek byla pomocí CTPA diagnostikována PE u o 5 % pacientů více než při použití ventilačně perfuzního scanu [3]. Co však je třeba brát v úvahu při srovnání obou metod u gravidních žen, je podstatný rozdíl v dávce rentgenového záření, kterou je zasažena tkáň prsou matky a která je až 150krát vyšší v případě CT plicní angiografie oproti ventilačně perfuzní scintigrafii [3]. Na základě modelů tato dávka může být spojena s mírným zvýšením rizika karcinomu prsou, avšak použití štítu ke krytí prsou ženy tuto radiační dávku při CT vyšetření redukuje o více než 40 % [3].
Při srovnání obou metod je riziko zatížení plodu při vyšetřování matky, ať již provedením ventilačně perfuzního scanu nebo CTPA, velmi malé. Při RTG vyšetření hrudníku matky je dávka záření pro plod v jakémkoli gestačním věku zanedbatelná. Dávka záření pro plod při CTPA je srovnatelná s dávkou při vyšetření pomocí ventilačně perfuzního scanu; obě tyto dávky jsou velmi nízké, pod hranicí teratogenního účinku. Na druhou stranu, jak již bylo uvedeno, se liší v riziku pro matku. Přesto CT plicní angiografie nadále zůstává preferovanou metodou u hemodynamicky nestabilní těhotné pacientky, protože toto vyšetření může rychleji vést k zahájení terapeutických opatření a rovněž vyloučit i jiné závažné diagnózy.
Někteří autoři zastávají stanovisko, že u žen s podezřením na plicní embolii je vhodné zvážit UZ kompresivní vyšetření hlubokého žilního systému ještě před indikováním ventilačně perfuzního scanu nebo CT plicní angiografie. Vycházejí ze stanoviska, že pokud je hluboká žilní trombóza na UZ potvrzena, další radiologické vyšetření není třeba k potvrzení plicní embolie [4]. Avšak je třeba mít na paměti, že negativní výsledek ultrazvukového vyšetření končetin nevylučuje diagnózu plicní embolie a v další diagnostice je třeba pokračovat.
Echokardiografie představuje důležitou metodou v diagnostice PE u pacientek v závažném šokovém stavu, kdy není možný transport a provedení urgentní CTPA. V tomto případě je vhodné provedení bedside transtorakální echokardioagrafie a v případě echokardiografických známek akutního pravostranného srdečního přetížení svědčících pro plicní embolii je tato diagnostika dostatečná k podání trombolýzy [15, 16].
Pokud jde o vyšetření magnetickou rezonancí, není zatím jednoznačně určeno její místo v diagnostice plicní embolie u těhotných žen. Magnetická rezonance, která pravděpodobně nepředstavuje riziko pro plod, má vysokou senzitivitu a specificitu pro diagnostiku trombózy ilických žil a v této indikaci může být v diagnostice přínosem [2].
Terapie hluboké žilní trombózy a plicní embolie u těhotné ženy (obr. 2)
Obr. 2. Terapie plicní embolie v těhotenství 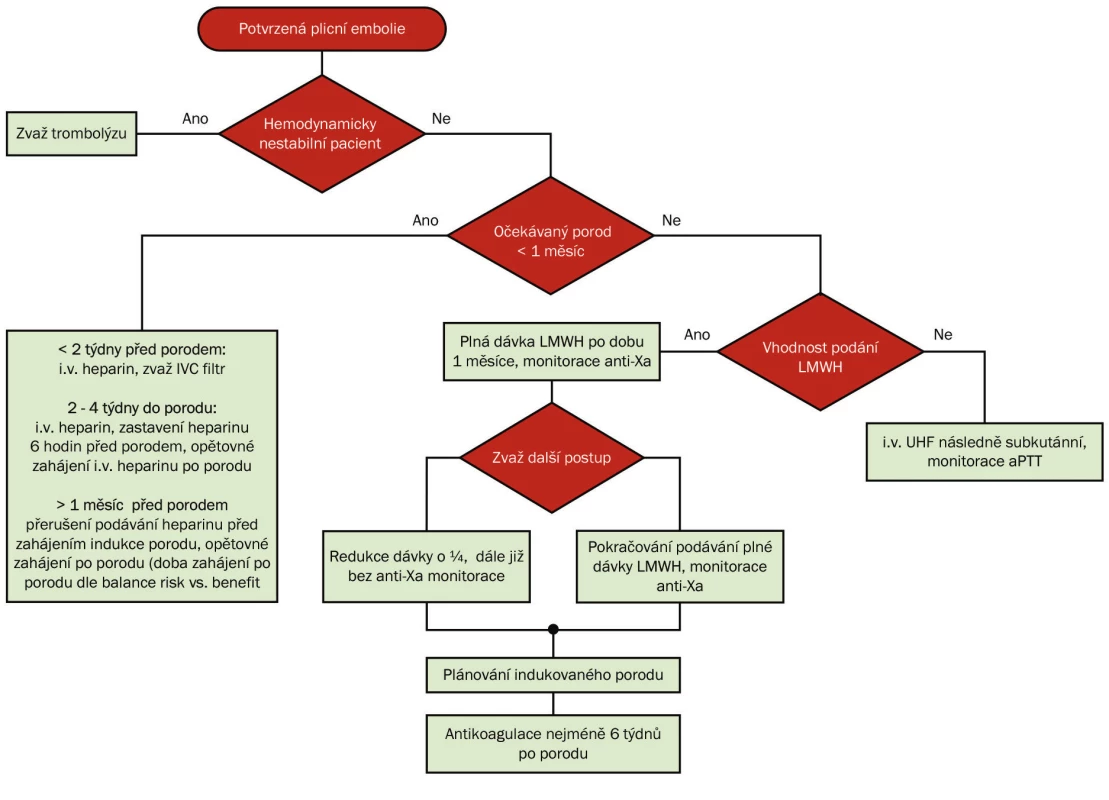
V léčbě TEN u těhotných je indikováno podání heparinu. Nefrakcionovaný heparin (UHF) stejně jako nízkomolekulární hepariny (LMWH) nepřechází přes placentu, ani nevstupují do mateřského mléka. Na rozdíl od antagonistů vitaminu K – warfarinu, který přechází přes placentu a je spojen s rizikem embryopatie, potratu a s možným krvácením plodu. Na druhou stranu warfarin minimálně přechází do mateřského mléka, proto jeho užití po porodu u kojících matek je možné.
Nízkomolekulární hepariny (LMWH) jsou široce a přednostně užívané před nefrakcionovaným heparinem při léčbě trombembolických komplikací v těhotenství. Dostupná data ze studií u běžné populace v kombinaci s výsledky observačních studií u těhotných žen ukazují na to, že podávání LMWH v těhotenství se považuje za účinné i bezpečné [1, 18–22, 23]. Je spojeno s nižším rizikem heparinem indukované trombocytopenie, osteoporózy a s minimálním rizikem krvácení [1, 18–20].
Nejčastěji používané jsou enoxaparin (Clexane) v dávce 1,5 mg/kg 1krát denně nebo 1 mg/kg 2krát denně, tinzaprin 175 IU/kg 1krát denně a dalteparin (Fragmin) v dávce 200 IU/kg 1krát denně nebo 100 IU/kg 2krát denně [1], který ale není v současnosti v ČR k dispozici. Rutinní monitorace anti Xa hladin je doporučována v úvodu terapie, dále již není nutná, opatrnost je na místě u pacientů s renální insuficiencí [1].
Při volbě dávkovacího schématu, je možné podání LMWH jedenkrát nebo dvakrát denně, většinou se začíná s dávkováním dvakrát denně, následně pro větší komfort pacientky se častěji přechází na podávání jedenkrát denně. Nebylo zjištěno, že některý způsob podávání by byl výhodnější, zdá se, že obě podání mají stejnou efektivitu i bezpečnost [1, 18–20]. Pro minimalizaci rizika neuroaxiálních blokád při indikaci plánovaného císařského řezu je třeba dávkovací schéma upravit tak, aby provedení neuroaxiální blokády u rodičky bylo bezpečné.
Podávání antikoagulace po porodu by mělo pokračovat ještě 6 týdnů, ať již podání LMWH nebo kumarinů. Po akutní epizodě VTE u těhotných žen se podává LMWH v plné dávce po dobu 1 měsíce, následně se dávka může redukovat.
Pokud jde o podání fondaparinu u těhotných žen, data jsou limitovaná na jednotlivé série případů popisujících jeho podání gravidním ženám, a to zejména v případě heparinem indukované trombocytopenie. Malé množství fondaparinu bylo detekováno ve fetální krvi po léčbě matky [21, 24].
Přímé inhibitory trombinu nebo inhibitoru faktoru Xa nejsou v těhotenství doporučovány. Tato farmaka přecházejí přes placentární bariéru s možnými nežádoucími účinky na plod. V literatuře je popsán případ podání rivaroxabanu těhotné pacientce léčené pro rekurentní hlubokou žilní trombózu, u které byla diagnostikována plicní embolie. Během léčby rivaroxabanem bylo zjištěno, že žena je v 19. týdnu těhotenství, poté byla terapie rivaroxabanem ukončena a nahrazena LMWH. Žena byla po celou dobu těhotenství sledována a podání rivaroxabanu bylo bez následků pro plod, pacientce se narodilo zdravé dítě ve 40. týdnu. Jedná se o unikátní kazuistiku, protože rivaroxaban je v těhotenství kontraindikován. Z testů použití rivaroxabanu u zvířat byla prokázána jeho reprodukční toxicita, která vedla ke ztrátám plodu, malformacím skeletu, srdce a cév [25].
Kompresivní elastické punčochy redukují bolest a otoky u hluboké žilní trombózy, avšak podle recentních randomizovaných studií nemají efekt v prevenci posttrombotického syndromu [26].
Trombolýza u těhotných je určena pro léčbu masivní plicní embolie s hemodynamickou nestabilitou. Pro vysoké riziko závažného krvácení, jehož výskyt po trombolýze je udáván ve 4–14 % [3], je užití této léčby u těhotné ženy vždy pečlivě zvažováno.
K dispozici jsou popisy jednotlivých kazuistik nebo sérií případů, kdy byla podána trombolýza těhotným ženám a na základě těchto případů je udáváno, že riziko krvácivých komplikací je srovnatelné pro těhotné s netěhotnými ženami [1, 16, 27]. Riziko krvácení zejména z genitálního traktu je po trombolýze kolem 8 % [15]. Mateřská mortalita se pohybuje kolem 1 %. Pokud jde o ovlivnění plodu přímo trombolýzou, streptokináza ani altepláza neprochází uteroplacentární bariérou v signifikantním množství [2].
V jednotlivých nověji popsaných kazuistikách byla podávána altepláza, podání streptokinázy nebo urokinázy je spíše starší záležitostí. V práci popisující asi 20 případů podání alteplázy (rt-PA) těhotným ženám (indikace: embolie s oběhovou nestabilitou, cévní mozková příhoda, infarkt myokardu, trombóza na arteficiálních chlopních) bylo dosaženo poměrně dobrých terapeutických výsledků se srovnatelnými riziky oproti netěhotným ženám [28]. Mortalita při podání trombolýzy u těhotných pacientek byla kolem 6,3–9,3 %, v případě podání z indikace plicní embolie kolem 6 %. Intrakraniální krvácení v souboru těchto 20 kazuistik nebylo popsáno vůbec, i když obecně se udává po trombolytické léčbě asi u 5 % pacientek s plicní embolií, nejvyšší výskyt intracerebrálního krvácení je popisován u trombolýzy pro akutní CMP (10–19 %). Riziko potratu nebo předčasného porodu je u trombolýzy kolem 6–8 %. Pokud jde o výsledky přežití plodu po trombolýze v souboru těchto 20 těhotných, 6 dětí (24 %) nepřežilo, 5 v souvislosti s trombolýzou, ale pouze u 2 dětí (8 %) byla prokázána přímá souvislost úmrtí plodu s podáním rt-PA [28].
U větších souborů 200 pacientek, kdy byla podávána ve většině případů streptokináza, podání trombolýzy vedlo ke ztrátě těhotenství u 6 % žen a u dalších 6 % k předčasnému porodu [29, 30]. Jiná souhrnná práce z poslední doby zahrnující 189 těhotných žen, jimž byla podána trombolýza, udávala velké krvácení v 2,6 % případů a nulovou mateřskou mortalitu [31, 32].
Závěrem lze říci, že trombolýza by měla být indikována u žen s plicní embolií a současnou oběhovou nestabilitou, její podání je vždy spojeno s riziky, a proto by pokaždé měl být zvážen benefit podání trombolýzy versus riziko u konkrétní těhotné pacientky a eventuálně i zváženy další možnosti terapie [28, 33]. Trombolytická léčba by neměla být podána peripartálně pro velmi vysoké riziko krvácení, i když v kritickém případě bude zvažována, ale preferovány by měly být jiné možnosti jako katetrizační nebo chirurgická léčba podle dostupnosti na pracovišti [16, 31]. V případě porodu císařským řezem je obecně trombolytická léčba kvůli riziku krvácení relativně kontraindikovaná 2 týdny po operaci, podle možností pracoviště by opět měly být preferovány jiné možnosti řešení (fragmentace trombu vodičem nebo katétry, odsátí trombu speciálními katétry, chirurgická embolektomie) [16, 31].
Pokud jde o zavedení kaválního filtru (IVC filtr), může být indikován u žen s opakovanými epizodami plicní embolie navzdory adekvátní antikoagulační léčbě nebo u žen, kde je antikoagulační léčba kontraindikována, a případně u těhotných, u kterých se objevila hluboká žilní trombóza krátce před porodem. Zavedení kaválního filtru je ale spojeno s riziky komplikací, v těhotenství ještě zvýšených, a to migrace kaválního filtru (> 20 % pacientů), zlomení filtru nebo velmi závažná perforace vena cava inferior (5 %) [22]. Proto i indikace IVC filtru musí být vždy přísně zvažována.
Peripartální management u žen se zavedenou terapií LMWH pro diagnostikovanou plicní embolii v těhotenství
Indukce porodu u všech pacientek s plnou terapeutickou antikoagulační dávkou je racionálním opatřením, které umožní zvolit vhodný management porodu a tímto způsobem i redukovat riziko krvácení během porodu při plné heparinizaci a zároveň umožňuje volbu anestezie.
V období plánovaného porodu je preferováno podávání nefrakcionovaného heparinu (UHF) z důvodu jeho předvídatelného, krátkého působení a možnosti zvrácení jeho účinku podáním protaminu sulfátu před porodem. Cílem je, aby plná antikoagulační terapie byla přerušena na minimální dobu, odpovídající době porodu, a to méně než 12 hodin u pacientek s plicní embolií, která je léčena 2–4 týdny. Podávání intravenózního UHF může být zastaveno nebo jeho účinek zrušen podáním protaminu sulfátu v případě překotného porodu. Reverze účinku nízkomolekulárních heparinů je méně modifikovatelná protaminem a lze předpokládat odeznění účinku LMWH až za 24 hod při plné terapeutické dávce a za 12 hodin v případě profylaktického podávání [3].
Pokud je plicní embolie diagnostikována krátce před porodem, mělo by být zváženo zavedení kaválního filtru a následná indukce porodu s možností přerušení heparinizace. V případě, kdy kavální filtr zaveden není, přerušení antikoagulační terapie se zásadně nedoporučuje během prvních dvou týdnů od plicní embolie kvůli vysokému riziku úmrtí při přerušení antikoagulační terapie [3].
Zahájení antikoagulační terapie bezprostředně po porodu se řídí rizikem rekurence hluboké žilní trombózy versus riziko krvácení po porodu. Intravenózní terapie heparinem by měla být zahájena co nejdříve po porodu, jakmile je dosaženo hemostázy. U pacientek s plicní embolií před více než 3 měsíci je zahájení antikoagulační terapie za více než 12 hodin po porodu považováno za bezpečné [3]. Antikoagulační terapie by měla být podávána nejméně 6 týdnů po porodu. Celková délka terapie hluboké žilní trombózy tři měsíce se považuje za dostatečnou v případě VTE spojenou s dočasnými rizikovými faktory, jako je sádrová fixace před porodem, imobilizace delší než 72 hodin nebo operace v období těhotenství. Podávání antikoagulační terapie 6 měsíců i déle by mělo být zvažováno u těhotných žen s hlubokou žilní trombózou, která byla spojena s dalšími závažnými rizikovými faktory [3].
ZÁVĚR
Klíčové body v diagnostice a terapii hluboké žilní trombózy a plicní embolie u těhotných
- Primární diagnostické techniky:
Kompresivní duplexní žilní ultrasonografie.
Ventilačně perfuzní scan.
CT plicní angiografie.
- Antikoagulační léčba:
LMWH preferenčně, UHF těsně před porodem.
Nepodávání kumarinů těhotným.
LMWH, UHF, kumariny mohou být podávány kojícím ženám.
- Délka trvání antikoagulační léčby 3–6 měsíců celkem, ale nejméně 6 týdnů po porodu.
- Monitorování destiček pro riziko heparinem indukované trombocytopenie
- doporučené u žen s UHF
- není třeba při terapii LMWH.
- Trombolýza je rezervována zejména pro masivní, život ohrožující plicní embolii s hemodynamickou nestabilitou.
- Kavální filtry je vhodné zvážit u žen s rekurentními trombózami navzdory terapeutické antikoagulační terapii, nebo u žen krátce před porodem a u rodiček, u kterých je antikoagulační terapie kontraindikována.
Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Do redakce došlo dne 21. 11. 2016.
Do tisku přijato dne 6. 1. 2017.
Adresa pro korespondenci:
MUDr. Jitka Mannová Ph.D.
e-mail: j.mann@seznam.cz
Zdroje
1. Greer IA. Pregnancy Complicated by Venous Thrombosis. N Engl J Med. 2015, 373, 540–547.
2. Stone SE, Timothy A, Morris MD. Pulmonary embolism during and after pregnancy. Crit Care Med. 2005, 33, Suppl 10.
3. Bourjeily G, Paidas M, Khalil H, et al. Pulmonary embolism in pregnancy. Lancet, 2010, 375, 500–512.
4. Greer IA. Thrombosis in pregnancy: updates in diagnosis and management, Hematology, 2012, 203–207.
5. James AH. Venous Thromboembolism in Pregnancy, Arteriocler Thromb Vasc Biol. 2009, 29, 326–331.
6. Gherman RB, Goodwin TM, Leung B, et al. Incidence, clinical characteristics, and timing of objectively diagnosed venous thromboembolism during pregnancy. Obstet Gynecol. 1999, 94, 730–734.
7. Marik PE, Plante LA. Venous Thromboembolism Disease and Pregnancy. N Engl J Med, 2008, 359, 2025–2033.
8. James AH, Tapson VF, Golddhaber SZ. Thrombosis during pregnancy and the postpartum period. Am J Obstet Gynecol. 2005, 193, 216–219.
9. Kamel H, Navi BB, Sriram N, et al. Risk of a thrombotic event after the 6-week post-partum period. N Engl J Med, 2014, 370, 1307–1315.
10. Khan KS, Wojdyla D, Say L, et al. WHO analysis of causes of maternal death: a systematic review. Lancet, 2006, 367, 1066–1074.
11. Simpson EL, Lawrenson RA, Nightingale AL et al. Venous thromboembolism in pregnancy and the puerperium: incidence and additional risk factors from a London perinatal database. Br J Obstet Gyneacol, 2001, 108, 56–60.
12. Kjellberg U, Andersson NE, Rosen S, et al. APC resistance and other haemostasis variables during pregnancy and puerperium. Thromb Haemost. 1999, 81, 527–531.
13. Clark P, Brennand J, Conkie JA, et al. Activated protein C sensitivity, protein C, protein S and coagulation in normal pregnancy. Thromb Haemost. 1998, 79, 1166–1170.
14. Chan WS, Spenecer FA, Lee AY, et al. Safety of withholding anticoagulation in pregnant women with suspected deep vein thrombosis following negative serial compression ultrasound and iliac vein imaging. CMAJ, 2013, 185:E194-E200.
15. Regitz-Zagrosek V, Blomstrom LC, Borghi C, et al. ESC Guidelines on the management of cardiovascular diseases during pregnancy. The Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J, 2011, 32, 3147–3197.
16. Konstantinides SV, Torbicki A, Angellli G, et al. ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J, 2014, 1–48.
17. Kline JA, Kabrhel Ch. Emergency Evaluation for Pulmonary Embolism, Part 2, Diagnostic Approach. J Emergency Medicine, 2015, 1–14.
18. Greer JA, Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood, 2005, 106, 401–407.
19. Romualdi E, Dentali F, Rancan E, et al. Anticoagulant therapy for venous thrombembolism during pregnancy: a systematic review and a meta-analysis of the literature. J Thromb Haemost. 2013, 11, 270–281.
20. Knol HM, Schultinge L, Veeger NJGM, et al. The risk of postpartum hemorrhage in women using high dose of low-molecular-weight heparins during pregnancy. Thromb Res, 2012, 130, 334–338.
21. Bates SM, Greer IA, Middeldorp S, et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prvention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 2012, 141 : 2, Suppl:e691S-736S.
22. Kearon C, Akl EA, Comerota AJ, et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th: American College of Chest Physicians evidence-based clinical practice guidelines. Chest, 2012, 141, 2 Suppl:e419S-e494S.
23. Dulíček P, Penka M, Binder T, et al. Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví. Doporučení pro klinickou praxi, 2006; www.thrombosis.cz.
24. Tang AW, Greer IA. A systematic review on the use of new anticoagulants in pregnancy. Obstet Med. 2013, 6, 64–71.
25. Königsbrügge O, Langer M, Hayde M, et al. Oral anticoagulation with rivaroxaban during pregnancy: a case report. Thrombosis and Haemostasis, 2014, 1, 12–15.
26. Kahn SR, Shapiro S, Wells PS, et al. Compression stockings to prevent post-thrombotic syndrome: a randomised placebo-controlled trial. Lancet, 2014, 383, 880–888.
27. te Raa GD, Ribbert LSM, Snijder RJ, et al. Treatment options in massive pulmonary embolism during pregnancy a case-report and review of literature. Thromb Res, 2009, 124, 1–5.
28. Leonhardt G, Gaul Ch, Nietsch HH, et al. Thrombolytic therapy in pregnancy. J Thromb Thrombolysis, 2006, 21, 271–276.
29. Ahearn GS, Hadjiilidas D, Gover J, et al. Massive pulmonary embolism during pregnancy successfully treated with recombinant tissue plasminogen activator: a case report and review of treatment options. Arch Intern Med. 2002, 162, 1221–1227.
30. Turrentine MA, Braems RMM. Use of thrombolytics for the treatment of thromboembolic disease during pregnancy. Obstet Gyn Surv, 1995, 50, 534–541.
31. Condliffe R, Elliot ChA, Hughes RJ, et al. Management dilemmas in acute pulmonary embolism. Review Thorax, 2013, thoraxjnl-2013-20467.
32. Gartman EJ. The use of thrombolytic therapy in pregnancy. Obstet Med. 2013, 6, 105–111.
33. Shaikh N, Ummunnisa F, Aboobacker N, et al. Peripartum pulmonary embolism Anesthetic and surgical considerations. J Obstetr and Gyn. 2013, 3, 158–164.
Štítky
Anesteziologie a resuscitace Gynekologie a porodnictví Intenzivní medicína
Článek Zajímavosti z literaturyČlánek Zajímavosti z literaturyČlánek Zajímavosti, tipy a trikyČlánek Současné trendy v zajištění dýchacích cest u dětí – tradice a mýty versus evidence based medicineČlánek Zajímavosti z literaturyČlánek Zajímavosti z literaturyČlánek Zajímavosti z literaturyČlánek Zajímavosti z literatury
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2017 Číslo 2- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Magnosolv a jeho využití v neurologii
- Dlouhodobé užívání dienogestu v terapii endometriózy
-
Všechny články tohoto čísla
- Inhalační aplikace furosemidu - univerzální lék na dušnost?
- Zajímavosti z literatury
- Dlouhodobá léčba opioidy a závislost
- Zajímavosti z literatury
- Dexmedetomidin a jeho využitie v anestéziológii a intenzívnej medicíne
- Zajímavosti, tipy a triky
- Současné trendy v zajištění dýchacích cest u dětí – tradice a mýty versus evidence based medicine
- Zajímavosti z literatury
- Lékař a právo II – soudní znalci a znalecké ústavy
- Volba způsobu anestezie – celková a/nebo regionální
- Zajímavosti z literatury
- Selhání kostí u kriticky nemocných – zapomenutá oblast pro lékaře pracovišť intenzivní péče?
- K tekutinové léčbě hospitalizovaných dospělých pacientů
- Zajímavosti z literatury
- Vztah citrátu podaného v transfuzních přípravcích a hladiny ionizovaného kalcia u kardiochirurgických pacientů
- Anafylaktická reakce po podání sugammadexu při vyvádění z anestezie
- Zajímavosti z literatury
- Účinek noční směny/služby na repolarizaci srdce u sester a lékařů (studie EQUINDOC)
- Hluboká žilní trombóza a plicní embolie v těhotenství
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hluboká žilní trombóza a plicní embolie v těhotenství
- Dexmedetomidin a jeho využitie v anestéziológii a intenzívnej medicíne
- Inhalační aplikace furosemidu - univerzální lék na dušnost?
- Lékař a právo II – soudní znalci a znalecké ústavy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



