-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
INTERAKTIVNÍ KAZUISTIKA: Kombinace rituximab + venetoklax ve 2. linii léčby CLL u pacienta s mutací TP53
15. 7. 2024
Tato kazuistika dokumentuje případ pacienta s 1. relapsem chronické lymfocytární leukémie (CLL), s vysoce rizikovou mutací genu TP53, u kterého byla v rámci časově omezené léčby úspěšně použita kombinace rituximabu s venetoklaxem.
Úvod
Chronická lymfocytární leukémie je monoklonální onemocnění vycházející ze zralých B lymfocytů. S incidencí 6 nových případů na 100 000 obyvatel za rok patří v Česku mezi nejčastější hematologické malignity dospělých (1). Typicky je diagnostikována u pacientů starších 70 let.
Mezi klasické projevy patří lymfadenopatie, splenomegalie a celkové příznaky jako hubnutí, noční poty nebo febrilie. V pokročilejších fázích nemoci se mohou přidat příznaky spojené s infiltrací kostní dřeně a anemizací či trombocytopenií. U velké části pacientů je ovšem nemoc zpočátku asymptomatická a bývá diagnostikována náhodně vyšetřením krevního obrazu z jiného důvodu.
InzercePrůběh onemocnění bývá pomalý, ale existují i agresivní formy nemoci, jež se typicky vyznačují kumulací genetických mutací, včetně aberace TP53, a často vyžadují okamžité zahájení terapie. Prognóza je všeobecně příznivá, a to především v posledních letech, kdy se užívání cílených molekul v léčbě CLL, jak v 1. linii, tak u relapsů, stalo všeobecným trendem. Mezi tyto molekuly patří především inhibitory Brutonovy tyrosinkinázy (BTKi), inhibitor fosfatidylinositol-3-kinázy (PI3Ki) idelalisib a inhibitor BCL-2 venetoklax. Nevýhodou těchto preparátů v monoterapii je především potřeba kontinuální terapie, jež s sebou nese riziko vzniku lékové rezistence či kumulace nežádoucích účinků. Z tohoto důvodu se nyní pozornost soustředí na využití kombinací cílených léků v rámci časově omezené terapie.
Popis případu
V prosinci 2015 byl do našeho centra odeslán 72letý pacient s nově vzniklou krční lymfadenopatií (dle UZ vyšetření 6/2015, jež bylo provedené po prodělané tonzilitidě, bilaterálně zvětšené lymfatické uzliny o velikosti 6–11 mm) a leukocytózou (26,7 × 109/l s 82,7 % lymfocytů v krevním diferenciálu); ostatní parametry krevního obrazu, renální a jaterní testy v normě.
Pacient byl v době prvního vyšetření u nás celkově v dobrém stavu, z komorbidit byl léčen zejména pro diabetes mellitus 2. typu na intenzifikovaném inzulinovém režimu, dále pro tyreotoxikózu a hypercholesterolémii. Fyzikální vyšetření bylo bez přítomnosti hmatné lymfadenopatie, ze subjektivních potíží udával pouze noční pocení při hyperfunkci štítné žlázy, bez dalších celkových příznaků. Bylo doplněno UZ vyšetření břicha s nálezem mírné splenomegalie (135 × 65 mm), bez přítomnosti abdominální lymfadenopatie.
Vyšetření periferní krve průtokovou cytometrií pak v populaci leukocytů prokázalo 80,5 % monoklonálních B lymfocytů, fenotypem odpovídající CD38-negativní CLL (negativita znaku CD38 patří k příznivým prognostickým faktorům; pacienti s CD38– CLL mají statisticky delší dobu do zahájení léčby i celkové přežití a liší se v řadě dalších klinických a laboratorních parametrů) (2). Z dalších prognostických faktorů byl prokázán nemutovaný stav IgHV a cytogeneticky normální nález pouze s minoritní delecí genu TP53 ve 2 % interfází jader (nález pod cut-off).
#160 Vzhledem k nízkému klinickému stadiu Rai II/Binet A a absenci klinických potíží nebyla v době diagnózy indikace k zahájení terapie a pacient byl dále sledován. V květnu 2019 došlo k 1. progresi do klinického stadia Rai IV/Binet C, s anémií (Hb 108 g/l) a trombocytopenií (87 × 109/l), s generalizovanou lymfadenopatií především v retroperitoneu a na mezenteriu, kde byly přítomny splývající masy o velikosti 60 × 42 mm (viz obr. 1).
Obr. 1 5/2019: CT trupu při první progresi CLL

#161 Tab. Současná doporučení CSCLL pro 1. linii léčby CLL
Delece 17p/mutace TP53
Výkonnostní stav
Hlavní léčebná možnost na základě úhradových podmínek v Česku
Další léčebné možnosti (v abecedním pořadí)
nepřítomná
dobrý
FCR
akalabrutinib ± obinutuzumab*
ibrutinib*
ibrutinib + venetoklax*
venetoklax + obinutuzumab*
zanubrutinib*významné komorbidity
venetoklax + obinutuzumab
akalabrutinib ± obinutuzumab*
ibrutinib*
ibrutinib + venetoklax*
obinutuzumab + chlorambucil
venetoklax + obinutuzumab*
zanubrutinib*přítomná
BTKi (akalabrutinib, ibrutinib, zanubrutinib)§
ibrutinib + venetoklax* idelalisib + rituximab** venetoklax + obinutuzumab***
Pozn.: FCR = fludarabin + cyklofosfamid + rituximab
* Léčba nemá t.č. v Česku stanovenou úhradu ze zdravotního pojištění.
** U pacientů, u nichž není vhodná žádná jiná léčba.
*** Úhrada t.č. pouze pro nemocné s významnými komorbiditami.
§ Zejména u pacientů s vyšším kardiovaskulárním rizikem by měly být preferovány BTKi 2. generace (akalabrutinib, zanubrutinib).Pacient byl indikován k terapii 6 cykly kombinace bendamustin + rituximab. Léčba probíhala od srpna 2019 do ledna 2020, od 3. cyklu s redukcí bendamustinu na 70 mg/m2 pro opakované neutropenie grade 3–4. Klinicky došlo k ústupu krční lymfadenopatie a lymfocytózy. Dle restagingového CT vyšetření po ukončení léčby ovšem přetrvávala generalizovaná lymfadenopatie, dokonce s mírnou progresí v abdominální oblasti (viz obr. 2).
Obr. 2 4/2020: CT trupu po ukončení 1. linie terapie (BR), hodnoceno jako stabilní choroba
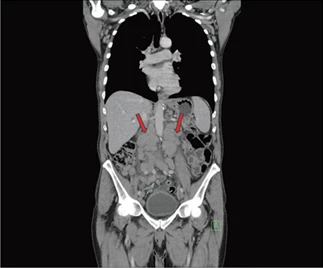
Stav byl tedy hodnocen jako stabilní choroba. Dále byla v květnu 2020 nově prokázána mutace genu TP53.
#162 Vzhledem k chemorefrakternosti onemocnění a vysoce rizikové aberaci TP53 byla dále zvažována léčba inhibitory BTK, případně kombinací R-Ven. Pacient byl v té době stále ve velmi dobrém celkovém stavu (PS ECOG 0) a vzhledem k aktivnímu životnímu stylu preferoval časově limitovanou terapii. Proto byla v červnu 2020 zahájena 2. linie léčby kombinací R-Ven.
Terapie byla opět komplikována neutropenií grade 4, kvůli které byla přibližně měsíc po zahájení na 21 dní pozastavena. Další komplikací byla bilaterální pneumonie v terénu neutropenie, bez záchytu původce, jež si vyžádala dvouměsíční přerušení léčby od srpna do října 2020. Dle restagingového CT bylo – i přes opakované přerušení léčby a podávání venetoklaxu pouze v redukované dávce 100 mg/den – v září 2020 dosaženo kompletní remise. Další infekční komplikace se dostavila na konci listopadu 2020 v podobě uroinfektu s vysokými febriliemi, a léčba byla proto znovu na 30 dní přerušena. Po znovuzahájení byla dávka venetoklaxu pozvolna titrována během dalších 9 měsíců s ohledem na hodnoty neutrofilů v krevním obrazu až do dosažení plné dávky 400 mg/den.
#163 Obr. 3 Doporučený postup pro hematologické toxicity (zdroj: SPC Venclyxto)
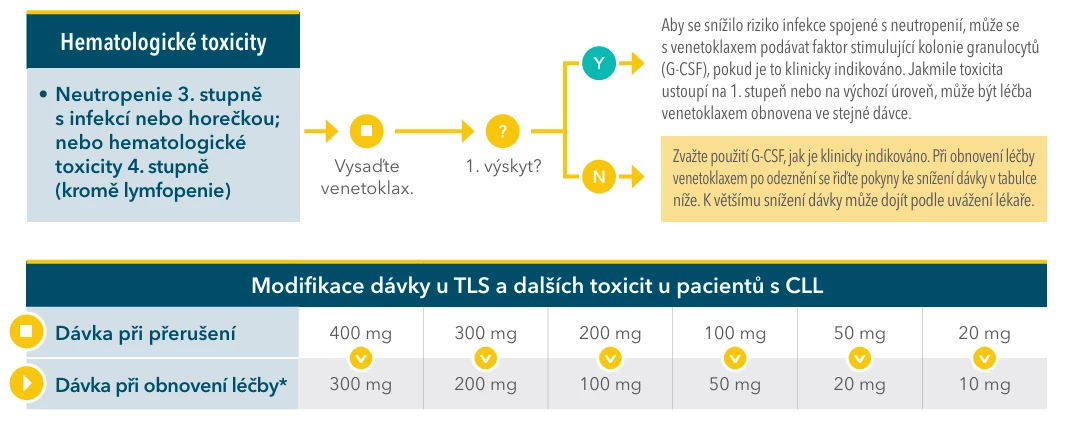
V následujícím průběhu léčby byl pacient zajištěn pravidelným podáváním rekombinantního humánního G-CSF filgrastimu. Další přerušení léčby ani redukce dávkování již nebyly potřebné, a to i přes prodělanou infekci COVID-19 v lednu 2022, která u nemocného při zajištění antivirotiky proběhla téměř asymptomaticky. Po ukončení terapie došlo k úplné normalizaci krevního obrazu a dle CT vyšetření bylo prokázáno dosažení kompletní remise (viz obr. 4).
Obr. 4 9/2022: CT trupu po ukončení 2. linie terapie (R-Ven), hodnoceno jako kompletní remise
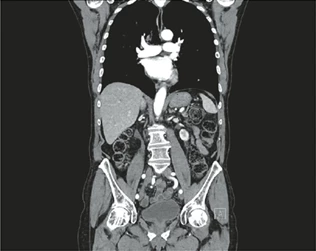
Průtokovou cytometrií byla zjištěna pozitivní minimální reziduální nemoc (MRD) při přítomnosti 0,01 % CLL buněk z populace leukocytů (LoD = 0,003 %/senzitivita = 10–4). K dnešnímu dni je pacient více než rok po ukončení terapie v celkově dobrém stavu, v trvající remisi onemocnění, bez klinických či laboratorních známek relapsu.
Diskuse
Venetoklax je inhibitor antiapoptotického proteinu BCL-2 a základním principem jeho fungování je spuštění programované buněčné smrti v buňkách CLL, a to mechanismem, který je nezávislý na proteinu p53. Účinnost u pacientů s R/R CLL a rizikovou mutací TP53 byla potvrzena ve studii fáze II, kde celková odpověď (ORR) na léčbu venetoklaxem dosáhla 79,2 % při mediánu sledování 12,1 měsíce (3).
V návaznosti na tyto poznatky byl venetoklax nejprve schválen v monoterapii právě u této vysoce rizikové skupiny předléčených pacientů s aberací TP53 (4). Následně byl na základě studie MURANO schválen i v kombinaci s anti-CD20 protilátkou rituximabem pro všechny pacienty s R/R CLL. V této studii fáze III byl srovnáván režim bendamustin + rituximab (BR) s režimem R-Ven. K dnešnímu dni jsou již dostupná finální data ze 7letého sledování, která ukazují benefit cílené léčby oproti chemoimunoterapii. Při mediánu sledování 85,7 měsíce byl medián přežití bez progrese (PFS) ve skupině R-Ven 54,7 měsíce oproti 17 měsícům u pacientů léčených režimem BR. Tento efekt byl znatelný především v kohortě pacientů s nedetekovatelnou reziduální chorobou po ukončení léčby (medián doby do progrese [PFS] 52,5 měsíce u MRD-negativních při ukončení léčby vs. 18 měsíců u MRD-pozitivních). Rozdíl byl i v celkovém přežití (OS), kdy ve skupině R-Ven dosahovalo 7leté přežití 69,6 % ve srovnání s 51 % u bendamustinového režimu (5). Naše kazuistika příhodně dokumentuje případ pacienta, který byl léčen jak kombinací BR, tak kombinací R-Ven, a zatímco na BR byl zcela refrakterní, při podání režimu R-Ven se podařilo dosáhnout přetrvávající kompletní remise.
Z nežádoucích účinků, se kterými se setkáváme v rámci léčby dle protokolu R-Ven, se jedná především o neutropenii a s ní související infekční komplikace, dále pak o syndrom z nádorového rozpadu (TLS) při zahájení léčby a vzácněji i o reakce spojené s infuzí (IRR) při podávání rituximabu. V již zmíněné studii MURANO byla neutropenie grade 3–4 pozorována u 57,7 % pacientů a byla také nejčastějším důvodem k přerušení léčby (6). Případ našeho pacienta rovněž dokumentuje neutropenické a infekční komplikace, jež vedly k opakovanému přerušení léčby a nutnosti dlouhodobě redukovat dávku venetoklaxu. Příznivé je, že i přes tyto komplikace se podařilo dosáhnout výborného léčebného efektu.
Co se týká dalších nežádoucích účinků, TLS se dá efektivně předcházet dodržením postupné eskalace dávky venetoklaxu v 5týdenním schématu (s počáteční dávkou 20 mg/den až k cílovým 400 mg/den) a pečlivým laboratorním monitorováním. U pacientů s vysokým rizikem TLS (absolutní počet lymfocytů > 25 × 109/l a velikostí lymfatických uzlin > 5 cm nebo jakákoliv lymfatická uzlina > 10 cm) je doporučena i krátkodobá monitorace za hospitalizace při prvním podání venetoklaxu a při první eskalaci dávky. Hospitalizace může být zvážena rovněž u pacientů se středním rizikem TLS (absolutní počet lymfocytů > 25 × 109/l nebo velikost lymfatických uzlin v rozmezí 5–10 cm) a nemocných s renální dysfunkcí (7).
Velkou výhodou kombinace R-Ven oproti jiným cíleným preparátům podávaným v monoterapii je časově limitované schéma podávání (venetoklax na 2 roky, po dokončení ramp-up periody v kombinaci se 6 cykly rituximabu à 28 dní v dávce 375 mg/m2 tělesného povrchu v prvním cyklu a v dávce 500 mg/m2 tělesného povrchu ve všech dalších cyklech). To jednak zabraňuje kumulaci nežádoucích účinků, ale také předchází vzniku sekundární rezistence, která je často skloňovanou příčinou selhání terapie například u ibrutinibu či jiných kontinuálně podávaných BTKi. Navíc možnost dosažení hluboké dlouhotrvající remise bez nutnosti kontinuální terapie je důležitý faktor z hlediska kvality života, který například u našeho pacienta zásadně ovlivnil výběr léčebného protokolu.
Ačkoli v současnosti nemáme k dispozici jasná doporučení k opakování terapie v terénu R/R CLL, časově omezená cílená léčba otevírá diskusi i o této možnosti. Doporučení Evropské společnosti pro klinickou onkologii (ESMO) z roku 2020 již zmiňuje možnost opakování frontline terapie při dosažení dlouhodobé remise > 36 měsíců (8). Data ze studie MURANO pak naznačují vysokou efektivitu opakování léčby R-Ven u pacientů s R/R CLL. Celková odpověď na léčbu u 25 pacientů, kteří podstoupili retreatment, činila 72 % a medián PFS 23,3 měsíce (5). Než se však tento postup stane součástí běžné praxe, bude pravděpodobně potřeba odpovědět velké množství otázek k určení správné strategie léčby. Jednou z nich je i často diskutované postavení parametru minimální reziduální nemoci (MRD). Zatímco nyní slouží jako efektivní prognostický marker, je otázkou, zda se do budoucna hodnocení MRD stane součástí i léčebné strategie ve smyslu rozhodování o konsolidační léčbě nebo jejím včasném znovuzahájení při MRD konverzi. V současné době přibývá klinických studií, jež sledují MRD jako jeden z koncových ukazatelů odpovědi na léčbu, ovšem zda časem dojde ke standardizaci tzv. MRD řízené terapie, zůstává prozatím otázkou.
Závěr
Kombinace R-Ven představuje efektivní léčebnou možnost v terénu R/R CLL, a to i u chemorefrakterních pacientů s vysoce rizikovou mutací TP53. Hlavní předností oproti jiným cíleným lékům, např. BTKi, je časově omezená doba podávání, která jednak snižuje riziko kumulace nežádoucích účinků, jednak může být pro některé nemocné významným benefitem z hlediska kvality života. Z nežádoucích účinků je třeba myslet především na neutropenické komplikace a syndrom z nádorového rozpadu, který je ovšem ve většině případů dobře zvladatelný při dodržení správné eskalace dávky venetoklaxu a adekvátního monitorování pacienta. Výsledky studie MURANO naznačují, že do budoucna by mohlo být možné i opakování stejného léčebného protokolu v případě následného relapsu. Jaké bude postavení MRD v léčebné strategii, zatím není jasné.
MUDr. Tereza Shokralla
MUDr. Martin Špaček, Ph.D.
1. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Hematologie a transfuzní lékařství Onkologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




