-
Medical journals
- Career
Ureteroskopická biopsie tumorů horních cest močových: endoskopické a cytologické techniky
Authors: D. H. Bagley; K. A. Healy; N. Kleinmann; M. Bibbo
Authors‘ workplace: Department of Urology, Thomas Jefferson University
Published in: Urol List 2012; 10(2): 26-30
Overview
Ureteroskopická biopsie představuje významnou součást diagnostiky tumorů horních cest močových. Jak bylo prokázáno, alternativní modality jako rozbor moči a zobrazovací vyšetření s aplikací kontrastní látky neumožňují stanovení přesné diagnózy. Pro vyšetření příslušné části horních cest močových je vhodné užívat systematickou „no touch“ (tj. minimálně invazivní) ureteroskopickou techniku. Nejúčinněji lze biopsii odebrat pomocí košíčku s plochými dráty nebo pomocí bioptických kleští. Použití kartáčku neumožňuje získat adekvátní vzorek. Všechny vzorky je nutné co nejrychleji odeslat čerstvé, uložené v normálním fyziologickém roztoku na cytopatologické vyšetření. Vzorky jsou následně připraveny pomocí cytospinu a v případě, že je přítomen jakýkoli makroskopicky viditelný vzorek tkáně, jsou připraveny rovněž parafinové cytologické bločky. Tyto ureteroskopické a cytopatologické techniky napomáhají stanovit přesnou diagnózu a následně zvolit vhodnou léčbu.
Klíčová slova:
ureteroskopie, močovod, tumor, biopsie, cytologieU pacientů s neoplazmaty je vhodná léčba stanovena na základě grade a stadia příslušné léze, což spolu s přibývajícím množstvím terapeutických modalit nabývá ještě většího významu. Klasická léčba uroteliálních neoplazmat lokalizovaných v horních cestách močových spočívala v radikální nefroureterektomii a excizi manžety močového měchýře. Spolu se zdokonalováním ureteroskopů a ablačních zařízení se však u pečlivě vybraných pacientů stala možností volby rovněž nefron šetřící operace. Menší tumory nízkého grade dobře reagují na léčbu pomocí nefron šetřícího endoskopického přístupu. Naopak větší léze, zejména léze o vyšším grade, zpravidla vyžadují extirpační operaci.
Při volbě léčby uroteliálního karcinomu horních cest močových (UTUC) je nezbytné mít k dispozici co nejvíce informací o grade a histologické povaze onemocnění. Základní roli hraje při diagnostice endoskopická biopsie. V tomto článku hodnotíme techniky ureteroskopické biopsie tumorů horních cest močových a metody manipulace se vzorky a jejich přípravy pro dosažení maximální diagnostické výtěžnosti.
NEINVAZIVNÍ VYŠETŘENÍ
Pokusy o diagnostiku onemocnění pomocí neinvazivních metod jsou často nepřesvědčivé. Rozbor moči i cytologické vyšetření vymočené moči vykazují nízkou senzitivitu na UTUC, zejména v případě tumorů nízkého grade [1]. Ani další testy, jako např. BTA a FISH vymočené moči, nemají velkou výtěžnost [2,3].
Radiologická vyšetření – vylučovací urografie i CT urografie (CTU) – obvykle odhalí přítomnost defektu náplně v horních cestách močových. CTU představuje v současné době zlatý standard mezi zobrazovacími technikami hned z několika důvodů. CTU poskytuje nejen lepší výsledek, ale rovněž přináší potenciální výhodu v podobě informace o stadiu onemocnění [4]. Některé studie rovněž prokazují, že přítomnost hydronefrózy souvisí s invazivnějšími tumory [5]. U pacientů trpících azotemií nebo alergií na intravenózní aplikaci kontrastní látky lze užívat urografii s využitím magnetické rezonance (MRU). Navzdory všem technologickým pokrokům však samotná zobrazovací vyšetření neumožňují definitivně diagnostikovat UTUC a indikovat radikální nefroureterektomii. Případné defekty náplně mohou zahrnovat i řadu benigních stavů, jako jsou fungus ball, krevní sraženina, polyp nebo slabě kalcifikovaný konkrement, jako např. konkrement tvořený převážně matrix. Volba léčby navíc závisí na grade tumoru, který nelze stanovit bez vyšetření vzorku tkáně. Podezřelé léze je tedy nutné diagnostikovat endoskopicky.
Ureteroskopie s biopsií a případně resekcí představují dosud nejpřesnější techniky pro stanovení grade a případně rovněž stadia lézí v horních cestách močových [6,7]. Samotné endoskopické vyšetření není adekvátní metodou pro stanovení grade onemocnění. Jedna ze studií uvádí, že maligní povahu nebo grade tumoru v horních cestách močových lze na základě vzhledu tumoru při ureteroskopickém vyšetření stanovit pouze se 70% přesností [8].
ENDOSKOPICKÉ TECHNIKY
Prvním krokem endoskopického vyšetření je cystoskopie. Celá močová trubice, prostata i močový měchýř jsou vyšetřeny pro přítomnost jakýchkoli podezřelých lézí, neboť anamnéza karcinomu močového měchýře představuje rizikový faktor pro vznik UTUC. Ke vzniku nového nebo recidivujícího karcinomu v močovém měchýři po ureteroskopické léčbě dochází u 20–44 % pacientů [9]. Následně je na postižené i kontralaterální straně proveden retrográdní ureteropyelogram (RPG) s aplikací zředěné jodové kontrastní látky (30% roztok) (obr. 1). Rozhodně doporučujeme při RPG užívat katétr vhodné velikosti s kuželovitým zakončením, obvykle užíváme 8 French, který dokonale utěsní ústí močovodu, a zabrání tak úniku kontrastní látky do močového měchýře. Zavedení katétru s otevřeným koncem nemusí umožnit dostatečnou distenzi močovodu pro identifikaci defektů náplně. Katétr s otevřeným koncem se navíc často zavádí pomocí vodiče, který může poškodit dosud nevyšetřenou uroteliální sliznici. Po vyjmutí cystoskopu je močovod vyšetřen pomocí ureteroskopu o menším průměru.
Image 1. Retrográdní ureteropyelogram prokazuje přítomnost tumoru v močovodu o velikosti 3 cm. 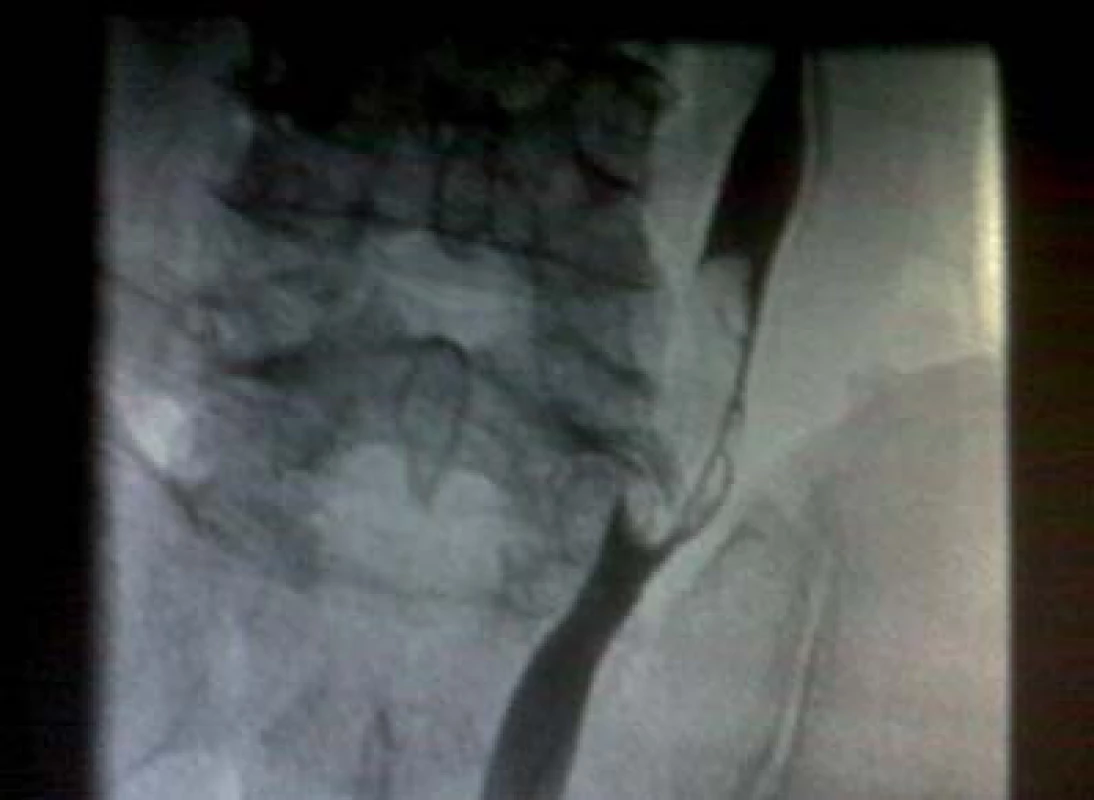
Horní cesty močové lze důkladně vyšetřit pomocí jedné ze dvou „no touch“ technik. Cíl této techniky spočívá ve vyšetření celého urotelu bez předchozí instrumentace, která by mohla zapříčinit krvácení, a zmařit tak endoskopické vyšetření. Nejprve je pod přímou zrakovou kontrolou zaveden rigidní ureteroskop o malém průměru močovým měchýřem až do distálního močovodu [10,11]. Při užití instrumentů o kalibru 7 F nebo méně není obvykle nutné provádět dilataci. Ureteroskop je zaveden co možná nejvíce proximálně. Zatímco u žen lze obvykle vyšetřit celý močovod pomocí rigidního ureteroskopu, u mužů tento nemusí překonat oblast křížící ilické cévy. Vodič je ponechán na poslední zobrazené úrovni a ureteroskop je vyjmut. Následně je pod skiaskopickou kontrolou flexibilní ureteroskop zaveden do pozice, která byla naposledy vyšetřena rigidním ureteroskopem. Díky zmenšování velikosti flexibilních ureteroskopů není obvykle nutné močovod dilatovat. Ideálním instrumentem je flexibilní ureteroskop o průměru 7,5 F, o čemž svědčí skutečnost, že pouze v méně než 1 % případů nebylo možné ureteroskop zavést bez předchozí dilatace [12]. Větší zařízení, jako jsou např. digitální ureteroskopy, mají v průměru téměř 10 F a před jejich zavedením může být nezbytné močovod dilatovat, čehož je lepší se vzhledem k riziku poranění tkáně vodičem vyvarovat.
Při druhé technice se rigidní ureteroskop vůbec neužívá. Místo toho je zaveden flexibilní instrument pro vyšetření přímo z močového měchýře přes močovod až do intrarenálního vývodného systému [13], čehož lze dosáhnout pouze pomocí instrumentu vhodné velikosti a odpovídajícího lumen močovodu.
Flexibilní ureteroskop je tak pod přímou zrakovou kontrolou zaveden močovodem až do ledvinné pánvičky a vývodný systém je systematicky vyšetřen – od ledvinné pánvičky přes horní a střední pól až po kalichy dolního pólu. Nejlépe přístupná místa jsou tak vyšetřena nejdříve a často obtížně dostupný dolní pól je ponechán na konec. Tímto postupem předejdeme poranění ledvinné pánvičky, k němuž může dojít v podmínkách horší vizualizace horních cest močových.
Při vyšetřování močovodu pomocí jakékoli z „no touch“ technik je nutné v případě detekce jakékoli malé léze provést biopsii před dalším zaváděním ureteroskopu, který by mohl lézi případně traumatizovat. V případě detekce většího ureterálního tumoru může být vhodnější pokračovat v zavádění ureteroskopu za lézí, a prozkoumat tak proximálnější oblasti močovodu ve snaze detekovat další tumory. V některých případech může být obtížné nalézt samotné lumen močovodu pro obejití tumoru. Můžeme se pokusit vizualizovat a sledovat stěnu močovodu (obr. 2). Případně může být užitečné zavést za tumor hydrofilní vodič, a zajistit tak přístup do proximálních částí.
Image 2. Endoskopické zobrazení intraureterálního neoplazmatu. 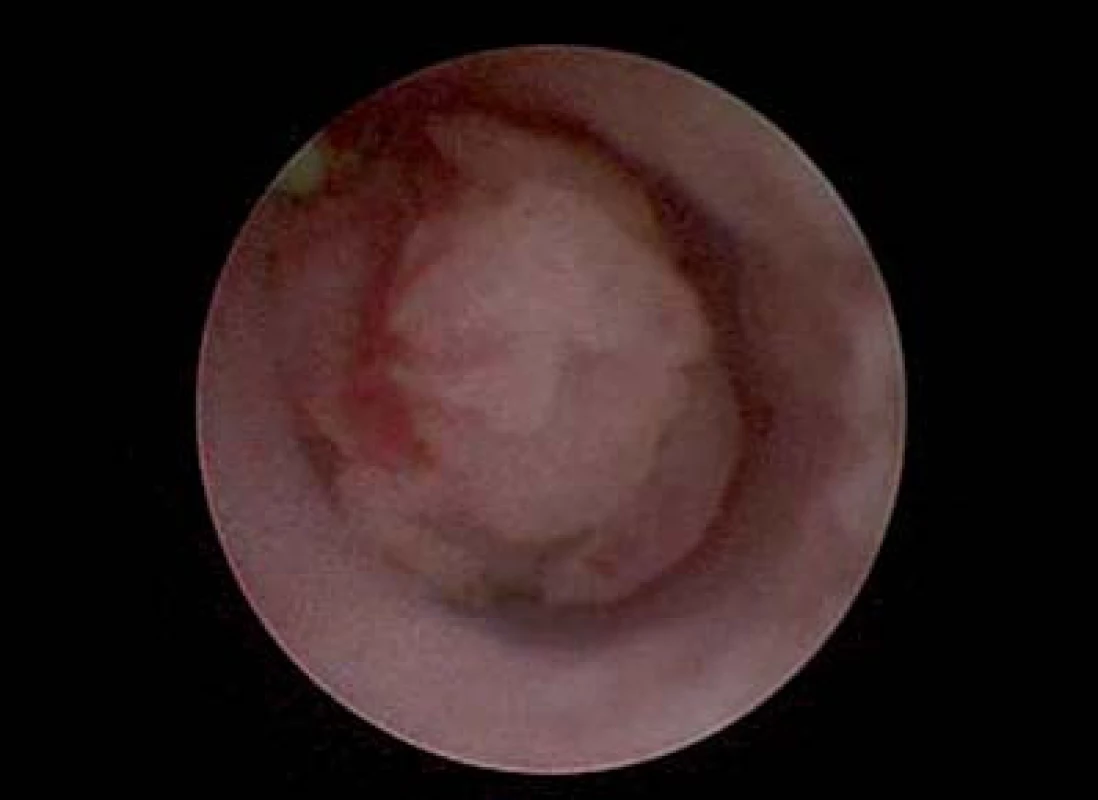
Ačkoli upřednostňujeme „no touch“ techniku, v případě jakýchkoli pochyb o možnosti opakovaného přístupu do močovodu je zaveden vodič. Ve výše popsaném případě, kdy bylo nutné ureteroskop zavádět za tumor, by měl být vodič ponechán na místě.
V současné době je k dispozici řada pomůcek pro biopsii podezřelých ureterálních lézí: košíčky, kleště, graspery, drátěná očka a kartáčky (obr. 3). Nejúčinnější pomůcku pro odběr biopsie z papilárních tumorů představuje ocelový košíček s plochým drátem [14]. Tento instrument je vhodný zejména pro tumory větší velikosti. Dráty košíčku se zaboří do tumoru a tento je přiměřeně (nikoli kompletně) uzavřen. Zachycená tkáň je následně vytržena. Tímto způsobem lze odebrat velký vzorek o velikosti až několik milimetrů. Celý komplex tumor-košíček--ureteroskop je vhodné vyjmout z močovodu zároveň, aby zůstal zachován co největší možný vzorek (obr. 4). V opačném případě, pokud je vzorek vyjmut pracovním kanálem ureteroskopu, se může tkáň vysmeknout.
Image 3. Mezi dvě nejčastěji užívané pomůcky při ureteroskopické biopsii patří bioptické kleště a košíček s plochými dráty. 
Image 4. Velký vzorek tumoru visící z košíčku s plochými dráty. Celý komplex sestávající z tumoru, košíčku a ureteroskopu je vyjmut současně, což nám umožní zachovat co největší možný vzorek. 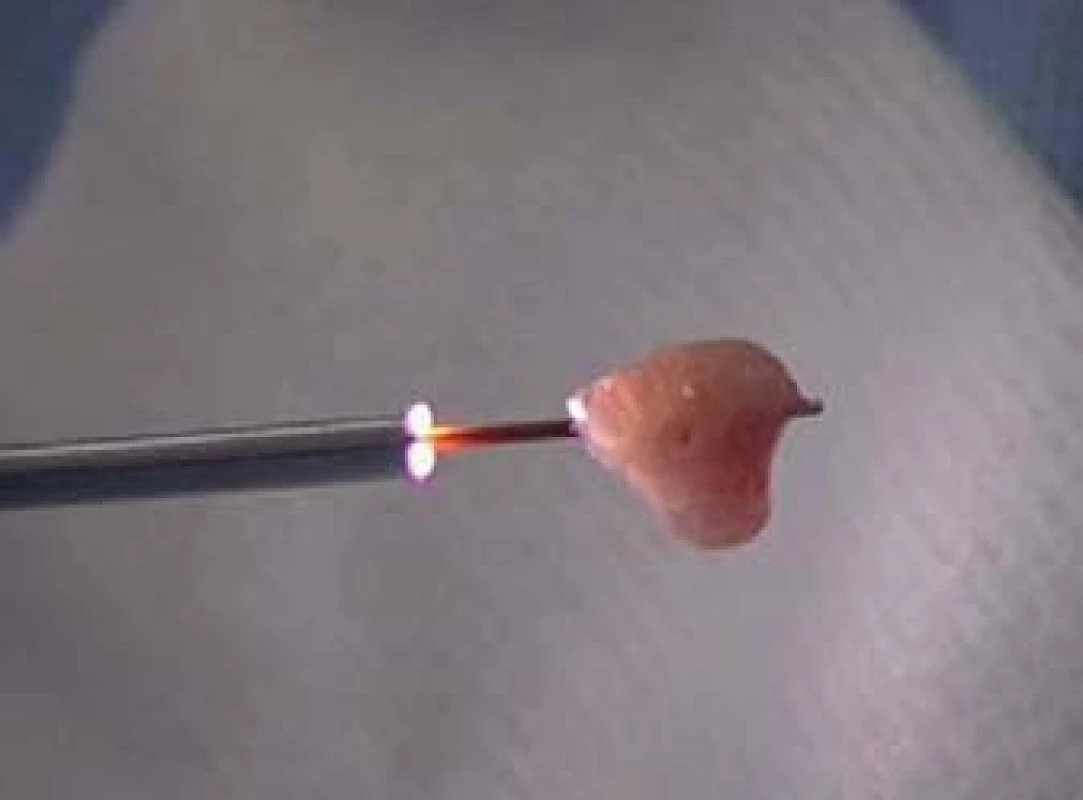
Při odběru vzorků z tumorů v horních cestách močových lze užít rovněž bioptické kleště (obr. 3). Bioptické kleště lze podobně jako košíček s plochým drátem užít pro odběr vzorků z papilárních tumorů, jejich užití je však vhodnější u menších, přisedlých nebo plochých lézí. Pokud je celý vzorek uzavřen uvnitř pracovní části bioptických kleští, je možné jej vyjmout kanálem ureteroskopu. V případě, že tumor přesahuje samotnou pracovní část, je nutné vyjmout celý komplex tumor--kleště-ureteroskop najednou. Tento postup opět slouží k zajištění odběru co největšího možného vzorku.
Použití jiných instrumentů je mnohem méně efektivní. Nitinolové košíčky s kruhovým drátem nemají dostatečný okraj pro uchopení tumoru. Podobně ani kartáček neumožňuje adekvátní odběr tkáně. Při endoskopickém zobrazení vidíme, že kartáček pohybuje tkání, ale neodebírá ji. Při odběru biopsie z papilárních tumorů může být užitečné použití kleští s hroty, pakliže nemáme k dispozici jiná zařízení nebo je tumor špatně přístupný. V nedávné době byly vyvinuty větší bioptické kleště s 2mm pracovní částí. Tyto kleště je však nutné vložit do ureteroskopu, který je třeba zavádět pomocí pochvy. Při užívání tohoto instrumentu doporučujeme před zavedením přístupové pochvy nejprve pečlivě vyšetřit močovod pomocí „no touch“ techniky pro detekci případných lézí.
Ať již použijeme jakoukoli metodu, odebíráme vždy větší počet vzorků, abychom získali dostatečný materiál pro patologické vyšetření. Tyto techniky lze v některých případech užít pro mechanické zmenšení velikosti léze. Nádor může být odstraněn až ke své bázi, která může být dále léčena. Po odebrání adekvátního vzorku je indikována laserová léčba pomocí holmium nebo neodymium:YAG laseru.
MANIPULACE SE VZORKEM A JEHO DALŠÍ ZPRACOVÁNÍ
Vzorek by měl být umístěn do malého kontejneru s fyziologickým roztokem, bez přidání fixačního roztoku (obr. 5). Abychom předešli ztrátě vzorku, měli bychom minimalizovat manipulaci při transferu vzorku. Jako tomu je u všech biopsií, je třeba odebrat co nejvíce tkáně. Rovněž je třeba pokusit se odebrat všechny makroskopicky viditelné vzorky tkáně, jež lze zpracovat jako parafinové cytologické bločky. Vzorek by měl být odeslán přímo na cytologii. Se všemi vzorky je v našem centru nakládáno jako s cytologickými vzorky. Kromě biopsie je z močového měchýře a vývodných cest aspirován vzorek moči před biopsií a léčbou i po nich (tab. 1,2).
Image 5. Vzorek je přemístěn přímo do malé nádoby s fyziologickým roztokem (bez fixačního roztoku) a odeslán do cytopatologické laboratoře. 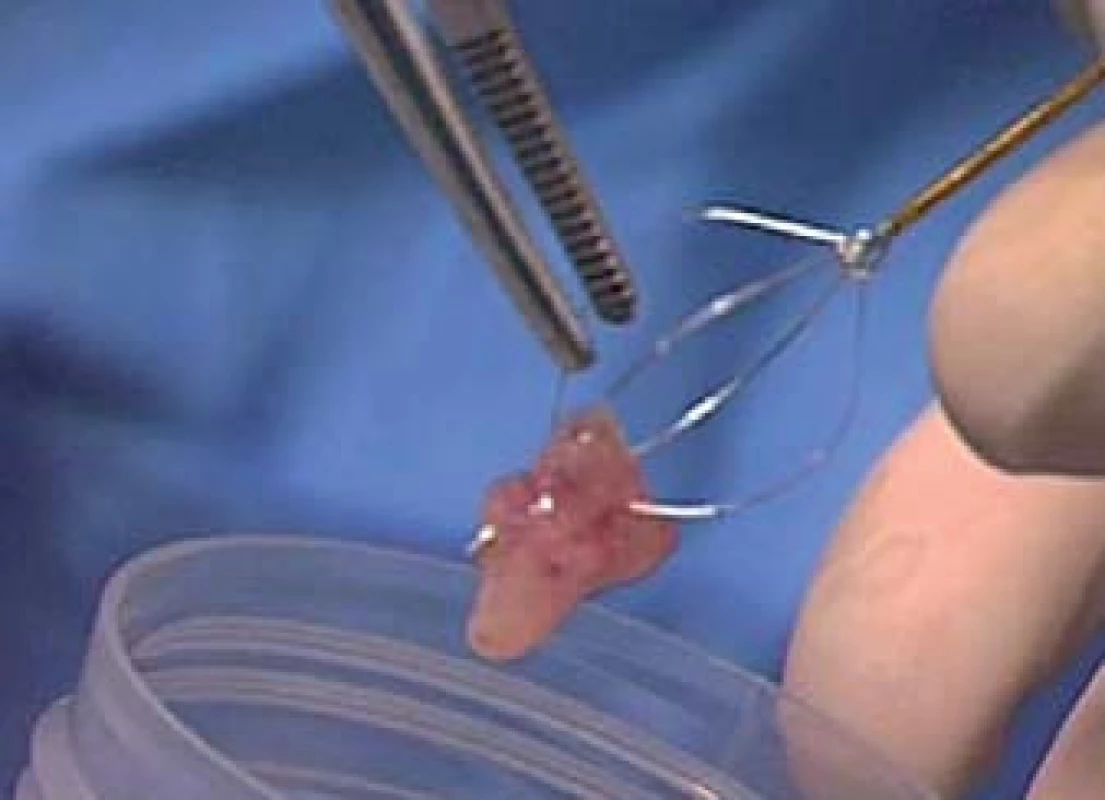
Table 1. Vzorky odebrané pro cytologické vyšetření během ureteroskopické biopsie. 
Table 2. Manipulace se vzorkem biopsie a jeho zpracování. 
V cytopatologické laboratoři jsou vzorky připraveny pomocí cytospinu a pakliže je to možné, jsou připraveny i parafinové cytologické bločky. Cytologické vyšetření odráží primární tumor a ostatní části vývodného systému. Parafinové cytologické bločky odráží architekturu tumoru a jednotlivé buňky.
Po cytospinu je do vzorku přidán fixační roztok Saccomanno. Jestliže je ve vzorku přítomna makroskopická hematurie, přidáme roztok CytoRich, který rozpouští erytrocyty. Následně je vzorek zcentrifugován a většina sedimentu je odstraněna. Přibližně 3–5 ml sedimentu je umístěno do speciální nálevky a sediment je znovu centrifugován. Buňky přilnou ke sklíčku a jsou vysušeny a připraveny k barvení podle Papanicolaou. Nakonec je vzorek umístěn do roztoku Xylenu, jenž pomůže odstranit carbowax obsažený ve fixačním prostředku Saccomanno (obr. 6a).
Obr. 6. a) Tumor 2 grade v cytologickém vzorku. 
Kromě cytospinu lze parafinové cytologické bločky připravit v případě, že je ve vzorku přítomna makroskopicky viditelná tkáň, přičemž se užívá peleta z prvního odstředění. Peleta je umístěna do perforovaného sáčku navlhčeného ve formalínu, následně je vložena do kazety a ponořena do roztoku formalínu. Peleta je zpracována v několika roztocích: fixována ve formalínu, dehydrována v alkoholu a nakonec očištěna v xylenu. Vzorek je poté vyjmut ze sáčku a vnořen do vosku. Na sklíčku je vzorek rozřezán a nabarven pomocí hematoxylinu a eosinu (H & E) a je připraven jako histologický vzorek (obr. 6b).
Obr. 6. b) Buněčné bločky vykazují histologii stejného tumoru. 
Pomocí tohoto postupu se nám podařilo významně zlepšit výtěžnost ureteroskopické biopsie. Pouze díky zpracování vzorků v cytologické laboratoři se výtěžnost vhodných vzorků zvýšila ze 40 % na přibližně 90 % [11].
Existují obavy, že ureteroskopická biopsie nereflektuje skutečnou patologii, zejména grade tumoru. Co se týče grade tumoru, však několik studií prokázalo 80–90% shodu mezi výsledkem biopsie vzorků odebraných pomocí endoskopického vyšetření a finálním patologickým vyšetřením [7,15]. Přesnost vyšetření lze navíc zvýšit odběrem většího počtu vzorků a v ideálním případě pomocí makroskopických vzorků, jež lze užít pro přípravu parafinových cytologických bločků. Velmi důležité je rovněž odeslat všechny vzorky naložené ve fyziologickém roztoku co nejrychleji do cytopatologické laboratoře, aby nedošlo k destrukci buněk.
ZÁVĚR
Díky zdokonalování designu ureteroskopů a doplňkových instrumentů se ureteroskopie stala nedílnou součástí při diagnostice a dokonce léčbě tumorů v horních cestách močových. Samotná vizualizace močovodu pomocí endoskopického vyšetření není dostatečná a je nezbytné provedení biopsie. Ureteroskopická biopsie a pečlivé zpracování vzorků může zvýšit přesnost diagnostiky, a pomoci tak při volbě vhodné léčby. Úspěch je podmíněn úzkou spoluprací urologů a cytopatologů.
Zkratky
UTUC = uroteliální karcinom horních cest močových
CTU = CT urogram
MRU = magnetická rezonanční urografie
RPG = retrográdní ureteropyelogram
Demetrius H. Bagley, M.D., FACS
Department of Urology, Thomas Jefferson University
1025 Walnut Street
Suite 1112 College Building
Philadelphia, PA 19107
Demetrius.Bagley@jefferson.edu
Sources
1. Rife CC, Farrow GM, Utz DC. Urine cytology of transitional cell neoplasms. Urol Clin North Am 1979; 6(3): 599–612.
2. Zimmerman RL, Bagley DH, Hawthorne C et al. Utility of the Bard BTA Test in Detecting Upper Urinary Tract Transitional Cell Carcinoma from Ureteroscopic Biopsy. Urology 1998; 51(6): 956–959.
3. Johannes JR, Nelson E, Bibbo M et al. Voided urine fluorescence in situ hybridization testing for upper tract urothelial carcinoma surveillance. J Urol 2010; 184(3): 879–882.
4. Fritz GA, Schoellnast H, Deutschman HA et al. Multiphasic multidetector – row CT (MDCT) in detection and staging of transitional cell carcinomas of the upper urinary tract. Eur Radiol 2006; 16(6): 1244–1252.
5. Ito Y, Kikuchi E, Tanaka N et al. Preoperative hydronephrosis grade independently predicts worse pathological outcomes in patients undergoing nephroureterectomy for upper tract urothelial carcinoma. J Urol 2011; 185(5): 1621–1626.
6. Keeley FX, Bibbo M, Bagley DH. Ureteroscopic treatment and surveillance of upper urinary tract transitional cell carcinoma. J Urol 1997; 157(5): 1550–1565.
7. Williams SK, Denton KJ, Minervini A et al. Correlation of upper tract cytology, retrograde pyelography, ureteroscopic appearance and ureteroscopic biopsy with histologic examination of upper tract transitional cell carcinoma. J Endourol 2008; 22(1): 71–76.
8. El-Hakim A, Weiss GH, Lee BR et al. Correlation of ureteroscopic appearance with histologic grade of upper tract transitional cell carcinoma. Urology 2004; 63(4): 647–650.
9. Bagley DH, Grasso M. Ureteroscopic Laser Treatment of Upper Urinary Tract Neoplasms. World J Urol 2010; 28(2): 143–149.
10. Abdel-Razzak OM, Ehya H, Cubler-Goodman A et al. Ureteroscopic Biopsy in the Upper Urinary Tract. Urology 1994; 44(3): 451–457.
11. Tawfiek ER, Bibbo M, Bagley DH. Ureteroscopic Biopsy: Technique and Specimen Preparation. Urology 1997; 50(1): 117–119.
12. Hudson RG, Conlin MJ, Bagley DH. Ureteric Access with Flexible Ureteroscopes: Effect of the Size of the Ureteroscope. BJU Int 2005; 95(7): 1043–1044.
13. Johnson JB, Portela D, Grasso M. Advanced ureteroscopy: Wireless and sheathless. J Endourol 2006; 20(8): 552–555.
14. Abdel-Razzak OM, Ehya H, Cubler-Goodman A et al. Ureteroscopic biopsy in the upper urinary tract. Urology 1994; 44(3): 451–457.
15. Keeley FX, Kulp DA, Bibbo M et al. Diagnostic Accuracy of Ureteroscopic Biopsy in Upper Tract Transitional Cell Carcinoma. J Urol 1997; 157(1): 33–37.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2012 Issue 2-
All articles in this issue
- Denosumab rozšiřuje možnosti farmakoterapie kostního postižení pacientů s karcinomem prostaty
- Nejnovější informace v oblasti terapeutických cílů a preparátů pro léčbu karcinomu prostaty rezistentního na kastrační léčbu
- Etiologie a diagnostika nádorů horních močových cest
- Ureteroskopická biopsie tumorů horních cest močových: endoskopické a cytologické techniky
- Technické triky a tipy pro retroperitoneální laparoendoskopickou nefrektomii jedním portem (LESS)
- Chemoterapie karcinomů horních cest močových
- Léčba generalizovaných nádorů ledvin: systémová imunoterapie, paliativní léčba
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Léčba nádorů, které neprorůstají do svaloviny: transuretrální resekce, nové postupy
- Chemoterapie a radioterapie u nádorů močového měchýře
- Léčba metastatických nádorů močového měchýře, systémová chemoterapie, symptomatická léčba
- Antimuskarinika a lékové interakce
- Extrakt ze Serenoa repens při léčbě benigní hyperplazie prostaty
- EAU Guidelines pro vazektomii
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antimuskarinika a lékové interakce
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Chemoterapie a radioterapie u nádorů močového měchýře
- Etiologie a diagnostika nádorů horních močových cest
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

