-
Medical journals
- Career
LIEČBA NÁDOROV TESTIS
Authors: prof. MUDr. Dalibor Ondruš, DrSc.
Authors‘ workplace: I. onkologická klinika LF Univerzity Komenského a Onkologického ústavu sv. Alžbety, Bratislava
Published in: Urol List 2006; 4(3): 22-26
Overview
Diskutuje sa postavenie radikálnej orchiektómie, resp. orgán šetriacej operácie v primárnej liečbe nádoru testis. Detailné histologické vyšetrenie operačného preparátu je predpokladom na ďalšie liečebné postupy. Predkladá sa prehľad liečebných možností u seminómov a neseminomatóznych nádorov v závislosti od klinického štádia ochorenia. Diskutuje sa postavenie rádioterapie, retroperitoneálnej lymfadenektómie, chemoterapie prvej línie, ako aj postavenie postchemoterapeutickej chirurgie a možností ďalších línií chemoterapeutických režimov v liečebnom algoritme ako aj prognóza ochorenia v závislosti od prognostických faktorov.
KĽÚČOVÉ SLOVÁ:
nádor testis, orchiektómia, chemoterapia, rádioterapia, lymfadenektómiaLIEČBA PRIMÁRNEHO NÁDORU
Pri istej diagnóze alebo pri podozrení na nádor testis je indikovaná operačná revízia testis z ingvinálneho prístupu a po potvrdení diagnózy nádoru radikálna orchiektómia. Výhodou inguinálneho prístupu pred skrotálnym je odstránenie testis a epididymis spolu s obalmi testis a s dostatočne dlhým semenným povrazcom a pri manipulácii s nádorom sa predíde metastázovaniu nádorových buniek. Transskrotálny prístup je kontraindikovaný, lebo ponechá intaktnú inguinálnu čas semenného povrazca a môže vies k lokálnej implantácii do steny skróta a inguinálnych a panvových uzlín [1].
Pri bilaterálnom výskyte nádoru testis je alternatívou orchiektómie testis zachovávajúca operácia (testis preserving surgery). Pri simultánnom náleze, ak objem nádoru v jednom testis nepresahuje 25–30 % jeho tkaniva a hodnoty testosterónu sú v norme, možno z ingvinálneho len nádor a v prípade nálezu seminómu následne testis ožiari. Napriek azoospermii pri tomto postupe dochádza k redukcii, avšak k zachovaniu určitej androgénovej produkcie a libida [2,21].
Tento postup možno samozrejme použi aj pri metachrónnom výskyte, kde liečbu nádoru v solitárnom testis ovplyvňuje časový interval medzi vznikom oboch nádorov, histologický nález, štádium ochorenia, charakter a rozsah liečby prvého nádoru. Pacienti po bilaterálnej orchiektómii vyžadujú hormonálnu substitúciu i monitorovanie parametrov kostného metabolizmu, nakoľko dlhodobá androgénová deprivácia može vies k osteopénii až osteoporóze. V prípade orgán-zachovávajúcej enukleácie nádoru majú pacienti z tohto postupu endokrinologický a psychologický benefit.
Detailné histologické vyšetrenie operačného preparátu je predpokladom na ďalšie liečebné postupy.
Liečba seminómov
Štandardnou liečbou seminómov v I. klinickom štádiu (normálna veľkos lymfatických uzlín retroperitonea, bez orgánových metastáz) je pooperačná, zaisovacia rádioterapia. Cieľový objem zahrňuje regionálne lymfatické uzliny, tj. uzliny paraaortálne, parakaválne, renálne hilové uzliny obojstranné a homolaterálne uzliny panvové. Okraje cieľového objemu zasahujú od platničky medzi Th10–11 k dolnému okraju foramen obturatum panvovej kosti. Pokiaľ sa ožaruje len paraaortálna oblas, dolný okraj je medzi L5–1. Šírka poľa je obvykle 8–10 cm a mala by zaujíma aj renálne hilové lymfatické uzliny. Radiačná technika spočíva v použití 2 protiľahlých polí - predného a zadného, ktoré majú tvar „hokejky“. Ožaruje sa X-žiarením lineárneho urýchľovača. Celková dávka je 20,0 Gy. Homolaterálna polovica skróta a ingvinálne lymfatické uzliny sa ožarujú v prípade orchiektómie skrotálnou cestou, po iných predchádzajúcich operáciách na testis alebo ak nádor prerastá do obalov testis. K relapsu po adjuvantnej rádioterapii dochádza v 3–4 % prípadov, väčšinou mimo ožiarenej oblasti, preto sa rieši chemoterapiou.
Za alternatívu k rádioterapii u pacientov so seminómom v I. klinickom štádiu sa považuje taktika tzv. prísneho dohľadu, ktorá spočíva v pravidelnom sledovaní pacientov po samotnej orchiektómii a až po zistení progresie ochorenia v rádioterapii. K relapsu dochádza v 15–20 % prípadov a rieši sa buď rádioterapiou alebo chemoterapiou. Rizikovým faktorom, ktorý je kontraindikáciou k taktike prísneho dohľadu, je veľkos nádoru > 4 cm a invázia do rete testis.
Ďalšou alternatívou je v súčasnosti použitie adjuvantnej chemoterapie. Použitím 2 cyklov monoterapie karboplatinou dochádza k výraznejšej minimalizácii rizika relapsu oproti jednému cyklu, kde sa popisovalo riziko v 3–4 % [18]. Prípadný lokoregionálny relaps možno rieši rádioterapiou.
Vo včasnom II. klinickom štádiu - II.A a II.B (zväčšenie lymfatických uzlín retroperitonea do 5 cm v priemere) je štandardnou liečbou seminómov pooperačná rádioterapia. Cieľovou oblasou sú tiež paraaortálne, parakaválne a homolaterálne (v II.B štádiu bilaterálne) panvové lymfatické uzliny. Pri ožarovaní bilaterálnych panvových lymfatických uzlín má pole tvar obráteného „Y“ s krytím stredu. Používa sa technika protiľahlých polí. Ožaruje sa denne. Celková dávka je 30, resp. 36 Gy [3]. Alternatívou rádioterapie je pri II.B štádiu chemoterapia (2 cykly BEP kombinácie - BEP: bleomycín, etopozid, cisplatina).
V pokročilých štádiách seminómu - II.C a III. (rozsiahle pakety lymfatických uzlín v retroperitoneu, metastázy v lymfatických uzlinách mediastína a orgánové metastázy) je indikovaná primárna chemoterapia - 3 cykly BEP alebo 4x EP (EP - etopozid, cisplatina). Ak sa po nej pri CT-vyšetrení nezistí reziduálna masa, je indikovaná observácia. V prípade nálezu reziduálnej masy sa indikuje PET-vyšetrenie (PET - pozitrónová emisná tomografia). Ak je PET--nález negatívny, indikovaná je observácia, ak je pozitívny, prichádza do úvahy buď biopsia a tzv. záchranná systémová liečba, buď rádioterapia alebo chirurgická resekcia. Ak nie je PET-vyšetrenie dostupné a reziduálna masa v retroperitoneu je > 3 cm, indikovaná je lymfadenektómia alebo rádioterapia, ak je menšia, pacienta možno observova. Pri progresii ochorenia po chemoterapii prvej línie je indikovaná záchranná chemoterapia [4,19].
Zmiešané germinatívne nádory (kombinácia seminómu s neseminomatóznou zložkou) sa liečia ako neseminomatózne nádory.
Liečba neseminomatóznych nádorov (NSNT)
Štandardnou liečbou včasných štádií NSNT (I. štádium, II.A a II.B štádium - zväčšenie lymfatických uzlín retroperitonea do 5 cm v priemere) bola donedávna retroperitoneálna lymfadenektómia (RPLA). Touto operáciou sa neodstraňovali len metastázy v regionálnych lymfatických uzlinách, ale získaval sa aj presnejší obraz o rozsahu ochorenia než klinickými metódami.
Rozsah RPLA určuje klinické štádium ochorenia, resp. peroperačný nález na regionálnych lymfatických uzlinách. U pacientov v I. klinickom štádiu potvrdenom normálnym nálezom nezmenených lymfatických uzlín sa používa tzv. modifikovaná RPLA.
Pri modifikovanej RPLA sa odstraňujú všetky regionálne lymfatické uzliny na postihnutej strane, čo je dôležité z diagnostického aj liečebného hľadiska. Lymfatické uzliny na kontralaterálnej strane zostanú nedotknuté. Táto znížená radikalita má zabráni strate ejakulácie.
Pri bilaterálnej RPLA (u pacientov v II. klinickom štádiu) sa odstraňujú všetky lymfatické uzliny ležiace v okolí renálnych ciev, v okolí aorty a dolnej dutej žily až po bifurkáciu na postihnutej strane aj z oko-lia a. a v. iliaca communis až po odstup a. a v. iliaca interna. Laterálnu hranicu tvoria močovody. Suprahilárne tkanivo sa neodstraňuje. Tkanivo obsahujúce lymfatické uzliny sa odstraňuje spred aorty, v. cava inferior ako aj z priestorov medzi oboma cievami a močovodmi technikou „rozdeli a stiahnu“ [5,20].
Vzhľadom na mladý vek väčšiny pacientov najzávažnejším dôsledkom RPLA môže by strata ejakulácie s následnou trvalou infertilitou, ktorá vyplýva z iatrogénneho poškodenia ejakulačného oblúka, najmä po bilaterálnej RPLA.
Pretože RPLA ako samostatná metóda nedokázala vylieči metastázy v retroperitoneu, začala sa kombinova, spočiatku s rádioterapiou, neskôr s chemoterapiou. Napriek dobrým výsledkom RPLA v I. klinickom štádiu NSNT vznikla snaha obmedzi aj nepriaznivé následky tejto liečby.
Zavedením účinnej chemoterapie do komplexnej liečby testikulárnych nádorov sa spochybnila potreba rutínnej RPLA u pacientov v I. klinickom štádiu. Zlepšením diagnostických metód hodnotiacich rozsah ochorenia stratila RPLA význam aj ako tzv. štádiová operácia. Začiatkom 80. rokov uplynulého storočia sa začala vo viacerých centrách používa taktika tzv. prísneho dohľadu ako alternatíva k RPLA. Taktika prísneho dohľadu spočíva v pravidelnom sledovaní pacientov po samotnej orchiektómii a až po zistení progresie ochorenia v chemoterapii. Sledovanie spočíva v pravidelných kontrolách hladín nádorových markerov a vyšetrení CT hrudníka a brucha, resp. RTG hrudníka v postupne predlžujúcich sa intervaloch [6].
Metóda postupne získala veľkú popularitu, lebo u väčšiny pacientov sa výrazne zredukovala nepotrebná liečba. Pacienti, u ktorých došlo k progresii ochorenia, sa vyliečili pomocou účinnej chemoterapie obsahujúcej cisplatinu, resp. následnou chirurgickou liečbou reziduálnych metastáz. Dlhším sledovaním týchto pacientov však rástlo aj percento pacientov s progresiou (30–35 %), preto sa začali uplatňova rizikové faktory predpovedajúce možnos progresie ochorenia. Došlo k snahe urči skupinu tzv. rizikových pacientov, ktorí vyžadujú aktívnejší prístup k liečbe. V súčasnosti sa za rozhodujúci rizikový faktor považuje prítomnos vaskulárnej invázie v primárnom nádore. Títo pacienti vyžadujú buď primárnu adjuvantnú chemoterapiu - 2 cykly BEP (ak je v primárnom nádore prevaha embryonálneho karcinómu) alebo RPLA (ak je v primárnom nádore prevaha teratómu). Taktika prísneho dohľadu sa odporúča len u pacientov bez vaskulárnej invázie s rizikom progresie 10–15 % [7,8]. Progresia ochorenia sa rieši chemoterapiou.
Pri liečbe II.A a II.B klinického štádia NSNT sa používajú: RPLA s následným pozorovaním a chemoterapia pri výskyte recidívy, RPLA s následnou profylaktickou chemoterapiou u rizikových pacientov, prípadne u všetkých pacientov. V súčasnosti väčšina pracovísk používa primárnu chemoterapiu a chirurgickú liečbu rezervuje len na odstránenie reziduálnej masy v retroperitoneu po ukončení chemoterapie.
V pokročilých štádiách NSNT (II.C a III. klinické štádium) je prvým liečebným krokom primárna chemoterapia, väčšinou 3 cykly BEP alebo 4 cykly EP kombinácie.
Niektorí autori dokonca uvádzajú, že nie je potrebné zača liečbu pokročilého štádia nádoru testis orchiektómiou, lebo súčasné zobrazovacie a laboratórne vyšetrenia poskytujú dostatočný dôkaz o prítomnosti nádoru z germinatívnych buniek a zisk z rýchleho ovplyvnenia metastáz chemoterapiou je väčší ako výhody presnej histopatologickej klasifikácie nádoru. Napriek vyliečeniu metastáz chemoterapiou môže v testis perzistova ložisko reziduálneho vitálneho nádoru, preto je tzv. odložená orchiektómia plne odôvodnená [9]. V prípade perzistencie reziduálnej nádorovej masy v retroperitoneu alebo v pľúcach sa môže orchiektómia urobi súčasne s RPLA, resp. s pľúcnou metastazektómiou v "jednom sedení", t.j. pri jednej anestézii [10].
Z historického pohľadu bolo v 70. rokoch uplynulého storočia výrazným medzníkom v liečbe pokročilých štádií testikulárnych nádorov zaradenie cisplatiny do kombinovanej systémovej liečby. Testikulárne nádory boli jedným z prvých solídnych nádorových ochorení vyliečiteľných aj v pokročilom štádiu pomocou chemoterapie [11]. Neskôr zavedenie etopozidu do liečby NSNT ukázalo, že kombinácia BEP je rovnako účinná ako predtým používaná schéma PVB (cisplatina, vinblastín, bleomycín), ale jej toxicita je nižšia, a preto sa považuje v súčasnosti za „zlatý štandard“ [12].
Dalším dôležitým medzníkom bolo určenie optimálnej liečebnej stratégie. Podaním 4 kúr základnej schémy chemoterapie dosiahne 60–70 % pacientov kompletnú remisiu, t.j. normalizáciu nádorových markerov a vymiznutie RTG detekovateľných metastáz. Ak sa podaním 4 kúr chemoterapie nedosiahne kompletná remisia alebo aspoň normalizácia nádorových markerov, je nepravdepodobné, že pokračovanie v tej istej liečbe povedie k vyliečeniu pacienta. Ak sú hladiny nádorových markerov v norme, ale CT-vyšetrením sa zistí reziduálna nádorová masa, nie je ďalšia chemoterapia indikovaná, ale odporúča sa chirurgické odstránenie všetkých reziduálnych ložísk (metastázy v retroperitoneu, mediastíne alebo v orgánoch, napr. v pľúcach, ak je to technicky možné).
Pri racionálnom zdôvodnení chirurgie reziduálnych metastáz sa na prvom mieste uvádza získanie materiálu na histologické vyšetrenie a posúdenie nutnosti ďalšej liečby. Je zrejmé, že pacienti s nekrózou, fibrózou alebo so zrelým teratómom nevyžadujú ďalšiu liečbu. Pacientom so zrelým teratómom hrozí recidíva, ktorú možno rieši opätovnou operáciou. Nález vitálneho nádoru je spojený s vysokým rizikom recidívy a vyžaduje sekvenčnú chemoterapiu, lebo aj po úplnom odstránení reziduálnej masy môžu perzistova mikroskopické ložiská vitálneho nádoru. Pri chirurgickej resekcii reziduálnej masy sa vitálne ložisko zistí v 10–15 % prípadov, zrelý teratóm v 45 % a nález nekrotického, resp. fibrotického tkaniva v 45 % prípadov [13]. Nakoľko ani PET-vyšetrením nemožnoŠtandardným spôsobom liečby (chemoterapia + chirurgia reziduálnej masy) sa dá vylieči 70–80 % pacientov s pokročilým NSNT. ďalšia optimalizácia liečebných postupov sa uberá dvoma smermi. U pacientov, ktorých pravdepodobnos vyliečenia štandardným spôsobom je nízka, je snaha hľada agresívnejšie liečebné spôsoby. Naopak, u pacientov, u ktorých je pravdepodobnos vyliečenia vysoká, je snaha minimalizova podávanú chemoterapiu (redukova počet podávaných kúr) a nevystavova ich zbytočnej toxicite. Hľadajú sa prognostické kritériá, podľa ktorých by bolo možné rozdeli pacientov už pred začatím chemoterapie na skupinu s dobrou prognózou a skupinu so zlou prognózou (tab).
Table 1. International Germ Cell Consensus Classification [14]. ![International Germ Cell Consensus Classification [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f701a6d9c03540a30fef15205610115d.png)
Pacienti s metastatickým ochorením s „dobrou prognózou“ začínajú liečbu primárnou chemoterapiou (3 cykly BEP alebo 4 cykly EP). U skupiny pacientov so „stredne dobrou prognózou“ sú indikované 4 cykly BEP a u pacientov so „zlou prognózou“ 4 cykly VIP (etopozid, ifosfamid, cisplatina) [15].
Po základnej štandardnej liečbe pokročilých germinatívnych nádorov testis sa približne 80 % pacientov dostane do dlhodobej kompletnej remisie. Pacienti, ktorí nedosiahli kompletnú remisiu primárnou liečbou, a pacienti s recidívou ochorenia po dosiahnutí kompletnej remisie sú kandidátmi na tzv. „záchrannú liečbu“. Záchrannú liečbu štandardnou chemoterapiou, ktorá môže navodi dlhotrvajúcu kompletnú remisiu ešte u štvrtiny pacientov, podstupuje asi 20 % pacientov [13]. V individuálne indikovaných prípadoch sa používa vysokodávkovaná chemoterapia (HD CHT) s následným myeloprotektívnym režimom (autológna transplantácia kostnej drene, kmeňových buniek z periférnej krvi a aplikácia hemopoetických rastových faktorov). Za štandardnú záchrannú liečbu sa v súčasnosti považuje režim VIP (etoposid, ifosfamid, cisplatina) alebo VeIP (vinblastin, ifosfamid, cisplatina).
Použitie týchto liečebných režimov viedlo k vyliečeniu asi 20–30 % pacientov s recidívou ochorenia. Nahradenie etoposidu paklitaxelom zvyšuje kurabilitu o ďalších 10 % [16]. Aj kombinácia gemcitabin, paklitaxel a cisplatina sa ukazuje ako porovnateľná s režimom VIP alebo VeIP [22].
Ostáva asi 15 % pacientov s perzistenciou ochorenia aj po záchrannej liečbe 2. rady. Liečba týchto pacientov je individuálna, závisí od celkového stavu ochorenia, od odpovede na predchádzajúcu liečbu a od prognostických faktorov [13].
PREVENCIA
V prevencii vzniku nádoru v retinovanom testis je nevyhnutné zabezpeči úpravu jeho polohy už v predškolskom veku, optimálne do konca 2. roku života. Nevhodné je vyčkáva do puberty na prípadný spontánny zostup semenníkov. U pacientov s retenciou testis po puberte nemá orchidopexa miesto v liečbe tejto polohovej anomálie, lebo ide o orgán z hľadiska fertility bezcenný, kozmetický efekt je už aj tak narušený atrofiou semenníka a operácia nezníži riziko malignizácie. Preto prípady jednostrannej retencie testis v postpubertálnom veku treba rieši orchiektómiou.
V školách by sa mala zdravotná výchova okrem výchovy sexuálnej orientova aj na onkologické ochorenia s upozornením na vhodnos samovyšetrovania semenníkov u všetkých mužov od 15. roku života (obr).
Image 1. Samovyšetrovanie semenníkov. 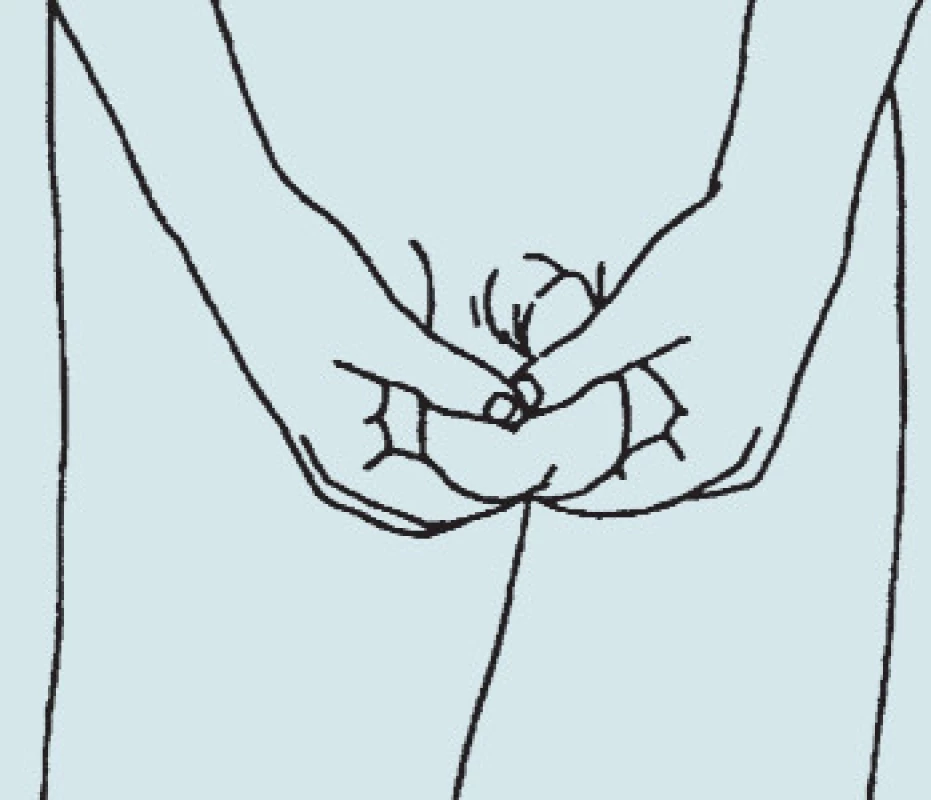
Treba prija zásadu vyšetrova vonkajší genitál u všetkých pacientov mužského pohlavia vo veku nad 15 rokov, ktorí sú prijatí do nemocnice, ako súčas komplexného fyzikálneho vyšetrenia, v ambulantnej praxi pri všetkých prehliadkach typu vstupných, periodických a pod.
Každé podozrenie na nádor by malo vies k neodkladnej chirurgickej revízii z ingvinálneho prístupu a po potvrdení diagnózy k radikálnej orchiektómii v celkovej anestézii ako prvej etape komplexnej liečby.
ZÁVER
Liečba germinatívnych nádorov testis je optimistickou kapitolou súčasnej klinickej onkológie. Prognóza ochorenia však závisí predovšetkým od histologického typu nádoru a od klinického štádia ochorenia, ale aj od poznania prognostických a prediktívnych faktorov ochorenia, ich správnej interpretácie a od presného dodržiavania terapeutických režimov [17]. Celkove má 60-100 % pacientov, ktorí sa liečili pre testikulárny nádor, šancu dlhodobo prežíva, a to práve vďaka súčasnému pokroku v diagnostike a komplexnej liečbe.
prof. MUDr. Dalibor Ondruš, DrSc.
I. onkologická klinika LF Univerzity Komenského a Onkologického ústavu sv. Alžbety, Bratislava
Sources
1. Weissbach L. Guidelines for the diagnosis and therapy of testicular cancer and new developments. Urol Int 1999; 63(1): 46-56.
2. Heidenreich A, Holtl W, Albrecht W, Pont J, Engelmann UH. Testis-preserving surgery in bilateral testicular germ cell tumours. Br J Urol 1997; 79(2): 253-257.
3. Molnárová A. Úloha rádioterapie v liečbe seminómov. Klin Onkol 1996; 9 : 9-10.
4. Albers P, Albrecht W, Algaba F, Bokemeyer C, Cohn-Cedermark G, Horwich A, Klepp O, Laguna MP, Pizzocaro G. EAU Guidelines on Testicular Cancer. Arnheim: EAU Healthcare Office 2005 : 52.
5. Zvara V, Horňák M. Urologické operácie. Martin: Osveta 1983 : 224.
6. Peckham MJ, Barrett A, Husband JE, Hendry WF. Orchidectomy alone in testicular stage I nonseminomatous germ cell tumors. Lancet 1982; 2(8300): 678-680.
7. Albers P, Siener R, Kliesch S, Weissbach L, Krege S et al. Risk factors for relapse in clinical stage I nonseminomatous testicular germ cell tumors. Results of the German Testicular Cancer Study Group Trial. J Clin Oncol 2003; 21(8): 1505-1512.
8. Ondruš D. Dlhodobé skúsenosti s diferencovaným liečebným prístupom u pacientov s neseminomatóznym nádorom testis v I. klinickom štádiu. Urológia 2003; 9(3): 20-25.
9. Greist A, Einhorn LH, Williams SD, Donohue JP, Rowland RG. Pathologic findings at orchiectomy following chemotherapy in disseminated testicular cancer. J Clin Oncol 1984; 2(9): 1025-1027.
10. Ondruš D, Horňák M, Breza J, Maoška J, Schnorrer M et al. Delayed orchiectomy after chemotherapy in patients with advanced testicular cancer. Int Urol Nephrol 2001; 32(4): 665-667.
11. Einhorn LH, Donohue JP. Cis-diamminedichloroplatinum, vinblastine, bleomycin combination chemotherapy in disseminated testicular cancer. Ann Intern Med 1977; 87(3): 293-298.
12. Peckham MJ, Barrett A, Liew KH, Horwich A, Robinson B et al. The treatment of metastatic germ cell testicular tumours with bleomycin, etoposide and cisplatin (BEP). Br J Cancer 1983; 47(5): 613-619.
13. Abrahámová J. Terapie testikulárních germinálních nádorù. In: Dvoøáček J, Babjuk M (eds). Onkourologie. Praha: Galén 2005 : 495-501.
14. International Germ Cell Cancer Collaborative Group. International Germ Cell Consensus Classification: A Prognostic Factor-Based Staging System for Metastatic Germ Cell Cancers. J Clin Oncol 1997; 15(2): 594-603.
15. Schmoll HJ, Souchon R, Krege S, Albers P, Beyer J et al. European consensus on diagnosis and treatment of germ cell cancer: a report of the European Germ Cell Cancer Consensus Group (EGCCCG). Ann Oncol 2004; 5(9): 1377-1399.
16. Mardiak J, Šálek T, Syčová-Milá Z, Obertová J, Hlavatá Z, Mego M, Rečková M, Koza I. Paclitaxel plus ifosfamide and cisplatin in second-line treatment of germ cell tumors: a phase II study. Neoplasma 2005a; 52(6): 497-501.
17. Mardiak J. Liečba pokročilých nádorov z germinatívnych buniek. Via Practica 2005; 2(Suppl 1): 42-45.
18. Reiter WJ, Brodowicz T, Alavi S, Zielinski CC, Kozak W, Maier U, Nost G, Lipsky H, Marberger M, Kratzik C. Twelve-year experience with two courses of adjuvant single-agent carboplatin therapy for clinical stage I seminoma. J Clin Oncol 2001; 19(1): 101-104.
19. Motzer RJ, Boston B, Carducci MA, Fishman M, Hancock SL et al. Clinical Practice Guidelines in Oncology. Testicular Cancer, version 1.2006. National Comprehensive Cancer Network 2005 : 35.
20. Horňák M, Maťoška J. Nádory testis, diagnostika a liečba. Bratislava: Veda 1990 : 260.
21. Chung PW, Jewett MA, Warde PR. Testicular radiation for primary seminoma in a solitary testis. Can J Urol 2006; 13(1): 2975-2977.
22. Mardiak J, Šálek T, Syčová-Milá Z, Obertová J, Hlavatá Z, Mego M, Rečková M, Koza I. Gemcitabine plus cisplatine and paclitaxel (GCP) in second-line treatment of germ cell tumors (GCT): a phase II study. Neoplasma 2005b; 52(3): 243-247.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2006 Issue 3-
All articles in this issue
- LYMFATICKÁ DRENÁŽ VARLETE
- BIOLOGICKÉ CHOVÁNÍ GERMINÁLNÍCH NÁDORŮ VARLETE
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- NÁDORY TESTIS: EPIDEMIOLÓGIA, ETIOLÓGIA, PATOLÓGIA A DIAGNOSTIKA
- LIEČBA NÁDOROV TESTIS
- NÁDORY VARLAT - CHIRURGICKÉ ŘEŠENÍ
- ROLE RADIOTERAPIE V LÉČEBNÉ STRATEGII NÁDORŮ VARLAT
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- LYMFATICKÁ DRENÁŽ VARLETE
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

