-
Medical journals
- Career
Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
Authors: M. Hermanová 1; R. Matěj 2; J. Dušková 3; E. Honsová 4; M. Tichý 1
Authors‘ workplace: I. patologicko-anatomický ústav, FN u sv. Anny v Brně a Lékařská fakulta Masarykovy univerzity: Prof. MUDr. M. Hermanová, Ph. D. 1; Oddělení patologie a molekulární medicíny, Thomayerova nemocnice: Doc. MUDr. R. Matěj, Ph. D. 2; Ústav patologie, Všeobecná fakultní nemocnice v Praze a 1. lékařská fakulta Univerzity Karlovy: Doc. MUDr. P. Dundr, Ph. D. 3; Pracoviště klinické a transplantační patologie, Institut klinické a experimentální medicíny: Doc. MUDr. E. Honsová, Ph. D. 4
Published in: Rozhl. Chir., 2014, roč. 93, č. 2, s. 100-106.
Category: Various Specialization
Práce je určena k postgraduálnímu vzdělávání lékařů.
Overview
Definice bezpečných resekčních okrajů u nádorů parenchymatózních orgánů je předmětem častých diskuzí a řady studií. Pro parenchymatózní orgány obecně není téma bezpečných resekčních okrajů jednotné a má řadu orgánových specifik. Situaci současně komplikuje řada kontraverzí v diagnostických kritériích a definicích pozitivních resekčních okrajů, v indikacích peroperačního vyšetření resekčních linií a v prognostickém významu postižení resekčních linií v různých parenchymatózních orgánech. Vysoce žádoucí je rovněž dosažení konsenzu v terminologii a standardizace protokolů pro histopatologické vyšetření v jednotlivých diagnostických oblastech.
Klíčová slova:
resekční okraje – nádory parenchymatózních orgánůResekční okraje u pankreatického karcinomu – duktálního adenokarcinomu pankreatu
Podíl R1 resekcí pankreatického karcinomu je v různých studiích vysoce variabilní a kolísá mezi 20 a 80 %. Standardizace protokolů pro zpracování resekátů pankreatu s karcinomem má zásadní význam, studie vykazující vyšší podíl R1 resekcí (nad 70 %) ve studovaných souborech pracují s novou technikou založenou na zpracování resekátů pankreatoduodenektomie využívající sériového přikrojení v rovině kolmé na podélnou osu sestupného úseku duodena bez narušení struktur vývodů a tumoru [1,2]. Tento přístup umožňuje validní vyšetření všech resekčních linií i volných anatomických povrchů (tzv. Leeds Pathology Protocol (LEEPP)) [3]. Současná absence konsenzu v terminologii (zejména definice mikroskopického postižení resekčních linií) však limituje validitu příslušných klinických studií [4]. Prognostický význam mikroskopického postižení resekčních linií není u pankreatického karcinomu dosud spolehlivě potvrzen [1].
Metodiky zpracování resekátů pankreatoduodenektomie pro histopatologické vyšetření:
V současnosti jsou využívány tři hlavní přístupy vzájemně se lišící zvolenými rovinami přikrojení a podélným otevřením vývodů, žlučového a pankreatického [1]. Standardem společným pro všechny přístupy je označení povrchů resekátu barevnými inkousty/tušemi.
- Tradiční technika s nasondováním vývodů a přikrojením jedním či více řezy v rovině definované nasondovanými vývody. Následné tkáňové řezy takto „rozpolceného“ resekátu hlavy pankreatu jsou prováděny kolmo k průběhům uvedených vývodů tak, aby byla zastižena i tuší značená retroperitoneální/zadní resekční linie.
- Sériové přikrojení podél osy kolmé k rovině pankreatického krčku představuje sporný přístup vedoucí k suboptimálnímu blokování oblasti ampuly a přiléhajících úseků žlučového a pankreatického vývodu. Některými autory je doporučována modifikace tohoto přístupu využívající získání tkáňových řezů kolmo k ose definované zakřivením hlavy pankreatu. Získané tkáňové řezy však nejsou striktně paralelní, nýbrž klínovité.
- V současnosti je doporučovaná a preferovaná technika sériového přikrojení v rovině kolmé na podélnou osu sestupného úseku duodena (v axiální rovině jako na počítačové tomografii či magnetické rezonanci), bez narušení struktur vývodů a tumoru (dle LEEPP) [3]. Získané tkáňové řezy (obvykle 12 a více) umožňují relativně snadnou orientaci a odběr tkáňových vzorků pro histologické vyšetření se zastižením vztahu ke všem sledovaným strukturám (ampula, žlučový i pankreatický vývod, duodenum). Uvedený přístup rovněž umožňuje kompletní vyšetření okrajů resekátu (chirurgických resekčních linií i volných povrchů), korelaci s vyšetřeními zobrazovacími metodami i trojrozměrnou rekonstrukci infiltrátu za účelem stanovení přesné lokalizace a rozměrů (Obr. 1).
Image 1. Schéma přikrojení resekátu hemipankreatoduodenektomie dle LEEPP Hlava pankreatu je po označení resekčních linií a volných anatomických povrchů barevnými inkousty/tušemi sériově přikrojena v rovinách kolmých na podélnou osu sestupného úseku duodena. V každém ze získaných tkáňových řezů lze posoudit vztah k cirkumferenčním okrajům resekátu a pankreatický i žlučový vývod mohou být posouzeny v celém svém průběhu. Fig. 1: The scheme of tissue sampling of the hemipancreatoduodenectomy specimen using the LEEPP Following multicolour inking of resection margins and free anatomical surfaces, the pancreatic head is serially sectioned in planes perpendicular to the longitudinal axis of the descending duodenum. In every specimen slice, it is possible to evaluate the relationship to circumferential margins of the resection specimen and pancreatic and common bile duct can be examined in their entire length. 
Předpokladem záchytu diagnostické léze, jejího vztahu ke sledovaným strukturám a validního vyšetření resekčních linií i volných povrchů je extenzivní blokování tkáňových vzorků [2]. Při vyšetřování resekátů s pankreatickým karcinomem je situace komplikována faktem, že přesná identifikace hranic nádorového infiltrátu makroskopicky obvykle není možná. Hlavní příčinou je desmoplastická reakce ve stromatu pankreatického karcinomu i ve tkáních chronické pankreatitidy obstrukčního typu vyjádřené na periferii tumoru a obvykle infiltrativní charakter invazivní fronty tumoru [5]. K výše uvedenému přispívá i fakt, že duktální adenokarcinom pankreatu může hluboce infiltrovat přiléhající nenádorovou tkáň pankreatu, aniž by ji výrazněji destruoval, a infiltrovat peripankreatickou tukovou tkáň, často v podobě solitárních izolovaných duktů (tzv. „solitary naked ducts“) bez perifokální desmoplastické reakce [6]. Tyto skutečnosti mohou vést nejen k podhodnocení velikosti tumoru a stadia nádorového onemocnění, ale také k falešně negativnímu vyhodnocení mikroskopického postižení resekčních linií. Přesnost vyšetření resekčních linií je tedy výrazně ovlivněna zvolenou metodikou zpracování resekátů karcinomu pankreatu a rozsahem blokování tkáňových vzorků [1].
Terminologie resekčních linií:
Terminologie transsekčních resekčních linií (žaludku/proximálního duodena, distálního duodena, pankreatu (krčku pankreatu) a žlučovodu) je jednotná a mezinárodně akceptovaná. Absence konsenzu se týká cirkumferenčních resekčních linií/povrchů, u nichž jsou v literatuře uváděné pojmy značně nejednotné [7]. Cirkumferenční linie resekátu hemipankreatoduodenektomie zahrnují zadní cirkumferenční resekční linii, přední cirkumferenční linii/povrch a linie/povrchy směřující k véně a arterii mesenterica superior (Obr. 2). S těmito termíny pracuje i LEEPP [3] s potenciálem mezinárodního akceptování odbornou veřejností.
Image 2. Cirkumferenční okraje v resekátu hemipankreatoduodenektomie Zahrnuje zadní cirkumferenční resekční linii, přední cirkumferenční linii/povrch a linie/povrchy směřující k véně (SMV) a arterii mesenterica superior (SMA). Fig. 2: The circumferential margins in hemipancreatoduodenectomy specimen Include the posterior circumferential resection margin, anterior circumferential margin/surface and margins/surfaces facing the superior mesenteric vein (SMV) and superior mesenteric artery (SMA). 
Diagnostická kritéria mikroskopického postižení resekčních linií:
Představují kontroverzní téma a úplného konsenzu v této oblasti nebylo dosud dosaženo. V řadě center celosvětově je pro diagnózu R1 resekce vyžadována přítomnost nádorových buněk přímo v resekční linii (tzv. 0 mm „clearance“). Řada center zejména v Evropě však definuje R1 resekci vzdáleností nádorových buněk od vlastní resekční linie menší než 1 mm. Tento přístup podporuje skutečnost, že pankreatický karcinom patří mezi nádory rostoucí často nekohezivně s infiltrativním charakterem invazivní fronty [5] a uplatnění principu 0 mm „clearance“ nezaručuje kompletní resekci [8]. Požadavek na minimálně 1mm „clearance“ je v tomto směru zdůvodnitelný a na významu nabývající LEEPP tento princip aplikuje. Oprávněný je odlišný přístup k hodnocení přítomnosti nádorových buněk v předním pankreatickém povrchu, který není chirurgickou resekční linií, ale volným anatomickým povrchem a uplatnění principu 0 mm „clearance“ zde má své opodstatnění [1].
Otázka hodnocení přítomnosti nádorových buněk v krevních a lymfatických cévách a perineurálních prostorách v rámci hodnocení mikroskopického postižení resekčních linií není dořešena a literatura postrádá v tomto směru validní data. Pokud pracujeme s definicí „International Union Against Cancer“ (UICC), podle které je R1 status definován jako mikroskopická reziduální choroba, pak přítomnost nádorových buněk v uvedených strukturách v liniích resekce oprávněně klasifikujeme jako R1.
Prognostický význam mikroskopického postižení resekčních linií:
Duktální adenokarcinom pankreatu je fatální ve většině případů, s celkovým 5letým přežitím nepřesahujícím 5 %. Pouze 15–20 % pacientů má v době diagnózy resekabilní karcinom a 5leté přežití těchto pacientů dosahuje 7–25 %. Resekabilita pankreatického karcinomu je nejsilnějším determinantem prognózy. Postižení lymfatických uzlin a stupeň diferenciace tumoru (grade) představují rovněž akceptované nezávislé prognostické faktory [9]. Vliv mikroskopického postižení resekčních linií (R1 status) na celkové a celkové bezpříznakové přežití není jednoznačně prokázán. Počet studií prezentujících signifikantní korelaci mezi statem R a přežitím je srovnatelný s počtem studií, které tuto závislost neprokázaly [1]. Základní charakteristiky souborů se neliší, studie byly provedeny ve specializovaných centrech. Studie se však lišily v počtu a lokalizaci vyšetřených resekčních linií a také v diagnostických kritériích mikroskopického postižení resekčních linií.
V příslušných souborech také výrazně kolísá podíl R1 resekcí (mezi 17–85 %). Data o přežití pacientů však tyto výrazné rozdíly v podílu R1 resekcí neodrážejí. Vysoký podíl R1 resekcí (>70 %) byl zaznamenán ve studiích, které využívaly pro zpracování resekátu LEEPP. Tradiční metody byly aplikovány ve studiích s nižším podílem R1 resekcí.
Vzhledem ke skutečnosti, že u 50–80 % s předpokládanou R0 resekcí dojde k lokální rekurenci tumoru, lze předpokládat, že při aplikaci tradičních metod zpracování resekátu pankreatoduodenektomie dochází k podhodnocení statu R a skutečný podíl R1 resekcí je vyšší, jak ukazují recentní studie pracující s LEEPP. Současně nelze opomenout fakt, že přežití je ve srovnání s lokální rekurencí tumoru ovlivněno signifikantněji rozvojem vzdálených metastáz.
Současně nebylo prokázáno delší přežití pacientů s pankreatickým karcinomem, u kterých byla na základě výsledků peroperačního vyšetření pankreatické resekční linie rozšířena resekce tak, aby bylo dosaženo negativních okrajů [10]. Peroperační vyšetření pankreatické resekční linie sice signifikantně zvyšuje pravděpodobnost dosažení R0 resekce, prediktivní význam pro přežití pacientů však dle dostupných literárních údajů nemá [11,12].
Nejednotnost v terminologii, definicích a způsobech zpracování resekátů pankreatoduodenektomie, které vedou ke značně divergentním výsledkům, jež se týkají statu R s řadou konsekvencí, je alarmující. Absence mezinárodního konsenzu mezi chirurgy, patology a onkology je citelná zejména v oblasti definování cirkumferenčních resekčních linií a mikroskopického postižení resekčních linií. I přesto, že není spolehlivě prokázána korelace mezi mikroskopickým postižením resekčních linií a přežitím, je standardizace protokolů pro zpracování a hodnocení pankreatických resekátů vysoce žádoucí. Aplikace LEEPP pro zpracování resekátů pankreatoduodenektomie do rutinní praxe představuje možnou cestu k naplnění tohoto požadavku.
Resekční okraje u nemalobuněčného plicního karcinomu
Prognóza nemalobuněčného plicního karcinomu (NSCLC) je zásadně závislá na stadiu, nejvyšší přežití je u časných stadií. Bohužel velká část NSCLC je diagnostikována v pokročilejších fázích onemocnění, často již jako generalizované či inoperabilní procesy. Kompletní chirurgická resekce (R0 resekce) je podstatou nejlepší šance pro vyléčení obecně pro všechny případy až do klinického stadia IIIA [13]. I přesto jsou pacienti, kteří byli léčeni optimálně kompletní chirurgickou resekcí, ohroženi lokální recidivou mezi 13–45 % ve stadiu I a 17–55 % ve stadiu II. R1 (mikroskopicky pozitivní resekční linie) a R2 (makroskopicky pozitivní resekční linie) výrazně zhoršují prognózu a zvyšují riziko lokoregionální recidivy nádorového procesu. Podíl R1 resekcí u operabilních NSCLC je v různých studiích vysoce variabilní a pohybuje se od 4 % až do 20 % s tím, že tito pacienti mají medián přežití 23 měsíců a pětileté přežití nepřekračuje 30 %, u některých subtypů R1 se však limitně blíží 0 %. U R2 resekcí je navíc výrazně zvýšená perioperační letalita výkonu (až 25 % pacientů zemře v průběhu 30 dní) a roční přežití se blíží 0 % [14,15].
V současnosti je obecně akceptovaným standardem chirurgické resekce NSCLC nádoru prostá bronchiální resekční linie. Definice „bezpečné“ vzdálenosti resekční linie bronchu od makroskopicky patrného nádoru je předmětem debat v mnoha studiích. Pohybuje se mezi 15–30 mm s tím, že někteří autoři dokonce navrhují odlišnou vzdálenost pro adenokarcinomy (20 mm) a skvamocelulární karcinomy (15 mm) [16,17,18]. Kara et al. uvádí, že při vzdálenosti 15 mm je resekční linie bronchu mikroskopicky prosta nádoru v 93 % případů, toto pozorování však nebylo dosud korelováno s dlouhodobým follow-up a dlouhodobou prognózou pacientů [19]. Pokud by vzdálenost „bezpečné“ linie resekce přímo závisela na vzdálenosti resekční linie od nádoru, měla by být prognóza pacientů této vzdálenosti úměrná, doposud však žádná taková studie, která by se porovnáním těchto údajů zabývala, nebyla provedena. Definice „bezpečné“ vzdálenosti resekční linie by totiž mohla mít přímý dopad na extenzivitu chirurgického zásahu. Byla-li by vzdálenost nedostatečná u lobektomie, potenciálně by přibylo agresivnějších resekčních výkonů (pneumonektomií) se všemi důsledky komplikací takových výkonů či výrazným nárůstem podílu inoperabilních případů. Dalším problémem je potenciální adjuvantní protinádorová terapie, protože reoperace bývá povětšinou technicky nemožná.
Terminologie a klasifikace pozitivních resekčních linií:
R1 pozitivní resekční linie je:
- Postižení vnitřní části bronchiální stěny, buď ve formě postižení sliznice in situ karcinomem (CIS), nebo karcinomem s invazí do submukózy.
- Postižení vnějších úseků bronchiální stěny přímou invazí vlastní primární nádorové léze nebo invazí nádoru přímo prorůstajícího z metastatického postižení okolních lymfatických uzlin.
- Nádorová lymfangiopatie lymfatických cév submukózních či peribronchiálních.
- Detekce fragmentů nádoru intraluminálně v bronchu u papilárního či polypoidního tumoru bez jednoznačné souvislosti se sliznicí.
Prognosticky nejméně závažný je subtyp CIS, jehož stanovení je však zatíženo největší mírou nepřesnosti, zejména v peroperačních zmrazených/kryostatových tkáňových řezech. Na rozdíl od CIS je totiž různá míra dysplázie metaplastického skvamocelulárního epitelu v resekční linii bronchu v současné době hodnocena jako R0 (Obr. 3). Bohužel přesná definice rozdílu mezi high grade dysplázií a CIS není jednoznačně stanovena a ze současných studií plyne možnost budoucího využití prediktivních molekulárně-biologických markerů [16, 17,18].
Image 3. Dysplázie dlaždicobuněčného metaplastického epitelu resekční linii bronchu Původní zvětšení 400x, přehledné barvení hematoxylin-eosin. Fig. 3: Dysplasia of squamocellular metaplastic epithelium in bronchial resection margin. Original magnification 400x, hematoxylin-eosin stain. 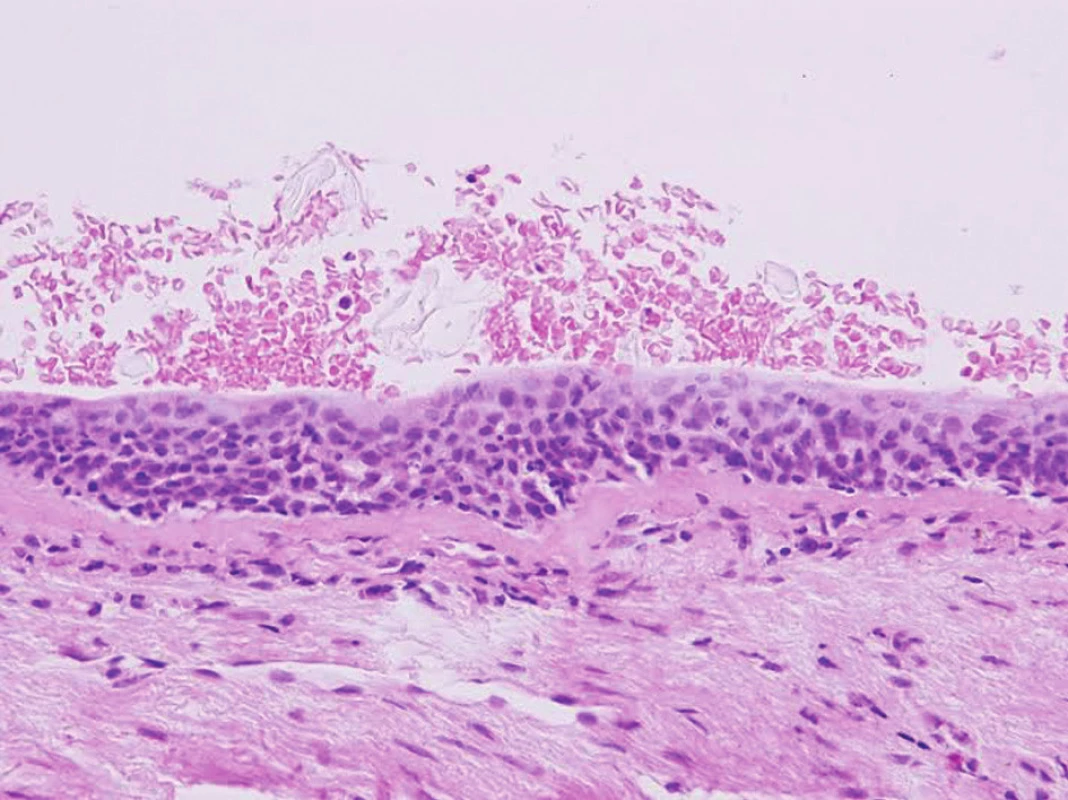
Metodiky zásadní pro histopatologické vyšetření:
V současnosti jsou využívány dva hlavní přístupy stanovení nádoru prosté resekční linie vzájemně se lišící technikou operačního přístupu:
V současné době čím dál více užívaný přístup chirurgické plicní biopsie otevřenou či videoasistovanou thorakotomií (VATS), která šetří plicní parenchym a je nejvhodnější pro periferní nádorové léze či odstraňování metastáz. Tento přístup je zpravidla iniciálním zásahem určeným pro histopatologické zařazení léze a vlastní radikální chirurgický zásah následuje ve druhé době, ať už klasickou otevřenou lobektomií s mediastinální lymfadenektomií, či resekčním výkonem v rámci rychle se rozšiřujících endoskopických výkonů (VATS). U tohoto přístupu, zejména s ohledem na lokalizaci nádorové léze, už zpravidla není potřeba resekční linii bronchu peroperačně ověřovat, resekční linie je nádoru prosta [15,18].
Peroperační ověření nádorového postižení resekční linie bronchu prostřednictvím biopsie zmrazeného materiálu (kryostatových tkáňových řezů) je standardně užívaným postupem u centrálněji lokalizovaných tumorů bez makroskopického postižení lobárního bronchu. V literatuře je poměrně značné množství kontroverzí spojených s užíváním tohoto postupu, zejména s ohledem na možnou falešnou pozitivitu a falešnou negativitu. V recentním článku o užití peroperačního vyšetření ze zmrazeného vzorku resekční linie bronchu Owenová et al. dokládají, že pozitivita resekčního okraje byla zaznamenána u 2,2 % případů a ani u jediného nevedla ke změně operačního zásahu vzhledem k nemožnosti provedení radikálnějšího zásahu, ať už z důvodů technických, či biologických [14]. Skutečná falešná pozitivita byla pozorována jen u 0,4 % případů, zatímco u 5,9 %, kde nebyla peroperační biopsie indikována, nebyl zaznamenán tumor ani v definitivním histopatologickém vyšetření resekční linie bronchu. Autoři proto doporučují velmi cílené užívání této metodiky [14]. Zcela zásadní roli však peroperační vyšetření resekční linie bronchu hraje u některých vzácnějších subtypů NSCLC, u nichž je sklon k šíření v bronchiální stěně známý. Proto by tento přístup měl být využíván u tzv. nádorů typu ze slinných žláz („salivary gland type“), zejména u adenoidně-cystického a mukoepidermoidního karcinomu [18].
Kompletní chirurgická resekce tumorózní léze u NSCLC je zásadní pro prognózu pacienta. Její stanovení není jednoznačně definováno, stejně jako standardizovaný postup pro stanovení tzv. bezpečné vzdálenosti okraje resekce od makroskopicky zřetelné tumorózní masy. Obecně používaná technika peroperačního vyšetření resekčního okraje bronchu ze zmrazeného tkáňového vzorku má své místo zejména u některých typů nádorů, její paušální užívání však je předmětem sporů. Samostatným problémem je pak nález skvamocelulárního CIS v resekční linii a jeho odlišení od nijak specificky definované cytologické dysplázie vysokého stupně. I vzhledem ke všem těmto kontroverzím a stále více se rozvíjejícím endoskopickým operačním přístupům se zřejmě jednotného standardu těžko v dohledném časovém horizontu dočkáme.
Vyšetření linie resekce v chirurgickém řešení renálních karcinomů
Renální tumory vzhledem ke své lokalizací a pozdním příznakům bývají často odhaleny až v pokročilém stadiu, některé jsou však diagnostikovány ještě v bezpříznakovém období jako tzv. incidentalomy. Celosvětově se prosazuje trend ošetřit menší tumory do průměru 40 mm omezené na ledvinu (pT1a) parciální nefrektomií (tzv. „nephron - sparing surgery“), ať už klasickou otevřenou technikou, laparoskopicky, nebo roboticky [20–22].
Na rozdíl od nádorů pankreatu, bronchů nebo i karcinomu prsu je však dle dostupných literárních údajů význam pozitivity nebo negativity resekčních okrajů malý. V metaanalytických studiích Marszalka et al. [23] a Borghesiho et al. [24] se udává incidence pozitivních okrajů obdobná: po klasické otevřené resekci 0–7 %, po laparoskopické operaci 0,7–4 %, po robotické operaci 3,9–5,7 % [23] a 0–7 % pozitivních okrajů celkově, bez rozdílu operačních technik [24].
Vzdálenost tumoru od resekčních okrajů (tj. šíře negativního okraje) rovněž nehrála roli ve frekvenci recidiv, pokud bylo dosaženo kompletní resekce (R0). Za dostačující je považována šíře negativního okraje tloušťky 5 mm [25]. Avšak ani většina pacientů s pozitivními okraji neměla ve střednědobém sledování lokální nebo vzdálené projevy onemocnění.
Peroperační vyšetření resekčních okrajů není nutné, zpravidla koreluje s makroskopickým nálezem stanoveným chirurgem. Omezený význam peroperačního vyšetření resekčních okrajů zdůrazňuje i studie 76 pacientů z USA [26], kde je tento postup přímo označován za neekonomický bez většího přínosu, pokud chirurg vidí, že resekuje ve zdravé tkáni. Obdobně i další americká studie [27], která vidí význam peroperačního vyšetření u exofytických tumorů a laparoskopických výkonů. V této studii sice bylo peroperačním vyšetřením statisticky významně sníženo procento pozitivních okrajů a prodloužen interval do recidivy nádoru ve skupině pacientů s laparoskopickou, nikoli však otevřenou technikou parciální nefrektomie.
Ani v případě pozitivních resekčních okrajů není jednoznačně doložena nutnost doplnění totální nefrektomie. Izraelská studie 17 pacientů s pozitivními okraji [28], z nichž pět se podrobilo okamžité konverzi parciální nefrektomie v totální, nalezla nádorové buňky v reziduu pouze u dvou, další 4 pacienti ze skupiny měli odloženou nefrektomii bez nálezu nádoru a ostatní dlouhodobě přežívali bez nádoru (dva zemřeli z jiné příčiny) – pětileté přežití v této skupině bylo 98,2 % a autoři dovozují, že pozitivní resekční linie není důvodem k radikální nefrektomii. Podobně nedoložila význam pozitivního resekčního okraje pro předpověď recidivy ani další studie [29] s dlouhodobým sledováním (9–31 měsíců). Všichni 4 pacienti z 537 operovaných, kteří rozvinuli recidivu, měli negativní resekční okraje.
Závěrem lze tedy konstatovat, že v současně publikovaném písemnictví převažuje následující postoj:
- Parciální nefrektomie (tzv. „nephron-sparing surgery“) představuje v současné době postup lege artis pro tumory menší než 40 mm, omezené na ledvinu.
- Prediktivní význam histologického vyšetření resekční linie, peroperačního i následného, není pro recidivu tumoru ve velkých sestavách doložen.
- Peroperační vyšetření resekční linie není standardem, je na indikaci chirurga a jeho význam je spíše zřejmý v laparoskopických výkonech.
- Prognostické faktory se odvíjejí od kombinace klasických deskriptorů (typing, grading, staging).
Resekční linie u resekcí jater
Na rozdíl od jiných parenchymových orgánů, při zvažování resekce jater vstupují do rozhodovacího procesu vedle čistě chirurgických faktorů (anatomická versus neanatomická resekce) ještě další velmi závažné skutečnosti, které potenciálně tento výkon limitují. Jde především o kvalitu jaterní tkáně (cirhóza versus zdravá játra) a množství jaterní tkáně, které zůstane po provedené resekci.
I přes velkou regenerační schopnost jater, ponechání nedostatečně velkého rezidua nebo rezidua s velmi omezenou funkcí bude následováno selháním jater a smrtí pacienta.
Pro pacienty s normálními játry je více než 20 % reziduálního objemu považováno za hranici, kdy lze výkon zvažovat. Pro pacienty s cirhózou nebo významnou nealkoholickou steatózou/steatohepatitidou nejsou pevná kritéria stanovena, nicméně ve většině center je považováno za limit zachování více než 40 % reziduální jaterní tkáně [30,31].
Resekce jater představuje metodu léčby pro mnoho typů ložiskových jaterních lézí, od benigních (adenomů) po maligní (primární nádory jater i metastázy do jater). Benigní afekce, které vyžadují resekci, jsou obvykle symptomatické nebo představují pro pacienta život ohrožující komplikaci. Nejčastější indikací k resekci jsou tedy maligní tumory (hepatocelulární karcinom (HCC), cholangiocelulární karcinom, metastázy kolorektálního karcinomu).
Velikost volných resekčních okrajů závisí na indikaci k resekci; benigní afekce jako adenom, fokální nodulární hyperplazie, hemangiom atd. mohou být řešeny enukleací nebo resekcí s minimálními okraji.
Data, která dokumentují význam volných resekčních okrajů při resekcích maligních tumorů v játrech, jsou nečetná. Obecně se předpokládá, že při resekci maligního tumoru by měl být dodržen volný okraj 10 mm a okraj 20 mm je považován za optimální, ale tato pravidla lze dodržet jen zřídka. Např. pokud je tumor v blízkosti velkých cév, několik milimetrů velký resekční okraj může být maximum, čeho lze dosáhnout.
V případě metastáz kolorektálního karcinomu je okraj 1 mm velký považován některými pracovišti za dostatečný. I když literárně je většinová shoda na velikosti volného okraje 5 mm [32].
Pro HCC a cholangiocelulární karcinom se považuje za dostatečný okraj 10 mm, protože v těchto případech byl pozorován menší počet rekurentních ložisek a také pacienti dosahovali mírně delšího přežití [33,34].
Optimální resekční okraj pro karcinomy žlučníku také není dobře definován. V případě primárního výkonu lze považovat délku okraje 5 mm za dostatečnou, v případě že jde o druhou operaci lze za cílový považovat okraj 10–20 mm.
Komplikace po resekcích jater jsou poměrně běžné, až 20 % pacientů má významné komplikace jako prosakování žluči nebo plicní komplikace [35,36].
Rizikovými faktory jsou zvláště vyšší věk a metabolický syndrom. Perioperační mortalita podle velkých US registrů je cca 2 %, cirhóza představuje významný rizikový faktor.
Závěrem lze tedy konstatovat, že v současně publikovaném písemnictví převažuje následující postoj:
- Benigní afekce mohou být řešeny enukleací nebo resekcí s minimálními okraji.
- Okraj 10 mm by měl být dodržen při resekci maligního tumoru a okraj 20 mm je považován za optimální (i když jen zřídka lze toto pravidlo striktně dodržet).
- Pro metastázy kolorektálního karcinomu je okraj šíře 1 mm považován některými pracovišti za dostatečný; většinová shoda je na 5 mm volného okraje.
- Pro HCC a cholangiocelulární karcinom se považuje za dostatečný okraj 10 mm.
- Pro karcinom žlučníku lze u primárního výkonu považovat okraj 5 mm za dostatečný; při reoperaci lze za cílový považovat okraj 10–20 mm.
Prof. MUDr. Markéta Hermanová, Ph.D.
I. patologicko-anatomický ústav FN u sv. Anny v Brně a LF MU
Pekařská 53
656 91 Brno
e-mail: marketa.hermanova@fnusa.cz
Sources
1. Verbeke CS. Resection margins in pancreatic cancer. Surg Clin North Am 2013;93 : 647–62.
2. Verbeke CS, Leitch D, Menon KV, et al. Redefining the R1 resection in pancreatic cancer. Br J Surg 2006;93 : 1232–7.
3. Menon KV, Gomez D, Smith AM, et al. Impact of margin status on survival following pancreatoduodenectomy for cancer: the Leeds Pathology Protocol (LEEPP). HPB (Oxford) 2009;11 : 18–24.
4. Verbeke CS, Menon KV. Redefining resection margin status in pancreatic cancer. HPB (Oxford) 2009;11 : 282–9.
5. Verbeke CS, Knapp J, Gladhaug IP. Tumour growth is more dispersed in pancreatic head cancers than in rectal cancer: implications for resection margin assessment. Histopathology 2011; 59 : 1111–21.
6. Bandyopadhyay S, Basturk O, Coban I, et al. Isolated solitary ducts (naked ducts) in adipose tissue: a specific but underappreciated finding of pancreatic adenocarcinoma and one of the potential reasons of understaging and high recurrence rate. Am J Surg Pathol 2009;33 : 425–9.
7. Gill AJ, Johns AL, Eckstein R, et al. New South Wales Pancreatic Cancer Network (NSWPCN). Synoptic reporting improves histopathological assessment of pancreatic resection specimens. Pathology 2009;41 : 161–7.
8. Chang DK, Johns AL, Merrett ND, et al. Margin clearance and outcome in resected pancreatic cancer. J Clin Oncol 2009; 27 : 2855–62.
9. Hruban RH, Boffetta P, Hiraoka N, et al. Tumours of the pancreas. In: WHO classification of tumours of the digestive system. 4th Edn, Lyon, WHO Press 2010 : 279–338.
10. Hernandez J, Mullinax J, Clark W, et al. Survival after pancreaticoduodenectomy is not improved by extending resections to achieve negative margins. Ann Surg 2009;250 : 76–80.
11. Nelson DW, Blanchard TH, Causey MW, et al. Examining the accuracy and clinical usefulness of intraoperative frozen section analysis in the management of pancreatic lesions. Am J Surg 2013;205 : 613–7.
12. Dillhoff M, Yates R, Wall K, et al. Intraoperative assessment of pancreatic neck margin at the time of pancreaticoduodenectomy increases likelihood of margin-negative resection in patients with pancreatic cancer. J Gastrointest Surg 2009;13 : 825–30.
13. Maygarden SJ, Detterbeck FC, Funkhouser WK. Bronchial margins in lung cancer resection specimens: utility of frozen section and gross evaluation. Mod Pathol 2004;17 : 1080–6.
14. Owen RM, Force SD, Gal AA, et al. Routine intraoperative frozen section analysis of bronchial margins is of limited utility in lung cancer resection. Ann Thorac Surg 2013;95 : 1859-65; discussion 1865–6.
15. Tomaszek SC, Wigle DA. Surgical management of lung cancer. Semin Respir Crit Care Med 2011;32 : 69–77.
16. Tomaszek SC, Kim Y, Cassivi SD, et al. Bronchial resection margin length and clinical outcome in non-small cell lung cancer. Eur J Cardiothorac Surg 2011;40 : 1151–6.
17. ValliŹres E, Van Houtte P, Travis WD, et al. International Association for the Study of Lung Cancer (IASLC) International Staging Committee. Carcinoma in situ at the bronchial resection margin: a review. J Thorac Oncol 2011;6 : 1617–23.
18. Hofmann HS, Taege C, Lautenschläger C, et al. Microscopic (R1) and macroscopic (R2) residual disease in patients with resected non-small cell lung cancer. Eur J Cardiothorac Surg 2002;21 : 606–10.
19. Kara M, Sak SD, Orhan D, Yavuzer S. Changing patterns of lung cancer; (3/4 in.) 1.9 cm; still a safe length for bronchial resection margin? Lung Cancer 2000;30 : 161–8.
20. Van Poppel H. Efficacy and safety of nephron-sparing surgery. Int J Urol 2010;17 : 314–26.
21. Porpiglia F, Fiori C, Terrone C, et al. Assessment of surgical margins in renal cell carcinoma after nephron sparing: a comparative study: laparoscopy vs open surgery. J Urol 2005;173 : 1098–101.
22. Sivarajan G, Huang WC. Current practice patterns in the surgical management of renal cancer in the United States. Urol Clin North Am 2012;39 : 149–60.
23. Marszalek M, Carini M, Chlosta P, et al. Positive surgical margins after nephron-sparing surgery. Eur Urol 2012;61 : 757–63.
24. Borghesi M, Brunocilla E, Schiavina R, Martorana G. Positive surgical margins after nephron-sparing surgery for renal cell carcinoma: incidence, clinical impact, and management. Clin Genitourin Cancer 2013;11 : 5–9.
25. Sutherland SE, Resnick MI, Maclennan GT, Goldman HB. Does the size of the surgical margin in partial nephrectomy for renal cell cancer really matter? J Urol 2002;167 : 61–4.
26. Kubinski DJ, Clark PE, Assimos DG, Hall MC. Utility of frozen section analysis of resection margins during partial nephrectomy. Urology 2004;64 : 31–4.
27. Venigalla S, Wu G, Miyamoto H: The Impact of Frozen Section Analysis During Partial Nephrectomy on Surgical Margin Status and Tumor Recurrence: A Clinicopathologic Study of 433 Cases. Clin Genitourin Cancer 2013 Jul 16. pii: S1558 – 7673(13)00134?1. doi: 10.1016/j.clgc.2013.05.003. [Epub ahead of print]
28. Raz O , Mendlovic S, Shilo Y, et al. Positive surgical margins with renal cell carcinoma have a limited influence on long-term oncological outcomes of nephron sparing surgery. Urology 2010;75 : 277–80.
29. Sterious SN, Simhan J, Smaldone MC, et al. Is there a benefit to frozen section analysis at the time of partial nephrectomy? Can J Urol 2013;20 : 6778–84.
30. Rahbari NN, Garden OJ, Padbury R, et al. Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery 2011;149 : 713–24.
31. Ferrero A, Viganė L, Polastri R, et al. Postoperative liver dysfunction and future remnant liver: where is the limit? Results of a prospective study. World J Surg 2007;31(8):1643–51.
32. Adams RB, Aloia TA, Loyer E, et al. Selection for hepatic resection of colorectal liver metastases: expert consensus statement. HPB Oxford 2013;15 : 91–103.
33. Jarnagin W, Chapman WC, Curley S, et al. Surgical treatment of hepatocellular carcinoma: expert consensus statement. HPB Oxford 2010;12 : 302–10.
34. Sadamori H, Yagi T, Shinoura S, et al. Risk factors for major morbidity after liver resection for hepatocellular carcinoma. Br J Surg 2013;100 : 122–9.
35. Nobili C, Marzano E, Oussoultzoglou E, et al. Multivariate analysis of risk factors for pulmonary complications after hepatic resection. Ann Surg 2012;255 : 540–50.
36. Hyder O, Pulitano C, Firoozmand A, et al. A risk model to predict 90-day mortality among patients undergoing hepatic resection. J Am Coll Surg 2013;216 : 1049–56.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 2-
All articles in this issue
- Deset let endovenózní ablace varixů, úspěchy, neúspěchy a budoucnost
- Transarteriální chemoembolizace pomocí „drug eluting beads“ (TACE DEB) u nemocných s radikálně neodstranitelným hepatocelulárním karcinomem (HCC)
- Problematika klostridiové kolitidy na chirurgickém pracovišti
- Využití acelulárních biologických xenotransplantátů v lokální léčbě Lyellova syndromu
- Využití telemetrického monitorování intrakraniálního tlaku v diferenciální diagnostice idiopatické nitrolební hypertenze – kazuistika
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
- Problematika klostridiové kolitidy na chirurgickém pracovišti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

