-
Medical journals
- Career
Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
: M. Trnková
: BIOLAB Praha, k. s., ředitelka: MUDr. M. Trnková
: Rozhl. Chir., 2014, roč. 93, č. 2, s. 107-111.
: Various Specialization
Práce je určena k postgraduálnímu vzdělávání lékařů.
Prs záchovné operace se v posledních letech stávají nejčastěji používanou metodou léčby časných stadií karcinomu prsu. Kompletní odstranění nádorového ložiska je při použití této metody statisticky významným parametrem, který ovlivňuje vznik lokální recidivy a celkové přežití. Stanovení kompletnosti resekce a zejména vzdálenosti nádorového ložiska od okrajů resekátu však přináší řadu problémů, které vyplývají jak z charakteru tkáně s převahou tukového stromatu, tak z charakteru vlastní nádorové tkáně, dané jejím způsobem růstu a multifokalitou. Přitom stanovení velikosti okraje, který považujeme za bezpečný, zůstává kontroverzním tématem.
V článku probíráme současné pohledy na hodnocení volných, resp. bezpečných okrajů a shrnujeme technické možnosti stanovení resekčních okrajů v mamární onkochirurgii.Klíčová slova:
karcinom prsu – prs záchovná operace – resekční okrajeMetodou volby pro terapii časných stadií karcinomu prsu se v posledních letech staly prs záchovné operace, tedy parciální resekce nádorem postiženého orgánu. Randomizované studie prokázaly, že prs záchovným chirurgickým výkonem v kombinaci s exstirpací sentinelové lymfatické uzliny a následnou radioterapií lze dosáhnout stejné účinnosti léčby jako u mastektomie, ale s nepoměrně lepším kosmetickým efektem. To vede k rozšiřování indikací této metody i u pacientek po neoadjuvantní léčbě.
Reziduální onemocnění po nekompletní excizi má evidentní vliv na vznik lokální recidivy a celkové přežití. Přitom, jak dokazují četné studie, reziduální nádorová tkáň nemusí bezprostředně souviset s přítomností nádorových buněk v okraji resekátu, ale je prokázána i v případech, kdy se nádor nachází v těsné blízkosti resekčního okraje. Další možnou příčinou reziduální nemoci je samozřejmě existence dalších mikroskopických ložisek bez souvislosti s hlavním odstraněným nádorem.
Hodnocení resekčních okrajů se tak považuje za klíčový faktor pro stanovení rizika vzniku lokální recidivy, a tedy pro úspěšnost onkochirurgické léčby.
Samotné hodnocení však představuje velmi komplexní a i dosti kontroverzní problematiku, kde nejde jen o vlastní techniku měření okrajů, ale zejména o stanovení tzv. bezpečných hranic. Limitací je řada, patří mezi ně i praktická nemožnost porovnávání literárních údajů jednak v důsledku toho, že se jedná převážně o retrospektivní údaje sahající do 90. let, tedy do doby počátků zavádění tlustojehlové biopsie (core cut biopsie) jako verifikačního prostředku pro karcinomy mamy, a v řadě studií jsou zařazeny pacientky zcela bez histologické verifikace nádorového ložiska, pacientky, jejichž jediným určením velikosti nádoru byla palpace apod. Dále v důsledku použití různých modalit pro peroperační diagnostiku i technik pro vlastní histopatologické vyšetření resekovaných okrajů.
„O jakých resekcích tedy můžeme říci, že byly kompletní?“ a „Kde jsou hranice pro bezpečné okraje?“
Pozitivní okraje
Panuje všeobecná shoda, že mikroskopický nález nádorových buněk jak invazivního karcinomu, tak in situ duktálního karcinomu (DCIS) v resekčním okraji znamená pozitivní okraj. Nemusí však nutně znamenat reziduální nemoc. Studie, které se zabývají frekvencí výskytu pozitivních okrajů, reziduální nemoci v reexcizi a lokální rekurence po prs záchovných operacích vykazují poměrně širokou variabilitu. U reoperací při pozitivních okrajích byla nádorová tkáň přítomna v širokém rozptylu od 20 % do 80 % reexcizí*, stejně tak procento pozitivních okrajů v primárních resekátech se pohybuje v širokém pásmu od 2,5 % do 50 %, resp. 71,3 %, uvažuje-li se i tzv. těsný okraj do 2 mm.
* Použité procentuální údaje udávají orientačně rozptyl zastižený ve vyhledané literatuře dostupné na PubMed (1995–2013) a nemají charakter multivariační analýzy. Do odkazované literatury jsou zahrnuty pouze recentní studie a přehledové články zabývající se tematikou.
Jak bylo zmíněno výše, tyto údaje zahrnují nesourodé skupiny pacientek jak s diagnózou stanovenou excizí nebo jehlovou biopsií, tak i pacientky s preoperačně nestanovenou diagnózou. Současné práce (Haloua et al., Russo et al., Yu et al., 2013) dokládají pozitivní okraje u méně než 20 % pacientek, s obvyklou frekvencí do 10 % a lokální rekurencí 0 % až 10 % (follow up a následná onkologická terapie se však mezi studiemi liší).
Vysvětlení negativního nálezu při reexcizi může být následující:
- pozitivní okraj může znamenat záchyt několika „posledních“ nádorových buněk zcela na periferii ložiska, zejména v případě invazivního karcinomu (Obr. 1),
- okrajové nádorové buňky podlehnou nekróze v demarkační zóně chirurgického řezu. Předpokládá se, že nádorové buňky invazivního karcinomu jsou náchylnější k regresivním změnám v místech ischemie v hranicích resekátu, pravděpodobně díky tomu, že nemají bazální membrány, vlastní stroma a cévní zásobení.
1. Invazivní lobulární karcinom v okraji resekátu (HEO 200x) Fig. 1: Invasive lobulary carcinoma in the resection margin of the lumpectomy (HEO 200x) Tušovaný okraj resekátu (černá šipka), řádky a skupinky buněk invazivního lobulárního karcinomu gr. 1 ve vazivovém a tukovém stromatu, jednotlivé nádorové buňky v resekčním okraji (červené šipky). Pozitivní okraj s minimálním množstvím nádorových buněk, při reexcizi již karcinom nezastižen. 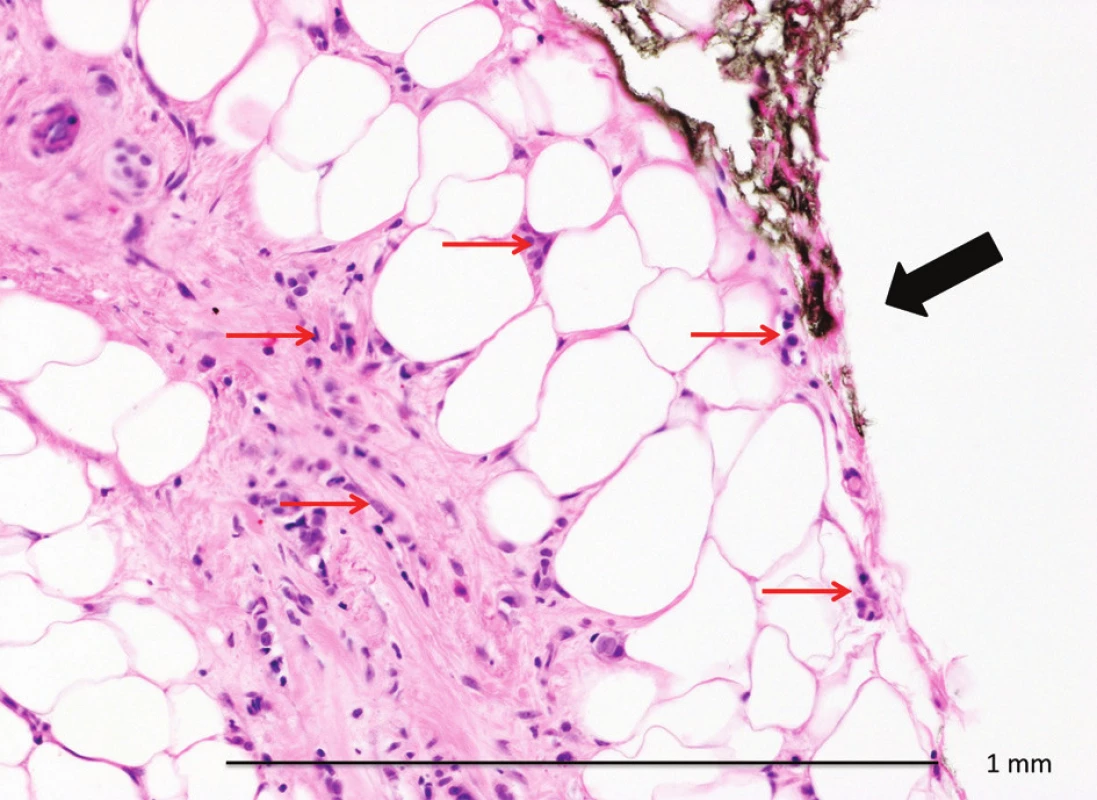
Šíře této nekrotické zóny jak ve vyjmutém resekátu, tak v poresekční dutině není jednoznačně stanovená a závisí na použité chirurgické, resp. hemokoagulační technice. Předpokládá se, že se jedná o desetiny milimetru až milimetry, ale literární údaje jsou omezené.
V reexcizích se při pozitivních okrajích i pro invazivní karcinom významně častěji nachází DCIS, a to zejména při excesivním rozsahu in situ komponenty, čímž se míní rozsah větší než 1 cm v největším rozměru.
Přítomnost lymfatické invaze, lobulárního karcinomu in situ (resp. LIN) a atypické duktální hyperplazie (ADH) v okraji resekátu se nepovažuje za pozitivní okraj.
V případě ADH je tento přístup diskutabilní. Vzhledem k definici ADH a v podstatě arbitrárnímu stanovení hranice mezi ADH a low grade DCIS je interobserver variabilita značná a shoda stanovení ADH v jehlové biopsii se udává méně než 60 %. Upstaging na in situ duktální karcinom v následné excizi je poměrně častý, v 24–45 %.
Bezpečné okraje
Za bezpečné okraje se považuje vzdálenost, při které je dosaženo maximální clearence nádorové tkáně, s nejnižší pravděpodobností reziduální nemoci a tím lokální rekurence.
V průběhu posledních 15 let se náhled na bezpečné okraje značně mění a vzdálenost se postupem času zmenšuje z 20 mm na 10 mm, resp. 5 mm, resp. 1–2 mm! Konsenzus neexistuje.
Většina autorů se shoduje, že okraj větší než 2 mm je možno považovat za negativní, okraj menší než 2 mm pak za těsný, který přináší vyšší riziko reziduální nemoci (25 % Skripenova S. et al. 2010). Jsou však práce, které dokládají, že při adjuvantní hormonální léčbě a radioterapii neexistuje statisticky signifikantní rozdíl mezi lokální rekurencí při okrajích 1 mm a větších (Houssami et al., 2010).
Velikost bezpečného okraje se tedy ukazuje jako parametr individuální, závislý na biologických charakteristikách nádoru, jeho lokalizaci a především další plánované onkologické terapii. Zajímavé je i porovnávání pracovišť v jejich přístupu k velikosti bezpečného okraj a nutnosti reexcize. Evropská pracoviště se přiklánějí k větším okrajům 2–5 mm, v USA spíše k 1 mm, menší okraje a menší míru reexcizí vykazují mamární centra (Taghian, 2005).
Způsoby stanovení okrajů
Jak již bylo zmíněno, na způsobech dosažení negativních okrajů se značnou měrou podílí radiodiagnostik identifikací nádoru, posouzením multifokality, změřením velikosti a co nejpřesnější lokalizací ložiska při použití uhlíkových depozit nebo kovových vodičů apod. Toto značení je následně důležitým vodítkem i pro patologa při vyšetřování resekátu.
K vlastnímu posouzení okrajů resekátu se využívá jednoho nebo kombinace z následujících postupů, peroperačně nebo při definitivním histologickém zpracování:
Peroperační makroskopické hodnocení chirurgem při vynětí resekátu – hmatné ložisko v okraji má pozitivní prediktivní hodnotu a umožňuje reresekci v jedné době.
Negativní pohmatový nález však neznamená negativní okraj.
Peroperační zmrazené řezy – technika oblíbená chirurgy, ale ne patology.
Výhodou je rychlé stanovení pozitivního okraje a možnost reexcize v jedné době.
Nevýhodou, že peroperačně lze vyšetřit poměrně malé množství tkáně – jeden řez by neměl mít větší plochu než 10x10 mm a počet bloků (a následných řezů) je limitovaný z časového hlediska.
Navíc zpracování tukové tkáně prsu zmrazenými řezy je technicky obtížné a hodnocení jednotlivých nádorových buněk zejména v termicky arteficiálně změněném okraji je prakticky nemožné, což může vést k falešně negativním výsledkům.
Metoda vyžaduje přítomnost patologa na sále, což představuje i finanční zátěž, která má význam, pokud je frekvence reexcizí vyšší než 36 % (Osborne et al., 2011).
Peroperační otisková cytologie – otisk resekčního okraje na sklo nebo nátěr buněk oškrábaných z okraje resekátu umožňuje rychlou identifikaci jednotlivých nádorových buněk. Nevýhody jsou stejné jako u zmrazených řezů – přítomnost patologa na sále, časová náročnost při hodnocení většího počtu nátěrů, chyba samplingu a požadovaná senzitivita a prediktivní hodnota, pouze v případě, prochází-li chirurgický řez nádorem.
U všech histologických a cytologických peroperačních metod lze zvýšit efektivitu správnou indikaci vyšetření, tzn. zacílením na suspektní okraj v korelaci s mamogramem specimenu.
Definitivním histologickým vyšetřením lze stanovit nejen pozitivní okraje, ale změřit vzdálenost nádoru od okrajů a posoudit jeho biologické charakteristiky. Nevýhodou je, že informace o pozitivních okrajích přichází pozdě a neumožňuje reexcizi v jedné době. To může být zčásti kompenzováno možností vyhodnotit nutnost reexcize v rámci mamárního týmu.
Metoda přířezů (shave margins) – jedná se o vyšetření tenkých plátků buď z obvodu resekátu, nebo z vnitřních okrajů dutiny po resekci, samostatně dodaných chirurgem.
Nevýhody: Samotné odkrajování z nefixované tkáně je obtížné pro chirurga i patologa. V případě použití u resekátu se plátek zpracovává plošně a hodnocení je omezeno na přítomnost nebo absenci nádoru v okraji, nikoliv na vlastní posouzení vzdálenosti. Jedná se o množství bloků tkáně, tedy o nákladnou a časově náročnou metodu.
Výhodou je však validní zhodnocení největší možné plochy okrajů resekátu (při experimentech bylo dosaženo průměrně vyhodnocení cca 40 % celkového povrchu resekátu, přitom obvyklý resekát o rozměrech 8x7x3 cm má plochu kolem 120 cm2, což by při kompletním zpracování představovalo cca 120 bloků tkáně!, tj. např. v UK více než denní nálož pro 1 patologa).
Při správném značení jednotlivých přířezů je možné poměrně přesně rekonstruovat místo nedostatečného okraje.
Metoda orientovaných rovnoběžných řezů – nejpoužívanější metoda. Při prokrajování resekátu v paralelních řezech se průběžně odebírá tkáň v místech makroskopicky nejmenší vzdálenosti mezi nádorem a okrajem resekátu. Okraj se barví tuší a mikroskopické vyhodnocení spočívá v měření vzdálenosti mezi tuší obarveným okrajem a nejbližší nádorovou buňkou.
Výhodou je cílené vyšetření míst suspektních z pozitivních okrajů, což přináší úsporu nákladů i času, při stejné možnosti přesné lokalizace pozitivního okraje jako u přířezů.
Metoda poskytuje největší přehled o charakteru tkáně v okraji resekátu a umožňuje identifikaci jednotlivých kolagenních snopců, které se považují za doklad resekce pektorální fascie v dorzálním okraji resekátu.
Nevýhodou je možnost falešné negativity při nedostatečném samplingu.
Příčiny nepřesností při stanovování okrajů
Nepřesnosti ve smyslu falešně negativního, ale i falešně pozitivního okraje se mohou vyskytnout z následujících příčin:
Charakter vlastní tkáně prsu
Převahu vlastní tkáně resekátu obvykle tvoří tukové stroma. Tuková tkáň je obtížně zpracovatelná jak nefixovaná, při peroperačních zmrazených řezech, tak po fixaci. Skupinky adipocytů se snadno oddrolují a rozpadají při manipulaci, což může vést ke ztrátám okrajové tkáně a falešné pozitivitě okraje.
Při fixaci ve formolu tuková tkáň velmi mírně zvyšuje svoji váhu a minimálně zmenšuje objem, navíc po vyjmutí ztrácí tvar a v důsledku gravitace se vzorek oplošťuje. Oproti tomu nádorová tkáň při vyšším podílu vazivového kolagenního stromatu se fixací příliš nemění, dochází tak k relativnímu zmenšení okrajů resekátu, které však není větší než 5 %. Někteří autoři však nenašli změny ve velikosti jak vzorku, tak volných okrajů v resekátech (Krekel et al., 2012).
K dalším změnám v prostorovém uspořádání dochází při mechanické kompresi resekátu při mamografii specimenu.
Charakter nádorové tkáně
Diskontinuální šíření in situ karcinomu a multifokalita invazivního karcinomu jsou hlavní příčinou reziduální nemoci u pacientek s negativními okraji resekátu.
Způsob růstu lobulárního karcinomu, pro který je charakteristické šíření tukovým a vazivovým stromatem žlázy v dyskohezivních řádcích či po jednotlivých buňkách, aniž by vytvářel vlastní fibrózní stroma, často vede k podhodnocení velikosti nádorového ložiska v zobrazovacích metodách i následně při resekci (Obr. 1).
Operační technika
Svůj podíl má i použitá operační technika. Při tupé preparaci dochází k dislokaci určitého množství tukové tkáně a může tak dojít k obnažení nádorového okraje. Stejně tak existují mírné rozdíly velikosti nekrotického okraje při použití různých hemokoagulačních technik. Posouzení těchto změn však přináleží chirurgovi, což dále podtrhuje význam spolupráce onkologicko-chirurgicko-radiodiagnosticko-patologického týmu (Obr. 2).
2. DCIS a kancerizace lobulů v termicky změném okraji resekátu (HEO 40x) Fig. 2: DCIS and cancerization of lobules in the resection margin of the lumpectomy with thermal changes (HEO 40x) Okraj resekátu s naříznutím (černé šipky), DCIS s termickými změnami v naříznutém okraji (červený kruh a detail v rámečku HEO 100x). V místě otazníku zcela nečitelný buněčný okrsek. V reexcizi byl zastižen excesivní DCIS. 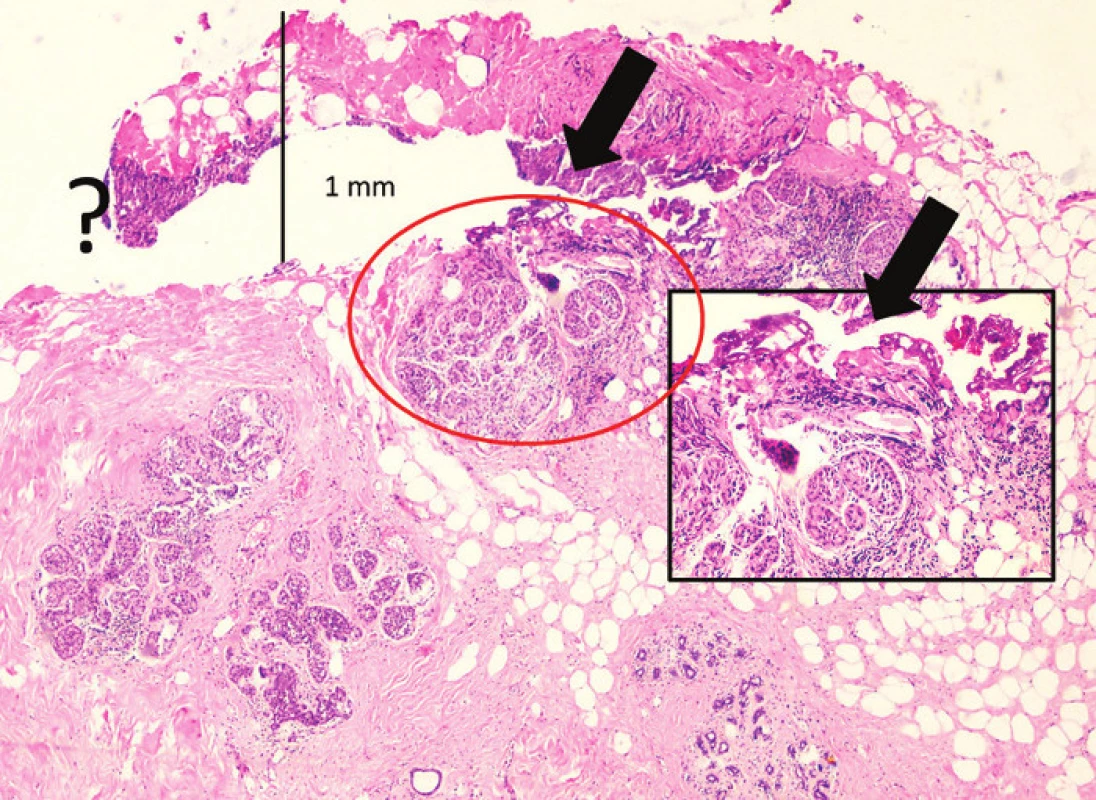
Možnosti predikce a prevence pozitivních okrajů
Při současných znalostech a možnostech vyšetřování patrně nelze zabránit určitému procentu reziduální nemoci, resp. lokální rekurence po prs záchovných operacích. Za přijatelné se považuje dosažení hranice pro lokální rekurenci u časných karcinomů prsu 1 % za rok a 10 % za 10 let.
Margenthalerová et al. vypracovala „margin index“ jako matematickou kalkulaci rizika reziduální nemoci.
Margin index = velikost nejmenšího okraje/velikost invazivního karcinomu x 100.
Index > 5 je spojen s rizikem reziduální nemoci 3 %, tzn., že 97 % pacientů s tímto indexem nemělo v reexcizi reziduální karcinom.
Jiní autoři považují za nezávislé prediktory reziduální nemoci věk pod 45 let, vysoký grade, velikost nádoru a pozitivitu lymfatických uzlin.
Větší pravděpodobnost rezidua mají též pacienti s excesivním rozsahem DCIS, za který se považuje rozsah větší než 1 cm v největším rozměru. Tento rozsah lze předvídat při nálezu duktální in situ komponenty současně s invazivním karcinomem v jehlové biopsii (Dillon et al., 2007).
Pozitivním okrajům lze předejít i předoperačním vyšetřením se stanovením rozsahu a náležitým značením mikrokalcifikací, obdobně jako ultrazvukovou peroperační kontrolou.
Závěr
Pozitivní okraje jsou definované přítomností buněk invazivního karcinomu a DCIS v okraji resekátu, nikoliv však přítomností lobulárního in situ karcinomu (LCIS, LIN) a atypické duktální hyperplazie (ADH). Pozitivní okraje však neznamenají automaticky reziduální nemoc ani zvýšení rizika lokální rekurence. Neexistuje konsenzus, jak široké by měly být tzv. bezpečné okraje. Za těsné okraje se většinou považuje vzdálenost nádoru do 1 mm od hranice resekátu. Tato vzdálenost by však měla být závislá na vlastnostech nádoru včetně způsobu jeho růstu. Významně častěji se nachází reziduální nemoc při extenzivním rozsahu DCIS, u lobulárního karcinomu a u multifokálního růstu. Dosažení bezpečných krajů je přímo závislé na způsobu předoperačního vyšetření a lokalizace nádoru zobrazovacími metodami a způsobu značení nádorového ložiska radiodiagnostiky.
Většina prací zabývajících se touto tematikou jsou retrospektivní studie, které analyzují případy před zavedením digitální mamografie, která zvýšila rozlišovací schopnost a tím zpřesnila měření velikosti a záchyt multifokálního růstu. Současné studie již nenacházejí tak významnou závislost vzniku lokální recidivy na pozitivních okrajích.
Jako nezávislé rizikové faktory pro vznik lokální rekurence při prs záchovných operacích, které by měly být zohledněny při stanovení rozsahu resekce, jsou velikost, grade a typ nádoru, rozsah DCIS, pozitivita lymfatických uzlin, věk pacientky pod 45 let a plánovaná následná terapie.
Vzdálenost nádoru od hranice resekátu by měla být vždy součástí zprávy patologa a měla by být stanovena nejefektivnějším způsobem, k výsledku je ale nutné přistupovat s vědomím, že i při maximálně extenzivním způsobu vyšetření lze vyšetřit méně než polovinu povrchu resekátu. Pro způsob vyšetřování neexistují jednoznačná doporučení.
Jako nejdůležitější se ukazuje spolupráce chirurga a patologa a vzájemná dohoda o způsobu značení resekátu a předávání informací.
Podle literárních údajů se ani reexcize pro pozitivní okraje neprovádějí podle jednotného protokolu a jejich četnost kolísá od 50 do 90 %, ale obvykle jsou výstupem konsenzu mamárního týmu.
Z uvedeného je zřejmé, že se jedná o velmi komplexní problematiku, pro kterou naše současné znalosti nepřinášejí jednoznačná obecně platná řešení. Faktory, které ji ovlivňují, jsou jak na straně pacientky, biologické povahy nádoru, možností předoperačního vyšetření, erudice chirurga i práce patologa, následné onkologické léčby – a to vše v propojení na finanční možnosti daného zdravotního systému.
MUDr. Markéta Trnková
BIOLAB Praha, k. s.
Evropská 33B
160 00 Praha 6
e–mail: trnkova@biolab.cz
Sources
1. Lakhani SR, Ellis IO, Schnitt SJ, et al. WHO Classification of Tumours of the Breast, 4th edition 2012.
2. Veronesi U, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. New England Journal of Medicine 2002;16 : 1227–1232.
3. Houssami N, MacAskill P, Marinovich ML, et al. Metaanalysis of the impact of surgical margins on local recurrence in women with early-stage invasive breast cancer treated with breast-conserving therapy. European Journal of Cancer 2010;18 : 3219 – 3232.
4. Corsi F, Sorrentino L, Bossi D, Sartani A, Foschi D. Preoperative Localization and Surgical Margins in Conservative Breast Surgery. International Journal of Surgical Oncology 2013; Epub 2013 Aug 5 http://dx.doi.org/10.1155/2013/793819.
5. Gulcelik MA, Dogan L, Yuksel M, Camlibel M, Ozaslan C, et al. Comparison of outcomes of standard and oncoplastic breast-conserving surgery. The Breast Journal 2013;1 : 56–63.
6. Krekel NM et al. Is breast specimen shrinkage really a problem in breast-conserving surgery? Journal of Clinical Pathology 2012;3 : 224–7.
7. Russo AL, et al. Margin status and the risk of local recurrence in patients with early-stage breast cancer treated with breast-conserving therapy. Breast Cancer Research and Treatment 2013;7 : 353–61
8. Ananthakrishnan P. Optimizing Surgical Margins in Breast Conservation. International Journal of Surgical Oncology 2012; Epub 2012 Dec 9 http://dx.doi.org/10.1155/2012/585670
9. Schwartz GF. Consensus Conference Committee Journal of the American College of Surgeons 2006;2 : 198–207.
10. Margenthaler JA, Gao F, Klimberg VS. Margin index: a new method for prediction of residual disease after breastconserving surgery. Annals of Surgical Oncology 2010;10 : 2696–2701.
11. Haloua MH, Krekel NM, Winters HA, Rietveld DH, et al. A systematic review of oncoplastic breast-conserving surgery: current weaknesses and future prospects. Annals of Surgery 2013; 4 : 609–20.
12. Emmadi R, Wiley EL. Evaluation of Resection Margins in Breast Conservation Therapy: The Pathology Perspective – Past, Present, and Future. International Journal of Surgical Oncology 2012;Epub 2012 Nov 19 http://dx.doi.org/10.1155/2012/180259.
13. Wood WC. Close/positive margins after breast-conserving therapy: Additional resection or no resection? The Breast 2013;22 : 115–117.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 2-
All articles in this issue
- Ten years of endovenous ablation – achievements, failures and future
- Chemoembolization with Drug Eluting Beads (TACE DEB) in patients with primary unresectable hepatocellular carcinoma (HCC)
- Clostridium colitis at a surgical department
- The use of acellular biological xenografts in local treatment of Lyell’s syndrome
- The use of telemetric intracranial pressure monitoring in the differential diagnosis of idiopathic intracranial hypertension – a case report
- Evaluation of safe resection margins in rectal carcinoma
- Evaluation of safe resection margins in tumours of parenchymatous organs
- Evaluation of safe margins in pathology examination in breast oncosurgery
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Evaluation of safe resection margins in tumours of parenchymatous organs
- Evaluation of safe resection margins in rectal carcinoma
- Evaluation of safe margins in pathology examination in breast oncosurgery
- Clostridium colitis at a surgical department
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

