-
Medical journals
- Career
K-ras mutace a nádory infiltrující lymfocyty u karcinomu kolon, současnost a výhledy
Authors: P. Kocian 1; M. Šedivcová 3; J. Drgáč 4; Karin Černá 3; J. Hoch 1; R. Kodet 4; J. Bartůňková 2; R. Špíšek 2; A. Fialová 2
Authors‘ workplace: Chirurgická klinika 2. LF UK a FN v Motole 1; Ústav imunologie 2. LF UK a FN v Motole 2; Ústav patologie LF Plzeň 3; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole 4
Published in: Rozhl. Chir., 2012, roč. 91, č. 8, s. 427-432.
Category: Original articles
Práce byla věnována prof. MUDr. Jiřímu Hochovi, CSc. při příležitosti jeho významného životního jubilea.
Overview
Úvod:
Prognóza kolorektálního karcinomu v současné době vychází z TNM klasifikace, která je zároveň určujícím kritériem pro indikaci adjuvantní onkologické léčby. Aktuálním tématem je hledání nových prognostických a prediktivních biomarkerů, které povedou k selekci rizikových pacientů a racionalizaci adjuvantní onkologické léčby. Vedle řady molekulárních biomarkerů je jednou z možností analýza lymfocytů infiltrujících nádory. Cílem studie je stanovení mutace K-ras a analýza imunitních buněk infiltrujících nádorovou tkáň u pacientů s karcinomem kolon ve vztahu k recidivě onemocnění.Materiál e metodika:
Do retrospektivní studie bylo zařazeno 44 pacientů s karcinomem kolon, kteří podstoupili radikální chirurgický výkon (R0 resekce) v období 2004–2009. V parafinových řezech karcinomu kolon byly stanoveny mutace K-ras a provedena imunofluorescenční analýza imunitních buněk infiltrujících nádorovou tkáň (CD3, CD8, FoxP3, CD1a, DC-LAMP).Výsledky:
Všichni pacienti s karcinomem kolon (n=44) podstoupili radikální chirurgický výkon (R0 resekce). U 16 pacientů došlo k recidivě onemocnění (36,4 %). Mutace K-ras byla prokázána u 45,5 % (n=20) karcinomů: 65 % v kodonu 12 a 35 % v kodonu 13. Přestože mutace K-ras v kodonu 13 byla frekventní zejména mezi pacienty s recidivou onemocnění, vyskytovala se i ve skupině pacientů v remisi. Při podrobnější analýze pacientů s mutantní formou kodonu 13 byly nicméně mezi pacienty s recidivou onemocnění a pacienty v remisi zjištěny zásadní rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň. Byl prokázán trend ke klesajícímu množství lymfocytů infiltrujících nádory ve skupině pacientů s recidivou onemocnění. Navíc u pacientů s recidivou onemocnění bylo v nádorové tkáni detekováno pouze malé množství zralých dendritických buněk (DC-LAMP+) a naopak velké množství nezralých dendritických buněk (CD1a+) v porovnání se skupinou pacientů v remisi.Závěr:
Pacienti s mutantní formou kodonu 13, nízkou denzitou lymfocytů infiltrujících nádory a vysokým poměrem CD1a+/DC-LAMP+ buněk v nádorové tkáni mají vysoké riziko rekurence onemocnění.Klíčová slova:
kolorektální karcinom – K-ras – lymfocyty infiltrující nádoryÚVOD
Kolorektální karcinom je civilizačním onemocněním s významným socioekonomickým dopadem. Prognóza kolorektálního karcinomu v současné době vychází z TNM klasifikace, která je zároveň určujícím kritériem pro indikaci adjuvantní onkologické léčby. Zatímco pacienti v klinickém stadiu III (přítomnost uzlinového postižení) po radikálním chirurgickém výkonu z adjuvantní chemoterapie jednoznačně profitují, role adjuvantní léčby v klinickém stadiu II zůstává stále diskutabilní [1–3]. Při rozhodování o indikaci adjuvantní léčby zůstává v dnešní době jedinou možností posouzení klinických a histopatologických rizikových faktorů (nádor velikosti T4, angioinvaze, lymfatická invaze, perineurální šíření, stanovení N0 na základě vyšetření menšího počtu lymfatických uzlin než 12, nízká diferenciace nádoru G3-4, pozitivní resekční okraje, obstrukce či perforace střeva jako první projev nádoru, zvýšená hladina onkomarkeru CEA). Aktuálním tématem je hledání nových prognostických a prediktivních biomarkerů, které povedou k selekci rizikových pacientů napříč oběma klinickými stadii a racionalizaci adjuvantní onkologické léčby. Jinými slovy na základě laboratorního vyšetření těchto biomarkerů předurčit, zda bude další onkologická léčba pro pacienta přínosná ve srovnání s pouhým sledováním po radikální chirurgické resekci. V současné době jediným, rutinně používaným molekulárním biomarkerem je stav mutace K-ras. Tato mutace se vyskytuje přibližně u 30–50 % kolorektálních karcinomů [4–6] a ve více než 90 % případů je lokalizována v kodonu 12 a 13 [7]. Stanovení mutace K-ras je jednoznačným markerem absence léčebné odpovědi (non response) na léčbu inhibitory EGFR, tj. cetuximabem či panitumumabem (prediktivní biomarker)[8–10]. Naopak prognostický význam mutace K-ras zůstává stále kontroverzní. [11–13] Vedle řady molekulárních biomarkerů je jednou z možností analýza lymfocytů infiltrujících nádory (TILs). Existují důkazy pro to, že imunitní systém je schopen kontrolovat růst nádorových buněk, a to zejména v raných stadiích karcinogeneze. V boji proti nádorovým buňkám používá imunitní systém obě hlavní složky – systém přirozené imunity i systém imunity adaptivní (specifické T a B lymfocyty). Spojkou mezi oběma systémy jsou buňky dendritické, které hrají klíčovou roli v procesu zahájení plnohodnotné imunitní reakce. Nedávno publikovaná data získaná od pacientů s kolorektálním karcinomem prokazují, že přítomnost TILs je asociována s příznivou prognózou onemocnění [14–18]. Cílem této práce je stanovení mutace K-ras a analýza imunitních buněk infiltrujících nádorovou tkáň (včetně dendritických buněk) u pacientů s karcinomem kolon (zejména klinické stadium II a III) ve vztahu k relapsu onemocnění.
MATERIÁL A METODIKA
Do retrospektivní studie bylo zařazeno 44 pacientů s karcinomem kolon, kteří podstoupili radikální chirurgický výkon (R0 resekce) na Chirurgické klinice 2. LF UK a FN v Motole v období 2004–2009 (Tab. 1). Primárně byli vybráni pacienti s recidivou onemocnění a soubor byl doplněn o pacienty ze stejného období bez recidivy. Žádný pacient neabsolvoval neoadjuvantní onkologickou léčbu. Medián doby sledování byl 55 měsíců pro pacienty v remisi a 20 měsíců pro pacienty s recidivou onemocnění. V parafinových řezech karcinomu kolon byly vyšetřeny mutace K-ras pomocí PCR amplifikace exonu 1 následované přímým sekvenováním a K-ras StripAssay. Zastoupení jednotlivých subpopulací T lymfocytů a dendritických buněk, infiltrujících nádorovou tkáň, bylo identifikováno imunofluorescenčním značením parafinových řezů pomocí monoklonálních protilátek proti povrchovým a intracelulárním znakům (CD3, CD8, FoxP3, CD1a, DC-LAMP). Nádorové buňky byly charakterizovány pomocí protilátek proti cytokeratinu a proti proliferačnímu markeru Ki-67. Kvantitativní analýza imunitních buněk infiltrujících nádorovou tkáň (intraepiteliální a stromální lokalizace) byla provedena pomocí fluorescenčního mikroskopu Olympus FV300 (Obr. 1).
Table 1. Klinicko-patologická charakteristika pacientů Tab. 1: Clinicopathological features of patients 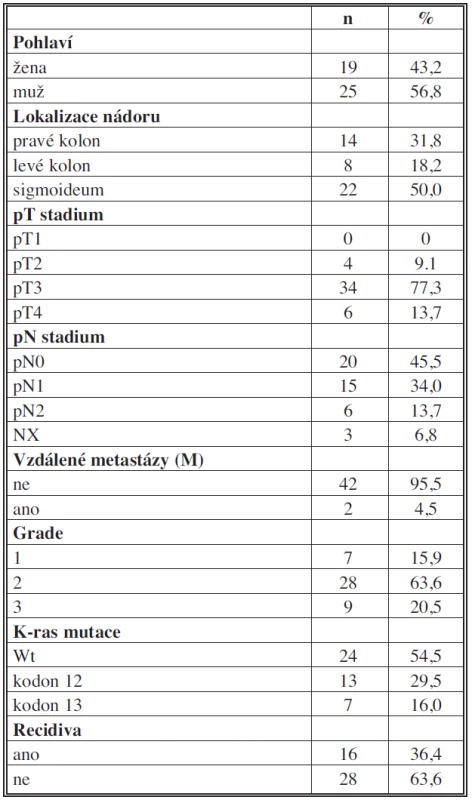
Image 1. Imunofluorescenční značení parafinových řezů Fig. 1: Immunofluorescent staining of paraffin sections 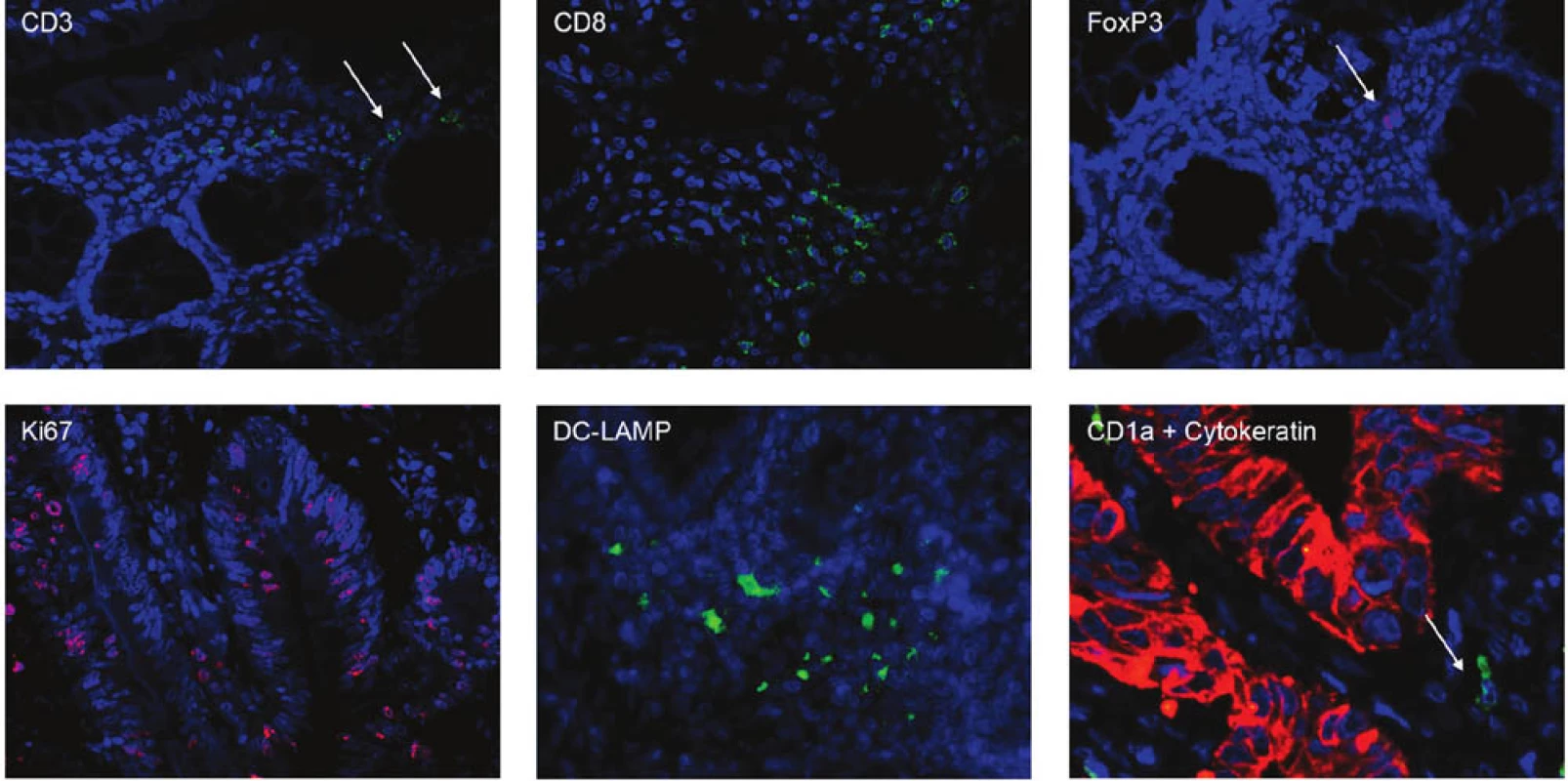
VÝSLEDKY
Všichni pacienti s karcinomem kolon (n=44) podstoupili radikální chirurgický výkon (R0 resekce). U dvou pacientů byla přítomna v době diagnózy solitární synchronní metastáza v játrech. V obou případech byla jaterní metastáza zresekována v jedné době s primárním karcinomem a bylo dosaženo R0 výkonu. U 16 pacientů došlo k recidivě onemocnění (36,4 %). Mutace K-ras byla prokázána u 45,5 % (n=20) karcinomů: 65 % v kodonu 12 a 35 % v kodonu 13. Karcinomy s mutantní formou kodonu 13 vykazovaly signifikantně vyšší proliferční aktivitu (vyšší poměr Ki67+ nádorových buněk) ve srovnání s karcinomy s mutantní formou kodonu 12 a wild-type karcinomy (bez mutace)(Graf 1). 57 % pacientů s mutantní formou kodonu 13 bylo asociováno s recidivou onemocnění ve srovnání pouze s 30,1 % a 33,3 % pacientů s mutantní formou kodonu 12 a wild type mutací (Graf 2). Přestože mutace K-ras v kodonu 13 byla frekventní zejména mezi pacienty s recidivou onemocnění, vyskytovala se i ve skupině pacientů v remisi. Při podrobnější analýze pacientů s mutantní formou kodonu 13 byly nicméně mezi pacienty s recidivou onemocnění a pacienty v remisi zjištěny zásadní rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň. Byl prokázán trend ke klesajícímu množství TILs ve skupině pacientů s recidivou onemocnění (Graf 3). Navíc u pacientů s recidivou onemocnění bylo v nádorové tkáni detekováno pouze malé množství zralých dendritických buněk (DC-LAMP+) a naopak velké množství nezralých dendritických buněk (CD1a+) v porovnání se skupinou pacientů v remisi. Pacienti s recidivou onemocnění měli signifikantně vyšší poměr nezralých/zralých dendritických buněk (CD1a+/DC-LAMP+ ratio) v nádorovém stromatu v porovnání s pacienty v remisi (Graf 4).
Graph 1. Zastoupení Ki67+ nádorových buněk ve vztahu k mutaci K-ras Wt (wild-type), pacienti bez přítomnosti mutace n=24; G12, pacienti s mutací v kodonu 12 n=13; G13, pacienti s mutací v kodonu 13 n=7. Graph 1: Proportions of Ki67+ tumour cells according to K-ras mutational status Wild-type (Wt) patients, n=24; patients with a mutation in codon 12 (G12), n=13; patients with a mutation in codon 13 (G13), n=7. 
Graph 2. Poměr pacientů v remisi/s recidivou ve vztahu k mutaci K-ras Wt (wild-type), pacienti bez přítomnosti mutace n=24; G12, pacienti s mutací v kodonu 12 n=13; G13, pacienti s mutací v kodonu 13 n=7 (bílé sloupce – pacienti v remisi, černé sloupce – pacienti s recidivou). Graph 2: Proportions of disease-free versus relapsed patients according to K-ras mutational status Wild-type (Wt) patients, n=24; patients with mutation in codon 12 (G12), n=13; patients with a mutation in codon 13 (G13), n=7. Columns represent the proportion of disease-free (white columns) or relapsed (black columns) patients classified according to K-ras mutational status. 
Graph 3. Rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň mezi pacienty s recidivou a pacienty v remisi s mutací v kodonu 13 (černé sloupce – nádorový epitel, bílé sloupce – nádorové stroma) Graph 3: Differences between patients with a codon 13 mutation of the K-ras gene with (relapse) and without (relapse) recurrence (black columns – immune cells inltrating the tumour epithelium; white columns – immune cells inltrating the tumour stroma) 
Graph 4. Poměr nezralých/zralých dendritických buněk (CD1a+/DC-LAMP+) v nádorové tkáni u pacientů s recidivou a u pacientů v remisi s mutací v kodonu 13 (černé sloupce – nádorový epitel, bílé sloupce – nádorové stroma) Graph 4: Ratio of CD1a+/DC-LAMP+ dendritic cells in patients with a codon 13 mutation of the K-ras gene with (relapse) and without (relapse) recurrence (black columns – immune cells inltrating the tumour epithelium; white columns – immune cells inltrating the tumour stroma) 
DISKUZE
V době biologické terapie již nelze spoléhat na klinické stadium podle TNM systému jako na jediný prostředek pro stratifikaci nemocných s kolorektálním karcinomem. Je to právě biologická léčba, která vyvolává naléhavou potřebu nových prediktivních a prognostických biomarkerů, které povedou k dalšímu zdokonalování v oblasti optimalizace a individuální specifikace adjuvantní chemoterapie. U pacientů s kolorektálním karcinomem je za tímto účelem velmi intenzivně studována mutace K-ras. Panuje široká shoda, že právě aktivační mutace K-ras na krátkém rameni chromozomu 12 v kodonu 12 a 13 patří mezi nejběžnější mutace u lidských maligních onemocnění. V případě kolorektálního karcinomu se mutace K-ras vyvíjí v časné fázi tumorigeneze, během progrese z adenomu na karcinom [19–21]. Výskyt K-ras mutace u kolorektálního karcinomu se pohybuje mezi 30–50 %. V naší kohortě pacientů s karcinomem kolon byla prokázána mutace K-ras v 45,5 % případů: 65 % v kodonu 12 a 35 % v kodonu 13, tedy v souladu s literárně udávanými daty [4–7]. Vzhledem k významu K-ras v rámci signální kaskády receptoru pro epidermální růstový faktor (EGFR) je stanovení mutace K-ras jednoznačným prediktivním markerem absence léčebné odpovědi (no response) na léčbu inhibitory EGFR, tj. cetuximabem či panitumumabem [8–10]. Přítomnost mutace K-ras vede k rezistenci nádoru vůči působení monoklonálních protilátek namířených proti EGFR, a tedy pouze pacienti s nemutovaným K-ras (wild-type K-ras) jsou vhodní pro tento druh terapie a lze u nich očekávat pozitivní terapeutickou odpověď (prediktivní marker). Naopak prognostický význam mutace K-ras zůstává stále kontroverzní [11–13]. Bazan et al. v prospektivní studii publikovali horší parametry přežití u pacientů s kolorektálním karcinomem s mutantní formou kodonu 13, zatímco pacienti s mutantní formou kodonu 12 byli asociováni s mucinózním typem karcinomu [4]. Obdobně v naší studii pacienti s karcinomem kolon s mutantní formou kodonu 13 byli asociováni s recidivou onemocnění a jejich karcinomy vykazovaly signifikantně vyšší proliferační aktivitu (vyšší poměr Ki67+ nádorových buněk) ve srovnání s karcinomy s mutantní formou kodonu 12 a wild type karcinomy. Mezi pacienty s mutantní formou kodonu 13 byly dále prokázány zásadní rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň. U pacientů s recidivou onemocnění bylo v nádorové tkáni (epitel, stroma) zastiženo pouze malé množství lymfocytů (TILs) a signifikantně vyšší poměr CD1a+/DC-LAMP+ buněk (nezralé/zralé dendritické buňky) ve srovnání s pacienty v remisi. Tyto výsledky podporují teorii protinádorového imunitního dohledu – podle něhož imunitní systém kontinuálně rozpoznává a odstraňuje maligní buňky v době jejich vzniku [22]. Nedávno publikovaná data získaná od pacientů s kolorektálním karcinomem prokazují, že právě přítomnost efektorových T lymfocytů v nádorové tkáni je asociována s příznivou prognózou onemocnění [14–18]. Naopak prognostický význam dendritických buněk infiltrujících nádorovou tkáň není stále objasněn [23]. Dendritické buňky patří mezi nejúčinnější antigen prezentující buňky, které hrají klíčovou roli v procesu zahájení plnohodnotné imunitní reakce. V organismu se vyskytují ve dvou vývojových stadiích – jako zralé a nezralé dendritické buňky. Zralé dendritické buňky jsou jediné, které dokážou aktivovat naivní T lymfocyty a tím zahájit primární specifickou imunitní odpověď, naopak v nezralém stavu se podílejí na indukci regulačních T lymfocytů, které specificky potlačují imunitní odpověď proti vlastním tkáním [24]. V souladu s výše uvedeným korelují výsledky i naší studie, u pacientů s recidivou onemocnění bylo v nádorové tkáni prokázáno malé množství zralých dendritických buněk (DC-LAMP+) a velké množství nezralých dendritických buněk (CD1a+) ve srovnání s pacienty v remisi. Pacienti s mutantní formou kodonu 13, nízkou denzitou lymfocytů (TILs) a vysokým poměrem CD1a+/DC-LAMP+ buněk v nádorové tkáni mají vysoké riziko rekurence onemocnění. Tito pacienti jsou vzhledem k přítomnosti K-ras mutace navíc rezistentní na léčbu inhibitory EGFR, a tudíž vystaveni vyššímu riziku úmrtí na nádorové onemocnění. Kombinací molekulárních biomarkerů s analýzou imunitních buněk infiltrujících nádorovou tkáň lze získat slibný prognostický faktor, pomocí kterého bude možné identifikovat rizikové pacienty s karcinomem kolon a racionalizovat adjuvantní onkologickou léčbu. S cílem porovnat infiltráty imunitních buněk u pacientů v remisi a s recidivou onemocnění, byli do souboru primárně vybráni pacienti s recidivou onemocnění (36,4 %) a soubor byl doplněn o pacienty ze stejného období bez recidivy. Pro statistiku bylo potřebné získání podobného počtu pacientů s recidivou a bez recidivy onemocnění.
ZÁVĚR
Pacienti s mutantní formou kodonu 13, nízkou denzitou lymfocytů (TILs) a vysokým poměrem CD1a+/DC-LAMP+ buněk v nádorové tkáni mají vysoké riziko rekurence onemocnění. Vzhledem ke skutečnosti, že tito pacienti jsou rezistentní na léčbu inhibitory EGFR, a tudíž vystaveni vyššímu riziku úmrtí na nádorové onemocnění, měli by být po radikálním chirurgickém výkonu indikováni k adjuvantní onkologické léčbě a pečlivému follow-up.
Seznam zkratek:
CEA – carcinoembryonic antigen
EGFR – epidermal growth factor receptor
K-ras – kirsten rat sarcoma viral oncogene homolog
PCR – polymerase chain reaction
TILs – tumor infiltrating lymphocytes
TNM – tumor node metastasis
MUDr. Petr Kocián
U Dívčích hradů 3289/22
150 00 Praha 5, Smíchov
e–mail: kocian.cz@gmail.com
Sources
1. Chau I, Cunningham D. Adjuvant therapy in colon cancer – what, when and how? Ann Oncol 2006;17(9):1347–59.
2. Chung KY, Saltz LB. Adjuvant therapy of colon cancer: current status and future directions. Cancer J 2007;13(3):192–7.
3. Van Cutsem E, Oliveira J. Primary colon cancer: ESMO clinical recommendations for diagnosis, adjuvant treatment and follow-up. Ann Oncol 2009;20 Suppl4 : 49–50.
4. Bazan V et al. Specific codon 13 K-ras mutations are predictive of clinical outcome in colorectal cancer patients, whereas codon 12 K-ras mutations are associated with mucinous histotype. Ann Oncol 2002;13(9):1438–46.
5. Bos JL et al. Prevalence of ras gene mutations in human colorectal cancers. Nature 1987;327(6120):293–7.
6. Boughdady IS et al. K-ras gene mutations in adenomas and carcinomas of the colon. Surg Oncol 1992;1(4):275–82.
7. Benvenuti S et al. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to anti-epidermal growth factor receptor antibody therapies. Cancer Res 2007;67(6):2643–8.
8. De Roock W et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008;19(3):508–15.
9. Di Fiore F et al. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by Cetuximab plus chemotherapy. Br J Cancer 2007;96(8):1166–9.
10. Lievre A et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J Clin Oncol 2008;26(3):374–9.
11. Andersen SN et al. K-ras mutations and prognosis in large-bowel carcinomas. Scand J Gastroenterol 1997;32(1):62–9.
12. Ince WL et al. Association of k-ras, b-raf, and p53 status with the treatment effect of bevacizumab. J Natl Cancer Inst 2005;97(13): 981–9.
13. Tortola S et al. p53 and K-ras gene mutations correlate with tumor aggressiveness but are not of routine prognostic value in colorectal cancer. J Clin Oncol 1999;17(5):1375–81.
14. Galon J et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 2006;313(5795):1960–4.
15. Chiba T et al. Intraepithelial CD8+ T-cell-count becomes a prognostic factor after a longer follow-up period in human colorectal carcinoma: possible association with suppression of micrometastasis. Br J Cancer 2004;91(9):1711–7.
16. Naito Y et al. CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer. Cancer Res 1998;58(16):3491–4.
17. Ohtani H. Focus on TILs: prognostic significance of tumor infiltrating lymphocytes in human colorectal cancer. Cancer Immun 2007;7 : 4.
18. Ropponen KM et al. Prognostic value of tumour-infiltrating lymphocytes (TILs) in colorectal cancer. J Pathol 1997;182(3): 318–24.
19. Forrester K et al. Detection of high incidence of K-ras oncogenes during human colon tumorigenesis. Nature 1987;327(6120): 298–303.
20. Pretlow TP et al. K-ras mutations in putative preneoplastic lesions in human colon. J Natl Cancer Inst 1993;85(24):2004–7.
21. Vogelstein B et al. Genetic alterations during colorectal-tumor development. N Engl J Med 1988;319(9):525–32.
22. Dunn GP et al. Cancer immunoediting: from immunosurveillance to tumor escape. Nat Immunol 2002;3(11):991–8.
23. Dadabayev AR et al. Dendritic cells in colorectal cancer correlate with other tumor-infiltrating immune cells. Cancer Immunol Immunother 2004;53(11):978–86.
24. Dhodapkar MV et al. Antigen-specific inhibition of effector T cell function in humans after injection of immature dendritic cells. J Exp Med 2001;193(2):233–8.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2012 Issue 8-
All articles in this issue
- Chirurgická léčba jaterních metastáz karcinomu žaludku
- Porucha evakuace žaludku po parciální duodenopankreatektomii
- K-ras mutace a nádory infiltrující lymfocyty u karcinomu kolon, současnost a výhledy
- Poranenie brušnej steny cudzím telesom s neskorou perforáciou GITu
- Komplikace augmentace – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Komplikace augmentace – kazuistika
- Chirurgická léčba jaterních metastáz karcinomu žaludku
- Porucha evakuace žaludku po parciální duodenopankreatektomii
- Poranenie brušnej steny cudzím telesom s neskorou perforáciou GITu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

