-
Medical journals
- Career
Cévní komplikace při transkatetrové implantaci aortální chlopně v IKEM
Authors: J. Malý; M. Želízko 1; I. Netuka; B. Janek 1; O. Szárszoi; T. Kotulák 2; T. Marek 1; J. Pirk
Authors‘ workplace: Klinika kardiovaskulární chirurgie IKEM, Praha, přednosta: prof. MUDr. Jan Pirk, DrSc. ; Klinika kardiologie IKEM, Praha, přednosta: prof. MUDr. Josef Kautzner, CSc. 1; Klinika anesteziologie a resuscitace IKEM, Praha, přednosta: MUDr. Tomáš Kotulák 2
Published in: Rozhl. Chir., 2011, roč. 90, č. 2, s. 106-110.
Category: Monothematic special - Original
Overview
Cíl:
Retrográdní transfemorální arteriální přístup je nejčastějši způsob implantace aortální chlopně. V současnosti dostupné katetry mají limitní velikost pro čistě perkutánní použití. Aktuální velikost námi používaného katetru třetí generace (Medtronic CoreValve Systém) je 18 F. Cílem našeho sdělení jsou periprocedurální cévní komplikace u našeho souboru pacientů.Materiál a metodika:
Hodnotili jsme soubor 35 pacientů (23 žen, 12 mužů), u kterých byla provedena transkatetrová implantace aortální chlopně (TAVI) 18 F katetrem (Medtronic CoreValve) v období od 12/2008 do 7/2010.Výsledky:
Průměrný věk byl 81,4 ± 6,1 roku (69–92); průměrné hodnoty logistického EuroSCORE 19,3 ± 8,9 % (8–42), střední aortální gradient 59,8 ± 19,8 mm Hg (30–86 mm Hg), plocha aortálního ústí 0,37 ± 0,11 cm2/m2 (0,16–0,58) a průměrná ejekční frakce 53 ± 10 %. Technická úspěšnost výkonu byla 100% a v průběhu prvních 30 dnů jsme neměli žádnou závažnou komplikaci (MACE – úmrtí, infarkt myokardu, mozková příhoda – 0 %). Došlo k významnému poklesu aortálního středního gradientu na konečných 3,0 ± 2 mm Hg. Významně se zlepšil klinický stav hodnocený klasifikací NYHA, z průměrných hodnot 3,0 ± 0,5 před výkonem na 1,4 ± 0,4 za 30 dní po výkonu. Komplikace spojené s invazí do cévního řečiště se vyskytly u deseti (29 %) pacientů, kdy byla provedena chirurgická preparace přístupové tepny; dvakrát (6 %) plánovaná (BMI > 35) a osmkrát (23 %) akutní, porucha hojení rány se vyskytla u jedné pacientky (10 %).Závěr:
Cévní komplikace jsou nejčastějším akutním problémem při TAVI. I při použití systému Prostar XL pro perkutánní uzávěr tepny zůstává výskyt těchto komplikací poměrně častý a nese s sebou významný negativní vliv na hospitalizační morbiditu pacientů. Proto je nezbytná úzká multidisciplinární spolupráce při volbě cévního přístupu u jednotlivých pacientů při TAVI.Klíčová slova:
TAVI – cévní komplikace – chirurgická revizeÚVOD
Aortální stenóza je nejčastější chlopenní vadou v populaci [1]. Její výskyt stoupá úměrně prodlužujícímu se věku populace v ekonomicky vyspělých zemích. Etiologie této vady je ve většině případů degenerativní. Po objevení se prvních příznaků (angina pectoris, presynkopální stavy, srdeční selhání) je průměrná doba přežití 2–3 roky. Dosavadním standardem léčby je chirurgická náhrada aortální chlopně biologickou či mechanickou chlopenní protézou. Operační mortalita tohoto výkonu osciluje v rozmezí 1,2–6,1 % podle rizikovosti dané skupiny pacientů (nezávislé rizikové faktory jsou definovány věkem nad 80 let (v současnosti kolem 20 %), klasifikací NYHA III-IV stupně, ženským pohlavím, EF LK < 30 %, závažným koronárním nálezem vyžadujícím rekonstrukci, DM na inzulinu, těžkou CHOPN, CHRI a dalšími faktory). Ve zkušených centrech se průměrná mortalita pohybuje kolem 3 %. I přes to, že je chirurgický výkon zejména u populace nad 75 let zatížen vyšší morbiditou a mortalitou, je vzhledem ke klinickému přínosu pro pacienta i pro tyto skupiny nemocných zlatým standardem léčby. Avšak až u třetiny nemocných ve věkové skupině nad 75 let je chirurgický výkon z důvodu vysokého rizika kontraindikován. Jedinou alternativou chirurgického řešení zůstávala v minulosti balonková katetrizační dilatace aortálního ústí (Cribier, 1985). Její středně až dlouhodobé výsledky byly neuspokojivé, proto se dnes provádí jen ve výjimečných indikacích. První humánní transkatetrová implantace aortální chlopně byla provedena v roce 2002 [2]. V posledních dvou letech došlo díky komerčnímu uvedení (CE) dvou technologických platforem (Medtronic CoreValve, Edwards SAPIEN) k prudkému rozvoji techniky transkatetrové implantace aortální chlopně, která začíná být v současnosti u nejrizikovějších skupin pacientů nad 75 let považována za alternativu chirurgické chlopenní náhrady [3, 4]. V našem Institutu používáme systém Medtronic CoreValve s užším profilem katétru (18 F), který umožňuje v optimální situaci plně perkutánní implantaci aortální chlopně. K uzávěru tepny je v tomto případě použit systém Prostar XL (Abbott Vascular, 10 F). Komplikace spojené se samotným výkonem jsou krvácivé (perforace levé komory či aortálního kořene), cévní (disekce tepenného řečiště, lacerace přístupové tepny, periprocedurální akutní infarkt myokardu) a převodní (poruchy rytmu jako důsledek implantace s následným zavedením permanentní kardiostimulace). Nejčastější závažnou komplikací je lacerace spojená s následným krvácením přístupové tepny (nejčastěji arterie femoralis communis). „The 18 F CoreValve Expanded Evaluation Registry“, což je aktuálně jediný souhrnný zdroj dat z referenčních pracovišť, udává celkový výskyt cévních komplikací u třetí generace těchto katetrů 9,2 % [5, 6]. Cílem této práce je prezentovat 30denní výskyt cévních komplikací u našeho souboru a definovat optimální strategii výběru cévního přístupu při TAVI.
MATERIÁL A METODA
K transkatetrové implantaci aortální chlopně (dále TAVI) jsou indikováni nemocní se symptomatickou hemodynamicky významnou aortální stenózou (angina pectoris CCS 2–4, námahová dušnost NYHA II–IV, presynkopální stavy až synkopy, plocha aortálního ústí < 1,0 cm2 nebo 0,5–0,6 cm2/m2). Základním zobrazovacím vyšetřením je echokardiografie (transtorakální a jícnová, pro významnost aortální vady je rozhodující plocha aortálního ústí; definuje eventuální přítomnost jiných chlopenních vad, funkci levé komory srdeční, plicní hypertenzi), CT bulbu a oblouku aorty a pánevních tepen (rozměry aorty, průměr pánevních tepen, kalcifikace a vinutí) a dále kompletní srdeční katetrizace s výpočtem plochy aortálního ústí, angiografií levé komory srdeční, bulbu aorty a pánevního řečiště (kalibrace), případně spojená s perkutánní koronární intervencí s implantaci stentu před výkonem v případě významných koronárních stenóz). U nemocných je zároveň nutné vyloučit infekční fokusy (stomatologický, ORL, gynekologický). Pacienti, které v současnosti indikujeme k TAVI, musejí splňovat následující klinická a morfologická kritéria: velikost aortálního anulu v rozmezí 20–27 mm, rozměr aorty 5 cm nad chlopní < 43 mm (40 mm pro chlopeň velikosti 26 mm), příznivý odstup koronárních tepen (výška Valsalvova sinu > 10 mm, normální nebo vysoký odstup koronárních tepen), vhodný cévní přistup (průměr femorálních tepen > 6 mm, nepřítomnost výrazného vinutí pánevních tepen či těžkých aterosklerotických změn), věk nad 75 let, vysoké operační riziko (logistické EuroSCORE > 15 nebo tzv. STS Score > 10) nebo věk nad 65 let spolu s některou z následujících závažných komorbidit: chronické plicní onemocněni – FEV1 (jednovteřinova vitální kapacita < 1 l), předchozí kardiochirurgický výkon, problematický přistup k srdci pro kardiochirurga (stavy po radiaci, popálení apod.), porcelánová aorta, závažná plicní hypertenze (systolický tlak v plicnici > 60 mm Hg), dysfunkce pravé komory srdeční, systémové onemocnění pojiva, jaterní cirhóza typu Child A nebo B. Nezbytným předpokladem zařazení nemocných do vyšetřovacího programu s následným provedením TAVI je adekvátní životní prognóza. Všechny výkony u vysoce selektované skupiny pacientů byly prováděny v katetrizační laboratoři za přítomnosti intervenčního kardiologa, kardiochirurga a anesteziologa v klidné analgosedaci v lokální anestezii. Vlastní výkony byly v optimálním případě prováděny v lokální anestezii (Obr. 1). Cestou vena jugularis interna je zaveden centrální žilní katétr a následně stimulačni elektroda (5–6 F) do hrotu pravé komory srdeční. Vstupem přes arterii femoralis nebo arterii radialis zavádíme „pigtail“ katetr do oblasti bulbu aorty, kde slouží k provedení kalibrační angiografie a kontrole pozice implantované chlopně. Cestou kontralaterální femorální tepny je nejprve založena budoucí sutura tepny (systém Prostar XL) a poté je zavedeno pouzdro 18 F. Poté retrográdně pronikáme přes aortální chlopeň do levé komory a provádíme balonkovou dilataci aortální chlopně (použita rychlá stimulace komor o frekvenci 160–180/min ke snížení průtoku přes aortální chlopeň a stabilizaci dilatačního balonku). Následně je retrográdně zavedena a implantována vlastní chlopeň Medtronic CoreValve (velikost podle rozměru aortálního anulu). Poté se provádí kontrola polohy implantované chlopně, kontrolní měření gradientu a angiografie bulbu aorty k vyloučení významné aortální regurgitace. Výkon končí odstraněním zaváděcího katetru a sheathu 18 F s dotažením připravené sutury tepny (Prostar XL). Při eventuální následné cévní komplikaci jsou pacienti převezeni na operační sál k chirurgické revizi (cévnímu rekonstrukčnímu výkonu) v celkové anestezii [7, 8].
Image 1. Technika implantace Fig. 1. Technique of implantation 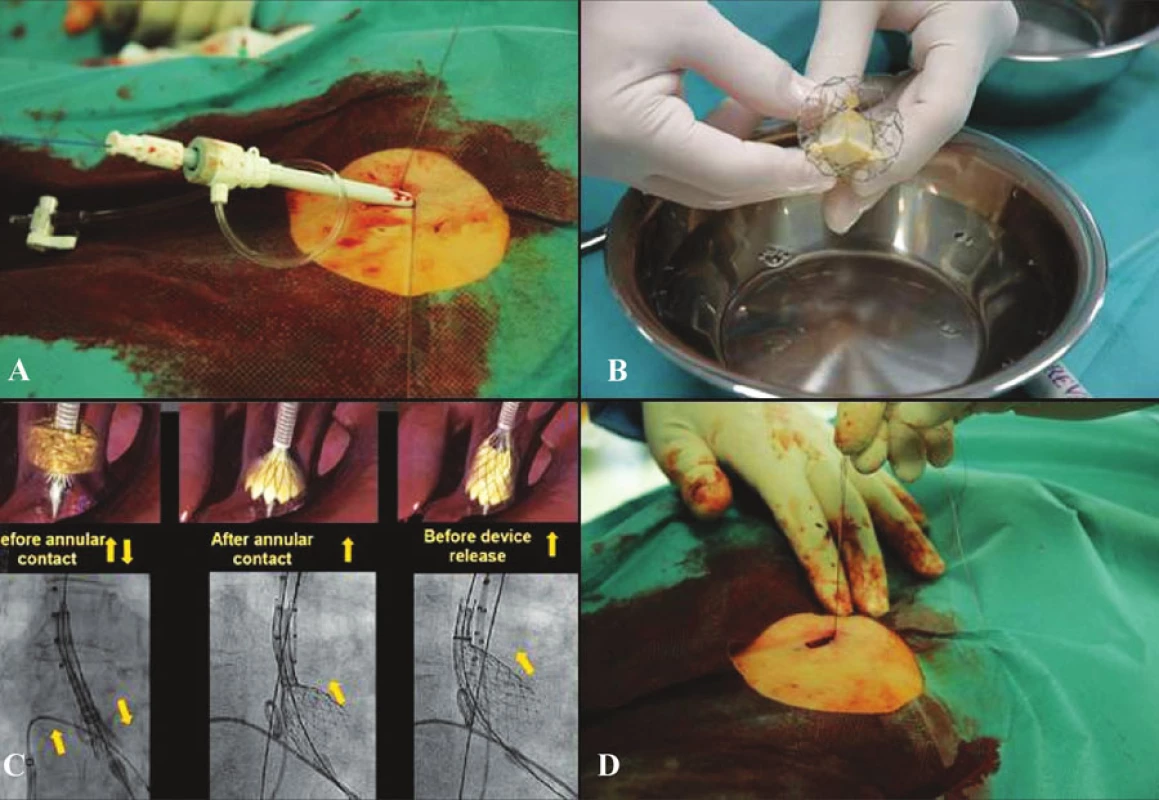
VÝSLEDKY
V období prosinec 2008 – červenec 2010 bylo provedeno 35 transkatetrálních implantací aortální chlopně (systém Medtronic Core-Valve ReValving® třetí generace) u nemocných s těsnou aortální stenózou. Vstupní charakteristiky pacientů jsou uvedeny v tabulkách 1, 2. Technická úspěšnost výkonu byla 100%. V průběhu prvních 30 dnů se nevyskytla žádná závažná komplikace související s výkonem (MACE – úmrtí, infarkt myokardu, mozková příhoda – 0 %) (Tab. 3) [9, 10]. Došlo k významnému poklesu aortálního středního gradientu a významně se zlepšil klinický stav hodnocený klasifikací NYHA (Graf 1.). Jedinými závažnými komplikacemi výkonu na sledované skupině pacientů byly komplikace cévní. Vstupem do cévního systému bylo ve všech případech pánevní řečiště. Všem pacientům byla provedena angiografie a MSCT pánevního řečiště a periferních cév dolních končetin. Byly hodnoceny stupně kalcifikace, vinutí pánevních cév, aterosklerotické změny a diametr přístupové tepny (min. 6 mm), ve většině případů arterie femoralis communis v oblasti bifurkace. Z celkového počtu 35 nemocných byla u deseti pacientů (29 %) provedena chirurgická preparace přístupové tepny, z toho dvakrát (6 %) plánovaná (BMI > 35) a osmkrát (23 %) akutní. Akutní revize byly provedeny ve dvou případech přímo v katetrizační laboratoři z důvodu silného krvácení a v šesti případech bylo možno pacienty převézt na chirurgický operační sál (Obr. 2). Přístupová tepna byla třikrát ošetřena plastikou pomocí protézy (Hemashield) a sedmkrát přímou suturou arterie (Obr. 3). U jedné pacientky (10 %) se chirurgická preparace následně zkomplikovala poruchou hojení rány (agens Staphyloccocus aureus) s prodloužením doby hospitalizace.
Table 1. Charakteristika souboru pacientů Tab. 1. Patient group characteristics 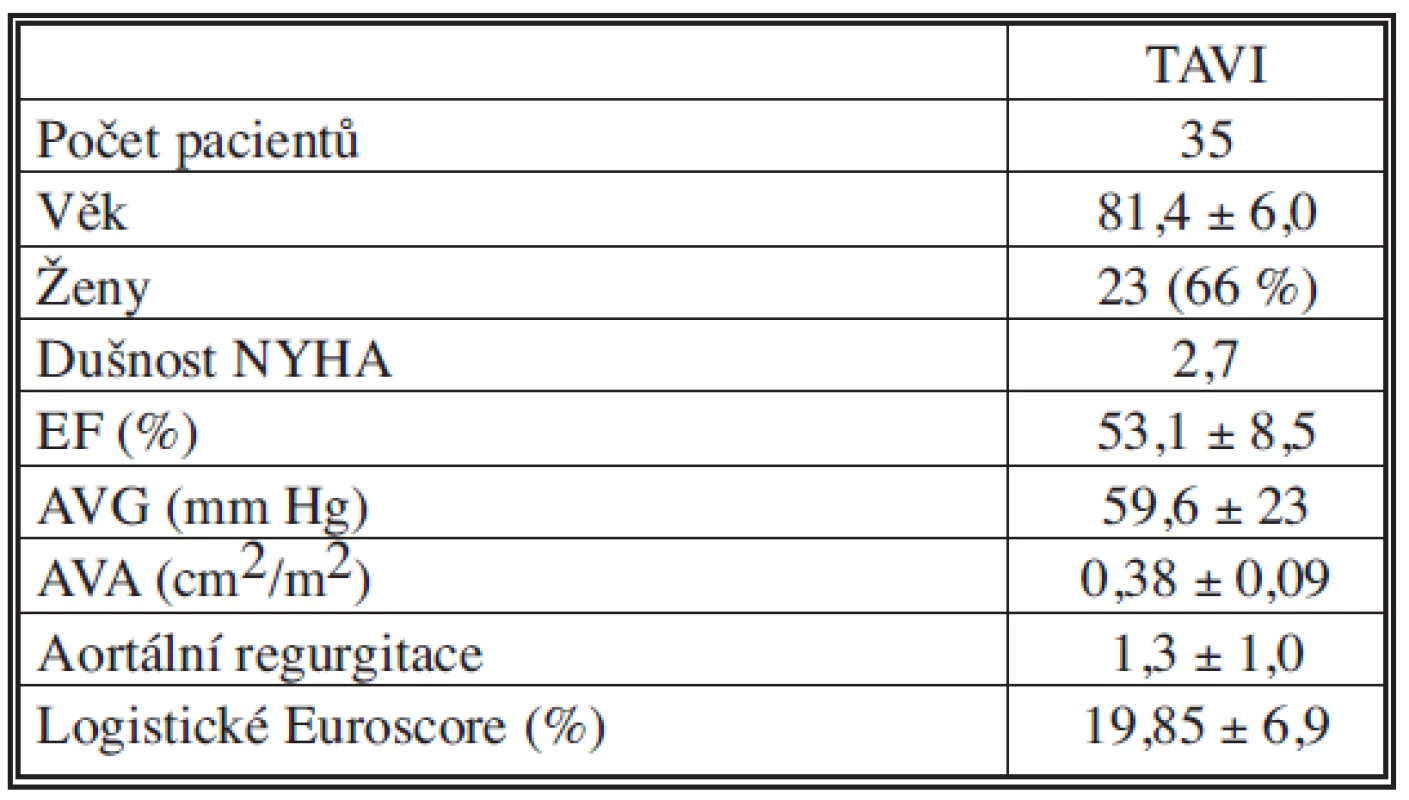
Table 2. Přidružená onemocnění Tab. 2. Associated disorders 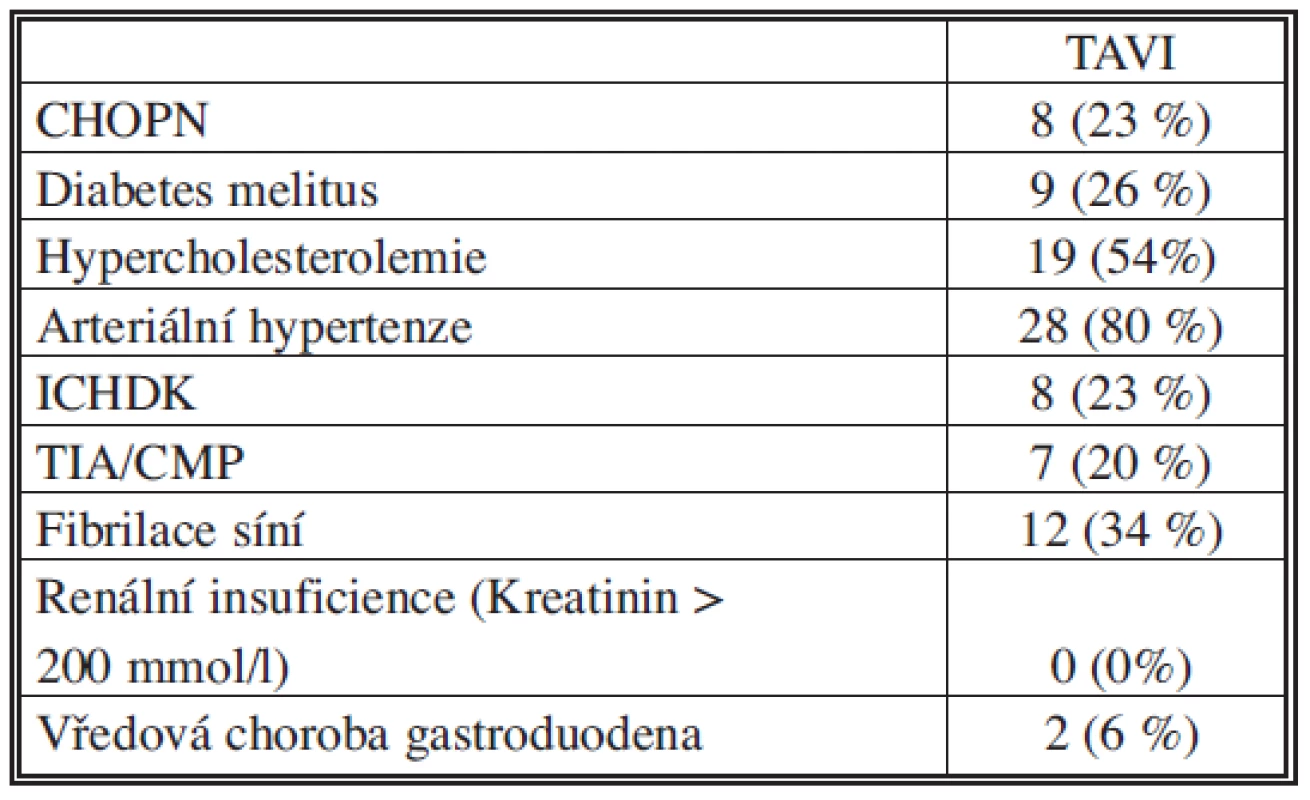
Table 3. Výsledky TAVI Tab. 3. TAVI outcomes 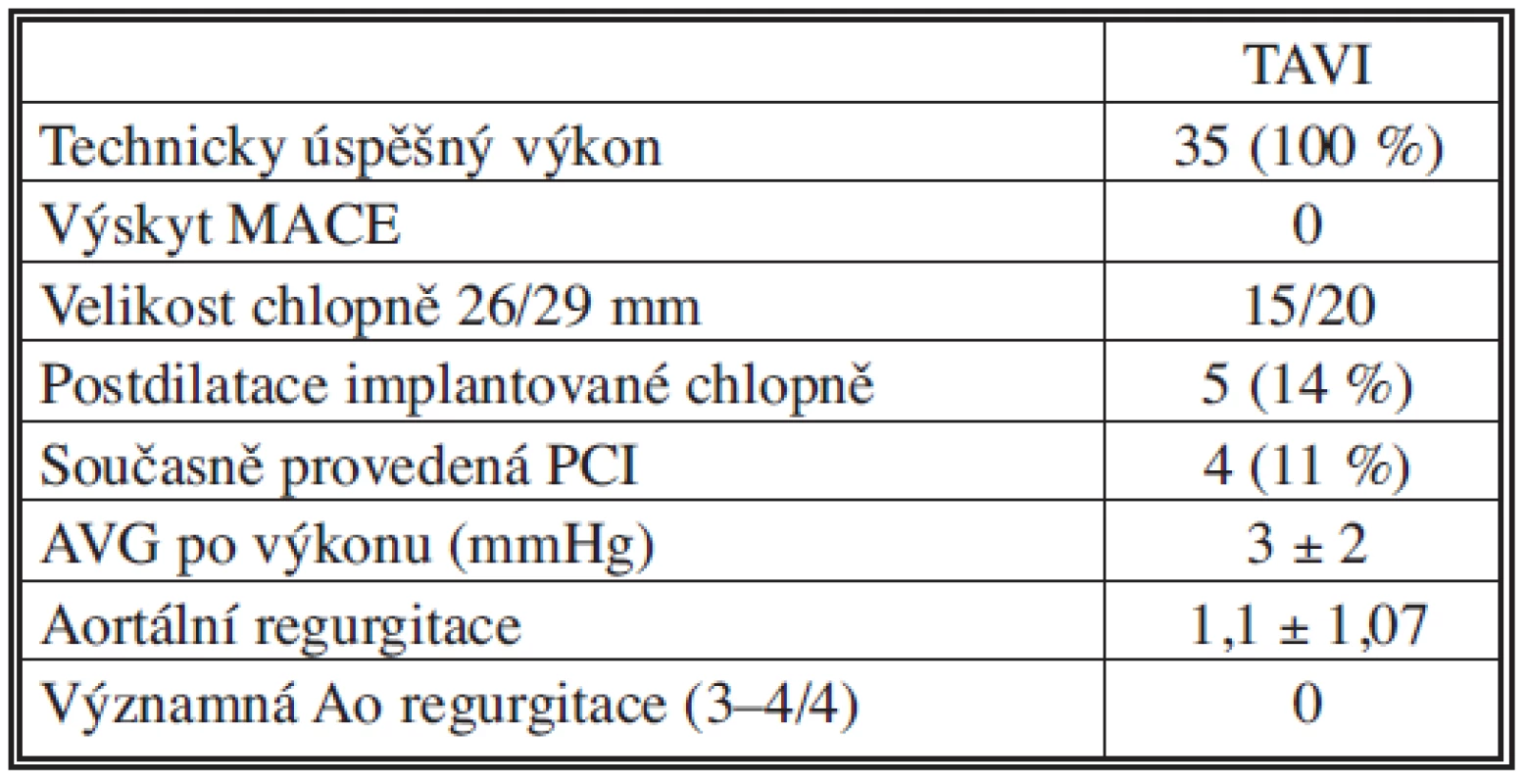
Graph 1. Srovnání gradientů na aortální chlopni a stupně NYHA před a po výkonu Graph 1. Comparison between pre and postoperative values of aortic valve gradients and NYHA grades 
Image 2. Lacerace stehenní tepny Fig. 2. Femoral artery laceration 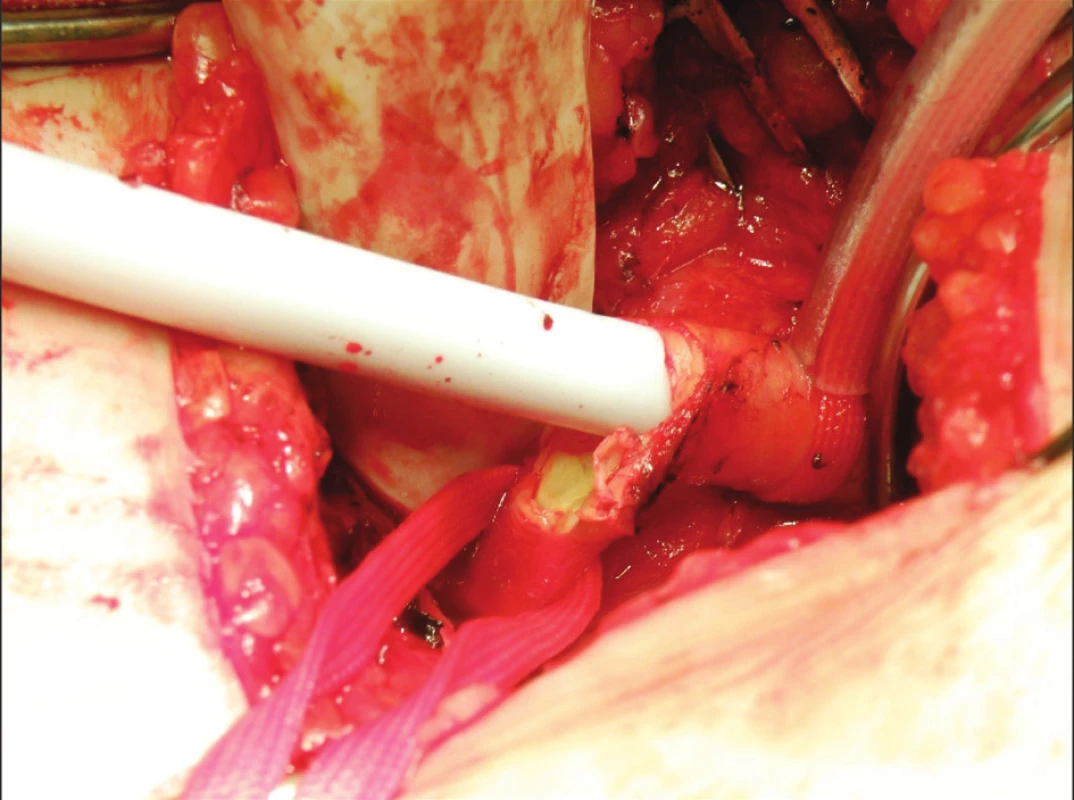
Image 3. Plastika stehenní tepny Fig. 3. Femoral artery surgery 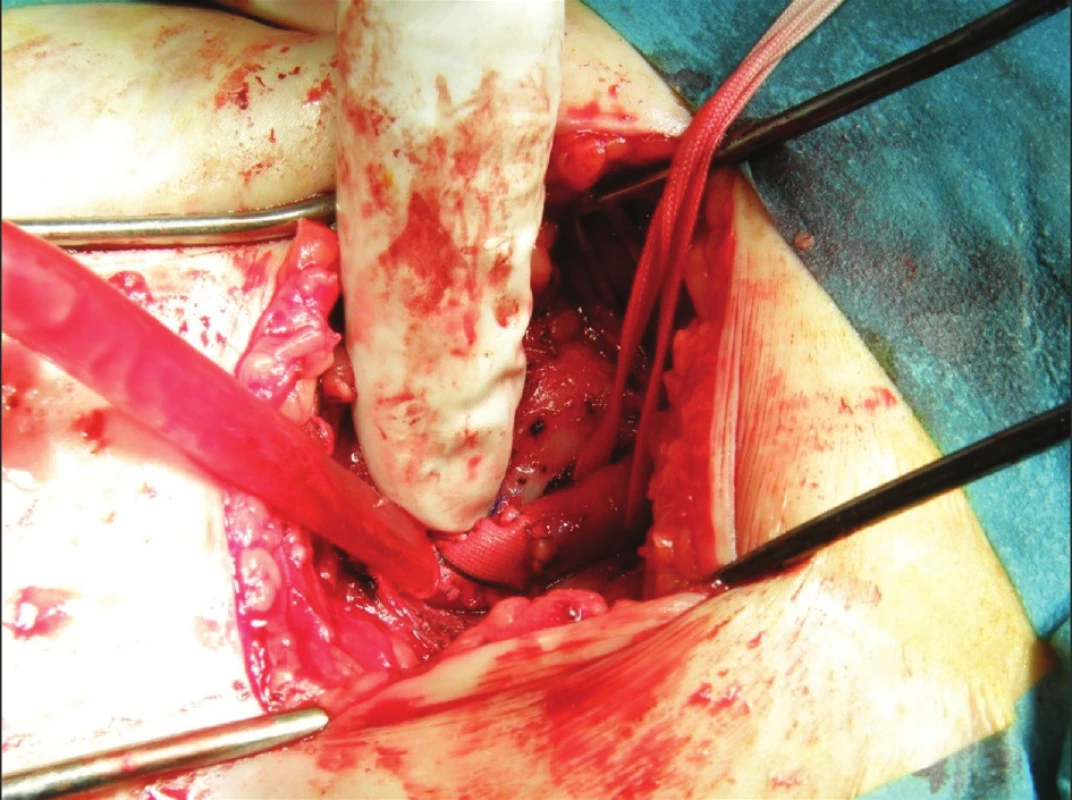
DISKUSE
Cílem tohoto sdělení bylo definovat a kvantifikovat pojem cévní komplikace u transkatetrové implantace aortální chlopně u našeho souboru pacientů. Prevalence závažných cévních komplikací se v aktuálních publikovaných souborech pohybuje v rozmezí 13–16 %. V rámci sledování kanadského multicentrického programu TAVI se vyskytly tyto komplikace u 13 % pacientů, avšak s extrémní 25% mortalitou. Dalším extrémem publikovaným v poslední době je práce Piazza et al., kde je výskyt závažných cévních komplikací jen u 1,9 % sledovaných pacientů. Obě tyto práce se vymykají standardním údajům a problémem tedy nadále zůstává definovat přesně pojem závažná cévní komplikace vzhledem k časné morbiditě a mortalitě. U plánovaných intervencí byla nutnost chirurgické preparace dána extrémní obezitou a aterosklerotickými změnami pánevního řečiště, zatímco u akutních byla způsobena nedostatečným uzávěrem femorální tepny systémem Prostar XL (Abbott Vascular, Redwood City, CA, USA), který je používán k perkutánnímu uzávěru tepny po výkonu. Okamžité chirurgické řešení cévní komplikace u TAVI či dokonce chirurgická preparace tepny již před výkonem u komplikovaných pacientů (obezita, pánevní řečiště s těžkými aterosklerotickými změnami či s hraničním diametrem přístupové cévy) má podle našeho názoru zásadní vliv na pooperační morbiditu pacientů. Četnost ranných komplikací je přijatelná vzhledem ke vstupní vysoce rizikové charakteristice souboru. Pokud se na základě předoperačních vyšetření (MSCT, angiografie) přístup přes pánevní řečiště jeví jako rizikový či dokonce nevhodný, je nutné zvážit další alternativní přístupy, zejména transapikální a subklaviální [11, 12, 13, 14]. V recentních publikacích je při použití obou v současnosti komerčně dostupných systémů (Medtronic, Edwards) uváděna úspěšnost výkonu při přístupu přes pánevní řečiště kolem 70 % pacientů [15], u dalších 30 % je nutné použití alternativních přístupů (Tchetche et al). Námi hodnocený soubor pacientů byl vysoce selektovanou skupinou s ohledem na vstupní parametry. Ke zvládnutí tzv. „learning curve“ jsme měli u prvních dvaceti pacientů velmi přísně stanovena vstupní kritéria výrobcem firmou CoreValve. Následně byl výběr kandidátů limitován tím, že naše pracoviště dosud používalo jen systém Medtronic CoreValve, který neumožňuje transapikální implantaci chlopně přes hrot levé komory; k samotnému výkonu jsme v rámci optimálního zvládnutí techniky implantace používali jen přístup retrográdní arteriální přes pánevní řečiště.
ZÁVĚR
Zlatým standardem nadále zůstává chirurgická náhrada aortální chlopně, nicméně prudký rozvoj TAVI bude zejména u pacientů s vysokým perioperačním rizikem klasického chirurgického výkonu posunovat indikační kritéria a rozšiřovat skupinu pacientů indikovaných k transkatetrovému řešení. Nadále nebude možné implantovat chlopně jen ideálním selektovaným kandidátům, proto bude v blízké budoucnosti nutná kombinace jednak implantačních systémů [16], které jsou již komerčně k dispozici, jednak u jednotlivých pacientů individuální volby přístupu do cévního řečiště, který zůstává vzhledem k profilu dostupných katétrů problematickým místem transkatétrové techniky.
MUDr. Jiří Malý, Ph.D.
IKEM
Vídeňská 1958/9
140 21 Praha
e-mail: jiml@medicon.cz
Sources
1. Ross, J. Jr., Braunwald, E. Aortic stenosis. Circulation, 1968; 38(1 Suppl): 61–67.
2. Cribier, A., Eltchaninoff, H., Bash, A., et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation, 2002; 106 : 3006–3008.
3. Grube, E., Schuler, G., Buellesfeld, L., et al. Percutaneous aortic valve replacement for severe aortic stenosis in high-risk patients using the second - and current third-generation self-expanding CoreValve prosthesis: device success and 30-day clinical outcome. J. Am. Coll. Cardiol., 2007; 50 : 69–76.
4. Dewey, T. M., Brown, D. L., Das, T. S., et al. High-risk patients referred for transcatheter aortic valve implantation: management and outcomes. Ann. Thorac. Surg., 2008; 86 : 1450–1456 [discussion 1456–1457].
5. Vahanian, A., Alfieri, O., Al-Attar, N., et al. Transcatheter valve implantation for patients with aortic stenosis: a position statement from the European Association of Cardio-Thoracic Surgery (EACTS) and the European Society of Cardiology (ESC), in collaboration with the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur. Heart J., 2008; 29 : 1463–14670.
6. Webb, J. G., Pasupati, S., Humphries, K., et al. Percutaneous transarterial aortic valve replacement in selected high-risk patients with aortic stenosis. Circulation, 2007; 116 : 755–763.
7. Masson, J.-B., Al Bugami, S., Webb, J. G. Endovascular balloon occlusion for catheter-induced large artery perforation in the catheterization laboratory. Catheter Cardiovasc. Interv., 2009; 73 : 514–518.
8. Berry, C., Cartier, R., Bonan, R. Fatal ischemic stroke related to non permissive peripheral artery access for percutaneous aortic valve replacement. Catheter Cardiovasc. Interv., 2007; 69 : 56–63.
9. Webb, J. G., Altwegg, L., Boone, R. H., et al. Transcatheter aortic valve replacement: impact on clinical and valve-related outcomes. Circulation, 2009; 119 : 3009–3016.
10. Tuzcu, M. E. Transcatheter aortic valve replacement malposition and embolization: innovation brings solutions also new challenges. Catheter Cardiovasc. Interv., 2008; 72 : 579–580.
11. Walther, T., Simon, P., Dewey, T., et al. Transapical minimally invasive aortic valve implantation: multicenter experience. Circulation, 2007; 116: I240–245.
12. Ruge, H., Lange, R., Bleiziffer, S., et al. First successful aortic valve implantation with the CoreValve ReValving System via right subclavian artery access: a case report. Heart Surg. Forum, 2008; 11: E323–324.
13. Bauernschmitt, R., Schreiber, C., Bleiziffer, S., et al. Transcatheter aortic valve implantation through the ascending aorta: an alternative option for no-access patients. Heart Surg. Forum, 2009; 12: E63–64.
14. Walther, T., Dewey, T., Borger, M. A., et al. Transapical aortic valve implantation: step by step. Ann. Thorac. Surg., 2009; 87 : 276–283.
15. Piazza, N., Wenaweser, P., van Gameren, M., et al. Relationship between the logistic EuroSCORE and the Society of Thoracic Surgeons Predicted Risk of Mortality score in patients implanted with the CoreValve ReValving system – a Bern-Rotterdam Study. Am. Heart J., 2010; 159 : 323–329.
16. Webb, J. G., Altwegg, L., Masson, J. B., et al. A new transcatheter aortic valve and percutaneous valve delivery system. J. Am. Coll. Cardiol., 2009; 53 : 1855–1858.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 2-
All articles in this issue
- Simultánní transplantace ledviny a Langerhansových ostrůvků
- Transplantace jater u pacientů s trombózou portální žíly
- Časné biliární komplikace po transplantaci jater
- První Česko-Slovenská domino transplantace jater
- Vývoj chirurgické techniky transplantací pankreatu v IKEM
- Imunosuprese po transplantaci žilních allograftů – naše zkušenosti
- Vliv biologických lepidel na cévní stěnu v modelu disekce aorty v experimentu
- Technika implantace a zkušenosti s dočasnou mechanickou srdeční podporou při selhání pravé komory
- Výsledky kombinované plastiky mitrální a náhrady aortální chlopně v IKEM Praha
- Kardiochirurgické operace u pacientů odmítajících krevní transfuze: výsledky v IKEM
- Cévní komplikace při transkatetrové implantaci aortální chlopně v IKEM
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Časné biliární komplikace po transplantaci jater
- Kardiochirurgické operace u pacientů odmítajících krevní transfuze: výsledky v IKEM
- Výsledky kombinované plastiky mitrální a náhrady aortální chlopně v IKEM Praha
- Vývoj chirurgické techniky transplantací pankreatu v IKEM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

