-
Medical journals
- Career
Vezikoureterální reflux u dětí: stále mnoho nezodpovězených otázek
: MUDr. Ph.D. Jakub Zieg
: Pediatrická klinika 2. LF UK a FN Motol
: Čas. Lék. čes. 2016; 155: 141-144
: Review Article
Vezikoureterální reflux (VUR) je nejčastější vrozenou vadou uropoetického traktu v dětském věku. Za zlatý standard v diagnostice VUR se považuje vyšetření mikční cystouretrografií, sonografické metody k detekci refluxu představují alternativu, ale zatím nejsou v praxi rutinně dostupné. Statické scintigrafie se využívá při pátrání po jizvení ledvin − tzv. refluxové nefropatii (RN), a to jak vrozené, vznikající vlivem prenatálního poškození ledvin, tak získané, jež se objevuje po proběhlé akutní pyelonefritidě (APN).
Rizikovými faktory vzniku RN jsou VUR, opakované APN, dysfunkce dolních močových cest a časová prodleva v zahájení léčby febrilní močové infekce. Mezi léčebná opatření určená k prevenci recidivy APN u dětí s VUR patří profylaktické podávání antibiotik, chirurgická intervence nebo pouhá observace. Závěry studií zabývajících se léčbou dětí s VUR jsou nejednoznačné, a proto také nejsou k dispozici jednotná terapeutická doporučení.Klíčová slova:
vezikoureterální reflux, refluxová nefropatie, infekce močových cest, dětiÚvod
Nejčastější vrozenou vadou uropoetického traktu v dětském věku je vezikoureterální reflux (VUR). Lze jej definovat jako zpětný tok moči do jednoho či obou močovodů, eventuálně do dutého systému ledviny. Za jediné vhodné vyšetření při prvotní diagnostice VUR je pokládána mikční cystouretrografie (MCUG). Reflux nejčastěji diagnostikujeme po proběhlých infekcích močových cest (IMC). VUR se dělí podle mezinárodní klasifikace do 5 stupňů (1) (viz obr. 1). Zatímco VUR 1. stupně představuje reflux moči pouze do distální části ureteru, VUR 5. stupně označuje reflux dilatovaným močovodem do výrazně rozšířené pánvičky i kalichů. Pokud se VUR zobrazuje již při plnění močového měchýře kontrastní látkou, hovoříme o pasivním refluxu, aktivní reflux je patrný až při mikci.
Zatímco příčinou primárního VUR je vrozená insuficience ureterovezikálního spojení, sekundární VUR vzniká při patologických změnách močových cest souvisejících se zvýšením intravezikálního tlaku − např. neurogenní měchýř, subvezikální obstrukce močových cest. Víme již několik desetiletí, že přítomnost VUR je rizikovým faktorem pro vznik febrilní IMC i pro jizvení renálního parenchymu, tedy trvalého poškození parenchymu ledvin, tzv.refluxové nefropatie (RN). Riziko vzniku RN je přímo úměrné závažnosti VUR (2).
1. Klasifikace VUR dle závažnosti podle The International classification of vesicoureteral reflux (obrázek podle předlohy vytvořila MUDr. Lucie Gonsorčíková, Ph.D.) (1). 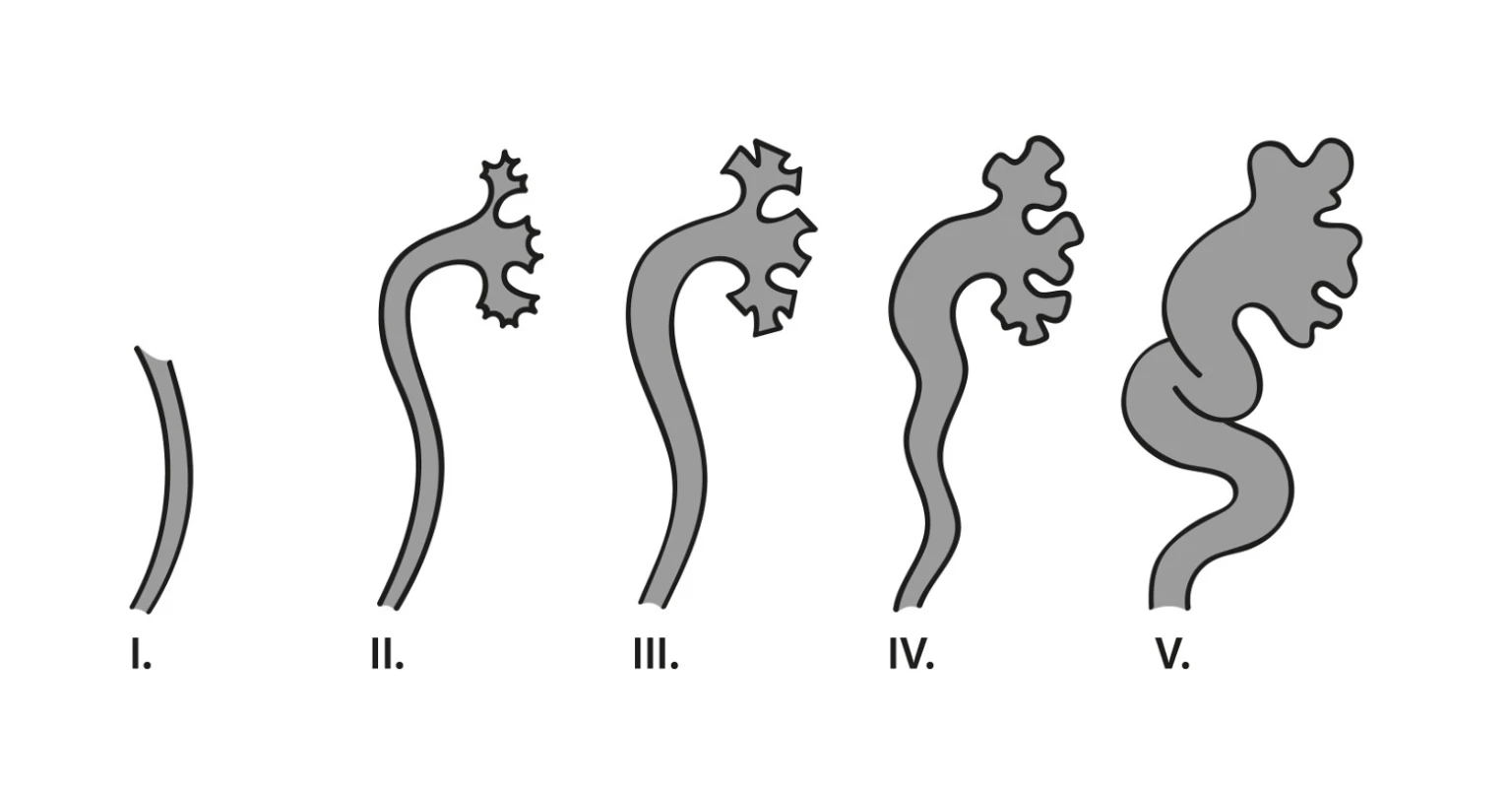
Epidemiologie
Přesná incidence VUR není známa, jelikož nelze z etických důvodů vzhledem k povaze vyšetření provádět MCUG zdravým dětem. Prevalence VUR u dětí po prodělané febrilní IMC je udávaná v rozmezí 30−45 % (3). Studie uvádějí vyšší výskyt VUR v bělošské populaci ve srovnání s populací černošskou. Je známa také genetická predispozice pro VUR u sourozenců dětí s VUR. Obecně se udává riziko 30−40 % pro sourozence pacienta s refluxem, v případě jednovaječných dvojčat je riziko ještě vyšší (80 %). V posledních letech probíhá intenzivní výzkum genetické podstaty VUR; předpokládá se značná genetická heterogenita, pouze u sedmi evropských rodin byl zmapován lokus zodpovědný za VUR v oblasti chromosomu 1 (4). U dětí s VUR byl popsán i častější výskyt dalších anomálií močového traktu (5).
Diagnostika vezikoureterálního refluxu a refluxové nefropatie
MCUG slouží k zobrazení přesné anatomie uropoetického traktu. Výhodou tohoto vyšetření je přesné zobrazení dutého systému ledviny, močovodů, močového měchýře i uretry. Mezi nevýhody MCUG patří nutnost katetrizace měchýře a expozice ionizujícímu záření, a proto by měla být indikace MCUG u dítěte vždy pečlivě zvážena. Dříve se toto vyšetření provádělo s odstupem několika týdnů po APN, aby se předešlo falešně pozitivním výsledkům při detekci VUR. Posléze se však ukázalo, že pacienti mohou podstoupit MCUG již v rámci hospitalizace dítěte s APN se zaléčenou infekcí a negativní močovou kultivací. Doporučený postup provedení MCUG u dětí byl publikován v časopisu Česká radiologie (6).
Novou metodu pro diagnostiku VUR představuje mikční sonografie. Pacientovi se intravezikálně podá kontrastní látka a VUR se detekuje ultrazvukovou sondou. Výhodou mikční sonografie je, že toto vyšetření není spojeno s expozicí rentgenovému záření. V rukách zkušeného radiologa je mikční sonografie vyšetřením s vysokou senzitivitou i specificitou, ale zatím se v České republice rutinně nevyužívá.
Své místo ve vyšetřování VUR mají rovněž radionuklidové metody: rozlišujeme přímou a nepřímou MCUG. Zatímco přímá MCUG probíhá podobně jako klasická rentgenová cystografie, kdy se intravezikálně podává značený radionuklid − nejčastěji 99mTc-merkaptoacetyltriglycin (99mTcMAG3), nepřímá MCUG je součástí dynamické scintigrafie a močový měchýř se plní fyziologicky. Nepřímou MCUG lze provést pouze u dětí starších 2−3 let, jež jsou schopny regulovat dobu provedení mikce. K vyšetření není nutné zavádět močový katetr, ale musíme brát v úvahu nižší senzitivitu při detekci VUR 1. a 2. stupně a pasivního VUR. Izotopová vyšetření nejsou vhodná k primární diagnostice VUR, jelikož neposkytují dostatečnou informaci o přesné morfologii vývodných močových cest. Radionuklidovou MCUG tedy využíváme spíše pro kontrolu u dětí s již diagnostikovaným VUR.
K ozřejmění jizvení ledvin, refluxové nefropatie, provádíme statickou scintigrafii. Dítěti se aplikuje 99mTc-dimerkaptosukcinát ( 99mTcDMSA), který je vychytáván a zadržován buňkami proximálního tubulu. Toto vyšetření nám umožňuje zobrazit renální parenchymové poškození, navíc získáváme informaci o stranové funkci ledvin. DMSA tedy můžeme využít v diagnostice APN přímo v době onemocnění, ale i k průkazu RN, kdy se vyšetření provádí s odstupem alespoň 6 měsíců od proběhlé infekce. RN se obvykle objevuje u pacientů s VUR po proběhlé APN, nicméně rovněž víme, že se může vyskytovat po proběhlé febrilní IMC bez přítomnosti VUR a také že RN nalézáme u pacientů s VUR bez APN v anamnéze. RN považujeme za kongenitální v případě, kdy jizvení ledvin vzniká prenatálně a dítě se narodí již s poškozenými ledvinami. Získanou formu RN nacházíme v souvislosti s poškozením ledvin po proběhlé APN. Kongenitální RN je častější u chlapců, postnatální poškození ledvin jizvením vídáme častěji u dívek. Vzhledem k tomu, že DMSA neodliší jizvy vzniklé prenatálně od poškození způsobeného APN, může být u některých pacientů obtížné určit, zda je jejich postižení vrozené, nebo získané (7).
Komplikace refluxové nefropatie
Komplikace RN jsou dobře známé, nemáme však k dispozici přesná data o jejich četnosti v populaci. Podle výroční zprávy North American Pediatric Renal Trials and Collaborative Studies představuje RN čtvrtou nejčastější příčinu chronického onemocnění ledvin u dětí (8). I v dalších epidemiologických studiích byl prokázán vliv RN na sníženou funkci ledvin. Vyšší riziko poruchy funkce ledvin mají především pacienti s oboustranným jizvením ledvin. U pacientů s RN se také častěji objevuje nález mikroalbuminurie a proteinurie v rámci poškození ledvin.
RN je dále spojena s vyšším výskytem fokálně segmentální glomerulosklerózy, jejíž patogeneze není doposud zcela jasná. Příčinou je pravděpodobně glomerulární hyperfiltrace v kombinaci s imunologickým poškozením ledvin.
Za možný následek jizvení ledvin je považována rovněž hypertenze. Některé studie prokázaly vyšší výskyt hypertenze u dětí (17−30 %) i dospělých (34−38 %), jiné práce ale vyšší incidenci hypertenze u dětí s RN nezjistily. Vzhledem k rozdílným závěrům je k určení rizika hypertenze zapotřebí provést další klinické studie s dlouhodobým sledováním (7, 9).
Přístup k pacientům s vezikoureterálním refluxem
V případě primárního VUR víme, že antirefluxní mechanismy dozrávají v čase a že velká část dětí z refluxu "vyroste". Reflux nižšího (1.−2.) stupně vymizí dříve než dilatující VUR (3.−5. stupně). Rozsáhlá studie, do níž bylo zařazeno 735 dětí, ukázala, že medián doby potřebné k vymizení refluxu u dětí s nižším stupněm VUR byl 38 měsíců, u dětí s VUR 3. stupně 98 měsíců a u pacientů s VUR 4. a 5. stupně 156 měsíců (10).
Indikace MCUG se v posledních letech výrazně zúžily. Zatímco Americká pediatrická akademie doporučovala v roce 1999 provádět MCUG u všech dětí ve věku od 2 měsíců do 2 let již po první atace APN, v roce 2011 již doporučovala toto vyšetření pouze u dětí s opakovanou APN nebo u pacientů s abnormálním sonografickým nálezem, dále u dětí s jinou etiologií APN než Escherichia coli, eventuálně u jedinců s těžkým průběhem APN (11). Tyto závěry jsme potvrdili i v retrospektivní studii provedené ve FN Motol, kdy jsme vyhodnotili data 182 dětí ve věku od 2 měsíců do 2 let po první atace APN. Zjistili jsme, že pacienti s opakovanými APN měli signifikantně vyšší výskyt VUR i dilatujícího VUR. Pokud bychom postupovali podle amerických doporučení z roku 2011, ušetřili bychom 64 dětí invazivního vyšetření MCUG (12).
Kvalitně provedené ultrazvukové vyšetření výrazně napomáhá výběru pacientů indikovaných k provedení MCUG. Evropská urologická společnost nicméně nadále doporučuje provedení MCUG u všech dětí do 2 let po první atace APN. Některá centra používají tzv. top-down přístup. K diagnostice APN využívají DMSA a u dětí s patologickým nálezem na DMSA indikují provedení MCUG. V současnosti není doporučení pro vyšetřování dětí po prodělání APN jednotné, v posledních letech se však objevuje zjevná snaha o racionální indikaci MCUG a také se klade důraz na kvalitně provedené sonografické vyšetření.
Léčba
Cílem léčby pacienta s VUR je snížit výskyt IMC a bránit dalšímu poškozování ledvin. Důležitá je rovněž minimalizace zátěže pro pacienta s ohledem na vyšetření i léčebná opatření. Léčba IMC by měla být včasná, jelikož prodleva v zahájení terapie může podle některých studií zvyšovat riziko tvorby jizev ledvinného parenchymu.
Mezi terapeutické intervence řadíme mimo prosté observace bakteriální profylaxi, chirurgickou intervenci a léčbu primární patologie u sekundárního VUR. Samotný sterilní VUR se již nepovažuje za rizikový faktor jizvení ledvin, a proto nevyžaduje žádnou specifickou terapii. Smyslem podávání antibiotické profylaxe je sterilizace moči jakožto prevence vzniku IMC. Obvykle podáváme úzkospektré antibiotikum v jedné dávce na noc. Děti do 2 měsíců věku užívají pouze amoxicilin kvůli riziku nežádoucích účinků ostatních antibiotik. Širokospektrá antibiotika nejsou vhodná k profylaktickému podávání vzhledem k možnému vzniku bakteriální rezistence. Dávkování antibiotik shrnuje tab. 1.
1. Dávkování antibiotik k profylaxi močové infekce 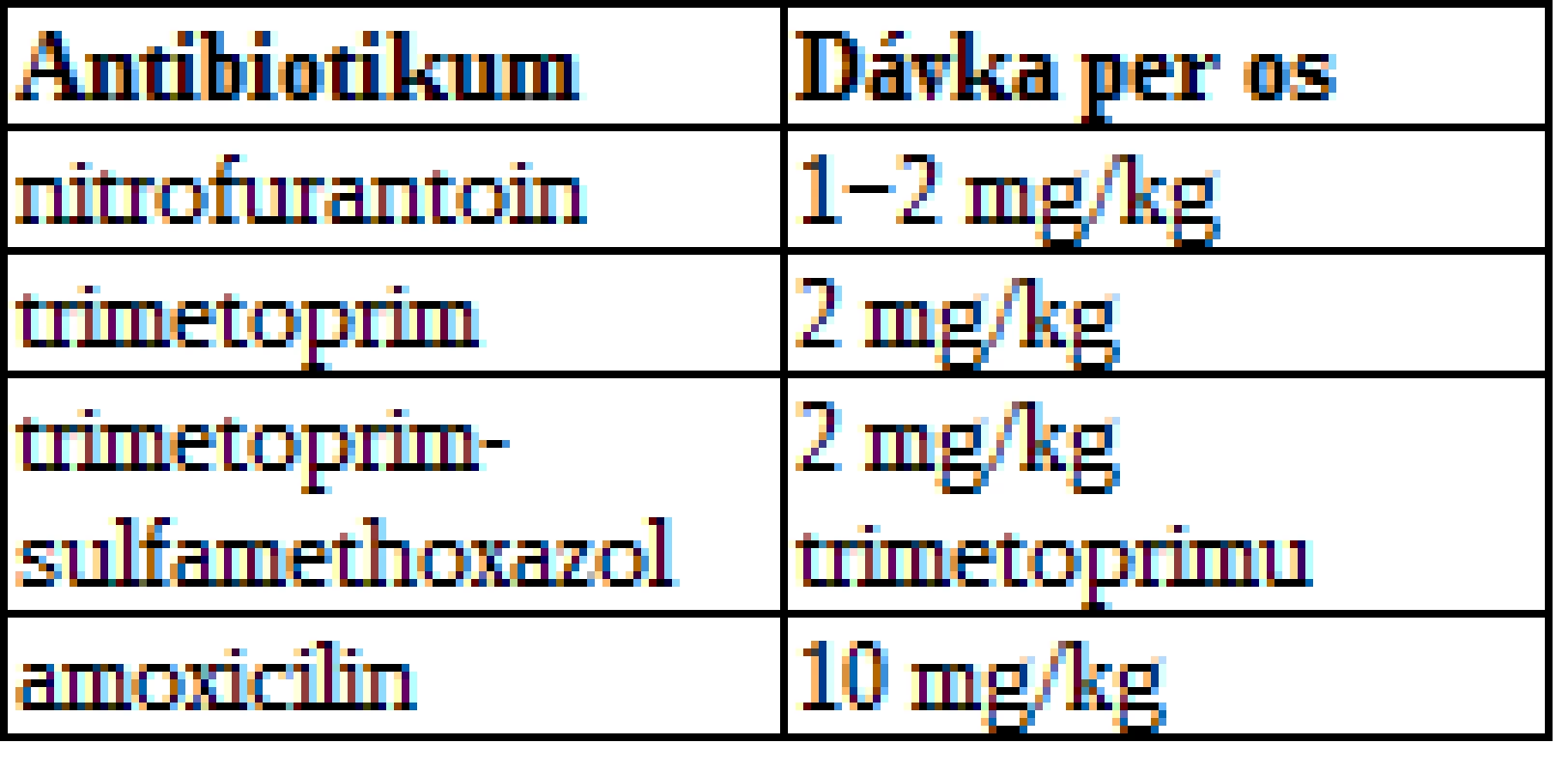
Mezi chirurgická řešení VUR řadíme otevřenou reimplantaci ureteru, endoskopickou reimplantaci ureteru a endoskopickou korekci VUR. Otevřená reimplantace spočívá v prodloužení intramurální části ureteru a vede v 92−98 % případů k úspěšné korekci refluxu (13). Při endoskopickém zákroku se látka aplikuje submukózně do oblasti ureterovezikální junkce za pomocí cystoskopu. V současné době se nejčastěji používá dextranomer a hyaluronová kyselina. Injekce se může aplikovat i opakovaně, její velkou výhodou je nižší invazivita v porovnání s otevřenou operací. Úspěšnost endoskopické korekce klesá se závažností refluxu a je nižší než u otevřené reimplantace, navíc recentní studie ukázaly, že u části pacientů dochází s odstupem času k rekurenci VUR (14).
Výběr správné léčby je často složitý a jednotná doporučení nemáme k dispozici. Musíme vzít v úvahu věk a pohlaví dítěte, závažnost refluxu, výskyt eventuálního jizvení ledvin, četnost močových infekcí, přítomnost urologické vady či zácpy a preference rodičů (15). Předmětem řady provedených studií bylo srovnání efektu observace, antibiotické profylaxe a chirurgického řešení VUR. Navzdory tomu, že se profylaktická antibiotická léčba používá již několik desetiletí, řada prací její efekt zpochybnila a upozornila spíše na nárůst bakteriální rezistence.
Garin et al. provedli v roce 2006 studii, do níž bylo zařazeno 236 dětí ve věku od 3 měsíců do 18 let, jež prodělaly APN. První skupina užívala profylaktická antibiotika, druhá skupina byla bez profylaxe. U 52 % dětí byl zjištěn VUR 1.−2. stupně. Po dobu sledování (12 měsíců) nebyl v obou skupinách zjištěn rozdíl ve výskytu IMC, ani v rozsahu jizvení ledvin (16). Rovněž studie Montiniho et al., které se zúčastnilo 338 dětí ve věku od 2 měsíců do 7 let, neprokázala vliv profylaxe na snížení četnosti opakování IMC u pacientů po první atace APN s VUR maximálně 2. stupně (17). Ve stejném roce publikovali Pennesi et al. práci, v níž zkoumali vliv profylaxe na recidivy IMC a vznik renálního jizvení. 100 dětí mladších 30 měsíců s VUR 2.−4. stupně po první atace APN bylo rozděleno do dvou skupin, taktéž se srovnávalo podávání profylaxe s observací. Ani tato studie neprokázala vliv antibiotické profylaxe na snížení počtu rekurentních APN či na incidenci nového jizvení ledvin (18). Hlavní limitací některých studií byla nepřesná diagnostika IMC, např. odběr moči do sběrného sáčku (17, 18), a obtížná kontrola compliance s podáváním profylaxe.
Pozitivní vliv profylaxe byl prokázán ve studii uskutečněné roku 2009 australskou skupinou. Bylo do ní zařazeno 576 dětí, které prodělaly jednu nebo více IMC. Jedna skupina užívala profylaxi kotrimoxazolem, děti ve druhé skupině dostávaly placebo, doba sledování činila 1 rok. U 42 % dětí byl diagnostikován VUR, z toho u více než poloviny VUR 3. a vyššího stupně. 13 % dětí užívajících profylaxi mělo rekurenci IMC, zatímco ve skupině dětí, jež dostávaly placebo, byla diagnostikována IMC v 19 %. Na základě těchto výsledků by však 14 dětí muselo užívat profylaxi po dobu 1 roku, abychom zabránili jedné rekurenci IMC (19).
Efekt aktivní léčby − profylaxe i chirurgické intervence − na redukci počtu rekurentních IMC, avšak pouze u děvčat, prokázala studie Swedish reflux trial publikovaná v roce 2009, které se zúčastnilo 203 dětí ve věku 12−24 měsíců. Děti s VUR 3.−4. stupně byly rozděleny do 3 skupin: observační, profylaktickou a s endoskopickou korekcí VUR. Tato studie prokázala efekt aktivní léčby − profylaxe i chirurgické intervence − na redukci počtu rekurentních IMC, avšak pouze u děvčat. Navíc se ukázalo, že u dívek léčených profylaxí bylo zjištěno statisticky významně méně nového jizvení ledvin ve srovnání s dívkami ve skupině observační. Chlapci neprofitovali z žádné aktivní léčby. Důležitým zjištěním však bylo, že u 20 % dětí léčených endoskopickou korekcí došlo po 2 letech od výkonu k rekurenci VUR (20).
S velkými nadějemi se očekávaly výsledky studie RIVUR. Do této zatím nejrozsáhlejší randomizované placebem kontrolované dvojitě zaslepené studie bylo zařazeno 607 dětí ve věku 2−72 měsíců s VUR 1.−4. stupně z 19 amerických nefrologických center. Jedna skupina byla léčena profylaktickými antibiotiky, ve 2. skupině děti dostávaly placebo. 92 % účastníků tvořily dívky, 91 % dětí bylo do studie zařazeno po prodělání první IMC. Výsledky této práce ukázaly, že profylaxe statisticky významně snížila riziko rekurence IMC pouze u dětí s VUR 1.−2. stupně. U pacientů s VUR 3.−4. stupně, kteří jsou považováni právě za rizikovou skupinu, snížení rizika rekurence febrilní IMC nedosáhlo statistické významnosti. Antibiotická profylaxe byla nejúčinnější u pacientů s poruchou vyprazdňování stolice a u dětí, jejichž první IMC byla APN. Incidence nového jizvení ledvin po 2 letech sledování se však mezi skupinami nelišila. Kontrolní MCUG provedená se stejným časovým odstupem ukázala vymizení VUR u 51 % dětí, snížení stupně VUR u 23 % nemocných, stacionární nález u 19 % a vyšší stupeň VUR u 9 % dětí. Zjistilo se také, že u pacientů léčených profylaxí byla vyšší incidence IMC způsobených rezistentními patogeny, což je nález konzistentní se závěry dalších studií (17−19, 21). Vzhledem k nepoměrnému zastoupení pohlaví lze výsledky této studie vztahovat pouze k dívkám.
Dysfunkce dolních močových cest a vezikoureterální reflux
Incidence dysfunkce dolních močových cest (DDMC) v dětském věku se pohybuje mezi 10 a 25 %. Jedná se o skupinu chorob, mezi něž patří vrozené vady, ale i řada funkčních poruch (22). Spojitost mezi DDMC a vznikem VUR je dlouhodobě známá. Tito pacienti mají častější IMC i navzdory profylaktické léčbě, nižší incidenci spontánního ústupu VUR v čase a v neposlední řadě je u těchto jedinců daleko méně úspěšná endoskopická korekce VUR. Pacienti se symptomy DDMC by měli být vyšetření urologem a dle jeho zvážení podstoupit případné doplňující vyšetření, protože u dětí se sekundárním VUR léčbu zaměřujeme na primární onemocnění (23).
Při pátrání po příčině sekundární formy VUR je nutné vyloučit poruchy vyprazdňování stolice, jež bývají často spojeny s dysfunkcí močového měchýře a mohou být příčinou přetrvávajícího sekundárního VUR i selhání léčby refluxu. Současný výskyt zácpy a dysfunkční mikce shrnuje termín dysfunkční eliminační syndrom. Předpokládaným mechanismem vzniku tohoto onemocnění je přímý vliv tlaku distendovaného rekta na zadní stěnu močového měchýře, což vede k poruše jeho vyprazdňování. Zvažuje se i nadměrná kontrakce svalů pánevního dna při zvýšené náplni rekta s následnou dyssynergií mezi sfinkterem a detruzorem či porucha relaxace zevního uretrálního sfinkteru v důsledku obstipace (24).
Závěr
Strategie léčby pacientů s VUR je stále diskutovaným tématem. Sterilní VUR není nutné aktivně léčit.
MCUG se podle většiny doporučení neprovádí po prodělání první nekomplikované APN způsobené Escherichii coli u dětí s normálním sonografickým nálezem na ledvinách. MCUG je zlatým standardem v diagnostice VUR u dětí, mikční sonografie je v rukách zkušeného radiologa vyšetřením s vysokou senzitivitou i specificitou, rutinně ale zatím využívána není.
Zatímco řada studií neprokázala efekt antibiotické profylaxe na redukci počtu rekurentních IMC a nového jizvení ledvin, jiné práce účinek antibiotik na snížení rekurence IMC popsaly pouze u určitých skupin pacientů.
Endoskopická korekce VUR, jejíž výhodou je nižší invazivita, nahradila z velké části otevřené operace refluxu. Dodatečně však bylo zjištěno, že u části nemocných dochází s odstupem času k recidivě VUR. Provedené studie také neprokázaly významný vliv chirurgické intervence na snížení incidence jizvení ledvin.
DDMC je spojena s přetrváváním VUR, léčba primární příčiny má v těchto případech zásadní význam. Jednou z častých příčin DDMC u dětí je zácpa, jejíž diagnostice a terapii je třeba věnovat dostatečnou pozornost. Důležitá je racionální indikace vyšetřovacích metod bez zbytečného zatížení dítěte spolu s individuálním léčebným postupem u každého pacienta.
Seznam zkratek
APN akutní pyelonefritida
DDMC dysfunkce dolních močových cest
IMC infekce močových cest
MCUG mikční cystouretrografie
RN refluxová nefropatie
VUR vezikoureterální reflux
Korespondenční adresa
MUDr. Jakub Zieg, Ph.D.
Pediatrická klinika 2. lékařské fakulty UK a Fakultní nemocnice Motol
V Úvalu 84
150 06 Praha 5
Tel.: 224 432 001
e-mail: jakubzieg@hotmail.com
Sources
1. Lebowitz RL, Olbing H, Parkkulainen KV et al. International system of radiographic grading of vesicoureteric reflux. International Reflux Study in Children. Pediatr Radiol 1985; 15 : 105−109.
2. Gonzalez E, Papazyan JP, Girardin E. Impact of vesicoureteral reflux on the size of renal lesions after an episode of acute pyelonephritis. J Urol 2005; 173 : 571–574.
3. Hoberman A, Charron M, Hickey RW et al. Imaging studies after a first febrile urinary tract infection in young children. N Engl J Med 2003; 348 : 195−202.
4. Feather SA, Malcolm S, Woolf AS et al. Primary, nonsyndromic vesicorureteric reflux and its nephropathy is genetically heterogeneous,with a locus on chromosome 1. Am J Hum Genet 2000; 66 : 1420−1425.
5. Reiterová J, Merta M. Genetické aspekty nefrologických onemocnění. Medicína pro praxi 2008; 5 : 423−425.
6. Mlynářová E. Doporučený postup pro provedení mikční cystouretrografie u dětí. Čes Radiol 2013; 67 : 263−269.
7. Matoo TK. Vesicoureteral reflux and reflux nephropathy. Adv Chronic Kidney Dis 2011 Sep; 18 : 348−354.
8. NAPRTCS. North American Pediatric Renal Trials and Collaborative Studies (NAPRTCS) Annual Report 2008.
9. Zhang Y, Bailey RR. A long term follow up of adults with reflux nephropathy. N Z Med J 1995; 108 : 142−144.
10. Silva JM, Santos Diniz JS, Marino VS et al. Clinical course of 735 children and adolescents with primary vesicoureteric reflux. Pediatr Nephrol 2006; 21 : 981−988.
11. Roberts KB, Downs SM, Finell SM et al. Urinary tract tract infection: clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics 2011; 128 : 595−610.
12. Mlynářová E, Zieg J, Sorantin E. Zobrazení močového traktu u dětí s febrilní infekcí močových cest ve věku 2 - 24 měsíců v centru terciální péče v České republice: zamyšlení nad současnými postupy. Čes Radiol 2013; 67 : 253−259.
13. Duckett JW, Walker RD, Weiss R. Surgical results: International Reflux Study in Children-United States branch. J Urol 1992; 148 : 1674−1675.
14. Holmdahl G, Brandström P, Läckgren G et al. The Swedish reflux trial in children: II. Vesicoureteral reflux outcome. J Urol 2010; 184 : 280.
15. Tullus K. Vesicoureteric reflux in children. Lancet 2015; 385 : 371−379.
16. Garin EH, Olavarria F, Garcia Nieto V et al. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after acute pyelonephritis: a multicenter, randomized, controlled study. Pediatrics 2006; 117 : 626−632.
17. Montini G, Rigon L, Zucchetta P et al. Prophylaxis after first febrile urinary tract infection in children? A multicenter, randomized, controlled, noninferiority trial. Pediatrics 2008; 122 : 1064−1071.
18. Pennesi M, Travan L, Peratoner L et al.; North East Italy Prophylaxis in VUR study group. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonephritis and renal scars? A randomized, controlled trial. Pediatrics 2008; 121 : 1489−1494.
19. Craig JC, Simpson JM, Williams GJ et al. Prevention of Recurrent Urinary Tract Infection in Children. N Engl J Med 2009; 361 : 1748−1759.
20. Brandström P, Jodal U, Sillén U et al. The Swedish reflux trial: review of a randomized, controlled trial in children with dilating vesicoureteral reflux. J Pediatr Urol 2011; 7 : 594−600.
21. Hoberman A, Greenfield SP, Mattoo TK et al. Antimicrobial prophylaxis for children with vesicoureteral reflux. Antimicrobial prophylaxis for children with vesicoureteral reflux. N Engl J Med 2014; 370 : 2367−2376.
22. Dítě Z. Dysfunkce dolních močových cest. Urologické listy 2007; 5 : 42–45.
23. Fast AM, Nees SN, Van Batavia JP et al. Outcomes of targeted treatment for vesicoureteral reflux in children with nonneurogenic lower urinary tract dysfunction. J Urol 2013; 190 : 1028−1032.
24. Elder JS, Diaz M. Vesicoureteral reflux-the role of bladder and bowel dysfunction. Nat Rev Urol 2013; 10 : 640−648.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Trends in indication of selected laboratory methods by general practitioners
- Potential sources of phthalates and bisphenol A and their significance in the development of metabolic diseases
- To the anniversary of prof. Jana Parizkova, MD, DSc.
- Surgical treatment of lower extremity peripheral nerve injuries
- Outpatient parenteral antibiotic therapy (OPAT)
- Faecal incontinence – serious medical and social issue
- Vesicoureteric reflux in children: many questions still unanswered
- Hyponatremia in children: from pathophysiology to therapy
- Role of incretins in energy metabolism and weight changes after smoking cessation
- Biobanks − European infrastructure
- Surgeons and Neurosurgeons as Nobel Prize Winners
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vesicoureteric reflux in children: many questions still unanswered
- Surgical treatment of lower extremity peripheral nerve injuries
- Hyponatremia in children: from pathophysiology to therapy
- Faecal incontinence – serious medical and social issue
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

