-
Medical journals
- Career
Konzervativní terapie pozdní infekce aortální protézy
Authors: Peter Baľa 1; Kamil Zeman 1; Renata Kološová 1; Ivo Pavlas 1; Dušan Kučera 2
Authors‘ workplace: Interní oddělení Nemocnice ve Frýdku-Místku, p. o. 1; Vaskulární centrum Vítkovické nemocnice, a. s., Ostrava 2
Published in: Vnitř Lék 2017; 63(2): 133-137
Category: Case Reports
Overview
Infekce aortální protézy je jednou z nejzávažnějších komplikací aortovaskulární chirurgie. Diagnóza je založená na klinických a radiologických nálezech. Důraz je kladen na časnou diagnostiku, jež má zásadní vliv na prognózu pacientů. Strategie léčby musí být individualizovaná. Zlatým standardem léčby je chirurgická terapie s explantací infikovaného cizího materiálu s débridementem infikovaných okolních tkání a následná revaskularizace dolních končetin extraanatomickým nebo in situ bypassem autologní femorální žílou nebo kryoprezervovaným tepenním alograftem. U stabilních selektovaných pacientů s vysokou perioperační mortalitou může být alternativní volbou konzervativní terapie. V kazuistice popisujeme případ onemocnění 54letého muže s komplikovanou historií rekonstrukčních výkonů torakoabdominální aorty. Diagnóza infekce aortální protézy byla stanovena na základě klinických nálezů a výsledků zobrazovacích metod (CT angiografie a pozitronové emisní tomografie/počítačové tomografie). Podle závěru multidisciplinární komise byl zvolen konzervativní postup.
Klíčova slova:
antibiotická terapie – infekce aortální protézy – konzervativní terapieÚvod
Infekce aortální protézy jsou relativně vzácnou, ale za to závažnou komplikací aortovaskulární chirurgie. Incidence se pohybuje mezi 0,5 až 5 % a mortalita je odhadována v rozmezí 8–27 % [1]. Z časového hlediska je dělíme na časné a pozdní. Pozdní se vyskytují po 4 měsících po operaci. Nejčastějším etiologickým agens jsou stafylokoky, z důvodu kontaminace operačního pole kožní mikrobiální flórou. Staphylococcus epidermidis, pomalu rostoucí bakterie, je klasicky příčinou pozdní, indolentní infekce, zatímco virulentnější Staphylococcus aureus typicky způsobuje časné infekce s projevy sepse. V poslední době narůstá výskyt infekcí meticilin rezistentním zlatým stafylokokem (MRSA) a gramnegativními bakteriemi [2].
Časné infekce se prezentují systémovými projevy infekce, jako jsou teplota, zimnice, malátnost a infekčními komplikacemi operační rány (abscesy, píštěle). Dehiscence anastomózy, krvácení z anastomózy, trombóza protézy, septické embolizace a výskyt pseudoaneuryzmatu jsou méně častými projevy infekce aortální protézy. Pozdní infekce mají často indolentní průběh bez specifických symptomů či příznaků infekce. Raritními projevy jsou hydronefróza a aortoenterické píštěle s gastrointestinálním krvácením nebo aortobronchiální píštěle projevující se masivní hemoptýzou.
Diagnózu stanovujeme na základě klinických a radiologických nálezů. Z paraklinických vyšetření se využívají CT angiografie, zobrazení magnetickou rezonancí (MRI), pozitronová emisní tomografie/počítačová tomografie (PET/CT) a scintigrafie značenými leukocyty.
CT angiografie se považuje za nejlepší metodu k diagnostice suspektní infekce aortální protézy. Definuje anatomii, průchodnost aorty a její větví a postižení okolních tkání [3]. Obvyklými nálezy při CT kontrastním vyšetření jsou přítomnost tekutiny, ektopického plynu kolem protézy a formace pseudoaneuryzmatu [4].
Některé práce uvádějí PET/CT jako velmi efektivní a spolehlivou metodu pro diagnózu infekcí aortálních protéz s 93% senzitivitou, 91% specificitou, 91% pozitivní prediktivní hodnotou a 96% negativní prediktivní hodnotou [5,6]. Laboratorní parametry zánětů (množství leukocytů, sedimentace erytrocytů, hladina C-reaktivního proteinu a presepsinu) jsou často zvýšeny. Nezastupitelnou roli hraje odběr biologického materiálu na kultivační vyšetření k indikaci cílené antibiotické terapie. Při podezření na aortoenterickou píštěl může být v diagnostice užitečné gastrofibroskopické vyšetření.
V prevenci infekce aortální protézy se zdůrazňují striktní zásady asepse a antisepse během operačního výkonu, pečlivé sterilní operační techniky, dekontaminace operačního pole antiseptiky a profylaktické intravenózní podávaní antibiotik. K profylaxi se doporučují cefalosporiny 1. a 2. generace (cefazolin/cefuroxim). Při intraabdominálních výkonech spolu s metronidazolem pro pokrytí anaerobů. První dávka se podává 30–60 min před operací a druhá dávka v odstupu 120 min od první dávky [7]. Antibiotická profylaxe podávaná po více než 24 hod nepřináší další benefit.
Strategie léčby musí být individualizovaná. Volba strategie závisí na klinické prezentaci, rozsahu, anatomické lokalizaci infekce a na přítomnosti krvácivých komplikací a aortoenterických píštělí [8]. V neposlední řadě je nutné posoudit perioperační riziko pacienta vzhledem k jeho věku a komorbiditám. Mezi bezprostřední léčebné priority patří kontrola sepse a zabezpečení distální cirkulace k zabránění ischemických komplikací. Zcela klíčová je intenzivní a prolongovaná antibiotická terapie s cílem snížení rizika sepse a předcházení sekundární infekce [9]. V případě podezření na infekci cévní protézy je nutné zahájit empirickou antibiotickou terapii dle odhadovaného etiologického agens a předpokládané citlivosti. Při časných infekcích je nutné zahájit antibiotickou terapii zacílenou na stafylokoky rezistentní k meticilinu a gramnegativní bakterie [10]. Britská společnost pro antibiotickou terapii (British Society for Antimicrobial Chemotherapy) doporučuje zahájit terapii kombinací cefuroximu s metronidazolem v kombinaci s nebo bez amoxicilinu. Při alergii na penicilinová antibiotika lze jako sekundární volbu použít ciprofloxacin nebo klindamycin. V případě pozdních infekcí, při nichž jsou etiologickým agens často koaguláza-negativní stafylokoky, se doporučuje zahájit terapii glykopeptidy (vankomycin) s nebo bez rifampicinu [11]. Další antibiotická léčba musí být zacílena na etiologické agens dle výsledků kultivačních vyšetření. Délka antibiotické terapie má trvat minimálně 4–6 týdnů po explantaci infikované cévní protézy [12].
Zlatým standardem léčby je chirurgická terapie s explantací infikovaného cizího materiálu s débridementem infikovaných okolních tkání a následná revaskularizace dolních končetin extraanatomickým nebo in situ venózním bypassem [13]. Nejpoužívanější extraanatomickou cévní rekonstrukcí při infekci aorto-iliako-femorální protézy je axilo-(bi)femorální bypass. Dlouhodobé výsledky extranatomických cévních rekonstrukcí nejsou uspokojivé, vzhledem k vysokému riziku rekurentní infekce (až 20 %) a hlavně vysokému riziku trombózy a s tím spojené riziko amputace končetiny (až 43 %) [14]. Využívá se hlavně v urgentních stavech, jako je akutní krvácení z aorto-duodenální píštěle u pacienta s infekcí aortální protézy [13].
Dalšími metodami jsou in situ rekonstrukce infikované protézy. Nejlepší výsledky z in situ rekonstrukcí má použití autologní femorální a popliteální vény, vzhledem k vysoké odolnosti vůči infekci, dlouhodobé průchodnosti protéz a nepotřebě dlouhodobé antibiotické a antitrombotické terapie. Nevýhodou je časová i technická náročnost výkonu a značné krevní ztráty [15]. Dalšími možnostmi in situ rekonstrukcí je použití kryoprezervovaného arteriálního alograftu nebo antibiotikem potažené cévní protézy (smáčené v roztoku rifampicinu) nebo cévní protézy impregnované solemi stříbra. Chirurgické metody jsou obecně zatíženy vysokou mortalitou a rizikem reinfekce [8]. U stabilních selektovaných pacientů s vysokou perioperační mortalitou může být alternativní volbou konzervativní terapie [16].
Kazuistika
V naší kazuistice popisujeme případ 54letého muže s komplikovanou historií rekonstrukčních výkonů torakoabdominální aorty. Celý příběh začíná v červenci roku 2012, kdy byl hospitalizován na Interním oddělení Nemocnice ve Frýdku-Místku k došetření náhodného nálezu makroadenomu hypofýzy, zjištěného na MRI mozku, indikovaného pro nitrooční hypertenzi.
Při vstupním RTG snímku hrudníku byl popsán náhodný nález rozšíření stínu aorty (obr. 1). Následná transezofageální echokardiografie prokázala asymptomatickou chronickou disekci descendentní aorty Stanford B (distální část aortálního oblouku zasahující až do oblasti břišní aorty). Pro asymptomatický průběh byl indikován konzervativní postup a pacient byl dispenzarizován ve vaskulárním centru. V meziobdobí byla provedena exstirpace adenomu hypofýzy na neurochirurgické klinice v říjnu roku 2012. Kontrolní CT angiografie aorty v únoru roku 2013 prokázala progresi dilatace sestupné hrudní aorty o 9 mm, s dobrou perfuzí končetinových a viscerálních tepen. Pro výše uvedené byla provedena ve vaskulárním centru implantace stentgraftu do sestupné hrudní aorty v srpnu roku 2013. V prosinci roku 2014 se stav komplikoval distální rupturou aneuryzmatu v disekci hrudní aorty s levostranným hemotoraxem. Komplikace byla vyřešena implantací torakální extenze a hrudní drenáží levostranného hemotoraxu v kardiochirurgickém centru.
Image 1. RTG hrudníku – rozšíření stínu aorty 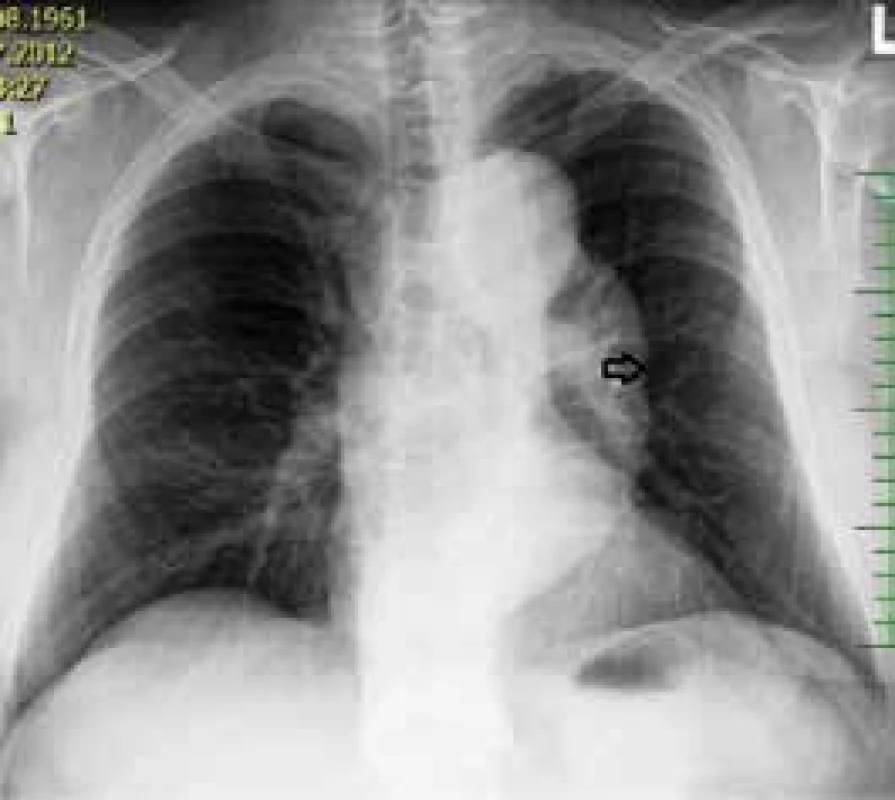
Po druhé se s pacientem setkáváme na našem oddělení v lednu roku 2015. Přichází pro subfebrilie, kašel a dušnost. HRCT plic prokázala levostranný pleurální výpotek (obr. 2), který byl po diagnostické pleurální punkci hodnocen jako recidiva levostranného hemotoraxu. S nálezy bylo konzultováno Kardiochirurgické centrum, dle jehož doporučení byla provedena hrudní drenáž. Vzhledem k doplňujícímu se hemotoraxu byla úvaha o pokračujícím krvácení do hrudní dutiny po zavedení stentgraftu, etiologicky z falešného kanálu aorty jako komplikace předchozího výkonu. Pro nemožnost dalšího endovaskulárního řešení byl pacient přeložen na Oddělení cévní chirurgie v Nemocnici na Homolce Praha, na kterém byla provedena evakuace hemotoraxu, explantace stentgraftu z hrudní aorty, resekce a náhrada aneuryzmatu torakoabdominální aorty.
Image 2. HRCT plic – hemotorax vlevo 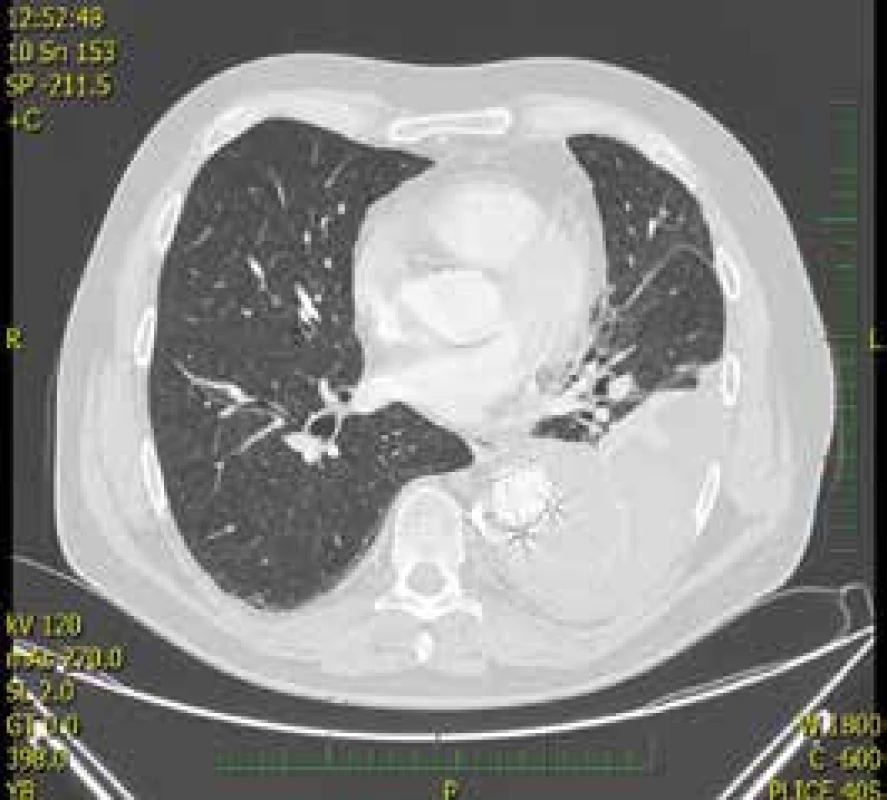
Do třetice byl pacient hospitalizován na našem oddělení v listopadu roku 2015 pro zimnice a febrilie. Pro suspekci na infekci cévní náhrady aorty byla provedena CT angiografie aorty s nálezem levostranného empyému a hydronefrózy vlevo při útlaku levého ureteru expanzivním zánětlivým procesem. Multidisciplinární komise doporučila konzervativní postup. Byl zaveden hrudní drén s napojením na aktivní hrudní sání a byla zahájena empirická 2kombinační antibiotická (ATB) terapie (cefotaxim 1 g po 8 hod po dobu 8 dnů + gentamicin 240 mg/24 hod po dobu 8 dnů), po zhoršení renálních funkcí pro obstrukční pyelonefritidu (viz dále) byla redukována dávka gentamicinu na 160 mg/24 hod. Po 3 dnech bylo provedeno kontrolní CT plic a vzhledem k nepřítomnosti tekutinové kolekce v levé pohrudniční dutině byl hrudní drén extrahován. Následující den se stav komplikuje oligurií a zhoršením renálních funkcí při obstrukční pyelonefritidě vlevo při extramurálním útlaku zánětlivým retroperitoneálním procesem. Pro výše uvedené byl zaveden JJ stent a změněna ATB terapie za piperacilin/tazobaktam (2,25 g po 8 hod po dobu 10 dnů – redukováno dle glomerulární filtrace) dle výsledku kultivace z hrudní drenáže (Staphyloccocus hominis). Při zavedené terapii dochází k obnově diurézy a úpravě renálních funkcí ad integrum. K posouzení lokalizace a aktivity zánětu byla v ,,antibiotickém oknu“ provedena PET/CT, dle výsledků které přetrvává zánětlivá kolekce v oblasti cévní protézy hrudní i břišní aorty šířící se do levé pohrudniční dutiny a reaktivní lymfadenopatie (obr. 3).
Image 3. PET/CT – zánětlivá kolekce v oblasti cévní protézy hrudní aorty šířící se do levé pohrudniční dutiny 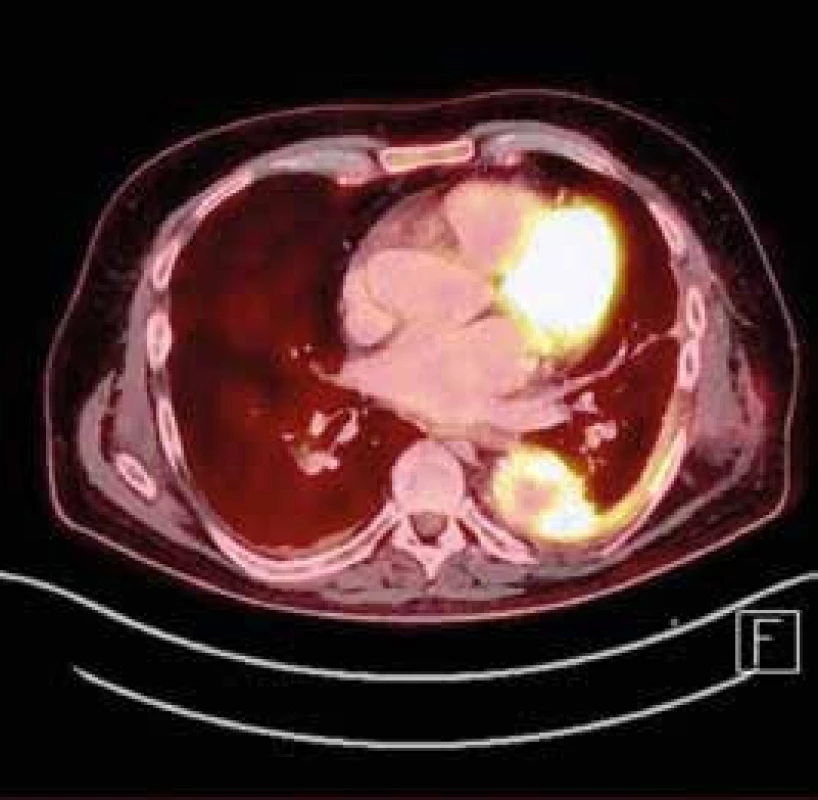
(Klinika nukleární medicíny Fakultní nemocnice Olomouc) Po konzultaci s Antibiotickým centrem bylo pokračováno v parenterální ATB terapii cefalosporinem 4. generace (cefepim 2 g i.v. po 12 hod po dobu 10 dnů). Po 5týdenní hospitalizaci byl pacient propuštěn do domácí péče v klinicky zlepšeném a stabilizovaném stavu. Po propuštění pokračoval v 2kombinační perorální ATB terapii (trimetoprim + sulfametoxazol 960 mg po 12 hod a rifampicin 300 mg po 8 hod po dobu 14 dnů). Po další konzultaci s antibiotickým centrem užíval dlouhodobě perorální antibiotika (amoxicilin/kyselina klavulanová 625 mg tbl po 6 hod po dobu 14 dnů, dále amoxicilin 500 mg po 8 hod po dobu 5 měsíců). Laboratorně dochází k normalizaci zánětlivých parametrů a pacient je nadále sledován v odborných ambulancích. V březnu roku 2016 byla provedena na urologickém oddělení výměna JJ stentu vlevo pod ATB clonou za dlouhodobý JJ stent. K posouzení perzistence zánětu aortální protézy byla po 14denním vysazení antibiotik provedena scintigrafie s 99mTc-HMPAO (technecium hexametylpropylenaminoxim) značenými leukocyty, dle kterého nedochází k akumulaci radiofarmaka v oblasti aortální protézy. Vzhledem k negativnímu výsledku vyšetření a nepřítomnosti klinických projevů infekce byla z terapie vysazena antibiotika a pacient dochází k pravidelným ambulantním kontrolám k ošetřujícímu kardiologovi. Po 6měsíčním vysazení antibiotik nedochází k recidivě infekce náhrady torakoabdominální aorty a zánětlivé parametry přetrvávají nízké.
Diskuse
V kazuistice popisujeme případ konzervativní terapie pozdní infekce aortální protézy s doposud překvapivým úspěšným výsledkem. Na vzniku infekce aortální protézy mohla mít zásadní vliv koexistující chronická infekce urotraktu. Konzervativní strategie byla zvolena vzhledem k významným komorbiditám pacienta a lokalizaci infekce, která znemožňovala její explantaci. Byla zvolena perkutánní drenáž a prolongovaná antibiotická terapie, která byla upravována podle výsledků kultivačních vyšetření po konzultaci s antibiotickým centrem. Jako kontrolní zobrazovací vyšetření k posouzení perzistence zánětu aortální protézy jsme zvolili scintigrafii se značenými leukocyty, vzhledem k dostupnosti vyšetření v naši nemocnici a nižší ekonomické náročnosti vyšetření oproti PET/CT. V práci zdůrazňujeme multidisciplinární a individualizovaný přístup. Za zcela klíčovou v úspěšné strategii léčby považujeme dobře zvolenou intenzivní a prolongovanou antibiotickou terapii. Přes úspěch konzervativní terapie nezpochybňujeme zásadní význam chirurgické terapie u pacientů s infekčními komplikacemi aortálních protéz.
Konzervativní terapie infekce aortální protézy je optimální terapií u selektovaných pacientů [3]. V případech, v nichž není totální excize aortální protézy možná nebo je vysoce riziková, má být u stabilních pacientů zvažována alternativní strategie s parciálním nebo kompletním ponecháním infikované protézy [16]. Optimální podmínky pro konzervativní terapii jsou vysoká perioperační mortalita pro významné komorbidity pacienta, lokalizace infekce cévní protézy, která znemožňuje její explantaci (aortální oblouk, torakoabdominální aorta), infekce ohraničená na tělo protézy bez postižení anastomózy a infekce způsobená indolentními grampozitivními bakteriemi [3]. Podmínkou volby konzervativní strategie je nepřítomnost známek sepse, zachovalá průchodnost cévní náhrady, nepostižení anastomózy, nepřítomnost krvácivých komplikací a arteriovenózní či aortoenterické píštěle [3]. Konzervativní strategie by neměla být zvažována v případě infekce způsobené invazivními gramnegativními bakteriemi (např. druhu pseudomonas nebo salmonella), a to s ohledem na tendenci k invazi do okolních tkání a rizikem roztržení anastomózy [3]. Možnostmi konzervativní terapie jsou prolongovaná intravenózní/perorální antibiotická terapie, perkutánní drenáž infikované tekutinové kolekce, lokální aplikace antibiotik a antiseptik (povidone iodid, peroxid), chirurgický débridement infikovaných okolních tkání a překrytí protézy svalovým, či muskulokutánním lalokem [3].
Prolongovaná intravenózní antibiotická terapie bez intervence může být zvažována u polymorbidních pacientů s infekcí aortální protézy bez přítomnosti okolního abscesu či flegmóny [3]. Samotná antibiotická terapie bez intervence obvykle není kurativní léčbou a má jen krátkodobý efekt. Konzervativní strategie bude úspěšná, jenom když se podaří odstranit infekci z okolí protézy. Proto je k úspěchu konzervativní strategie nezbytná perkutánní drenáž pod ultrasonografickou nebo CT kontrolou nebo otevřená chirurgická drenáž infikované tekutinové kolekce v okolí protézy [3]. Perkutánní drenáž v kombinaci s antibiotiky může být definitivní nebo jen přemosťující terapii k resekci infikované protézy.
Belair et al publikovali práci, v níž popisují užití perkutánní drenáže jako definitivní i přemosťující terapii. Srovnali tento soubor pacientů se souborem pacientů, kteří podstoupili iniciální chirurgickou terapii. Byla popsána signifikantně vyšší mortalita ve skupině pacientů, kteří podstoupili chirurgický výkon jako iniciální terapii, bez perkutánní drenáže a kontroly sepse [17]. Morris et al popisují konzervativní strategii u 10 pacientů, kteří podstoupili extraperitoneální chirurgickou exploraci infikované aortální protézy. Postup spočíval v otevření infikovaného vaku, odběru materiálu ke kultivačnímu vyšetření, débridementem nekrotických tkání a umístněním katétrů k proplachové laváži antibiotiky, v které pokračovali, až dokud nebyly kultivace negativní. Roční přežívaní popisují až v 80 % případů [18].
Další možností konzervativní terapie je užití svalových nebo omentálních laloků k obalení infikované protézy po débridementu okolních nekrotických tkáni. Poskytují krevní zásobení, která kontroluje infekci in situ a brání jejímu šíření do arteriální stěny nebo okolních struktur [3].
K novým možnostem terapie se řadí využití hojení chirurgických ran řízeným podtlakem, zejména použití VAC systému (vacuum assisted closure devices for wounds). VAC systém redukuje bakteriální kolonizaci, podporuje granulaci, snižuje otok a stimuluje mikrovaskularizaci v ráně. VAC systém byl použit po otevřené revizi prasklé břišní výdutě k prevenci intraabdominální hypertenze a břišního kompartment syndromu a k prevenci infekce aortální protézy [19].
Závěr
Časná diagnóza infekcí cévních protéz je klíčová v léčbě a prevenci septických komplikací ohrožujících končetinu nebo pacientův život. Zlatým standardem léčby je chirurgická terapie s explantací infikovaného cizího materiálu s débridementem infikovaných okolních tkání a následná revaskularizace dolních končetin extraanatomickým nebo in situ bypassem autologní femorální žílou nebo kryoprezervovaným tepenním alograftem. Konzervativní terapie infekce aortální protézy je optimální terapií u selektovaných pacientů s vysokou perioperační mortalitou [3]. Přes významný pokrok v chirurgické i konzervativní terapii zůstávají morbidita i mortalita zůstávají vysoké.
MUDr. Peter Baľa
peter.bala5988@gmail.com
Interní oddělení Nemocnice ve Frýdku-Místku, p. o.
www.nemfm.cz
Doručeno do redakce 13. 11. 2016
Přijato po recenzi 28. 12. 2016
Sources
1. Akhtar M, Meechan L, Birkett R et al. Conservative Treatment of an Infected Aortic Graft with Antibiotic Irrigation. Int J Angiol 2016; 25(5): e118-e120. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0035–1548738>.
2. Tsapralis D, Charalampopoulos A, Lazaris AM. Abdominal Aortic Graft Infection. In: Grundmann R (ed). Diagnosis, Screening and Treatment of Abdominal, Thoracoabdominal and Thoracic Aortic Aneurysms. InTech: 2011. ISBN: 978–953–307–466–5. Dostupné z WWW: <http://www.intechopen.com/books/diagnosis-screening-and-treatment-of-abdominal-thoracoabdominal-andthoracic-aortic-aneurysms/abdominal-aortic-graft-infection>.
3. Lawrence PF. Conservative Treatment of Aortic Graft Infection. Semina Vasc Surg 2011; 24(4): 199–204. Dostupné z DOI: <http://dx.doi.org/10.1053/j.semvascsurg.2011.10.014>.
4. Low RN, Wall SD, Jeffrey RB et al. Aortoenteric fistula and perigraft infection: evaluation with CT. Radiology 1990; 175(1): 157–162.
5. Keidar Z, Engel A, Hoffman A et al. Prosthetic vascular graft infection: the role of 18F-FDGPET/CT. J Nucl Med 2007; 48(8): 1230–1236.
6. Keidar Z, Nitecki S FDG-PET for the detection of infected vascular grafts. Q J Nucl Med Mol Imaging 2009; 53(1): 35–40.
7. Antimicrobial prophylaxis in surgery. Med Lett Drugs Ther 2001; 43(1116–1117): 92–97. Erratum in Med Lett Drugs Ther 2001; 43(1119): 108.
8. Carrel T, Schmidli J. Management of vascular graft and endoprosthetic infection of the thoracic and thoraco-abdominal aorta. Multimedia Manual of Cardiothoracic Surgery 2011; 2011(1101): mmcts.2010.004705. Dostupné z DOI: <http://dx.doi.org/10.1510/mmcts.2010.004705>.
9. Bunt TJ. Vascular graft infections: An update. Cardiovasc Surg 2011; 9(3): 225–233.
10. Perera GB, Fujitani RM, Kubaska SM. Aortic graft infection: Update on Management and Treatment Options. Vasc Endovascular Surg 2006; 40(1): 1–10.
11. O‘Connor S, Andrew P, Batt M et al. systematic review and metaanalysis of treatments for aortic graft infection. J Vasc Surg 2006; 44(1): 38–45.
12. Roy D, Grove DI. Efficacy of long-term antibiotic suppressive therapy in proven or suspected infected abdominal aortic grafts. J Infect 2000; 40(2): 184–187.
13. Staffa R. Náhrada infikované aortální protézy autologní femorální žílou včetně stavů po resekci AAA. Vask Med 2011; 3(2): 54–56. Dostupné z WWW: <http://www.solen.sk/pdf/9e240555854b6d7708da15e5a8bdf040.pdf>.
14. Seeger JM, Pretus HA, Welborn MB et al. Long-term outcome after treatment of aortic graft infection with staged extra-anatomic bypass grafting and aortic graft removal. J Vasc Surg 2000; 32(3): 451–459.
15. Beck AW, Murphy EH, Hocking JA et al. Aortic reconstruction with femoral-popliteal vein: Graft stenosis incidence, risk and reintervention. J Vasc Surg 2008; 47(1): 36–43.
16. Calligaro KD, Veith FJ, Yuan JG et al. Intraabdominal aortic graft infection: Complete or partial graft preservation in patients at very high risk. J Vasc Surg 2003; 38(6): 1199–1205.
17. Belair M, Soulez G, Oliva VL et al. Aortic graft infection: the value of percutaneous drainage. AJR Am J Roentgenol 1998; 171(1): 119–124.
18. Morris GE, Friend PA, Vassallo DJ et al. Antibiotic irrigation and conservative surgery for major aortic graft infection. J Vasc Surg 1994; 20(1): 88–95.
19. Ross CB, Irwin CL, Mukherjee K et al. Vacuum-pack temporary abdominal wound management with delayed-closure for the management of ruptured abdominal aortic aneurysm and other abdominal vascular catastrophes: absence of graft infection in long-term survivors. Am Surg 2009; 75(7): 565–570.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 2-
All articles in this issue
- Dlouhodobě působící inzuliny v léčbě diabetu 2. typu a jejich postavení v rámci současného léčebného algoritmu
- Akútne obličkové poškodenie: aktuálny komplexný prehľad
- Autoprotilátky u systémových onemocnění pojiva a ANCA asociovaných vaskulitid, jejich vztah k intersticiálním plicním procesům a prognóze
- Vyhodnocení kinetiky VO2 v zotavovací fázi spiroergometrického vyšetření u kardiologicky nemocných – význam a klasifikace
- Funkční význam hERG: od fyziologické role po cíl protinádorové terapie
- Antitrombocytová tromboprofylaxia artériových vaskulárnych chorôb a orgánovaskulárnych ischemických chorôb
- Konzervativní terapie pozdní infekce aortální protézy
- Karcinóm prištítneho telieska
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autoprotilátky u systémových onemocnění pojiva a ANCA asociovaných vaskulitid, jejich vztah k intersticiálním plicním procesům a prognóze
- Karcinóm prištítneho telieska
- Dlouhodobě působící inzuliny v léčbě diabetu 2. typu a jejich postavení v rámci současného léčebného algoritmu
- Akútne obličkové poškodenie: aktuálny komplexný prehľad
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

