-
Medical journals
- Career
Heterogenita dětského diabetu a její terapeutické implikace
Authors: Zdeněk Šumník; Štěpánka Průhová; Ondřej Cinek
Authors‘ workplace: Pediatrická klinika 2. LF UK a FN v Motole, Praha
Published in: Vnitř Lék 2016; 62(Suppl 4): 129-135
Category: Reviews
Overview
Diabetes se u českých dětí a adolescentů vyskytuje s prevalencí 1 : 500–1 000 dětí. V posledních 25 letech jeho incidence stoupla přibližně 3krát. Nejčastěji se v této věkové kategorii vyskytuje diabetes 1. typu, stále častěji se setkáváme též s monogenními formami diabetu, diabetes 2. typu je u dětí na rozdíl od dospělých marginální. Etiologická diagnostika představuje nezbytný předpoklad efektivní terapie. Článek shrnuje současné poznatky o etiologii a léčbě diabetu manifestovaného do 18 let věku.
Klíčová slova:
děti – diabetes mellitus – etiopatogeneze – terapieÚvod
Vývoj molekulární genetiky a medicíny obecně si v posledních dekádách vynutil kromě jiného také přepsání kapitol o etiopatogenezi diabetu diagnostikovaného v dětství. Dětský diabetes je daleko barevnější, než jsme předpokládali, a rozhodně již automaticky neznamená diabetes 1. typu (DM1T). Ten sice představuje nejčastější typ (přibližně 95 % případů), nicméně genetická diagnostika potvrzuje výskyt monogenních forem u 3–4 % dětí, což je bezesporu signifikantní proporce pacientů. Etiologicky výhradně monogenním, ale stále poměrně heterogenním je novorozenecký diabetes (NDM) s manifestací do 6 měsíců věku. Relativní výskyt diabetu 2. typu (DM2T) u dětí se liší mezi jednotlivými etniky a populacemi, u Evropanů kavkazského etnika je výskyt dětských diabetiků 2. typu stále pouze okolo 1 %, u Asiatů či Afroameričanů jsou však tato čísla mnohonásobně vyšší a představují až 90 % všech případů, a to při podobném BMI. Správná diagnostika jednotlivých typů dětského diabetu založená zejména na kombinaci klinických, biochemických, genetických a imunologických parametrů představuje základní předpoklad pro volbu adekvátní terapie vedoucí ke zlepšení dlouhodobé prognózy a kvality života dnešních diabetických dětí. Následující článek shrnuje současné poznatky o etiologii a léčbě diabetu manifestovaného do 18 let věku.
Novorozenecký diabetes (NDM)
Novorozenecký a časně kojenecký věk je z diabetologického hlediska naprosto unikátním obdobím, proto byla pro manifestaci novorozeneckého diabetu stanovena věková hranice 6 měsíců, která přesahuje období klasicky označované jako novorozenecké (tedy 28 dní). Podle průběhu rozlišujeme 2 skupiny NDM:
- tranzientní novorozenecký diabetes mellitus (TNDM), který vymizí během prvních měsíců života a dále nevyžaduje léčbu, ale až v 50 % případů později relabuje, a
- permanentní novorozenecký diabetes mellitus (PNDM), který vyžaduje celoživotní léčbu
NDM je vzácné onemocnění s incidencí přibližně 1 : 200 000, které vzniká výhradně v důsledku mutace jediného genu ovlivňujícího funkci B-buňky [1,2]. V současné době je známo 20 genů způsobujících NDM (tab. 1).
Table 1. Monogenně podmíněné formy novorozeneckého diabetu 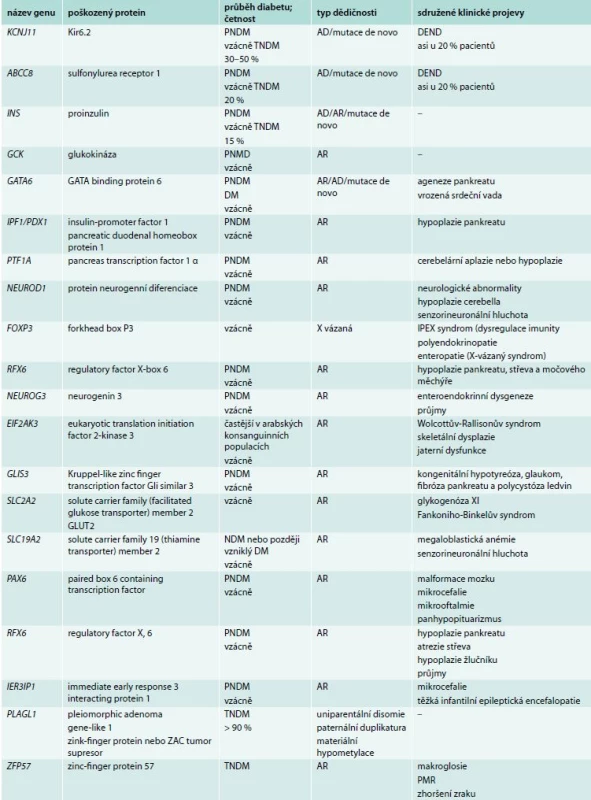
AD – autozomálně dominantní dědičnost AR – autozomálně recesivní dědičnost DEND – kombinace diabetu a neurologického postižení různého stupně (developmental delay, epilepsy and neonatal diabetes) PNDM – permanentní novorozenecký diabetes mellitus TNDM – transientní novorozenecký diabetes mellitus Nejčastějšími z nich jsou geny KCNJ11 a ABCC8 kódující Kir6.2, respektive SUR1 podjednotky napěťově řízeného kaliového kanálu (KATP) B-buňky [1,3], tedy organely klíčové pro spuštění sekrece inzulinu z B-buňky. Pankreatický KATP má 8 podjednotek – 4 podjednotky SUR1 (sulfonylureový receptor typu 1, kódován genem ABCC8) a 4 podjednotky tzv. B-cell inward rectifier (Kir6.2, kódovaný genem KCNJ11). Zatímco podjednotky Kir6.2 tvoří póry a představují část kanálu závislého na hladině ATP, regulační podjednotky SUR1 jsou řízeny kromě ADP také sloučeninami ze skupiny derivátů sulfonylurey. Snížení toku kaliových iontů KATP kanálem způsobí depolarizaci membrány, která spouští vstup kalciových iontů přes napěťově řízený Ca2+ kanál, a tím stimuluje uvolnění sekrečních granul obsahujících inzulin. Aktivační mutace v některém z uvedených genů způsobí nedostatečnou produkci inzulinu vedoucí k časnému rozvoji diabetu, leckdy doprovázenému život ohrožující diabetickou ketoacidózou a metabolickým rozvratem [3]. Inaktivační mutace vedou naopak k neonatálnímu hyperinzulinizmu [4], jak je popsáno v článku prof. Lebla v tomto čísle [5]. Třetí nejčastější příčinou NDM je mutace v genu pro inzulin (INS). Mutace v těchto 3 genech (typicky v heterozygotním stavu) jsou zodpovědné za 90 % případů NDM, ostatní jsou výrazně vzácnější [6]. Rychlá DNA analýza, která dnes již patří mezi standardy péče o děti s NDM, proto preferenčně zahrnuje právě tyto geny. Většina pacientů s TNDM má abnormality imprintingu genu PLAGL1 na chromozomu 6q charakteru uniparentální disomie, paternální duplikatury nebo maternální hypometylace.
Děti s novorozeneckým diabetem se častěji rodí předčasně nebo s nižší porodní hmotností a délkou. Obojí je projevem deficitu inzulinu jako dominantního prenatálního růstového faktoru. K hlavním postnatálním projevům diabetu patří neprospívání, ubývání na hmotnosti, polyurie a rychlý rozvoj dehydratace. Zvláště nedonošené děti mají vysoké riziko metabolického rozvratu s rychlým nástupem i progresí. Laboratorně zjišťujeme hyperglykemii, u 30 % případů je přítomna ketoacidóza. Většina dětí s NDM nemá v séru detekovatelný C-peptid [6].
Léčbu NDM zahajujeme většinou inzulinem, vždy v případě rozvinuté diabetické ketoacidózy. Po zvládnutí akutního stavu terapii modifikujeme podle genetické diagnostiky a předpokládané reakce na alternativní terapii. V případě mutací v některé z podjednotek KATP kanálu jsou lékem první volby antidiabetika ze skupiny derivátů sulfonylurey (nejvíce zkušeností je s glibenklamidem a gliklazidem), většina dětí na tuto terapii dobře zareaguje vyplavením inzulinu s následnou korekcí hyperglykemie [6]. Přechod z terapie inzulinem na léčbu deriváty sulfonylurey je možný v jakémkoli věku, citlivost B-buněk na tuto léčbu přetrvává i po dlouhodobé inzulinové terapii. Podle nedávné studie však u pacientů převedených v nižším věku dosáhneme lepší odpovědi v produkci inzulinu [7], což ukazuje na důležitost časné diagnostiky. Děti s nejtěžšími mutacemi KATP kanálu však na tuto terapii nereagují a je nutné se vrátit k podávání inzulinu.
Část dětí s novorozeneckým diabetem má navíc závažné neurologické příznaky (opožďování psychomotorického vývoje, epilepsie). Tento stav označujeme jako DEND syndrom (z anglického developmental delay, epilepsy, neonatal diabetes) [3]. Tyto děti většinou léčíme inzulinem, protože charakter postižení kaliového kanálu neumožní reakci na léčbu perorálními antidiabetiky [8]. Několik kazuistik však doložilo parciální zlepšení psychomotorického vývoje po podávání glibenklamidu u dětí s neurologickým deficitem, ale bez přítomnosti epilepsie [9,10]. Tento stav nazýváme i-DEND (intermediate DEND). V terapii využíváme kombinace inzulinu a vysokých dávek derivátů sulfonylurey. Efektivitu perorální terapie je třeba kriticky zhodnotit ve spolupráci s dětským neurologem v prvních letech života.
Pokud diagnostikujeme mutace v ostatních genech způsobujících NDM, např. genu INS, není zpravidla jiná možnost léčby než inzulin. Obecně pro novorozence platí, že nejčastěji využíváme depotní inzulinová analoga, po zvýšení množství sacharidů ve stravě přidáváme standardně rychlé inzuliny preprandiálně. Vhodnou alternativou je léčba inzulinovou pumpou, jejíž výhodou je možnost flexibilnější aplikace inzulinu podle času a množství přijatých sacharidů.
Diabetes 1. typu u dětí
Pokud se diabetes mellitus manifestuje ve 2. půlroce života a později v dětství a adolescenci, jedná se nejčastěji o DM1T, autoimunitní onemocnění multifaktoriální etiologie, v jehož patogenezi se přibližně stejnou měrou uplatňují vlivy genetické a faktory prostředí.
Epidemiologie
Epidemiologická data o výskytu diabetu v ČR čerpáme již od roku 1989 z údajů Českého registru dětského diabetu [11–13]. Z jeho údajů je zřejmé, že incidence diabetu se za minulých 25 let vyšplhala z 6,8/100 000/rok 1989 až na 24,8/100 000/rok 2012 (graf). Absolutní počet případů diagnostikovaných každým rokem roste navzdory změnám velikosti dětské populace. Změny incidence se odrážejí v prevalenci pouze zvolna. Prevalence DM1T je velmi nízká u nejmenších dětí (0,2–0,4/1 000) a postupně vzrůstá do puberty, během níž dosahuje hodnot 1,6–1,8/1 000. Prevalence je kromě incidence ovlivněna též úmrtností a strukturou populace. Zatímco úmrtnost dětských diabetických pacientů je u nás zanedbatelná, dva zbývající parametry se rychle mění. Příčina změn incidence DM1T není známa, ale je zřejmé, že není způsobena genetickými vlivy. Během posledních několika desítek let se nejspíše změnil nějaký negenetický faktor nebo faktory a tato změna měla za následek buďto vzestup výskytu autoimunitní inzulitidy, nebo – méně pravděpodobně – přesun jejího začátku do dětského věku.
Graph 1. Incidence dětského diabetu v ČR v letech 1989–2012. Upraveno podle [10–12] ![Incidence dětského diabetu v ČR v letech 1989–2012. Upraveno podle [10–12]](https://pl-master.mdcdn.cz/media/image/2021a4337bd3f4cd0fd841880b1a07eb.jpg?version=1537792866)
Genetika diabetu 1. typu
Genetické faktory hrají v patogenezi DM1T nezpochybnitelnou roli. Konkordance mezi jednovaječnými dvojčaty se pohybuje v různých studiích od 23 % do 53 %, zatímco u dizygotních dvojčat je to pouze 2,5 % až 11 % [14]. Podobně nejbližší příbuzní diabetických pacientů mají vyšší riziko vzniku DM1T než běžná populace. Zatímco prevalence DM1T se v naší populaci pohybuje kolem 1 : 500–1 000, děti diabetických matek a sourozenci dětí s DM1T mají celoživotní riziko přibližně 3–5 % a děti diabetických otců přibližně 5–7 %.
Míra rizika DM1T je determinována polygenně. Je však zřejmé, že jeden z genových komplexů, HLA (human leucocyte antigen, hlavní histokompatibilní systém člověka), hraje hlavní roli s podílem přibližně 50 %. Podíl HLA na genetické etiologii diabetu byl odhadnut z podílu na familiárním výskytu v rodinách s více než jedním diabetickým dítětem. Jedním z důkazů pro vedoucí roli HLA je, že riziko diabetu u HLA identického (nesoucí stejnou kombinaci HLA) sourozence diabetického dítěte je 12,9 %, zatímco u HLA haploidentického (mající jen část kombinace HLA stejnou jako dítě s diabetem) sourozence je to 4,7 % a u neidentického pouze 1,8 % [15]. V lidském genomu neexistuje žádná jiná oblast s tak velkým vlivem na riziko DM1T, jako má HLA. Schopnost vazby HLA na autoantigen a její síla jsou zásadní pro vznik a rozvoj autoimunitních chorob včetně DM1T. O zbytek genetického rizika se dělí několik desítek minoritních genových polymorfizmů souhrnně nazývaných non-HLA geny. Nejdůležitějšími z nich jsou gen pro inzulin [16] a gen PTPN22 [17].
Proporce genetického a negenetického rizika se mění v čase. Ukázalo se, že vliv genetických faktorů za léta oslabil: k tomu, aby člověk dostal diabetes, je nyní třeba méně genetických predisponujících faktorů než v minulosti; analogicky, diabetes dostávají ve zvýšené míře i lidé nesoucí ochranné genetické faktory. Rizikové haplotypy tedy v posledních desetiletích patrně ztratily kus své rizikovosti, a možná i protektivní ztratily část své protektivity [18]. Vzestup incidence diabetu je tedy příliš rychlý na to, aby se dal objasnit změnou genetického podkladu v populaci, ale je pravděpodobně způsoben změnou expozice nějakému negenetickému faktoru. Liší se též rozložení rizikových HLA haplotypů podle věku při manifestaci. Nejrizikovější genotyp mají děti diagnostikované v prvních letech života, naopak adolescenti mají častěji genotypy neutrální či dokonce mírně protektivní [19]. To ukazuje na postupně klesající podíl rizika daného genetickými faktory a naopak stoupající vliv faktorů prostředí s rostoucím věkem při manifestaci diabetu.
Distribuce jednotlivých HLA haplotypů neovlivňuje pouze riziko DM1T, ale také jeho průběh. Přítomnost genotypů rizikových pro DM1T je asociována jednak s rychlejší progresí z prediabetické fáze do klinického diabetu [20] a také s kratším obdobím postiniciální remise, tedy rychlejší ztrátou reziduálních B-buněk [21]. Vzhledem ke známému překryvu rizikových genotypů mezi DM1T, celiakií a autoimunitní tyreoiditidou není překvapivé, že diabetické děti s HLA-DQ2 či HLA-DQ8 mají několikanásobně vyšší pravděpodobnost rozvoje těchto tzv. sdružených autoimunit [22,23].
Negenetické příčiny diabetu 1. typu
Pro zásadní úlohu negenetických faktorů v patogenezi diabetu mluví několik faktů:
- konkordance monozygotních dvojčat je neúplná, dosahuje maximálně 50 %
- existují lokální epidemie DM1T
- incidence DM1T u mnoha geneticky stabilních populací setrvale stoupá a zdá se, že podíl genetických faktorů na etiologii diabetu s časem klesá
Mezi další nepřímé důkazy patří též místní a časové hromadění případů DM1T. Pozorujeme, že nově manifestovaní přicházejí častěji v určitých fázích roku (sezonalita diagnózy) i místě diagnózy (lokální epidemie diabetu), clustering je ovšem vidět i mnoho let před nástupem diabetu – v době školní docházky a dokonce v místě a čase narození [24,25]. Existují četné negenetické faktory s prokázaným nebo alespoň diskutovaným vlivem na riziko DM1T – přehled uvádíme v tab. 2. Většina z těchto faktorů je asociována sekundárně, nejsou to tedy přímí etiologičtí činitelé, ale indikátory (tzv. proxy measures), měřítka nějaké další expozice, která je v kauzálním vztahu k DM1T. Negenetické rizikové faktory jsou jednotlivě slabé, je jich nicméně velké množství. Riziko je rozdrobeno mezi špatně definované faktory, jejichž jednotlivý příspěvek je nízký – riziko asociované s přítomností nebo nepřítomností faktoru se zřídka liší více než 2–5krát, u většiny expozic je to však ještě mnohem méně [26].
Table 2. Vybrané negenetické faktory asociované s rizikem DM1T 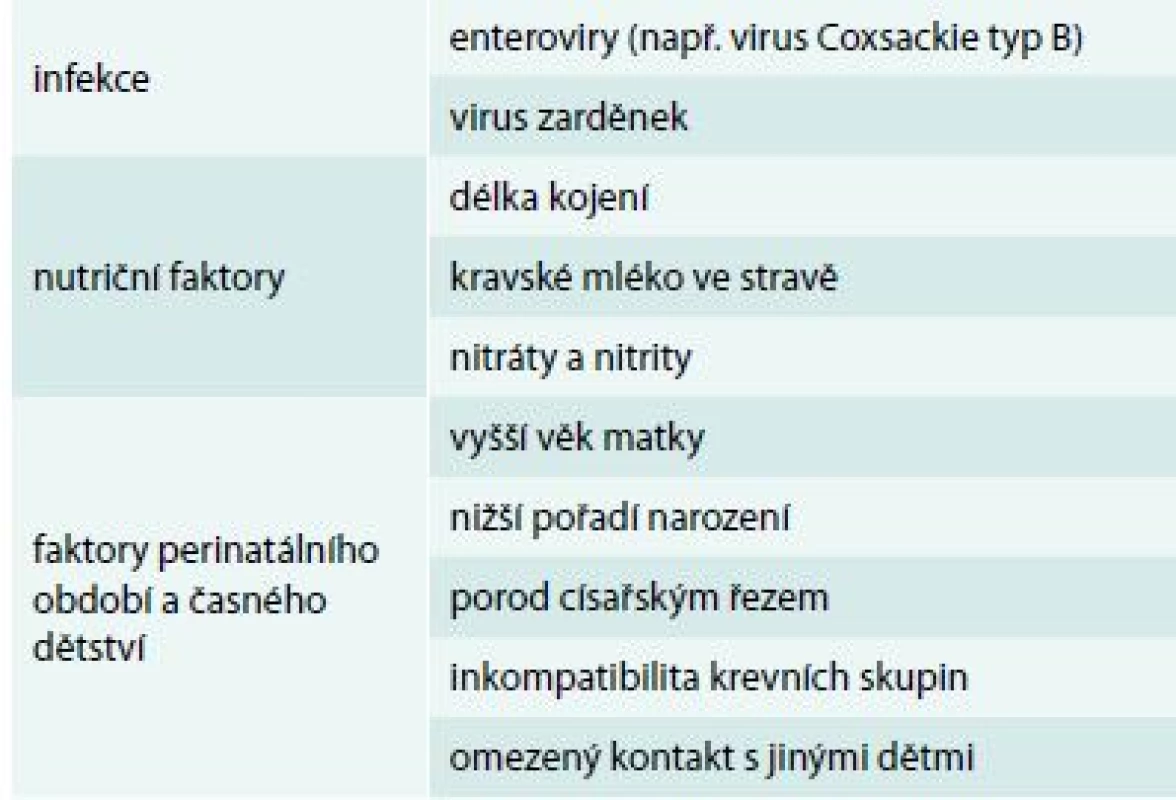
Monogenní typy diabetu
Monogenní diabetes vzniká na podkladě nosičství jedné mutace nebo více mutací v jednom genu. U dětí je většina případů monogenního diabetu způsobena mutacemi v genech regulujících funkci B-buněk [6]. Vzácně může diabetes vzniknout i díky mutaci vedoucí k velmi těžké inzulinové rezistenci. Mezi monogenní typy diabetu řadíme i diabetes vzniklý jako součást jiné geneticky podmíněné nemoci, např. diabetes při cystické fibróze.
Monogenní diabetes mají přibližně 3–4 % dětí s diabetem. Velmi často je zaměněn za většinové typy diabetu (DM1T nebo DM2T) [27], přitom stanovení správné diagnózy umožní výběr optimální terapie, která je v mnohých aspektech odlišná od doporučení pro běžnější typy diabetu.
V klasickém pojetí se jedná o autozomálně dominantně dědičné onemocnění, které je typické výskytem diabetu v každé generaci s 50% rizikem přenosu na děti. Jednotlivé typy MODY diabetu se dříve číslovaly (MODY1, MODY2 atd) podle pořadí objevů genů, jejichž mutace MODY diabetes způsobují. V současné době se již toto číselné označení nepoužívá, preferujeme označení genetické obsahující název mutovaného genu (např. HNF1A-diabetes, nikoli MODY3). Na monogenní diabetes pomýšlíme u pacientů, kteří mají:
- pozitivní rodinnou anamnézu diabetu (nebo poruch glukózové tolerance, gestačního diabetu, mírné hyperglykemie nalačno) s manifestací nemoci do 40 let věku v každé generaci (autozomálně dominantní typ dědičnosti)
a dále alespoň jedno z následujících kritérií:
- k manifestaci diabetu (hyperglykemie) došlo bez známek diabetické ketoacidózy
- pacient je sledován pro trvalou stacionární mírnou hyperglykemii, která ani bez léčby neprogreduje
- byla zjištěna negativita protilátek anti-GAD, anti-IA2, anti-IAA, anti-ZnT8, případně HLA genotyp protektivní proti DM1T
Pro monogenní diabetes svědčí kromě absence autoprotilátek též pozitivní rodinná anamnéza diabetu alespoň ve 3 generacích, i zde je však třeba zohlednit možnost mutací de novo, které se vyskytují v České republice a na Slovensku u necelých 8 % potvrzených případů [28]. Celou situaci komplikuje fakt, že i u monogenního diabetu se mj. podle studie pocházející ze skupiny jubilanta mohou vyskytovat GAD protilátky povětšinou v nízkých titrech [29]. Přítomnost diabetické ketoacidózy není absolutním vylučovacím kritériem monogenního diabetu, v případě dalšího precipitujícího faktoru (např. infekt) může k těžké ketoacidóze dojít [30]. Nikdy však nebyla popsána při manifestaci diabetu.
Etiolopatogeneze i klinický obraz monogenního diabetu je velmi pestrý a jejich detailní popis přesahuje rozsah i cíl tohoto sdělení. Proto se omezíme pouze na monogenně podmíněné autoimunitní typy diabetu, z nichž některé byly popsány teprve nedávno.
Monogenní formy autoimunně podmíněného diabetu
Vrozené defekty imunologické autotolerance způsobují komplexní dysfunkci imunitního systému; v jejich důsledku nositelé těchto mutací vyvíjejí v průběhu dětství různé autoimunitní choroby včetně autoimunitního diabetu.
APECED (autoimunní polyendokrinopatie, kandidóza, ektodermální dystrofie, alternativní název APS-1 – autoimunitní polyglanduální syndrom typu 1) je vzácné autoimunitní onemocnění vznikající na podkladě autozomálně recesivní dědičnosti s incidencí přibližně 1 : 100 000. Jeho podkladem je autoimunní destrukce endokrinních žláz zprostředkovaná T-lymfocyty a současné postižení neendokrinních orgánů. Ve 2–23 % případů je onemocnění spojeno se vznikem diabetu, který se klinicky neliší od DM1T. Klasická forma APECED zahrnuje především kombinaci hypoparatyreózy, chronické mukokutánní kandidózy a Addisonovy choroby, nicméně příznaky mohou být velmi pestré [31]. Syndrom je způsobený mutacemi v genu AIRE (autoimmune regulátor), jehož produkt protein AIRE je transkripčním faktorem, který je nezbytný k „přečtení“ molekulární sekvence všech potenciálních autoantigenů v thymu během vývoje imunitního systému [32]. Tento mechanizmus je zásadním předpokladem pro eliminaci potenciálně autoreaktivních klonů T-lymfocytů. Pokud je porušen, dochází v průběhu života k rozvoji četných autoimunitních onemocnění. O tom, zda se mezi ně zařadí též autoimunitní diabetes, nicméně rozhodují zřejmě i další faktory – např. alela HLA-DQB1*0602 má DM1T–protektivní charakter podobně jako u ostatních osob [33].
Syndrom IPEX (imunitní polyendokrinopatie vázaná na X chromozom) je vzácné autoimunitní onemocnění postihující pouze chlapce. Do klinického obrazu patří permanentní novorozenecký diabetes, velmi časně nastupující tyreoiditida, průjmy, ekzémy, rekurentní těžké infekce, hemoragická diatéza a hemolytická anémie [34]. Nicméně klinické formy mohou být velmi proměnlivé v závislosti na tom, který orgán je autoimunitní reakcí nejvíce postižen. V krvi je přítomna trvalá aktivace autoagresivních T-lymfocytů CD4+. Syndrom vzniká na podkladě mutace v genu FOXP3 kódujícím protein scurfin působící jako transkripční faktor. Předpokládá se, že scurfin je protein nutný pro diferenciaci a správnou funkci CD4+CD25+ T-lymfocytů, tedy regulačních T-lymfocytů (Tregs). U pacientů s mutací FOXP3 nedochází k supresi efektorových lymfocytů pomocí Treg, což vede k závažnému rozvoji lymfoproliferativního onemocnění s rozličnými klinickými projevy [34]. V případě plně vyjádřeného IPEX je jedinou možností léčby transplantace kostní dřeně.
Diabetes způsobený mutací v genu CTLA4 byl popsán v roce 2014 [35,36]. CTLA4 (protein cytotoxic T-lymfocyte antigen 4) je základní negativní regulátor imunitní odpovědi, jehož úplná ztráta způsobuje rozvoj autoimunitních onemocnění, polymorfizmus v tomto genu modifikuje riziko manifestace klasického DM1T. Heterozygotní mutace v CTLA4 způsobují autozomálně dominantní syndrom dysfunkce imunitního systému charakterizovaný nejčastěji kombinací různých autoimunitních projevů (pancytopenie, průjmy, diabetes, alopecie, hemolytická anémie a další) a recidivujících infekcí. Onemocnění má neúplnou penetranci, klinický obraz u nositelů mutace v rámci jedné rodiny se může zásadně lišit. Terapeuticky se u nejtěžších případů zkouší kromě kombinace imunosupresiv abatacept [37], v případě selhání je i v těchto případech indikována transplantace kostní dřeně s nejistým výsledkem.
Podobnou jednotkou je diabetes vzniklý v důsledku mutace genu LRBA (lipopolysaccharide-responsive and beige-like anchor protein). Jeho změny byly nově popsány u pacientů s časně vznikajícím autoimunitním diabetem (kojenecký a batolecí věk), enteropatií a torpidní trombocytopenií nebo pancytopenií. Terapie se neliší od mutace v genu CTLA4 [38].
Geny STAT1 a STAT3 (signal transducers and activator of transcription) kódují rodinu tzv. STAT proteinů. Ty působí v jádře jako transkripční faktory mediující expresi řady genů, které se aktivují v odpovědi buňky na stimulaci prostřednictvím cytokinů (interferon α, γ nebo IL6) nebo růstových faktorů [39]. Ztráta funkce STAT3 v důsledku mutace se klinicky projevuje rozsáhlými ekzémy (při velmi vysokém IgE) a opakovanými infekty. Naopak aktivační mutace STAT3 vedou k rozvoji autoimunitních onemocnění zahrnujících časně nastupující diabetes, autoimunitní tyreoiditidu, zánětlivá střevní onemocnění i hematologické abnormality [40]. Rozvoj autoimunitního diabetu byl publikován také u nositelů mutací v STAT1 [41]. Terapie je svízelná, jsou popsány případy úspěšné transplantace kostní dřeně, naše zkušenosti s touto léčbou prozatím příliš povzbudivé nejsou.
Diabetes 2. typu u dětí
V naší populaci je proporce dětí s DM2T velmi nízká, okolo 1 %, a nejsou signály, že by docházelo k růstu incidence [42]. V diferenciální diagnostice DM2T vs DM1T využíváme v prvním kroku autoprotilátky specifické pro diabetes, jejichž negativita zvyšuje pravděpodobnost, že se skutečně jedná o DM2T. Jsou-li protilátky pozitivní, jde nejspíše o DM1T, nicméně je dobré mít na paměti, že existují přechodné typy někdy označované též jako „double diabetes“ či „diabetes 1,5“, které sdružují základní klinické znaky obou nejčastějších typů diabetu [43].
Metodou volby při terapii DM2T u adolescentů je metformin v dávce postupně stoupající až na 2–2,5 g denně. Pokud nedojde k zlepšení kontroly diabetu na doporučené hodnoty (HbA1c < 53 mmol/mol), zahajujeme terapii inzulinem, nejčastěji pomocí intenzifikovaného inzulinového režimu [44]. Studie s využitím novějších antidiabetik u dospívajících probíhají.
Závěr
Dětský diabetes je etiologicky heterogenní. Rozpoznání etiopatogenetických mechanizmů vedoucích ke vzniku jednotlivých typů umožňuje zahájení cílené terapie, pomáhá k odhadu rizika komorbidit a v některých případech i stanovení životní prognózy pacientů.
doc. MUDr. Zdeněk Šumník, Ph.D.
zdenek.sumnik@lfmotol.cuni.cz
Pediatrická klinika 2. LF UK a FN v Motole, Praha
www.lf2.cuni.cz
Doručeno do redakce 6. 8. 2016
Přijato po recenzi 26. 9. 2016
Sources
1. Ashcroft FM, Rorsman P. K(ATP) channels and islet hormone secretion: new insights and controversies. Nat Rev Endocrinol 2013; 9(11): 660–669. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2013.166>.
2. Stanik J, Gasperikova D, Paskova M et al. Prevalence of permanent neonatal diabetes in Slovakia and successful replacement of insulin with sulfonylurea therapy in KCNJ11 and ABCC8 mutation carriers. J Clin Endocrinol Metab 2007; 92(4): 1276–1282.
3. Gloyn AL, Pearson ER, Antcliff JF et al. Activating mutations in the gene encoding the ATP-sensitive potassium-channel subunit Kir6.2 and permanent neonatal diabetes. N Engl J Med 2004; 350(18): 1838–1849. Erratum in N Engl J Med 2004; 351(14): 1470.
4. Rozenkova K, Malikova J, Nessa A et al. High Incidence of Heterozygous ABCC8 and HNF1A Mutations in Czech Patients With Congenital Hyperinsulinism. J Clin Endocrinol Metab 2015; 100(12): E1540-E1549. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2015–2763>.
5. Lebl J, Roženková K, Průhová Š. Vrozený hyperinzulinismus: Když beta-buňka ztratí sebekontrolu. Vnitř Lék 2016; 62(11 Suppl 4): 4S72–4S76.
6. Rubio-Cabezas O, Hattersley AT, Njølstad PR et al. ISPAD Clinical Practice Consensus Guidelines 2014. The diagnosis and management of monogenic diabetes in children and adolescents. Pediatr Diabetes 2014; 15(Suppl 20): S47-S64. Dostupné z DOI: <http://dx.doi.org/10.1111/pedi.12192>.
7. Thurber BW, Carmody D, Tadie EC et al. Age at the time of sulfonylurea initiation influences treatment outcomes in KCNJ11-related neonatal diabetes. Diabetologia 2015; 58(7): 1430–1435. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–015–3593–9>.
8. Sumnik Z, Kolouskova S, Wales JK et al. Sulphonylurea treatment does not improve psychomotor development in children with KCNJ11 mutations causing permanent neonatal diabetes mellitus accompanied by developmental delay and epilepsy (DEND syndrome). Diabet Med 2007; 24(10): 1176–1178.
9. Zwaveling-Soonawala N, Hagebeuk EE, Slingerland AS et al. Successful transfer to sulfonylurea therapy in an infant with developmental delay, epilepsy and neonatal diabetes (DEND) syndrome and a novel ABCC8 gene mutation. Diabetologia 2011; 54(2): 469–471. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–010–1981–8>.
10. Peña-Almazan S. Successful transition to sulfonylurea in neonatal diabetes, developmental delay, and seizures (DEND syndrome) due to R50P KCNJ11 mutation. Diabetes Res Clin Pract 2015; 108(1): e18-e20. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2014.12.010>.
11. Cinek O, Lánská V, Kolousková S et al. Type 1 diabetes mellitus in Czech children diagnosed in 1990–1997: a significant increase in incidence and male predominance in the age group 0–4 years. Diabet Med 2000; 17(1): 64–69.
12. Cinek O, Sumnik Z, Vavrinec J. Continuing increase in incidence of childhood-onset type 1 diabetes in the Czech Republic 1990–2001. Eur J Pediatr 2003; 162(6): 428–429.
13. Cinek O, Kulich M, Sumnik Z. The incidence of type 1 diabetes in young Czech children stopped rising. Pediatr Diabetes 2012; 13(7): 559–563. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–5448.2012.00858.x>.
14. Kaprio J, Tuomilehto J, Koskenvuo M et al. Concordance for type 1 (insulin-dependent) and type 2 (non-insulin-dependent) diabetes mellitus in a population-based cohort of twins in Finland. Diabetologia 1992; 35(11): 1060–1067.
15. Thomson G, Robinson WP, Kuhner MK et al. Genetic heterogeneity, modes of inheritance, and risk estimates for a joint study of Caucasians with insulin-dependent diabetes mellitus. Am J Hum Genet 1988; 43(6): 799–816.
16. Cinek O, Drevínek P, Sumník Z et al. Association of insulin gene variants with type 1 diabetes mellitus in Czech population. Čas Lék Česk 2004; 143(5): 318–322.
17. Cinek O, Hradsky O, Ahmedov G et al. No independent role of the -1123 G>C and+2740 A>G variants in the association of PTPN22 with type 1 diabetes and juvenile idiopathic arthritis in two Caucasian populations. Diabetes Res Clin Pract 2007; 76(2): 297–303.
18. Fourlanos S, Varney MD, Tait BD et al. The rising incidence of type 1 diabetes is accounted for by cases with lower-risk human leukocyte antigen genotypes. Diabetes Care 2008; 31(8): 1546–1549. Dostupné z DOI: <http://dx.doi.org/10.2337/dc08–0239>.
19. Awa WL, Boehm BO, Kapellen T et al. HLA-DR genotypes influence age at disease onset in children and juveniles with type 1 diabetes mellitus. Eur J Endocrinol 2010; 163(1): 97–104. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-09–0921>.
20. Lipponen K, Gombos Z, Kiviniemi M et al. Effect of HLA class I and class II alleles on progression from autoantibody positivity to overt type 1 diabetes in children with risk-associated class II genotypes. Diabetes 2010; 59(12): 3253–3256. Dostupné z DOI: <http://dx.doi.org/10.2337/db10–0167>.
21. Kawabata Y, Ikegami H, Awata T et al. Differential association of HLA with three subtypes of type 1 diabetes: fulminant, slowly progressive and acute-onset. Diabetologia 2009; 52(12): 2513–2521. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–009–1539–9>.
22. Sumnik Z, Cinek O, Bratanic N et al. Risk of celiac disease in children with type 1 diabetes is modified by positivity for HLA-DQB1*02-DQA1*05 and TNF -308A. Diabetes Care 2006; 29(4): 858–863.
23. Sumnik Z, Drevínek P, Snajderová M et al. HLA-DQ polymorphisms modify the risk of thyroid autoimmunity in children with type 1 diabetes mellitus. J Pediatr Endocrinol Metab 2003; 16(6): 851–858.
24. Patterson CC, Gyürüs E, Rosenbauer J et al. Seasonal variation in month of diagnosis in children with type 1 diabetes registered in 23 European centers during 1989–2008: little short-term influence of sunshine hours or average temperature. Pediatr Diabetes 2015; 16(8): 573–580. Dostupné z DOI: <http://dx.doi.org/10.1111/pedi.12227>.
25. Lewy H, Hampe CS, Kordonouri O et al. Seasonality of month of birth differs between type 1 diabetes patients with pronounced beta-cell autoimmunity and individuals with lesser or no beta-cell autoimmunity. Pediatr Diabetes 2008; 9(1): 46–52.
26. Cinek O. Epidemiology of childhood type 1 diabetes mellitus: lessons from Central and Eastern European data. Horm Res Paediatr 2011; 76(Suppl 1): S52-S56. Dostupné z DOI: <http://dx.doi.org/10.1159/000329168>.
27. Petruzelkova L, Dusatkova P, Cinek O et al. Substantial proportion of MODY among multiplex families participating in a Type 1 diabetes prediction programme. Diabet Med 2015 Dec 7. Dostupné z DOI: <http://dx.doi.org/10.1111/dme.13043>. [Epub ahead of print].
28. Urbanová J, Rypáčková B, Kučera P et al. Should the negativity for islet cell autoantibodies be used in a prescreening for genetic testing in maturity-onset diabetes of the young? The case of autoimmunity-associated destruction of pancreatic B-cells in a family of HNF1A-MODY subjects. Int Arch Allergy Immunol 2013; 161(3): 279–284. Dostupné z DOI: <http://dx.doi.org/10.1159/000346906>.
29. Pruhova S, Dusatkova P, Neumann D et al. Two cases of diabetic ketoacidosis in HNF1A-MODY linked to severe dehydration: is it time to change the diagnostic criteria for MODY? Diabetes Care 2013; 36(9): 2573–2574. Dostupné z DOI: <http://dx.doi.org/10.2337/dc13–0058>.
30. Zeitler P, Fu J, Tandon N et al. ISPAD Clinical Practice Consensus Guidelines 2014. Type 2 diabetes in the child and adolescent. Pediatr Diabetes 2014; 15(Suppl 20): S26-S46. Dostupné z DOI: <http://dx.doi.org/10.1111/pedi.12179>.
31. Cihakova D, Trebusak K, Heino M et al. Novel AIRE mutations and P450 cytochrome autoantibodies in Central and Eastern European patients with APECED. Hum Mutat 2001; 18(3): 225–232.
32. Gallo V, Giardino G, Capalbo D et al. Alterations of the autoimmune regulator transcription factor and failure of central tolerance: APECED as a model. Expert Rev Clin Immunol 2013; 9(1): 43–51. Dostupné z DOI: <http://dx.doi.org/10.1586/eci.12.88>.
33. Huang W, Connor E, Rosa TD et al. Although DR3-DQB1*0201 may be associated with multiple component diseases of the autoimmune polyglandular syndromes, the human leukocyte antigen DR4-DQB1*0302 haplotype is implicated only in beta-cell autoimmunity. J Clin Endocrinol Metab 1996; 81(7): 2559–2563.
34. Bacchetta R, Barzaghi F, Roncarolo MG. From IPEX syndrome to FOXP3 mutation: a lesson on immune dysregulation. Ann NY Acad Sci 2016; Feb 25. Dostupné z DOI: <http://dx.doi.org/10.1111/nyas.13011I>.
35. Schubert D, Bode C, Kenefeck R et al. Autosomal dominant immune dysregulation syndrome in humans with CTLA4 mutations. Nat Med 2014; 20(12): 1410–1416. Dostupné z DOI: <http://dx.doi.org/10.1038/nm.3746>.
36. Kuehn HS, Ouyang W, Lo B et al. Immune dysregulation in human subjects with heterozygous germline mutations in CTLA4. Science 2014; 345(6204): 1623–1627. Dostupné z DOI: <http://dx.doi.org/10.1126/science.1255904>.
37. Lee S, Moon JS, Lee CR et al. Abatacept alleviates severe autoimmune symptoms in a patient carrying a de novo variant in CTLA-4. J Allergy Clin Immunol 2016; 137(1): 327–330. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2015.08.036>.
38. Lo B, Zhang K, Lu W et al. Autoimmune disease. Patients with LRBA deficiency show CTLA4 loss and immune dysregulation responsive to abatacept therapy. Science 2015; 349(6246): 436–440. Dostupné z DOI: <http://dx.doi.org/10.1126/science.aaa1663>.
39. Forbes LR, Milner J, Haddad E. Signal transducer and activator of transcription 3: a year in review. Curr Opin Hematol 2016; 23(1): 23–27. Dostupné z DOI: <http://dx.doi.org/10.1097/MOH.0000000000000206>.
40. Flanagan SE, Haapaniemi E, Russell MA et al. Activating germline mutations in STAT3 cause early-onset multi-organ autoimmune disease. Nat Genet 2014; 46(8): 812–814. Dostupné z DOI: <http://dx.doi.org/10.1038/ng.3040>.
41. Toubiana J, Okada S, Hiller J et al. Heterozygous STAT1 gain-of-function mutations underlie an unexpectedly broad clinical phenotype. Blood 2016; 127(25): 3154–3164. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2015–11–679902>.
42. Pickova K, Venhacova J, Skvor J et al. National childhood diabetes register: disease onset, diabetes control and therapeutic data in the Czech Republic (abstrakt). Diabetologia 2015; 58(Suppl 1): S168-S169.
43. Pozzilli P, Guglielmi C. Double diabetes: a mixture of type 1 and type 2 diabetes in youth. Endocr Dev 2009; 14 : 151–166. Dostupné z DOI: <http://dx.doi.org/10.1159/000207484>.
44. Stanik J, Dusatkova P, Cinek O et al. De novo mutations of GCK, HNF1A and HNF4A may be more frequent in MODY than previously assumed. Diabetologia 2014; 57(3): 480–484. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–013–3119–2>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl 4-
All articles in this issue
- Adaptace tukové tkáně na redukční nízkoenergetickou dietu u obézních jedinců
- Heterogenita dětského diabetu a její terapeutické implikace
- Historie diagnostiky a léčby diabetické retinopatie
- Metabolický syndrom u nemocných s diabetes mellitus 1. typu, prevalence, vliv na morbiditu a mortalitu, komplexní přístup k nemocnému
- Frekvence a načasování jídel a změny v body mass indexu: analýza dat z Adventist Health Study-2
- Edukace pacienta s diabetem – součást komplexní terapie
- Pregestační diabetes mellitus a gravidita
- Bariatrické operace u nemocných s diabetem
- Duše jako imunomodulátor
- Syndrom diabetické nohy z pohledu internisty podiatra
- Komplex oxLDL/β2-glykoprotein I jako proaterogenní autoantigen. Je ateroskleróza autoimunitní onemocnění?
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Perspektivní molekuly pro léčbu hyperglykemie u pacientů s diabetem 2. typu
- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Obstrukční spánková apnoe a diabetes mellitus 2. typu
- Krátkodobá a dlouhodobá glykemická variabilita a její vztah k mikrovaskulárním komplikacím diabetu
- Složení makronutrientů v diabetické dietě
- Je glukóza pouze základní energetický substrát?
- Súčasné trendy v diagnostike a liečbe kongenitálneho hyperinzulinizmu
- Máme uvažovat o nové klasifikaci diabetu ovlivněné terapeutickým rozhodováním?
- Diabetes mellitus ve starším věku z pohledu klinického diabetologa
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Edukace pacienta s diabetem – součást komplexní terapie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

