-
Medical journals
- Career
Současnost a perspektivy léčby akromegalie
Authors: Václav Hána
Authors‘ workplace: III. interní klinika 1. LF UK a VFN v Praze
Published in: Vnitř Lék 2016; 62(Suppl 3): 68-72
Category: Reviews
Overview
Akromegalie je vzácné onemocnění způsobené nadprodukcí růstového hormonu, které zhoršuje kvalitu života a významně zvyšuje morbiditu a mortalitu pacientů. Moderní specializovaná operační léčba, radiochirurgie, radioterapie a farmakoterapie zásadně zlepšily terapeutické možnosti a perspektivu pacientů. Současné léčebné modality umožňují individuálně volit optimální postup pro konkrétního pacienta a dosáhnout inaktivity akromegalie. Farmaceutický průmysl připravuje nové formy podání užívaných účinných látek i koncepčně nové formy medikamentózní léčby (např. oktreotid v kapslích, CAM2029, Somatoprim, ATL1103).
Klíčová slova:
akromegalie – analoga somatostatinu – kabergolin/carbegolin – léčba – nové léky – pegvisomantÚvod
Akromegalie je závažné vzácné onemocnění, způsobené nadprodukcí růstového hormonu (GH – growth hormone). Prevalence onemocnění se pohybuje okolo 100 osob na 1 milion obyvatel. Téměř vždy je onemocnění způsobeno adenomem hypofýzy a jen zcela výjimečně má jinou příčinu (Mc Cuneův-Albrightův syndrom, extrahypofyzární nádor produkující GH nebo GH-RH (growth hormone releasing hormone) a karcinom hypofýzy jsou extrémně vzácné). Hypofyzární adenom produkuje autonomně růstový hormon a v přibližně 30 % bývá přítomna kosekrece i dalšího hypofyzárního hormonu, nejčastěji prolaktinu a výjimečně i TSH. Adenomy jsou v 95 % případů sporadické a jen v 5 % se vyskytují v rámci některého z familiárních syndromů.
Diagnóza akromegalie bývá u většiny pacientů stanovena obvykle až po několika letech trvání onemocnění, když má nádor v 75–80 % případů charakter makroadenomu (> 1 cm alespoň v jednom rozměru) a když bývají příznaky onemocnění již výrazněji rozvinuté [1]. Nadbytek GH a jím stimulovaného inzulinu-podobného faktoru 1 (IGF1), který je významným mediátorem působení GH (kromě přímého působení GH) na tkáně, má dopad na celou řadu orgánů s odpovídajícími klinickými projevy. Neléčené onemocnění výrazně zvyšuje morbiditu, zhoršuje kvalitu životu, zvyšuje mortalitu zejména na kardiovaskulární a cerebrovaskulární onemocnění a zkracuje délku života přibližně o 10 let [2]. Nádor svou velikostí může též působit lokální příznaky jako poruchy zorného pole při supraselární propagaci s útlakem optických nervů, bolesti hlavy, diplopii při porušení okohybných nervů a výjimečně při mimořádně velkém tumoru i hydrocefalus a epilepsii. Poškození zdravé hypofýzy nádorem vede k rozvoji hypopituitarizmu parciálního nebo úplného (panhypopituitarizmu).
Léčba akromegalie
Cílem léčby akromegalie je normalizace koncentrace GH nebo případně zablokování působení GH na cílové tkáně a odstranění nebo zmenšení adenomu. Optimální je situace, při níž se těchto cílů dosáhne bez dalšího poškození zdravé části hypofýzy. Vzhledem k tomu, že u většiny pacientů je v době diagnózy onemocnění již přítomen makroadenom, který často není možné celý odstranit, je léčba komplikovanější a vyžaduje obvykle multimodální terapeutický přístup (schéma).
Schéma. Současný algoritmus léčby akromegalie v České republice 
DA – dopaminergní agonista SMSA – analoga somatostatinu Chirurgická léčba
Nejrychlejším a nejúčinnějším způsobem léčby je operační odstranění celého adenomu hypofýzy a operace je doporučována jako primoterapie [3]. Není-li možný radikální výkon, pak je cílem maximální zmenšení adenomu s podstatným snížením koncentrací GH a IGF1 v cirkulaci. Na specializovaných pracovištích je dosahováno normalizace IGF1 po operaci adenomu hypofýzy, pokud hodnotíme všechny operované pacienty neselektovaně, v 61 % případů (hodnoceno z našeho souboru celkem 105 pacientů; 16 pacientů s mikroadenomy). U mikroadenomů bylo v našem souboru dosaženo radikální resekce v 75 % a u makroadenomu v 58,4 %. V případech, v nichž lze z předoperačního vyšetření magnetickou rezonancí (MRI) předpokládat radikální resekci (v našem souboru 80 pacientů), je dosaženo pooperačního vyhasnutí aktivity akromegalie v 77,5 % případů. V případech, v nichž lze z MRI nálezu předpokládat, že radikální výkon vzhledem k šíření expanze není možný, je dosaženo radikální resekce zcela výjimečně – v naší sestavě 25 pacientů u 2 (8 %) [4]. Nicméně, i v případech, v nichž není nádor odstraněn celý a je dosaženo významného debulkingu, je operace významným přínosem. Výrazná redukce tumorózní masy vytváří lepší podmínky pro uplatnění následné radiochirurgie nebo radioterapie a současně farmakoterapie [5,6]. Pokud nebyl hypofyzární adenom odstraněn celý a jsou pro to vhodné podmínky, reziduum tumoru ozáříme gama nožem. Použití gama nože není možné, pokud se jedná o nádor příliš velký (> 2,5 cm), v kontaktu nebo příliš blízko u optiků (< 2 mm) nebo když pacient nemůže podstoupit magnetickou rezonanci, která se užívá k zaměření paprsků záření (např. při zavedeném kardiostimulátoru atd). Nelze-li aplikovat radiochirurgii gama nožem, pak nádor ozáříme nejčastěji frakcionovaně lineárním urychlovačem případně ve specifických situacích protonovým zářením [7,8]. Efekt ozáření se projeví nejdříve v průběhu následujících měsíců až let. V naší sestavě dosáhla polovina pacientů vyhasnutí aktivity akromegalie přibližně za 5 let [9]. Do uplatnění plného efektu ozáření je nutné potlačit aktivitu akromegalie (GH, IGF1) farmakoterapií.
Farmakoterapie
Ve farmakoterapii máme v současnosti v rutinní praxi k dispozici 3 skupiny léků.
První skupinu tvoří dopaminergní agonisté a z nich především kabergolin. Výhodou kabergolinu je perorální podání, velmi dobrá snášenlivost léku s minimem vedlejších účinků a nízká cena. Nevýhodou je jeho malá účinnost. Ve studiích se ukázalo, že nejlepších výsledků je dosaženo u pacientů s nízkou hormonální aktivitou. U pacientů s IGF1 pod 1,5násobek horní hranice normy bylo dosaženo normalizace IGF1 až v 50 % [10]. V rutinní praxi při neselektované populaci pacientů lze očekávat normalizaci parametrů aktivity akromegalie kabergolinem mnohem nižší (odhadem do 10 %). Nicméně i při celkově nízké účinnosti z hlediska celé skupiny pacientů s akromegalií je kabergolin v případě účinnosti u daného pacienta léčbou pro pacienta velmi výhodnou umožňující individualizovanou dobře snášenou léčbu. Je proto vhodné účinnost kabergolinu vyzkoušet dříve, nežli přistoupíme k jiným formám farmakologické léčby, a to zvláště u pacientů s relativně mírnou hormonální aktivitou.
Druhou skupinou léků, které také působí přímo na buňky hypofyzárního adenomu, jsou analoga somatostatinu (SMSA). Kromě dominantního centrálního účinku je známo, že SMSA inhibují i tvorbu IGF1 na úrovni hepatocytu [11]. V této skupině jsou rutinně v ČR používány v současnosti oktreotid a lanreotid ve formě preparátů s pomalým uvolňováním (Sandostatin LAR Novartis a Somatuline Autogel Ipsen). Oktreotid a lanreotid působí především na somatostatinové receptory (SMSR) 2., a méně 3. a 5. typu. Injekce jsou aplikovány převážně v 4týdenním intervalu, ale podle odpovědi laboratorních parametrů aktivity onemocnění na léčbu (IGF1, GH) je někdy nutné interval zkrátit, a jindy je naopak možné interval prodloužit na 6–8 týdnů. Účinnost obou těchto preparátů v léčbě akromegalie je srovnatelná [12]. Plné normalizace parametrů aktivity akromegalie (GH, IGF-1) podle přísných kritérií je při léčbě SMSA dosaženo v přibližně 25 % neselektované populace pacientů s akromegalií [13]. V jiném hodnocení účinnosti se uvádí zhruba u třetiny úplné potlačení aktivity akromegalie, u třetiny parciální a u třetiny nedostatečný efekt. Oba tyto preparáty působí kromě potlačení aktivity akromegalie i zmenšení rezidua adenomu – o více než 20 % u 75 % [14].
Nově je v této skupině registrován pasireotid (Signifor LAR Novartis), který prokázal ve studiích větší účinnost ve srovnání s oktreotidem. Bylo dosaženo normalizace IGF1 u 38,6 % pacientů léčených pasireotidem LAR proti 23,6 % léčených oktreotidem LAR [15]. Pokles GH byl podobný po pasireotidu i oktreotidu. Přesný mechanizmus, který by vysvětlil výraznější supresi IGF1 při pasireotidu, není zcela jasný. Mohl by se podílet výraznější inhibiční vliv pasireotidu na sekreci inzulinu. Pasireotid má jiné spektrum afinity k somatostatinovým receptorům než oba výše zmíněné analogy. Má 40krát vyšší afinitu k SMSR5, 30krát k SMSR1 a 5krát k SMSR3, ale nižší afinitu k SMSR2. Jeho nevýhodou jsou vedlejší účinky, především výrazně vyšší výskyt hyperglykemie – při pasireotidu v 57 % proti 22 % při oktreotidu LAR [15]. To je způsobeno výraznější supresí sekrece inzulinu, jen mírnou supresí glukagonu a sníženou odpovědí inkretinů (GLP1 a GIP) při léčbě pasireotidem. V léčbě hyperglykemie při pasireotidu se proto doporučuje podání gliptinů nebo DPP4 inhibitorů [16,17]. Ke kompenzaci hyperglykemie přispívá i léčba metforminem.
Třetí skupinu farmak v léčbě akromegalie představuje blokátor receptorů pro GH – pegvisomant (Somavert Pfizer). Na rozdíl od prvních 2 skupin léků, které ovlivňují buňky adenomu, působí pegvisomant v cílových tkáních. Blokuje účinek růstového hormonu na úrovni receptoru GH. Pegvisomant je modifikovaná molekula růstového hormonu, která se v jednom místě pevně váže na receptor GH a blokuje účinnou dimerizaci receptorů GH, která je nezbytná pro aktivaci další kaskády dějů nutných k účinku GH v cílových tkáních. Účinnost pegvisomantu je vysoká (ve studiích přes 90 %) a závisí na výši podané dávky [18]. V každodenní praxi se ukázalo, že dávkování není vždy adekvátně zvýšeno a plně kontrolovaná aktivita akromegalie byla jen u 63 % pacientů [19]. Při léčbě pegvisomantem je výhodné podání v kombinaci s SMSA, kdy se využije synergistického potlačení aktivity akromegalie působením obou preparátů na různých úrovních [20]. U pegvisomantu se setkáváme s těmito vedlejšími účinky – elevace v jaterním souboru (ve velké observační studii ACROSTUDY do 3 %), lipodystrofie, lipohypertrofie, při velmi nízkých koncentracích IGF1 mohou být až známky deficitu GH. Pokud byl pozorován růst rezidua adenomu hypofýzy, jednalo se ve většině případů o rebound fenomen po vysazení SMSA při jeho nedostatečném efektu.
Při nedostatečném efektu léčby jedním preparátem bývá farmakologická léčba kombinována s preparátem z druhé skupiny (D2 agonista + SMSA; D2 agonista + pegvisomant; SMSA + pegvisomant).
Perspektivy léčby akromegalie
Současný farmakologický výzkum vyvíjí nová farmaka k léčbě akromegalie. Jednou cestou je vývoj nových aplikačních forem stávajících účinných látek – oktreotidu a lanreotidu a druhou cestou vývoj nových účinných látek [21,22].
Nové aplikační formy současných analogů somatostatinu
Subkutánní aplikace oktreotidu – CAM2029
Vyvíjený preparát pod označením CAM2029 obsahuje oktreotid, který se postupně uvolňuje z tekutých krystalů, a má tedy depotní charakter. Účinná látka je uložena v nanostrukturách. Aplikuje se injekčně v podobě subkutánních předplněných injekcí. Jeho výhodou se jeví lepší biologická dostupnost s kontinuálním uvolňováním oktreotidu, rychlejší nástup a příjemnější aplikace malého objemu tenkou jehlou ve srovnání s dosud nutnými silnými jehlami. Umožnil by i vlastní aplikaci a uchovávání v pokojové teplotě.
Klinická zkoušení fáze 1 již proběhla a nyní probíhá fáze 2, ve které je porovnávána subkutánní aplikace CAM2029 à 2 nebo 4 týdny u pacientů s akromegalií a neuroendokrinními tumory proti Sandostatin® LAR, Novartis.
Subkutánně implantované kapsle oktreotidu
Jako další aplikační forma SMSA je vyvíjena kapsle s pomalým uvolňováním oktreotidu k subkutánní implantaci. Výhodou by mohla být aplikace kapsle à 6 měsíců. Proběhly studie fáze 2 a 3, během nichž byl srovnáván biochemický efekt a bezpečnostní profil během 24 týdnů v porovnání s léčbou měsíčně aplikovaného oktreotidu LAR. Efektivita i bezpečnostní profil byly obdobné [23]. Program vývoje byl dle dostupných informací pozastaven (Endo Pharmaceuticals, Philadelphia, U. S.), ale další vývoj se předpokládá.
Perorálně podávaný oktreotid v kapslích – Octreolin
Za fyziologických okolností je oktreotid po požití vstřebáván do cirkulace v jejunu, ale bariéra gastrointestinálního traktu brání jeho resorpci, takže se vstřebá jen minimální množství. Při podání oktreotidu ve speciálních kapslích označovaných TPE (transient permeability enhancer; obsahují sůl mastné kyseliny o střední délce sodium kaprylát a inertní excipienty spolu s oktreotidem v olejové suspenzi) dochází k přechodnému otevření těsných mezibuněčných spojení (tight junctions) a většímu přechodu oktreotidu do cirkulace, čímž je dosaženo účinných koncentrací. Zvýšená mezibuněčná permeabilita je limitována časem (1–2 hod) a velikostí molekul. Výrazně lepší efekt byl pozorován při podání nalačno, bez inhibitorů protonové pumpy.
Proběhly již zkoušky fáze 3. Ve studii byl posuzován efekt oktreolinu (Octreolin cps), proti injekčnímu oktreotidu. U 85 % byla zachována kontrola aktivity akromegalie ve srovnání s injekčním oktreotidem podávaným v předchozí fázi zkoušení [24]. Výhodou této formy aplikace je vyloučení injekčního podání a dále by mohlo jeho podání zmírnit průlomové potíže ke konci efektu injekčního podání SMSA. Profil vedlejších účinků je obdobný jako u i. m. podání oktreotidu s výjimkou obtíží v místě vpichu.
Octreolin zatím nemohl být uveden do praxe, protože FDA v dubnu roku 2016 preparát neschválila a vyžádala provedení další studie (nová aplikační forma již byla ve FDA schválena v roce 2015). V Evropské unii je zkoušení preparátu ve fázi 3 klinických studií.
Nové preparáty
Analog somatostatinu označený DG3173, Somatoprim (Aspireo Pharm)
Tento nově vyvíjený analog somatostatinu je heptapeptid, který má vysokou afinitu k SMSR-2, SMSR-4 a SMSR-5 a farmakokinetický profil podobný oktreotidu. Je vysoce selektivní v supresi sekrece GH a vykazuje minimální inhibiční efekt na inzulin [25]. Studie in vitro ukazují na větší účinnost než oktreotid. Lepší odpověď byla pozorována in vitro u tumorů s řídkými granulacemi. Studie fáze 1 ukázala menší účinek DG3173 na sekreci inzulinu a glukagonu a na koncentrace glukózy ve srovnání s oktreotidem i při užití vyšších dávek [26]. V současnosti probíhá klinické zkoušení fáze 2 u dosud neléčených pacientů s akromegalií. V listopadu roku 2015 získal Somatoprim statut Orphan Drug pro akromegalii v Evropské unii.
Inhibitor sekrece odvozený od botulotoxinu – SXN101959
Je to rekombinantní protein tvořený chimérou domény vážící se na receptor releasing hormonu GH (GHRH) a endopeptidázové domény botulotoxinu. Váže se na GHRH receptor na somatotropních buňkách hypofýzy, je internalizován a následně štěpí proteiny, které jsou důležité pro exocytózu GH z granul buněk. In vivo u potkanů inhibuje syntézu, skladování a sekreci GH a tím snižuje i IGF-1 [27].
Antisens oligonukleotid RNA – ATL1103 (COR-004)
Antisens oligonukleotidy jsou navržené tak, aby se specificky vázaly na komplementární mRNA a snižovaly tvorbu jejího peptidového produktu. Oligonukleotid 2. generace ATL1103 obsahuje 20 nukleotidů, je namířený proti mRNA receptoru pro GH a aktivuje ribonukleázu H, která vzniklý komplex štěpí. Tím klesá tvorba receptorů pro GH v játrech a následně se snižuje tvorba IGF-1 v játrech a tím se oslabí působení ve tkáních. Účinnost potvrzuje i pozorovaný pokles vazebného proteinu GH, který tvoří extracelulární část receptoru GH.
Ve studii fáze 2 u pacientů s akromegalií při aplikaci injekcí 2krát týdně došlo k poklesu IGF-1 o 26 % (byla potvrzena závislost poklesu na dávce). Současně byl pozorován vzestup GH během studie. U více než 85 % pacientů byla pozorována mírná až střední reakce v místě vpichu. Reakce typu „flu-like“ se nevyskytly. Současné výsledky je možné brát jako potvrzení konceptu účinnosti antisens nukleotidů namířených proti receptoru GH u pacientů s akromegalií, i když zatím nelze říci, zda tato cesta představuje nějakou výhodu oproti pegvisomantu. V plánu je provedení studie s vyšším dávkováním, která by měla ukázat, zda podání vyšších dávek přinese lepší účinnost, aniž by se zhoršil bezpečnostní profil [28].
Přehled zmíněných preparátů užívaných v současnosti k léčbě akromegalie je uveden v tab.
Table 1. Přehled aktuálně užívaných i vyvíjených preparátů k léčbě akromegalie 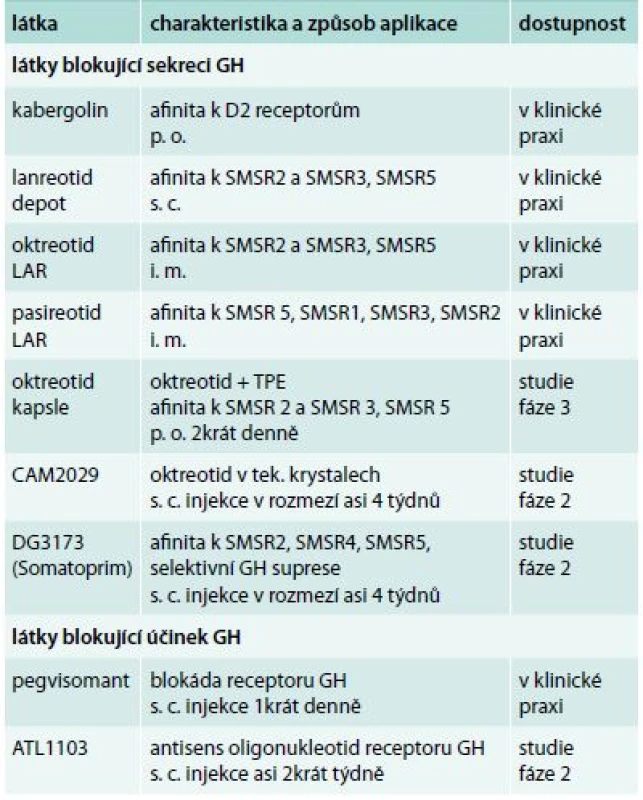
SMSR – receptor somatostatinu Závěr
Akromegalie je vzácné onemocnění, které neléčené významně zvyšuje morbiditu a mortalitu pacientů. Moderní specializovaná operační léčba, radiochirurgie, radioterapie a farmakoterapie zásadně zlepšily osud pacientů s akromegalií. Současné léčebné možnosti umožňují individuálně volit optimální postupy pro konkrétního pacienta. I když se zatím volba terapie opírá především o klinickou zkušenost, je možné předpokládat, že časem bude naše rozhodování podloženo novými molekulárně biologickými objevy. Farmaceutický průmysl připravuje nové formy podání stávajících účinných látek i koncepčně nové formy léčby.
prof. MUDr. Václav Hána, CSc.
vhana@lf1.cuni.cz
III. interní klinika 1. LF UK a VFN v Praze
www.int3.lf1.cuni.cz
Doručeno do redakce 15. 8. 2016
Přijato po recenzi 1. 9. 2016
Sources
1. Hána V, Švancara J, Bandúrová L et al. Registr selárních tumorů – RESET: diagnostika a léčba akromegalie v České a Slovenské republice v 21. století. DMEV2013; 16(4): 219–224. Dostupné z WWW: http://www.tigis.cz/images/stories/DMEV/2013/04/04_hana.pdf.
2. Rajasoorya C, Holdaway IM, Wrightson P et al. Determinants of clinical outcome and survival in acromegaly. Clin Endocrinol (Oxf) 1994; 41(1): 95–102.
3. Katznelson L, Laws jr. ER, Melmed S et al. Acromegaly: an Endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014; 99(11): 3933–3951. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–2700>.
4. Netuka D, Májovský M, Masopust V et al. Intraoperative MRI during endoscopic transsphenoidal surgery of growth hormone-secreting pituitary adenomas. World Neurosurg 2016; 91 : 490–496. Dostupné z DOI: <http://dx.doi.org/10.1016/j.wneu.2016.04.094>.
5. Petrossians P, Borges-Martins L, Espinoza C et al. Gross total resection or debulking of pituitary adenomas improves hormonal control of acromegaly by somatostatin analogs. Eur J Endocrinol 2005; 152(1): 61–66.
6. Colao A, Attanasio R, Pivonello R et al. Partial surgical removal of growth hormone-secreting pituitary tumors enhances the response to somatostatin analogs in acromegaly. J Clin Endocrinol Metab 2006; 91(1): 85–92.
7. Rowland NC, Aghi MK. Radiation treatment strategies for acromegaly. Neurosurg Focus 2010; 29(4): E12. Dostupné z DOI: <http://dx.doi.org/10.3171/2010.7.FOCUS10124>.
8. Wattson DA, Tanguturi SK, Spiegel DY et al. Outcomes of proton therapy for patients with functional pituitary adenomas. Int J Radiat Oncol Biol Phys 2014; 90(3): 532–539. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijrobp.2014.06.068>.
9. Ježková J, Marek J, Hána V et al. Gamma knife radiosurgery for acromegaly--long-term experience. Clin Endocrinol (Oxf) 2006; 64(5): 588–595.
10. Sandret L, Maison P, Chanson P. Place of cabergoline in acromegaly: a meta-analysis. J Clin Endocrinol Metab 2011; 96(5): 1327–1335. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2010–2443>.
11. Pokrajac A, Frystyk J , Flyvbjerg A et al. Pituitary-independent effect of octreotide on IGF1 generation. Eur J Endocrinol 2009; 160(4): 543–548. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0822>.
12. Murray RD, Melmed S. A critical analysis of clinically available somatostatin analog formulations for therapy of acromegaly. J Clin Endocrinol Metab 2008; 93(8): 2957–2968. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2008–0027>.
13. Giustina A, Chanson P, Kleinberg D et al. Expert consensus document: A consensus on the medical treatment of acromegaly. Nature Rev Endocrinol 2014; 10(4): 243–248. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2014.21>.
14. Mercado M, Borges F, Bouterfa H et al. A prospective, multicentre study to investigate the efficacy, safety and tolerability of octreotide LAR in the primary therapy of patients with acromegaly. Clin Endocrinol 2007; 66(6): 859–868.
15. Colao A, Bronstein MD, Freda P et al. Pasireotide versus octreotide in acromegaly: a head-to-head superiority study. J Clin Endocrinol Metab 2014; 99(3): 791–799. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–2480>.
16. Breitschaft A, Hu K, Hermosillo Reséndiz K et al. Management of hyperglycemia associated with pasireotide (SOM230): healthy volunteer study. Diabetes Res Clin Pract 2014; 103(3): 458–465. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2013.12.011>.
17. Henry RR, Ciaraldi TP, Armstrong D et al. Hyperglycemia associated with pasireotide: results from a mechanistic study in healthy volunteers. J Clin Endocrinol Metab 2013; 98(8): 3446–3453. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–1771>.
18. Van der Lely AJ, Hutson RK, Trainer PJ et al. Long-term treatment of acromegaly with pegvisomant, a growth hormone receptor antagonist. Lancet 2001; 358(9295): 1754–1759.
19. van der Lely AJ, Biller BM, Brue T et al. Long-term safety of pegvisomant in patients with acromegaly: comprehensive review of 1288 subjects in ACROSTUDY. J Clin Endocrinol Metab 2012; 97(5): 1589–1597. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–2508>.
20. Neggers SJ, Kopchick JJ, Jørgensen JO et al. Hypothesis: Extra-hepatic acromegaly: a new paradigm? Eur J Endocrinol 2011; 164(1): 11–16. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-10–0969>.
21. Melmed S. New therapeutic agents for acromegaly. Nat Rev Endocrinol 2016; 12(2): 90–98. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2015.196>.
22. Cuevas-Ramos D, Fleseriu M. Pasireotide: a novel treatment for patients with acromegaly. Drug Des Devel Ther 2016; 10 : 227–239. Dostupné z DOI: <http://dx.doi.org/10.2147/DDDT.S77999>.
23. Chieffo C, Cook D, Xiang Q et al. Efficacy and safety of an octreotide implant in the treatment of patients with acromegaly. J Clin Endocrinol Metab 2013; 98(10): 4047–4054. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–2262>.
24. Melmed S, Popovic V, Bidlingmaier M et al. Safety and efficacy of oral octreotide in acromegaly: results of a multicenter phase III trial. J Clin Endocrinol Metab 2015; 100(4): 1699–1708. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–4113>.
25. Afargan M1, Janson ET, Gelerman G et al. Novel long-acting somatostatin analog with endocrine selectivity: potent suppression of growth hormone but not of insulin. Endocrinology 2001; 142(1): 477–486.
26. Plöckinger U, Hoffmann U, Geese M et al. DG3173 (somatoprim), a unique somatostatin receptor subtypes 2-, 4 - and 5-selective analogue, effectively reduces GH secretion in human GH-secreting pituitary adenomas even in Octreotide non-responsive tumours. Eur J Endocrinol 2012; 166(2): 223–234. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-11–0737>.
27. Somm E, Bonnet N, Zizzari P et al. Comparative inhibition of the GH/IGF-I axis obtained with either the targeted secretion inhibitor SXN101959 or the somatostatin analog octreotide in growing male rats. Endocrinology 2013; 154(11): 4237–4248. Dostupné z DOI: <http://dx.doi.org/10.1210/en.2013–1427>.
28. Trainer PJ, Newell-Price J, Ayuk J et al. A Phase 2 study of antisense oligonucleotide therapy directed at the GH receptor demonstrates lowering of serum IGF‑I in patients with acromegaly. [abstract OR09‑1]. Presented at the Endocrine Society’s 97th Annual Meeting and Exposition (2015). Dostupné z DOI: <http://dx.doi.org/10.1530/endoabs.37.GP.19.10>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl 3-
All articles in this issue
- Zásobení jodem u těhotných žen v České republice
- Nádory štítné žlázy u dětí a dospívajících a jejich molekulárně genetická podstata
- Endokrinní komplikace moderní onkologické léčby
- Léčba levotyroxinem – faktory ovlivňující její úspěšnost
- Endokrinní orbitopatie – téma stále živé
- Jsou tyreoidální hormony a tyreotropin asociovány s kardiometabolickými riziky a inzulinovou rezistencí u eutyreoidních jedinců?
- Současnost a perspektivy léčby akromegalie
- Kardiorenální syndrom – biomarkery a mediátory
- TSH produkující adenomy
- Centrální poruchy funkce štítné žlázy
- Vitamín D a syndróm polycystických ovárií
- Tyreoidální hormony a kardiovaskulární systém
- Endokanabinoidný systém a kosť
-
Řešení jodového deficitu v České republice – historie a současný stav
20 let práce prof. MUDr. Václava Zamrazila v Meziresortní komisi pro řešení jodového deficitu - Psycho-imuno-endokrinologie štítné žlázy
- Karcinomy štítné žlázy – současné léčebné postupy
- Vitamin D a autoimunitní tyreopatie
- Testosteron a mortalita
- Vrozená adrenální hyperplazie v dospělosti
- Polyfarmakoterapie nahlížená nejen prizmatem multimorbidity, ale jako další geriatrický syndrom
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Priebeh ochorenia u pacientov s diferencovaným mikrokarcinómom štítnej žľazy pri použití rôznych liečebných postupov
- Projekt SPACE (Stav Pacientů Akceptovaných diabetologem Cestou Exportu)
- Zásobení jodem a jodurie obyvatel v České republice v letech 1995–2016
- Jodurie u nemocných s diabetes mellitus 1. typu Vztahy k vybraným parametrům charakterizujícím diabetický syndrom
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozená adrenální hyperplazie v dospělosti
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Vitamin D a autoimunitní tyreopatie
- Centrální poruchy funkce štítné žlázy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

