-
Medical journals
- Career
Vitamin D a aortální stenóza
Authors: K. Linhartová 1; G. Štěrbáková 2; R. Čerbák 3
Authors‘ workplace: Kardiologická klinika 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Josef Veselka, CSc. 1; I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D. 2; Centrum kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MUDr. Petr Němec, CSc. 3
Published in: Vnitř Lék 2012; 58(5): 390-392
Category: Appendix: Vitamin D
Overview
Aortální stenóza je 3. nejčastější kardiovaskulární onemocnění a nejčastěji operovaná chlopenní vada v rozvinutých zemích. Hlavním rysem patogeneze aortální stenózy je aktivní progresivní kalcifikace cípů, která omezuje jejich hybnost a způsobuje obstrukci transaortálního průtoku. Dysregulace systémového kalciumfosfátového metabolizmu spojená s nízkou hladinou vitaminu D je možným rizikovým faktorem aortální stenózy i u pacientů se zachovanou funkcí ledvin. Tato hypotéza vyžaduje další ověření v klinických studiích i experimentu.
Klíčová slova:
kalcifikace aortální chlopně – vitamin D – aortální stenózaPředneseno na odborném pracovním setkání Vitamin D (projekt OPVK CZ 1.07/2.3.00/09.0182), konaném dne 22. června 2011 v Plzni a organizovaném LF UK a FN Plzeň ve spolupráci s Českou společností klinické biochemie České lékařské společnosti J. E. Purkyně, sekcí imunoanalýzy České společnosti nukleární medicíny České lékařské společnosti J. E. Purkyně a Endokrinologickým ústavem Praha
Aortální stenóza je po ischemické chorobě srdeční a hypertenzi 3. nejčastějším kardiovaskulárním onemocněním a nejčastěji operovanou chlopenní vadou v rozvinutých zemích. Postihuje 2–3 % osob nad 65 let a prevalence tohoto onemocnění dále stoupá s věkem [1]. S prodlužováním věku v Evropě navíc narůstá i počet pacientů s touto vadou. Přitom dosud neznáme žádný způsob, jak progresi aortální stenózy ovlivnit, a jedinou možností léčby zůstává náhrada chlopně nebo implantace protézy v terminálním stadiu vady.
Patogeneze aortální stenózy je aktivní, regulovaný, a tedy potenciálně modifikovatelný děj, který probíhá ve 2 stadiích: počáteční je charakterizováno neobstrukčním ztluštěním, tzv. sklerózou aortální chlopně. Pouze asi u 2,5 % těchto pacientů přechází postižení chlopně do dalšího stadia, jimž je progresivní kalcifikace cípů, která omezuje jejich hybnost a způsobuje významnou obstrukci transaortálního průtoku [2].
V počátečním stadiu vykazují změny na aortální chlopni řadu znaků shodných s aterosklerózou, se kterou navíc sdílejí i hlavní rizikové faktory [3,4]. Proto byla jako první zvažována možnost farmakologického ovlivnění aortální stenózy statiny. Asociace statinů s pomalejší progresí vady byla nalezena v několika retrospektivních analýzách. Celkem 3 intervenční randomizované kontrolované studie však následně tento účinek statinů nepotvrdily [5–7].
Uvedená fakta poukazují na intenzivní potřebu věnovat se dále studiu rizikových faktorů aktivní kalcifikace aortální chlopně a možnostem jejího medikamentózního ovlivnění. V posledních 15 letech byla velká pozornost věnována tzv. kalcifikačnímu paradoxu, tj. nálezu inverzní asociace mezi vaskulárními kalcifikacemi a sníženou kostní denzitou nebo poruchou mineralizace kosti [8], pozorovanému zejména u osteoporózy a chronického selhání ledvin. Úsilí věnované vysvětlení tohoto paradoxu může mít zásadní význam nejen ve vztahu ke koronární nemoci, ale i k aortální stenóze, v jejíž patogenezi hraje kalcifikace dominantní roli. Jak prokázali Rajamannan et al, vývoj valvulární kalcifikace je proces příbuzný tvorbě kosti, kdy myofibroblasty ve tkáni chlopně nabývají osteoblastický fenotyp [9]. V excidovaných stenotických chlopních se v 13 % nachází zralá lamelární kost [10], oblasti enchondrální osifikace, ojediněle pletivová kost (obr. 1 a 2) a mikrofraktury kostní tkáně se známkami hojení a neoangiogeneze. Buněčnou složku tvoří kromě osteoblastů také osteoklasty a hematopoetické buňky.
Image 1. Excidovaná stenotická aortální chlopeň: hyalinní chrupavka. van Giesonovo barvení, zvětšeno 240krát. Snímek zapůjčil MUDr. O. Daum, Ph.D., Šiklův patologicko-anatomický ústav LF UK a FN Plzeň. 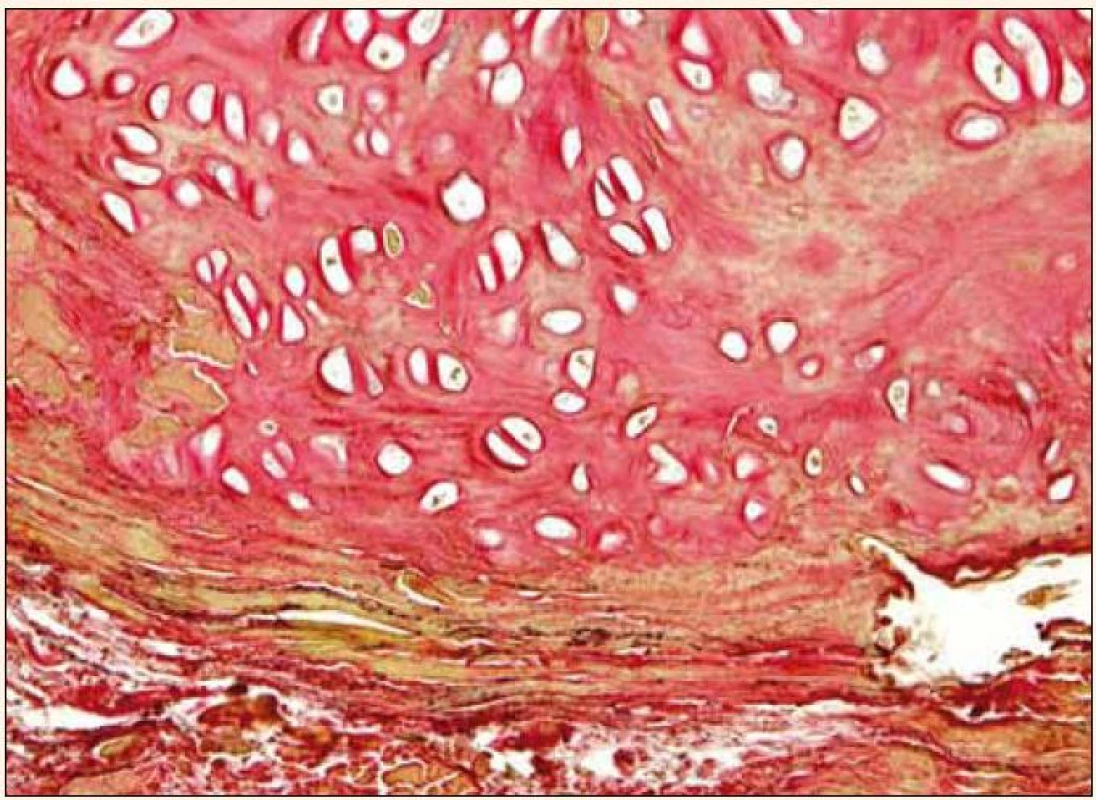
Image 2. Excidovaná stenotická aortální chlopeň: pletivová kost. Barvení hematoxylin-eozin, zvětšeno 240krát. Snímek zapůjčil MUDr. O. Daum, Ph.D., Šiklův patologicko-anatomický ústav LF UK a FN Plzeň. 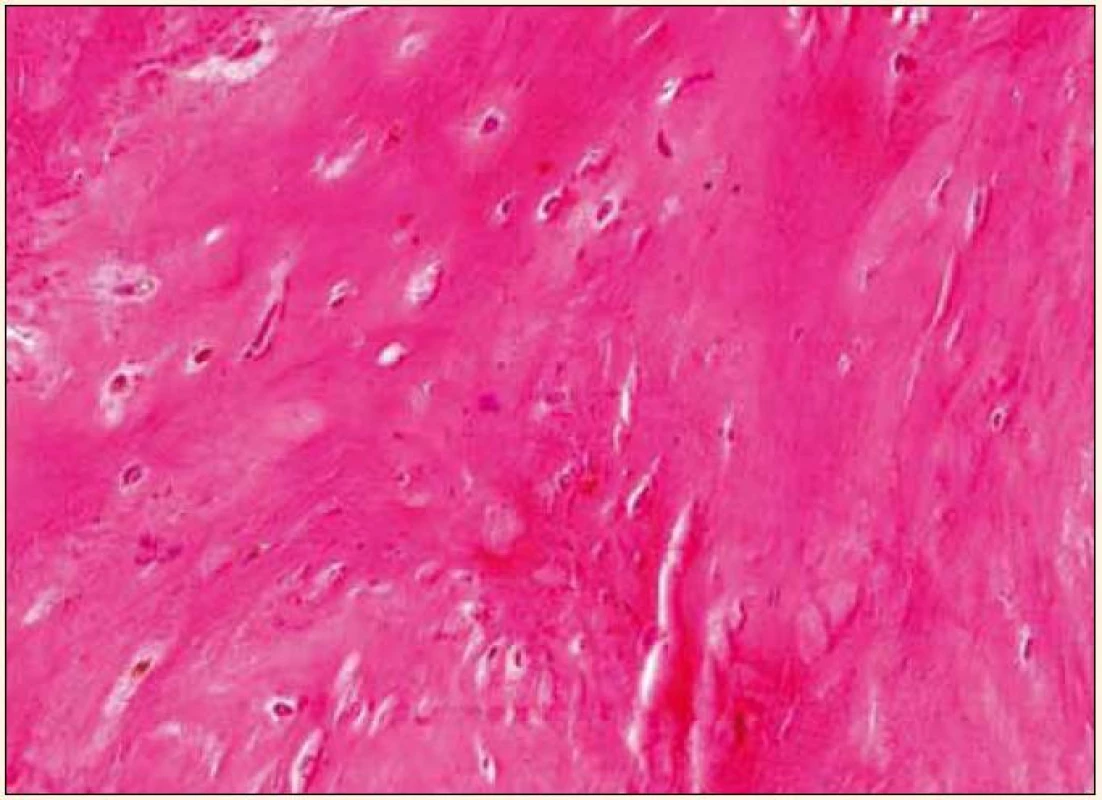
Hypoteticky lze tedy předpokládat i význam dysregulace vitaminu D a parathormonu (PTH) v patogenezi aortální stenózy a tímto tématem se zabývalo několik prací genetických i klinických. Z genetických studií jako první Ortlepp et al roku 2001 prokázali, že polymorfizmus receptorů pro vitamin D predisponuje ke vzniku aortální stenózy [11]. V německé práci Schmitze et al [12] z roku 2009 byla zjištěna statisticky významně vyšší prevalence PTH AA genotypu u pacientů s aortální stenózou, polymorfizmus genu pro receptor vitaminu D vykazoval pozitivní trend, statistická významnost prokázána nebyla.
Kardiovaskulární kalcifikace jsou dominantním rysem vysoké kardiovaskulární mortality pacientů s chronickým selháním ledvin. Kalcifikace chlopní se nacházejí u 1/2 dialyzovaných pacientů [13]. U dialyzovaných pacientů s aortálními kalcifikacemi byla zjištěna rychlejší progrese k aortální stenóze a vyšší hladina intaktního PTH (iPTH) než u dialyzovaných bez kalcifikací [14]. Nejvýznamnějším rizikovým faktorem kalcifikace u těchto pacientů je patrně hyperfosfatemie, která podporuje osteoblastickou transformaci myofibroblastů v chlopni a mohla by být spojením mezi kalcifikací chlopní a funkcí ledvin: asociace hladiny fosfátu s kalcifikacemi byla nalezena i v predialyzačním stadiu [15]. Asociace vyšších hladin fosfátu v rozmezí normálu s neobstrukční kalcifikací aortální chlopně byla prokázána i u pacientů se zachovanou funkcí ledvin v recentní průřezové analýze 1 938 účastníků Cardiovascular Health Study, což byla prospektivní populační studie starších osob (nad 65 let) [16].
V naší prospektivní průřezové analýze 223 pacientů průměrného věku 70 let se stenózou nebo sklerózou aortální chlopně na pozadí pokročilé aterosklerózy a se zachovanou funkcí ledvin jsme jako první zjistili asociaci nižší hladiny vitaminu D (25-hydroxyvitaminu D, kalcidiolu) a vyšší hladiny sérového iPTH s aortální stenózou [17]. Tato asociace zůstala významná i po adjustaci na věk, pohlaví, hladinu C-reaktivního proteinu, index tělesné hmotnosti a clearance kreatininu. Hladina vitaminu D klesá s věkem a u více než 1/2 starších Evropanů dosahuje hranic pro insuficienci (25–50 nmol/l) [18]. V naší studii mělo insuficienci nebo přímo deficienci (< 25 nmol/l) vitaminu D 59 % pacientů s aortální stenózou a 46 % pacientů s aortální sklerózou, v obou skupinách přitom korelovaly hladiny vitaminu D negativně s hladinou iPTH. Většina pacientů v obou skupinách měla hladinu iPTH v širokém rozmezí udávaných normálních hodnot. Nezjistili jsme významné rozdíly v hladině neionizovaného kalcia a hladině fosfátů, pacienti s aortální stenózou měli však statisticky významně vyšší 24hodinový odpad fosfátu do moči oproti těm s neobstrukční aortální sklerózou, což může ukazovat směrem k vyššímu obratu kalcia u pacientů s aortální stenózou. Dle očekávání jsme nezaznamenali významné ovlivnění tak vitálního parametru, jakým je hladina ionizovaného kalcia, a obě skupiny se také nelišily v hladině kalcitriolu.
Ačkoli jsme v metodice věnovali maximální pozornost faktorům, které mohly ovlivnit stanovení, jako je vliv denní doby i ročního období, musíme být v hodnocení těchto výsledků samozřejmě velmi opatrní. Průřezové stanovení iPTH a hladiny vitaminu D neumožňuje činit závěry o příčinném vztahu, trvání či stabilitě nálezu. V analýze Cardiovascular Health Study recentně [16] nebyla nalezena asociace hladiny vitaminu D ani iPTH s neobstrukční sklerózou aortální chlopně, avšak tato analýza nezahrnovala pacienty s kalcifikovanou aortální stenózou.
Námi zjištěná asociace hladiny iPTH a vitaminu D s kalcifikací aortální chlopně není jistě akutně klinicky podstatná, možný význam u natolik dlouhodobého procesu, jakým je patogeneze aortální stenózy, však nelze vyloučit.
Domníváme se proto, že hypotéza dysregulace systémového kalciumfosfátového metabolizmu a role nízké hladiny vitaminu D jako rizikového faktoru progrese aortální stenózy si zasluhují další pozornost a ověření své platnosti v prospektivní studii.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol).
doc. MUDr. Kateřina Linhartová, Ph.D.
www.fnmotol.cz
e-mail: linhartkaterina@seznam.cz
Doručeno do redakce: 30. 9. 2011
Sources
1. Stewart BF, Siscovick D, Lind BK et al. Clinical factors associated with calcific aortic valve disease. Cardiovascular Health Study. J Am Coll Cardiol 1997; 29 : 630–634.
2. Faggiano P, Antonini-Canterin F, Ehrlicher A et al. Progression of aortic valve sclerosis to aortic stenosis. Am J Cardiol 2003; 91 : 99–101.
3. Otto CM, Kuusisto I, Reichenbach DD et al. Characterization of the early lesion in „degenerative valvular aortic stenosis”: histological and immunohistochemical studies. Circulation 1994; 90 : 844–853.
4. Linhartová K, Čerbák R, Rosolová H. Aortální stenóza, skleróza a ateroskleróza. Vnitř Lék 2005; 51 : 458–461.
5. Cowell SJ, Newby DE, Prescott RJ et al. Scottish Aortic Stenosis and Lipid Lowering Trial, Impact on Regression (SALTIRE) Investigators. A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis. N Engl J Med 2005; 352 : 2389–2397.
6. Rossebø AB, Pedersen TR, Skjaerpe T et al. Design of the Simvastatin and Ezetimibe in Aortic Stenosis (SEAS) Study. Am J Cardiol 2007; 99 : 970–973.
7. Chan KL, Teo K, Dumesnil JG et al. ASTRONOMER Investigators. Effect of Lipid lowering with rosuvastatin on progression of aortic stenosis: results of the aortic stenosis progression observation: measuring effects of rosuvastatin (ASTRONOMER) trial. Circulation 2010; 121 : 306–314.
8. Persy V, D’Haese P. Vascular calcification and bone disease: the calcification paradox. Trends Mol Med 2009; 15 : 405–416.
9. Rajamannan NM, Subramaniam M, Rickard D et al. Human aortic valve calcification is associated with an osteoblast phenotype. Circulation 2003; 107 : 2181–2184.
10. Mohler ER 3rd, Gannon F, Reynolds C et al. Bone formation and inflammation in cardiac valves. Circulation 2001; 103 : 1522–1528.
11. Ortlepp JR, Hoffmann R, Ohme F et al. The vitamin D receptor genotype predisposes to the development of calcific aortic stenosis. Heart 2001; 85 : 635–638.
12. Schmitz F, Ewering S, Zerres K et al. Parathyroid hormone gene variant and calcific aortic stenosis. J Heart Valve Dis 2009; 18 : 262–267.
13. Raggi P, Boulay A, Chasan-Taber S et al. Cardiac calcification in adult hemodialysis patients. A link between end-stage renal disease and cardiovascular disease? J Am Coll Cardiol 2002; 39 : 695–701.
14. Kume T, Kawamoto T, Akasaka T et al. Rate of progression of valvular aortic stenosis in patients undergoing dialysis. J Am Soc Echocardiogr 2006; 19 : 914–918.
15. Qunibi WY, Nolan CA, Ayus JC. Cardiovascular calcification in patients with end-stage renal disease: a century old phenomenon. Kidney International 2002; 62 (Suppl 82):S73–S80.
16. Linefsky JP, O’Brien KD, Katz R et al. Association of serum phosphate levels with aortic valve sclerosis and annular calcification: the cardiovascular health study. J Am Coll Cardiol 2011; 58 : 291–297.
17. Linhartova K, Veselka J, Sterbakova G et al. Parathyroid hormone and Vitamin D levels are independently associated with calcific aortic stenosis Circ J 2008; 78 : 245–250.
18. Pal BR, Marshall T, James C et al. Distribution analysis of vitamin D highlights differences in population subgroups: preliminary observations from a pilot study in UK adults. J Endocrinol 2003; 179 : 119–129.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 5-
All articles in this issue
- Endoskopická retrográdní cholangiografie pomocí jednobalónkového enteroskopu u pacientů s Roux-Y hepatikojejunoanastomózou
- Interakce glukokortikoidů s warfarinem u chronických zánětlivých (autoimunitních) chorob
- Skórovací systémy hodnotící prognózu komunitních pneumonií
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Význam vitaminu D – nové poznatky, které svědčí o jeho úloze v medicíně
- Polymorfizmus genu pro receptor vitaminu D
- Vitamin D a riziko kardiovaskulárních chorob
- Vitamin D a aortální stenóza
- Vitamin D a neurologická onemocnění
- Endokrinní mikrosystémy kalcitriolu – vývojové aspekty a předpoklady jejich celoživotní funkčnosti
- Metabolizmus vitaminu D
- D vitamin a imunita
- Stane se vitamin D novým antidiabetikem?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolizmus vitaminu D
- Vitamin D a neurologická onemocnění
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Skórovací systémy hodnotící prognózu komunitních pneumonií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

