-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vitamin D a aortální stenóza
Vitamin D in aortic stenosis
Aortic stenosis is the third most common cardiovascular disease and the most commonly operataed valve disease in developed countries. Progressive valve calcification leading to significant flow obstruction is the main pathogenetic feature. Dysregulation of the systemic calcium-phosphate metabolism with low vitamin D level is a possible risk factor of aortic stenosis even in patients with preserved renal function. This hypothesis deserves further clinical and experimental study.
Key words:
calcification of the aortic valve – vitamin D – aortic stenosis
Autoři: K. Linhartová 1; G. Štěrbáková 2; R. Čerbák 3
Působiště autorů: Kardiologická klinika 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Josef Veselka, CSc. 1; I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D. 2; Centrum kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MUDr. Petr Němec, CSc. 3
Vyšlo v časopise: Vnitř Lék 2012; 58(5): 390-392
Kategorie: Příloha: Vitamin D
Souhrn
Aortální stenóza je 3. nejčastější kardiovaskulární onemocnění a nejčastěji operovaná chlopenní vada v rozvinutých zemích. Hlavním rysem patogeneze aortální stenózy je aktivní progresivní kalcifikace cípů, která omezuje jejich hybnost a způsobuje obstrukci transaortálního průtoku. Dysregulace systémového kalciumfosfátového metabolizmu spojená s nízkou hladinou vitaminu D je možným rizikovým faktorem aortální stenózy i u pacientů se zachovanou funkcí ledvin. Tato hypotéza vyžaduje další ověření v klinických studiích i experimentu.
Klíčová slova:
kalcifikace aortální chlopně – vitamin D – aortální stenózaPředneseno na odborném pracovním setkání Vitamin D (projekt OPVK CZ 1.07/2.3.00/09.0182), konaném dne 22. června 2011 v Plzni a organizovaném LF UK a FN Plzeň ve spolupráci s Českou společností klinické biochemie České lékařské společnosti J. E. Purkyně, sekcí imunoanalýzy České společnosti nukleární medicíny České lékařské společnosti J. E. Purkyně a Endokrinologickým ústavem Praha
Aortální stenóza je po ischemické chorobě srdeční a hypertenzi 3. nejčastějším kardiovaskulárním onemocněním a nejčastěji operovanou chlopenní vadou v rozvinutých zemích. Postihuje 2–3 % osob nad 65 let a prevalence tohoto onemocnění dále stoupá s věkem [1]. S prodlužováním věku v Evropě navíc narůstá i počet pacientů s touto vadou. Přitom dosud neznáme žádný způsob, jak progresi aortální stenózy ovlivnit, a jedinou možností léčby zůstává náhrada chlopně nebo implantace protézy v terminálním stadiu vady.
Patogeneze aortální stenózy je aktivní, regulovaný, a tedy potenciálně modifikovatelný děj, který probíhá ve 2 stadiích: počáteční je charakterizováno neobstrukčním ztluštěním, tzv. sklerózou aortální chlopně. Pouze asi u 2,5 % těchto pacientů přechází postižení chlopně do dalšího stadia, jimž je progresivní kalcifikace cípů, která omezuje jejich hybnost a způsobuje významnou obstrukci transaortálního průtoku [2].
V počátečním stadiu vykazují změny na aortální chlopni řadu znaků shodných s aterosklerózou, se kterou navíc sdílejí i hlavní rizikové faktory [3,4]. Proto byla jako první zvažována možnost farmakologického ovlivnění aortální stenózy statiny. Asociace statinů s pomalejší progresí vady byla nalezena v několika retrospektivních analýzách. Celkem 3 intervenční randomizované kontrolované studie však následně tento účinek statinů nepotvrdily [5–7].
Uvedená fakta poukazují na intenzivní potřebu věnovat se dále studiu rizikových faktorů aktivní kalcifikace aortální chlopně a možnostem jejího medikamentózního ovlivnění. V posledních 15 letech byla velká pozornost věnována tzv. kalcifikačnímu paradoxu, tj. nálezu inverzní asociace mezi vaskulárními kalcifikacemi a sníženou kostní denzitou nebo poruchou mineralizace kosti [8], pozorovanému zejména u osteoporózy a chronického selhání ledvin. Úsilí věnované vysvětlení tohoto paradoxu může mít zásadní význam nejen ve vztahu ke koronární nemoci, ale i k aortální stenóze, v jejíž patogenezi hraje kalcifikace dominantní roli. Jak prokázali Rajamannan et al, vývoj valvulární kalcifikace je proces příbuzný tvorbě kosti, kdy myofibroblasty ve tkáni chlopně nabývají osteoblastický fenotyp [9]. V excidovaných stenotických chlopních se v 13 % nachází zralá lamelární kost [10], oblasti enchondrální osifikace, ojediněle pletivová kost (obr. 1 a 2) a mikrofraktury kostní tkáně se známkami hojení a neoangiogeneze. Buněčnou složku tvoří kromě osteoblastů také osteoklasty a hematopoetické buňky.
Obr. 1. Excidovaná stenotická aortální chlopeň: hyalinní chrupavka. van Giesonovo barvení, zvětšeno 240krát. Snímek zapůjčil MUDr. O. Daum, Ph.D., Šiklův patologicko-anatomický ústav LF UK a FN Plzeň. 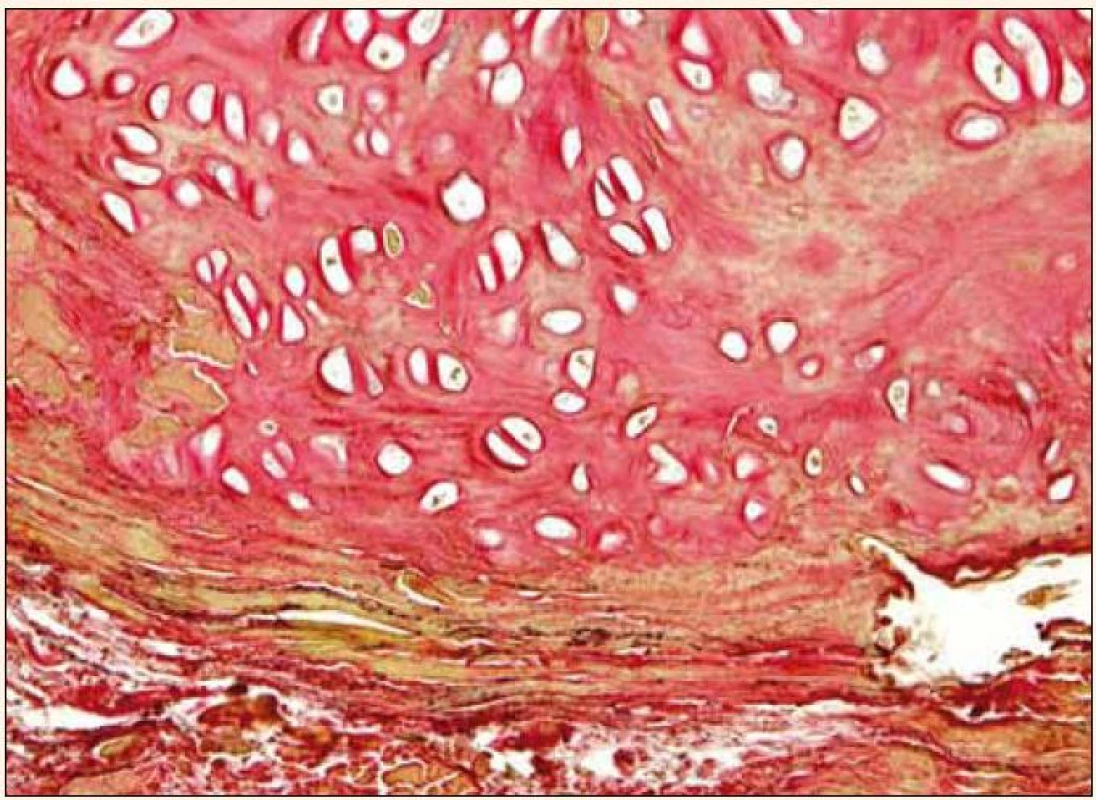
Obr. 2. Excidovaná stenotická aortální chlopeň: pletivová kost. Barvení hematoxylin-eozin, zvětšeno 240krát. Snímek zapůjčil MUDr. O. Daum, Ph.D., Šiklův patologicko-anatomický ústav LF UK a FN Plzeň. 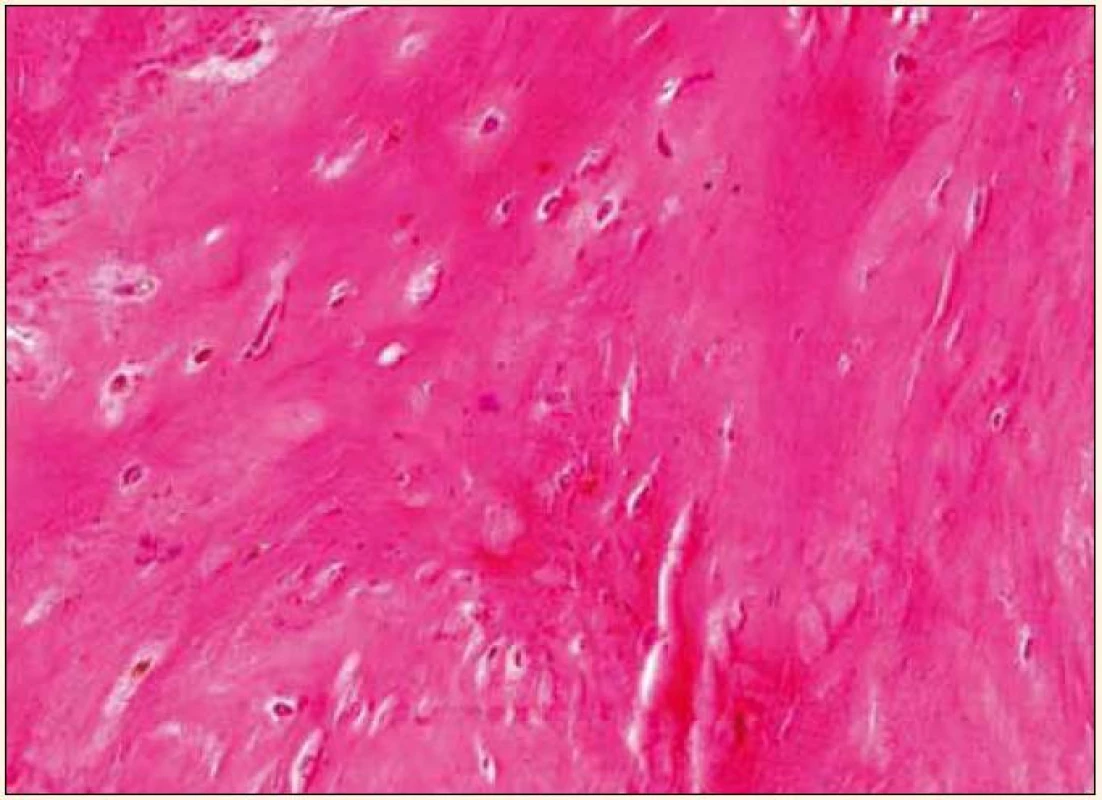
Hypoteticky lze tedy předpokládat i význam dysregulace vitaminu D a parathormonu (PTH) v patogenezi aortální stenózy a tímto tématem se zabývalo několik prací genetických i klinických. Z genetických studií jako první Ortlepp et al roku 2001 prokázali, že polymorfizmus receptorů pro vitamin D predisponuje ke vzniku aortální stenózy [11]. V německé práci Schmitze et al [12] z roku 2009 byla zjištěna statisticky významně vyšší prevalence PTH AA genotypu u pacientů s aortální stenózou, polymorfizmus genu pro receptor vitaminu D vykazoval pozitivní trend, statistická významnost prokázána nebyla.
Kardiovaskulární kalcifikace jsou dominantním rysem vysoké kardiovaskulární mortality pacientů s chronickým selháním ledvin. Kalcifikace chlopní se nacházejí u 1/2 dialyzovaných pacientů [13]. U dialyzovaných pacientů s aortálními kalcifikacemi byla zjištěna rychlejší progrese k aortální stenóze a vyšší hladina intaktního PTH (iPTH) než u dialyzovaných bez kalcifikací [14]. Nejvýznamnějším rizikovým faktorem kalcifikace u těchto pacientů je patrně hyperfosfatemie, která podporuje osteoblastickou transformaci myofibroblastů v chlopni a mohla by být spojením mezi kalcifikací chlopní a funkcí ledvin: asociace hladiny fosfátu s kalcifikacemi byla nalezena i v predialyzačním stadiu [15]. Asociace vyšších hladin fosfátu v rozmezí normálu s neobstrukční kalcifikací aortální chlopně byla prokázána i u pacientů se zachovanou funkcí ledvin v recentní průřezové analýze 1 938 účastníků Cardiovascular Health Study, což byla prospektivní populační studie starších osob (nad 65 let) [16].
V naší prospektivní průřezové analýze 223 pacientů průměrného věku 70 let se stenózou nebo sklerózou aortální chlopně na pozadí pokročilé aterosklerózy a se zachovanou funkcí ledvin jsme jako první zjistili asociaci nižší hladiny vitaminu D (25-hydroxyvitaminu D, kalcidiolu) a vyšší hladiny sérového iPTH s aortální stenózou [17]. Tato asociace zůstala významná i po adjustaci na věk, pohlaví, hladinu C-reaktivního proteinu, index tělesné hmotnosti a clearance kreatininu. Hladina vitaminu D klesá s věkem a u více než 1/2 starších Evropanů dosahuje hranic pro insuficienci (25–50 nmol/l) [18]. V naší studii mělo insuficienci nebo přímo deficienci (< 25 nmol/l) vitaminu D 59 % pacientů s aortální stenózou a 46 % pacientů s aortální sklerózou, v obou skupinách přitom korelovaly hladiny vitaminu D negativně s hladinou iPTH. Většina pacientů v obou skupinách měla hladinu iPTH v širokém rozmezí udávaných normálních hodnot. Nezjistili jsme významné rozdíly v hladině neionizovaného kalcia a hladině fosfátů, pacienti s aortální stenózou měli však statisticky významně vyšší 24hodinový odpad fosfátu do moči oproti těm s neobstrukční aortální sklerózou, což může ukazovat směrem k vyššímu obratu kalcia u pacientů s aortální stenózou. Dle očekávání jsme nezaznamenali významné ovlivnění tak vitálního parametru, jakým je hladina ionizovaného kalcia, a obě skupiny se také nelišily v hladině kalcitriolu.
Ačkoli jsme v metodice věnovali maximální pozornost faktorům, které mohly ovlivnit stanovení, jako je vliv denní doby i ročního období, musíme být v hodnocení těchto výsledků samozřejmě velmi opatrní. Průřezové stanovení iPTH a hladiny vitaminu D neumožňuje činit závěry o příčinném vztahu, trvání či stabilitě nálezu. V analýze Cardiovascular Health Study recentně [16] nebyla nalezena asociace hladiny vitaminu D ani iPTH s neobstrukční sklerózou aortální chlopně, avšak tato analýza nezahrnovala pacienty s kalcifikovanou aortální stenózou.
Námi zjištěná asociace hladiny iPTH a vitaminu D s kalcifikací aortální chlopně není jistě akutně klinicky podstatná, možný význam u natolik dlouhodobého procesu, jakým je patogeneze aortální stenózy, však nelze vyloučit.
Domníváme se proto, že hypotéza dysregulace systémového kalciumfosfátového metabolizmu a role nízké hladiny vitaminu D jako rizikového faktoru progrese aortální stenózy si zasluhují další pozornost a ověření své platnosti v prospektivní studii.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol).
doc. MUDr. Kateřina Linhartová, Ph.D.
www.fnmotol.cz
e-mail: linhartkaterina@seznam.cz
Doručeno do redakce: 30. 9. 2011
Zdroje
1. Stewart BF, Siscovick D, Lind BK et al. Clinical factors associated with calcific aortic valve disease. Cardiovascular Health Study. J Am Coll Cardiol 1997; 29 : 630–634.
2. Faggiano P, Antonini-Canterin F, Ehrlicher A et al. Progression of aortic valve sclerosis to aortic stenosis. Am J Cardiol 2003; 91 : 99–101.
3. Otto CM, Kuusisto I, Reichenbach DD et al. Characterization of the early lesion in „degenerative valvular aortic stenosis”: histological and immunohistochemical studies. Circulation 1994; 90 : 844–853.
4. Linhartová K, Čerbák R, Rosolová H. Aortální stenóza, skleróza a ateroskleróza. Vnitř Lék 2005; 51 : 458–461.
5. Cowell SJ, Newby DE, Prescott RJ et al. Scottish Aortic Stenosis and Lipid Lowering Trial, Impact on Regression (SALTIRE) Investigators. A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis. N Engl J Med 2005; 352 : 2389–2397.
6. Rossebø AB, Pedersen TR, Skjaerpe T et al. Design of the Simvastatin and Ezetimibe in Aortic Stenosis (SEAS) Study. Am J Cardiol 2007; 99 : 970–973.
7. Chan KL, Teo K, Dumesnil JG et al. ASTRONOMER Investigators. Effect of Lipid lowering with rosuvastatin on progression of aortic stenosis: results of the aortic stenosis progression observation: measuring effects of rosuvastatin (ASTRONOMER) trial. Circulation 2010; 121 : 306–314.
8. Persy V, D’Haese P. Vascular calcification and bone disease: the calcification paradox. Trends Mol Med 2009; 15 : 405–416.
9. Rajamannan NM, Subramaniam M, Rickard D et al. Human aortic valve calcification is associated with an osteoblast phenotype. Circulation 2003; 107 : 2181–2184.
10. Mohler ER 3rd, Gannon F, Reynolds C et al. Bone formation and inflammation in cardiac valves. Circulation 2001; 103 : 1522–1528.
11. Ortlepp JR, Hoffmann R, Ohme F et al. The vitamin D receptor genotype predisposes to the development of calcific aortic stenosis. Heart 2001; 85 : 635–638.
12. Schmitz F, Ewering S, Zerres K et al. Parathyroid hormone gene variant and calcific aortic stenosis. J Heart Valve Dis 2009; 18 : 262–267.
13. Raggi P, Boulay A, Chasan-Taber S et al. Cardiac calcification in adult hemodialysis patients. A link between end-stage renal disease and cardiovascular disease? J Am Coll Cardiol 2002; 39 : 695–701.
14. Kume T, Kawamoto T, Akasaka T et al. Rate of progression of valvular aortic stenosis in patients undergoing dialysis. J Am Soc Echocardiogr 2006; 19 : 914–918.
15. Qunibi WY, Nolan CA, Ayus JC. Cardiovascular calcification in patients with end-stage renal disease: a century old phenomenon. Kidney International 2002; 62 (Suppl 82):S73–S80.
16. Linefsky JP, O’Brien KD, Katz R et al. Association of serum phosphate levels with aortic valve sclerosis and annular calcification: the cardiovascular health study. J Am Coll Cardiol 2011; 58 : 291–297.
17. Linhartova K, Veselka J, Sterbakova G et al. Parathyroid hormone and Vitamin D levels are independently associated with calcific aortic stenosis Circ J 2008; 78 : 245–250.
18. Pal BR, Marshall T, James C et al. Distribution analysis of vitamin D highlights differences in population subgroups: preliminary observations from a pilot study in UK adults. J Endocrinol 2003; 179 : 119–129.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Endoskopická retrográdní cholangiografie pomocí jednobalónkového enteroskopu u pacientů s Roux-Y hepatikojejunoanastomózou – editorial
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem – editorial
- Endoskopická retrográdní cholangiografie pomocí jednobalónkového enteroskopu u pacientů s Roux-Y hepatikojejunoanastomózou
- Interakce glukokortikoidů s warfarinem u chronických zánětlivých (autoimunitních) chorob
- Skórovací systémy hodnotící prognózu komunitních pneumonií
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Význam vitaminu D – nové poznatky, které svědčí o jeho úloze v medicíně
- Polymorfizmus genu pro receptor vitaminu D
- Vitamin D a riziko kardiovaskulárních chorob
- Vitamin D a aortální stenóza
- Vitamin D a neurologická onemocnění
- Endokrinní mikrosystémy kalcitriolu – vývojové aspekty a předpoklady jejich celoživotní funkčnosti
- Metabolizmus vitaminu D
- D vitamin a imunita
- Stane se vitamin D novým antidiabetikem?
- O diabetu v Senátu Parlamentu ČR
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Metabolizmus vitaminu D
- Vitamin D a neurologická onemocnění
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Skórovací systémy hodnotící prognózu komunitních pneumonií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



