-
Medical journals
- Career
Hojení kožních afekcí u syndromu diabetické nohy při hospitalizaci
Authors: A. Jirkovská
Authors‘ workplace: Centrum diabetologie IKEM, Praha, přednostka prof. MUDr. Terezie Pelikánová, DrSc.
Published in: Vnitř Lék 2006; 52(5): 459-464
Category: Diabetes and other subjects (infection, dermatovenerology and rheumatology) Hradec Králové 3 to 4 June 2005
Overview
Pacienti se syndromem diabetické nohy jsou nejčastěji indikováni k hospitalizaci pro nehojící se ulcerace nebo gangrény v případě závažné infekce nebo kritické ischemie a v případě nutnosti rozsáhlejšího chirurgického zákroku. Syndrom diabetické nohy je nejčastější příčinou hospitalizace pacientů s diabetem, což potvrzují i naše vlastní zkušenosti. Klinicky je chronická rána charakterizována tím, že se nehojí déle než 4 týdny. Častými příčinami obtížného hojení jsou ischemie a rekurentní trauma při nedostatečném odlehčení rány; ke chronicitě vedou také prolongovaný zánět a infekce. Infekce je jednou z hlavních příčin prolongované hospitalizace pacientů. U chronické rány dochází lokálně např. k poklesu růstových faktorů a ke vzestupu tkáňových proteáz. Proces hojení rány je kaskádou vzájemně propojených reakcí zahrnujících infekční a zánětlivé faktory. Výzkum v této oblasti vedl ke koncepci vlhkého hojení ran, k použití růstových faktorů a kožních náhrad získaných bioinženýrskými technikami. Sami máme u pacientů s diabetickou nohou dobré zkušenosti s použitím kožní náhrady ve formě xenotransplantátu. Metaanalýza hodnotící lokální terapii vyzdvihuje především odlehčení pomocí kontaktní fixace, mechanické očištění rány - debridement a použití kožních náhrad - pro tyto metody existují jednoznačné důkazy o účinnosti ve studiích. Novou metodou, kterou zavádíme v léčbě diabetické nohy, je také léčba podtlakem, tzv. VAC (Vacuum Assisted Closure). Základním principem terapie pacientů se syndromem diabetické nohy za hospitalizace je její komplexnost - vynechání kterékoli součásti léčby, např. odlehčení, léčby infekce nebo ischemie, může přispět k selhání celé terapie.
Klíčová slova:
syndrom diabetické nohy - léčba chronické rány - infekceÚvod
Pacienti se syndromem diabetické nohy jsou nejčastěji indikováni k hospitalizaci pro nehojící se ulcerace nebo gangrény v případě závažné infekce nebo kritické ischemie a v případě nutnosti rozsáhlejšího chirurgického zákroku. Ze zkušeností s léčbou pacientů se syndromem diabetické nohy vyplývá, že ulcerace často přecházejí do chronicity, protože je narušen normální proces hojení ran. Ke klinické charakteristice chronické rány patří:
- rána se nehojí déle než 4 týdny
- častá je ischemie nebo rekurentní trauma při nedostatečném odlehčení rány
- ke chronicitě vede prolongovaný zánět a infekce
- lokálně dochází např. k poklesu růstových faktorů a vzestupu tkáňových proteáz.
Infekce u syndromu diabetické nohy
Infekce diabetických ulcerací je nejčastějším důvodem pro hospitalizaci pacientů se syndromem diabetické nohy a v mnoha případech je i hlavní příčinou amputací [1]. K infekci ohrožující končetinu a vyžadující nutně antibiotickou léčbu [2,3,4] patří hlubší ulcerace přesahující plantární fascii (tj. ulcerace stupně Wagner 3). Parciální gangréna (tj. stupeň Wagner 4) je ve většině případů rovněž infikována. Antibiotickou léčbu považujeme za nevyhnutelnou zejména v perioperačním období či v období kolem revaskularizačních zákroků. Rozhodnutí, ve kterých případech a jak dlouho léčit infekci u pacienta se syndromem diabetické nohy, je v některých případech obtížné a vyžaduje zkušenosti [5].
Infekce ohrožující končetinu je charakterizována rozsáhlejší flegmónou, hlubší ulcerací (Wagner 3 nebo 4, 5) s přítomností osteomyelitidy, abscesu, tendinitidy, artritidy případně s nekrotizující fasciitidou. Faktory vztahující se ke špatné spolupráci pacienta s léčbou nebo ke špatné kompenzaci diabetu, opakované infekce s rezistencí na antibiotika či imunosuprese mohou zhoršovat prognózu i méně závažných lokálních infekcí. Infekce ohrožující končetinu vyžaduje okamžitou hospitalizaci pacienta.
Infikovaná diabetická noha je indikovaná k hospitalizaci v následujících situacích:
- závažnější infekce lokální:
- flegmóna přesahující 2 cm
- absces, tendinitis, artritis, nekrotizující fasciitis
- vlhká gangréna
- osteomyelitis
- celkové projevy infekce (teplota, zánětlivé markery - CRP, hyperglykemie)
- obtížná ambulantní antibiotická (ATB) léčba - alergie na ATB, nesnášenlivost perorálních ATB, necitlivost na p.o. ATB
- nonkompliance pacienta s léčbou - užívání léků, lokální terapie, odlehčení
- kritická ischemie končetiny, nutnost chirurgického zásahu
Patofyziologie hojení ran
Hojení ran je proces odpovědi tkáně na poranění a obnovy tkáně [6]. Jedná se o komplex biologických procesů zahrnujících chemotaxi, buněčnou reprodukci a obnovu mezibuněčné tkáně, proces neovaskularizace a remodelaci jizvy. Mnohé z těchto procesů nejsou dostatečně objasněny. Základní tři fáze hojení ran - zánětlivé stadium, granulační stadium s fibroplazií a stadium maturace s reepitelizací a remodelací - jsou kontrolovány především růstovými faktory [7]. Růstové faktory mohou zásadně ovlivnit hojení ran a spolu s genovou terapií jsou předmětem intenzivního výzkumu. V časném zánětlivém stadiu (stadiu koagulace) dochází po poranění k vazokonstrikci a k přechodnému uzavření rány trombem. Trombocyty jsou po poranění aktivovány kontaktem s kolagenem v subendoteliálních cévních vrstvách a zahajují koagulaci. Lokální vazokonstrikce je podmíněna zejména serotoninem a tromboxanem, vazodilatace umožňující zvýšení cévní permeability a přechod dalších krevních elementů do místa poranění je iniciována histaminem. V další fázi zánětlivého stadia působí zánětlivé chemoatraktanty na neutrofily, které především fagocytují bakterie (produkují volné kyslíkové radikály a lyzozomální enzymy). Neutrofily však nejsou považovány za nejdůležitější buněčné elementy v hojení ran, mnohem důležitější role přísluší monocytům-makrofágům. V pozdější fázi zánětlivého stadia jsou neutrofily odstraňovány tkáňovými makrofágy. Monocyty se přeměňují v zánětlivém ložisku na makrofágy a přibližně třetí den po poranění přebírají hlavní roli v procesu hojení. Makrofágy fagocytují bakterie a poškozenou tkáň v ráně (debris). Makrofágy regulují produkci růstových faktorů (např. platelet-derived growth factor - PDGF, tumor necrosis factor - TNF, transforming growth factor-β - TGF β). Postupně dochází k aktivaci fibroblastů, endotelií, lymfocytů a keratinocytů a zánětlivé stadium přechází postupně do granulačního stadia. V granulačním stadiu začínajícím asi pátý den po poranění dochází k aktivaci keratinocytů, fibroplazii a angiogenezi. Fibroblasty produkují extracelulární matrix složenou z glykosaminoglykanů a proteoglykanů (strukturálních proteinů kolagenu a elastinu a proteinů kontrolujících buněčnou adhezi, jako jsou fibronektin a laminin). Angiogeneze je proces vedoucí k obnovení krevního zásobení rány. Fibronektin tvoří síť, po níž se mohou pohybovat fibroblasty, a je také podstatný pro aktivaci angiogeneze a epitelizace. Vlastní angiogeneze je nastartována fibroblastovým růstovým faktorem (FGF). Endoteliální buňky proliferují a migrují v ráně. Hypoxie stimuluje angiogenezi, paralelně produkují endotelie cytokiny. Granulocyty i makrofágy produkují rovněž cytokiny a proteázy, které degradují poškozenou tkáň v ráně. Maturační stadium začíná reepitelizací tak, že keratinocyty migrují z okrajů rány podél kolagenních a fibronektinových vláken již během zánětlivého a granulačního stadia. Maturace a remodelace jizvy probíhá během měsíců a hlavní roli mají hyaluronidázy, kolagenázy a elastázy. Hyaluronát tvořící provizorní matrix v granulační tkáni je nahrazen dermatansulfátem a chondroitinsulfátem.
Znalostí o procesu hojení ran se využívá nejen při studiu poruch jednotlivých procesů u pacientů se syndromem diabetické nohy, ale především ke zlepšení terapie. Prosadila se koncepce, že lokální terapie tvořící vlhké prostředí, urychluje hojení. Vlhké prostředí může podporovat viabilitu buněk a umožňovat jim modulaci, proliferaci a produkci cytokinů. Je-li akutní rána překryta okluzivním obvazem, stoupá uvolňování proteolytických enzymů včetně kolagenáz (matrix degradujících metaloproteináz) urychlujících autolytický debridement a potencující migraci keratinocytů z okrajů rány vedoucí k reepitelizaci. Sekret z rány pod okluzivním obvazem stimuluje in vitro fibroblasty i endotelie [8]. Hojení akutních ran u pacientů s diabetem může být komplikováno infekcí. Hojení chronických ran ve vlhkém prostředí okluzivního krytí je u pacientů s diabetem také problematičtější. Sekret z chronické rány se liší od sekretu z rány akutní a může mít naopak inhibiční vliv na buněčnou proliferaci [9]. Hlavní obavy z okluzivního krytí u chronických diabetických ulcerací jsou podmíněny možností šíření infekce. Výsledky studií jsou v tomto ohledu velmi rozporuplné a větší naděje se vkládají v oblasti lokální terapie především do použití růstových faktorů a kožních náhrad získaných technikami biologického inženýrství, především kultivací autologních fibroblastů a keratinocytů [10].
Aktivace hojení chronických ran
Aktivace hojení chronické rány představuje vytvoření optimálního prostředí v ráně a v jejím okolí. Klasickými technikami jsou čištění rány pomocí debridementu, revaskularizace, zmenšení edému, odlehčení rány a terapie infekce.
Aktivace hojení chronické rány pomocí lokálního čištění - debridementu patří k těm, pro něž existují jednoznačné důkazy o účinnosti ve studiích [11].
Rozeznáváme následující způsoby debridementu [6]:
- chirurgický neboli ostrý až ulcerektomie, mění biologii chronické rány na akutní
- autolytický - potencuje vlastní enzymy pomocí vlhkého prostředí
- pomocí topických antiseptik - chlorhexidin, jód, slabé kyseliny, preparáty Ag a Cu. Cl a peroxid mohou mít toxický efekt na hojení
- topická antibiotika
- enzymatický - kolagenázy, kolagen, streptokináza
- mechanický - vlhká gáza, která se nechá přischnout, irigace za vysokého tlaku, hydroterapie, ultrazvukové techniky
- biologický - sterilní larvy, překrytí hydrokoloidy; vhodné i pro suché gangrény.
Jedním z novějších způsobů biologického debridementu je larvální lokální léčba rány [12]. „Maggot therapy“ (larvy specielního druhu mouchy Lucilia sericata) se uplatňuje při čištění nekrotických ran s hojným sekretem. Larvy se aplikují přímo do rány asi na 4 dny a překrývají specielním krytím. Larvy čistí pouze devitalizovanou tkáň, neporušují zdravou tkáň a granulace. Mechanizmem účinku larvální terapie je především enzymatické zkapalnění nekrotické tkáně a strávení patogenních organizmů. Pohybem larev se stimuluje produkce serózního exsudátu, který odplavuje bakterie, a tvorba granulační tkáně. Alkalizace rány zlepšuje terapeutický efekt. Hlavní indikací larvální léčby jsou nekrotické infikované rány - např. syndrom diabetické nohy, bércové vředy, dekubity, popáleniny. Kontraindikací jsou rány komunikující s tělními dutinami nebo orgány, rány v blízkostí velkých cév a zvýšené riziko krvácení. K nežádoucím účinkům patří nepříjemné vnímání pohybu larev až bolest v ráně, vzácně alergie či krvácení z rány. Armstrong et al [13] zjistili, že larvální terapie vedla k signifikantně kratšímu hojení diabetické nohy (18 vs 22 týdnů), ke 3krát menší potřebě amputací a ke kratší době antibiotické terapie (86 vs 126 dní v kontrolní skupině).
Dalším problémem hojení chronických ran je ischemie a hypoxie. Ischemie limituje hojení - revaskularizace je proto pro hojení chronických ran klíčová. Je prokázána korelace mezi transkutánní tenzí kyslíku a hojením rány [14,15]. Paradoxně může ale nízká tenze kyslíku stimulovat proliferaci fibroblastů a syntézu růstových faktorů [16]. Hyperbarická komora (HBO) může stimulovat hojení pomocí růstových faktorů (VEGF), avšak důkazy nejsou dostatečné. Selhává-li hojení chronické rány, je možné zkusit léčbu HBO nebo prostaglandiny, zejména u hlubokých ischemických ran [11].
Hojení chronické rány je nepříznivě ovlivněno také edémem a hydratací rány [6]. Cílem je zmenšit edém při udržení dostatečné hydratace rány, protože edém potencuje infekci a intersticiální tekutina z chronické rány blokuje buněčnou proliferaci a angiogenezi. Edém lze zmenšit negativním tlakem nebo kompresí. Obvazy mají mít dostatečnou absorpční kapacitu pro intersticiální tekutinu nebo mají být často měněny.
Ke klasickým způsobům aktivace hojení syndromu diabetické nohy patří odlehčení ulcerací, pro které rovněž existují jednoznačné důkazy o účinnosti ve studiích [11]. Poměrně recentně byla publikována práce, která prokázala vliv terapie kontaktní sádrovou fixací (TCC) na histopatologické změny u neuropatické ulcerace [17]. Po 20 dnech léčby ulcerací bez známek ischemie a infekce pomocí TCC došlo ve srovnání se skupinou neléčenou odlehčením pomocí TCC ke snížení histologických známek zánětu a k akceleraci reparativního procesu. Semikvantitativní analýza prokázala histologické známky hyperkeratózy, fibrózy, zánětu a buněčného detritu ve skupině s ulcerací bez odlehčení a novotvorbu adnex, kapilár a granulační tkáně u skupiny léčené odlehčením TCC.
Mechanizmus účinku lokálních prostředků užívaných k terapii chronických ran
Optimální fyzikální a chemické vlastnosti nejsou jasné a zatím není jednoznačné, které krytí je optimální. Zlatým standardem zůstává odlehčení rány a mechanické čištění - debridement.
Nové dělení lokálních prostředků [6]:
- filmy (povrchové ulcerace, kožní náhrady)
- pěny (absorpční vlastnosti, mechanická ochrana)
- hydrogely (90 % voda + polymery, debridement)
- hydrokoloidy (podpora hojení, ale i riziko infekce)
- algináty (vlastnosti podle obsahu Ca a Na alginátu, absorbují exsudát, mají hemostatický efekt; degradují se, ale někdy vyschnou a brání drenáži)
- hydrofibres (modulují vlhkost rány a faktory hojení).
Nové techniky jsou zaměřeny na biologii rány a zahrnují použití růstových faktorů, dermálních a epidermálních štěpů a perspektivně i kmenové buňky.
Modulaci abnormální biologie rány mohou ovlivňovat následující moderní způsoby lokální léčby [19,20,21,22,23]:
- růstové faktory - např. PDGF
- matrix replacement - kyselina hyaluronová - může stimulovat fibroblasty a tvorbu ECT; podobný efekt - lyofilizovaný kolagen
- modulace enzymů - inhibitor MMP (např.Promogran)
- kmenové buňky - pluripotentní (z kostní dřeně), které se mohou diferencovat na fibroblasty, endoteliální buňky a keratinocyty
- genová terapie - např. plazmid DNA s genem pro VEGF
- nadějné se zdají být především Bi-layered bioengineered skin substitues (BBSS).
Porucha hojení rány může být ovlivněna sníženou expresí růstových faktorů nebo jejich zvýšenou proteázovou destrukcí. Mezi významné endogenní růstové faktory při hojení ran patří PDGF, FGF, TGF β, EGF apod. K novým technologiím [6] patří např. Platelet Relesate (PR) a CT-102 (aktivovaný destičkový supernatant, obsahující řadu růstových faktorů).
Autologní in vitro kultivované kožní transplantáty jsou připraveny z pacientových fibroblastů, které se kultivují in vitro v trojrozměrné matrix - biomateriálu z hyaluronové kyseliny. Aplikace kožního transplantátu z autologních keratinocytů kultivovaných in vitro na laserem mikroperforované membráně většinou navazuje na terapii předchozí.
V naší podiatrické praxi zatím zkušenosti s těmito preparáty nemáme. Poměrně často používáme xenotransplantáty z vepřové kůže, které mají velmi dobrý efekt na podporu granulací a epitelizaci (obr. 1). Je nutné je aplikovat na ránu, která nejeví známky akutní infekce - především nedochází k hnisavé sekreci ani není okolní výraznější flegmóna či edém. Kultivační nález není rozhodující, pokud je ale v ráně jasný patogen, je nutné celou terapii xenotransplantátem zajistit i adekvátní léčbou antibiotiky. Podobně je nutné zajistit, aby xenotransplantát byl trvale odlehčen, tj. pacient nesmí na ránu šlápnout ani na ni nesmí nic tlačit. Nejčastěji to znamená vybavit pacienta pojízdným křeslem nebo alespoň terapeutickou obuví a podpažními berlemi. Výměny xenotransplantátu provádíme v průměru po 3-10 dnech, jeho aplikace musí být provedena odborně a velmi pečlivě tak, aby tvar mírně překrýval obrysy rány a aby nedošlo k další infekci rány. Xenotransplantát musí být trvale zvlhčován nejčastěji iontovými roztoky.
Image 1. Vlastní zkušenosti s léčbou xenotransplantátem. 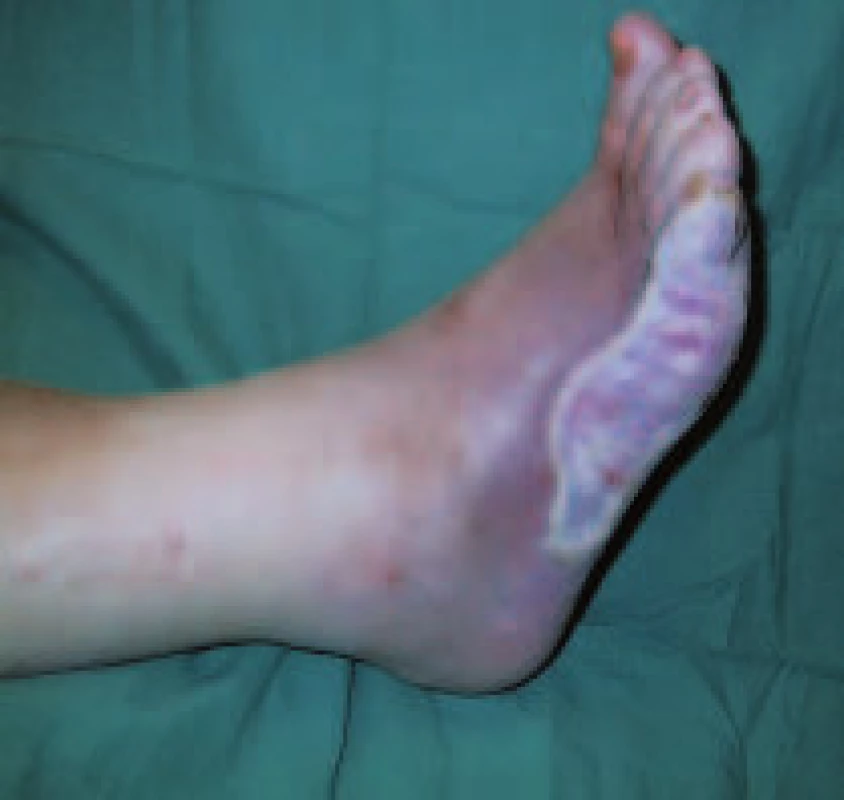
V.A.C. (Vacuum Assisted Closure) terapie - nová léčba urychlující hojení ran
V.A.C. zlepšuje hojení ran lokální aplikací podtlaku [24,25]. V.A.C. lokální podtlak se aplikuje na ránu, na lalokovou plastiku či tranplantát (obr. 2). Distribuce podtlaku napomáhá sekreci tekutiny z rány a stimuluje růst granulační tkáně i adhezi laloků či štěpů.
Image 2. VAC (Vacuum Assisted Closure) – léčba ran řízeným podtlakem. 
Indikace k této léčbě:
- chronické otevřené rány (venostatické ulcerace, diabetické ulcerace, tlakové ulcerace - dekubity a ischemické ulcerace)
- akutní a traumatická poranění
- subakutní rány (např. pooperační dehiscence)
- štěpy a lalokové plastiky.
Kontraindikace k této léčbě:
- píštěle do tělních dutin nebo orgánů
- nekrotické tkáně a eschary (před debridementem)
- neléčená osteomyelitis
- malignita v ráně.
Opatrnosti je třeba při riziku krvácení, např. u pacientů na antikoagulanciích a při obtížném stavění krvácení z rány.
Terapie V.A.C. se má používat alespoň po dobu 22 z 24 hodin. Součástí je léčby je u diabetických ulcerací komplexní terapie (odlehčení, léčba infekce, kompenzace DM, výživa apod). Nutný je důkladný debridement rány a případně agresivní léčba osteomyelitidy. Rána musí být obklopena dostatečným množstvím tkáně (alespoň 2 cm) tak, aby bylo zajištěno vakuum. Dále musí být rána dostatečně otevřená, aby byla zajištěna drenáž. Zpočátku může rána zrudnout, postupně se ale hojí. Výsledky V.A.C. terapie u syndromu diabetické nohy ve studii Armstronga et al [24] prokázaly, že:
- doba aplikace V.A.C. terapie byla v průměru 4,7 týdnů, a to až do pokrytí celé rány granulační tkání bez viditelných šlach, kloubních pouzder či kostí
- doba hojení byla individuální, v průměru 8 týdnů
- komplikacemi při hojení ran byly macerace okolí rány v 19 %, flegmóna ve 3,2 % a hluboká infekce ve 3,2 %
- 90,3 % ran se po V.A.C. zhojilo, i když před touto terapií byla průměrná doba léčby 25 týdnů
- 9,7 % ran vyžadovalo amputaci.
Vlastní zkušenosti s terapií V.A.C. v IKEM máme dosud omezené. Indikováno bylo 6 pacientů, průměrná doba terapie byla 16 dní. Došlo ke zmenšení plochy ulcerací o 17 %, a ke zlepšení granulací. Jeden pacient přerušil léčbu pro progresi infekce, u dalšího ustoupily nepříjemné parestezie v končetinách po úpravě parametrů podtlaku.
Závěrem můžeme shrnout, že syndrom diabetické nohy je třeba léčit vždy komplexně, opomenutí kterékoli součásti léčby má za následek zpomalení hojení nebo zhoršení ulcerace a zbytečné amputace. Zejména zdůrazňujeme dvě nezbytné součásti komplexní léčby, které se v praxi nejčastěji opomíjejí: odlehčení ulcerací a účinnou dostatečně dlouhodobou antibiotickou léčbu. Nezbytné je také vždy při podezření na cévní etiologii se pokusit o revaskularizaci. Dostatečné důkazy účinnosti lokální terapie na hojení syndromu diabetické nohy ve studiích existují pro debridement, v poslední době i biologický, a odlehčení kontaktní fixací. Mezi nadějné způsoby lokální léčby patří zejména náhradní kůže získané bioinženýrskými technikami (tab. 1). Vlastní dobré zkušenosti máme s hojením ran pomocí lokální aplikace podtlaku V.A.C. a pomocí xenotransplantátů.
Table 1. Metaanalýza publikovaných randomizovaných klinických studií zaměřených na účinnost lokálních prostředků hojení ran (upraveno dle 11). 
Práce byla podpořena výzkumným záměrem MZO 00023001.
doc. MUDr.Alexandra Jirkovská, CSc.
www.ikem.cz
e-mail: alexandra.jirkovska@medicon.cz
Doručeno do redakce: 3. 6. 2005
Přijato k otištění: 3. 6. 2005
Sources
1. Eneroth M, Larsson J, Apelqvist J. Deep foot infections in patients with diabetes and foot ulcer: an entity with different characteristics, treatments, and prognosis. J Diab Comp 1999; 13 : 254-263.
2. Caputo G, Cavanagh PR, Ulbrecht JS et al. Assessment and management of foot disease in patients with diabetes. N Engl J Med 1994; 331 : 854-860.
3. Caputo GM. The rationale use of antimicrobial agents in diabetic foot infection.. In: Boulton AJM, Connor H, Cavanagh PR (eds). The foot in diabetes. Chichester: John Wiley and sons, LTD 2000 : 143-151.
4. Mason J, Keeffet CO, Hutchinson A et al. A systematic review of foot ulcer in patients with type 2 diabetes mellitus. II: Treatment. Diabet Med 1999; 16 : 889-909.
5. Chantelau E, Tanudjaja T, Altenhofer F et al. Antibiotic treatment for uncomplicated forefoot ulcers in diabetes: a controlled trial. Diabet Med 1996; 13 : 156-159.
6. Jeffcoat WJ, Price P, Harding KG. Wound healing and treatments for people with diabetic foot ulcers. Diabetes Metab Res Rev 2004; 20(Suppl 1): S78-S89.
7. Steed DL. Role of growth factors in the treatment of diabetic foot ulceration. In: Veves A, Giurini JM, LoGerfo FW (eds). The diabetic foot. Totowa: Human Press 2002 : 385-395.
8. Katz MH, Alvarez AF, Kirsner RS et al. Human wound fluid from acute wounds stimulates fibroblasts and endotelial cell growth. J Am Acad dermatol 1991; 25 : 1054-1058.
9. Bucalo B, Eaglstein WH, Falanga V. Inhibition of cell proliferation by chronic wound fluid. Wound Rep Regen 1993; 1 : 181-186.
10. Grey JE, Jones V, Harding KG. Principles of treatment of chronic wound. In: Veves A, Giurini JM, LoGerfo FW (eds). The diabetic foot. Totowa: Human Press 2002 : 247 - 278.
11. Eldor R, Raz I, Ben Yehudat A et al. New and experimental approaches to treatment of diabetic foot ulcers: a comprehensive review of emerging treatment strategies. Diabet Med 2004; 21 : 1161-1173.
12. Courtney M. The use of larval therapy in wound management in the UK. J Wound Care 1999; 8 : 177-179.
13. Armstrong DG, Salas P, Short B et al. Maggot therapy in „lower - extremity hospice“ wound care: fewer amputations and more antibiotic-free days. J Am Podiatr Med Assoc 2005; 95 : 254-257.
14. Kalani M, Brismar K, Fagrell B et al. Transcutaneous oxygen tension and toe blood pressure as predictors for outcome of diabetic foot ulcers. Diabetes Care 1999; 22 : 147-151.
15. Fife CE, Buyukcakir C, Otto GH et al. The predictive value of transcutaneous oxygen tension measurement in diabetic lower extremity ulcers treated with hyperbaric oxygen therapy: a retrospecitve analysis of 1 144 patients. Wound Repair Regen 2002; 10 : 198-207.
16. Falanga V, Oian SV, Danielpour D et al. Hypoxia upregulates synthesis of TGF β 1 by human fibroblasts. J Invest Dermatol 1991; 97 : 634-637.
17. Jirkovská A. Aktuální problematika syndromu diabetické nohy. In: Perušičová J (ed). Trendy soudobé diabetologie. Praha: Galén 2001 : 51-87.
18. Piaggesi A, Viacava P, Rizzo L et al. Semiquantitative analysis of the histopathological features of the neuropathic foot ulcers. Diabetes Care 2003; 26 : 3123-3128.
19. Steed DL. Clinical evaluation of recombinant human platelet-derived growth factor for the treatment of lower extremity diabetic ulcers. The diabetic ulcer study group. J Vasc Surg 1995; 21 : 71-78.
20. Smiell JM, Wieman TJ, Steed DL et al. Efficacy and safety of becaplermin (recombinant human platelet-derived growth factor BB) in patients with nonhealing, lower extremity diabetic ulcers: a combined analysis of four randomized studies. Wound repair regen 1999; 7 : 335-346.
21. Veves A, Sheehan P, Pham HT. A randomized, controlled trial of Promogran (a collagen/oxidized regenerated cellulose dressing) vs standard treatment in the management of diabetic foot ulcers. Arch Surg 2002; 137 : 822-827.
22. Badiavas EV, Falanga V. Treatment of chronic wounds with bone-marrow derived cells. Arch Dermatol 2003; 139 : 510-516.
23. Falanga V, Isaacs C, Paquette D et al. Wounding of bioengineered skin: cellular and molecular aspects after injury. J Invest Dermatol 2002; 119 : 653-660.
24. Armstrong DG, Lavery LA, Abu-Rumman P et al. Outcomes of sub-athmospheric pressure dressing therapy on wounds of the diabetic foot. Ostotomy Wound management 2002; 48 : 64-68.
25. Armstrong DG, Boulton AJM, Banwell PE. Topical negative pressure: management of complex diabetic foot wounds. Oxford: The Oxford Wound Healing Society 2004.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 5-
All articles in this issue
- Nemocniční nákazy a diabetes
- Diabetes mellitus a imunizace
- Úloha diabetologa při infekčním onemocnění diabetika
- Patogeneze postižení pojivové tkáně při diabetes mellitus
- Metabolické jaderné receptory PPAR a kůže
- Kožní změny při diabetu z pohledu dermatologa
- Hojení kožních afekcí u syndromu diabetické nohy při hospitalizaci
- Infekce a syndrom diabetické nohy v terénní praxi
- Komplex hyaluronanu a jodu - Hyiodine® - nová metoda při terapii diabetických defektů
- Uroinfekce u diabetiků
- Respirační infekce a terapie inhalačním inzulinem
- Metabolizmus glukózy a účinky inzulinu v sepsi
- Kožní projevy hyperlipidemie u diabetiků z pohledu internisty
- Mykózy a diabetes
- Kožní komplikace terapie diabetes mellitus
- Difuzní idiopatická skeletální hyperostóza a souvislost s metabolickými parametry
- Revmatologické manifestace při diabetes mellitus
- Metabolické kostní choroby a diabetes
- Dna a diabetes
- Glukokortikoidy a diabetes mellitus
- Anagrelid v léčbě esenciální trombocytemie a dalších myeloproliferací s trombocytemií sledovaných v registru pacientů v ČR
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kožní změny při diabetu z pohledu dermatologa
- Glukokortikoidy a diabetes mellitus
- Difuzní idiopatická skeletální hyperostóza a souvislost s metabolickými parametry
- Kožní komplikace terapie diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



