-
Medical journals
- Career
Endoskopická extraperitoneální radikální prostatektomie a její komplikace – vlastní zkušenosti z prvních 300 operací
Authors: Květoslav Novák 1; Petr Macek 1; Michael Vraný 2; Michael Pešl 1; Zuzana Vaľová 1; Jan Dvořáček 1; Tomáš Hanuš 1
Authors‘ workplace: Urologická klinika 1. LF UK a VFN, Praha 1; Chirurgické oddělení Nemocnice Jablonec nad Nisou 2
Published in: Ces Urol 2014; 18(2): 119-127
Category: Original article
Overview
Cíl:
Zhodnocení dat vlastní skupiny pacientů s karcinomem prostaty (KP) léčených chirurgicky endoskopickou extraperitoneální radikální prostatektomií (EERP) a jejích komplikací.Materiál a metoda:
Operaci jsme prováděli výhradně z extraperitoneálního přístupu antegrádně. Bylo porovnáno pět chronologicky řazených skupin pacientů (A-36, B-34, C-70, D-77, E-83).Výsledky:
Od 2/2008 do 6/2013 jsme provedli 300 EERP u pacientů s BMI do 45, věku 48–77 (ø 64) let, s PSA 0,71–34,9 (ø 8,1) ng/ml. Hmotnost prostaty byla 15–185 (ø 56) g. Průměrná doba trvání operace v jednotlivých skupinách byla: A – 265 min, B – 220 min, C – 200 min, D – 142 min, E – 129 min, krevní ztráta > 1000 ml byla v A 19 (53 %) pacientů, v B u šesti (18 %), v C u tří (4 %), v D u šesti (8 %) a v E u dvou (3 %), transfuze krve byla nutná jen u devíti (3 %) pacientů. Žádný výkon nebyl konvertován na otevřený, chirurgická revize týž den byla indikována u dvou (0,7 %). K poranění rekta došlo u šesti (2 %) pacientů – peroperačně rozpoznané s okamžitou suturou u čtyř (všichni zhojeni), u dalších dvou se vyvinula vezikorektální píštěl později (oba zhojeni po odložené rekonstrukci). Níže jsou publikovány další významné komplikace.Závěr:
EERP je minimálně invazivní chirurgický výkon indikovaný u pacientů s lokalizovaným KP. Peroperační data se příznivě mění s rostoucím počtem provedených operací. Frekvence závažných komplikací je nízká.Klíčová slova:
endoskopická extraperitoneální radikální prostatektomie, komplikace.ÚVOD
Chirurgickou léčbou karcinomu prostaty (KP) je radikální prostatektomie (RP). Indikováni jsou muži s lokalizovaným KP, s očekávanou délkou života (life expectancy) nad 10 let. Cílem je eradikovat nádorové onemocnění při zachování kontinence moče a erekce (1). Standardní operační postup při retropubické RP (RRP) popsal Walsh poprvé v roce 1979 s ohledem na anatomii dorzálního venózního plexu a neurovaskulárních plexů v posterolaterální oblasti prostaty. Další vývoj videoendoskopie a miniinvazivních přístupů v urologii vedl k rozvoji laparoskopické radikální prostatektomie (LRP). První operaci provedl Schuessler v roce 1992 (2). Guillonneau a Vallancien popsali detailně transperitoneální techniku (Montsouris technique) po jednotlivých krocích (3). Zejména tito francouzští urologové se zasloužili o její rozšíření a jejich domácím pracovištěm v Paříži prošli v dalších letech i někteří čeští urologové. Na tomto pozadí byl na přelomu tisíciletí popsán přístup extraperitoneální – endoskopická extraperitoneální radikální prostatektomie (EERP) (4, 5).
Při všech výhodách endoskopického a miniinvazivního přístupu (zvětšení obrazu, menší incize) vedla tato operace (tj. EERP) k dalšímu zkrácení operačních časů ve srovnání s „klasickou“ transperitoneální LRP, snížení frekvence komplikací, redukci některých anatomických limitů (obezita, předchozí břišní operace), zkrácení vzdálenosti trokar-prostata atd. Její nevýhodou může být omezený prostor zejména u prováděné rozšířené pánevní lymfadenektomie (PLAE) a větší riziko rozvoje lymfokély (6).
Na našem pracovišti jsme si po předchozích nečetných zkušenostech s LRP se střídavými úspěchy následně osvojili extraperitoneální přístup a prezentujeme naše výsledky.
METODIKA
Charakteristika souboru
Od února 2008 do června 2013 jsme provedli 300 EERP u pacientů s BMI do 45, přičemž BMI > 30 mělo 67 pacientů. Průměrný věk pacientů byl 64 let (48–77), průměr PSA 8,1 ng/ ml (0,71–34,9). Průměrná hmotnost prostaty s váčky byla 56 g (rozmezí 15–185 g). U 130 (43 %) byla provedena pánevní lymfadenektomie – limitovaná (obturatorní jáma) nebo rozšířená (vnitřní ilické, obturatorní a zevní ilické uzliny po laterální hranici tvořenou genitofemorálním nervem). Anatomické faktory, které mohly významně měnit průběh operace, byly následující: sedm pacientů bylo po transuretrální resekci prostaty (TURP), po transuretrální resekci močového měchýře (TURM) tři (jeden se stentem v močovodu), jeden po retroperitoneální lymfadenektomii a aktinoterapii pro tumor varlete a jeden po hemikolektomii dolní střední laparotomií, jeden pacient byl po implantaci inflatabilní penilní protézy s rezervoárem v kyčelní jámě vpravo. Nejkratší interval mezi TURP a EERP byl 3 měsíce.
Všech 300 EERP prováděli tři operatéři v počtu 275, 16 a 9. Byly zhodnoceny peroperační údaje v pěti skupinách pacientů jdoucích chronologicky za sebou – A (36), B (34), C (71), D (77), E (83), dále časné a pozdní komplikace.
Postup operace
Operaci se provádí výhradně z extraperitoneálního přístupu, kdy se z incize pod pupkem digitálně pronikne pod přímé břišní svaly a zde tupě prstem disekuje tkáň laterálně a distálně. Zavedeno je pět portů v případě zároveň prováděné lymfadenektomie, bez ní jsou porty obvykle čtyři. Operační skupinu tvoří dva lidé – operatér stojí zleva od pacienta a asistent stojí zprava. Individuálně je nastavena Trendelenburgova poloha různého stupně. Před výkonem se zavede Foleyův katétr do rekta k provedení vzduchovému testu těsnosti rekta po odstranění prostaty z lůžka. Technika operace je descendentní (antegrádní), nejčastěji postupem dle Stolzenburga. Nervy šetřící operaci lze provést bez incize laterální pelvické facie s ponecháním fascie prostaty laterálně od ligamentum puboprostaticum (intrafasciální postup (obr. 1). Většinou je ale incize pelvické fascie laterálně od prostaty prvním krokem, dále následuje vypreparování hrdla močového měchýře a jeho oddělení od prostaty. Po incizi jednoho z listů Denonvilliersovy fascie jsou vypreparovány chámovody a přerušeny, následně disekovány semenné váčky z lůžka za přerušení vezikulárních cév. Dalším krokem je preparace posterolaterálních svazků a jejich resekce nebo oddělení od prostaty (dle indikace k nervy-šetřící či nervy-nešetřící EERP) descendentně od baze k apexu. Po izolaci plexus Santorini a většinou i incizi puboprostatických ligament je plexus hemostaticky ligován, přerušen, vypreparována uretra a incidována těsně pod apexem. Oddělením apikálních částí svazků od prostaty je dokončena prostatektomie. Test těsnosti rekta spočívá v naplnění rektálního katétru vzduchem stříkačkou a sledování hladiny fyziologického roztoku v lůžku po prostatektomii. Poté je katétr odstraněn. Uretrovezikální anastomóza je šita většinou pokračujícím stehem Monocryl 2-0 (Ethicon) jednouzlovou metodou dle van Velhoevena na cévce 20CH/10 ml v balonku. V posledním roce používáme též techniku pokračujícího stehu s vláknem V-loc (CovidienTM). Prevezikálně je vždy ponechán silastikový nebo Redonův drén (obvykle 2–3 dny). Rekonstrukci zadní fasciální vrstvy („Rocco stitch“) jsme neprováděli, stejně tak ani suspenzi s fixací dorzálního venózního plexu. Tyto modifikace nejsou u EERP standardem. Sedmý den po operaci je u všech pacientů provedena cystografie. Dle jejího výsledku je uretrální cévka odstraněna nebo ještě ponechána několik dní – interval je různý dle stupně úniku kontrastu anastomózou. U pacientů po TURP se předoperačně zavádí do močovodů ureterální katétry kvůli modifikovaným anatomickým poměrům po předchozí operaci a tyto jsou v průběhu operace extrahovány. Všichni pacienti mají předoperačně připravené střevo Fortransem, výkon je proveden vždy v antibiotické cloně.
Image 1. Lůžko po intrafasciální EERP Fig. 1. Prostatic bed after intrafascial EERP 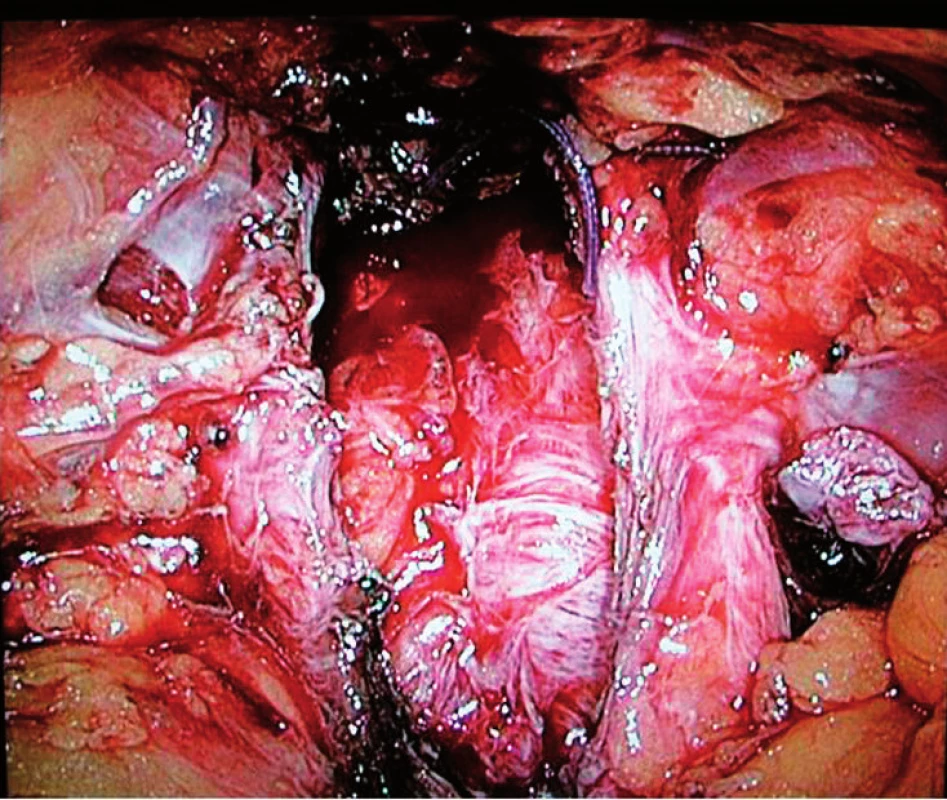
VÝSLEDKY
Žádná operace nebyla konvertována na otevřený výkon. Se zvyšující se zkušeností došlo k redukci času operace a krevních ztrát. Peroperační údaje v jednotlivých skupinách ukazuje tabulka 1.
Table 1. Peroperační údaje v jednotlivých chronologicky řazených skupinách pacientů Table 1. Peroperative data in chronologically arranged groups of patients 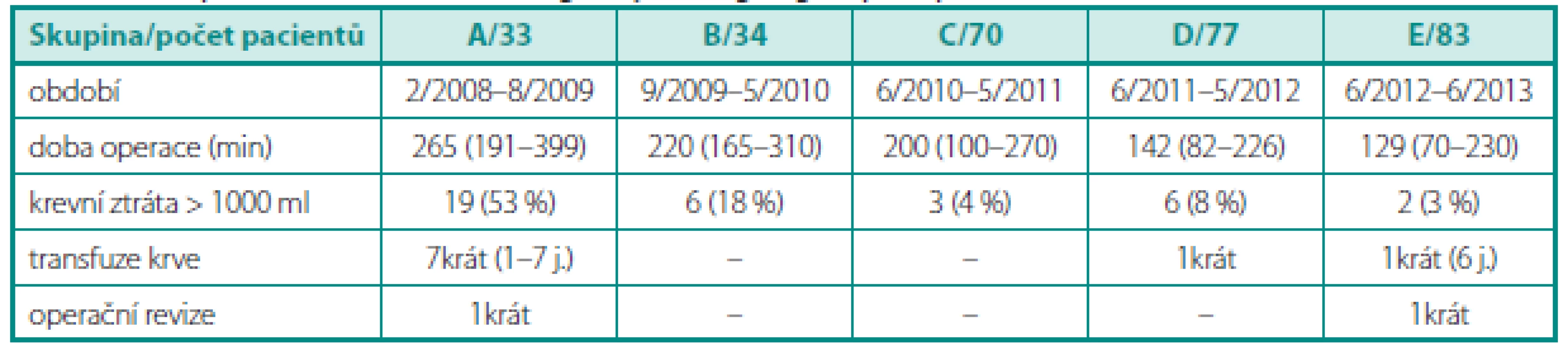
Transfuze krve byla nutná jen u devíti (3 %) pacientů. Operační revize (vždy otevřenou cestou) týž den bylo nutné provést u dvou pacientů 2 (0,7 %), vždy pro krvácení. K poranění rekta došlo celkem u šesti (2 %) pacientů, u čtyř byla perforace rozeznána peroperačně a defekt sešit ve dvou vrstvách, všichni tito pacienti se zhojili (obr. 2). U dvou operovaných vznikla rektoanastomotická píštěl 6., resp. 10. pooperační den (obr. 3). U obou nemocných byla založena punkční epicystostomie a následující den terminální sigmoideostomie. Uretrální katétr byl u obou operovaných po několika týdnech odstraněn a ponechána jen epicystostomie. Přesto nedošlo ke zhojení píštěle a u jednoho z nich se vyvinula filiformní dlouhá striktura uretry vyžadující uretroplastiku ještě před definitivním uzávěrem píštěle. Oba se zahojili až po složité excizi píštěle a rekonstrukci perineální cestou 9, resp. 13 měsíců po EERP. Oba pacienti jsou kontinentní (jedna „jistící“ vložka), u jednoho je prováděna dilatace striktury uretry v měsíčních intervalech. Další časnou komplikací byly megauretery u jednoho pacienta se spontánní jednostrannou perirenální paravazací moči. Stav byl řešen založením dočasné (2 týdny) oboustranné punkční nefrostomie. Zde byla ústí močovodů blízko anastomózy a ke stavu jistě přispěl též otok ureterálních ústí, pacient se zhojil bez komplikací.
Obr. 2a. Peroperační perforace rekta v distální části Fig. 2a. Peroperative rectal injury distally 
Obr. 2b. Po dvouvrstevné sutuře stěny rekta Fig. 2b. After two-layers suture of the rectal wall 
Image 2. Cystografie s průkazem rektovezikální píštěle Fig. 3. Cystography with the rectovesical fistula 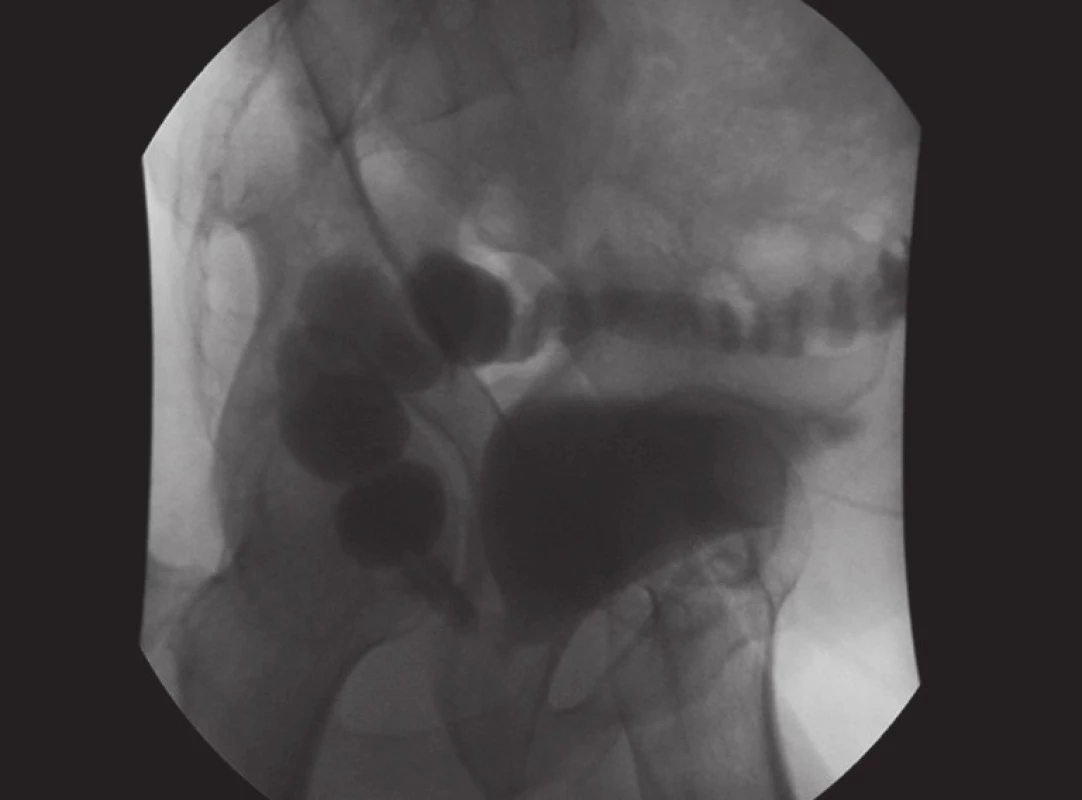
Uretrální katétr byl ponechán dle výsledků cystografie 6–30 dní. Do 10. dne včetně mělo cévku 220 (73 %) pacientů. Příčinou delšího intervalu ponechání katétru byl jakýkoliv (i sebemenší) únik kontrastu anastomózou popisovaný rentgenologem, tj. jakákoliv netěsnost anastomózy i u pacientů, kteří byli již několik dní bez drénu. V případě významné urinózní sekrece drénem se nám osvědčilo založit cca 2. až 5. den po výkonu punkční epicystostomii 15CH a ponechat ji do zhojení anastomózy (12 pacientů).
Pozdní komplikace ukazuje tabulka 2, téměř všechny byly klasifikovány dle Claviena stupněm IIIb. Striktura anastomózy byla vždy řešena endoskopicky a u všech pěti pacientů byla nalezena ve fibrózní tkáni jedna či více Hem-o-lok svorek (Teleflex®) prořezaných do stěny vezikouretrální anastomózy. Dle možností byly svorky endoskopicky odstraněny transuretrálně (kleštěmi či resekcí okolní tkáně). U tří pacientů se symptomatickou lymfokélou byl též lymfedém dolní končetiny různého stupně, po drenáži lymfokély vymizel. Drenáž byla provedena punkční cestou a v jednom případě otevřenou cestou. U pacienta s dislokovaným fragmentem ureterální cévky do močovodu (předoperační sondáž a nechtěné přerušení ureterální cévky při otevření hrdla močového měchýře) byl tento ponechán in situ a následně za 6 týdnů extrahován cystoskopicky (distální konec byl vidět v močovém měchýři). Pacient neměl po celou dobu žádné obtíže a byl kontinentní.
Table 2. Pozdní komplikace EERP Table 2. Late complications after EERP 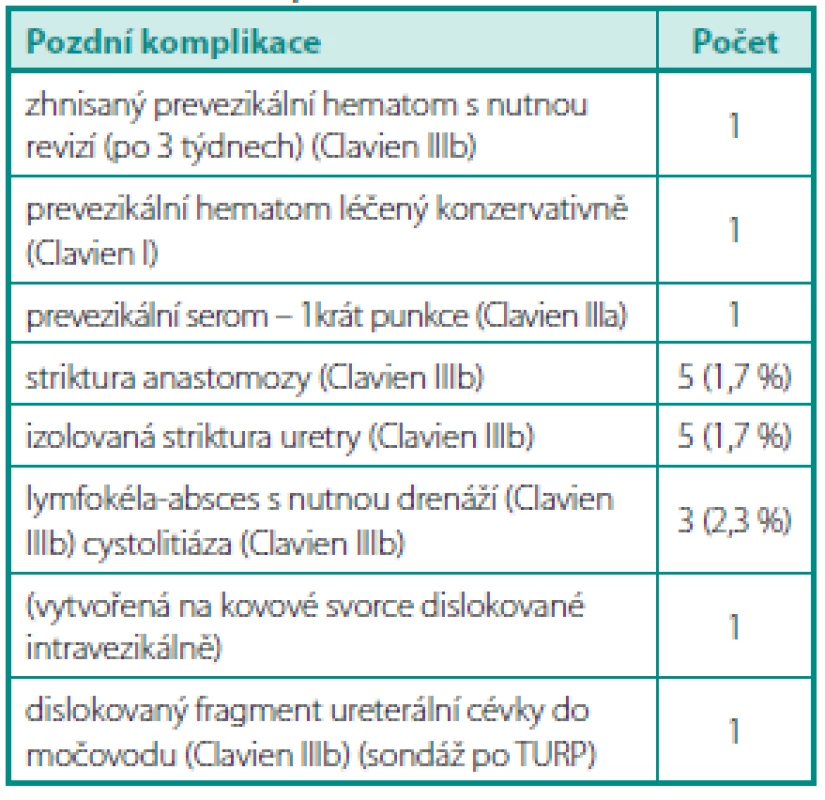
Funkční výsledky
Časnou kontinenci moči jsme byli schopni zhodnotit u 282 (94 %) pacientů. Při první kontrole za 6–8 týdnů po operaci 201 (71 %) pacient udával potřebu žádné nebo jedné vložky. Po 6–12 měsících jsme hodnotili kontinenci 229 pacientů, kontinentních při použití téhož kritéria (tj. 0–1 vložka/den) bylo 208 (91 %), zcela bez vložky 162 (71 %). Jeden z prvních pacientů je po implantaci a též následné explantaci umělého svěrače AMS 800. Žádný další pacient námi sledovaných po EERP a s močovou inkontinencí různého stupně nepodstoupil chirurgický výkon indikovaný z důvodů močové inkontinence.
Zhodnocení erektilní funkce je obtížné vzhledem k věkové heterogenitě souboru a dalším faktorům (kvalita erekce před operací, medikace, motivace k léčbě atd.). Tato data nemáme kompletní. Motivovaní pacienti s erektilní dysfunkcí po EERP jsou sledováni a léčeni andrologem.
Onkologické výsledky
Lokálně pokročilý nebo metastatický KP byl diagnostikován u 83 (28 %) odoperovaných pacientů našeho souboru (pT3a – 49, pT3b – 29, pT4 – 2, pT3a N+ – 1, pT3b N+ – 2). Jeden pacient byl klasifikován jako pT0.
Frekvence pozitivních nádorových okrajů v celém souboru operovaných byla 16,3 % (49 pacientů). Z toho u pT2 (216 pacientů) – 9,7 % (21), u pT3 (81 pacient) – 34,6 % (28). U dvou pacientů pT3 byly časně po výkonu (do 2 měsíců) zjištěny metastázy.
DISKUSE
EERP byla vyvinuta mimo jiné i z důvodů vyhnout se možným intraabdominálním komplikacím (poranění střeva, intraperitoneální krvácení, ileus, intraperitoneální únik moči, peritonitida s následným rozvojem adhezí atd) (7). Její technika a modifikace se od první publikace v roce 2001 (Bollens) vyvíjely. EERP lze provádět antegrádně (tj. descendetně), ale i retrográdně (tj. ascendentně – tj. Heilbronn technika) (8). Antegrádní technika má výhodu v kratší výukové křivce, menším riziku krvácení díky časnější kontrole laterálních prostatických pediklů a zkrácení doby operace díky iniciální disekci váčků (6). S rostoucími zkušenostmi odpadly též limity typu obezity nebo předchozích chirurgických břišních výkonů. V našem souboru měla více jak pětina pacientů BMI > 30 (maximální BMI bylo 45!). Několik pacientů bylo po předchozích hernioplastikách, tato skutečnost byla zřídka limitující, a když, tak jen v případě nutné lymfadenektomie. Jeden z pacientů byl po hemikolektomii a extraperitoneální přístup byl možný při modifikovaném založení portů do nestandardní polohy, vlastní operace ale proběhla bez komplikací. Průběh operace dle našich zkušeností ovlivňuje jako jeden z hlavních faktorů velikost prostaty a tvar či prostornost pánve. V případě užší malé pánve a velké prostaty se výkon provádí nejhůře. Několikrát jsme se setkali s nálezem velkého středního laloku, který komplikoval hlavně přerušení zadního obvodu hrdla močového měchýře, ve dvou případech byla nutná resekce středního laloku harmonickým skalpelem před definitivním přerušením hrdla (obr. 4). Samotná velikost prostaty není faktorem, který ovlivňuje vhodnost pacienta k EERP (9). U pacientů po předchozím TURP jsme prováděli vždy cystoskopii a u většiny z nich založili do močovodů ureterální katéry tak, abychom měli v průběhu operace dokonalý přehled o lokalizaci ústí močovodů. Tento postup (ale se založením stentů) je obecně doporučován (7).
Image 3. Velký střední lalok prostaty po oddělení předního obvodu hrdla močového měchýře Fig. 4. Large prostatic middle lobe after incision of the bladder neck anterior wall 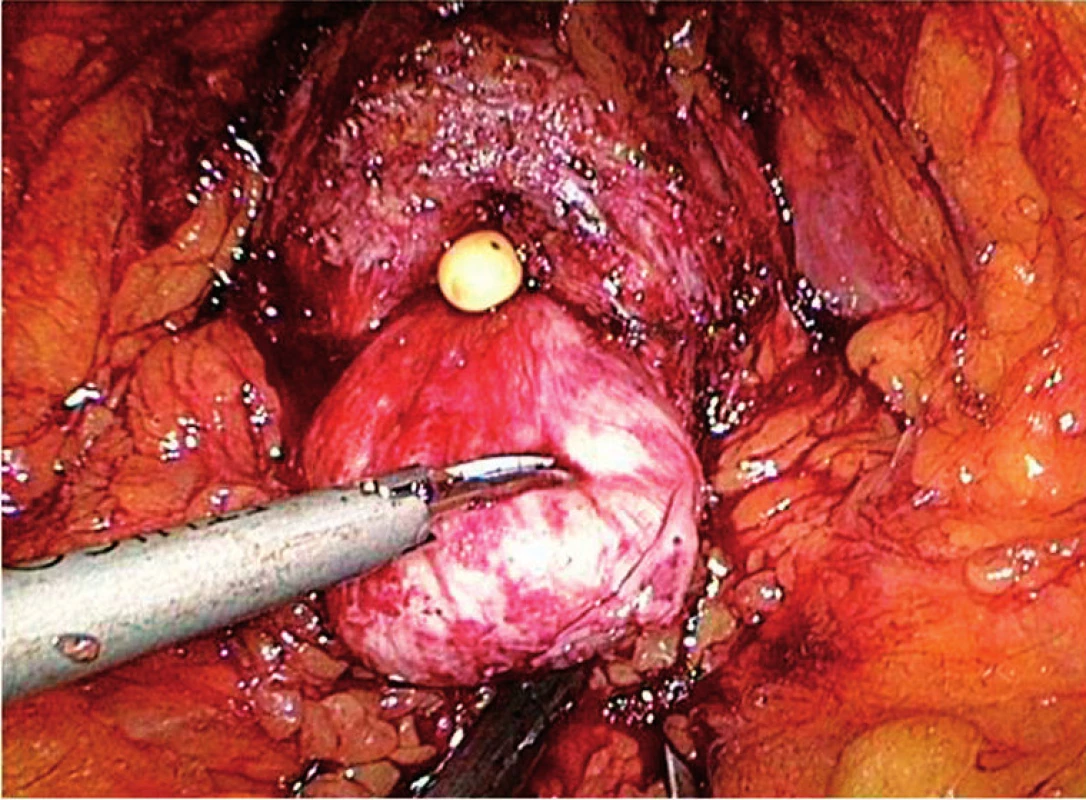
Operaci prováděl operatér vždy jen s jedním asistentem. V úvodních 100 operacích jsme po disekci v prevezikálním prostoru založili pět portů, později byl tento počet použit jen v případě prováděné pánevní lymfadenektomie, jinak byly porty jen 4 (3 × 10 mm a 1 × 5 mm). Kamerový port byl zaveden v místě pod pupkem, zleva dva porty 10 mm a zprava 1–2 porty 5 mm. Prostatu jsme po jejím odstranění z lůžka v naprosté většině případů vložili do sáčku a tento ponechali vpravo přitažený k portu za vlákno, které jím procházelo. Po došití vezikouretrální anastomózy a založení drénu byla prostata v sáčku extrahována z rozšířené incize pod pupkem po kamerovém portu. K výkonu jsme používali standardní laparoskopické instrumentárium, titanové a polymerové svorky (Hem-o-lok velikosti L), kleště na bázi ultrazvukového skalpelu („harmonický skalpel“) různých výrobců.
Anatomózu jsme šili u naprosté většiny pacientů technikou dle van Velthoevena pokračujícím stehem vláknem Monocryl 2-0 (10). V případě širokého hrdla jsme toto zúžili stehem na přední komisuře. V poslední době jsme použili též pokračující steh V loc (CovidienTM), který díky designu vlákna po zatažení drží pevně oba okraje (hrdlo a uretru) šité k sobě v definitivní poloze.
Perioperační údaje (čas operace, krevní ztráta) a pooperační morbidita se významně redukují s narůstajícím počtem operovaných pacientů. Z kumulativní analýzy 37 prací porovnávajících otevřenou (RRP), laparoskopickou (LRP) a robotickou prostatektomii (RALP) je zřejmé, že čas operace je kratší u RRP, zvláště v iniciální fázi výukové křivky (11). Sami jsme dosáhli operačních časů poprvé pod 4, 3 a 2 hodiny u pacienta č. 17, 47 a 109. V současné době je čas operace většinou kolem 130 minut, což odpovídá zkušenostem z jiných pracovišť (11, 12). Krevní ztráta nad 1000 ml byla v úvodním roce u 53 % pacientů, téměř čtvrtina z nich potřebovala substituci krve. V dalších letech došlo k redukci krevní ztrát a potřeba krevní transfúze byla tedy celkem jen u 3 % operovaných, ta je na dolní hranici rozmezí udávaného v literatuře (3–9,6 %) u LRP, resp. EERP (11).
Čas ponechání uretrálního katétru je ovlivněn urinózním únikem drénem a výsledkem cystografie. Rizikovými faktory jsou obezita, velikost prostaty, typ anatomózy, předchozí operace prostaty, napětí anastomózy a vzdálenost ureterálních ústí od anastomózy. Intervence z těchto důvodů je nutná v 0,9–2,5 % (13). Problémem je definice urinózního úniku – je založena na skutečností sekrece moče drénem nebo na úniku kontrastu při cystografii. V době, který pooperační den je cystografie prováděna, existuje široká variabilita (13). Sami máme zkušenost, že v případě urinózní sekrece pomůže manipulace s cévkou – často její zavedení dále do dutiny měchýře, eventuálně i s vypuštěním balónku a zevní fixací v této poloze. Tento manévr je často účinnější než prostá trakce za cévku. U významné prolongované sekrece jsme založili epicystostomii 15CH a ponechali ji několik dní po vymizení úniku, což nastane často ihned po jejím zavedení. Jiná intervence nebyla nikdy nutná. Do 10. dne jsme odstranili cévku u 220 (73 %) pacientů. Výslednou kontinenci anamnéza urinózní sekrece neovlivňuje, v některých případech jen její časný návrat (13).
Významnou komplikací je poranění rekta (0–6,8 %) (7, 14). Frekvence v našem souboru je 2 %, což odpovídá světovému písemnictví. Peroperačně rozpoznané poranění je zhojeno bez komplikací po sutuře a následných opatřeních typu parenterální a bezezbytkové diety několik dní, nerozpoznané ale vede k rozvoji rektoanastomotické píštěle s nutností založení kolostomie (15). Při ponechání derivace močového měchýře je možné spontánní zhojení píštěle. Tuto skutečnost nemůžeme po naší zkušenosti potvrdit, u obou našich pacientů se vzniklou píštělí ke spontánnímu zhojení nedošlo, byla nutná odložená excize píštěle se suturou močového měchýře i rekta z perineálního přístupu. U jednoho z nich byla v píštěli nalezena svorka Hem-o-lok, druhý byl anamnesticky celkem po čtyřech transrektálních biopsiích než byl diagnostikován KP. Peroperačně rozpoznaná a ošetřená poranění rekta se zhojila u všech čtyř našich pacientů. Rizikovými faktory vzniku jsou fibrózní změny v okolí prostaty, používání elektrokoagulace a svorek při disekci apikální části prostaty.
Striktura anastomózy je po LRP (tj. i EERP) méně častá (0,8–6,4 %) než po RRP (až 16 %) (11). Jednou z příčin vzniku je migrace klipů Hem-o-lok (14). V našem souboru to platí pro všechny pacienty s anastomotickou strikturou (1,7 %). U stejného počtu pacientů vznikla izolovaná významná striktura uretry mimo anastomózu. Všechny byly řešeny endoskopicky.
Funkční výsledky kontinence moči jsou hodnoceny velmi heterogenně. Samotným problémem je již kritérium kontinence. V naprosté většině je za kontinentního považován pacient se spotřebou 0–1 vložky denně (16). Po LRP je 12měsíční kontinence moči v rozmezí 66–95 % (11, 15). Lepší výsledky mají pacienti do 60 let věku, zlepšení stavu je možné až do 24 měsíců po výkonu (16). Výsledky v našem souboru jsou shodné s těmito publikovanými údaji.
Funkční výsledky erektilní funkce je obtížné v našem souboru hodnotit i vzhledem k udávaným intervalům obnovení erekce – 180–440 dní (11). Faktory, které ovlivňují hodnocení, jsou věk, předoperační stav erekce, způsob operace – šetření či nešetření nervově-cévních svazků s ohledem na předoperační histologický výsledek, motivace pacientů k léčbě ED, v našem případě též u mnoha pacientů příliš krátká doba sledování.
Onkologické výsledky jsou hodnoceny v časné fázi zejména podle frekvence pozitivních nádorových okrajů. Analýza 400 prací z let 2002–2010 zahrnující mimo jiné 57 303 pacientů po LRP udává jejich frekvenci na 20,4 %, u pT2 13 % a pT3 39,7 % (17). Zejména u stadia pT2 jsou publikované výsledky velmi heterogenní (6,2–27,2 %), diskrepanci lze vysvětlit rozdílnou zkušeností chirurga, výběrem pacientů a různými operačními postupy (18). V hodnoceném souboru (pT2 a pT3) byla frekvence pozitivních nádorových okrajů 16,3 % (u pT2 na hranici 10 %).
ZÁVĚR
EERP je minimálně invazivní chirurgickou možností léčby indikovaných pacientů s KP. Peroperační údaje (doba operace, krevní ztráta) se příznivě mění s počtem odoperovaných pacientů. Onkologické výsledky jsou ovlivněny rizikovými faktory provázejícími indikaci k výkonu. Funkční výsledky týkající se kontinence moči jsou dobré, frekvence významných chirurgických komplikací je nízká.
Došlo: 4. 2. 2014.
Přijato: 28. 4. 2014.
Kontaktní adresa
MUDr. Květoslav Novák
Urologická klinika 1. LF UK a VFN
Ke Karlovu 6, Praha 2
e-mail: slavek.novak@seznam.cz
Prohlášení o podpoře:
Nákup laparoskopické sestavy byl podpořen projektem OPPK „Materiálně technická základna pro výzkum v oblasti diagnostiky a léčby civilizačních a onkologických onemocnění a jejich závažných rizik ve VFN v Praze“, reg. č. CZ.2.16/3.1.00/24012 spolufinancovaným z Evropského fondu pro regionální rozvoj.
Střet zájmů: žádný.
Sources
1. Heidenreich A, Bastian PJ, Bellmunt J, et al. Guidelines on Prostate Cancer (2013 Edition): http//uroweb.org
2. Schuessler WW, Schulman P, Clayman R, Kavoussi L. Laparoscopic radical prostatectomy: Initial short-term experience. Urology 1997; 50 : 854–857.
3. Guillonneau B., Vallancien G. Laparoscopic radical prostatectomy: The Monsouris experience. J Urol 2000; 163 : 418–422.
4. Bollens R, Vanden Bossche M, Rhoumeguere T, et al. Extraperitoneal laparoscopic radical prostatectomy: results after 50 cases. Eur Urol 2001; 40 : 65–69.
5. Stolzenburg JU, Do M, Rabenalt R, et al. Endoscopic extraperitoneal radical prostatectomy : initial expeerince after 70 procedures. J Urol 2003; 169 : 2066–2071.
6. Rassweiler J, Hruza M, Teber D, et al. Laparoscopic and robotic assisted radical prostatectomy – critical analysis of the results. Eur Urol 2006; 49 : 612–624.
7. Stolzenburg JU, Gettman MT, Liatsikos EN. Endoscopic extraperitoneal radical prostatectomy. Berlin-Heidelberg: Springer Verlag 2007; 195.
8. Rassweiler J, Sentker L, Seemenn O, et al. Laparoscopic radical prostatectomy with the Heilbronn technique: an analysis of the first 180 cases. J Urol 2001; 160 : 201–208.
9. Chang CM, Moon D, Gianduzzo TR, et al. The impact of prostate size in laparoscopic radical prostaectomy. Eur Urol 2005; 48 : 285–290.
10. Van Velhoeven RF, Ahlering TE, Peltier A, et al. Technique for laparoscopic running urethrovesical anastomosis:the single knot method. Urology 2003; 61 : 699–702.
11. Ficarra V, Novara G, Artibani W, et al. Retropubic, laparoscopic and robot-assisted radical prostatectomy:A systematic Review and cumulative analysis of comparative studie. Eur Urol 2009; 55 : 1037–1063.
12. Rabbani F, Yunis L, Pinochet R, et al. Comprehensive standardised report of complications of retropubic and laparoscopic radical prostatectomy. Eur Urol 2010; 57 : 371–386.
13. Tyritzis S, Katafigiotis I, Constantinides C. All you need to know about urethrovesical anastomotic urinary leakage following radical prostatectomy. J Urol 2012; 188 : 369–376.
14. Hruza M, Weiss H, Giovannalberto P, et al. Complications in 2200 consecutive laparoscopic radical prostatectomies: standardised evaluation and analysis of learning curves. Eur Urol 2010; 58 : 731–733.
15. Touijer K, Guillonneau B. Laparoscopic radical prostatectomy: A critical analysis of surgical quality. Eur Urol 2006; 46 : 625–632.
16. Prabhu V, Sivarajan G, Taksler G, et al. Long-term continence outcomes in men undergoing radical prostatectomy for clinically localized prostate cancer. Eur Urol 2014; 65 : 52–57.
17. Tewari A, Sooriakumaran P, Bloch D, et al. Positive surgical mergin and preoperative complication rates of primary surgical treatments for prostate cancer: A systematic review and meta-analysis comparin, retropubic, laparoscopic and robotic prostatectomy. Eur Urol 2012; 62 : 1–15.
18. Paul A, Ploussard G, Nicolaiew N, et al. Oncologic outcome after extraperitoneal laparoscopic radical prostatectomy: Midterm follow-up of 1115 procedures. Eur Urol 2010; 57 : 267–273.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2014 Issue 2-
All articles in this issue
- Intravezikální léčba nádorů močového měchýře
- Klasifikace intraepiteliálních neoplazií předcházejících dlaždicovému karcinomu penisu a jejich analogie s prekancerózami dlaždicových karcinomů vulvy
- Prediktivní parametry metastatického renálního karcinomu
- Role plicní metastazektomie v léčbě diseminovaného světlobuněčného renálního karcinomu
- Endoskopická extraperitoneální radikální prostatektomie a její komplikace – vlastní zkušenosti z prvních 300 operací
- Perkutánní operace nefrolitiázy v Galdakao-modifikované supinační poloze
- Aneuryzmatická cysta nadledviny
- „Burned-out“ tumor semenníka s metastázou do retroperitoneálnej lymfatickej uzliny
- Případ monstrózní benigní hyperplazie prostaty
- Asynchronní solitární metastáza světlobuněčného renálního karcinomu 7 let po nefrektomii projevující se Hornerovým syndromem
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intravezikální léčba nádorů močového měchýře
- Aneuryzmatická cysta nadledviny
- Klasifikace intraepiteliálních neoplazií předcházejících dlaždicovému karcinomu penisu a jejich analogie s prekancerózami dlaždicových karcinomů vulvy
- „Burned-out“ tumor semenníka s metastázou do retroperitoneálnej lymfatickej uzliny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

