-
Medical journals
- Career
Nové léčebné postupy v léčbě dětské akutní lymfoblastické leukemie
Authors: Šrámková Lucie
Authors‘ workplace: Klinika dětské hematologie a onkologie, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha
Published in: Čes-slov Pediat 2022; 77 (5): 265-271.
Category: Comprehensive Report
doi: https://doi.org/10.55095/CSPediatrie2022/042Overview
Akutní lymfoblastická leukemie (ALL) u dětí je onemocnění s dobrou šancí na vyléčení na současných moderních léčebných protokolech. Přesto 10–15 % dětí prodělá relaps onemocnění, část z nich je již rezistentní k chemoterapii a vyžaduje použití dalších léčebných modalit. Z těchto nových léčebných postupů se již v současné klinické praxi používá imunoterapie a další cílené léky, které mají velmi dobrý efekt i u výrazně předléčených pacientů a postupně mění koncept léčby ALL.
Klíčová slova:
relaps – cílená léčba – imunoterapie – akutní lymfoblastická leukémie
Úvod
Akutní lymfoblastická leukemie (ALL) je nejčastější nádorové onemocnění dětského věku. Ročně je v České republice diagnostikováno 65–70 dětí. Na počátku šedesátých let minulého století byla kurabilita dětské ALL prakticky nulová, v současné době stoupla šance na vyléčení až na 90 %. Přesto jsou 2 % pacientů refrakterní na indukční chemoterapii a 10–15 % pacientů prodělá relaps onemocnění.(1) Tento zásadní pokrok byl dosažen díky intenzifikaci chemoterapie a trvalému zlepšování podpůrné léčby, která minimalizuje život ohrožující komplikace. Důležitým momentem bylo i zavedení transplantace hematopoetických kmenových buněk včetně využití nepříbuzných dárců a postupné snižování mortality spojené s tímto výkonem. V neposlední řadě výsledky zlepšila přesnější stratifikace pacientů na základě molekulárních charakteristik a měření odpovědi na léčbu pomocí tzv. minimální reziduální nemoci (MRN). V posledních letech k dalšímu pokroku přispívá i zavádění nových cílených léků, zvláště imunoterapie.
Konvenční léčba
Standardem léčby je kombinovaná chemoterapie, jejíž intenzita je přizpůsobena biologickému podtypu leukemie a odpovědi na léčbu. Léčba se skládá z několika základních částí. První je tzv. indukce, která slouží k navození remise onemocnění v trvání 1 měsíce, tato fáze zahrnuje prednison, vinkristin, daunorubicin a pegylovanou asparaginázu. Léčba pokračuje konsolidační fází, kdy je podáván cytosinarabinosid, merkaptopurin, cyklofosfamid a vysokodávkovaný methotrexát, a přibližně 6 měsíců od zahájení terapie následuje pozdní intenzifikace, kdy je zopakována obdoba indukční fáze. Pacienti vysokého rizika mají v konsolidaci zařazeny bloky vysokodávkované chemoterapie a prodlouženou pozdní intenzifikaci. Nedílnou součástí terapie je i intratekální podávání methotrexátu k prevenci a léčbě leukemické infiltrace mozku, pro některé rizikové pacienty je zařazeno i ozařování neurokrania. Je snaha neustále zmenšovat skupinu pacientů, pro které je indikována profylaktická radioterapie neurokrania vzhledem k riziku pozdních komplikací (endokrinopatie, sekundární malignity). Po skončení intenzivní chemoterapie následuje udržovací léčba merkaptopurinem a methotrexátem do celkové délky terapie 2 roky. Transplantace hematopoetických kmenových buněk (HSCT) v první remisi je využívána pouze pro přesně definovanou část pacientů ze skupiny dětí vysokého rizika. Léčba ALL náročnými chemoterapeutickými protokoly s sebou přináší řadu akutních i dlouhodobých toxických komplikací. Nejzávažnějším problémem je úmrtí na komplikace léčby, které v současnosti postihuje 2–4 % dětí, mortalita je nejčastěji způsobena bakteriálními a mykotickými infekcemi. Riziko úmrtí na komplikace léčby se zvyšuje u dětí nad 10 let věku, dětí s Downovým syndromem a při léčbě ALL vysokého rizika. Mezi závažné akutní komplikace kromě infekcí patří neurologické komplikace, pankreatitidy a trombózy.( 2) Z dlouhodobého hlediska se sledování zaměřuje zvláště na osteonekrózy, endokrinologické poruchy, kardiovaskulární onemocnění a poruchy neurokognitivních funkcí. Závažnou vzácnou pozdní komplikací je rozvoj sekundární malignity, která postihuje 1–2 % dětí, vyšší incidenci zaznamenáváme u dětí po radioterapii a zvláště po celotělovém ozáření, které je součástí přípravného předtransplantačního režimu.(3,4)
Biologické podskupiny ALL
ALL je heterogenní onemocnění, zahrnuje několik imunofenotypově a genotypově charakterizovaných podskupin. Jejich spektrum se s rozvojem možností molekulárně genetického vyšetření nadále rozšiřuje. Tyto podskupiny se liší i odpovědí na léčbu a prognózou. Prognosticky příznivé změny u B-prekurzorových (BCP) ALL jsou t(12;21) (ETV6::RUNX1) a vysoká hyperdiploidie (51–65 chromozomů). Nepříznivé chromozomální aberace jsou na všech používaných léčebných protokolech spojeny s vysokým rizikem relapsu, patří mezi ně přestavby MLL (KMT2A) genu, t(9;22)(BCR::ABL), t(17;19)(TCF3::HLF) a hypodiploidie pod 39 chromozomů. Asi 30 % dětských pacientů s BCP ALL nemá přítomnu žádnou z výše uvedených změn a řadíme je do tzv. skupiny B-ostatní. Tato skupina je opět heterogenní, přibližně 30 % z ní tvoří leukemie s expresním profilem podobným BCR::ABL pozitivním ALL a je nazývána BCR::ABL - -like.(5,6) Část těchto pacientů má detekovatelné fúzní geny s kinázovou aktivitou, které mohou být léčebně ovlivněny tyrosinkinázovými inhibitory (TKI).(7) Molekulárně genetické charakteristiky T-ALL, která představuje přibližně 15 % dětských ALL, jsou více studovány až v posledních letech. V současné době je známa řada rekurentních změn, z nichž část má i prognostický význam a některé jsou potenciálně léčebně ovlivnitelné. Nejčastějšími aberacemi jsou delece CDKN2A/2B (až u 70 % T-ALL), aktivační mutace NOTCH1 (60 % T-ALL) a aberantní exprese transkripčních faktorů způsobená různými mechanismy, jako jsou TA L1, TA L2, TLX1, TLX3, LMO1, LMO2, HOXA a další.(8) V nedávné době byly identifikovány biologicky mimořádně nepříznivé T-ALL s některou z následujících mutací: p53, MSH6, USP7, KRAS/ NRAS, IL7R.(9)
Detekce minimální reziduální nemoci
Sledování minimální reziduální nemoci (MRN) dále zpřesnilo stratifikaci pacientů do rizikových skupin a umožnilo použití adekvátní léčby. Jako marker MRN se využívají pacient specifické přestavby imunoreceptorových genů IgH/ TCR na klonální populaci lymfoblastů. Měření je prováděno z kostní dřeně kvantitativní polymerázovou řetězovou reakcí (qPCR) v daných časových bodech léčby (po indukci, týden 12 od zahájení léčby, event. v dalších časových bodech) s citlivostí až 10-5, tedy 1 leukemická buňka mezi 100 000 zdravými. Hladina MRN je nezávislým prognostickým faktorem a dobře odráží senzitivitu onemocnění na podanou léčbu.(10–12)
Cílená léčba
Zahrnuje léky s různými mechanismy účinku, jejichž společnou charakteristikou je selektivnější působení přímo na leukemické buňky ve srovnání s chemoterapií.
Největší skupinu tvoří v současné době imunoterapie, tedy léky, které cílí na specifické povrchové znaky nádorových buněk a využívají následné destrukce imunitními buňkami. Mají podobu prostých protilátek, protilátek konjugovaných s toxinem, bispecifických protilátek, nebo dokonce biotechnologicky upravených autologních T lymfocytů.
Imunoterapie
Blinatumomab
Blinatumomab je bispecifická monoklonální protilátka anti - -CD19/anti-CD3 (obr. 1). Povrchový antigen CD19 je exprimován na více než 90 % B-prekurzorových ALL.13 Blinatumomab zprostředkovává vazbu CD3 pozitivních cytotoxických T buněk a CD19 pozitivních B buněk, což umožní, aby pacientovy endogenní T lymfocyty rozpoznaly a zničily CD19 pozitivní lymfoblasty.(14–16) Vyznačuje se velmi krátkým poločasem, což vyžaduje podání v kontinuální infuzi velmi přesnou infuzní pumpou v 28denních cyklech s dvoutýdenní pauzou. Protilátka neproniká do centrálního nervového systému (CNS), proto je nutné současně podávat standardní intratekální profylaxi methotrexátem.
Image 1. Struktura a mechanismus účinku blinatumomabu 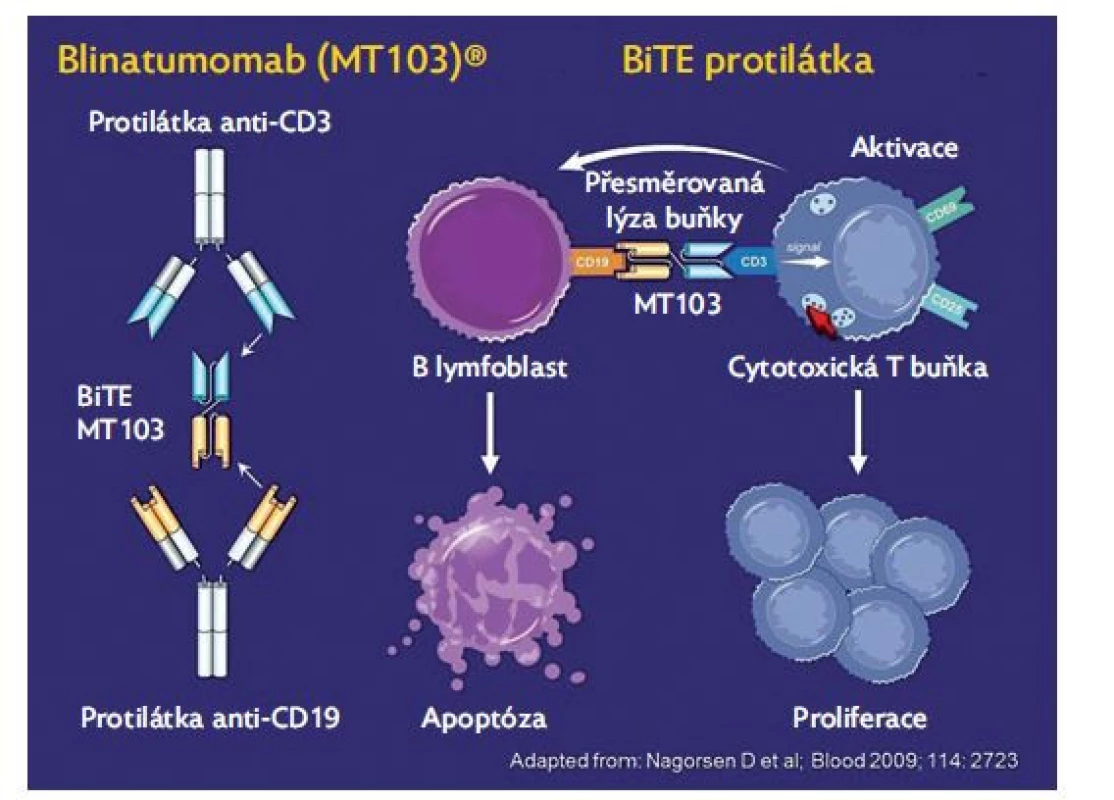
První zkušenosti s touto protilátkou byly publikovány u pacientů s B non-hodgkinským lymfomem.(17) V prvních větších studiích u dospělých pacientů s ALL(18) bylo dosaženo kompletní remise u přibližně 40 %, což je ve skupině pacientů rezistentních na mnoho linií léčby velmi dobrý výsledek. Ještě nadějnější jsou výsledky ve skupině pacientů, kde je tato léčba indikována před propuknutím hematologického relapsu v situaci perzistující MRN nebo molekulárního relapsu, kdy lze dosáhnout molekulární remise v 80 % případů.( 19) V následných pediatrických studiích bylo dosaženo podobných výsledků.(20) Nejčastějšími toxickými komplikacemi byly syndrom z uvolnění cytokinů (CRS – cytokine release syndrome) a neurotoxicita. Tyto komplikace jsou častější u pacientů s velkou nádorovou masou a následnou masivní imunitní reakcí. Obvyklými projevy CRS je horečka, tachykardie, hyposaturace, otoky, mezi neurologické projevy patří třes, zmatenost nebo křeče. Ve většině případů jsou tyto nežádoucí projevy ovlivnitelné kortikoidy, event. anti-IL-6 terapií (tocilizumab), ve výjimečných případech však mohou vést až k život ohrožujícímu multiorgánovému selhání.
V České republice jsme u dětí začali blinatumomab používat v roce 2015, v období 2015–2022 jsme léčili blinatumomabem celkem 13 dětí (11 dětí bylo léčeno na našem pracovišti) v indikaci relapsu onemocnění po selhání předchozích linií chemoterapie nebo v případě perzistující vysoké MRN. Léčebné odpovědi dosáhlo 12 pacientů, 7 z nich dosáhlo i negativity MRN. Po léčbě blinatumomabem byli transplantováni všichni pacienti, kteří dosáhli léčebné odpovědi, 10 z nich žije v kompletní remisi. Toxicita léčby byla v rámci očekávaného rozmezí, cytokinový syndrom vyžadující přerušení infuze jsme zaznamenali u 2 pacientů, 2 pacienti vyvinuli křeče jako projev neurotoxicity. I přes jiné spektrum toxických komplikací je léčba blinatumomabem i u významně předléčených pacientů lépe tolerovaná než intenzivní chemoterapie a přináší zásadní posun v léčbě rezistentní ALL. Role tohoto léku je v současné době randomizovaně testována v primární léčbě ALL (protokol AIEOP BFM ALL 2017) ve skupině středního a vysokého rizika a očekává se, že sníží riziko relapsu.
Inotuzumab ozogamicin
Je humanizovaná monoklonální anti-CD22 protilátka konjugovaná s cytotoxickou látkou kalicheamicinem. Povrchový znak CD22 je silně exprimován u většiny dětských BCP ALL.(21) Po navázání na CD22 je komplex antigen–protilátka rychle internalizován. Poté je kalicheamicin uvolněn uvnitř leukemické buňky, kde se váže na dvoušroubovici deoxyribonukleové kyseliny (DNA) a způsobuje dvouvláknové zlomy DNA. Maligní buňky poté podléhají apoptóze. Mechanismus účinku je zobrazen na obr. 2.
Image 2. Mechanismus účinku inotuzumab ozogamicinu 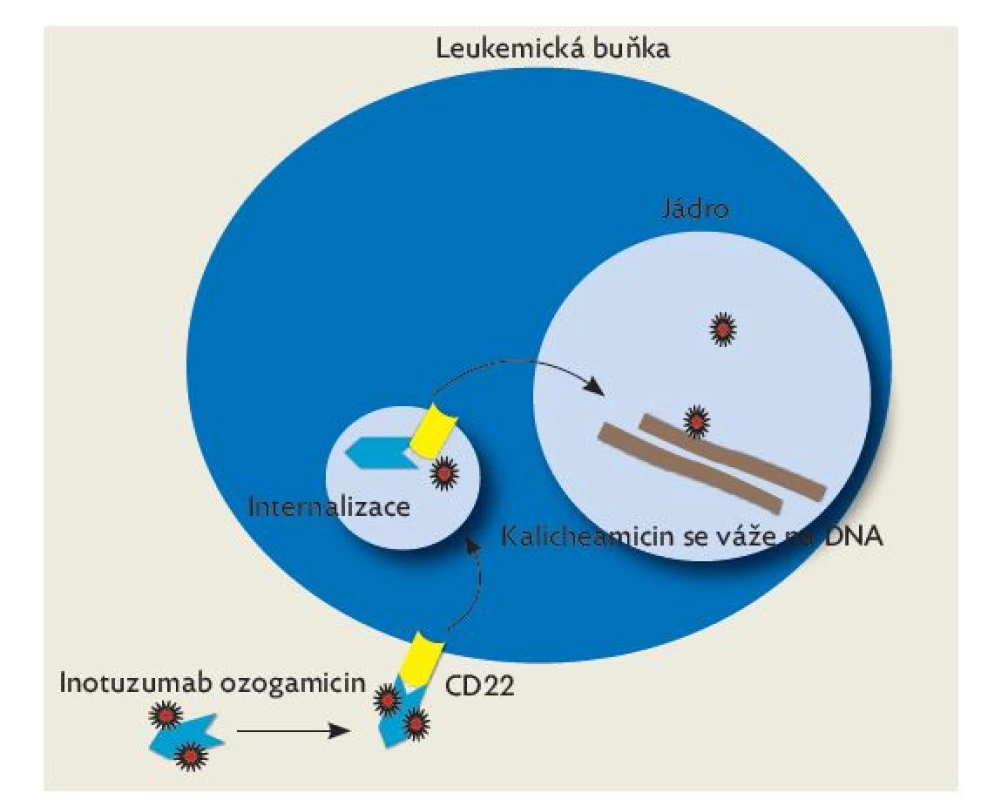
(upraveno dle Thomas X, et al. Profile of inotuzumab ozogamicin and its potential in the treatment of acute lymphoblastic leukemia: Blood Lymph Cancer Targets Ther 2014: 4). První zkušenosti s léčbou byly shrnuty ve studii fáze II Kantarjian et al.,(22) která byla prováděna v letech 2010–2011. Primárně byla určena pro mladé dospělé pacienty, po pilotní fázi v ní bylo léčeno i několik dětí. V dalších letech byl lék používán v pediatrii off-label v rámci tzv. compassionate access programu. Takto léčené pediatrické pacienty v Evropě, USA a Austrálii shrnula práce Bhojwani et al.,(23) do které byla zahrnuta i pacientka léčená v našem centru. Tato retrospektivní analýza ukázala, že z 51 velmi předléčených dětí s rezistentní ALL dosáhlo kompletní remise 67 %, z nichž 71 % dosáhlo negativní MRN. Toxicita léčby byla vzhledem k této skupině pacientů přijatelná, kromě očekávaných infekčních komplikací dominovala hepatotoxicita s rizikem rozvoje venookluzivní nemoci jater po následné transplantaci hematopoetických kmenových buněk. Tyto výsledky jsou nyní prospektivně ověřovány v akademické pediatrické studii, která probíhá i na našem pracovišti. V České republice jsme jako jediné pracoviště použili tento lék v klinické praxi u 3 dětí s ALL, u všech jsme zaznamenali odpověď na léčbu, u 2 dětí i dosažení negativní MRN, žije 1 dítě, 2 zemřely na potransplantační komplikace.
CAR T lymfocyty
Tento terapeutický přístup využívá cytotoxicity T lymfocytů, na kterých je biotechnologicky vytvořen tzv. chimérický antigenní receptor (CAR), ten může být teoreticky zaměřen vůči jakémukoliv povrchovému znaku jiné buňky. CAR T lymfocyty se pak specificky naváží na antigeny nádorové buňky a spouští cytotoxickou reakci T lymfocytu (obr. 3). Celý proces začíná separací lymfocytů pacienta pomocí leukaferézy, podmínkou je dostatečné množství a funkčnost T lymfocytů, což může být problém u pacientů krátce po transplantaci hematopoetických kmenových buněk. Následuje genetická modifikace (transdukce) T lymfocytů CAR konstruktem, a to buď s použitím virového vektoru (retroviry, lentiviry), nebo transpozonovou technologií, kdy je plazmidová DNA elektroporací vpravena do buňky, kde se integruje do genomu. CAR T lymfocyty jsou kultivovány a expandovány. Před podáním musí pacient podstoupit lymfodepleční chemoterapii (nejčastěji režim fludarabin/cyklofosfamid), která usnadňuje přihojení a přežití CAR T lymfocytů. CAR T lymfocyty mohou přežívat po podání i několik let. Ideálním povrchovým znakem je takový, který se vyskytuje ve vysoké denzitě na nádorových buňkách a je minimálně exprimován na jiných tkáních. Takovým příkladem je např. znak CD19 nebo CD22, které jsou téměř exkluzivně exprimovány na B lymfocytech. Několik úspěšných studií prováděných na pracovištích v USA(24–26) přineslo velmi dobré výsledky s dlouhodobým efektem u rezistentní ALL, včetně efektu u extramedulárního postižení zvláště v CNS.
Image 3. Struktura a funkce chimérického antigenního receptoru 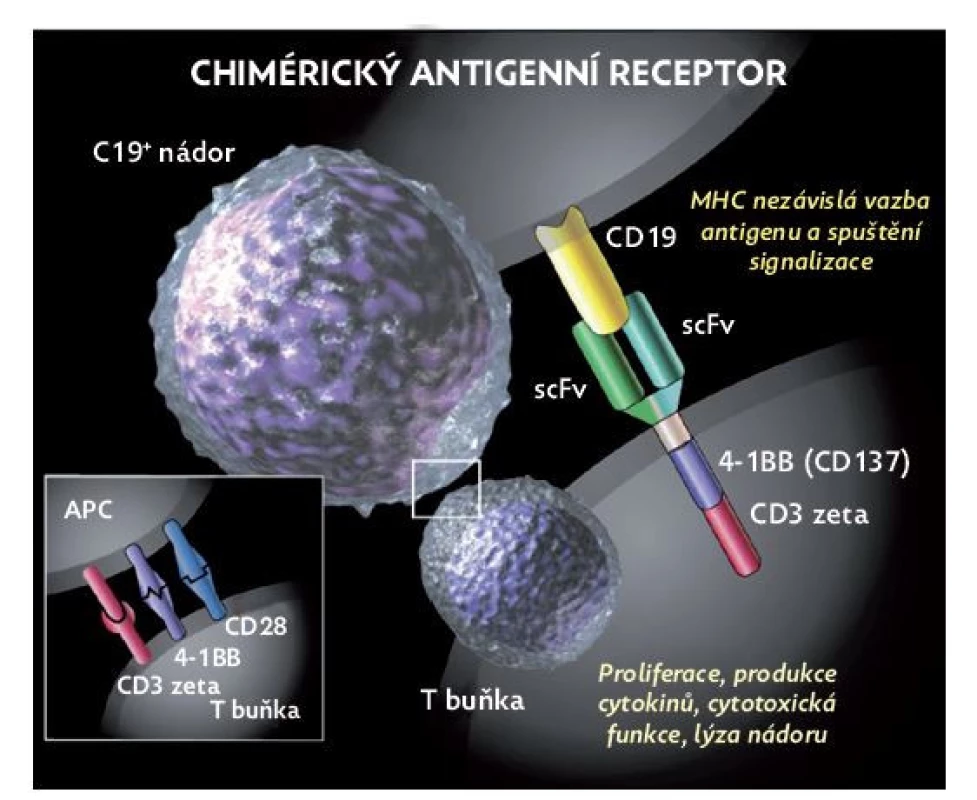
(upraveno dle Blood J 2015; 125: 4017–4023).
APC – antigen prezentující buňka.Tak byly CAR T lymfocyty zaměřené proti CD19 antigenu první, které byly v roce 2017 schváleny jak americkou, tak evropskou lékovou agenturou k léčbě rezistentní ALL u dětí a mladých dospělých. Velmi účinná aktivace T lymfocytů s sebou přinesla obdobný typ komplikací jako po podání blinatumomabu. Je to jak tzv. syndrom uvolnění cytokinů (CRS), tak neurotoxicita (ICANS – imunne cell associated neurotoxicity syndrome). Syndrom uvolnění cytokinů se projevuje horečkou, hypotenzí, hyposaturací a otoky, způsobuje systémovou zánětlivou reakci s poškozením endotelu s následným orgánovým postižením, jehož důsledkem může být multiorgánové selhání s úmrtím pacienta.(25–28) Neurotoxicita asociovaná s CAR T lymfocyty zahrnuje různé klinické projevy, kterými mohou být zmatenost, afázie, poruchy pozornosti, třes, ztráta paměti, frontální příznaky, meningismus, dysartrie, slabost, ataxie, myoklonus nebo křeče.(25–28) V některých případech dochází k hluboké poruše vědomí vyžadující mechanickou ventilaci. Léčebně se uplatňuje anti-IL-6 léčba a kortikosteroidy. Dlouhodobým známým nežádoucím účinkem je deplece nejen maligních, ale i zdravých B lymfocytů, z čehož vyplývá nutnost dlouhodobé substituce imunoglobulinů.
Prvním dětským pacientem z České republiky léčeným tímto způsobem byl 6letý pacient naší kliniky s rezistentním CNS relapsem ALL po alogenní transplantaci. Prognóza pacienta byla v této situaci infaustní. Díky mezinárodní spolupráci byl léčen v akademické klinické studii CD19 CAR T lymfocyty v roce 2015 v USA v NIH (National Institute of Health, Bethesda). Po léčbě CD19 CAR T lymfocyty dosáhl remise a manifestoval středně těžký CRS bez potřeby plicní ventilace, pacient žije v dlouhodobé remisi. V roce 2020 se otevřel program léčby CAR T lymfocyty pro dětské pacienty z ČR na našem pracovišti, a to díky procesu akreditace aferézy, zpracování autologních T lymfocytů a zkušenostem s léčbou relapsu ALL. Zatím bylo v tomto programu léčeno 6 pacientů s relabující ALL, všichni žijí, 3 podstoupili následnou transplantaci pro relaps nebo časnou ztrátu CAR T lymfocytů. Přes všechna úskalí otevírá použití CAR T lymfocytů další pole možností. Nejrozsáhlejší a nejpokročilejší výzkum se týká všech hematologických malignit, ale rychlým tempem se rozbíhají studie i u řady jiných nádorů (neuroblastom, glioblastom, rhabdomyosarkom atd.). Kromě využití autologních T lymfocytů se testuje i použití „univerzálních“ CAR T lymfocytů od dobrovolných dárců. Cena je zatím extrémně vysoká, ale lze předpokládat, že s rozvojem technologií bude klesat. U hematologických malignit má tato léčba potenciál nahradit v některých indikacích transplantaci hematopoetických kmenových buněk.
Daratumumab
Daratumumab je monoklonální humánní IgG1 protilátka cílená proti CD38 antigenu, je používána u pacientů s refrakterním mnohočetným myelomem. V posledních letech se zdá být nadějným přístupem pro léčbu rezistentní T-ALL v kombinaci s chemoterapií. T-ALL relabují obvykle časně a při relapsu jsou často významně chemorezistentní. Šance na vyléčení přes použití intenzivní chemoterapie a alogenní transplantace kostní dřeně se pohybuje kolem 10 %, spektrum dostupné cílené léčby je velmi omezené.
V roce 2018 byla publikována preklinická data, která prokazují výraznou expresi CD38 antigenu na T lymfoblastech a jeho stabilitu i po intenzivní chemoterapii a současně nízkou expresi na jiných normálních lymfoidních a myeloidních buňkách a v nehematopoetické tkáni.(29) I některé BCP ALL mají výraznou expresi CD38. V současné době probíhá několik studií fáze I/II u rezistentní BCP i T-ALL u dětí i dospělých, které testují daratumumab v monoterapii nebo v kombinaci s chemoterapií, a v následujících letech můžeme očekávat jejich výsledky. V České republice jsme zatím daratumumab použili u 4 pacientů s relapsem T-ALL v monoterapii nebo kombinaci s chemoterapií a u 1 pacienta s B-ALL, CD19 negat., kde nebylo možné použít anti-CD19 léčbu, u 3 pacientů jsme zaznamenali odpověď na léčbu.(30)
Ostatní cílené léky
Tyrosinkinázové inhibitory
Tyrosinkinázový inhibitor (TKI) imatinib byl vůbec prvním cíleným lékem použitým v onkologii. Je schopen zablokovat vazebné místo pro ATP v patologickém BCR::ABL proteinu a takto blokuje jeho konstitutivní tyrosinkinázovou aktivitu. Tento lék zásadním způsobem změnil osud pacientů s chronickou myeloidní leukemií (CML). Dříve používaná léčba dávala pacientům perspektivu několika let života, jedinou možnou kurativní léčbou byla transplantace hematopoetických kmenových buněk se všemi jejími riziky.
Vzhledem k tomuto efektu se začaly TKI využívat i u ALL s fúzním genem BCR::ABL nebo s jiným funkčně podobným fúzním genem (tzv. ABL class fúze). V dětském věku je tato skupina vzácná, představuje přibližně 3–5 % ALL. Léčba probíhá podle mezinárodního protokolu v kooperaci severoamerických a evropských zemí COG (Children Oncology Group) a EsPhALL (European intergroup study on post-induction treatment of Phpositive ALL). Tento protokol kombinuje intenzivní chemoterapii s tyrosinkinázovými inhibitory (TKI) podávanými od 15. dne chemoterapie kontinuálně po dobu 2 let. Tato kombinace intenzivní chemoterapie s TKI přinesla výrazné zlepšení výsledků léčby,(31) přestože je spojena s vyšším rizikem toxicity, a to zejména hematologické a jaterní. V době před érou TKI byli transplantováni všichni pacienti, kteří měli dostupného dárce a dosáhli remise, v současnosti transplantaci podstupují pouze pacienti s nedostatečnou odpovědí měřenou MRN, což snižuje rizika akutních a dlouhodobých komplikací.
V případě rezistence nebo intolerance na imatinib jsou v klinickém použití další generace TKI (dasatinib, nilotinib, bosutinib). I přes dosažený pokrok zůstává Ph pozitivní ALL s pravděpodobností 5letého přežití 70 % a vysokou toxicitou léčby jedním z prognosticky méně příznivých podtypů nemoci u dětí. Do nové léčebné studie bude zařazen blinatumomab při současném snížení intenzity chemoterapie.
Proteasomové inhibitory
Prvním používaným lékem v této skupině byl bortezomib, který byl již testován ve studiích u dětských relabujících ALL a v současné době probíhají další studie fáze III v primární léčbě i u relapsu. Dostupná data potvrzují nejen přijatelnou toxicitu, ale také zajímavý synergistický efekt bortezomibu v kombinaci s chemoterapií.(32,33) Bortezomib specificky inhibuje aktivitu proteasomu 26S reverzibilní kovalentní vazbou, tento velký proteinový komplex degraduje ubikvitinované proteiny. Systém ubikvitin–proteasom má klíčovou roli v regulaci proteinů, které ovlivňují buněčný cyklus, aktivaci transkripčních faktorů a apoptózu.(34,35) Je prokázáno, že bortezomib zvyšuje citlivost maligních hematopoetických buněk k chemoterapii.(36,37) Pravděpodobně je to ovlivněním poměru pro - a protiapoptotických proteinů a zvýšením senzitivity k apoptóze.(38) Roli bortezomibu ve zlepšení časné odpovědi na léčbu ověřujeme prospektivní randomizovanou akademickou studií.
BCL-2 inhibitory
Proteiny z BCL-2 rodiny patří k významným regulátorům apoptózy, mají antiapoptotický efekt a u řady nádorových buněk nacházíme jejich zvýšenou expresi. Venetoklax je perorální vysoce selektivní BCL-2 inhibitor, v současné době je již široce používán u dalších hematologických malignit, které se vyskytují výhradně nebo převážně u dospělých, jako je chronická lymfatická leukemie a akutní myeloidní leukemie. Po povzbudivých výsledcích u těchto onemocnění je nyní testován v monoterapii nebo v kombinaci s azacytidinem i u ALL, přes určitou gastrointestinální toxicitu (průjem, nevolnost) je dobře tolerován.(39) Další možností je kombinace s navitoklaxem (BCL-XL inhibitor), která je v počátcích testování.(40) Kombinaci venetoklaxu s azacytidinem jsme využili u 1 pacienta s rezistentní ALL, CD19 a CD22 negativní, kde nebylo možno použít dostupnou imunoterapii. Tato léčba byla zvolena na základě in vitro testování senzitivity nádorových buněk ve spolupráci se zahraniční laboratoří. Pacient dosáhl remise onemocnění a mohl podstoupit transplantaci hematopoetických kmenových buněk.
Vývoj dalších nových léků se zaměřuje také na inhibici patologicky aktivovaných kináz a onkoproteinů MEK inhibitory (selumetinib), m-TOR inhibitory (rapamycin, everolimus), JAK1/2 inhibitory (ruxolitinib), FLT3 inhibitory (lestaurtinib, midostaurin, sorafenib) nebo na ovlivnění transkripce: inhibitory histon-deacetyláz (vorinostat, panobinostat) a hypomethylační látky (azacytidin). Většina těchto léků je v současné době testována ve studiích fáze I/II.
Závěr
Akutní lymfoblastická leukemie u dětí je bezpochyby jedno z onemocnění, kde byl dosažen v posledních desetiletích převratný pokrok v šanci na trvalé vyléčení, přesto zůstává mnoho dětí, jejichž nemoc je za současných znalostí nevyléčitelná, a právě ty představují velkou výzvu pro klinický i laboratorní výzkum. Cílem je nalézt léky účinnější nebo minimálně stejně účinné, avšak s nižší akutní a dlouhodobou toxicitou. Pochopení biologie nádorové buňky a mechanismů její rezistence na léčbu je na této cestě klíčové a přináší již další viditelné zlepšení výsledků.
Korespondenční adresa:
doc. MUDr. Lucie Šrámková, Ph.D.
Klinika dětské hematologie a onkologie, 2. LF UK a FN Motol
V úvalu 84
150 06 Praha 5-Motol
Sources
1. Hunger SP, Mullighan CG. Acute lymphoblastic leukemia in children. N Engl J Med 2015; 373(16): 1541–1552. doi: 10.1056/NEJMra1400972.
2. Schmiegelow K, Attarbaschi A, Barzilai S, et al. Consensus definitions of 14 severe acute toxic effects for childhood lymphoblastic leukaemia treatment: a Delphi consensus. Lancet Oncol 2016; 17(6): e231–e239. doi: 10.1016/S1470-2045(16)30035-3.
3. Gruen A, Exner S, Kühl J-S, et al. Total body irradiation as part of conditioning regimens in childhood leukemia-long-term outcome, toxicity, and secondary malignancies. Strahlentherapie und Onkol Organ der Dtsch Rontgengesellschaft 2022; 198(1): 33–38. doi: 10.1007/s00066-021-01810-4.
4. Richards S, Pui C, Gayon P. Systematic Review and Meta-Analysis of Randomized Trials of Central Nervous System Directed Therapy for Childhood Acute Lymphoblastic Leukemia. 2013 : 185–195. doi: 10.1002/pbc.
5. Irving J, Enshaei A, Parker C, et al. Integration of genetic and clinical risk factors improves prognostication in relapsed childhood B-cell precursor acute lymphoblastic leukemia. Blood 2016; 128(7): 911–922. doi: 10.1182/ blood-2016-03-704973.
6. Den Boer ML, van Slegtenhorst M, De Menezes RX, et al. A subtype of childhood acute lymphoblastic leukaemia with poor treatment outcome: a genome-wide classification study. Lancet Oncol 2009; 10(2): 125–134. doi: 10.1016/S1470-2045(08)70339-5.
7. Roberts KG, Li Y, Payne-Turner D, et al. Targetable kinase-activating lesions in Ph-like acute lymphoblastic leukemia. N Engl J Med 2014; 371(11): 1005–1015. doi: 10.1056/NEJMoa1403088.
8. iu Y, Easton J, Shao Y, et al. The genomic landscape of pediatric and young adult T-lineage acute lymphoblastic leukemia. Nat Genet 2017; 49(8): 1211–1218. doi: 10.1038/ng.3909.
9. Richter-Pechańska P, Kunz JB, Hof J, et al. Identification of a genetically defined ultra-high-risk group in relapsed pediatric T lymphoblastic leukemia. Blood Cancer J 2017; 7(2). doi: 10.1038/bcj.2017.3
10. van Dongen JJ, Seriu T, Panzer-Grümayer ER, et al. Prognostic value of minimal residual disease in acute lymphoblastic leukaemia in childhood. Lancet (London, England) 1998; 352(9142): 1731–1738. doi: 10.1016/ S0140-6736(98)04058-6.
11. Conter V, Bartram CR, Valsecchi MG, et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia: results in 3184 patients of the AIEOP-BFM ALL 2000 study. Blood 2010; 115(16): 3206–3214. doi: 10.1182/blood-2009-10-248146.
12. Fronkova E, Mejstrikova E, Avigad S, et al. Minimal residual disease (MRD) analysis in the non-MRD-based ALL IC-BFM 2002 protocol for childhood ALL: Is it possible to avoid MRD testing? Leukemia 2008; 22(5): 989–997. doi: 10.1038/leu.2008.22.
13. Raponi S, Stefania De Propris M, Intoppa S, et al. Flow cytometric study of potential target antigens (CD19, CD20, CD22, CD33) for antibody-based immunotherapy in acute lymphoblastic leukemia: Analysis of 552 cases. Leuk Lymphoma 2011; 52(6): 1098–1107. doi: 10.3109/10428194.2011.559668.
14. Hoffmann P, Hofmeister R, Brischwein K, et al. Serial killing of tumor cells by cytotoxic T cells redirected with a CD19-/CD3-bispecific single-chain antibody construct. Int J Cancer 2005; 115(1): 98–104. doi: 10.1002/ ijc.20908.
15. Dreier T, Lorenczewski G, Brandl C, et al. Extremely potent, rapid and costimulation - independent cytotoxic T-cell response against lymphoma cells catalyzed by a single-chain bispecific antibody. Int J Cancer 2002; 100(6): 690–697. doi: 10.1002/ijc.10557.
16. Löffler A, Gruen M, Wuchter C, et al. Efficient elimination of chronic lymphocytic leukaemia B cells by autologous T cells with a bispecific anti-CD19/ anti-CD3 single-chain antibody construct. Leukemia 2003; 17(5): 900–909. doi: 10.1038/sj.leu.2402890.
17. Bargou R, Leo E, Zugmaier G, et al. Tumor regression in cancer patients by very low doses of a T cell-engaging antibody. Science 2008; 321(5891): 974–977. doi: 10.1126/science.1158545.
18. Topp MS, Gökbuget N, Stein AS, et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Oncol 2015; 16(1): 57–66. doi: 10.1016/S1470-2045(14) 71170-2.
19. Topp MS, Kufer P, Gökbuget N, et al. Targeted therapy with the T - -cell –Engaging antibody blinatumomab of chemotherapy-refractory minimal residual disease in B-lineage acute lymphoblastic leukemia patients results in high response rate and prolonged leukemia-free survival. J Clin Oncol 2011; 29(18): 2493–2498. doi: 10.1200/JCO.2010.32. 7270.
20. Von Stackelberg A, Locatelli F, Zugmaier G, et al. Phase I/Phase II study of blinatumomab in pediatric patients with relapsed/refractory acute lymphoblastic leukemia. J Clin Oncol 2016; 34(36). doi: 10.1200/ JCO.2016.67.3301.
21. Shah NN, Stevenson MS, Yuan CM, et al. Characterization of CD22 expression in acute lymphoblastic leukemia. Pediatr Blood Cancer 2015; 62(6): 964–969. doi: 10.1002/pbc.25410.
22. Kantarjian H, Thomas D, Jorgensen J, et al. Inotuzumab ozogamicin, an anti-CD22-calecheamicin conjugate, for refractory and relapsed acute lymphocytic leukaemia: A phase 2 study. Lancet Oncol 2012; 13(4): 403–411. doi: 10.1016/S1470-2045(11)70386-2.
23. Bhojwani D, Sposto R, Shah NN, et al. Inotuzumab ozogamicin in pediatric patients with relapsed/refractory acute lymphoblastic leukemia. Leukemia 2019; 33(4): 884–892. doi: 10.1038/s41375-018-0265-z.
24. Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med 2018; 378(5). doi: 10.1056/NEJMoa1709866.
25. Park JH, Rivière I, Gonen M, et al. Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. N Engl J Med 2018; 378(5): 449 - 459. doi: 10.1056/NEJMoa1709919.
26. Lee DW, Kochenderfer JN, Stetler-Stevenson M, et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: A phase 1 dose-escalation trial. Lancet 2015; 385(9967): 517-528. doi: 10.1016/S0140-6736(14)61403-3.
27. Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N Engl J Med 2013; 368(16): 1509-1518. doi: 10.1056/NEJMoa1215134.
28. Maude SL, Teachey DT, Porter DL, Grupp SA. CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia. Blood 2015; 125(26). doi: 10.1182/blood-2014-12-580068.
29. Bride KL, Vincent TL, Im SY , et al. Preclinical efficacy of daratumumab in T-cell acute lymphoblastic leukemia. Blood 2018; 131(9): 995–999. doi: 10.1182/blood-2017-07-794214.
30. Vakrmanová B, Nováková M, Říha P, et al. CD38: A target in relapsed/ refractory acute lymphoblastic leukemia-Limitations in treatment and diagnostics. Pediatr Blood Cancer 2022: e29779. doi: 10.1002/pbc. 29779.
31. Schultz KR, Carroll A, Heerema NA, et al. Long-term follow-up of imatinib in pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia: Children’s Oncology Group study AALL0031. Leukemia 2014; 28(7): 1467–1471. doi: 10.1038/leu.2014.30.
32. Horton TM, Pati D, Plon SE, et al. A phase 1 study of the proteasome inhibitor bortezomib in pediatric patients with refractory leukemia: A children’s oncology group study. Clin Cancer Res 2007; 13(5): 1516–1522. doi: 10.1158/1078-0432.CCR-06-2173.
33. Messinger YH, Gaynon PS, Sposto R, et al. Bortezomib with chemotherapy is highly active in advanced B-precursor acute lymphoblastic leukemia: Therapeutic Advances in Childhood Leukemia & Lymphoma (TACL ) Study. Blood 2012; 120(2): 285–290. doi: 10.1182/blood-2012-04 - 418640.
34. Bonvini P, Zorzi E, Basso G, Rosolen A. Bortezomib-mediated 26S proteasome inhibition causes cell-cycle arrest and induces apoptosis in CD-30+ anaplastic large cell lymphoma [16]. Leukemia 2007; 21(4): 838–842. doi: 10.1038/sj.leu.2404528.
35. Gelman JS, Sironi J, Berezniuk I, et al. Alterations of the Intracellular Peptidome in Response to the Proteasome Inhibitor Bortezomib. PLoS One 2013; 8(1). doi: 10.1371/journal.pone.0053263.
36. Junk S, Cario G, Wittner N, et al. Bortezomib treatment can overcome glucocorticoid resistance in childhood B-cell precursor acute lymphoblastic leukemia cell lines. Klin Padiatr 2015; 227(3): 123–130. doi: 10.1055/s - 0034-1398628.
37. Landis-Piwowar KR, Milacic V, Chen D, et al. The proteasome as a potential target for novel anticancer drugs and chemosensitizers. Drug Resist Updat 2006; 9(6): 263–273. doi: 10.1016/j.drup.2006.11.001.
38. Adams J. Preclinical and clinical evaluation of proteasome inhibitor PS-341 for the treatment of cancer. Curr Opin Chem Biol 2002; 6(4): 493–500.
39. Gibson A, Trabal A, McCall D, et al. Venetoclax for Children and Adolescents with Acute Lymphoblastic Leukemia and Lymphoblastic Lymphoma. Cancers (Basel) 2021; 14(1). doi: 10.3390/cancers14010150.
40. Pullarkat VA, Lacayo NJ, Jabbour E, et al. Venetoclax and Navitoclax in Combination with Chemotherapy in Patients with Relapsed or Refractory Acute Lymphoblastic Leukemia and Lymphoblastic Lymphoma. Cancer Discov 2021; 11(6): 1440–1453. doi: 10.1158/2159-8290.CD-20-1465.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 5-
All articles in this issue
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Století profesora Hrodka v dětské hematologii a onkologii
- Nové léčebné postupy v léčbě dětské akutní lymfoblastické leukemie
- Hodgkinův lymfom – minulost a současnost
- Transplantace kmenových buněk krvetvorby u dětí s dědičnými metabolickými poruchami a maligní infantilní osteopetrózou
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Závažné vrozené krvácivé poruchy s manifestací v novorozeneckém období – kazuistiky
- Nové možnosti echokardiografie v diagnostice subklinické formy kardiotoxicity jako následku léčby dětských onkologických onemocnění
- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Vrozené poruchy krevního srážení
- Historický rozhovor s legendou prof. MUDr. Otto Hrodek, DrSc. (1922–2022)
- Pediatrická poezie
- Jaterní infantilní hemangioendoteliom
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Vrozené poruchy krevního srážení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

