-
Medical journals
- Career
Syndrom diseminované intravaskulární koagulace u dětí
Authors: Mazánek Pavel; Blatný Jan
Authors‘ workplace: Oddělení dětské hematologie a biochemie, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno
Published in: Čes-slov Pediat 2022; 77 (5): 306-309.
Category: Chapters for Specialization in Pediatrics
doi: https://doi.org/10.55095/CSPediatrie2022/050Overview
Diseminovaná intravaskulární koagulace (DIK) je závažnou formou konsumpční koagulopatie. Jedná se o syndrom charakterizovaný nadměrnou intravaskulární aktivací koagulační kaskády, která vede jak ke krvácení, tak i tvorbě krevních sraženin. DIK je vždy sekundární proces způsobený celou řadu chorobných stavů (např. sepse, trauma, maligní onemocnění…), které zapříčiní prokoagulační nastavení organismu a následně i spuštění koagulační kaskády. Klinický obraz syndromu DIK je charakterizovaný krvácivou diatézou doprovázenou mikrovaskulární trombotizací a poškozením vnitřních orgánů, které může velmi rychle vyústit do multiorgánového selhání a smrti pacienta. Diagnóza probíhajícího syndromu DIK je založena na kombinaci klinických nálezů a abnormálních koagulačních testů. Vždy je nutné hodnotit dynamiku změn v laboratorních nálezech společně s měnícím se klinickým obrazem. Základem úspěšné léčby syndromu DIK je především včasné odhalení a odstranění primárního onemocnění, které dokázalo syndrom diseminované intravaskulární koagulace vyvolat. Podpůrná léčba při syndromu DIK se soustředí především na dodávku spotřebovaných krevních destiček a faktorů krevního srážení.
Klíčová slova:
krvácení – multiorgánové selhání – diseminovaná intravaskulární koagulace – konsumpční koagulopatie – trombocytopenie – mikrotrombotizace
Úvod
Diseminovaná intravaskulární koagulace (DIK) je získaný syndrom charakterizovaný nadměrnou intravaskulární (systémovou) aktivací koagulační kaskády, která vede jak ke krvácení, tak i tvorbě krevních sraženin. Syndrom diseminované intravaskulární koagulace může velmi rychle progredovat a vyústit do život ohrožujícího multiorgánového selhání. DIK je vždy sekundární proces, a proto základem úspěšné léčby syndromu DIK je především včasné odhalení primárního onemocnění, které dokázalo DIK vyvolat.
Patogeneze
Za fyziologických podmínek je v těle proces tvorby i odbourávání krevních sraženin velmi komplexně a přísně regulován. V případě DIK nadměrná aktivace koagulačního systému vede k rozvoji konsumpční koagulopatie a mikrovaskulární trombotizaci. DIK je vždy sekundární proces způsobený celou řadu chorobných stavů (např. sepse, trauma, maligní onemocnění), které zapříčiní poškození endoteliální tkáně, prokoagulační nastavení organismu a následně i spuštění koagulační kaskády.(1) Konečným produktem aktivované koagulační kaskády je fibrin. Při jeho neúměrné tvorbě dochází nejen ke zvýšené spotřebě faktorů krevního srážení a krevních destiček, zároveň je utlumen i systém přirozených inhibitorů krevního srážení a souběžně dochází i k aktivaci fibrinolýzy. Syndrom DIK je ve svém klinickém obraze pestrou mozaikou několika souběžně probíhajících procesů:
• Intravaskulární aktivace koagulace: při základním onemocnění se uvolní prokoagulační látky (např. lipopolysacharidy bakteriální stěny, fosfolipidy uvolněné z poškozeného cévního endotelu, fosfolipidy nebo tkáňové enzymy uvolněné při poranění nebo popáleninách) do krevního oběhu a dojde k intravaskulární aktivaci koagulační kaskády.
• Formace fibrinu v oběhu: tkáňové prokoagulační látky aktivují primární hemostázu interakcí s tkáňovým faktorem (TF) a faktorem VII (FVII), důsledkem je formace fibrinu v oběhu a jeho ukládání v mikrocirkulaci.
• Fibrinolýza: fibrin aktivuje fibrinolytickou kaskádu, jejímž finálním produktem je plasmin. Plasmin štěpí fibrinogen a fibrin na fibrin degradační produkty (FDP). FDP interferují s procesem polymerizace fibrinu a narušují také agregaci destiček.
• Konsumpce koagulačních faktorů a destiček při neustávající aktivaci koagulační kaskády.
• Hemolýza: intravaskulární vlákna fibrinu zapříčiňují mechanickou destrukci červených krvinek. Důsledkem je mikroangiopatická hemolytická anemie s možným mikroskopickým průkazem schistocytů v krevním obraze.
• Poškození vnitřních orgánů: depozita fibrinu a tvorba trombů v mikrovaskulatuře vnitřních orgánů vede ke tkáňové hypoxii, orgánovému poškození a při masivním postižení i k jejich selhání.
Výsledkem všech těchto dějů je typický klinický obraz DIK – krvácivá diatéza doprovázená mikrovaskulární trombotizací s poškozením vnitřních orgánů, které může vyústit v multiorgánové selhání.
Etiologie
Sepse je nejčastější příčinou DIK.(2) Typickým příkladem je meningokoková sepse, kde je DIK důsledkem masivního poškození endotelií při meningococcemii. DIK ale může provázet celou řadu jiných bakteriálních, virových, ricketsiových a mykotických infekcí. DIK byl popsán i v rámci multisystémové zánětlivé reakce u dětí asociované s covidem-19 (MIS-C).(3) DIK může být komplikací u traumat a popálenin, ale k rozvoji DIK může dojít i v důsledku hypotermie nebo úpalu. DIK může být asociován i s maligními onemocněními, nejen s akutní leukemií, ale i se solidními nádory.(4,5) DIK byl popsán i u pacientů s akutním i chronickým onemocněním jater, včetně Reyova syndromu,(6) při akutní hemolytické transfuzní reakci, po uštknutí hady nebo kousnutí exotickými pavouky.
DIK v novorozeneckém věku
Novorozenci jsou obzvláště zranitelnou skupinou dětí ohrožených rozvojem DIK. Rizikovými faktory pro rozvoj DIK v novorozeneckém věku jsou především prematurita, nízká porodní hmotnost a nízké Apgar skóre při porodu.(7) Je to dáno i tím, že hladiny přirozených inhibitorů krevního srážení (ATIII , protein C, protein S) jsou v novorozeneckém věku fyziologicky nižší ve srovnání se staršími dětmi a dospělými.( 8) U pacientů s homozygotní deficiencí proteinu C nebo S může nerovnováha mezi generací trombinu a fibrinolýzou vést ke klinickému obrazu purpura fulminans. V novorozeneckém věku mohou DIK spustit virové infekce (např. rubeola, cytomegalovirus, enteroviry), systémová kandidiáza i bakteriální sepse (hlavně infekce streptokoky skupiny B a gramnegativní bakterie). Kongenitální infekce (TORCH) mohou být také s DIK asociovány. Mimo infekce může být primárním onemocněním vedoucím k rozvoji DIK u novorozenců i perinatální asfyxie, hypotermie, syndrom respirační tísně novorozence (respiratory distress syndrome, RDS) a nekrotizující enterecolitis (NEC).
Klinická manifestace
Klinický obraz charakterizovaný krvácivou diatézou doprovázenou mikrovaskulární trombotizací a poškozením vnitřních orgánů se odvíjí od závažnosti syndromu DIK. U lehčích forem DIK se krvácivá diatéza projeví třeba jen jako prodloužené krvácení z místa venepunkce, u plně rozvinutého DIK může být jak extenzivní krvácení, tak i trombózy v oblasti ledvin, jater, plic, končetin a centrálního nervového systému. V kůži se DIK může projevit jako purpura a akrální gangréna (purpura fulminans). U novorozenců je nejčastějším místem krvácení trávicí trakt a místa po venepunkci,(9) u závažných případů může dojít i k intrapulmonálnímu nebo intraventrikulárnímu krvácení.
DIK se může někdy manifestovat i chronickou formou, kdy je, např. u maligních nádorových onemocnění, organismus vystaven dlouhodobé přítomnosti prokoagulačních látek uvolňovaných do oběhu. V případě chronického DIK ale kompenzační mechanismy namířené proti probíhající konsumpční koagulopatii většinou převáží koagulační rovnováhu ve prospěch krevního srážení a pacienti s chronickým DIK jsou více ohroženi trombotickými příhodami než krvácivými projevy.
Diagnostika
Diagnóza zjevně probíhajícího syndromu DIK je založena na kombinaci klinických nálezů (např. krvácení a/nebo trombóza či dysfunkce orgánů v důsledku vaskulární mikrotrombotizace při koexistenci primárního onemocnění predisponujícího ke vzniku DIK) a abnormálních koagulačních testů.
Základní panel vyšetření, který potvrdí možnost zjevně probíhajícího DIK u pacienta, musí vždy zahrnovat následující laboratorní vyšetření: kompletní krevní obraz včetně mikroskopického nátěru periferní krve, protrombinový čas (PT), aktivovaný parciální tromboplastinový čas (aPTT), vyšetření hladiny D-dimerů (DD) a fibrinogenu (Fbg). Pacient s DIK nemusí mít detekované laboratorní odchylky ve všech výše uvedených vyšetřeních, ani výrazná odchylka v jednotlivých vyšetřeních nemá dostatečnou senzitivitu a specificitu, aby diagnózu DIK pomohla jednoznačně stanovit.(10) V klinické praxi mají zásadní význam především testy poukazující na probíhající fibrinolýzu, např. stanovení D-dimerů. Spíše než jednotlivé abnormální nálezy podporující podezření na syndrom DIK je důležité zhodnocení dynamiky změn při opakovaných vyšetřeních krevního obrazu a koagulací. Při stanovení diagnózy syndromu DIK mohou být nápomocné i skórovací systémy, jakým je např. International Society on Thrombosis and Haemostasis (ISTH) skórovací systém (viz tab. 1). Vždy je nutné hodnotit dynamiku změn v laboratorních nálezech společně s klinickým obrazem.(11)
Table 1. International Society on Thrombosis and Haemostasis (ISTH) skórovací systém pro stanovení diagnózy syndromu DIK 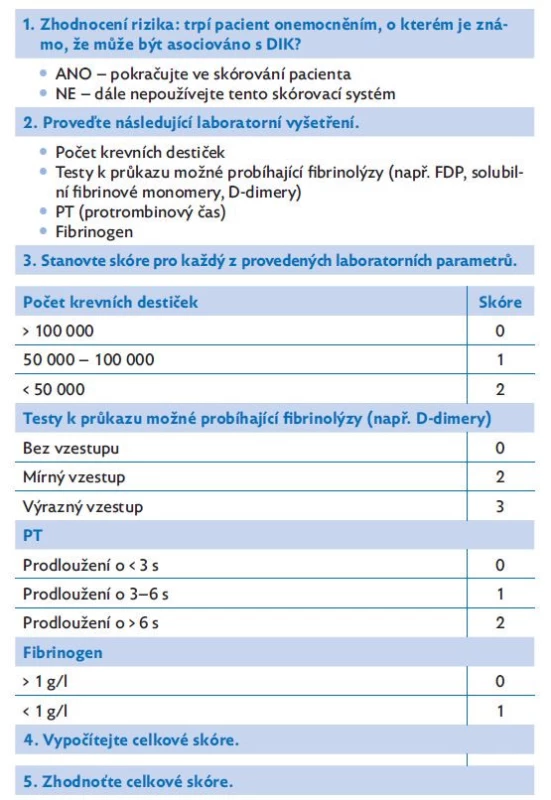
Skóre ≥ 5 – nálezy odpovídají zjevnému syndromu DIK, opakujte skórování denně
Skóre < 5 – neodpovídá zjevně probíhajícímu syndromu DIK, zopakujte za 1–2 dnyDiferenciální diagnostika
Diferenciální diagnostika syndromu DIK je široká. Pečlivá anamnéza, detailní zhodnocení klinického stavu a komplexní zhodnocení laboratorních vyšetření nás navede k jasnému odlišení DIK od ostatních patologických stavů spojených s krvácením, abnormálními koagulačními testy nebo trombocytopenií.
Jaterní selhání se v důsledku snížené syntetické funkce jater manifestuje snížením hladiny fibrinogenu, zvýšením PT i aPTT. Tyto nálezy mohu odpovídat i syndromu DIK, ale v rozlišení nám pomůže hladina krevních destiček, která je, až na terminální fázi jaterního selhání, normální. Diskriminační může být také vyšetření hladiny faktoru VIII, který je v případě DIK snížený, při jaterním selhání jsou jeho hladiny normální nebo zvýšené, protože jeho syntéza neprobíhá v játrech, ale zdrojem jeho syntézy jsou endoteliální buňky.
Deficit vitaminu K. Vitamin K je nezbytný pro tvorbu a správnou funkci faktorů krevního srážení II, VII, IX a X. Jeho nedostatek vede k prodloužení PT i aPTT podobně jako v případě syndromu DIK, ale diskriminační je opět normální počet krevních destiček. Hladina faktorů krevního srážení, které jsou na vitaminu K nezávislé, jako je faktor V a faktor VII, je normální, v případě DIK snížená.
Trombotické mikroangiopatie (TMA) jako trombotická trombocytopenická purpura (TTP) a hemolyticko-uremický syndrom (HUS) jsou spojeny s poklesem počtu krevních destiček a projevy mikroangiopatie pozorovatelnými mikroskopicky v nátěru periferní krve (schistocyty). Protože se v případě TMA nejedná ve své podstatě o konsumpční koagulopatii, koagulační časy (PT, aPTT) většinou nebývají prodloužené.
Imunitní trombocytopenie (ITP) je nejčastější příčinou nedostatku krevních destiček v dětském věku. Na rozdíl od DIK jsou ale děti s ITP většinou v dobrém klinickém stavu, bez závažnějších komorbidit a mají normální koagulační testy.
U novorozenců je v případě trombocytopenie nutné pomýšlet na aloimunní neonatální trombocytopenii, maternální idiopatickou trombocytopenii, možnou trombózu renální žíly a v neposlední řadě i na infekce.
Těžkou koagulopatii, někdy těžko odlišitelnou od DIK, může vyvolat i hypotermie nebo acidóza, případně kombinace obou těchto stavů. Při poklesu tělesné teploty o 1 °C dochází ke snížení aktivity prokoagulačních faktorů o 10 %, hypotermie pod 33 °C snižuje aktivitu většiny faktorů pod 33 %.(12)
Závažná je i diluční koagulopatie, která vzniká následkem volumové resuscitace při těžkém krvácení (např. při porodu, traumatu), kdy dojde ke snížení koncentrace přirozených složek krve vlivem aplikace velkého množství náhradních roztoků.(13)
Léčba
Syndrom diseminované intravaskulární koagulace je vždy sekundární proces, a proto základem úspěšné léčby je především včasné odhalení a odstranění primárního onemocnění, které dokázalo syndrom DIK vyvolat. Pokud i po zahájení léčby primárního onemocnění DIK přetrvává, tak se podpůrná léčba při syndromu DIK soustředí především na dodávku spotřebovaných krevních destiček (transfuze trombocytů – TAD ) a faktorů krevního srážení. Cílem substituční léčby není úplná normalizace laboratorních parametrů, ale stabilizace klinického stavu a zástava krvácení. Substituční léčba by měla usilovat o dosažení hladiny destiček alespoň 50 000 / μl a hladiny fibrinogenu > 1 g/l. K substituci faktorů krevního srážení se podávají koncentráty plazmatických proteinů (Octaplas), čerstvě mražená plazma – ČMP (angl. fresh frozen plasma – FFP) nebo fibrinogen.( 14) Koncentráty plazmatických proteinů (Octaplas) a ČMP jsou komplexní transfuzní přípravky, které slouží k dodávce jak prokoagulačních, tak antikoagulačních faktorů. Antikoagulační léčba hepariny (UHF; LMWH) není při léčbě DIK standardem, především z obavy ze zhoršení krvácivé diatézy. Heparin je potřeba použít především u pacientů s těžkou symptomatickou venózní nebo arteriální trombózou. Při probíhajícím syndromu DIK dochází i ke snížení hladiny přirozených inhibitorů krevního srážení (protein C – PC; antitrombin III – ATIII ).(15) I přesto, že podání ATIII a PC může napomoci v k normalizaci jejich plazmatických hladin a stabilizaci klinického stavu, jejich dodávka zatím není obecným standardem v substituční léčbě DIK.
Korespondenční adresa:
MUDr. Pavel Mazánek
Oddělení dětské hematologie a biochemie FN
Brno a LF MU
Černopolní 9
613 00 Brno
Sources
1. Levi M. Disseminated intravascular coagulation. Crit Care Med 2007; 35 : 2191.
2. Okamoto K. Sepsis and disseminated intravascular coagulation. J Intensive Care 2016; 4 : 23.
3. Asakura H. COVID-19 associated coagulopathy and disseminated intravascular coagulation. Int J Hematol 2020; 7 : 1–13.
4. Abshire TC, Gold SH, Odom LF, et al. The coagulopathy of childhood leukemia. Thrombin activation or primary fibrinolysis? Cancer 1990; 66 : 716.
5. Ribeiro RC, Pui CH. The clinical and biological correlates of coagulopathy in children with acute leukemia. J Clin Oncol 1986; 4 : 1212.
6. Pegelow C, Goldberg R, Turkel S, Powars D. Severe coagulation abnormalities in Reye syndrome. J Pediatr 1977; 91 : 413.
7. Woods WG, Luban NL, Hilgartner MW, Miller DR. Disseminated intravascular coagulation in the newborn. Am J Dis Child 1979; 133 : 44.
8. Andrew M, Paes B, Milner R, et al. Development of the human coagulation system in the full-term infant. Blood 1987; 70 : 165.
9. Buchanan GR. Coagulation disorders in the neonate. Pediatr Clin North Am 1986; 33 : 203.
10. Favaloro EJ. Laboratory testing in disseminated intravascular coagulation. Semin Thromb Hemost 2010; 36 : 458.
11. Penka M. Neonkologická hematologie. 2. vyd. Praha: Grada Publishing a.s. 2009.
12. Martini WZ. Coagulopathy by hypothermia and acidosis: mechanisms of trombin generatin and fibrinogen availability. J Trauma 2009; 67 : 202 – 209.
13. Coats TJ, Brasil E, Heron M, MacCallum PK. Impairment of coagulation by commonly used resuscitation fluids in human volunteers. Br Med J 2006; 23 : 846–849.
14. Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol 2009; 145 : 24.
15. Hanada T, Abe T, Takita H. Antithrombin III concentrates for treatment of disseminated intravascular coagulation in children. Am J Pediatr Hematol Oncol 1985; 7 : 3.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 5-
All articles in this issue
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Století profesora Hrodka v dětské hematologii a onkologii
- New therapeutic modalities in the treatment of childhood acute lymphoblastic leukemia
- Hodgkin lymphoma – history and current approach
- Hematopoietic stem cell transplantation in children with inborn errors of metabolism and malignant infantile osteopetrosis
- Algorithm for recognition a seriously ill child
- Severe congenital bleeding disorders manifesting in the neonatal period – case reports
- New possibilities of echocardiography in the diagnosis of the subclinical form of cardiotoxicity as a consequence of the treatment of children’s oncological diseases
- Hemorrhagic disease of the newborn caused by vitamin K deficiency
- Disseminated intravascular coagulation in children
- Inherited coagulation disorders
- Historický rozhovor s legendou prof. MUDr. Otto Hrodek, DrSc. (1922–2022)
- Pediatrická poezie
- Infantile hepatic hemangioendothelioma
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hemorrhagic disease of the newborn caused by vitamin K deficiency
- Disseminated intravascular coagulation in children
- Algorithm for recognition a seriously ill child
- Inherited coagulation disorders
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

