-
Medical journals
- Career
Hodgkinův lymfom – minulost a současnost
Authors: Čepelová Michaela
Authors‘ workplace: Klinika dětské hematologie a onkologie, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha
Published in: Čes-slov Pediat 2022; 77 (5): 272-275.
Category: Comprehensive Report
doi: https://doi.org/10.55095/CSPediatrie2022/043Overview
Hodgkinův lymfom je systémové lymfoproliferativní onemocnění, které představuje zhruba 10 % všech lymfomů a postihuje zpravidla děti starší 10 let. V posledních desetiletích došlo k významnému pokroku v porozumění biologii Hodgkinova lymfomu a v souvislosti s tím i ke zlepšení léčebných výsledků u tohoto onemocnění, kdy 5leté celkové přežití přesahuje 95 %. V současné době se stává stále důležitějším nalezení rovnováhy mezi efektivitou protinádorové léčby a jejími riziky, včetně pozdních nežádoucích účinků, které u dlouhodobě přeživších významně ovlivňují kvalitu jejich života.
Klíčová slova:
radioterapie – Hodgkinův lymfom – cílená léčba – chemoterapie
Lymfadenopatie byla v minulosti považována pouze za příznak jiných onemocnění a nikoli za samostatné onemocnění. Přesto již v roce 1666 popsal Marcello Malphigi onemocnění, které se projevovalo zduřením mízních uzlin. V roce 1832 popsal Thomas Hodgkin ve své publikaci On some morbid appearances of the absorbent glands and spleen detailně pitevní nálezy u 7 osob s nebolestivou lymfadenopatií a splenomegalií, léčených v Guyʼs Hospital v Londýně. Roku 1856 Samuel Wilks popsal podobné nálezy u svých nemocných v Guyʼs Hospital a následně ve své druhé práci Cases of enlargement of the lymphatic glands and spleen ve stejném roce pojmenoval toto onemocnění Hodgkinovou nemocí na počest svého předchůdce. Při revizi histologických nálezů z práce Thomase Hodgkina o více než 100 let později byla diagnóza Hodgkinova lymfomu potvrzena ve 3 případech, u ostatních nemocných se jednalo o non-hodgkinské lymfomy, tuberkulózu a syfilis. Carl Sternberg v roce 1898 a nezávisle na něm v roce 1902 Dorothy Reedová (On the Pathological Changes in Hodgkin Disease, with Especial Reference to it‘s Relation to Tuberculosis) popsali pro toto onemocnění charakteristické mnohojaderné maligní buňky, které se nyní nazývají buňky Reedové–Sternbergovy. Carl Sternberg považoval Hodgkinovu nemoc za formu tuberkulózy, zatímco Dorothy Reedová tento názor vyvrátila. Etiologie i patogeneze onemocnění i poté zůstávala nejasná, o původu Reedové–Sternbergových buněk byla vyslovena řada teorií. Teprve na počátku 21. století byl potvrzen jejich neoplastický charakter a původ ze zralých preapoptotických B lymfocytů germinálních center.(1) Dvou - a vícejaderné Reedové–Sternbergovy buňky vznikají z jednojaderných Hodgkinových buněk procesem nekompletní cytokineze. Hodgkinovy Reedové–Sternbergovy (HRS) buňky jsou unikátní jednak ztrátou exprese většiny znaků B lymfocytů, jednak svým nízkým počtem v nádorové tkáni, kde představují pouze 0,1 až 10 % všech přítomných buněk. HRS buňky prostřednictvím cytokinů atrahují do svého okolí řadu nenádorových buněčných elementů s následnou tvorbou reaktivního zánětlivého mikroprostředí, které přispívá k přežití HRS buněk a chrání je před cytotoxickým účinkem NK buněk a T lymfocytů.(2) Dosud nezodpovězenou otázkou zůstává, zda se u různých histologických podtypů klasické formy Hodgkinova lymfomu liší HRS buňky svými charakteristikami a stadiem diferenciace B lymfocytů, ze kterých pocházejí, a to především v souvislosti s překrývajícími se patologickými nálezy u primárního mediastinálního velkobuněčného lymfomu a podtypu nodulární sklerózy klasické formy Hodgkinova lymfomu.(3) Rozsah a proměnlivost genomických aberací u Hodgkinova lymfomu ukazuje na značnou genomickou nestabilitu HRS buněk a ztěžuje identifikaci patogeneticky relevantních alterací. Řada detekovaných genetických alterací má za následek konstituční aktivaci NFκB , která je pro toto onemocnění charakteristická.
První klasifikace Hodgkinovy nemoci byla vytvořena roku 1944 Jacksonem a Parkerem a byly rozlišovány 3 podtypy onemocnění: paragranulom, granulom a sarkom. Na konferenci v Rye roku 1966 byla přijata klasifikace na 4 podtypy: lymfocytární predominance, nodulární skleróza, smíšená buněčnost a podtyp chudý na lymfocyty. Tato klasifikace byla snadno použitelná a reprodukovatelná, korelovala s klinickými nálezy. Teprve po 28 letech, v souvislosti s novými objevy v oblasti molekulární biologie byla Hodgkinova nemoc přejmenována na Hodgkinův lymfom a v rámci REAL klasifikace byly rozlišeny dva hlavní typy onemocnění: nodulární lymfocytárně predominantní Hodgkinův lymfom (NLPHL) a klasická forma Hodgkinova lymfomu (CHL) se čtyřmi podtypy: nodulární skleróza, smíšená buněčnost, podtyp bohatý na lymfocyty a podtyp chudý na lymfocyty.
Základní principy stagingového systému u Hodgkinova lymfomu přijaté v minulém století zůstávají i v současné době v platnosti. Na konferenci v Rye roku 1966 byly dle histologických podtypů onemocnění určeny 4 prognostické skupiny. Na konferenci v Ann Arbor roku 1971 byl přijat systém 4 stadií dle rozsahu postižení uzlin na obou stranách bránice a postižení extralymfatických orgánů (obr. 1). Revize této klasifikace na jednání v Cotswolds roku 1988 umožnila hodnotit postižení podbráničních uzlin s využitím počítačové tomografie a zároveň bylo „bulky“ postižení zařazeno mezi rizikové faktory u tohoto onemocnění.
Image 1. Ann Arbor klasifikace 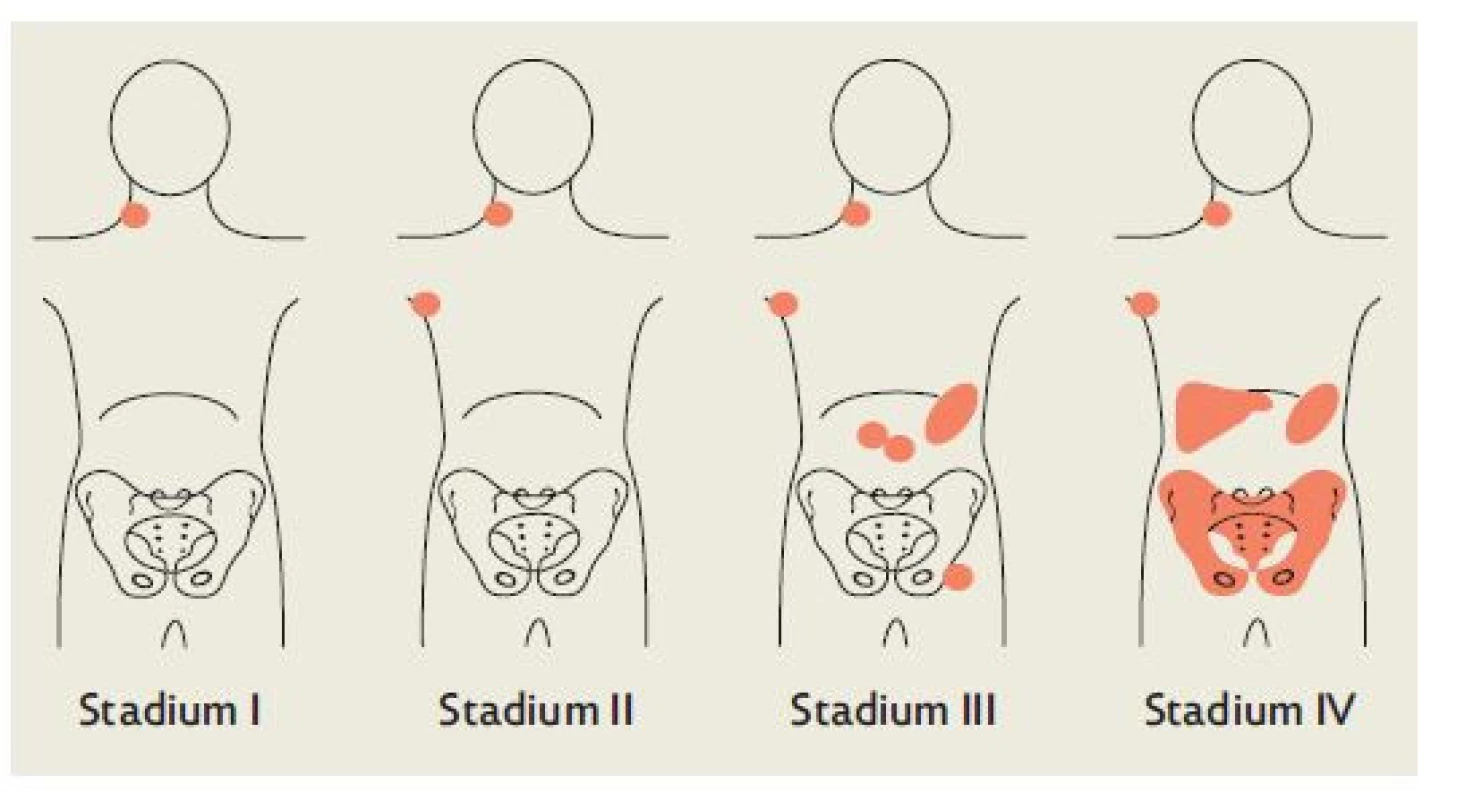
Základními zobrazovacími vyšetřeními byly zprvu předozadní a boční snímek hrudníku a ultrazvukové vyšetření dutiny břišní, následně byla prováděna počítačová tomografie (CT) hrudníku, břicha a pánve a bipedální lymfografie k posouzení strukturálních změn u nezvětšených paraaortálních a retroperitoneálních uzlin. V současnosti je základním stagingovým vyšetřením pozitronová emisní tomografie s podáním 18F-deoxyglukózy (FDG-PET) v kombinaci s počítačovou tomografií nebo magnetickou rezonancí. Senzitivita při detekci postižených oblastí je u FDG-PET uváděna v rozmezí 75–91 %.(4,5) Nenahraditelný význam má FDG-PET rovněž v hodnocení léčebné odpovědi.
Pokroky v diagnostice a znalosti biologie onemocnění vedly k pokroku v léčebných možnostech u tohoto onemocnění.
Léčebný efekt radioterapie u Hodgkinova lymfomu je znám od počátku dvacátého století, ale dosažené léčebné odpovědi byly často pouze částečné a krátce trvající.(6) Koncem 30. let navrhl francouzský radioterapeut Gilbert ozáření sousedních polí, což vedlo k určitému zlepšení léčebných výsledků. Ozařování rentgenem bylo provázeno častými nežádoucími účinky a jeho protinádorový účinek byl omezený. Zavedení vysokoenergetických zdrojů záření (betatron) a posléze využití gama záření z cesiového nebo kobaltového ozařovače umožnily dosažení lepšího léčebného efektu, a to prostřednictvím většího poměru hloubkové dávky k dávce povrchové. V počátcích léčby Hodgkinova lymfomu radioterapií byla standardem extended field radioterapie, kdy byla ozářena nejen postižená oblast, ale i ostatní lymfatické oblasti stejné části těla a dávky záření se pohybovaly kolem 40 Gy. V případě nadbráničního lymfatického systému (mantle field) se jednalo o krční, mediastinální a axilární uzliny, u podbráničního lymfatického systému (pole obráceného Y) se jednalo o paraaortální, ilické, tříselné a horní stehenní uzliny. Teprve koncem 20. století došlo vzhledem k závažným časným i pozdním nežádoucím účinkům radioterapie ke zmenšení velikosti ozařovacích polí – involved field radioterapie, spolu s redukcí dávky na 20 Gy bez negativního ovlivnění dosahovaných léčebných výsledků.(7) K další redukci velikosti ozařovaného pole dochází při aktuálně používané involved site radioterapii (obr. 2) a v souvislosti s vyšší dostupností přichází u řady nemocných v úvahu rovněž protonová radioterapie s cílem ochrany zdravých tkání, a to především srdce při radioterapii na oblast mediastina.
Image 2. Srovnání velikosti ozařovacích polí u extended field, involved field a involved site radioterapie 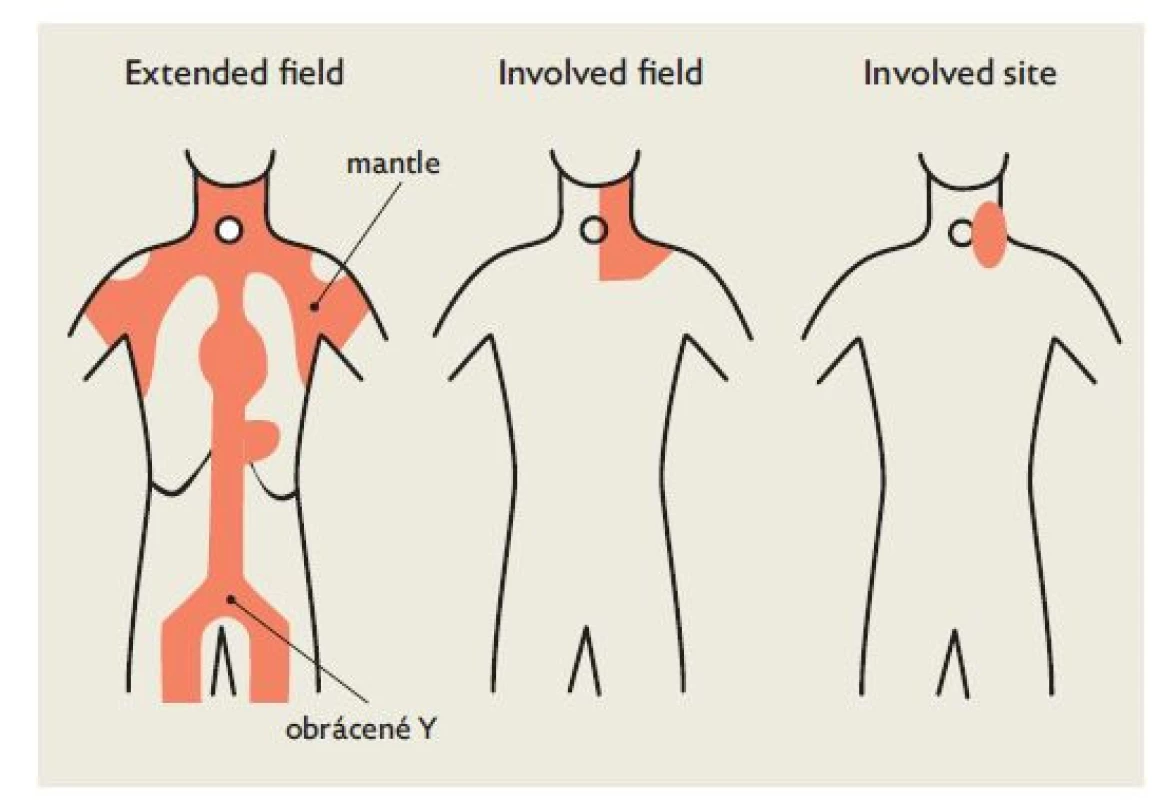
Ke změně v prognóze pacientů s Hodgkinovým lymfomem došlo po 2. světové válce podáním prvních cytostatik. Jednalo se nejprve o dusíkatý yperit, později cyklofosfamid a chlorambucil, koncem čtyřicátých let se začaly podávat kortikoidy a na počátku 60. let byly do praxe zavedeny vinka - alkaloidy. Zásadní zlom ale znamenalo zavedení kombinované chemoterapie. První kombinovanou chemoterapií u nemocných s Hodgkinovým lymfomem byl v roce 1964 režim MOPP (mustargen, vinkristin, prednison a prokarbazin), který se stal na mnoho let standardním léčebným postupem s dobrými léčebnými výsledky i u nemocných s pokročilým onemocněním. Po podání 6 až 8 cyklů chemoterapie MOPP bylo dosaženo kompletní remise onemocnění u 60 až 80 % nemocných a 10letého celkového přežití dosáhlo více než 50 % nemocných.(8) Na počátku 70. let 20. století se jako další režim začala používat kombinace ABVD (adriamycin, bleomycin, vinkristin a dakarbazin), která svými léčebnými výsledky překonala režim MOPP,(9) a je i v současné době standardním režimem první linie léčby u dospělých s časným stadiem klasické formy Hodgkinova lymfomu. Zavedení hematopoetických růstových faktorů do běžné praxe umožnilo plně využít protinádorový účinek cytostatických kombinací s omezením nežádoucích účinků souvisejících s granulocytopenií. V roce 1989 byl vytvořen režim Stanford V, zahrnující většinu agens použitých v režimu MOPP a ABVD. Jedná se o 12týdenní dávkově intenzivní režim střídající myelosupresivní (mustargen, doxorubicin, vinblastin, etoposid) a nemyelosupresivní cykly (vinkristin, bleomycin) v týdenních intervalech s velmi dobrými výsledky při snížení kumulativní dávky podaného doxorubicinu a bleomycinu.(10) Zhruba ve stejném období přichází German Hodgkin Study Group (GHSG) s novým režimem BEACOPP, standardním pro časná stadia, a rovněž dávkově eskalovaným režimem pro intermediární a pokročilá stadia Hodgkinova lymfomu (bleomycin, etoposid, doxorubicin, cyklofosfamid, vinkristin, prokarbazin a prednison).(11)
Klasická forma Hodgkinova lymfomu u dětí a dospělých je v současnosti jedním z nádorových onemocnění s nejlepší prognózou, 5leté celkové přežití přesahuje 90 %. U dlouhodobě přeživších je však významně zvýšeno riziko sekundárních malignit, kardiovaskulárních onemocnění, endokrinopatií a poruch plodnosti s nezanedbatelnou morbiditou a časnou mortalitou (obr. 3). Hlavní pozornost je proto nyní věnována možnosti individuální optimalizace léčby s vyvarováním se nedostatečné nebo naopak nadměrné léčby. Cílem je, aby nemocní, rozdělení do podskupin dle rozsahu onemocnění a dalších prognostických kritérií, dosahovali po odpovídajícím, ale zároveň minimálním rozsahu léčby stejných dlouhodobých léčebných výsledků.
Image 3. Kumulativní celková mortalita u dlouhodobě přeživších po léčbě Hodgkinova lymfomu v dětském věku 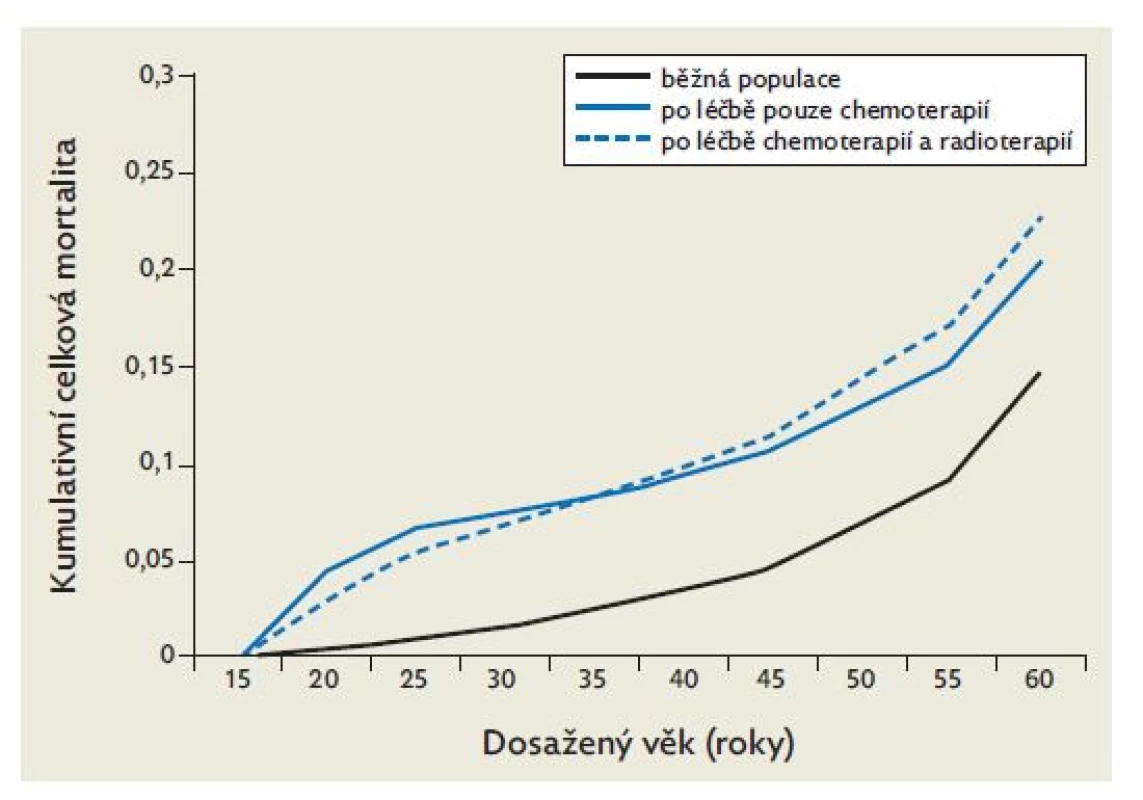
(upraveno dle Yeh JM, Diller L. Pediatric Hodgkin lymphoma: trade-offs between shortand long-term mortality risks. Blood 2012; 120(11): 2195–202.) European Network of Pediatric Hodgkin Lymphoma (EuroNet - PHL) se od roku 2004 zabývá optimalizací léčby u dětí a dospívajících s Hodgkinovým lymfomem. Standardem léčby je kombinovaná chemoterapie, která zahrnuje alkylační cytostatika (cyklofosfamid, dakarbazin), vinka-alkaloidy (vinkristin), antracyklinová antibiotika (doxorubicin) a kortikoidy. V rámci studie EuroNet-PHL-C1 byla u nemocných dle rozsahu postižení, přítomnosti B symptomů rozlišována časná, intermediární a pokročilá stadia Hodgkinova lymfomu. U všech nemocných byly podány dva intenzivní indukční cykly chemoterapie OEPA (vinkristin, etoposid, prednison a doxorubicin), u intermediárních a pokročilých stadií dva, resp. čtyři cykly konsolidační chemoterapie (COPDAC vs. COPP – vinkristin, cyklofosfamid, prednison, dakarbazin vs. prokarbazin). Zatímco v minulosti byla v návaznosti na chemoterapii standardem léčba radioterapií u všech nemocných s Hodgkinovým lymfomem, v rámci této studie byla radioterapie indikována pouze v případě nedostatečné časné léčebné odpovědi po dvou iniciálních indukčních cyklech chemoterapie, tj. při nedosažení parciální remise onemocnění (zmenšení postižených uzlin o méně než 50 %) a při přetrvávání zvýšené akumulace radiofarmaka v iniciálně postižených uzlinách (Deauville 3, 4 a 5). Výsledky studie EuroNet-PHL-C1 ukazují, že u většiny nemocných s dobrou citlivostí onemocnění na podávanou chemoterapii je možné se obejít bez ozáření původně postižených uzlin při zachování velmi dobrých léčebných výsledků a předpokládaném významném snížení rizika pozdních následků.(12) V rámci studie EuroNet-PHL-C1 nebylo nutné indikovat radioterapii u 40 % nemocných s intermediárními a pokročilými stadii onemocnění při zachování 5letého event-free survival nad 90 %, což vzhledem k rozsahu ozařovacích polí u těchto osob znamená významný benefit z dlouhodobého hlediska. Na tuto studii navázala studie EuroNet-PHL-C2 s podobným designem. K přesnějšímu zařazení nemocných do terapeutických úrovní byly v této studii využity navíc některé již dříve známé rizikové faktory (sedimentace erytrocytů nad 30 mm/h, „bulky“ postižení a přítomnost E lézí). Po pečlivém vyhodnocení předchozí studie EuroNet-PHl-C1 bylo přistoupeno rovněž ke změně PET kritéria při hodnocení časné léčebné odpovědi, kdy je za pozitivní nález považována pouze významně zvýšená perzistující akumulace v iniciálně postižených oblastech (Deauville 4 a 5).
U nemocných s relabujícím nebo refrakterním onemocněním cHL je podávána chemoterapie 2. volby, kdy se používají režimy založené na podávání cisplatiny nebo gemcitabinu, často s následnou konsolidací vysokodávkovanou chemoterapií s podporou autologních krvetvorných buněk (ASCT). U opakovaně relabujícího onemocnění po autologní transplantaci krvetvorných buněk se v případě chemosenzitivního onemocnění vzácně indikuje i alogenní transplantace krvetvorných buněk.(13)
Znalost interakcí v rámci nádorového mikroprostředí Hodgkinova lymfomu vedla k rozvoji cílené léčby. V současné době jsou k dispozici nové léčebné možnosti využívající monoklonální protilátky s navázaným cytostatikem (brentuximab vedotin – anti-CD30 protilátka s navázaným monomethylauristatinem) nebo imunoterapie za použití tzv. checkpoint inhibitorů namířených proti povrchovému PD-1 receptoru na HRS buňkách či jeho ligandu PD-L1, které blokují mechanismy bránící aktivaci T lymfocytů. Podávání brentuximab vedotinu je indikováno v léčbě 3. volby při relapsu onemocnění po autologní transplantaci kostní dřeně a rovněž jako udržovací léčba po autologní transplantaci u vysoce rizikových nemocných. V současnosti rovněž probíhají klinické studie se zařazením checkpoint inhibitorů do 1. linie léčby u vysoce rizikových nemocných s pokročilým onemocněním a nedostatečnou časnou léčebnou odpovědí. U těchto nemocných by jejich přidání ke konsolidační chemoterapii opět mohlo redukovat nutnost následné radioterapie.
NLPHL byl v minulosti léčen stejnými postupy jako CHL. V současnosti je u dětí a dospívajících s NLPHL při lokalizovaném postižení a možnosti operačního odstranění postižených uzlin bez rizika poškození okolních tkání považován operační výkon za dostatečný léčebný postup a pacienti jsou dále jen sledováni bez nutnosti jiné léčby. Není-li operační odstranění možné, jsou pacienti léčeni třemi cykly nízce intenzivní chemoterapie v kombinaci cyklofosfamid, vinkristin, prednison po dobu 9 týdnů.(14) Při výjimečně se vyskytujícím pokročilém NLPHL je indikována léčba jako u pokročilého stadia klasické formy Hodgkinova lymfomu. Radioterapie je u dětí a dospívajících s NLPHL indikována zcela výjimečně u opakovaně relabujícího onemocnění.
Korespondenční adresa:
MUDr. Michaela Čepelová, Ph.D.
Klinika dětské hematologie a onkologie 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Sources
1. Kanzler H, Küppers R, Hansmann ML, et al. Hodgkin’s and Reed–Sternberg cells in Hodgkin’s disease represent the outgrowth of a dominant tumor clone derived from (crippled) germinal center B cells. J Exp Med 1996; 184 : 1495–505.
2. Bräuninger A, Schmitz R, Bechtel D, et al. Molecular biology of Hodgkin’s and Reed/Sternberg cells in Hodgkin’s lymphoma. Int J Cancer 2006; 118(8): 1853–61. doi: 10.1002/ijc.21716.
3. Savage KJ, Monti S, Kutok JL, et al. The molecular signature of mediastinal large B-cell lymphoma differs from that of other diffuse large B-cell lymphomas and shares features with classical Hodgkin lymphoma. Blood 2003; 102(12): 3871–9. doi: 10.1182/blood-2003-06-1841.
4. Jerusalem G, Beguin Y, Fassotte MF, et al. Whole-body positron emission tomography using 18F-fluorodeoxyglucose compared to standard procedures for staging patients with Hodgkin’s disease. Haematologica 2001; 86(3): 266–73. PMID: 11255273.
5. Bangerter M, Moog F, Buchmann I, et al. Whole-body 2-[18F]-fluoro - -2-deoxy-D-glucose positron emission tomography (FDG-PET) for accurate staging of Hodgkin’s disease. Ann Oncol 1998; 9(10): 1117–22. doi: 10.1023/a:1008486928190.
6. Pusey WA. Cases of sarcoma and Hodgkin’s disease treated by exposure to X-rays: preliminary report. J Am Med Assoc 1902; 38 : 166–169.
7. Engert A, Schiller P, Josting A, et al. German Hodgkin’s Lymphoma Study Group. Involved-field radiotherapy is equally effective and less toxic compared with extended-field radiotherapy after four cycles of chemotherapy in patients with early-stage unfavorable Hodgkin’s lymphoma: results of the HD8 trial of the German Hodgkin’s Lymphoma Study Group. J Clin Oncol 2003; 21(19): 3601–8. doi: 10.1200/JCO.2003.03.023.
8. Devita Jr VT, Serpick AA, Carbone PP. Combination chemotherapy in the treatment of advanced Hodgkin’s disease. Ann Intern Med 1970; 73 : 881 – 895. doi: 10.7326/0003-4819-73-6-881.
9. Bonadonna G, Valagussa P, Santoro A, et al. Hodgkin’s disease: the Milan Cancer Instituteexperience with MOPP and ABVD. Recent Res Cancer Res. 1989; 117 : 169–74. doi: 10.1007/978-3-642-83781-4_17.
10. Horning SJ, Hoppe RT, Breslin S, et al. Stanford V and radiotherapy for locally extensive and advanced Hodgkin’s disease: mature results of a prospective clinical trial. J Clin Oncol 2002; 20(3): 630–7. doi: 10.1200/ JCO.2002.20.3.630.
11. Engert A, Diehl V, Franklin J, et al. Escalated-dose BEACOPP in the treatment of patients with advanced-stage Hodgkin’s lymphoma: 10 years of follow-up of the GHSG HD9 study. J Clin Oncol 2009; 27(27): 4548–54. doi: 10.1200/JCO.2008.19.8820.
12. Mauz-Körholz C, Landman-Parker J, Balwierz W, et al. Response-adapted omission of radiotherapy and comparison of consolidation chemotherapy in children and adolescents with intermediate-stage and advanced-stage classical Hodgkin lymphoma (EuroNet-PHL-C1): a titration study with an open-label, embedded, multinational, non-inferiority, randomised controlled trial. Lancet Oncol 2022; 23(1): 125–137. doi: 10.1016/S1470 - 2045(21)00470-8.
13. Daw S, Hasenclever D, Mascarin M, et al. Risk and Response Adapted Treatment Guidelines for Managing First Relapsed and Refractory Classical Hodgkin Lymphoma in Children and Young People. Recommendations from the EuroNet Pediatric Hodgkin Lymphoma Group. Hemasphere 2020; 4(1): e329. doi: 10.1097/HS9.0000000000000329.
14. Shankar A, Hall GW, Gorde-Grosjean S, et al. Treatment outcome after low intensity chemotherapy [CVP] in children and adolescents with early stage nodular lymphocyte predominant Hodgkin‘s lymphoma – an Anglo-French collaborative report. Eur J Cancer 2012; 48(11): 1700–6. doi: 10.1016/j.ejca.2011.10.018.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 5-
All articles in this issue
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Století profesora Hrodka v dětské hematologii a onkologii
- Nové léčebné postupy v léčbě dětské akutní lymfoblastické leukemie
- Hodgkinův lymfom – minulost a současnost
- Transplantace kmenových buněk krvetvorby u dětí s dědičnými metabolickými poruchami a maligní infantilní osteopetrózou
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Závažné vrozené krvácivé poruchy s manifestací v novorozeneckém období – kazuistiky
- Nové možnosti echokardiografie v diagnostice subklinické formy kardiotoxicity jako následku léčby dětských onkologických onemocnění
- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Vrozené poruchy krevního srážení
- Historický rozhovor s legendou prof. MUDr. Otto Hrodek, DrSc. (1922–2022)
- Pediatrická poezie
- Jaterní infantilní hemangioendoteliom
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Vrozené poruchy krevního srážení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

