-
Medical journals
- Career
Cytogenetika akútnych leukémií u detí
Authors: D. Ilenčíková
Authors‘ workplace: 2. detská klinika LFUK a DFNsP, Bratislava, prednosta prof. MUDr. L. Kovács, DrSc., MPH
Published in: Čes-slov Pediat 2015; 70 (2): 93-98.
Category: Acute leukemias in children
Overview
Detské akútne leukémie sú charakterizované rekurentnými numerickými a štruktúrovými chromozómovými aberáciami, ktoré sú špecificky asociované s diagnózou a prognózou detskej akútnej lymfoblastickej leukémie (ALL) ako aj akútnej myeloidnej leukémie (AML). Identifikácia chromozomálnych aberácií je klinicky mimoriadne dôležitá, nakoľko v onkologickej praxi slúži k zaradeniu pacientov do rizikových skupín. Existuje však nemalá skupina pacientov, u ktorých nie je možné identifikovať žiaden cytogenetický marker, a to práve kvôli nízkemu rozlíšeniu metód používaných v bežnej rutinnej laboratórnej praxi.
Tento článok poskytuje aktuálny prehľad klinicky významných chromozómových aberácií u detských ALL a AML, ako súčasných technológií používaných pre ich vyšetrenie.Kľúčové slová:
cytogenetická analýza, akútna lymfoblastická leukémia, akútna myeloidná leukémiaÚvod
Detské leukémie predstavujú geneticky a biologicky heterogénne ochorenia, asociované so širokým spektrom genetických faktorov, ktoré zohrávajú úlohu v epidemiológii, v zaradení pacientov do rizikových skupín a v rozhodovaní o liečbe. Cytogenetická analýza umožňuje identifikovať špecifické translokácie asociované s určitým podtypom leukémie, čím významne slúži precíznej diagnostike ochorenia. Súčasne prispieva k identifikácii génov zapojených do chromozómovej prestavby a vedie k lepšiemu pochopeniu mechanizmu leukemogenézy. Tým, že cytogenetická analýza umôžňuje detekovať mnohé chromozómové a genetické abnormality, poskytuje pohľad na heterogenitu celej bunkovej populácie. V tejto práci sa budem bližšie venovať jednotlivým chromozómovým aberáciám v pohľade na prognostický význam pre ALL ako aj AML u detských pacientov.
Metódy využívané v klasickej a molekulárnej cytogenetike
Cytogenetika, ktorá prispela k dnešnému chápaniu rakoviny, sa vyvíjala viac než štyri dekády a môže byť rozdelená do štyroch ér. Prvá éra sa začala úspešnou in vitro chromozómovou kultiváciou a identifikáciou správneho počtu chromozómov. Neskôr prišla prúžkovacia éra, ktorá umožnila klasifikáciu chromozómov použitím techník na farbenie vysoko rozlišovacích prúžkov. Prevrat v našom chápaní nádorovej genetiky spôsobila metóda FISH (fluorescenčná in vitro hybridizácia) a jej rôzne modifikácie. Teraz sa nachádzame vo štvrtej alebo tzv. genomickej ére vysoko-rozlišovacích genomických microarrayov a arrayovej komparatívnej genomickej hybridizácie (aCGH) (tab. 1) [1]. Všetky tieto metodiky prispievajú k stále presnejšiemu stanoveniu malígneho klonu a k definovaniu diagnózy, indikácii prognózy, asistujú pri výbere liečby, monitoringu odpovede na liečbu a podporujú ďalší výskum.
Table 1. Prehľad a porovnanie metód konvenčnej a molekulovej cytogenetiky. 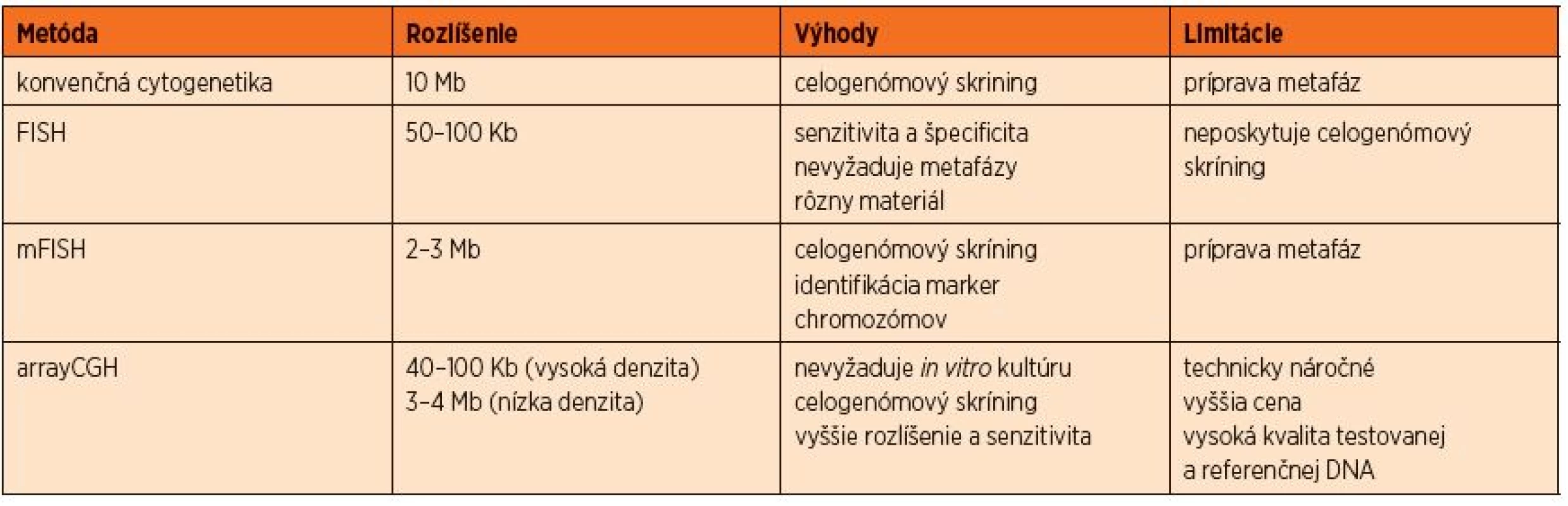
Numerické a štruktúrové chromozómové aberácie
Numerické abnormality môžu zahŕňať celú sadu chromozómov, čo má za následok ploidné zmeny, tj. zisk alebo stratu jednotlivých chromozómov (aneuploídia) (obr. 1) [1]. Vyšetrovanie ploídie je z prognostického hľadiska nevyhnutné hlavne u ALL pacientov [2].
Image 1. Ženský karyotyp 46, X, -X, +3, +8 použitím G-bandu (Odd. lekárskej genetiky, NOÚ, Bratislava). 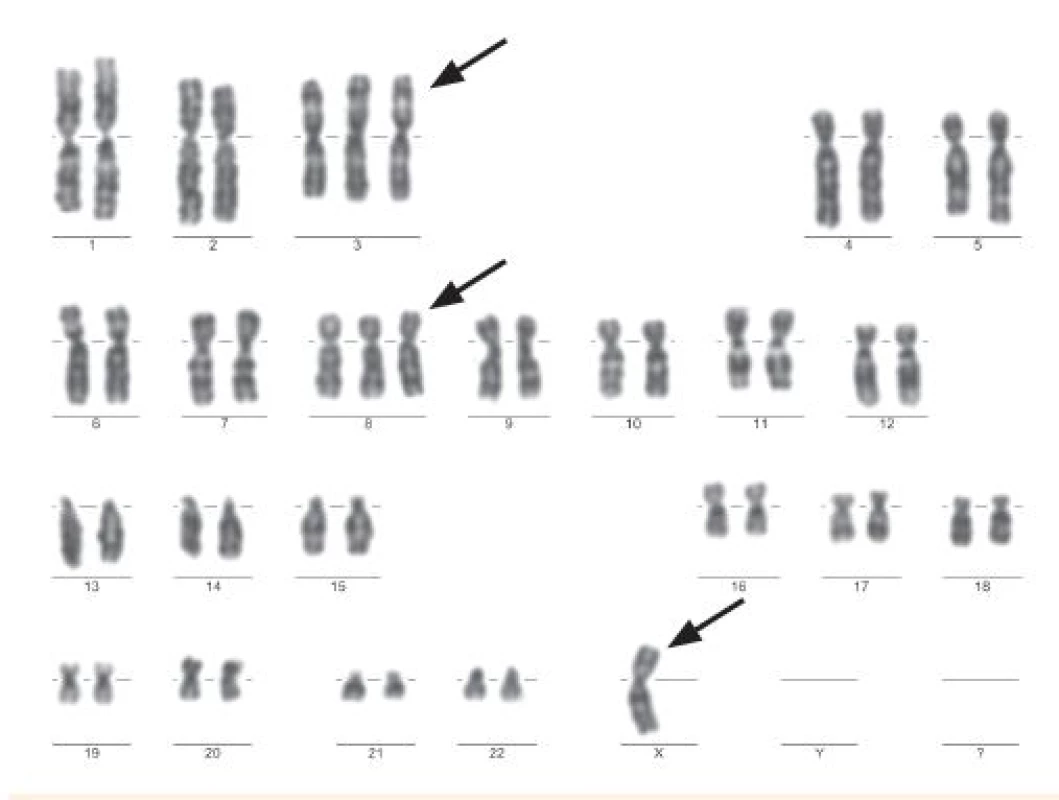
Medzi štruktúrové aberácie patria chromozómové translokácie, delécie, inzercie a inverzie. Môžu byť vyvážené alebo nevyvážené. Nevyvážené prestavby vedú k zmenám v počte kópií a teda k patológii [1].
1. A. Numerické aberácie u detskej ALL
Hyperdiploídia a hypodiploídia
Vysoká hyperdiploídia (51 až 67 chromozómov alebo index DNA >1,16), sa nachádza u 25 až 30 % pacientov s detskou B-bunkovou ALL (B-ALL), zatiaľ čo u T-bunkovej ALL (T-ALL) je len veľmi zriedkavá [1, 3, 4]. Za normálnych okolností majú deti s hyperdiploídiou veľmi dobré prežívanie [1, 5]. Významný indikátor pre dobrú prognózu je nález trizómie 4, 10 a 17. Frekvencia nálezu týchto chromozómov v klone s vysokou hyperdiploídiou je v skupine detí vo veku od 1–14 rokov vyššia (16,6 %) ako u v skupine adolescentov a mladých dospelých (8,5 %) (tab. 2) [8].
Table 2. Výskyt numerických aberácií u detí s B-bunkovou ALL [8]. ![Výskyt numerických aberácií u detí s B-bunkovou ALL [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8c7b132c5b4af7ca063a7ca8a91466f3.jpg)
Okrem toho, približne 50 % detí s vysokou hyperdiploídiou má štrukturové chromozómové aberácie, predovšetkým chromozómové zisky [3]. Deti s hyperdiploídiou majú tendenciu mať viacero faktorov spojených s priaznivou prognózou, vrátane veku (od 2 do 10 rokov), počet leukocytov <10 000 x 106/L, L1 morfologický typ a pre-B fenotyp [7]. Na vyšetrenie hyperdiploídie sa najčastejšie používa metóda konvenčnej cytogenetiky (obr. 1), arrayovej komparatívnej genomickej hybridizácie (aCGH) (obr. 2) a fluorescenčnej in situ hybridizácie (FISH) a prietokovej cytometrie. Všetky poskytujú spoľahlivú detekciu hyper - ako aj hypodiploídie [10].
Image 2. Molekulárny karyotyping pomocou metódy array CGH. Metódou môžeme určiť či už (1) zisky, ako na chromozóme 3, alebo (2) delécie, ako na chromozóme č. 8, ako aj (3) zisk - trizómiu celého chromozómu (Odd. lekárskej genetiky, NOÚ, Bratislava) 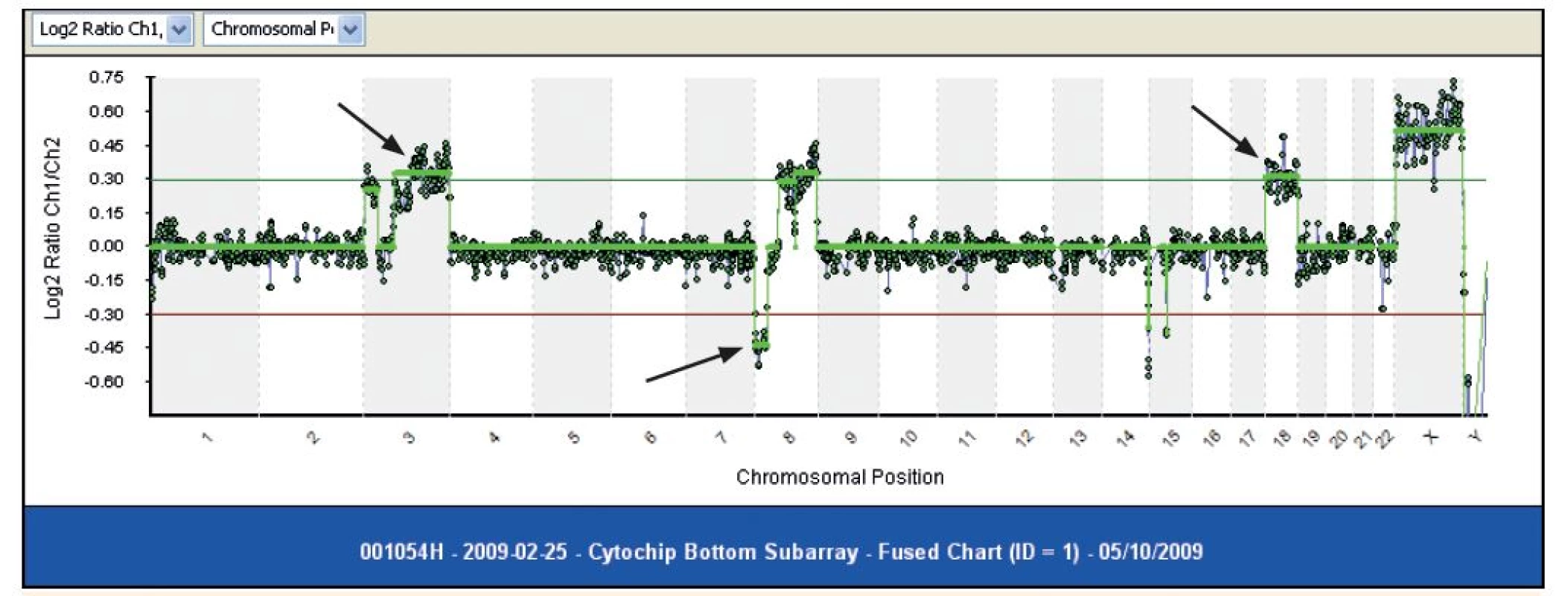
Nízka hyperdiploídia je odlišná od vysokej v pohľade na obraz chromozómových zmien v karyotype a v klinických prejavoch. U takmer 75 % detských ALL prípadov sa vyskytujú štruktúrové abnormality [10]. Nízka hyperdiploídia u ALL (47–50 chromozómov) sa vyskytuje u detí vo veku 1–14 rokov s rovnakou frekvenciou ako u adolescentov a mladých dospelých vo veku 15–30 rokov (10–15 %) [8]. Ich prognóza je závislá od prítomnosti štruktúrových aberácií. Pacienti bez rekurentných aberácií majú intermediárnu prognózu [8, 9].
Hypodiploídia
Karyotypy s <46 chromozómami sú klasifikované ako hypodiploidné a sú prítomné u približne 7 % detských ALL prípadov [7, 10]. Tieto deti majú horšie prežívanie. Prevažná väčšina pacientov so 45 chromozómami má priaznivé prežívanie v porovnaní s pacientmi s menej ako 45 chromozómami [2, 5, 6, 8, 9, 10]. Klony so 44 a menej chromozómami sa vyskytujú zriedkavejšie u detskej ALL, tvoria u 1–14-ročných detí <1,7 % prípadov a u adolescentov a mladých dospelých vo veku 15–30 rokov 2,3 % [8]. Takmer 90 % pacientov s klonovým vývojom so 40–43 chromozómami má štruktúrové aberácie a majú zlé prežívanie [6, 8, 9].
Karyotyp s 23–29 chromozómami predstavuje vzor chromozómov blízky haploídii. Pacienti s takýmto karyotypom sú vzácni, s prevalenciou 0,7 až 2,4 % prípadov [5] a majú obyčajne nepriaznivú prognózu s mediánom prežívania 11 mesiacov [4, 8, 9].
1. B. Štruktúrové aberácie u ALL
TEL/AML1
TEL/AML1 známa aj ako ETV6/RUNX1, predstavuje jednu z najčastejších translokácií u detských B-ALL, s prevalenciou 20 až 25 % prípadov [19]. Prognóza pacientov s TEL//AML1 je v 90 % priaznivá s dlhodobou remisiou, hoci sa v niektorých prípadoch popisujú aj neskoré relapsy [5]. Je kryptická a tedy cytogeneticky nevyšetriteľná, preto musí byť detekovaná metódou FISH alebo RT-PCR. Býva prítomná ako iniciálna v leukemickom klone, avšak sama o sebe nestačí na rozvoj leukemického klonu, musia byť prítomné ďalšie mutácie [1, 8].
Amplifikácia RUNX1
Amplifikácia oblasti chromozómu 21, obsahujúca RUNX1 gén, býva prítomná u detských pacientov vo vyššom veku, s nízkym počtom leukocytov a so zlou prognózou [8, 9]. Pričom u dospelých pacientov s B-ALL sa nevyskytuje [8].
Prestavby génu MLL
Gén sa nazýva MLL, lebo je alterovaný ako u myeloidnej, tak aj u lymfoidnej rady leukemických buniek, čo predpokladá pôvod leukemického klonu z kmeňových buniek alebo včasných progenitorových buniek [10]. MLL má viac ako 70 rôznych fúznych parnerov. Zo všetkých prestavieb 80 % je zapríčinené AF4 (80 %), AF9 (16 %), ENL (11 %), AF10 (7 %) a ELL (4 %) [22]. Ostatné translokácie (okolo 60) vznikajú ojedinele, táto skupina zahŕňa 20 % MLL translokácií. Niektoré translokácie možu byť prítomné rovnako u ALL ako aj u MLL, iné sú špecifické pre ALL a iné zas pre AML. Translokácia t(4;11)(q21;q23) je špecifická pre ALL deti do 1 roka, pričom t(11;19)(q23;p13.3) a t(9;11)(p22;q23) sa nachádzajú u oboch, ALL a AML. MLL translokácie sú indikátormi nízkeho prežívania detí s ALL, pričom rozdiel v prežívaní závisí od veku. Práve u t(11;19) a t(9;11) je prognóza u dojčiat veľmi zlá, u detí starších ako 1 rok o niečo lepšia, ale stále zlá. Výskyt je u dojčiat s ALL najvyšší (až 80 % tvorí práve MLL/AF4), u detí vo veku 1–14 rokov je frekvencia 1,7 % a pre 15–30-ročných pacientov 3,4 % (tab. 3) [8, 22]. MLL alterácia sa môže tiež vyskytnúť už v prenatálnom období, avšak podobne ako TEL/AML1 sama o sebe nestačí na rozvoj leukemického klonu, musia byť prítomné ďalšie mutácie. V diagnostike sa na identifikáciu rôznych preskupení MLL génu rutinne používa cytogenetická analýza, fluorescenčná in situ hybridizácia (FISH) a reverzne-transkriptázovej polymerázovej reťazovej reakcie (RT-PCR). Na detekciu zriedkavých zlomov LDI-PCR („long-distance inverse PCR“).
Table 3. Výskyt štruktúrových aberácií u detí s B-bunkovou ALL [8]. ![Výskyt štruktúrových aberácií u detí s B-bunkovou ALL [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/84336037c3e8b0ce3ed1177f1404be10.jpg)
BCR/ABL1, Ph chromozóm
Významnou abnormalitou u detských ALL je recipročná translokácia medzi chromozómami 9 a 22, t(9; 22)(q34;q11), ktorá má za následok vytvorenie Philadelphského chromozómu (Ph). Približne 95 % Ph+ALL prípadov je zistiteľných prostredníctom karyotypovania, avšak vzhľadom na prítomnosť možných kryptických preskupení, ktoré sa môžu prehliadnuť, sa v praxi využíva metóda FISH, RT-PCR, alebo RQ-PCR [5, 17, 18]. Frekvencia Ph+ALL predstavuje u detí vo veku 1–14 rokov 2,9 % a u adoslescentov a mladých dospelých vo veku 15–30 rokov 7,0 % a je silným indikátorom zlého prežívania u detí [8].
TCF3/PBX1 alebo E2A/PBX1
Táto translokácia charakterizuje detskú prekurzorovú B–bunkovú ALL a môže byť buď vyvážená t(1;19), alebo nevyvážená der(19)t(1;19)(q23;p13) s 2 normálnymi chromozómami [11, 17]. Translokácia je často detekovaná u detí okolo 10. roku života alebo u starších. Prognóza je pri súčasných liečebných protokoloch priaznivá [10, 23].
Pacienti s T-ALL nie sú v databázach natoľko početní ako s B-ALL a preto je štatistické vyhodnotenie chromozómových aberácií uvádzané len zriedkavo. Navyše aj veľké databázy uvádzajú väčšinou prítomnosť normálneho karyotypu (u 80 % detských pacientov s T-ALL) so zriedkavými numerickými ako aj štruktúrovými aberáciami. Prehľad najčastejších je zosumarizovaný v tabuľke 4.
Table 4. Výskyt štruktúrových aberácií u detí s T-bunkovou ALL [8]. ![Výskyt štruktúrových aberácií u detí s T-bunkovou ALL [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5105a07349f5be0f982cc5450f5c2ad1.jpg)
2. A. Numerické aberácie u AML
Pokiaľ ide o AML, väčšina hyperdiploidných prípadov má len 1 alebo 2 prídatné chromozómy, pričom najčastejšími sú trizómia 8 (u 5 až 10 % detských AML). Častejšia je aj u pacientov s Downovým syndrómom a AML [7, 8] a u AML-M7 skupiny podľa francúzsko-americko-britskej (FAB) klasifikácie. Najbežnejšie nadpočetné chromozómy sú 6, 8, 10, 19 a 21 [9].
Monozómia 7 a delécia 7 q
Anomálie chromozómu 7 sa vyskytujú u AML pacientov s vyváženou zmenou 7q22 a 7q32-q35. Opakujúce sa straty materiálu na chromozóme 7 sa dávajú do súvislosti s existenciou supresorových génov v zlomových oblas-tiach. Tieto regulujú rast a diferenciáciu myeloidnej rady. Strata ich funkcie predpokládá účasť na leukemickej transformácii bunky [12]. Incidencia monozómie 7 alebo delécie 7 q [(del (7 q)] je približne u 5 až 7 %, pričom je častejšia u AML M4 a M6 [7]. Môže sa vyskytnúť aj u sekundárnej AML na podklade myelodysplastického syndrómu (MDS) a u detí s konštitučným karyotypom s predispozíciou k myeloidnej leukémii, vrátane Fanconiho anémie a vrodenej neutropénie a neurofibromatózy typ 1 [13].
2. B. Štruktúrové aberácie u AML
AML1/ETO
Recipročná translokácia t(8;21)(q22;q22) medzi chromozómami 8 a 21 rezultuje do fúzneho génu AML1/ETO (RUNX1/CBFA2T1) a je považovaná za najčastejšie sa vyskytujúcu translokáciu u AML (8–12 % detských AML), hlavne u podtypu AML M2, ale aj u M1 alebo M4 [14] asociovanú s priaznivou prognózou a dlhodobými remisiami (tab. 5).
Table 5. Výskyt numerických a štruktúrových aberácií u detí a dospelých s AML [8]. ![Výskyt numerických a štruktúrových aberácií u detí a dospelých s AML [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b288211185b8566e6c2c80859d408f6d.jpg)
Inv(16) (CBFB/MYH11)
Inverzia inv(16)(p13;q22) predstavuje spolu s t(8;21), približne 25 % AML prípadov [15]. Väčšina štúdií spája inv(16)(p13q22) s priaznivou prognózou [16].
PML/RARA
Translokácia t(15;17)(q22;q21) sa vyskytuje u akútnej promyelocytovej leukémie (APL), pričom chýba u pacientov s inými typmi leukémie [7]. Drvivá väčšina pacientov má variant t(15;17), ktorý zahŕňa gén PML a α-receptor kyseliny retinovej (RARA gény).
OTT/MAL
Translokácia t(1;22)(p13;q13) rezultuje do fúzneho génu OTT/MAL. Nachádza sa často u malých detí, hlavne u tých s akútnou megakaryoblastickou leukémiou (AML M7), 96 % prípadov je mladších jako 24 měsíců [11].
Sekundárne cytogenetické aberácie
Skupina pacientov s AML a cytogeneticky detekovaným aberantným klonom má viac ako jeden chromozóm prestavaný [20]. Takéto prestavby chromozómov sa nazývajú sekundárne aberácie a predstavujú najčastejšie del(7q) (-7), trizómia 8, (+8), der(16)t(1;16)(q12-23;q12-24) a trizómia 21 (+21). Sú prítomné ako u ALL aj AML [20]. Trizómia 8 je známa tým, že neovplyvňuje prognózu leukémie, pokiaľ nejde o sekundárnu zmenu v karyotype. Vtedy pôsobí akceleračne v klonovom vývoji.
Záver
V súčasnosti používané metódy molekulárnej cytogenetiky (FISH, mFISH, aCGH) prispeli k identifikácii a charakterizácii nových a kryptických chromozómových aberácií. Vďaka vyššej rozlíšiteľnosti zatieňujú význam konvenčnej cytogenetiky. Avšak práve pre limitácie metód FISH aCGH vo vyšetrovaní vyvážených translokácií nemôžu metódu konvenčnej cytogenetiky úplne nahradiť.
V práci zosumarizované genetické aberácie majú svoje pevné miesto v diagnostike, prognóze a sledovaní minimálneho reziduálneho ochorenia u detí s ALL a AML. Sú nevyhnutné k zaradeniu pacientov do rizikových skupín a pri rozhodovaní o terapeutickej stratégii. To je významným dôvodom pre neustále zvyšovanie úsilia o zlepšovanie a štandardizáciu cytogenetických a molekulárnych metódy a interpretáciu ich výsledkov.
Doc. MUDr. Denisa Ilenčíková, PhD.
2. detská klinika LFUK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: denisa.ilencikova9@gmail.com
Sources
1. Harrison CJ. Cytogenetics of paediatric and adolescent acute lympho-blastic leukaemia. Br J Haematol 2009; 144 : 147–156.
2. Nachman JB, Heerema NA, Sather H, et al. Outcome of treatment in children with hypodiploid acute lymphoblastic leukemia. Blood 2007; 110 : 1112–1115.
3. Paulsson K, Johansson B. High hyperdiploid childhood acute lympho-blastic leukemia. Genes Chromosomes Cancer 2009; 48 : 637–660.
4. Vrooman LM, Silverman LB. Childhood acute lymphoblastic leukemia: update on prognostic factors. Curr Opin Pediatr 2009; 21 : 1–8.
5. Harrison CJ, Foroni L. Cytogenetics and molecular genetics of acute lymphoblastic leukemia. Rev Clin Exp Hematol 2002; 6 : 91–113.
6. Harrison CJ. The detection and significance of chromosomal abnormalities in childhood acute lymphoblastic leukaemia. Blood Rev 2001; 15 : 49–59.
7. Usvasalo A, Raty R, Knuutila S, et al. Acute lymphoblastic leukemia in adolescents and young adults in Finland. Haematologica 2008; 93 : 1161–1168.
8. Raimondi S, Heerema N. Cytogenetics in children, adolescents, joung adults with ALL and AML. In: Cairo MS, Sherrie L. Hematological Malignancies in Children, Adolescents and Young Adults. New York: Medical College, Word Scientific 2012 : 103–119. ISBN 978-981-4299-60-2.
9. Braoudaki M, Tzortzatou-Stathopoulou F. Clinical cytogenetics in pediatric acute leukemia: An update. Clin Lymphoma Myeloma Leuk 2012; 12 (4): 230–237.
10. Martinez - Leblanc T, Berger R. Molecular cytogenetics of childhood acute myelogenous leukaemias. Eur J Haematol 1997; 59 : 1–13.
11. Nordgren A. Hidden aberrations diagnosed by interphase fluorescence in situ hybridisation and spectral karyotyping in childhood acute lymphoblastic leukaemia. Leuk Lymphoma 2003; 44 : 2039–2053.
12. Mrózek K, Heerema NA, Bloomfield CD. Cytogenetics in acute leukemia. Blood Rev 2004; 18 : 115–136.
13. Luna-Fineman S, Shannon KM, Lange BJ. Childhood monosomy 7: epidemiology, biology, and mechanistic implications. Blood 1995; 85 : 1985–1999.
14. Le Beau MM, Espinosa R 3rd, Davis EM, et al. Cytogenetic and molecular delineation of a region of chromosome 7 commonly deleted in malignant myeloid diseases. Blood 1996; 88 : 1930–1935.
15. Gamerdinger U, Teigler-Schlegel A, Pils S, et al. Cryptic chromosomal aberrations leading to an AML1/ETO rearrangement are frequently caused by small insertions. Genes Chromosomes Cancer 2003; 36 : 261–272.
16. Cheng CK, Li L, Cheng SH, et al. Transcriptional repression of the RUNX3/AML2 gene by the t(8;21) and inv(16) fusion proteins in acute myeloid leukemia. Blood 2008; 112 : 3391–3402.
17. Burjanivova T, Madzo J, Muzikova K, et al. Prenatal origin of childhood AML occurs less frequently than in childhood ALL. BMC Cancer 2006; 6 : 100–107.
18. Bacher U, Schnittger S, Haferlach C, et al. Molecular diagnostics in acute leukemias. Clin Chem Lab Med 2009; 47 : 1333–1341.
19. Olde Nordkamp L, Mellink C, van der Schoot E, et al. Karyotyping, FISH, and PCR in acute lymphoblastic leukemia: competing or complementary diagnostics. J Pediatr Hematol Oncol 2009; 31 : 930–935.
20. Lazic J, Tosic N, Dokmanovic L, et al. Clinical features of the most common fusion genes in childhood acute lymphoblastic leukemia. Med Oncol 2010; 27 : 449–453.
21. Mrózek K, Heinonen K, Bloomfield CD. Clinical importance of cytogenetics in acute myeloid leukaemia. Best Pract Res Clin Haematol 2001; 14 : 19–47.
22. Ilencikova D, Kolenova A. MLL gene alterations in acute myeloid leukaemia (11q23/MLL+ AML). In: Siregar Y (ed). Oncogene and Cancer – From Bench to Clinic. InTech 2013 : 328–352. ISBN: 978-953-51-0858-0.
23. Felice MS, Gallego MS, Alonso CN, et al. Prognostic impact of t(1;19)//TCF3-PBX1 in childhood acute lymphoblastic leukemia in the context of Berlin-Frankfurt-Münster-based protocols. Leuk Lymphoma 2011 Jul; 52 (7): 1215–1221.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 2-
All articles in this issue
- Leukémie u dětí ve 21. století
- Etiologie dětských ALL a AML, molekulární genetika a minimální reziduální nemoc
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
- Cytogenetika akútnych leukémií u detí
- Akútna lymfoblastová leukémia
- Akutní myeloidní leukémie v dětském věku
- Transplantace kmenových buněk krvetvorby v terapii akutní lymfoblastické leukémie dětského věku
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní myeloidní leukémie v dětském věku
- Akútna lymfoblastová leukémia
- Leukémie u dětí ve 21. století
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

