-
Medical journals
- Career
Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
: O. Hrušák; E. Mejstříková; V. Kanderová; M. Vášková; T. Kalina
: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. Jan Starý, DrSc.
: Čes-slov Pediat 2015; 70 (2): 85-91.
: Acute leukemias in children
Cytometrická imunofenotypizace patří k nejpřínosnějším metodám pro diagnostiku AL. Hlavními výhodami jsou její rychlost, spolehlivost a schopnost hodnotit vyšetřované parametry na úrovni jednotlivých buněk. Mezi nevýhody patří ekonomická náročnost. Výsledky cytometrické imunofenotypizace je nutno expertně interpretovat a sdělit klinikovi takovým způsobem, aby byly zodpovězeny relevantní otázky pro zařazení a léčbu pacienta. Pomocí průtokové cytometrie lze hodnotit i další parametry, jako je množství DNA nebo proteóm. Praktické diagnostické uplatnění nových možností, které přinášejí multiparametrické přístroje nové generace, se prověřuje.
Klíčová slova:
akutní leukémie, děti, imunofenotypizace, cytometrieÚvod
Imunofenotypizace leukémií se provádí pomocí průtokové cytometrie. Její úlohou v okamžiku diagnózy je odlišit akutní leukémii (AL) od jiných stavů, jako jsou aktivace některé ze složek krvetvorby při zánětu či imunopatologii a útlumy kostní dřeně a rozlišit lymfoidní AL (ALL) od myeloidní (AML). Zatímco pro tato odlišení je imunofenotypizace průtokovou cytometrií poměrně suverénní metodou, odlišení AML od jednotlivých forem myelodysplastického syndromu (MDS) je o něco více závislé na dalších vyšetřeních, zejména morfologických.
Postavení cytometrické imunofenotypizace v diagnostice AL
Obrovskými výhodami cytometrie jsou rychlost (výsledky lze interpretovat během hodin od přijetí vzorku do laboratoře) a schopnost vyjadřovat měřené parametry na úrovni jednotlivých buněk. Při zachování nutných podmínek ohledně přípravy vzorku, nastavení přístroje a způsobu interpretace je cytometrie navíc vysoce objektivní a standardizovatelná [1]. Rozlišení podtypů ALL je zcela závislé na cytometrii (tab. 3), základní rozlišení AML stojí na mikroskopickém nálezu (FAB klasifikace, Šrámková, s. 108–113) a s cytometrickým nálezem se doplňuje [2].
Důležitou součástí diagnostiky je odhalení vhodné kombinace antigenů, která bude sloužit pro detekci minimální reziduální nemoci (MRN). Pro tento výběr je potřeba znát, jaká je fyziologická konstelace exprese jednotlivých antigenů za fyziologických podmínek i jak se exprese antigenů mění na leukemických buňkách během chemoterapie [3–5].
Cytometrie je schopna vyšetřit, zda leukemické buňky exprimují některé z cílů protilátkové imunoterapie (např. CD20, CD22, CD30, CD52 nebo CD19) – i z tohoto pohledu je třeba vést v patrnosti změny exprese během chemoterapie, které mohou jít nežádoucím i žádoucím směrem [5].
Přítomnost některých antigenů v okamžiku diagnózy má prognostický význam [2, 6, 7], nicméně v jednotlivých léčebných protokolech se tato skutečnost prakticky zohledňuje jen zřídka (např. rozlišení T a B řady, pro-B ALL). Imunofenotyp často zrcadlí genotyp AL, čehož lze využít např. v případech, kdy místo zlomu pro fúzní gen je v nestandardním místě a jeho přítomnost tak může uniknout běžné diagnostice [8, 9].
Princip cytometrické imunofenotypizace [10]
Průtoková cytometrie používá jako zkoumaný materiál buněčnou suspenzi (např. kostní dřeň, periferní krev či likvor). Metoda vyžaduje čerstvý materiál (živé a neagregované buňky – odebrané do heparinu či EDTA, obvykle do 24 hod po odběru, v případě likvoru je potřeba vyšetření provést maximálně do 2 hodin). Lze vyšetřit i tkáň, kdy před vlastním značením je nutno vytvořit buněčnou suspenzi. K detekci jednotlivých povrchových nebo cytoplazmatických molekul se používají monoklonální protilátky konjugované s fluo-rescenčními značkami. Příprava vzorku pro imunofenotypizaci povrchových molekul se skládá z inkubace vzorku s monoklonálními protilátkami, následné lýzy erytrocytů a z promytí pomocí centrifugace. Řada molekul vhodných pro bližší zařazení původu buněk se nachází pouze intracelulárně a mnohé z nich lze vyšetřit průtokovou cytometrií. Intracelulární značení se v prvním kroku skládá z fixace buněk (například pomocí 1% paraformaldehydu) a následuje permeabilizace, při které se protilátky dostanou do nitra buněk. Lze kombinovat i povrchové a intracelulární značení současně. Suspenze buněk je po navázání protilátek konjugovaných s fluorochromy nasáta do průtokového cytometru, kde jsou buňky seřazeny do úzkého proudu kapaliny, vysokou rychlostí proudí komorou a jsou ozářeny laserovým paprskem. Laserové světlo excituje molekuly fluorochromu v konjugátu protilátka-fluorochrom. Každý excitovaný fluorochrom emituje světlo o vlnové délce dané specifickými fyzikálními vlastnostmi molekuly. Současné průtokové cytometry umožňují zapojením jednoho až tří laserů excitovat 3 až 9 různých fluorescenčních fluo-rochromů zároveň. Nové generace přístrojů detekují více než 15 parametrů při použití jiných typů detekce (viz dále: Multiparametrická cytometrie u přístrojů nové generace). Pro každou buňku přístroj eviduje kvantitu každého fluorescenčního znaku a dva nefluorescenční parametry popisující velikost (tzv. Forward Scatter – Fsc) a granularitu buňky (tzv. Side scatter – Ssc). Podle Fsc a Ssc lze cytometricky rozlišit základní subpopulace buněk, jako jsou lymfocyty, monocyty a granulocyty ve fyziologické periferní krvi či kostní dřeni. Takto získaná digitální data se následně analyzují ve speciálních softwarech umožňujících grafické a statistické znázornění změřených dat.
Interpretace cytometrického vyšetření
Interpretace závisí na účelu vyšetření. Principem interpretace je vlastně zjednodušení komplexní informace, kdy o jednotlivých subpopulacích buněk známe intenzitu fluorescence každého z měřených parametrů, její rozložení (normální nebo sešikmený vlevo či vpravo, unimodální či vícemodální, heterogenní či homogenní, jasný či ztlumený, …). Tyto informace je nutno převést do jednodušší škály rozlišující negativitu a různé formy pozitivity. Pro většinu diagnostických aplikací včetně zařazení podle WHO klasifikace [11, 12] vystačíme s rozlišením negativní – slabý – silný. Tento princip vyjadřuje nově navržený sumární výpis, kód FDE (Flow Diagnostics Essential) [13]. Jeho použití usnadňuje komunikaci mezi cytometrickou laboratoří, klinickým pracovištěm a datamanažery. Za „slabé“ považujeme v FDE kódu ty antigeny, které jsou exprimovány buď s nízkou intenzitou, nebo jen na části leukemických buněk; „silné“ jsou všechny ostatní pozitivní antigeny, tzn. takové, jejichž intenzita je buď „vysoká“, nebo ji jen nelze označit za „slabou“. Příklady FDE kódů jsou v tabulce 1.
1. Příklady zápisu imunofenotypu pomocí kódu FDE (Flow Diagnostics Essential). Po řetězci „FDE“ následuje % atypických (maligních) buněk ve vzorku, dále silně (STRONG) exprimované antigeny, po nich slabě (WEAK) exprimované a negativní antigeny a závěr. Podrobnosti v ref. [13]. ![Příklady zápisu imunofenotypu pomocí kódu FDE (Flow Diagnostics Essential). Po řetězci „FDE“ následuje % atypických (maligních) buněk ve vzorku, dále silně (STRONG) exprimované antigeny, po nich slabě (WEAK) exprimované a negativní antigeny a závěr. Podrobnosti v ref. [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/10f438d6b54d2af894f037cac8f7159c.jpg)
Typizace akutních leukémií
Typizace akutních leukémií se opírá v současné době nejčastěji o EGIL klasifikaci, její verzi publikovanou z roku 1995–6 [14, 15], respektive o WHO klasifikaci 2008 [11, 12]. V tabulce 2 je současná klasifikace používaná skupinou AIEOP-BFM mj. pro české pediatrické pacienty.
2. Definice pro diagnostické a léčebné zařazení používané pro pacienty s AL léčených ve skupině AIEOP-BFM včetně ČR. 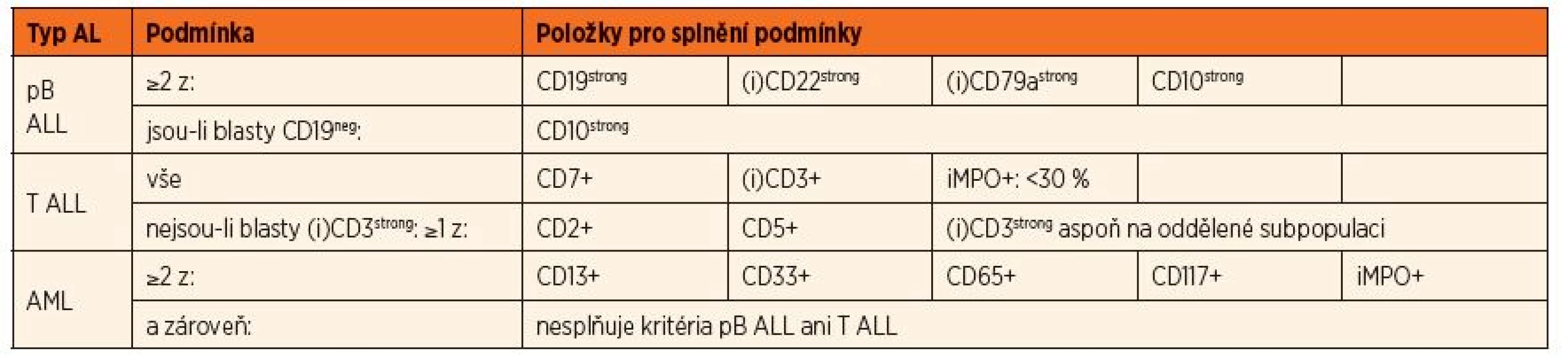
Klasifikace ALL
ALL se klasifikují do jednotlivých stadií podle zralosti. B prekurzorové ALL (pB ALL, tj. vycházející z B řady bez známky exprese povrchových lehkých řetězců imunoglobulinu) se člení do třech podskupin (tab. 3). Odlišení typické pB ALL od jiných nálezů je na obrázku 1. Negativita CD10 a CD20 určuje pro-B imunofenotyp a je nepříznivým prognostickým faktorem a často se pojí s přestavbami MLL genu, imunofenotyp pro-B častěji nacházíme u kojeneckých ALL. Prae-B ALL jsou definovány pozitivitou intracelulárního IgM. Nebyl prokázán prognostický rozdíl mezi cALL a prae-B ALL. T ALL členíme do čtyř stadií podle zralosti. Nedávno publikovala Coustan-Smith podtyp T ALL nazývaný jako „early T cell precursor“ (ETP) ALL jako podtyp s velmi špatnou prognózou [16]. ETP ALL je definována jako CD1aneg, CD8neg, CD5slabě nebo částečně pozitivní a s koexpresí myeloidních či markerů kmenových buněk.
3. Adaptovaná klasifikace ALL v rámci BFM (Berlin – Frankfurt – Münster) protokolů pro dětskou ALL. Klasifikace odpovídá i ALL v dospělém věku. 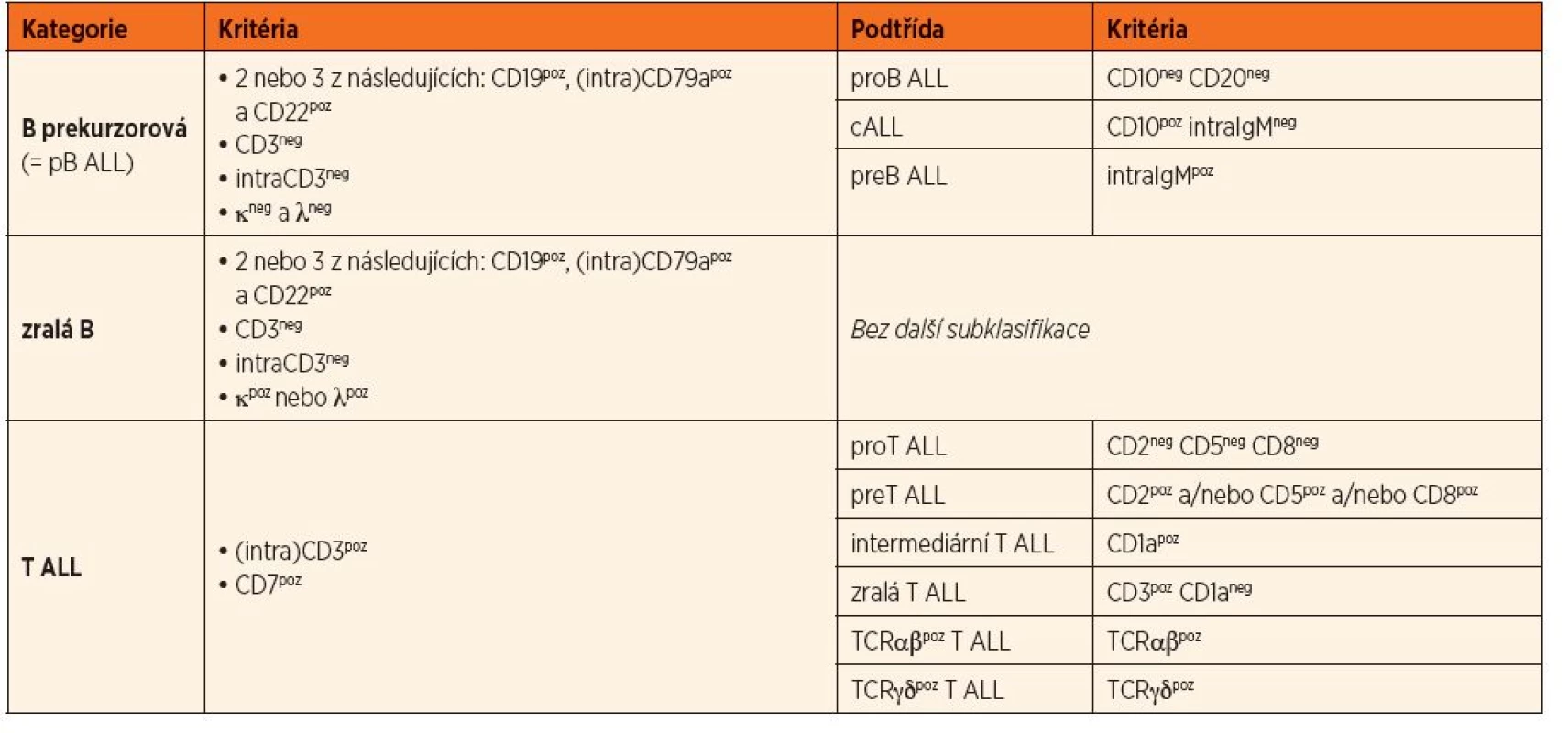
1. Analýza vývoje B řady v různých situacích. Červeně jsou ukázány buňky B řady (CD19<sup>poz</sup>), modře ostatní lymfoidní buňky a šedé pozadí zobrazuje všechny ostatní buňky. Zatímco při diagnóze pB ALL (A,E) tvořily CD10<sup>poz</sup> 19<sup>poz</sup> buňky naprostou většinu buněk kostní dřeně, ve dni 15 léčby (B, F) B řada tvoří již jen menšinu buněk a i v rámci ní je jen menšina maligních CD10<sup>poz</sup> 20<sup>neg</sup> buněk (v kroužku). U pacienta s infekční mononukleózou (C,G) vidíme v rámci minoritní B řady hlavní fáze vývoje (podél šipky). U pacientky s diagnózo CD10<sup>poz</sup> T ALL (D,H) jsou kromě modře znázorněných blastů, z nichž většina je CD10<sup>poz</sup>, vidět i zbytkové fyziologické buňky B řady, které jsou však většinou zralé, protože jejich prekurzory jsou potlačeny leukémií. 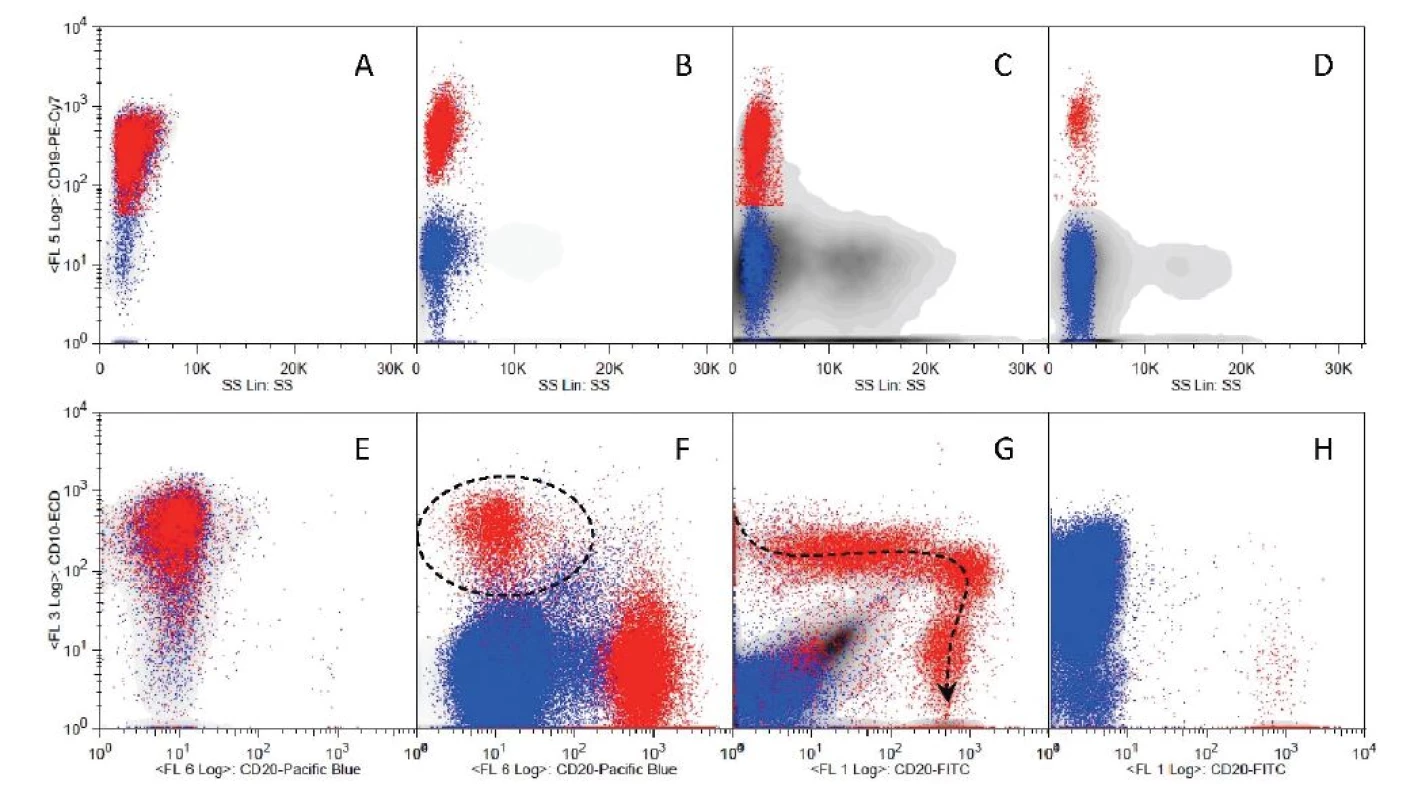
Maligní onemocnění vycházející ze zralých lymfocytů
Dětské malignity vycházející ze zralých lymfocytů se vyskytují častěji jako lymfom, nikoliv AL a jsou vzácnější než lymfoblastické ALL. Infiltrace kostní dřeně se objevuje u pacientů s Burkittovým lymfomem/leukémií, s imunofenotypem popsaným výše.
Onemocnění vycházející ze zralých T lymfocytů nebo NK buněk jsou daleko vzácnější než proliferace z B řady a podrobněji jsou rozebrány jinde [10].
Akutní myeloidní leukémie (AML)
Jednotlivé podtypy akutní myeloidní leukémie jsou především definovány morfologicky. Genotypové podskupiny AML se vyznačují typickým imunofenotypem [2]. Typická je například aberantní exprese CD19 u AML M2 s fúzním genem AML1/ETO nebo aberantní exprese CD2 u AML M4eo s fúzním genem CBFb/MYH11. Podobně jako u ALL koreluje aberantní exprese NG2 s přestavbami MLL genu. Fúzní gen PML/RARA se pojí s negativitou HLA DR a CD34. AML jsou prakticky vždy CD45 pozitivní, nelymfocytární vzhled atypických buněk a současná negativita CD45 budí podezření z infiltrace KD nehematopoetickým nádorem.
Akutní bifenotypové hybridní leukémie, MPAL
Leukémie, které nesou významné množství znaků více než jedné linie, mohou být zařazeny jedním z termínů uvedených v názvu odstavce. Jedná se sice o synonyma, ale termín MPAL je více spojován s definicemi podle WHO [17] a termín bifenotypická AL bývá spojován s definicemi podle EGIL [14, 15, 18]. Nejednotná klasifikace a hlavně absence jasných léčebných pravidel způsobuje praktické obtíže. Původní klasifikace EGIL hovořila pouze o koexistenci znaků myeloidní řady s B nebo T řadou. Následná WHO klasifikace zavedla i termín MPAL B/T a rovnou jeho význam zpochybnila a přiřkla předchozí klasifikaci EGIL. V současné době koordinujeme mezinárodní studii/registr iBFM AMBI2012, jejímž cílem je stanovení jasnějších diagnostických i léčebných pravidel pro tuto skupinu pacientů.
Můžeme rozlišit tři subtypy MPAL:
- Nález je zařaditelný jako ALL nebo AML, ale blasty exprimují aberantní antigeny, kterým EGIL klasifikace přiřazuje skóre. MPAL je spojena buď s dosažením limitního skóre (EGIL), nebo s koexpresí myeloperoxidázy (jakoukoli metodou). Otázkou je, jak přistupovat k leukémiím s jasnou ALL morfologií a nálezem pozitivity myeloperoxidázy (byť jen cytochemicky nad 3 %). Incidence těchto MPAL (podle jedné z definic) je mezi 2 a 5 % všech AL.
- Při diagnóze lze morfologicky a/nebo imunologicky identifikovat dvě nezávislé populace blastů z myeloidní a lymfoidní linie, nález pak nazýváme jako bilineární leukémie. Některé studie dávají přednost cytometrické identifikaci dvou linií pro klasifikaci leukémie jako bilineární před morfologií. Jedná se o velmi vzácnou entitu s často špatnou prognózou, nicméně bližší epidemiologická data chybějí. Ani u této podskupiny nejsou dána přesná kritéria (např. jak četné musí být obě populace, nebo jaké metody musí prokázat jejich odlišnost).
- Před dosažením kompletní remise morfologicky a/nebo imunologicky dojde ke změně fenotypu blastů. Tato podskupina byla dříve popisována jako velmi vzácná jednotka spojená podle kazuistik s přestavbou MLL genu, BCR/ABL či monosomií 7. chromozomu [19]. Nedávno publikovaná studie popsala tento jev jako nečekaně častý, postihující asi 4 % pB ALL a korelující s aberantní expresí CD2 při diagnóze [20].
Možná úskalí cytometrické diagnostiky
Pracnost laboratorní přípravy vzorku pro cytometrii není příliš náročná, přesto je nutno ji nepodcenit, protože nelze vyloučit, že některé chyby způsobené např. nepozorností by unikly během interpretace vyšetření. Běžná laboratorní praxe by měla zahrnovat přípravu vzorku dvěma vyškolenými pracovníky, kteří si vzájemně kontrolují práci se vzorkem a s protilátkami. Správná kalibrace přístroje a způsob měření jsou rovněž důležité. Za klíčovou část považujeme interpretaci vyšetření. Tu by měli provádět a validovat zkušení odborníci, kteří jsou na základě fungující komunikace s klinickým pracovištěm dobře obeznámeni s klinickou otázkou.
Další cytometrické techniky v diagnostice a výzkumu AL
Cytometrické stanovení obsahu DNA
Vedle imunofenotypizace se v rutinní cytometrické diagnostice uplatňuje i stanovení množství DNA v nádorových buňkách. Provádíme jej po fixaci a permeabilizaci pomocí fluorescenční barvičky, která po vazbě do dvojšroubovice DNA ukazuje její množství v každé buňce. Můžeme odlišit euploidní AL od různých forem aneuploidie (hypodiploidie, hyperdiploidie) či tetraploidie.
Cytometrická proteomika
Leukémie je komplexní onemocnění, které se patologicky projevuje nejen na úrovni genů, ale také na úrovni proteinů. Nejnovější genomické nástroje, jako je např. celoexomové sekvenování, dokáží rychle odhalit patologické změny na DNA – jednobodové mutace, translokace, delece aj. [21]. Objasnit funkční důsledky těchto změn však není vůbec jednoduché a jednou z metod, která tomu pomáhá, je proteomika. Genomové aberace totiž mohou, ale nemusí být vyjádřeny na funkční úrovni buňky, tedy na úrovni proteinu. Určité DNA změny mohou ovlivnit expresi proteinu, jiné jeho funkci, posttranslační modifikaci, protein-protein interakce nebo vnitrobuněčnou lokalizaci, jiné nemusí protein ovlivnit vůbec [22]. Víme také, že exprese mRNA špatně koreluje s expresí proteinu [23]. Proto je nutné, aby byly do klinického výzkumu zavedeny nejen metodiky genomické, ale také proteomické. Jednou takovou proteomickou metodikou je tzv. Single Cell Phospho-Flow (obr. 2), tedy detekce fosforylovaných epitopů intracelulárních signalizačních proteinů pomocí specifických protilátek průtokovou cytometrií [24]. Ta pomůže odhalit např. senzitivitu či rezistenci leukemických buněk na inhibitory tyrosinových kináz či na monoklonální protilátky. Chromozomální translokace v leukemické buňce (např. BCR-ABL) může vést k expresi fúzního proteinu, který působí jako konstitutivní, tj. stále aktivní, kináza. Tato i bez vnější stimulace neustále fosforyluje intracelulární signalizační dráhy, které vedou k nekontrolované proliferaci. Intracelulární signalizační dráhy jsou sítí proteinů, které se vzájemně fosforylují a defosforylují a tím přenášejí signál z povrchu buňky do jádra. V jádře je tím ovlivněn přepis genů pro proteiny, které následně ovlivňují proliferaci, migraci a jiné buněčné pochody. Znakem konstitutivně aktivované signalizační dráhy pod fúzní kinázou BCR-ABL je fosforylace signalizačního proteinu CRKL. Jeho defosforylace tedy může sloužit jako znak odpovědi leukemických buněk na specifický inhibitor BCR-ABL kinázy, např. imatinib mesylát. Metoda Single Cell Phospho-Flow může být navíc využita i ke sledování odpovědi na TKI u nově objevovaných typů leukémií s netradičními fúzními kinázami (např. RCSD1-ABL2) či s mutacemi v genech kódujících receptory cytokinů (např. CRLF2) ve skupině tzv. B-other pB ALL [25]. Díky současné detekci povrchových molekul určujících podtyp leukémie a intracelulárních signalizačních proteinů také můžeme zjišťovat, která buněčná subpopulace reaguje na inhibitor nejlépe, nebo zda jsou pozitivně či negativně ovlivněny i zdravé buňky ve vzorku.
2. Ukázka Single Cell Phospho-Flow. Bazální hladina fosforylace signalizačního proteinu MAPK1/2 v pB-ALL blastech (žlutě), zdravých T lymfocytech (zeleně) a zdravých B lymfocytech (šedě) ve vzorku kostní dřeně pacientky ze skupiny B-other pB-ALL. Zvýšená fosforylace MAPK1/2 v leukemických blastech byla detekována metodou Single Cell Phospho-Flow. Defosforylace signalizačních proteinů (včetně MAPK1/2) může být následně využito jako znaku senzitivity na inhibitory tyrosinových kináz. 
Dalším slibným proteomickým nástrojem, kterým lze sledovat změny v expresi, posttranslační modifikaci či vnitrobuněčné lokalizaci proteinů, je tzv. SEC-MAP array (Size Exclusion Chromatography-Microsphere--based Affinity Proteomics, obr. 3) [26]. Metoda SEC-MAP kombinuje rozdělení buněčného lyzátu leukemických buněk na různé vnitrobuněčné frakce (membrány, cytoplazma, organely, jádro), rozdělení jejich proteinů podle velikosti pomocí gelové „size-exclusion“ chromatografie a následnou cytometrickou detekci pomocí protilátek navázaných na fluorescenčně značených mikrokuličkách. Těchto mikrokuliček s různými protilátkami je v jedné arrayi až 1728, můžeme tak najednou detekovat až 1728 různých proteinů v jednom jediném vzorku (stačí 10 mil. buněk). Protilátky na kuličkách jsou buď specifické pro protein, nebo pro jeho fosforylovanou (aktivovanou) formu, čímž získáváme informace o proteinové expresi a jeho fosforylaci v kontextu vnitrobuněčné lokalizace a proteinových komplexů. Data získávaná takovýmto komplexním nástrojem však není snadné uchopit. V laboratořích CLIP jsme proto vyvinuli inovativní softwarové přístupy, díky kterým získáváme celkový proteomický profil leukemických buněk např. po stimulaci či inhibici léčivem, během několika dní [27].
3. Ukázka detekce proteinů pomocí SEC-MAP Arraye. Hladina exprese (osa x, měřená jako medián intenzity fluorescence detekční reagencie streptavidin-PE) 576 proteinů v leukemické linii REH. Proteiny byly specificky imunoprecipitovány 576 protilátkami navázanými na fluorescenčních mikrokuličkách (různobarevně) SEC-MAP arraye. 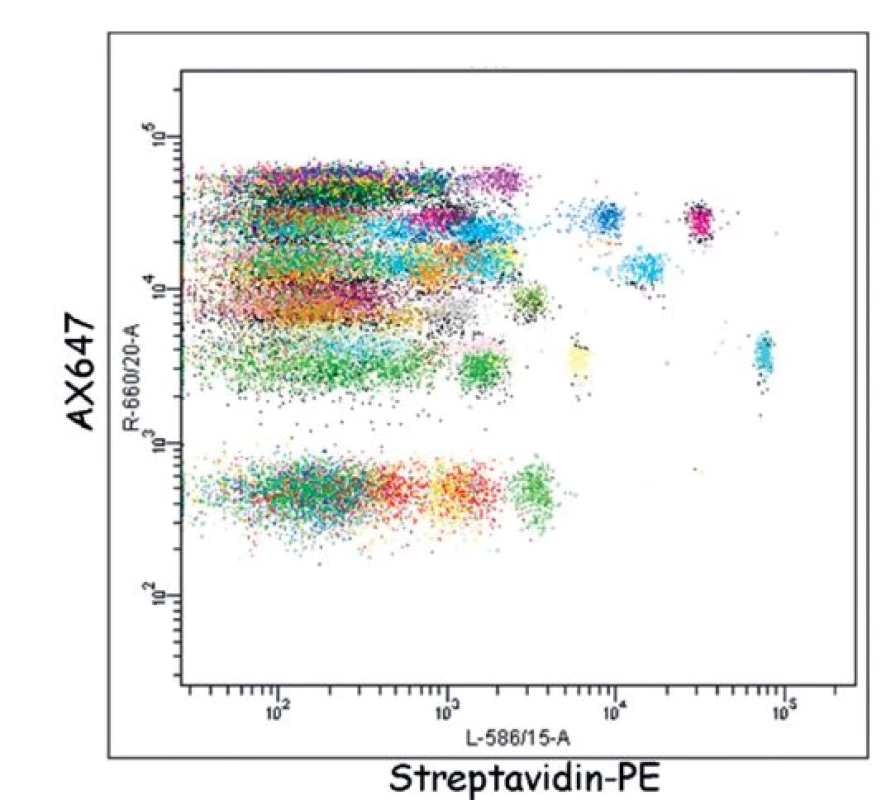
Multiparametrická cytometrie u přístrojů nové generace
Omezení možného počtu parametrů, které je u klasické cytometrie dáno rozsahem vlnových délek excitovaného světla a snahou o jejich nepříliš velký překryv, se u přístrojů nové generace obchází dvěma způsoby. U hmotnostní cytometrie se namísto fluorochromů používají atomy kovů a detekuje se jejich atomová hmotnost a u spektrální cytometrie se namísto detekce světla v určitém vlnovém intervalu detekuje celý rozsah a následně se matematicky rozloží podle známého profilu excitovaného každým z použitých fluorochromů.
Hmotnostní cytometr (CyTOF) umožní stanovit přítomnost a množství desítek molekul (obvykle proteinů) současně a na úrovni každé buňky (zatímco s tradičními přístroji „předcházející generace“ se standardně vyšetřuje kolem 6–8 molekul, CyTOF bude teoreticky schopen vyšetřit až 100 různých molekul, z čehož již dnes jich je k dispozici 34). Přítomnost proteinů je určena pomocí monoklonálních protilátek, které jsou označeny izotopy vzácných prvků, které se v buňkách normálně nevyskytují. Označené protilátky se nechají navázat na zkoumané buňky. Roztok obsahující buňky je v přístroji rozdělen a kapičky s jednotlivými buňkami jsou postupně spáleny ve vysokoteplotním plazmatu, čímž se přeruší všechny chemické vazby za vzniku směsi jednotlivých atomů. Následně změřené množství jednotlivých prvků původně navázaných na protilátky tak odpovídá množství proteinu přítomného v buňce.
Závěr
Cytometrická imunofenotypizace patří k nejpřínosnějším metodám pro diagnostiku AL. Hlavními výhodami jsou její rychlost, spolehlivost a schopnost hodnotit vyšetřované parametry na úrovni jednotlivých buněk. Mezi nevýhody patří ekonomická náročnost. Výsledky cytometrické imunofenotypizace je nutno expertně interpretovat a sdělit klinikovi takovým způsobem, aby byly zodpovězeny relevantní otázky pro zařazení a léčbu pacienta. Pomocí průtokové cytometrie lze hodnotit i další parametry, jako je množství DNA nebo proteom. Praktické diagnostické uplatnění nových možností, které přinášejí multiparametrické přístroje nové generace, se prověřuje.
Doc. MUDr. Ondřej Hrušák, Ph.D.
Klinika dětské hematologie a onkologie
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: ondrej.hrusak@lfmotol.cuni.cz
Sources
1. Kalina T, Flores-Montero J, van der Velden VHJ, et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia 2012; 26 : 1986–2010.
2. Hrusák O, Porwit-MacDonald A, Hrusak O. Antigen expression patterns reflecting genotype of acute leukemias. Leukemia 2002; 16 : 1233–1258.
3. Mejstríková E, Fronková E, Kalina T, et al. Detection of residual B precursor lymphoblastic leukemia by uniform gating flow cytometry. Pediatr Blood Cancer 2010; 54 : 62–70.
4. San Miguel JF, Ciudad J, Vidriales MB, et al. Immunophenotypical detection of minimal residual disease in acute leukemia. Crit Rev Oncol Hematol 1999; 32 : 175–185.
5. Gaipa G, Basso G, Maglia O, et al. Drug-induced immunophenotypic modulation in childhood ALL: implications for minimal residual disease detection. Leukemia 2005; 19 : 49–56.
6. Mejstríková E, Kalina T, Trka J, et al. Correlation of CD33 with poorer prognosis in childhood ALL implicates a potential of anti-CD33 frontline therapy. Leuk J Leuk Soc Am Leuk Res Fund U.K. 2005; 19 : 1092–1094.
7. Vaskova M, Mejstrikova E, Kalina T, et al. Transfer of genomics information to flow cytometry: expression of CD27 and CD44 discriminates subtypes of acute lymphoblastic leukemia. Leukemia 2005; 19 : 876–878.
8. Vaskova M, Fronkova E, Starkova J, et al. CD44 and CD27 delineate B-precursor stages with different recombination status and with an uneven distribution in nonmalignant and malignant hematopoiesis. Tissue Antigens 2008; 71 : 57–66.
9. Zaliova M, Meyer C, Cario G, et al. TEL/AML1-positive patients lacking TEL exon 5 resemble canonical TEL/AML1 cases. Pediatr Blood Cancer 2011; 56 : 217–225.
10. Mejstříková E, Pelková V, Kalina T, Hrušák O. Průtoková cytometrie – úloha imunofenotypizace v hematologii a navazujících oborech medicíny. In: Pospíšilová Š, Dvořáková D, Mayer J (eds). Molekulární hematologie. Praha: Galén, 2013.
11. Campo E, Swerdlow SH, Harris NL, et al. The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications. Blood 2011; 117 : 5019–5032.
12. Jaffe ES, Harris NL, Diebold J, Muller-Hermelink HK. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues. A progress report. Am J Clin Pathol 1999; 111: S8–S12.
13. Hrušák O, Basso G, Ratei R, et al. Flow diagnostics essential (FDE) code: A simple and brief format for the summary of leukemia phenotyping. Cytom Part B Clin Cytom 2013.
14. Bene MC, Castoldi G, Knapp W, et al. Classification of acute leukemias: reply from EGIL to Dr van Dongen. Leukemia 1996; 10 : 1363–1364.
15. Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia 1995; 9 : 1783–1786.
16. Coustan-Smith E, Mullighan CG, Onciu M, et al. Early T-cell precursor leukaemia: a subtype of very high-risk acute lymphoblastic leukaemia. Lancet Oncol 2009; 10 : 147–156.
17. Matutes E, Pickl WF, Van’t Veer M, et al. Mixed-phenotype acute leukemia: clinical and laboratory features and outcome in 100 patients defined according to the WHO 2008 classification. Blood 2011; 117 : 3163–3171.
18. Bene MC, Bernier M, Casasnovas RO, et al. The reliability and specificity of c-kit for the diagnosis of acute myeloid leukemias and un-differentiated leukemias. The European Group for the Immunological Classification of Leukemias (EGIL). Blood 1998; 92 : 596–599.
19. Fujisaki H, Hara J, Takai K, et al. Lineage switch in childhood leukemia with monosomy 7 and reverse of lineage switch in severe combined immunodeficient mice. Exp Hematol 1999; 27 : 826–833.
20. Slamova L, Starkova J, Fronkova E, et al. CD2-positive B-cell precursor acute lymphoblastic leukemia with an early switch to the monocytic lineage. Leukemia 2014; 28 : 609–620.
21. Mullighan CG. New strategies in acute lymphoblastic leukemia: Translating advances in genomics into clinical practice. Clin Cancer Res 2010; 17 : 396–400.
22. Kornblau SM, Tibes R, Qiu YH, et al. Functional proteomic profiling of AML predicts response and survival. Blood 2009; 113 : 154–164.
23. Tian Q, Stepaniants SB, Mao M, et al. Integrated genomic and proteomic analyses of gene expression in mammalian cells. Mol Cell Proteomics 2004; 3 : 960–969.
24. Perez OD, Nolan GP. Simultaneous measurement of multiple active kinase states using polychromatic flow cytometry. Nat Biotechnol 2002; 20 : 155–162.
25. Roberts KG, Morin RD, Zhang J, et al. Genetic alterations activating kinase and cytokine receptor signaling in high-risk acute lymphoblastic leukemia. Cancer Cell 2013; 22 : 153–166.
26. Wu W, Slåstad H, de la Rosa Carrillo D, et al. Antibody array analysis with label-based detection and resolution of protein size. Mol Cell Proteomics 2009; 8 : 245–257.
27. Stuchly J, Kanderova V, Fiser K, et al. An automated analysis of highly complex flow cytometry-based proteomic data. Cytom A 2012; 81 : 120–129.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 2-
All articles in this issue
- Leukemias in children in the 21st century
- Aetiology of childhood ALL and AML, molecular genetics and minimal residual disease
- Immunophenotyping and other applications of flow cytometry in acute leukemias
- Cytogenetics of acute leukemias in childhood
- Acute lymphoblastic leukemia
- Acute myeloid leukemia in children
- Hematopoietic stem cell transplantation in therapy of acute lymphoblastic leukemia in children
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Acute myeloid leukemia in children
- Acute lymphoblastic leukemia
- Leukemias in children in the 21st century
- Immunophenotyping and other applications of flow cytometry in acute leukemias
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

