-
Medical journals
- Career
Prenatálne a neonatálne prostredie a ich dôsledky na vývoj dieťaťa
Authors: Z. Blusková; Ľ. Košťálová
Authors‘ workplace: II. detská klinika LFUK a DFNsP, Bratislava prednosta prof. MUDr. L. Kovács, DrSc., MPH
Published in: Čes-slov Pediat 2012; 67 (4): 253-259.
Category: Reviews
Overview
Vysoká prevalencia obezity s metabolickými komplikáciami a následne vysoká úmrtnosť na kardiovaskulárne choroby sú v súčasnosti naliehavým problémom verejného zdravotníctva v Európskom regióne WHO. Alarmujúci je novo vzniknutý fenomén detského metabolického syndrómu. Okrem primárnej a sekundárnej prevencie a teda aj dispenzarizácie obéznych detí je potrebné hľadať nové možné rizikové faktory vývoja metabolického syndrómu.
V článku je diskutovaná nízka pôrodná hmotnosť ako jeden z možných rizikových faktorov vývoja metabolického syndrómu.Kľúčové slová:
metabolický syndróm, SGA, epigenetika, teória fetálneho pôvodu chorôbÚVOD
Celosvetová prevalencia detskej nadváhy a obezity vzrástla zo 4,2 % (v roku 1990) na 6,7 % (v roku 2010) a podľa predpokladov bude ďalej narastať. Podľa dostupných údajov trpí v súčasnosti na nadváhu a obezitu asi 43 miliónov detí (35 miliónov v rozvinutých krajinách) a 92 miliónov detí je rizikových z rozvoja obezity [1]. Detská nadváha je spojená s vývojom obezity u dospelých [2] a s výskytom rizikových faktorov kardiovaskulárneho ochorenia v dospelosti [3]. Kardiovaskulárne choroby sú na prvej priečke v špecifickej úmrtnosti a sú veľmi významným zdravotníckym, ale i ekonomickým a sociálnym problémom takmer všetkých krajín rozvinutého sveta. V roku 2006 sa preto v Istanbule konala konferencia 4 ministrov, záverom ktorej bolo podpísanie Charty proti obezite. Podľa nej epidémia obezity predstavuje jednu z najzávažnejších výziev pre verejné zdravotníctvo v Európskom regióne WHO [4].
Alarmujúce je, že v súčasnosti pozorujeme už v detskom veku výskyt komplikácií obezity, ktoré sú zložkami metabolického syndrómu (MS). Teda komplikácií, rizikových pre srdcovocievne poškodenie. V súčasnej dobe žije v Európskej únii vyše 20 000 obéznych detí, ktoré majú diabetes mellitus 2. typu, 400 000 detí s poruchou glukózovej tolerancie, vyše milión obéznych detí má známky kardiovaskulárneho ochorenia, vrátane hypertenzie a nárastu cholesterolu, a má tri alebo viac známok MS [5]. Na Slovensku trpí skoro 10 % školopovinných detí na nadváhu a 4,5 % detí je obéznych [6], pričom až 32,5 % zo sledovaných obéznych detí vo veku 10–16 rokov malo diagnostikovaný MS [7].
V českej detskej populácii je výskyt obezity [8] ako i komplikácií obezity veľmi podobný [9]. Preto je veľmi dôležitou (a tiež veľmi náročnou) úlohou zakladanie a vedenie detských obezitologických ambulancií, kde sú tieto deti, ktoré sú rizikové i bez zatiaľ zjavných metabolických abnormalít, sledované a liečené. Na tomto mieste si je však zároveň potrebné uvedomiť, že obezita je klinicky hodnotená na podklade BMI. Zachytené deti s hodnotou BMI výrazne presahujúcou normu vzhľadom k veku a pohlaviu môžeme rozdeliť do dvoch skupín – deti obézne s metabolickou obezitou a deti obézne bez metabolickej obezity. Zostáva však tretia skupina „obéznych detí“, ktorá je riziková a ktorá je na základe merania telesnej hmotnosti neodhalená. Sú ňou deti „metabolicky obézne“ s normálnou hmotnosťou. Tieto deti zasluhujú taktiež zvýšený záujem a treba ich aktívne vyhľadávať a dispenzarizovať. Problémom je absencia vhodného markera, ktorý by bol schopný vyselektovať zo skupiny úplne zdravo vyzerajúcich detí tie, ktoré majú prítomné metabolické abnormality.
V posledných rokoch sa v tejto súvislosti veľa pozornosti dostáva novému rizikovému faktoru, ktorý je akceptovaný aj Medzinárodnou diabetickou federáciou a ktorý by mohol odhaliť aspoň časť normálne vyzerajúcich detí s rizikom vývoja diabetu a ďalších zložiek MS. Je ním nízka pôrodná hmotnosť [10].
TEÓRIA FETÁLNEHO PÔVODU CHORÔB
V 80-tych rokoch minulého storočia britský lekár Barker a jeho spolupracovníci uverejnili výsledky veľkej epidemiologickej štúdie, v ktorej skúmali vplyv zhoršeného rastu a vývoja dieťaťa na vývoj ischemickej choroby srdca v dospelosti. Na vzorke 5654 mužov popísali výrazne zvýšenú úmrtnosť na ischemickú chorobu srdca u mužov s najnižšou hmotnosťou pri narodení a vo veku jedného roka [11].
Táto práca odštartovala obrovské množstvo ďalších štúdií po celom svete, ktoré potvrdili spojenie nepriaznivého prenatálneho prostredia s neskorším ochorením. Ak škodlivé stimuly (napríklad nevhodná výživa, psychický stres, nedostatok vitamínov, užívanie liekov, expozícia alkoholu, nikotínu, toxickým a iným látkam) pôsobia práve v kritickom období pre vývoj konkrétneho tkaniva, môžu natrvalo narušiť jeho správny vývoj a funkciu. Toto citlivé obdobie môže byť v závislosti od daného tkaniva perikoncepčné, embryonálne, fetálne, či neonatálne. Pôsobením negatívnych vplyvov môže dôjsť k narušeniu citlivých neuro-endokrinno-imunitných a metabolických interakcií vo vyvíjajúcom sa organizme, teda k narušeniu „riadiaceho systému“ [12]. Podľa teórie vývojovej plasticity sa môže organizmus na tieto nepriaznivé podnety adaptovať [13]. Adaptačné zmeny sú trvalé. Môže teda vzniknúť trvalá (i postnatálne) zmenená funkcia rôznych tkanív ako i „riadiaceho systému“.
Podľa teórie „šetriaceho fenotypu“ vznikajú adaptačné zmeny pre vyššiu životaschopnosť daného jedinca. Ak je napríklad prenatálne vystavený nedostatku potravy, adaptuje sa jeho metabolizmus na „šetriaci režim“, ktorý mu umožní maximálne využitie energetických zásob v čase ich nedostatku, v konečnom dôsledku prežitie [14]. Ak sa však postnatálne podmienky zmenia, trvalo adaptované tkanivá prestávajú byť pre svojho nositeľa výhodou. „Šetriaci režim“ pokračuje, hoci je prísun energie dostatočný. V tomto prípade môže byť normálny energetický prísun organizmom spracovávaný ako nadbytočný. Takto sa môže zvýšiť riziko vývoja diabetu, MS. Príkladom sú experimenty s gravídnymi samicami potkana, ktoré boli kŕmené nízkoproteínovou stravou. Ich potomstvo malo porušené nastavenie glukózovo-inzulínového metabolizmu so zvýšenou expresiou inzulínových receptorov a zvýšeným vychytávaním glukózy tukovým tkanivom [15], rezistenciu na ketózu [16], zvýšenú pečeňovú glukoneogenézu a uvoľňovanie glukózy pečeňou [17]. Dospelé potomstvo samíc, vystavených nízkoproteínovej diéte, vykazuje známky diabetu [18], zvýšenej adipozity [19], hypertenzie [20, 21] a cievneho poškodenia [20].
EPIGENETIKA
Akými mechanizmami dochádza k nastaveniu funkcie jednotlivých buniek, orgánov a systémov na molekulárnej úrovni? Vysvetlenie treba hľadať v epigenetike. Epigenetika je veda, zaoberajúca sa zmenami v génovej expresii, teda v „prejavovaní sa“ génov. Poradie nukleotidov v DNA zostáva pritom nezmenené. Dochádza k rôznym biochemickým reakciám na chromatíne, ktoré sú následne sprevádzané zmenou jeho štruktúry. Preto sa tiež nazýva „chromatínová dedičnosť“. Je neistá (nestabilná) a obvykle sa neriadi mendelovskými pravidlami [22].
V ľudskom genóme sa nachádza približne 30 000 génov. To, ktorý gén sa bude v ktorej bunke, počas ktorého štádia vývoja alebo života jedinca exprimovať, je presne riadené epigenetickými mechanizmami. Zjednodušene môžeme povedať, že epigenetické mechanizmy riadia „vypnutie a zapnutie“ potrebných génov v danom tkanive. Epigenetické mechanizmy sú ovplyvňované podmienkami prostredia. Expozícia fétu rôznym faktorom tak môže viesť k „zapnutiu“ rozličných génov. Z jediného základu (genotypu) môže vzniknúť množstvo dospelých foriem (fenotypov). Presná transkripcia potrebných génov a umlčanie génov nepotrebných je zabezpečené organizovaním DNA. Chromatín môže byť zahustený, vtedy sú gény inaktivované, alebo rozvláknený, vtedy sa gény prejavujú.
Kľúčové epigenetické mechanizmy, regulujúce chromatínovú organizáciu, sú biochemické reakcie, z ktorých najpreskúmanejšia je DNA metylácia. DNA metylácia prebieha na 5. pozícii cytozínu, tam, kde cytozín je v sekvencii s guanínom (-CpG-). Enzýmom sprostredkujúcim metyláciu je DNA metyltransferáza. Priamy donor metylových skupín je S-adenozylmetionín. Špecifickou formou epigenetického riadenia je „imprinting“.
Za normálnych okolností je každý gén zastúpený dvoma formami (alelami) – jedna v chromozóme od matky, druhá od otca. V 99 % prípadov sa prejavujú obe alely a spolu sa podieľajú na formovaní konkrétneho znaku. Asi u 1 % génov je však exprimovaná len jedna alela. To, či sa môže prejaviť alela otcovského alebo materského pôvodu, je presne riadené. Druhá alela je umlčaná epigenetickými mechanizmami. Takéto gény nazývame imprintované.
Imprinting prebieha špecificky počas gametogenézy. Existuje viacero teórií, prečo imprinting vznikol. Najviac akceptovaná je teória súboja pohlaví. Táto teória predpokladá, že imprinting sa vyvinul u cicavcov kvôli konfliktu záujmov matky a otca o prenos živín od matky k potomkovi. Otcovský genóm sa vyvinul pre plné využívanie materských zásob dieťaťom, pre optimálny fetálny rast a vývoj, zabezpečujúc tak prenos otcovských génov cez potomkov do ďalších generácií. Gény exprimované z materského genómu vedú k oslabeniu účinku otcovských génov, slúžia pre uchovanie živín pre matku a pre ďalšie gravidity, na úkor plodu [23]. Mnohé z imprintovaných génov regulujú placentárny a fetálny rast.
Epigenetické nastavenie všeobecne – určenie, ktoré gény sa budú prejavovať – je v diferencovaných telesných bunkách stabilné a mitoticky sa prenáša na ďalšie telesné bunky. Môže sa však dediť tiež transgeneračne a tým ovplyvniť zdravie budúcich generácií [24]. Počas vývoja pohlavných buniek sú však epigenetické znaky, vrátane genomického imprintingu, reprogramované (obr. 1).
Image 1. Načasovanie epigenetických znakov (upravené podľa Lucifero, 2004). <em>(Po obdobie fertilizácie sa metylujú imprintované gény i ostatný genóm približne rovnako, po fertilizácii zostávajú imprintované gény chránené od demetylácie – hrubá čiara, kým ostatný genóm sa demetyluje a znovu metyluje – prerušovaná čiara)</em> 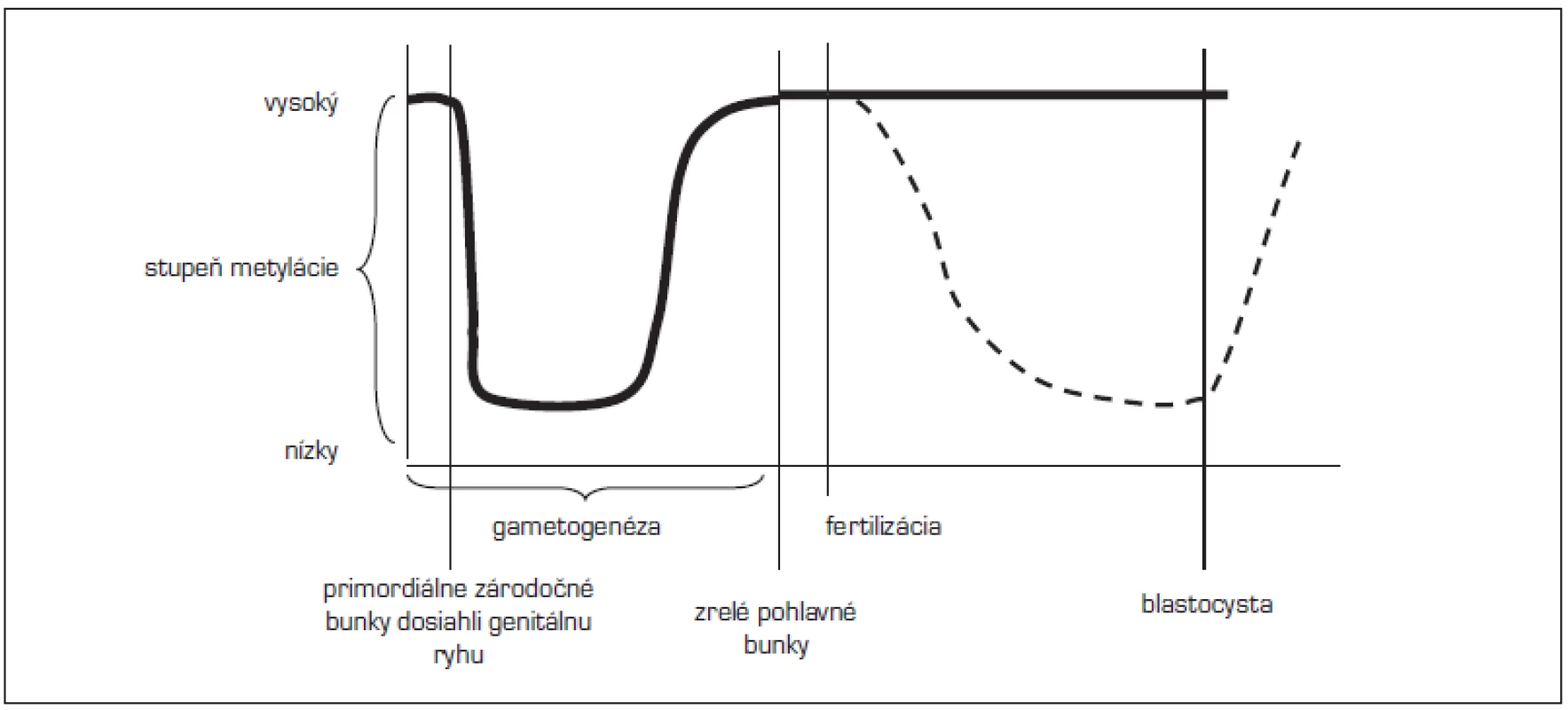
V zárodočných bunkách (vajíčkach či spermiách) dochádza v istom období k vymazaniu znakov (vrátane imprintovaných génov) a ich znovu nastoleniu (remetylácia). Z toho vyplýva, že vo vyvíjajúcich sa pohlavných bunkách dospelého fertilného človeka sa môže rôznymi stimulmi meniť epigenetické nastavenie. Je to vlastne nastavenie niektorých génov budúceho potomka. Imprinting je stanovený v zrelých pohlavných bunkách a ďalej je udržiavaný počas fertilizácie a predimplantačne, chránený od demetylácie. Inak sa správa ostatný genóm. Po fertilizácii sa, pravdepodobne aktívne, demetyluje otcovský genóm (u myši po 4 hodinách po fertilizácii). Materský genóm je chránený, demetyluje sa neskôr, pravdepodobne pasívne. V stave blastocysty je prítomné minimum metylácie, potom začína metylácia de novo [25]. Nastavenie a udržanie imprintovaných génov pred fertilizáciou a predimplantačne je dôležité pre správny vývoj embrya (viď vyššie). Pre nediferencované vyvíjajúce sa bunky embrya je však veľmi dôležitá demetylácia ostatných génov. Jednotlivé bunky demetyláciou ostatných génov dosahujú potenciál diferencovať sa v ktorékoľvek potrebné tkanivo s potrebnou funkciou.
DETI NARODENÉ S NÍZKOU PÔRODNOU HMOTNOSŤOU A/ALEBO DĹŽKOU VZHĽADOM NA GESTAČNÝ VEK (SGA)
Termín SGA (z angl. small for gestational age) popisuje novorodencov, ktorých pôrodná hmotnosť a/alebo dĺžka je nižšia, alebo rovná –2 SD pod priemerom pre daný gestačný vek. Niektoré publikácie definujú SGA ako pôrodnú hmotnosť alebo dĺžku na 3., alebo 10. percentile pre daný gestačný vek [26]. Termín SGA teda popisuje veľkosť pri narodení (na ktorú vplýva mnoho faktorov), nevyjadruje sa k vnútromaternicovému rastu. Treba preto odlišovať pojmy intrauterinná rastová reštrikcia (IUGR) a SGA, ktoré sa často nesprávne používajú ako synonymá. Pre označenie IUGR je potrebný dôkaz porušeného prenatálneho rastu potvrdený sonograficky. SGA deti mohli (a často prešli), no nemuseli prejsť fázou IUGR.
Napriek tomu sú jedinci, narodení s nízkou pôrodnou hmotnosťou (bez nutnosti dôkazu IUGR), v praxi najčastejšie študovanou skupinou, ktorá má odzrkadľovať pôsobenie negatívnych vnútromaternicových vplyvov na plod. Z novorodencov narodených SGA väčšina rastom dobehne svojich vrstovníkov, ktorí sa narodili s adekvátnou hmotnosťou, do veku 2 rokov [27]. Tento urýchlený rast nazývame „catch up” a v klinickej praxi sa hodnotí ako zrýchlený lineárny rast, pri ktorom sa dieťa dostane nad úroveň –2 SD pre daný vek. Odhaduje sa, že asi 15 % SGA narodených detí nedorastie – nedosiahne tabuľkovú hodnotu pre daný vek. Tieto deti mávajú znížený rast počas celého detstva a sú indikované k liečbe rastovým hormónom [28]. Ostatní, ktorí prešli fázou urýchleného „catch up” rastu v rannom období, sú podľa mnohých prác ešte náchylnejší na rozvoj metabolických abnormalít. Podľa „catch up” rastovej hypotézy je kľúčový vznik inzulínovej rezistencie. Novorodenci s rastovou reštrikciou majú v krvi nízke koncentrácie inzulínu a IGF-I a vysoké koncentrácie rastového hormónu. Počas prvých mesiacov po narodení dochádza k normalizácii týchto parametrov. Tkanivá, ktoré boli počas vnútromaternicového života chronicky vystavené nedostatku inzulínu a IGF-I, sú zrazu v kontakte so stúpajúcou hladinou týchto dvoch hormónov. V snahe uchrániť organizmus pred hypoglykémiou sa spúšťajú metabolické procesy, vedúce k inzulínovej rezistencii [29]. Taktiež novorodenci s extrémne nízkou pôrodnou hmotnosťou a závažnou perinatálnou a postnatálnou morbiditou, či deti vystavené v rannom období pôsobeniu závažných nepriaznivých faktorov (napr. malnutrícia) s rozvojom postnatálnej rastovej reštrikcie vykazujú rovnaké hormonálne zmeny s podobnými dôsledkami v neskoršom období (teda vysoké riziko rozvoja šetriaceho a metabolického fenotypu) [30, 31].
Deti, ktoré sa narodili s nízkou pôrodnou hmotnosťou, väčšinou nevykazujú známky MS, ani nebývajú obéznejšie ako ich vrstovníci [32, 33, 34], hoci niektoré práce hovoria o väčšej akumulácii viscerálneho tuku pri normálnom BMI [32]. V kardio-metabolických parametroch týchto detí však boli mnohokrát zaznamenané štatisticky významné odchýlky od normy. Hoci tieto nemusia byť bežnými vyšetrovacími postupmi detekovateľné, predstavujú pravdepodobne počiatky ochorenia. S rastúcim vekom sa môžu prehlbovať, až sa ochorenie naplno prejaví. U SGA detí bol pozorovaný sklon k inzulínovej rezistencii [35, 36, 37, 38], inverzný vzťah pôrodnej hmotnosti ku krvnému tlaku [39, 40, 41], hyperurikémia [40, 42], znížené hladiny adiponektínu [32, 42, 43], endoteliálna dysfunkcia ako prvé, reverzibilné štádium vývoja aterosklerózy [40, 44, 45, 46, 47]. Nízka pôrodná hmotnosť s rapídnym hmotnostným prírastkom v skorom detstve môže byť asociovaná s urýchleným adrenarché, sklonom k vyšším hladinám DHEAS u dievčat [48, 49] a redukovanou hladinou sexuálny-hormón viažuceho globulínu (SHBG), čo môže viesť k skoršiemu vývoju puberty a nižšej dospelej výške [50]. Predčasné pubarché u dievčat môže byť predchodcom MS a môže predchádzať vývoj ovariálneho nadbytku androgénov v adolescencii s poruchami menštruačného cyklu. Niektoré výsledky štúdií tiež svedčia pre zvýšené hladiny kortizolu [51], zvýšenú aktivitu sympatiku [52, 53] u detí s nízkou pôrodnou hmotnosťou.
ZÁVERY A PERSPEKTÍVY
Napriek všeobecnej akceptácii SGA detí ako rizikovej skupiny z hľadiska možného vývoja KVCH v dospelosti, neexistujú odporúčania pre ich dispenzarizáciu a liečbu. Dôvodom je, že metabolické odchýlky (hoci sú štatisticky významné) sú v detskom veku minimálne a ťažko detekovateľné, pretože závažnosť ochorenia narastá s vekom. Možnou príčinou je aj problematické určenie konkrétneho rizikového dieťaťa pre vývoj MS a kardiovaskulárneho ochorenia. Dieťa, ktoré sa narodí ako SGA, nemuselo nutne prejsť fázou negatívneho intrauterinného prostredia a IUGR, pretože na veľkosti novorodenca (fétu) sa podieľa i pohlavie, materská pôrodná hmotnosť, hmotnosť matky na začiatku gravidity, parita a materský vek, etnicita [26, 27]. Navyše, plod môže prejsť fázou IUGR, pričom sa môže narodiť ako novorodenec s adekvátnou hmotnosťou a dĺžkou (AGA). Hoci je jeho rast v priebehu gravidity zhoršený, nevybočí ešte z „normálnych“ tabuľkových hodnôt pôrodnej hmotnosti a dĺžky pre daný gestačný vek.
Nie vždy sa tiež nepriaznivé vplyvy pôsobiace intrauterinne prejavia rastovou reštrikciou. Výsledky experimentov s animálnymi modelmi potvrdili, že spojitosť negatívnych faktorov intrauterinne so zvýšeným rizikom niektorých ochorení dospelosti je nezávislá od zmien fetálnych rastových kriviek [54]. Intervenčných štúdií s ľudskou populáciou je pochopiteľne málo. Najlepšie znalosti nám poskytuje sledovanie skupín matka – dieťa. Výsledky zo štúdie Holandskej hladovej zimy (štúdia matiek, ktoré boli gravídne a vystavené stresu a hladovaniu počas 2. svetovej vojny a ich detí) dokazujú, že materská malnutrícia počas gestácie zvyšuje riziko KVCH u ich potomkov v neskoršom období.
Výsledky štúdie tiež poukazujú na odlišné dôsledky hladovania počas jednotlivých období gestácie. Hladovanie počas strednej alebo neskorej gestácie viedlo u potomkov k redukovanej glukózovej tolerancii, kým hladovanie počas skorej gestácie viedlo u potomkov k proaterogenetickým zmenám v lipidovom metabolizme, mali tiež vyššiu koncentráciu fibrinogénu, vyššie BMI, zníženú plazmatickú koncentráciu faktoru VII. Expozícia podvýžive v strede a ku koncu gestácie viedla k novorodencom, ktorí mali menšiu pôrodnú hmotnosť, boli kratší a mali menší obvod hlavy ako kontrolná skupina. Novorodenci, vystavení hladovaniu na začiatku tehotenstva, mali vyššiu pôrodnú hmotnosť a boli dlhší [55].
Nepriaznivé intrauterinné prostredie teda nemusí mať vplyv na zhoršený fetálny rast a rizikoví z hľadiska neskoršieho vývoja ochorenia sú všetci potomkovia s nepriaznivými vplyvmi, pôsobiacimi počas intrauterinného, perinatálneho a neonatálneho obdobia, bez ohľadu na ich fetálnu a neonatálnu veľkosť. Manifestácia šetriaceho fenotypu je navyše zásadným spôsobom ovplyvnená zmenou postnatálneho prostredia a expozíciou ďalším spúšťačom (napr. hojnosť energeticky bohatej stravy). Jednoznačný, v praxi využiteľný marker budúceho kardiovaskulárneho ochorenia v dôsledku pôsobenia nepriaznivých pre - a perinatálnych vplyvov teda zatiaľ neexistuje.
V etiopatogenéze ochorení zastupuje nepochybne významné miesto genetika. V dnešnej dobe sa veda i lekárska prax orientuje na hľadanie rôznych mutácií a polymorfizmov, ktoré sa spolupodieľajú na vzniku ochorenia. Na základe poznatkov z epigenetiky nie je však isté, či sa genetická dispozícia prejaví. Výzvou dnešnej medicíny by preto malo byť hľadanie spôsobov, ako správnym prostredím pozitívne ovplyvniť dispozície jedinca k chorobe a tiež skúmanie špecifických prostredí (napr. alternatívne druhy stavovania v priebehu gravidity, či prostredie médií počas umelého oplodnenia).
Kvalitná anamnéza s rodokmeňom, pretože epigenetické nastavenie sa môže prenášať na ďalšie generácie, by mala zaujať v hodnotení rizikovosti pacienta minimálne rovnaké postavenie ako genetika. Aj v dobe vynikajúcich moderných laboratórnych a zobrazovacích vyšetrení má svoje nezastupiteľné miesto a nemala by sa podhodnocovať. Deti, ktoré sa narodili ako SGA a majú pozitívnu osobnú anamnézu v zmysle výrazných nepriaznivých vplyvov (v priebehu intrauterinného a perinatálneho obdobia), so zmenou postnatálnych podmienok a expozíciou ďalším spúšťačom (napr. energeticky bohatá nezdravá strava, nadhmotnosť a pod.), alebo majú pozitívnu rodinnú anamnézu (najmä ak sa ochorenie vyskytuje v jednej línii po viacero generácií), pravdepodobne zasluhujú zo strany lekárov zvýšený dohľad.
Došlo: 5. 1. 2012
Přijato: 20. 4. 2012
MUDr. Zuzana Blusková
II. detská klinika LFUK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: zuzana.bluskova@gmail.com
Sources
1. de Onis M, Blössner M, Borghi E. Global prevalence and trends of overweight and obesity among preschool children. Am J Clin Nutr 2010; 92 : 1257–1264.
2. Engeland A, Bjørge T, Søgaard AJ, Tverdal A. Body mass index in adolescence in relation to total mortality: 32-year follow-up of 227 000 Norwegian boys and girls. Am J Epidemiol 2003; 157 : 517–523.
3. Freedman DS, Khan LK, Dietz WH, et al. Relationship of childhood obesity to coronary heart disease risk factors in adulthood: the Bogalusa Heart Study. Pediatrics 2001; 108 : 712–718.
4. Deitel M. The European Charter on counteracting obesity. Obes Surg 2007; 17 : 143-144.
5. Lobstein T, Jackson-Leach R. Estimated burden of paediatric obesity and co-morbidities in Europe. Part 2. Numbers of children with indicators of obesity-related disease. Int J Pediatr Obes 2006; 1 : 33–41.
6. Vitáriusová E, Babinská K, Košťálová Ľ, et al. Food intake, leisure time activities and the prevalence of obesity in schoolchildren in Slovakia. Cent Eur J Public Health 2010; 18 : 192–197.
7. Vitáriušová E, Košťálová Ľ, Pribilincová Z, et al. Výskyt metabolického syndrómu a jeho komponentov u obéznych detí. Čes-slov Pediat 2010; 65 : 55–61.
8. Šamánek M, Urbanová Z. Výskyt nadváhy a obezity u 7427 českých dětí vyšetřených v roce 2006. Čes-slov Pediat 2008; 63 : 120–125.
9. Marinov Z, Čepová J. Metabolické parametry pacientů dětské obezitologické ambulance. Čes-slov Pediat 2010; 65 : 72–78.
10. Zimmet P, Alberti KG, Kaufman F, et al. The metabolic syndrome in children and adolescents – an IDF consensus report. Pediatr Diabetes 2007; 8 : 299–306.
11. Barker DJP, Osmond C, Winter PD, et al. Weight in infancy and death from ischaemic heart disease. Lancet 1989; 334 : 577–580.
12. Mravec B. Vplyvy pôsobiace vo včasných vývinových obdobiach, epigenetika, starnutie a neurobiológia chorôb. In: Mravec B. Neurobiológia chorôb periférnych tkanív. Bratislava: SAP, 2008 : 1–220.
13. Bateson P, Barker D, Clutton-Brock T, et al. Developmental plasticity and human health. Nature 2004; 430 : 419–421.
14. Hales CN, Barker DJ. The thrifty phenotype hypothesis. Type 2 diabetes. Br Med Bull 2001; 60 : 5–20.
15. Ozanne SE, Nave BT, Wang CL, et al. Poor fetal nutrition causes long-term changes in expression of insulin signaling components in adipocytes. Am J Physiol 1997; 273 : 46–51.
16. Ozanne SE, Wang CL, Petry CJ, et al. Ketosis resistance in the male offspring of protein-malnourished rat dams. Metabolism 1998; 47 : 1450–1454.
17. Burns SP, Desai M, Cohen RD, et al. Gluconeogenesis, glucose handling, and structural changes in livers of the adult offspring of rats partially deprived of protein during pregnancy and lactation. J Clin Invest 1997;100 : 1768–1774.
18. Petry CJ, Dorling MW, Pawlak DB, et al. Diabetes in old male offspring of rat dams fed a reduced protein diet. Int J Exp Diabetes Res 2001; 2 : 139–143.
19. Bhasin KKS, van Nas A, Martin LJ, et al. Maternal low-protein diet or hypercholesterolemia reduces circulating essential amino acids and leads to intrauterine growth restriction. Diabetes 2009; 58 : 559–566.
20. Brawley L, Itoh S, Torrens C, et al. Dietary protein restriction in pregnancy induces hypertension and vascular defects in rat male offspring. Pediatr Res 2003; 54 : 83–90.
21. Langley-Evans SC. Hypertension induced by foetal exposure to a maternal low-protein diet, in the rat, is prevented by pharmacological blockade of maternal glucocorticoid synthesis. J Hypertens 1997; 5 : 537–544.
22. Vyskot B. Přenos epigenetické informace v liniích buněk somatické a zárodečné dráhy. In: Jonák J. Molekulární biologie a genetika XII. Praha: ÚMG, 2006 : 7–21.
23. Moore T, Haig D. Genomic imprinting in mammalian development: a parental tug-of-war. Trends Genet 1991; 7 : 45–49.
24. Jirtle RL, Skinner MK. Environmental epigenomics and disease susceptibility. Nature Rev Genet 2007; 8 : 253–262.
25. Lucifero D, Chaillet JR, Trasler JM. Potential significance of genomic imprinting defects for reproduction and assisted reproductive technology. Hum Reprod 2004; 10 : 3–18.
26. Clayton PE, Cianfarani S, Czernichow P, et al. Management of the child born small for gestational age through to adulthood: a consensus statement of the International Societies of Pediatric Endocrinology and the Growth Hormone Research Society. J Clin Endocrinol Metab 2007; 92 : 804–810.
27. Saenger P, Czernichow P, Hughes I, Reiter EO. Small for gestational age: short stature and beyond. Endocr Rev 2007; 28 : 219–251.
28. Košťálová Ľ. Rast a jeho poruchy. Nové Zámky: KORUND, 2005 : 1–56.
29. Cianfarani S, Germani D, Branca F. Low birthweight and adult insulin resistance: the „catch-up growth“ hypothesis. Arch Dis Child Fetal Neonatal Ed 1999; 81: F71–F73.
30. González-Barranco J, Ríos-Torres JM. Early malnutrition and metabolic abnormalities later in life. Nutr Rev 2004; 62 : 134–139.
31. Smith CM, Wright NP, Wales JK, et al. Very low birth weight survivors have reduced peak bone mass and reduced insulin sensitivity. Clin Endocrinol (Oxf) 2011; 75 : 443–449.
32. Ibáñez L, Lopez-Bermejo A, Suárez L, et al. Visceral adiposity without overweight in children born small for gestational age. J Clin Endocrinol Metab 2008; 93 : 2079–2083.
33. Hediger ML, Overpeck MD, McGlynn A, et al. Growth and fatness at three to six years of age of children born small - or large-for-gestational age. Pediatrics 1999; 104 : 33.
34. Martínez-Aguayo A, Capurro T, Peña V, et al. Comparison of leptin levels, body composition and insulin sensitivity and secretion by OGTT in healthy, early pubertal girls born at either appropriate - or small-for-gestational age. Clin Endocrinol (Oxf) 2007; 67 : 526–532.
35. Evagelidou EN, Giapros VI, Challa AS, et al. Serum adiponectin levels, insulin resistance, and lipid profile in children born small for gestational age are affected by the severity of growth retardation at birth. Eur J Endocrinol 2007; 156 : 271–277.
36. Sancakli O, Darendeliler F, Bas F, et al. Insulin, adiponectin, IGFBP-1 levels and body composition in small for gestational age born non-obese children during prepubertal ages. Clin Endocrinol 2008; 69 : 88–92.
37. Verkauskiene R, Figueras F, Deghmoun S. Birth weight and long-term metabolic outcomes: does the definition of smallness matter? Horm Res 2008; 70 : 309–315.
38. Pandolfi C, Zugaro A, Lattanzio F, et al. Low birth weight and later development of insulin resistance and biochemical/clinical features of polycystic ovary syndrome. Metabolism 2008; 57 : 999–1004.
39. Halvorsen CP, Andolf E, Hu J, et al. Discordant twin growth in utero and differences in blood pressure and endothelial function at 8 years of age. J Intern Med 2006; 259 : 155–163.
40. Franco MC, Christofalo DM, Sawaya AL, et al. Effects of low birth weight in 8 - to 13-year-old children: implications in endothelial function and uric acid levels. Hypertension 2006; 48 : 45–50.
41. Serné EH, Stehouwer CD, ter Maaten JC, et al. Birth weight relates to blood pressure and microvascular function in normal subjects. J Hypertens 2000; 18 : 1421–1427.
42. Kaneshi T, Yoshida T, Ohshiro T, et al. Birthweight and risk factors for cardiovascular diseases in Japanese schoolchildren. Pediatr Int 2007; 49 : 138–143.
43. Kamoda T, Nozue H, Matsui A. Serum levels of adiponectin and IGFBP-1 in short children born small for gestational age. Clin Endocrinol 2007; 66 : 290–294.
44. Goodfellow J, Bellamy MF, Gorman ST, et al. Endothelial function is impaired in fit young adults of low birth weight. Cardiovasc Res 1998; 40 : 600–606.
45. Leeson CPM, Whincup PH, Cook DG, et al. Flow-mediated dilation in 9 - to 11-year-old children: the influence of intrauterine and childhood factors. Circulation 1997; 96 : 2233–2238.
46. Leeson CPM, Kattenhorn M, Morley R, et al. Impact of low birth weight and cardiovascular risk factors on endothelial function in early adult life. Circulation 2001; 103 : 1264.
47. Wells JC, Chomtho S, Fewtrell MS. Programming of body composition by early growth and nutrition. Proc Nutr Soc 2007; 66 : 423–434.
48. Szathmári M, Reusz G, Tulassay T. Low birth weight, adrenal and sex hormones and their correlation with carbohydrate metabolism and cardiovascular physiology, investigated in young adulthood. Orv Hetil 2000; 141 : 1967–1973.
49. Veening MA, van Weissenbruch MM, Roord JJ, de Delemarre-van Waal HA. Pubertal development in children born small for gestational age. J Pediatr Endocrinol Metab 2004; 17 : 1497–1505.
50. Dunger DB, Ahmed ML, Ong KK. Early and late weight gain and the timing of puberty. Mol Cell Endocrinol 2006; 140 : 254–255.
51. Levitt NS, Lambert EV, Woods D, et al. Impaired glucose tolerance and elevated blood pressure in low birth weight, nonobese, young south african adults: early programming of cortisol axis. J Clin Endocrinol Metab 2000; 85 : 4611–4618.
52. Boguszewski MC, Johannsson G, Fortes LC, Sverrisdóttir YB. Low birth size and final height predict high sympathetic nerve activity in adulthood. J Hypertens 2004; 22 : 1157–1163.
53. Johansson S, Norman M, Legnevall L, et al. Increased catecholamines and heart rate in children with low birth weight: perinatal contributions to sympathoadrenal overactivity. J Intern Med 2007; 261 : 480–487.
54. Langley-Evans SC. Developmental programming of health and disease. Proc Nutr Soc 2006; 65 : 97–105.
55. Roseboom TJ, van der Meulen JH, Ravelli AC, et al. Effects of prenatal exposure to the Dutch famine on adult disease in later life: an overview. Mol Cell Endocrinol 2001; 185 : 93–98.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 4-
All articles in this issue
- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Využitie ultrasonografie pri diagnostike akútnej pyelonefritídy
- Hypothalamo-hypofyzární dysfunkce u dětí a dospívajících po mozkovém úrazu – prospektivní sledování
- Gangliozidóza GM1 asociovaná s mnohopočetnými mongolskými škvrnami
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
- Prenatálne a neonatálne prostredie a ich dôsledky na vývoj dieťaťa
- Čtení o logopedii – 2. část
- Prevence návykových nemocí v rodině
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
- Gangliozidóza GM1 asociovaná s mnohopočetnými mongolskými škvrnami
- Využitie ultrasonografie pri diagnostike akútnej pyelonefritídy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

