-
Medical journals
- Career
Gangliozidóza GM1 asociovaná s mnohopočetnými mongolskými škvrnami
: V. Urbanová 1; J. Behúnová 1; R. Petrovič 2; Ľ. Podracká 1
: I. Klinika detí a dorastu LF UPJŠ a DFN, Košice prednostka prof. MUDr. Ľ. Podracká, CSc. 1; Ústav lekárskej biológie, genetiky a klinickej genetiky LFUK a UNB, Bratislava prednosta doc. MUDr. D. Böhmer, PhD. 2
: Čes-slov Pediat 2012; 67 (4): 242-247.
: Case Histories
Autori prezentujú vzácnu kazuistiku 12-mesačného dieťaťa s ťažkou hypotóniou, závažným zaostávaním psychomotorického vývoja, s výraznou hepato-splenomegáliou a početnými mongolskými škvrnami splývajúceho charakteru. U pacienta boli prítomné aj viaceré vrodené vývojové chyby, ako kritická koarktácia aorty, hypospádia a obojstranná skrotálna hernia. Opakovane prekonalo ťažké recidivujúce bronchitídy a bronchopneumónie, s obrazom akútnej respiračnej insuficiencie, vyžadujúcej umelú pľúcnu ventiláciu.
Autori na základe „zvláštneho“ klinického obrazu (nápadné excesívne melanocytové škvrny, pribúdajúce podľa udania matky aj počas života dieťaťa, spolu so závažným zaostávaním psychomotorického vývoja a hepatosplenomegáliou) vyslovili podozrenie na gangliozidózu 1. typu, ktorá sa potvrdila enzymatickým vyšetrením deficitu aktivity β-D-galaktozidázy v lyzozómoch leukocytov. Zároveň sa doplnili aj výsledky rozšíreného metabolického skríningu, kde sa zistili abnormálne, špecifické vylučovanie oligosacharidov do moču, čo je typické pre GM1 gangliozidózu.Kľúčové slová:
GM1 gangliozidóza, mongolské škvrny, hepatosplenomegália, koarktácia aortyÚVOD
GM1 gangliozidóza (MIM# 230500) je vzácne autozómovo recesívne dedičné lyzozómové ochorenie, vznikajúce následkom deficitu enzýmovej aktivity kyslej β-D-galaktozidázy (E.C.3.2.1.23). Podľa charakteru špecifických klinických symptómov a veku v čase manifestácie prvých prejavov choroby rozoznávame 3 základné typy GM1 gangliozidózy:
Typ 1 – včasná infantilná forma je charakterizovaná progresívnym neurologickým poškodením už v prvom roku života, organomegáliou, dysmorfnými rysmi a čerešňovou škvrnou na očnom pozadí. Zriedkavo môže byť infantilná forma gangliozidózy asociovaná s rôznymi kožnými léziami [1, 2].
Typ 2 – neskorá infantilná/juvenilná forma nastupuje neskôr ako typ 1, prvé klinické príznaky sa zjavujú do 5. roku života. Spočiatku je prítomná len instabilita pri sedení a v stoji a/alebo poruchy chôdze. Ochorenie má však závažný priebeh a rýchlo progreduje až do spastickej kvadruparézy s pseudobulbárnymi príznakmi. Časté sú cerebrálne kŕče, ktoré zhoršujú celkový stav dieťaťa a zvyčajne ťažko reagujú na liečbu. Postihnutí pacienti nemajú na rozdiel od včasnej infantilnej formy zjavné dysmorfie ani hepatosplenomegáliu, zrak býva normálny. RTG chrbtice odhalí mierne, ale trvalé kostné zmeny s miernou anterosuperiórnou hypopláziou tiel stavcov v thorakolumbálnom spojení.
Typ 3 – dospelá/adultná forma sa označuje aj ako chronická forma GM1 gangliozidózy s neskorým začiatkom (v neskorom detstve, dospievaní až dospelosti). U pacientov nie sú prítomné známky kraniofaciálnej dyzmorfie a neurologicky sa vyvíjajú primerane, ale v neskoršom veku dochádza k pomaly progredujúcej demencii s prvkami parkinsonskej extrapyramídovej choroby a dystónie. Kognitívna porucha chýba, alebo je len mierna, pacient nemá žiadnu očnú patológiu. Ani kostné zmeny pri adultnej forme gangliozidózy nie sú konštantné. Klinický priebeh choroby je pomalý.
V kazuistike prezentujeme prípad 12-mesačného dojčaťa s ťažkou hypotóniou, závažným zaostávaním psychomotorického vývoja, s výraznou hepatosplenomegáliou a početnými rozsiahlymi mongolskými škvrnami splývajúceho charakteru. Cieleným enzymatickým vyšetrením sme potvrdili izolovaný deficit aktivity β-D-galaktozidázy v suspenzii leukocytov.
KAZUISTIKA
Prezentovaný chlapček sa narodil v 36. gestačnom týždni plánovanou sekciou pre patologické nálezy prenatálnej ultrasonografie (ascites, pleurálny výpotok, hepatomegália a dilatácia colon transversum). Pôrodná hmotnosť bola 2295 g, dĺžka 43 cm a Apgarovej skóre 8/10 bodov. Po pôrode sa zistili viaceré vrodené vývojové chyby – kritická koarktácia aorty vyžadujúca urgentnú operáciu, hypospádia a obojstranná skrotálna hernia. Dieťa bolo následne opakovane hospitalizované pre recidivujúce obštrukčné bronchitídy a bronchopneumónie, s obrazom akútnej respiračnej insuficiencie vyžadujúcej umelú pľúcnu ventiláciu, či pre iné ťažkosti a komplikácie. Rodičia dieťaťa a jeho dvaja súrodenci sú zdraví. V rodinnej anamnéze za pozornosť stojí nejasné úmrtie sestry matkinho otca pred dovŕšením druhého roku života, konsanguinita však napriek cielenej analýze sa nezistila.
Na našom pracovisku sme dieťa prvýkrát hospitalizovali vo veku 12 mesiacov. V klinickom obraze dominovalo dyspnoe, ťažká hypotónia, mikrocefália (obvod hlavy 40,5 cm, -4,1 SD), závažné zaostávanie psychomotorického vývoja (nefixoval pohľad, nesiahal za predmetmi, nesedel, neprevaľoval sa) a výrazná hepatosplenomegália (hepar 6 cm pod pravým rebrovým oblúkom, lien 5 cm pod ľavým rebrovým oblúkom) (obr. 1). Na koži boli nápadné početné modrosivé mongolské škvrny splývajúceho charakteru s maximom na chrbte, gluteách a stehnách (obr. 2).
1. Výrazná hepatosplenomegália u pacienta s GM1 gangliozidózou. Fig. 1. The marked hepatosplenomegaly in a patient with GM1 gangliosidosis. 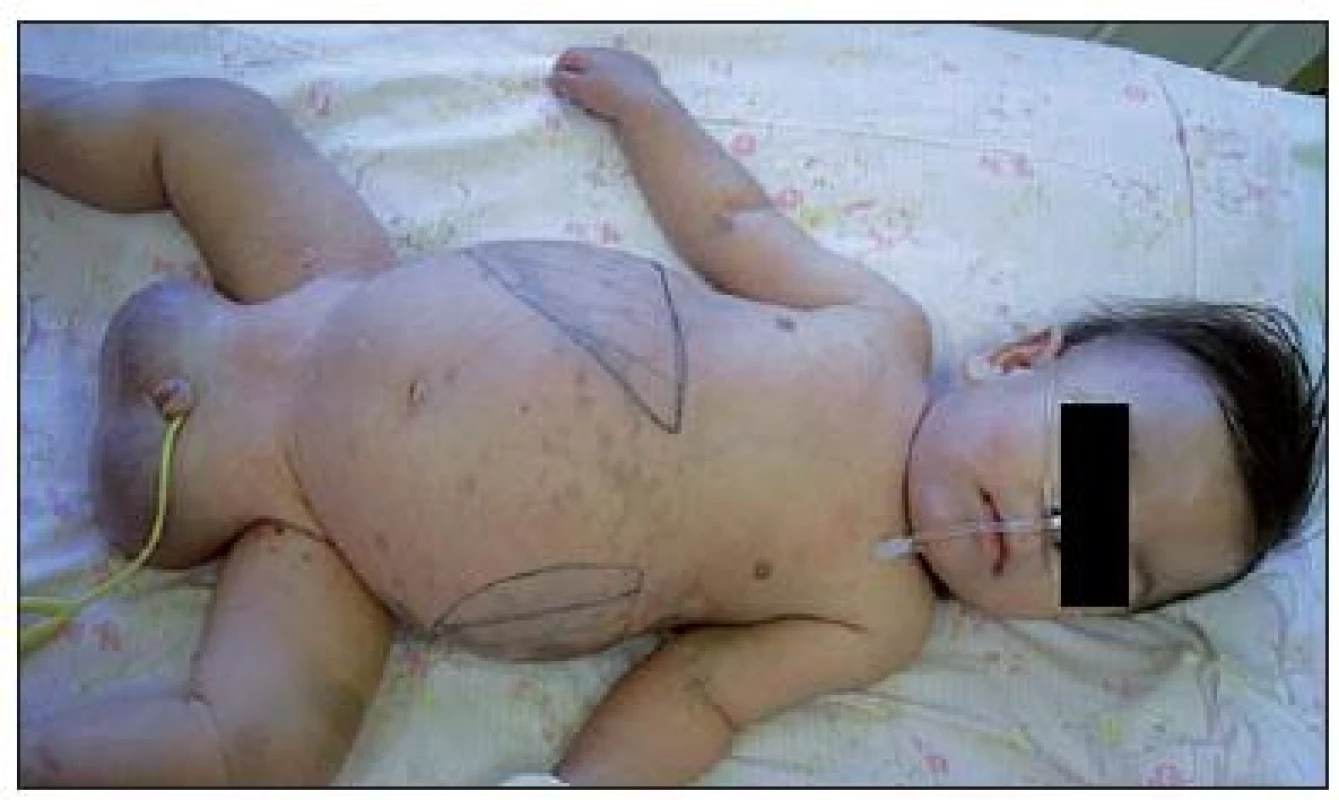
2. Početné modrosivé mongolské škvrny splývajúceho charakteru s maximom na chrbte, gluteách a stehnách. Fig. 2. A multiple blue-grey mongolian spot of coinciding character with maximum on the spite, glutei and thighs. 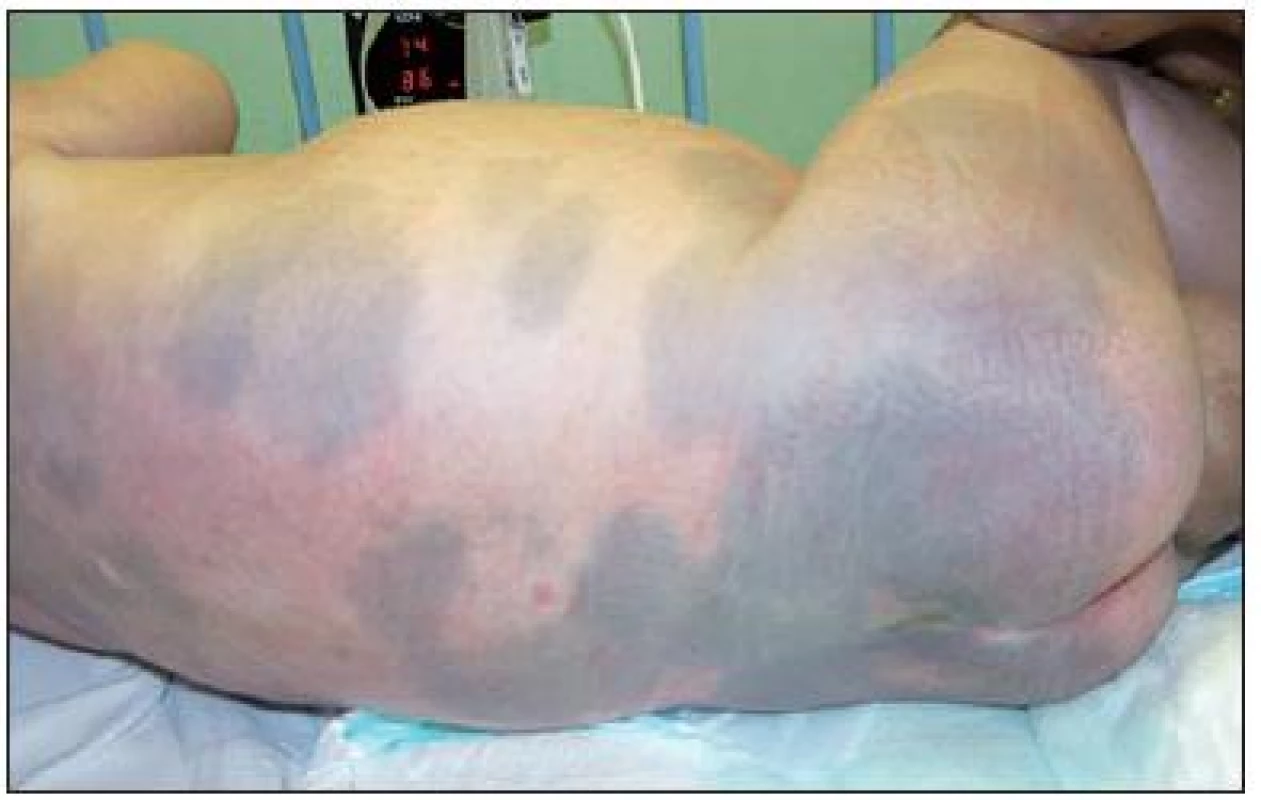
V laboratórnych vyšetreniach bola nízka zápalová aktivita (CRP 9 mg/l), krvný obraz a koagulačné parametre boli v norme. V biochemickom paneli sme zistili ľahko elevované aminotransferázy (AST 1,25 µkat.l-1, ALT 1.38 μkat.l-1, GMT 1.01 µkat.l-1) a nižšie imunoglobulíny pri normálnej hladine celkových bielkovín. Parametre acidobázickej rovnováhy boli uspokojivé, CO2 pacient neretinoval, ale na udržanie dostatočnej saturácie si vyžadoval kyslíkovú podporu (0,5–1 l/min). RTG snímka odkryla zníženú transparenciu pľúcneho parenchýmu pri zápalových zmenách a dystelektázu. Z nasofaryngeálneho sekrétu sa vykultivoval Pneumocystis carinii (Jiroveci), preto sme ordinovali cielenú liečbu trimetoprimom. Ukazovatele bunkovej imunity podporili predpoklad sekundárneho celulárneho imunodeficitu. Oftalmologickým vyšetrením sa potvrdila macula corneae vpravo, konvergentný strabizmus a suspektný vrodený glaukóm vpravo. EEG vyšetrenie odhalilo generalizovanú epilepsiu. Karyotyp bol normálny 46,XY.
Po komplexnom zhodnotení doterajšieho priebehu a „zvláštneho“ klinického nálezu (nápadné excesívne melanocytové škvrny, pribúdajúce podľa udania matky aj počas života dieťaťa, spolu so závažným zaostávaním psychomotorického vývoja a hepatosplenomegáliou) sme suponovali gangliozidózu 1. typu, resp. niektorý typ mukopolysacharidózy. Indikovali sme rozšírený metabolický skríning, ako aj priamo vyšetrenie aktivity β-D-galaktozidázy.
V suspenzii leukocytov pacienta sa zistila len reziduálna enzýmová aktivita β-D-galaktozidázy – 4 nmol/h/mg proteínu (5 % spodnej hranice, referenčné pásmo: 80–160 nmol/h/mg) a fyziologická aktivita kontrolného enzýmu hexozaminidázy, čo diagnózu GM1 gangliozidózy významne podporilo. Rovnako aj aktivita chitotriozidázy v sére bola hlboko pod dolnou referenčnou hranicou – 0,2 nmol/h/ml (referenčné pásmo 4–200 nmol/h/ml). Porovnanie aktivity oboch vyšetrených enzýmov pacienta s kontrolnou vzorkou takisto potvrdilo izolovaný deficit aktivity β-D-galaktozidázy u pacienta (aktivita β-D-galaktozidázy v kontrolnej vzorke bola 147 nmol/h/mg). Aktivita enzýmov β-D-galaktozidázy a chitotrizidázy sa stanovovala citlivou flourimetrickou metódou, pričom sa sledovala schopnosť pacientských leukocytov resp. séra metabolizovať arteficiálny, fluorescenčne značený substrát, 4-metylumbelliferyl-β-D-galaktopyranozid resp. 4-methylumbelliferyl β-D-N,N′,N″-triacetylchitotriozid. Hydrolýzou značených substrátov vzniká flurescenčná molekula 4-methylumbelliferón, ktorá je kvantifikovaná pomocou flourimetra (excitácia 366 nm a emisia 446 nm) a porovnaná s kalibračnou krivkou. Hodnoty enzýmov sú vyjadrené v nanomóloch hydrolyzovaného substrátu za hodinu 1 mg leukocytov resp. 1 ml séra. Zároveň sa doplnili aj výsledky rozšíreného metabolického skríningu, kde sa zistilo abnormálne, špecifické vylučovanie oligosacharidov do moču, čo je typické pre GM1 gangliozidózu (obr. 3).
3. Tenkovrstvová chromatografia (TLC) oligosacharidov moča. Dráha 1: pacient – GM1 gangliozidóza, dráha 2 a 3: normálny profil oligosacharidov v moči, dráha 4: referenčná – štandardy (od vrchu dole), xylóza/glukóza/galaktóza/laktóza/rafinóza. Abnormálne frakcie oligosacharidov typické pre GM1 gangliozidózu sú indikované šípkou. Fig. 3. Thin-layer chromatography (TLC) of urinary oligosaccharides: Track 1: patient – GM1 gangliosidosis, tract 2 and 3: normal profile of oligosaccharides in urine, track 4: reference standards (from top to bottom), xylose/glucose/galactose/lactose/raffinose. Abnormal fractions of oligosaccharides typical for GM1 gangliosidosis are indicated by arrow. 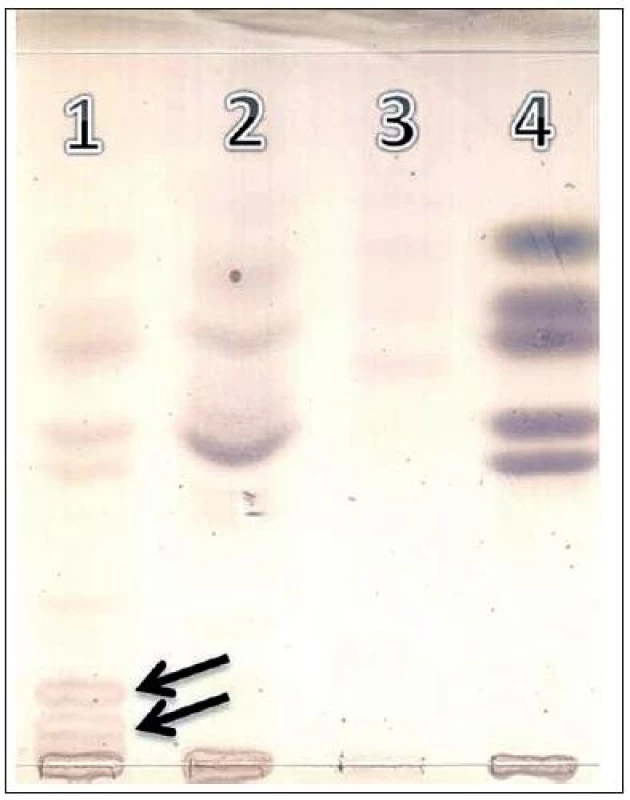
DISKUSIA
V článku opisujeme vzácnu kazuistiku dojčaťa s excesívnymi mongolskými škvrnami asociovanými s výraznou hepatosplenomegáliou, hypotóniou a oneskoreným psychomotorickým vývojom. Suponovanú diagnózu GM1 gangliozidózu sme potvrdili enzymatickým vyšetrením leukocytov (aktivita β-D-galaktozidázy len 5 % normy).
Vzájomnú asociáciu medzi GM1 gangliozidózou a početnými mongolskými škvrnami prvýkrát opísali Weissbluth a kol. v roku 1981 [3]. Správa o ďalšom „podobnom“ dieťati bola publikovaná v roku 1989, krátko na to sa sporadicky uvádzajú aj ďalšie kazuistiky. Zaujímavý prípad 5-mesačného dievčatka z konsanguinného vzťahu pakistanských rodičov s respiračnými ťažkosťami, neprospievaním, rozsiahlymi mongolskými škvrnami, hepatosplenomegáliou a oneskoreným neurologickým vývojom opísali tiež autori z Londýna [4]. Dvaja z bratrancov otca dievčatka zomreli pred dovŕšením 2. roku života a u probandky sa ku konečnej diagnóze gangliozidózy I. typu dospelo až po sérií zdĺhavých vyšetrení. Biopsia z hyperpigmentovaných ložísk histologicky potvrdila typické mongolské škvrny. Dievčatko napriek intenzívnej podpornej liečbe zomrelo vo veku 9 mesiacov.
Včasná infantilná forma (GM1) je prognosticky najzávažnejší typ gangliozidózy. Prevalencia GM1 gangliozidózy sa odhaduje na 1 z 100 000–200 000 novorodencov [5]. Postihnuté deti sú často už v prvých dňoch, alebo týždňoch života hypotonické a nedokážu „udržať“ hlavičku. Vo veku 3–6 mesiacov sa pozoruje neurologický regres. Poruchy výživy a neprospievanie sú pravidlom takmer u všetkých detí. V typických prípadoch sú už včasne prítomné dysmorfné rysy – edematózna tvárička, mierna makroglosia, hypertrofia gingív, vpadnutý koreň nosa, tvár veveričky. Avšak na druhej strane treba uviesť, že u časti postihnutých dojčiat faciálna dyzmorfia nie je zjavná (ako nebola ani u nášho pacienta). Takmer vždy je ale prítomná hepatomegália a neskôr aj splenomegália [6]. Časté sú poruchy zraku s kyvadlovým nystagmom. Asi polovica pacientov má čerešňovú škvrnu na očnom pozadí, ale zriedka sa nájde pred 6. mesiacom veku. Hypotónia prechádza časom do spasticity. Po prvom roku života je typický rýchly regres neurologického vývoja s generalizovanými kŕčmi, poruchami hĺtania, decerebračnou postúrou a smrťou, zvyčajne pred dosiahnutím 2. roku života [7]. Klinický obraz GM1 gangliozidózy v sebe spája črty neurolipidózy (neurodegenerácia, makulárne čerešňovo-červené škvrny) a mukopolysacharidózy (visceromegália, hrubé rysy tváre), lebo vzhľadom na multifunkčnosť chýbajúceho enzýmu sa najmä v mozgu a parenchymatóznych orgánoch kumulujú viaceré metabolity: sfingolipid GM1 gangliozid, oligosacharidy derivované z glykoproteínov a keratansulfát [8]. Je zaujímavé, že pri obidvoch týchto entitách, a predovšetkým GM1 gangliozidóze a MPS 1, sa vzácne vyskytujú nápadné a excesívne mongolské škvrny, ktoré môžu byť kľúčom k diagnóze dedičnej poruchy metabolizmu lyzozómov [9, 10, 11]. Aj u nášho pacienta charakteristické klinické črty spolu s perzistujúcimi a pribúdajúcimi mongolskými škvrnami, nás viedli k diferenciálne diagnostickej úvahe o dedičnej metabolickej poruche „strádavého“ typu.
Nález rozsiahlych mongolských škvŕn („blue-gray macule of infancy“) splývajúceho charakteru s maximom výskytu na chrbte, gluteách a stehnách si vždy zasluhuje osobitnú pozornosť. Mongolské škvrny sú benígne, vrodené, makulárne, modro-šedé hyperpigmentácie rôznej veľkosti a tvaru, ktoré sa často vyskytujú v lumbosakrálnej oblasti aj u zdravých novorodencov predominantne mongolskej rasy (ev. etník pochádzajúcich z Ázie). V histologickom obraze sa vyznačujú proliferáciou melanocytov uprostred dermis. Môžu rásť do veľkosti aj hustoty, nie sú však excesívne, splývavé a nepribúdajú, ale naopak, časom postupne spontánne vymiznú (obvykle do veku 5 rokov) [4]. Z lézie perzistujúcej mongolskej škvrny sa histologicky zistili dermálne dendritické melanocyty a tiež perivaskulárne nahromadenie penovitých histiocytov [12]. Hanson a spol. opísali dve dojčatá s extenzívnou dermálnou melanocytózou, ktorá bola u prvého pacienta asociovaná s gangliozidózou GM1 typu 1, a u druhého dieťaťa boli modrošedé škvrny pokrývajúce rozsiahle časti kože spojené s Hurlerovej syndrómom. Autori predpokladajú, že kumulácia metabolitov pri týchto ochoreniach môže nepriamo prispievať k zadržaniu transdermálnej migrácie melanocytov vo vnútri dermis, čo dáva vzhľad modrošedých kožných lézii [13]. V literatúre bolo doposiaľ publikovaných len 39 prípadov lyzozomálnych dedičných metabolických porúch (ďalej DMP) spojených s kožnou melanocytózou. Z nich sa u 24 pacientov diagnostikovala Hurlerova choroba a u 11 detí GM1 gangliozidóza. Náš pacient bol zaujímavý ešte tým, že okrem mnohopočetných mongolských škvŕn mal aj kritickú koarktáciu aorty, ktorá si hneď na druhý deň po pôrode vyžadovala urgentnú kardiologickú operáciu. V dostupnej literatúre sme nezaznamenali prípad dieťaťa s gangliozidózou typu 1, s mongolskými škvrnami a s touto vrodenou chybou srdca. Opísaná bola ale závažná infantilná forma s kardiomyopatiou [12]. GM1 gangliozidóza môže byť tiež príčinou neimúnneho hydropsu plodu. Prejavila sa takto aj u nášho pacienta, u ktorého sa už prenatálne diagnostikoval ascites, pleurálny výpotok a hepatomegália.
Genetické riziko pre súrodencov pacientov s gangliozidózou je vzhľadom na autozómovo recesívny spôsob dedičnosti 25%. Cieleným pátraním sa v sledovaných rodinách často nájde rôzny stupeň pokrvného príbuzenstva. Rodičia nášho pacienta však počas dôkladnej genealogickej analýzy negovali výskyt konsanguinity v užšom aj v širšom príbuzenstve. Etnická predominancia GM1 nebola opísaná, s výnimkou adultnej formy, ktorá sa vyskytuje najčastejšie v Japonsku.
GM1 je vyvolaná mutáciou génu GLB1 kódujúceho kyslú β-D-galaktozidázu. Tento enzým je dôležitou súčasťou bunkového multienzýmového lyzozómového komplexu a má zásadnú úlohu pre fyziologické fungovanie nervového tkaniva. Patologické mutácie génu GLB1 zapríčiňujú zníženú, v závažných prípadoch až nulovú aktivitu β-D-galaktozidázy, ktorá katalyzuje štiepenie glykokonjugátov s terminálnou β-D-galaktozidovou väzbou. Táto väzba je nevyhnutná nielen pre degradáciu GM1 gangliozidov a ďalších glykosfingolipidov, ale aj pre oligosacharidy s obsahom galaktózy a keratansulfátov [8]. To vysvetľuje, prečo sa pri závažných formách tejto metabolickej poruchy prekrývajú fenotypické rysy neurolipidóz, mukopolysacharidóz a oligosacharidóz. Deficit β-D-galaktozidázy sa spája s dvoma klinicky odlišnými chorobami: s GM1 gangliozidózou s dominanciou prejavov sfingolipidózy a s Morquiovym syndrómom (mukopolysacharidóza typu IV B – MPS IV B) s klinickými črtami charakteristickými pre poruchu mukopolysacharidov (hromadenie keratan sulfátu a chondroitin-6-sulfátu), pre ktorý je charakteristické postihnutie prevažne skeletálneho systému, sluchu a zraku (zákaly), avšak samotný nervový systém a vnútorné orgány ako pečeň, slezina, zostávajú bez významnejších patológií [14, 15].
Závažnosť priebehu závisí od reziduálnej funkcie a množstva prítomného enzýmu v lyzozómoch buniek. V tkanivách pacientov s GM1 gangliozidózou sa dokázali tri hlavné skupiny nahromadených metabolitov: sfingolipid GM1 gangliozid, oligosacharidy derivované z glykoproteínov a keratansulfát. Infantilný typ GM1 gangliozidózy masívne postihuje mozgové tkanivo s ukladaním/hromadením GM1 gangliozidu [16]. V pečeni a slezine sa hromadí keratansulfát a ďalšie mukopolysacharidy. Množstvo vylučovaného keratansulfátu v moči je nižšie pri GM1 gangliozidóze ako pri Morquiovom syndróme typu IV B, naopak pri GM1 gangliozidóze sa v porovnaní s MPS IV B omnoho významnejšie do moču vylučujú oligosacharidy, čo pri klinických pochybnostiach predstavuje aj možnosť diferenciálnej diagnostiky medzi týmito dvoma jednotkami [17]. U nášho pacienta sme zistili abnormálne, špecifické vylučovanie oligosacharidov do moču, čo je typické pre GM1 gangliozidózu. Diagnostika by sa mala začať hneď po narodení dieťaťa s neimúnnym hydropsom plodu, a to vyšetrením mukopolysacharidov a oligosacharidov v moči [18]. Pri klasickej infantilnej forme sa do moču masívne vylučujú oligosacharidy, pri forme s dominujúcim neurodegeneratívnym ochorením je exkrécia miernejšia. Analýza mukopolysacharidov v moči odhalí zvýšené vylučovanie keratansulfátu. Pri GM1 gangliozidóze môžu byť prítomné vakuolizované lymfocyty, preto pri podozrení na túto metabolickú poruchu je potrebné dôkladne vyšetriť krvný náter. Keď je vyšetrenie krvného náteru sporné/ťažko hodnotiteľné, pátrame v kostnej dreni po náleze penovitých histiocytov. Biopsiou postihnutých orgánov sa zistia nahromadené metabolity priamo v tkanive („strádavé“ zložky). Diagnózu potvrdí enzymatické vyšetrenie, ktoré dokáže deficit aktivity kyslej β-D-galaktozidázy v leukocytoch, a dnes už exaktne aj molekulovo-genetické vyšetrenie génu GLB1.
Kauzálna liečba gangliozidózy GM1 zatiaľ neexistuje. Antikonvulzíva a iná symptomatická terapia môžu spočiatku zmierniť príznaky, ale progresiu choroby nezastavia. V súčasnosti prebieha niekoľko klinických štúdií o funkcii chaperónov v liečbe lyzozomálnych ochorení, ale ich efekt v praxi sa ešte nepotvrdil [19].
ZÁVER
GM1 gangliozidóza je vzácna dedičná metabolická porucha, spôsobená mutáciami génu kódujúceho enzým kyslá β-D-galaktozidáza, vedúcimi k deficitu aktivity tohto enzýmu v lyzozómoch buniek a k hromadeniu GM1 gangliozidov a iných pôsobkov v centrálnej nervovej sústave a ďalších orgánoch. Choroba môže byť vzácne asociovaná s početnými mongolskými škrvnami, ako to bolo aj u nášho pacienta.
Nález excesívnych mongolských škvŕn u dojčaťa s hepatosplenomegáliou a zaostávaním vývinu by mal vždy upriamiť pozornosť aj na dedičnú metabolickú poruchu lyzozómov.
Došlo: 25. 2. 2012
Přijato: 15. 6. 2012
Prof. MUDr. Ľudmila Podracká, CSc.
1. Klinika detí a dorastu UPJŠ LF a DFN
Trieda SNP 1
040 11 Košice
Slovenská republika
e-mail: ludmila.podracka@upjs.sk
Sources
1. Su F, Li F, Jin H-Z. Extensive mongolian spots in a child with mucopolysacharidosis II, case report. Int J Derm 2010; 49 : 438–440.
2. Leung AKC, Robson WLM. Mongolian spots and GM1 gangliosidosis type one. J Roy Soc Med 1993; 86 : 120–121.
3. Weissbluth M, Esterly NB, Caro WA. Report of an infant with GM1 gangliosidosis type I and extensive and unusual mongolian spots. Br J Derm 1981; 104 : 195–200.
4. Beattie RM, Harvey D. Extensive and unusual Mongolian blue spots in a child with GM1 gangliosidosis type one. J Roy Soc Med 1992; 85 : 574–575.
5. Tegay DH. GM1 gangliosidosis. 2009, http://emedicine.medscape. com/article/951637-overview#showall, [citated 2012 Jan 16].
6. Brunetti-Perri N, Scaglia F. GM1 gangliosidosis: review of clinical, molecular, and therapeutic aspects. Mol Genet Metab 2008; 94 (4): 391–396.
7. Kliegman RM, Behrman RE, Jensen HB, et al. Lipidoses. In: McGovern MM, Desnick R.J. Nelson Textbook of Pediatrics. 18th ed. Philadelphia: An Imprint of Elsevier, 2007 : 593–595.
8. Fernandes J, Saudubray J-M, Berghe G, et al. Diagnostika a léčba dědičných metabolických poruch. 4. vyd. Praha: Triton, 2008 : 535–536.
9. Senanayake MP, Dissanayake PV, Rupasinghe S, et al. Unusually large mongolian blue spots in GM1 gangiosidosis: Is there an association? Sri Lanka Journal of Child Health 2010; 39 : 117–118.
10. Silengo M, Battistoni G, Spada M. Is there a relationship between extensive mongolian spots and inborn errors of metabolism? Am J Med Genet 1999; 87 : 276–277.
11. Dweikat I, Libdeh BA, Hanadi M, et al. GM1 gangliosidosis associated with neonatal-onset of siffuse ecchymoses and mongolian spots. Indian J Dermatol 2011; 56 : 98–100.
12. Nyhan WL, Barshop BA, Ozand PT. Atlas of Metabolic Diseases, GM1 Gangliosidosis/β-Galactosidase Deficiency. 2nd ed. London: Hodder Arnold, 2005 : 599–607.
13. Hanson M, Lupski JR, Hicks J, et al. Association of dermal melanocytosis with lysosomal storage disease. Arch Dermatol 2003; 139 : 916–920.
14. Hofer D, Paul K, Fantur K, et al. Phenotype determining alleles in GM1 gangliosidosis patients bearing novel GLB1 mutations. Clinical Genetics (an international journal of genetics molecular and personalized medicine) 2010; http://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2010.01378.x/pdf [citated 2012 Jan 25].
15. Caciotti A, German SC, Rivera-Colón Y, et al. GM1 gangliosidosis an Morquito B disease: an update on genetic alterations and clinical findings. Biochim Biophys Acta 2011; 1812 (7): 782–790.
16. Bloch LD, Matsumoto FY, Belda W Jr, et al. Dermal melanocytosis associated with GM1-gangliosidosis type 1. Acta Derm Venereol 2006; 86 : 156–157.
17. Callahan JW. Pathophysiological bases of GM1 gangliosidosis and Morquito, type B: a hypothesis. Biochimica at Biophysica Acta 1999; 1455 : 85-103.
18. Hoffman GF, Nyhan WL, Zschocke J, et al. Dědičné metabolické poruchy. Praha: Grada Publishing, 2006 : 349–360.
19. Fantur KM, Wrodnigg TM, Stütz AE, et al. Fluorous iminoalditols act as effectie pharmacological chaperones against gene products from GLB1 alleles causing GM1-gangliosidosis and Morquio B disease. J Inherit Metab Dis 2011; [Epub ahead of print].
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 4-
All articles in this issue
- Does the postnatal detection of renal pelvis dilation a higher risk of urinary tract infection?
- Application of ultrasonography in the diagnostics of pyelonephritis
- Hypothalamic-hypophyseal dysfunction in children and adolescents after brain injury – a prospective observation
- GM1 gangliosidosis associated with multiple mongolian spots
- Total anomalous pulmonary venous return – uncommon cause of failure to thrive in infant
- Prenatal and neonatal environment and their consequences in child’s development
- Reading about speech and language therapy
- Preventing illicit drug use in a family
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Does the postnatal detection of renal pelvis dilation a higher risk of urinary tract infection?
- Total anomalous pulmonary venous return – uncommon cause of failure to thrive in infant
- GM1 gangliosidosis associated with multiple mongolian spots
- Application of ultrasonography in the diagnostics of pyelonephritis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

