-
Medical journals
- Career
Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
: J. Radvanová 1; J. Kozák 2; P. Vojtovič 3
: Dětské oddělení, Nemocnice Třebíč, přísp. org. primářka. MUDr. A. Holubová 1; Ambulance dětské kardiologie, Třebíč 2; Dětské kardiocentrum, FN Motol, Praha primář prof. MUDr. J. Janoušek, Ph. D. 3
: Čes-slov Pediat 2012; 67 (4): 248-252.
: Case Histories
Neprospívání dítěte v kojeneckém věku je častým důvodem k návštěvě PLDD a následně i hospitalizace na dětských odděleních. Mezi jeho vzácné příčiny patří i vrozené srdeční vady.
V naší kazuistice popisujeme případ 2měsíční holčičky s totálním anomálním návratem plicních žil. Příčinou neprospívání byla vrozená srdeční vada vyžadující semiurgentní kardiochirurgickou operaci.Klíčová slova:
neprospívání, totální anomální návrat plicních žil, srdeční selhání, kojenecÚVOD
Vrozená srdeční vada (VSV) je diagnostikována u necelého 1 % živě narozených dětí. Jen asi 15 % těchto dětí není nutné operovat, neboť dochází ke spontánní úpravě, 5 % bývá primárně inoperabilních [1]. Nejčastější VSV je defekt komorového septa (42 %), následují defekt síňového septa (9 %), aortální a pulmonální stenóza (6–8 %), koarktace aorty (5 %); ostatní vrozené srdeční vady jsou již méně časté [2]. Mezi vzácnější VSV patří totální anomální návrat plicních žil (TAPVC), který tvoří sice jen 1–3 % z této skupiny onemocnění [3], může však svou závažností ohrozit dítě na životě.
V klasickém dělení je TAPVC řazena mezi kritické cyanotické vady a může být sdružena s dalšími srdečními anomáliemi. Patofyziologickým podkladem vady je abnormální embryonální vývoj plicních žil, které vyúsťují přímo do pravé síně, koronárního sinu nebo do povodí dutých žil, což vede k anomálnímu návratu okysličené krve z plic. Srdce tak nemá přímé spojení plicních žil s levou síní. Hemodynamicky dochází k objemovému přetížení pravého srdce, jeho dilataci, vzniká plicní hypertenze a městnání na plicích.
Podle vyústění plicních žil rozlišujeme 4 typy TAPVC – suprakardiální (ústí do povodí horní duté žíly, výskyt asi v 55 %), kardiální (napojení do koronárního sinu nebo přímo do pravé síně, 30 %), infrakardiální (cca v 13 %, nejčastěji do portálního řečiště) a vzácně smíšený (2 %) [4]. Přidruženou vadou bývá zpravidla defekt síňového septa nebo otevřený arteriální duktus. Tyto zkraty dovolují alespoň částečné mísení okysličené krve. Podobně jako u ostatních VSV se předpokládá multifaktoriální příčina vzniku TAPVC, vzácně jsou popsány i rodiny s autozomálně dominantní formou přenosu [5].
KAZUISTIKA
Uvádíme případ holčičky, narozené z 1. gravidity ve 40. týdnu těhotenství, porod byl indukován pro hypertenzi matky v posledním týdnu gravidity. Prenatální screeningy včetně UZ byly negativní. Porodní hmotnost 3850 g a délka 51 cm, s normální poporodní adaptací. Při propuštění z porodnice plně kojena, prospívá.
Asi 14 dní po porodu potíže s kojením, dítě je unavené, nechce se přisát, proto krmeno odstříkaným mlékem z lahve, váhové přírůstky cca 20 dkg týdně. Dechové potíže nepozorovány. Při delším rozbalení si maminka všímá promodrávání periferie. V průběhu druhého měsíce života váhové přírůstky klesají na 5–10 dkg za týden (obr. 1).
1. Růstový graf, hmotnost v průběhu 1. roku života. Je patrné snížení váhových přírůstků ve 2. měsíci života, rovněž patrný příznivý efekt operace, která je znázorněna šipkou na ose x. (Vytvořeno s použitím citace 19) Fig. 1. Growth curve, body mass in the course of the 1st year of life. The decreasing weight increments in the 2nd month of life are apparent as well as a favorable effect of the operation, which is depicted by arrow on the X axis. (Created according to reference 19.) 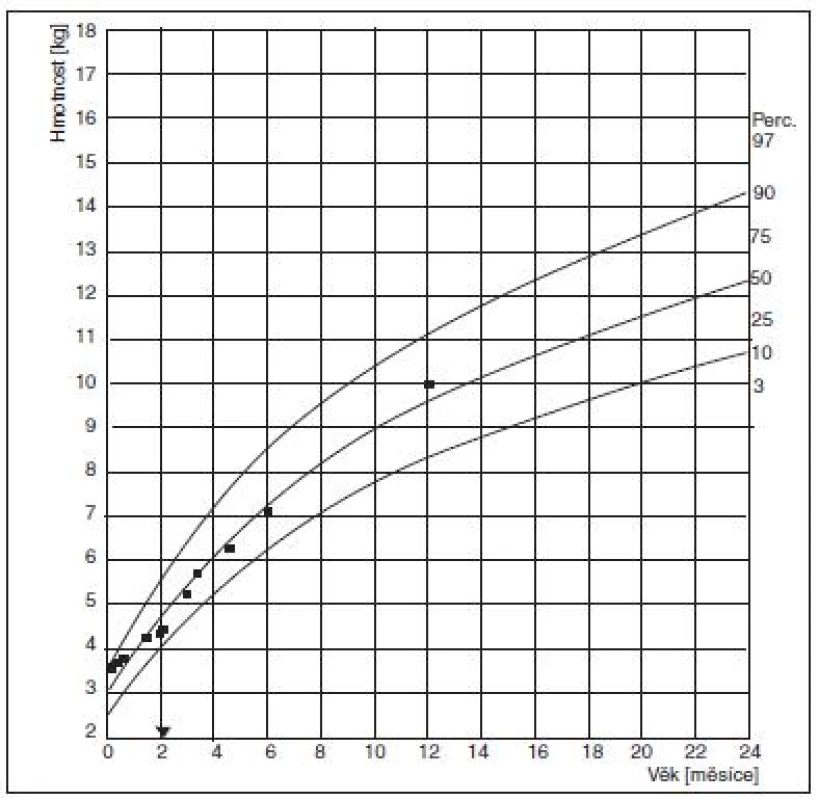
Ve věku 2 měsíců byla holčička odeslána praktickým lékařem k hospitalizaci pro neprospívání a dráždivost. Při příjmu v klidu klinický nález bez pozoruhodností: hmotnost 4500 g, délka 56 cm, TK 90/60 mmHg, HR 130/min, afebrilní, T 36,8 °C, AS pravidelná, ozvy ohraničené, dýchání čisté, eupnoe, periferie bez cyanózy, saturace 96 %, játra přesahují oblouk o 2 cm, po křiku ale rychlá dechová a oběhová dekompenzace – cyanóza, dušnost, tachypnoe 80/min, tepová frekvence 170/min. Na EKG sinusová tachykardie, intervaly v normě, známky hypertrofie pravé komory, repolarizace bez patologie. Dívenka byla přijata na JIP, kde byl zajištěn periferní žilní vstup, při kontinuální monitoraci vitálních funkcí saturace 60–70 %, HR 180/min, TK 85/55 mmHg. Oxygenoterapie byla bez efektu, ale po sedaci fenobarbitalem nastalo výrazné zlepšení, při průtoku 10 litrů O2/min již saturace 100 %. V diferenciální diagnóze byla zvažována pneumonie, sepse, meningitida, metabolické a další onemocnění. Provedená vyšetření ale žádné z výše uvedených podezření nepotvrdila. Vstupní laboratorní vyšetření ukázala nízkou zánětlivou aktivitu, hyperkalemii 6,0 mmol/l, zvýšený troponin T – 0,078 μg/l (norma do 0,016). Následně byl proveden rtg srdce a plic, kde byla popsána zmnožená bronchovaskulární kresba, kardiothorakální index 0,45 (obr. 2).
2. Zadopřední rtg srdce a plic, vstupní vyšetfiení: zmnožená bronchovaskulární kresba, kardiothorakální index 0,45. Fig. 2. Anterior-posterior X-ray of the heart and lungs, entry examination: multiplied bronchovascular picture, cardiothoracic index 0.45 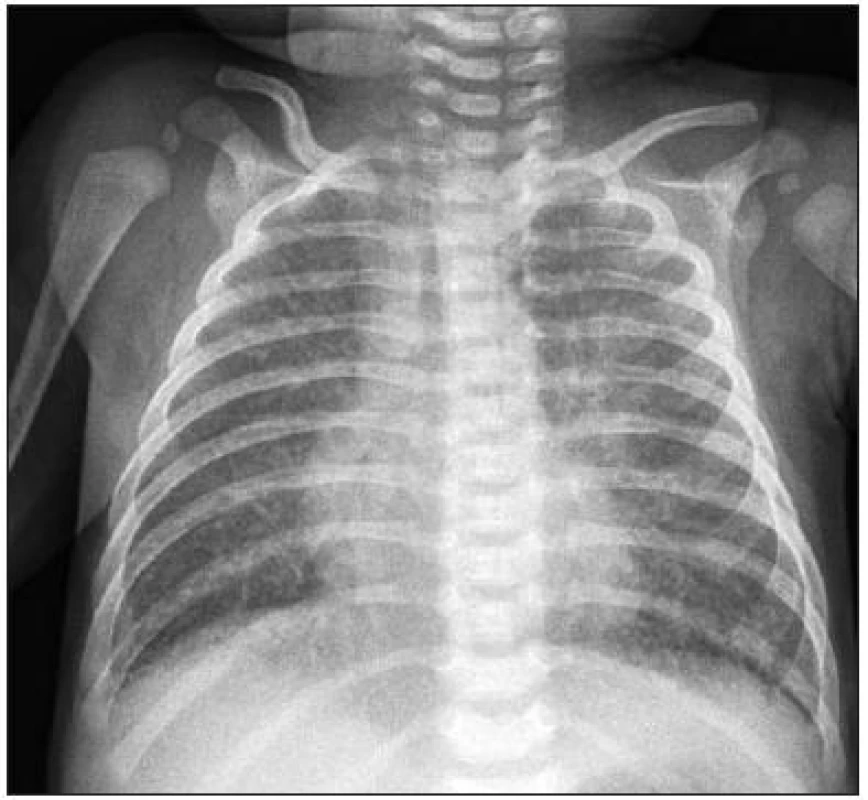
K vyloučení zvažované VSV bylo svoláno kardiologické konzilium, kde bylo na základě echokardiografie vysloveno podezření na totální anomální návrat plicních žil, infradiafragmatický typ (obr. 3, 4).
3. Subkostální sagitální projekce: distální žíla (DŽ) – žilní kmen, derivující confluens plicních žil, zachyceno po průchodu bránicí, s obstrukcí (gradient podle kontinuálního Dopplera 9/6 mmHg) při vústění do vena portae. Fig. 3. Subcostal long axis view: distal vein – venous stem, deriving confluence of pulmonary veins as detected in coming through the diaphragm and with obstruction (gradient according to continuous Doppler 9/6 mmHg) in outfall into portal vein. 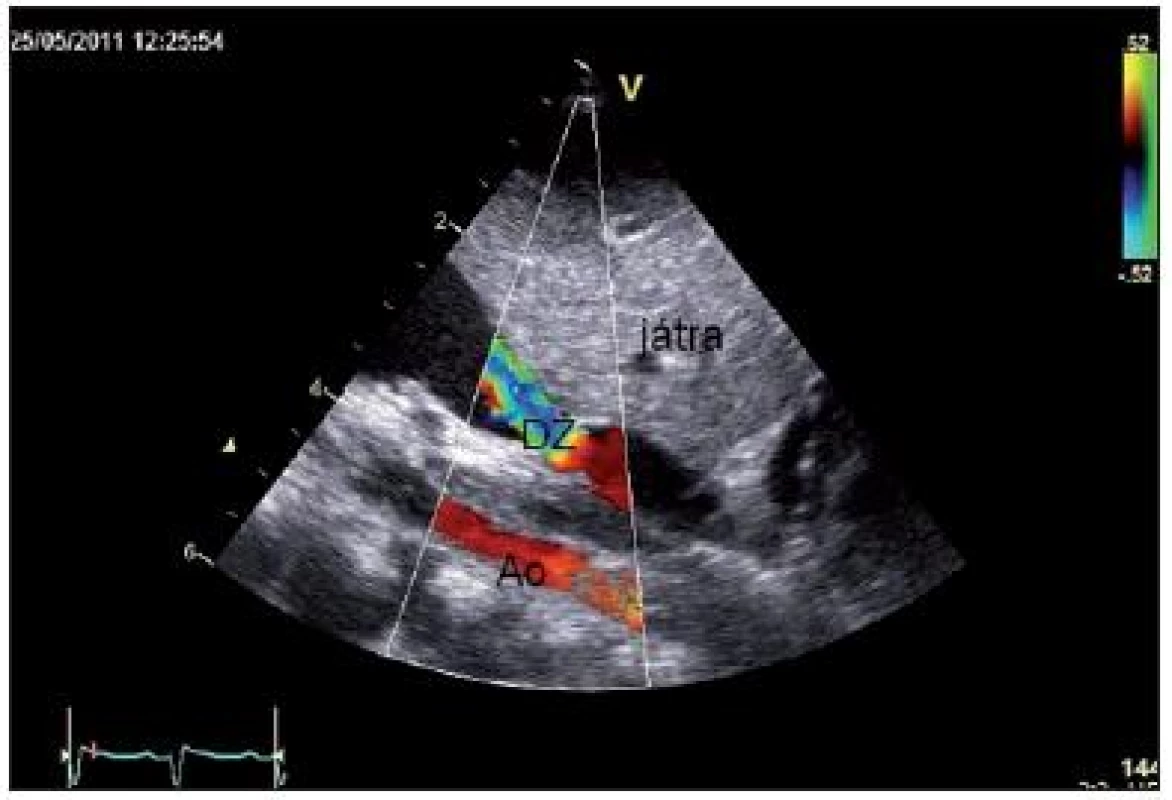
4. Subkostální koronární projekce: zvětšená pravá síň (PS) a pravá komora (PK), široká komunikace na síňovém septu. Za malou levou síní (LS) zachycen „free space“, který je vytvořen soutokem plicních žil. Dopplerovsky nelze prokázat komunikaci mezi LS a plicními žilami. Fig. 4. Subcostal coronary view: enlarged right heart atrium and right ventricle, wide communication on the atrium septum. There is a „free space“ behind the left heart atrium, which is formed by confluence of pulmonary veins, without any connection to left heart. 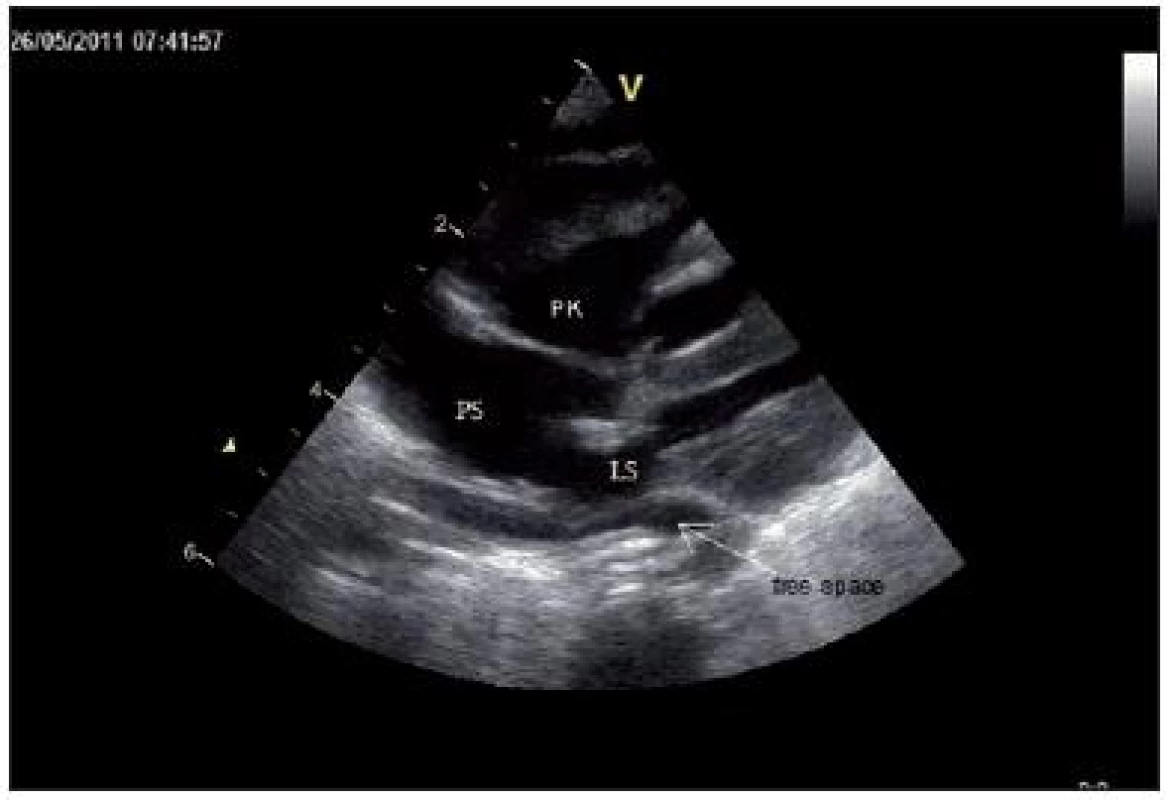
Pro známky hyperhydratace byl podán furosemid intravenózně. Pacientka byla konzultována a následně (do 2 hodin od přijetí) přeložena na JIP Pediatrické kliniky FN Brno, kde byla potvrzena diagnóza TAPVC infradiafragmatický typ s drenáží plicních žil do v. portae s defektem septa síní a pravolevým zkratem. Vzhledem k obstrukci plicních žil byla následující den ve stabilizovaném stavu přeložena k operaci do Dětského kardiocentra FN v Motole. Kardiochirurgický výkon spočívající v anastomóze společného kmene plicních žil a levé síně, uzávěru síňového defektu perikardiální záplatou, protětí společného kmene plicních žil a podvazu arteriálního duktu byl proveden po předoperační přípravě pacientky následující den. Bezprostřední pooperační průběh byl po stránce oběhové a ventilační bez komplikací. Odpojení pacientky od umělé plicní ventilace proběhlo 3. pooperační den. Echokardiografické vyšetření po operaci potvrdilo dobrý výsledek korekce, ale zároveň byl nalezen trombus ve v. portae, proto byla nasazena antikoagulační terapie nadroparinem. Další hospitalizace probíhala již bez potíží, hojení rány per primam, na kontrolním ultrazvuku byla popsána významná regrese trombu ve v. portae. Pacientka 21 dní po operaci byla propuštěna domů kardiopulmonálně kompenzovaná, s medikací nadroparin, kalium chloratum a furosemid. Echokardiografický nález po napojení plicních žil je zachycen na obrázku 5.
5. Apikální čtyřdutinová projekce (kontrolní echokardiografie 37. pooperační den): scan dokumentuje široké vústění „našitého“ žilního confluens na levou síň (LS), bez prokazatelného gradientu na anastomóze. Fig. 5. Apical four chamber view (control echocardiography 37th postoperative day): the scan documents a wide entry of the sewn-in vein confluence on the left heart atrium without demonstrable gradient on anastomosis. 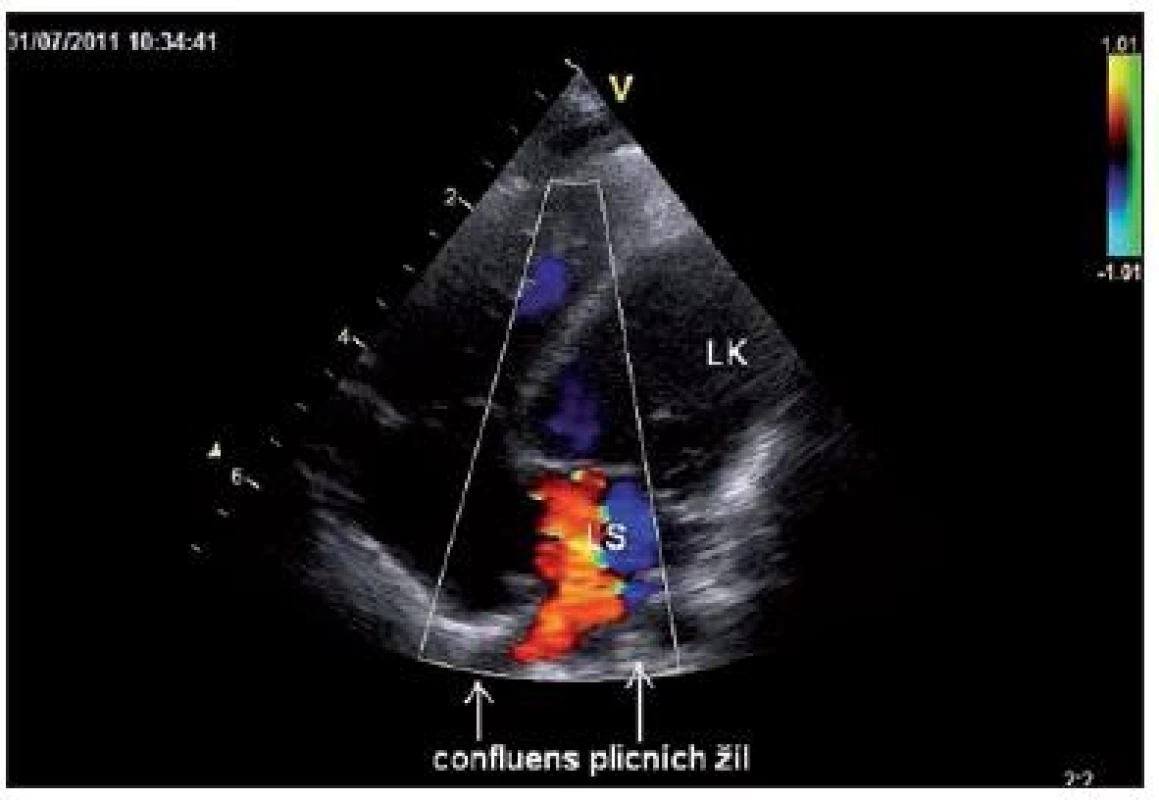
Kontrola 3,5 měsíce po operaci potvrzuje příznivý výsledek operačního zákroku, trombus ve v. portae již není patrný. Pacientce byla vysazena antikoagulace, zůstává jen na antiagregační terapii, plně kojena. Příznivý efekt výkonu na prospívání dítěte je patrný z růstového grafu (obr. 1).
DISKUSE
V České republice probíhá mezi 18. a 22. týdnem těhotenství ultrazvukový screening zaměřený na výskyt VSV [6]. V roce 2010 bylo prenatálně zjištěno 43 % všech VSV a 97 % kritických vad [7]. Prenatální diagnostika TAPVC je sice možná, nicméně vliv vady na fetální hemodynamiku je díky přítomnosti fyziologických zkratů (foramen ovale a ductus arteriosus) nepatrný. Její rozpoznání je tak zejména při izolovaném TAPVC značně obtížné. Ve velké mezinárodní studii (UK, Irsko, Švédsko) zahrnující data 244 živě narozených dětí s touto diagnózou bylo podezření na vrozenou vadu vysloveno prenatálně v pouhých 2,4 % případů [8], v moravskoslezské studii zaměřené na VSV a jejich rizikové faktory nebyl TAPVC prenatálně diagnostikován v žádném ze 7 popisovaných případů [9]. Matka prezentované pacientky se podrobila během gravidity všem obvyklým vyšetřením, včetně fetální echokardiografie ve 20. týdnu, vždy s negativním nálezem.
Závažnost VSV je dána anatomickými poměry a často může znamenat bezprostřední ohrožení dítěte na životě. Klinické symptomy onemocnění se mohou objevit kdykoliv po narození a nemusí být specifické. Kanadská studie [10] uvádí medián věku při diagnóze 16 dní (v širokém rozsahu od 1 dne do 12 let). Naše pacientka byla přijata a diagnostikována ve věku 60 dnů. Jednotlivé morfologické typy (suprakardiální, kardiální, infrakardiální, smíšený) se liší v závažnosti, klinických příznacích, i době jejich manifestace. Spektrum příznaků je velmi široké, nejčastěji bývá přítomna cyanóza (43 % případů), neprospívání (11 %), oběhové selhání, šok (4,5 %), zatímco přítomnost srdečního šelestu je spíše neobvyklá (0,5 %) [8]. Pacienti bez obstrukce s velkým zkratem mohou být dlouhou dobu asymptomatičtí. Diagnostické problémy mohou nastat v případě méně typických projevů. Klinický obraz může například napodobit těžkou pneumonii a zbytečná antibiotická léčba pak může vést k pozdní diagnóze [11]. Časová prodleva pak zvyšuje riziko nejen samotného výkonu, ale může zhoršit i dlouhodobou prognózu zvýšením výskytu obstrukce plicních žil a plicní hypertenze u jinak úspěšně operovaných [8].
Prognóza pacienta závisí na morfologii vady, přítomnosti případných dalších srdečních anomálií, jejich detailní diagnostice a samozřejmě v následném bezchybném kardiochirurgickém výkonu s optimální perioperační péčí včetně mimotělní perfuze. Nepříznivým prognostickým ukazatelem je přítomnost obstrukce žilního návratu (u 33 % všech pacientů s TAPVC, u infrakardiálního typu u 95 až 100 %) [12]. Její příčinou je nejčastěji útlak okolními tkáněmi, velkými cévami nebo intraluminálním procesem, často se projeví v návaznosti na uzávěr ductus venosus. Obstrukce plicních žil vede k plicní hypertenzi. Projeví se dramatickým zhoršením klinického stavu se známkami srdečního selhání a plicního edému, vyžadujícím okamžitou operaci. Umělá plicní ventilace a inotropní podpora katecholaminy mají jen dočasný efekt; infuze prostaglandinů je neúčinná. Bez urgentního chirurgického zákroku dochází rychle k srdečnímu selhání se 100% mortalitou [12]. V literatuře jsou popsány úspěšné případy katetrizační léčby obstrukce v oblasti ductus venosus s implantací stentu (přístupem přes v. umbilicalis), která umožnila stabilizaci pacienta do kardiochirurgického výkonu [13]. Další možností předoperační intervence je katetrizační balonková septostomie [14] při restriktivní síňové komunikaci. V bezprostředním pooperačním průběhu je hlavním problémem reaktivita plicního cévního řečiště a hypoxemie. Pozdní komplikací je pak obstrukce plicních žil a vznik plicní hypertenze, které jsou spojeny s vyšší dlouhodobou mortalitou [15].
Diagnostika neprospívání je založena na pečlivé anamnéze a kvalitním klinickém vyšetření. Spektrum možných příčin je značně široké: od banálních neorganických, které jsou poměrně časté, po potencionálně urgentní stavy, se kterými se naopak v běžné praxi potkáme spíše zřídka. Prenatálně nerozpoznané kritické srdeční vady představují právě takovou situaci. Zcela zásadní je pak na možnost VSV vůbec pomyslet, neboť příznaky jsou často nespecifické.
Na přítomnost VSV může vzácně upozornit už i rentgenový snímek srdce a plic. Typický obraz „sněhuláka“ či „osmičky“ popisovaný ve starší literatuře pro TAPVC suprakardiálního typu je dnes díky moderní diagnostice spíše raritní [16]. Dalším široce dostupným vyšetřením je elektrokardiogram, který u TAPVC i řady dalších vrozených srdečních vad může ukázat sklon osy doprava s hypertrofií pravé komory. Tento nález je však u novorozence běžný a v pozdějším věku nespecifický; jeho význam v diagnostice proto není velký [11]. V případě klinického podezření na srdeční vadu je v současné době základním neinvazivním vyšetřením transthorakální echokardiografie, která ve většině případů dokáže posoudit detailně morfologii vady a její hemodynamickou významnost. Na UZ srdce ve čtyřdutinové projekci vidíme dilatované pravostranné oddíly kontrastující s velikostí levého srdce, dále defekt síňového septa či otevřené foramen ovale s pravolevým zkratem. Přítomnost anomálního průběhu plicních žil a jejich vyústění intrakardiálně či do povodí horní a dolní duté žíly často detailně diagnostikuje až zkušený echokardiografista. Nepřetržitá dostupnost ultrazvuku srdce je ve specializovaném centru pro chirurgickou léčbu vrozených srdečních vad naprostou samozřejmostí. To ovšem neplatí pro okresní pediatrická pracoviště, kde je stanovení diagnózy z nepřímých známek onemocnění při absenci detailního ECHO vyšetření obtížné. V případě nejasného nálezu na ultrazvuku je možné doplnit angiografii s podáním kontrastní látky přímo do plicnice, v posledních letech jsou na některých pracovištích popisovány kladné zkušenosti i s CT angiografií srdce [17].
Před zavedením kardiochirurgické léčby se děti s TAPVC jen zřídka dožily 1 roku. Příčinou jejich úmrtí bylo při přirozeném průběhu choroby srdeční selhání a plicní hypertenze [5]. V současné době je u pacientů s podezřením na závažnou vrozenou srdeční vadu rutinním postupem snaha o stabilizaci klinického stavu se současným urgentním transportem na specializované pracoviště, kde je diagnóza definitivně potvrzena a provedena korekce vady. Riziko výkonu se za poslední čtyři dekády výrazně snížilo. Zatímco na počátku 70. let umírala v souvislosti s výkonem zhruba polovina pacientů [18], v dnešní době je 30denní mortalita 5,8 % [8]. Dlouhodobé přežití se pohybuje mezi 85 % (po 3 letech ve studii z Evropy) [8] a 97 % (po 5 letech v kanadské studii) [10].
ZÁVĚR
Díky kvalitnímu prenatálnímu screeningu se neonatologové a pediatři většiny nemocnic setkávají s kritickými vrozenými srdečními vadami stále vzácněji. Diagnostika a léčba těchto vad patří do rukou specialistů v dětských kardiocentrech, která zajišťují komplexní kardiologickou a kardiochirurgickou péči.
Naše kazuistika poukazuje na ojedinělý případ, kdy se za obecnými nespecifickými příznaky onemocnění může skrýt i vrozená srdeční vada, která pacienta ohrožuje na životě a vyžaduje rychlé rozpoznání a časný operační zákrok. Kombinace vzácné a přitom závažné příčiny maskované pod zdánlivě banální symptomatologií může být zdrojem potencionálního pochybení s mnohdy závažnými následky a forenzním dopadem. Zvažování kritické vrozené srdeční vady tak musí být u dětského pacienta vždy součástí širší diferenciálně diagnostické rozvahy.
Došlo: 22. 3. 2012
Přijato: 11. 6. 2012
MUDr. Jana Radvanová
Dětské oddělení
Nemocnice Třebíč, přísp. org.
Purkyňovo nám. 2
674 01 Třebíč
e-mail: svobjana@volny.cz
Sources
1. Muntau AC, et al. Pediatrie. 4. vyd. Praha: Grada, 2009 : 293–310.
2. Šamánek M, Voříšková M. Congenital heart disease among 815,569 children born between 1980 and 1990 and their 15-year survival: a prospective Bohemia survival study. Pediatr Cardiol 1999 Nov-Dec; 20 (6): 411–417.
3. Michielon G, DiDonato RM, Pasquini L, et al. Total anomalous pulmonary venous connection: long-term appraisal with evolving technical solutions. Eur J Cardiothorac Surg 2002; 22 : 184–191.
4. Chaloupecký V. Anomálie plicních žil. In: Chaloupecký V (ed.) Dětská kardiologie. Praha: Galén; 2006 : 155–158.
5. Bleyl SB, Botto LD, Carey JC, et al. Analysis of a Scottish founder effect narrows the TAPVR-1 gene interval to chromosome 4q12. Am J Med Genet Part A 2006; 140A: 2368–2373.
6. Marek J, Tomek V, Skovránek J, et al. Prenatal ultrasound screening of congenital heart disease in an unselected national population: a 21-year experience. Heart 2011 Jan; 97 (2): 124–130.
7. Škovránek J. Péče o děti s vrozenou srdeční vadou v České republice. Kap Kardiol 2011; 3 (4): 122–126.
8. Seale AN, Uemura H, Webber SA, et al. Total anomalous pulmonary venous connection: morphology and outcome from an international population-based study. Circulation 2010 Dec 21; 122 (25): 2718–2726. Epub 2010, Dec 6.
9. Pavlíček J, Gruszka T. Vrozené srdeční vady a jejich rizikové faktory. Čes-slov Pediat 2010; 65 (11): 626–633.
10. Karamlou T, Gurofsky R, Al Sukhni E, et al. Factors associated with mortality and reoperation in 377 children with total anomalous pulmonary venous connection. Circulation 2007; 115 : 1591–1598.
11. Yun SW. Congenital heart disease in the newborn requiring early intervention. Korean J Pediatr 2011 May; 54 (5): 183–1891. Epub 2011, May 31.
12. Bernstein D. Congenital heart disease. In: Behrman RE, Kliegman RM, Jenson BH, et al. Nelson Textbook of Pediatrics. 17th ed. Philadelphia, 2004 : 1499–1554..
13. Rothman A, Galindo A, Evans WN. Temporary transumbilical stenting of the ductus venosus in neonates with obstructed infradiaphragmatic total anomalous pulmonary venous return. Pediatr Cardiol 2011 Jan; 32 (1): 87–90. Epub 2010, Oct 12.
14. Bu’Lock FA, Jordan SC, Martin RP. Successful ballon dilatation of ascending vein stenosis in obstructed supracardiac total anomalous pulmonary venous connection. Pediatr Cardiol 1994; 15 : 78–80.
15. Bando J, Turrentine MW, Ensing GJ, et al. Surgical management of total anomalous pulmonary venous connection: thirty-year trends. Circulation 1996; 95: II12–II16.
16. Yee L. Cardiac emergencies in the first year of life. Emerg Med Clin North Am 2007; 25 : 981–1008.
17. Siles A, Lapierre C. Infracardiac total anomalous pulmonary venous return (TAPVR). Pediatr Radiol 2008 Dec; 38 (12): 1354. Epub 2008, Sep 25.
18. Wukasch DC, Deutsch M, Reul GJ, et al. Total anomalous pulmonary venous return: a review of 125 patients treated surgically. Ann Thorac Surg 1975; 19 : 622–633.
19. Vignerová J, Bláha P, Brabec M, et al. Program pro hodnocení růstu dítěte. http://www.szu.cz/publikace/data/rustove-grafy [citace 1.5.2012]
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 4-
All articles in this issue
- Does the postnatal detection of renal pelvis dilation a higher risk of urinary tract infection?
- Application of ultrasonography in the diagnostics of pyelonephritis
- Hypothalamic-hypophyseal dysfunction in children and adolescents after brain injury – a prospective observation
- GM1 gangliosidosis associated with multiple mongolian spots
- Total anomalous pulmonary venous return – uncommon cause of failure to thrive in infant
- Prenatal and neonatal environment and their consequences in child’s development
- Reading about speech and language therapy
- Preventing illicit drug use in a family
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Does the postnatal detection of renal pelvis dilation a higher risk of urinary tract infection?
- Total anomalous pulmonary venous return – uncommon cause of failure to thrive in infant
- GM1 gangliosidosis associated with multiple mongolian spots
- Application of ultrasonography in the diagnostics of pyelonephritis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

