-
Medical journals
- Career
Hypothalamo-hypofyzární dysfunkce u dětí a dospívajících po mozkovém úrazu – prospektivní sledování
Authors: D. Aleksijević 1; V. Smolka 1; E. Klásková 1; V. Mihál 1; J. Wiedermann 1; P. Venháčová 1; D. Krahulík 2; J. Zapletalová 1
Authors‘ workplace: Dětská klinika LF UP a FN, Olomouc přednosta prof. MUDr. V. Mihál, CSc. 1; Neurochirurgická klinika LF UP a FN, Olomouc přednosta prof. MUDr. M. Houdek, CSc. 2
Published in: Čes-slov Pediat 2012; 67 (4): 234-241.
Category: Original Papers
Overview
Úvod:
Neuroendokrinní dysfunkce po kraniotraumatu je v retrospektivních studiích popisována u 23–60 % dospělých a 15–21 % dětí.Cíl:
Prospektivním sledováním zjistit prevalenci hypothalamo-hypofyzární dysfunkce u dětí po úrazu mozku během 12měsíčního období a její závislost na typu úrazu a průběhu akutní posttraumatické fáze.Pacienti a metoda:
U 58 pacientů (21 dívek) po kraniocerebrálním traumatu (GCS 3–12/15) byl zhodnocen tělesný vývoj (růst, dospívání, skeletální zralost) a bylo provedeno hormonální vyšetření v časném poúrazovém období (2–14 dnů, T0) a dále za 3, 6 a 12 měsíců po traumatu (T3, T6 a T12). Hormonální vyšetření zahrnovala TSH, fT4, IGF-1, PRL, ranní hladinu kortisolu, FSH, LH, testosteron (u chlapců), estradiol (u děvčat). V případě odchylného klinického a/nebo laboratorního nálezu byly provedeny dynamické testy. U všech pacientů byla v T12 provedena kontrolní MRI mozku.Výsledky:
Věk v době úrazu byl 11,3 (0,5–18,7) roků (medián, rozpětí). Dvacet tři pacienti měli GCS <8/15. V T0 (n = 58) vykazovalo 12 pacientů příznaky diabetes insipidus (DI) a 4 pacienti syndrom nepřiměřené sekrece adiuretinu (SIADH). Časné hormonální změny napodobovaly centrální hypotyreózu (u 45 % nemocných) a hypogonadotropní hypogonadismus (u 25 % adolescentů, kteří byli v době úrazu již pubertální ≥ 2. st. Tannerovy škály). Vyšetření v T3 (n = 56) prokázalo u dvou chlapců kombinovaný deficit pituitárních hormonů a u jednoho DI. V T6 (n = 49) byla u dvou chlapců diagnostikována hormonální porucha (předčasná puberta a deficit růstového hormonu) a v T12 (n = 39) byla nová endokrinní porucha zjištěna u pěti pacientů (u dvou deficit růstového hormonu, u dvou hypogonadotropní hypogonadismus a u jednoho s již diagnostikovaným deficitem růstového hormonu centrální hypotyreóza). Na MRI mozku byl nalezen obraz empty selly u dvou pacientů s deficitem růstového hormonu. Pacienti s GCS ≤8/15 měli častěji příznaky DI nebo SIADH v časném poúrazovém období (11/23) vs. pacienti s GCS 8–13/15 (4/35) a častěji hormonální poruchu v T12 než jedinci se středně těžkým traumatem. Výskyt endokrinní dysfunkce v T0 významně koreloval s tíží úrazu (p ≤0,05), ale nebyl přesvědčivým ukazatelem pro rozvoj pozdní hormonální poruchy (p = 0,5).Závěr:
Do roka po úrazu se manifestovala hormonální porucha u 7 z 39 (17,9 %) pacientů. Neuroendokrinní dysfunkce jako pozdní následek kraniocerebrálního traumatu u dětí a dospívajících není tak častá, jak bylo prokázáno u dospělých. Rizikovými faktory pro její rozvoj se jeví tíže úrazu, patologický nález při zobrazení mozku a rozvoj DI nebo SIADH v akutní posttraumatické fázi.Klíčová slova:
úraz mozku u dětí, časná a pozdní postraumatická hormonální porucha, deficit růstového hormonu, předčasná puberta, rizikové faktoryÚVOD
Mozkové úrazy u dětí a dospívajících s průměrnou incidencí 250 : 100 000 ročně jsou jednou z nejčastějších příčin mortality a závažné morbidity. Četnost úrazů je dvakrát vyšší u chlapců než u dívek. Nejpočetnější skupinou jsou adolescenti ve věku 15–19 let a druhý vrchol tvoří děti do 5 let věku. U menších dětí jsou příčinou mozkových traumat především pády a fyzické týrání (u dětí do 2 let věku tzv. „shaken baby syndrome“, který vede ve více než 50 % k nejzávažnějším poraněním), u starších dětí sportovní aktivity a u adolescentů dopravní nehody [1, 2]. Důsledky středně těžkého až těžkého cerebrálního poranění jsou často velmi závažné – od fyzického postižení přes psychické problémy a logické sociální důsledky.
Porucha hormonálních funkcí v důsledku mozkového úrazu byla dlouho považována za raritu [3, 4], přitom histopatologické studie prováděné post mortem již v 70. a 80. letech minulého století prokázaly, že oblast hypothalamu a hypofýzy je značně vulnerabilní vůči zevním inzultům [5, 6, 7]. Porušení integrity a funkce hypothalamo-pituitárních struktur může vést k přechodné nebo trvalé neuroendokrinní dysfunkci a tak významným způsobem ovlivňovat morbiditu u přeživších pacientů. Častou a očekávanou komplikací je dočasná porucha vodního hospodářství – diabetes insipidus (DI) nebo syndrom nepřiměřené sekrece adiuretinu (SIADH) v důsledku tranzitorní dysfunkce neurohypofýzy a také přechodné hormonální změny srovnatelné se změnami hypothalamo-hypofyzární osy pozorovanými u jiných forem kritických stavů [8, 9]. Trvalá endokrinní porucha manifestující se za měsíce až roky po úrazu byla považována za výjimečnou. Tento pohled se změnil v průběhu uplynulého desetiletí, kdy četné studie prováděné u dospělých udávají prevalenci posttraumatického hypopituitarismu mezi 23–69 % (tab. 1) [10–18]. U pediatrické populace je o výskytu a významu neuroendokrinní dysfunkce známo méně než u dospělých. Publikované studie jsou retrospektivního charakteru a jejich výsledky vykazují nižší četnost hormonálního deficitu než u dospělých (tab. 2) [19–24].
Table 1. Posttraumatický hypopituitarismus u dospělých. 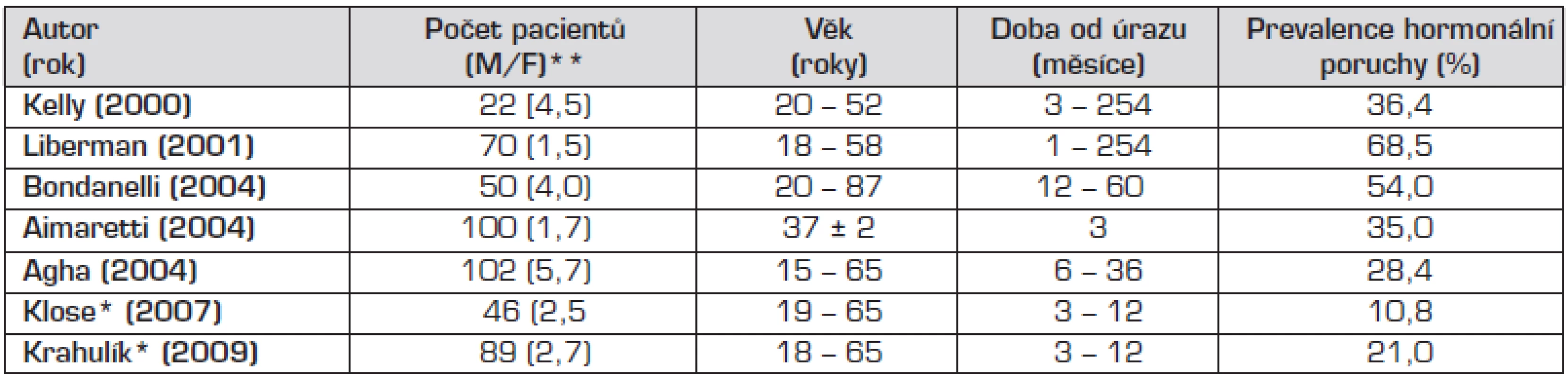
*prospektivní studie **M/F – muži/ženy Table 2. Posttraumatický hypopituitarismus u dětí. 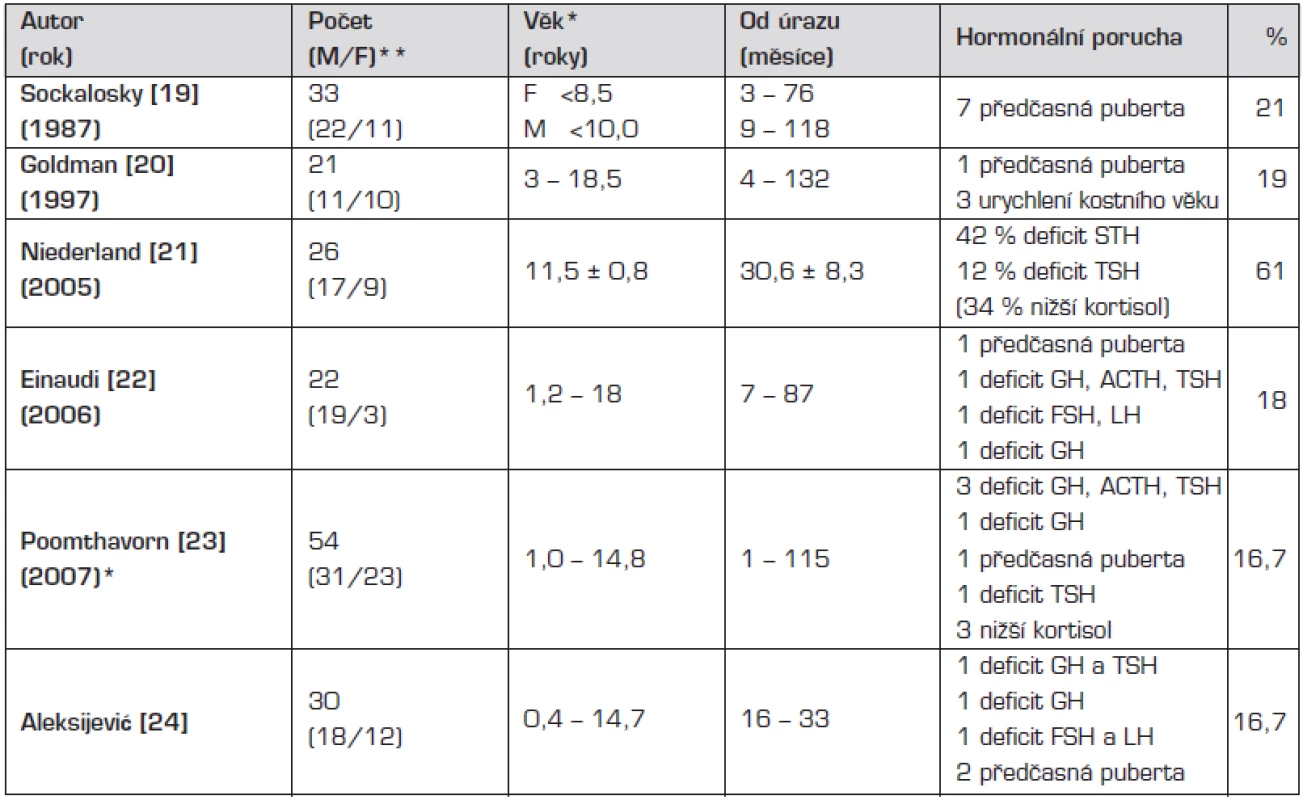
*věk v době endokrinologického vyšetření ** M/F – muži/ženy Uvádíme výsledky prospektivního sledování hormonálních funkcí u dětí a adolescentů po středně těžkém až těžkém úrazu mozku hospitalizovaných na Jednotce intenzivní a resuscitační péče Dětské kliniky Lékařské fakulty a Fakultní nemocnice Olomouc (JIRP DK LF UP a FN Olomouc). Studie byla schválena Etickou komisí FN Olomouc a zákonní zástupci všech pacientů podepsali informovaný souhlas.
SOUBOR PACIENTŮ A METODIKA
Pacienti
Prospektivní skupina zahrnovala 58 dětí a adolescentů (21 dívek), kteří byli hospitalizovaní v období od 1. 1. 2007 do 1. 10. 2009 po středně těžkém a těžkém úrazu mozku (GCS <3–12/15). Do sledování nebyli zahrnuti pacienti s předchozím závažným chronickým onemocněním a pacienti dlouhodobě užívající hormonální léčbu (včetně antikoncepce).
Příčinou úrazu byla v 50 % dopravní nehoda, v 35 % pád (u poloviny při sportovních aktivitách), v 15 % jiný mechanismus (kopnutí koněm, beranem, oběšení, týrání). Věk nemocných byl v době úrazu 11,3 (0,5–18,7) roků (medián a rozpětí), dvacet tři (38 %) bylo pubertálních (≥2. st. Tannerovy stupnice). Závažnost úrazu byla hodnocena podle Glasgow Coma Scale (po bazální resuscitaci): středně těžký úraz (GCS 8–12/15) mělo 35 pacientů, těžký úraz (GCS <8/15) měli 23 pacienti. Všichni pacienti měli v době úrazu provedeno zobrazení mozku pomocí počítačové tomografie (CT) nebo magnetické rezonance (MRI). U 21 (37 %) z nich byl popsán závažný patologický nález: edém mozku, subdurální hematom, subarachnoidální krvácení, epidurální krvácení, difuzní axonální postižení nebo fraktura baze lební. Klinický stav 14 pacientů si vyžádal umělou plicní ventilaci (UPV), medián její délky byl 8 (1–150) dnů.
Metoda
Klinické vyšetření
Při fyzikálním vyšetření byly v T0, T3, T6 a T12 hodnoceny auxologické údaje: aktuální délka/výška, hmotnost, body mas index (BMI), růstová rychlost a stupeň pubertálního vývoje podle Marshallovy a Tannerovy stupnice [25, 26]. Retrospektivně byl zhodnocen tělesný růst a BMI před úrazem a po úrazu podle údajů z individuální dokumentace každého pacienta získané od praktického lékaře pro děti a dorost. Výsledky retrospektivních i prospektivních měření byly vztaženy k normám pro českou populaci z roku 2001 a stanoveny jako skóre směrodatné odchylky SDS pro věk a pohlaví [27]. Biologická zralost byla posuzována podle kostní zralosti ze snímku levé ruky a zápěstí podle Greulicha a Pylové [28] v T0 a T12. Sledování zahrnovalo i 24hodinovou bilanci tekutin.
Laboratorní hodnocení
Základní biochemický a hormonální screening byl v T0, T3, T6 a T12 prováděn na lačno mezi 7. a 9. hodinou ráno a zahrnoval stanovení mineralogramu, glykemie, osmolality séra a moči, tyreotropního hormonu (TSH), volného tyroxinu (fT4), trijodthyroninu (fT3), ranního kortisolu, adrenokortikotropního hormonu (ACTH), inzulinu podobného růstového faktoru 1 (IGF-1), prolaktinu (PRL), folikulostimulačního hormonu (FSH), luteinizačního hormonu (LH), estradiolu (u dívek), testosteronu (u chlapců).
V případě patologického nálezu při laboratorním vyšetření a/nebo při zjištění opožděného, případně urychleného tělesného vývoje při klinickém vyšetření (vč. odchylky kostní zralosti více než ± 6 měsíců) byly provedeny standardní stimulační testy ověřující činnost jednotlivých hormonálních os [29].
V případě nízkého IGF-1 (<1,5 SDS) jsme tvorbu růstového hormonu (STH) ověřovali stimulačním testem s použitím pyridostigminu a L-dopy a testem s inzulinem indukovanou hypoglykemií (ITT). ITT byl proveden pouze u pacientů s příznivým neurologickým nálezem. U chlapců starších 9 let a u dívek nad 8 roků po primingu estrogeny.
Hladina gonadotropinů (FSH a LH) a pohlavních hormonů byla korelována s věkem, se stupněm pubertálního vývoje a u adolescentek s fází menstruačního cyklu. V případě pochybností byla jejich sekrece hodnocena pomocí stimulace gonadoliberinem (LHRH) a hodnoty vztaženy k věku a pohlaví pacienta [29].
Pro centrální hypotyreózu svědčila nízká nebo normální hladina TSH a současně nízká hladina fT4. K diagnóze centrálního hypokorticismu byla nutná nízká hladina ACTH i ranního kortisolu a nízká odpověď kortisolu v ITT a po podání ACTH.
V T12 byla u všech pacientů provedena kontrolní MRI mozku (pokud si to jejich stav nevyžádal dříve).
Statistické hodnocení
Data jsou uváděna jako medián (rozpětí). Srovnání mezi skupinami bylo provedeno pomocí Fisherova testu. Za statisticky významnou byla považována hladina p <0,05.
VÝSLEDKY
V akutní fázi (T0) bylo vyšetřeno 58 dětí a adolescentů. U 45 % laboratorní změny svědčily pro centrální hypotyreózu a u 25 % adolescentů pro hypogonadotropní hypogonadismus. Hladina PRL byla zvýšená u 35 % pacientů a u 10 % byla vyšší hladina kortisolu a ACTH. Hladina IGF-1 byla snížená u pěti pacientů. U 12 nemocných byl diagnostikován DI (u jednoho s přechodem do SIADH) a u čtyř SIADH. Častější výskyt hormonálních změn byl pozorován u pacientů po těžkém úrazu (20/23) proti ostatním (11/35) (p <0,05). Nicméně u všech pacientů byly tranzitorní a v době propuštění do domácí péče byl jejich hormonální status fyziologický.
Výjimku tvořili dva chlapci po těžkém traumatu, u kterých byl prokázán kombinovaný deficit pituitárních hormonů (STH, TSH, ACTH), který přetrvával až do jejich úmrtí ve 3 a 5 měsících věku. Měli apalický syndrom, byli substituováni L-thyroxinem, hydrokortisonem.
Po 3 měsících od úrazu bylo vyšetřeno 56 pacientů, kteří vykazovali normální auxologické parametry i hormonální nálezy. Dva pacienti s apalickým syndromem měli kombinovaný deficit pituitárních hormonů. Jeden chlapec se od úrazu trvale pomočoval a byl více žíznivý. Koncentrační test s ADH u něj prokázal centrální DI a byla zahájena substituce ADH. V akutní fázi měl rovněž DI, který u něj přešel do přechodného SIADH. Pomočování u něj bylo původně dáváno do souvislosti s poúrazovou stresovou poruchou. Je ale známo, že zhruba u 6 % nemocných přechází DI s následným SIADH do trvalého DI (tzv. „trojitá reakce“).
Za 6 měsíců od úrazu se ke kontrole dostavilo 49 (84,4 %) dětí a u 6 pacientů byl na základě patologického výsledku laboratorního vyšetření proveden stimulační test ověřující tvorbu STH. Pouze u jednoho pacienta byl deficit STH potvrzen a byla zahájena substituční léčba růstovým hormonem. Podezření na předčasnou pubertu bylo podle výsledků laboratorního nálezu (zvýšené pohlavní hormony a gonadotropiny) u 3 dětí, ale pouze u jednoho chlapce byla diagnóza verifikována po podání LHRH. Ani jeden z pacientů neměl zřejmé klinické příznaky předčasného dospívání.
Vyšetření za 12 měsíců absolvovalo 39 (67,2 %) nemocných. Z předcházejících návštěv měli 3 pacienti zjištěnu hormonální poruchu. Stimulační testy byly indikovány u dalších 12 dětí. Důvodem bylo zpomalení růstu a kostního zrání, porucha menstruačního cyklu nebo patologický nález při laboratorním vyšetření. U dvou pacientů byl potvrzen deficit růstového hormonu středního stupně (maximální postimulační hladina 6,9 μg/l a 8,1 μg/l) a u dvou dívek parciální hypogonadotropní hypogonadismus (obě měly oligomenoreu) při jinak klinicky fyziologickém nálezu. U jednoho hocha léčeného růstovým hormonem od šestého měsíce po úrazu pro prokázaný deficit STH se manifestovala centrální hypotyreóza (nízké fT3 a TSH). Při vyšetření MRI měli patologický nález v oblasti hypofýzy (empty sella) dva pacienti. Oba měli již před vyšetřením zjištěnu hormonální poruchu.
Srovnání časného a pozdního posttraumatického období
U 16 pacientů byly pozorovány DI a SIADH. U jednoho z nich přešel DI v trvalý typ.
U 65 % pacientů byly v časné fázi pozorovány změny napodobující deficit pituitárních hormonů. U 45 % centrální hypotyreózu a u 25 % adolescentů hypogonadotropní hypogonadismus. Hladina PRL byla zvýšená u 35 % pacientů a u 10 % byla vyšší hladina kortisolu a ACTH. Hladina IGF-1 byla snížená u pěti pacientů. Téměř u všech byly tyto změny tranzitorní (kromě dvou pacientů s apalickým syndromem, kteří do 6 měsíců po úrazu exitovali).
K postupnému rozvoji hormonálního deficitu došlo během 12 měsíců u sedmi pacientů. U tří byl potvrzen deficit STH (v jednom případě kombinovaný s centrální hypotyreózou, jeden chlapec měl předčasné dospívání a dvě dívky hypogonadotropní hypogonadismus) (tab. 3).
Table 3. Charakteristika pacientů s prokázanou hormonální dysfunkcí. 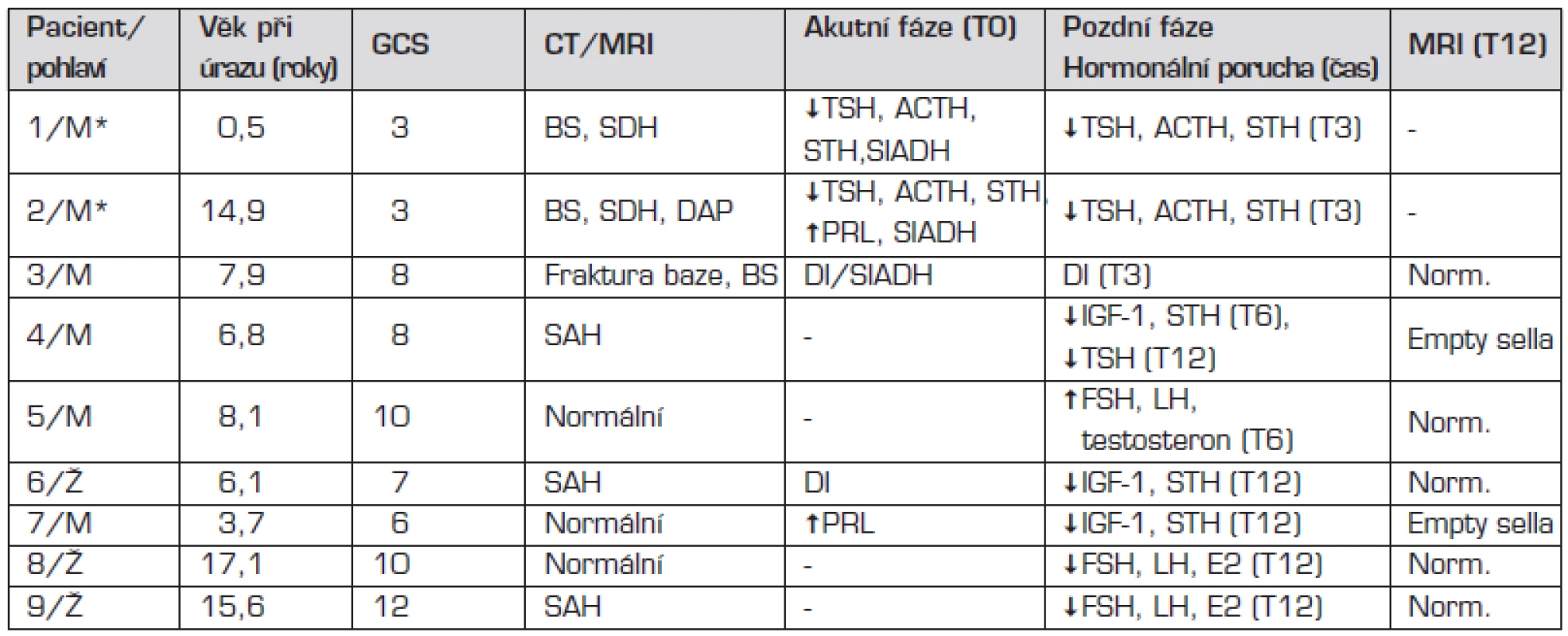
*Pacienti s apalickým syndromem, kteří exitovali do 6 měsíců po úrazu. BS – edém mozku, SDH – subdurální hematom, SAH – subarachnoidální krvácení, DAP – difuzní axonální postižení Rizikové faktory pro vznik pozdní hormonální poruchy
Při retrospektivním hodnocení skupiny 39 pacientů, kteří byli vyšetřeni v odstupu 12 měsíců od úrazu, bylo zřejmé, že pacienti s patologickým hormonálním nálezem byli v době úrazu mladší, měli častěji patologický nález při zobrazení mozku a příznaky poruchy vodního a elektrolytového metabolismu v časné posttraumatické fázi. Nebyl rozdíl v rozvoji pozdní hormonální poruchy mezi chlapci a dívkami (4/21 : 3/18). Pacienti s těžkým úrazem měli častěji hormonální poruchu (4 z 17) než se středně těžkým úrazem (3 z 22). V tabulce 4 je uvedeno srovnání pacientů s hormonální poruchou a bez ní.
Table 4. Srovnání skupiny pacientů s hormonální poruchou se zbytkem souboru v T12. 
*p <0,05 DISKUSE
Úrazy mozku u dětí představují celosvětově významný medicínský problém. Přestože počty přeživších dětí jsou vyšší než dospělých, poúrazové následky mohou být závažnější, protože úraz postihuje organismus s nedokončeným tělesným vývojem. Posttraumatický hypopituitarismus (PTH) byl dlouho popisován pouze kazuisticky. Počátkem 21. století se začaly objevovat četné studie hodnotící většinou retrospektivně výskyt PTH zpočátku u dospělých pacientů a později i u dětí [10–24]. Prevalence hormonální poruchy je podle jejich výsledků velmi variabilní a kolísá od 9 do 63 % u dospělé populace a od 10 do 61 % u dětí, různý je také časový interval od úrazu do manifestace hormonálního deficitu (tab. 1 a 2).
V poslední době přibývá důkazů, že zatímco hormonální změny v akutní posttraumatické fázi jsou tranzitorní a nevyžadují léčbu, pozdní nepoznaný hypopituitarismus může významným způsobem ovlivnit fázi dlouhodobé rekonvalescence a zhoršovat např. neurologickou symptomatologii nebo psychický stav pacienta. Předpokladem přesné diagnózy endokrinní dysfunkce je adaptace výsledků hormonálních hladin na věk pacienta a případnou medikaci (např. hormonální antikoncepce). U dětí před pubertou není možné diagnostikovat posttraumatický hypogonadismus, který se projeví až v období očekávaného dospívání. U dospělých je zase nutné počítat s přirozeným snižováním sekrece STH a gonadotropních hormonů během života. Výsledky testů ověřující sekreci STH mohou být u pacientů s jinou neléčenou hormonální poruchou (např. hypotyreózou nebo hypogonadismem) zkreslené.
V diagnostice tyreotropní, gonadotropní a případně i kortikotropní insuficience je možné využít stanovení bazálních hormonálních hladin. Potvrzení deficitu STH vyžaduje zejména u dospělých pacientů stimulační testy, protože v ojedinělých případech může být i hladina IGF-1 ve fyziologických rozmezích. U dětí pacientů je významným prediktorem deficitu STH zhoršení růstového tempa a opoždění kostního věku.
Je prokázáno, že nejčastěji je postižena osa somatotropní a gonadotropní, které mají v období dětství a adolescence úzký vztah k tělesnému růstu a dospívání. Odhalení růstové poruchy a nástupu nebo průběhu puberty by tedy nemělo činit obtíže. Posouzení fyziologického tělesného a duševního vývoje však bývá u dětí po závažných traumatech často podceňováno a péče je soustředěna především na poruchy hybné nebo psychické. Někdy brání měření tělesné výšky obtížná nebo nemožná vertikalizace dítěte. Opoždění pubertálního vývoje nebo poruchy menstruačního cyklu bývají často dávány do souvislosti s psychickými posttraumatickými poruchami. Mozkový úraz může u dětí paradoxně vyvolat i předčasný nástup puberty podobně jako u dětí s mozkovými nádory, vrozenými vývojovými vadami CNS nebo po shuntových operacích. Výskyt předčasné puberty jako následek kraniocerebrálního poranění uváděli již Sockalosky a Goldmann v prvních studiích zabývajících se PTH u dětí [19, 20]. I významná hormonální porucha může být přehlédnuta: skrytá v neurologické symptomatologii, v obtížné spolupráci dítěte při rehabilitaci, ve zhoršení prospěchu nebo v poruchách chování.
Výsledky naší studie potvrdily podobně jako u dospělých pacientů [16] vysokou incidenci tranzitorní hormonální poruchy v časném poúrazovém období. Tyto změny (tzv. „sick syndrome“ nebo „wasting syndrome“) jsou často pozorovány i u jiných kritických stavů a jsou spíše výrazem adaptivních změn organismu než důsledkem strukturálního poškození. Uznávanou hypotézou je inhibice sekrece anabolických hormonů – TSH, gonadotropních hormonů a STH, která vede k redukci výdaje energie a zachování metabolických zdrojů nutných k udržení funkcí pro život důležitých orgánů, jako je mozek, kardiovaskulární systém, ledviny apod. Stresové hormony jako PRL, ACTH bývají naopak zvýšené [18].
Výsledky prospektivního sledování jsou uvedeny v tabulce 3. U tří pacientů našeho souboru přetrvával hormonální deficit zjištěný v časném poúrazovém období (dva z nich měli apalický syndrom a zemřeli po třech a po pěti měsících po úrazu). U dvou dětí jsme hormonální poruchu diagnostikovali po 6 měsících od úrazu a u dalších čtyř ve 12. měsíci po úrazu. Výsledky jsou srovnatelné s nálezy jiných studií prováděných u dětí, v nichž autoři vykazují prevalenci hormonální poruchy kolem 20 % (tab. 2). Výjimku tvoří retrospektivní pozorování maďarských autorů, kteří vyslovili podezření na částečnou nebo parciální hormonální poruchu u 61 % dětí, aniž by některé z nich mělo odpovídající klinickou symptomatologii. U 42 % pacientů prokázali sice sníženou sekreci růstového hormonu, ale stimulační testy nebyly vzhledem k věku pacientů prováděny po klasickém primingu estrogeny, proto mohla být postimulační hladina falešně nižší [21].
Prevalence hormonální poruchy v našem souboru pacientů byla 17,9 % a je srovnatelná s publikacemi z posledních let hodnotících pacienty sledované retrospektivně v delším časovém odstupu od úrazu. Je pravděpodobné, že k manifestaci další hormonální poruchy může dojít i za delší interval od úrazu než je prvních 12 měsíců, které bývají všeobecně považovány za nejrizikovější období.
Za možné faktory predisponující ke vzniku hormonální poruchy lze považovat:
- těžké poranění mozku (GCS 3–8/15),
- patologický nález při zobrazení mozku v době úrazu,
- poruchu vnitřního prostředí v akutní posttraumatické fázi (DI, SIADH).
ZÁVĚR
Dlouhodobé následky po mozkových úrazech jsou komplexnější, než se dříve předpokládalo, proto je nutné věnovat pacientům pozornost nejen po stránce neurologické, neurochirurgické, rehabilitační, psychologicko-psychiatrické, ale též endokrinologické. Hormonální porucha jako následek poranění mozku bývá často opomíjena, přestože byla prokázána její vysoká prevalence.
U každého dětského a adolescentního pacienta po kraniocerebrálním poranění by mělo být nejen posouzeno, zda jeho tělesný vývoj odpovídá věku, ale také provedeno alespoň základní hormonální vyšetření, a to nejen v akutní fázi, ale i časovém odstupu (optimálně 6–12 měsíců) bez ohledu na jeho klinický stav. Rizikovější se jeví skupina pacientů po těžkém traumatu, s patologickým nálezem při zobrazení mozku v době úrazu a s DI nebo s SIADH v časném poúrazovém období.
Adekvátní hormonální léčba včas diagnostikovaných pacientů může významným způsobem ovlivnit proces úzdravy a zlepšit kvalitu jejich života.
Došlo: 22. 11. 2011
Přijato: 5. 5. 2012
MUDr. Darina Aleksijević
Dětská klinika LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: darina.aleksijevic@seznam.cz
Sources
1. Masson F, Salmi LR, Maurette P. Characteristics of head trauma in children: epidemiology and 5-years folow up. Arch Pediatr 1996; 3 : 651–660.
2. Schneler AJ, Schields BJ, Hostetler SG, et al. Incidence of pediatric brain injury and associated hospital resource utilization in the United States. Pediatrics 2006; 118 : 483–492.
3. Cyran E. Hypophysisenschadigung durch Schadelbasis fracture. Dtsch Med Wochenschr 1918; 44 : 1261–1270.
4. Escamilla RF, Lisser H. Simmonds disease. J Clin Endocrinol Metab 1942; 2 : 65–96.
5. Ceballos R. Pituitary changes in head trauma. Analysis of 102 consecutive cases of head injury. Alabama J Med Sci 1966; 3 : 185–198.
6. Crompton MR. Hypothalamic lesions folowing closed head injury. Brain 1971; 94 : 165–172.
7. Harper CG, Doyle D, Hume AJ, Graham DI. Analysis of abnormalities in pituitary gland in non-missile head injury: study of 100 consecutives cases. J Clin Pathol 1986; 39 : 769–773.
8. Agha A, Rogers B, Myllote D, et al. Neuroendocrine dysfunction in the acute phase of traumatic brain injury. Clin Endocrinol 2004; 60 : 584–591.
9. Woolf PD. Hormonal response to trauma. Crit Care Med 1992; 20 : 216–226.
10. Benvenga S, Campenni A, Ruggeri RM, Trimarchi F. Hypopituitarism secondary to head trauma. J Clin Endocrinol Metab 2000; 85 : 1353–1360.
11. Kelly DF, Gonzalo IT, Cohan P, et al. Hypopituitarism following traumatic brain injury and aneurysmal subarachnoid hemorage: a preliminary report. J Neurosurg 2000; 93 : 743–752.
12. Lieberman SA, Oberoi AL, Gilkison CR, Masel BE, Urban RJ. Prevalence of neuroendocrine dysfunction in patients recovering drom traumatic brain injury. J Clin Endocrinol Metab 2001; 86 : 2752–2756.
13. Bondanelli M, De Marinis L, Ambrosio MR, et al. Occurence of pituitary dysfunction following traumatic brain injury. J Neurotr 2004; 21 : 685–696.
14. Aimaretti G, Ambrosio MR, Di Somma C, et al. Residual pituitary function after brain injury-induced hypopituitarism: a prospective 12-month study. J Clin Endocrinol Metab 2005; 90 : 6085–6092.
15. Agha A, Thompson CJ. Anterior pituitary dysfunction following traumatic brain injury (TBI). Clin Endocrinol 2006; 64 : 481–488.
16. Klose M, Juul A, Struck J, Morgenthaler G, et al. Acute and long –term pituitary insufficiency in traumatic brain injury: a prospective single centre study. Clin Endocrinol 2007; 67 : 598–606.
17. Krahulík D, Zapletalová J, Fryšák Z, Vaverka M. Dysfunction of hypothalamo-hypophyseal axis after traumatic brain injury in adults. J Neurosurg 2009; Nov 20, DOI, 10.3171/2009.10.JNS09930.
18. Urban RJ, Harris P, Massel B. Anterior hypopituitarism following traumatic brain injury. Brain Inj 2005; 19 (5): 349–358.
19. Sockalosky JJ, Kriel RL, Krach LE, Sheehan M. Precocious puberty after traumatic brain injury. J Pediat 1987; 110 (3): 373–377.
20. Goldman M, Shahar E, Sack J, Meyerovitch J. Assessment of endocrine function in children folowing severe head trauma. Pediat Neurol 1997; 17 (4): 339–343.
21. Niederland T, Makovi H, Gál V, Andéka B, Ábrahám CS, Kovács J. Abnormalities of pituitary function after traumatic brain injury in children. J Neurotr 2007; 24 : 119–127.
22. Einaudi S, Matarazzo P, Peretta P, et al. Hypothalamo-hypophyseal dysfunction after traumatic brain injury in children and adolescents: A preliminary retrospective and prospective study. J Pediat Endocrinol Metab 2006; 19 : 692–703.
23. Poomthavorn P, Maixner W, Zacharin M. Pituitary function in paediatric survivors of severe traumatic brain injury. Arch Dis Child 2008; 3 : 133–137.
24. Aleksijevic D, Zapletalová J, Smolka V, Klásková E, Wiedermann J, Krahulík D, Vaverka M, Fryšák Z. Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku. Cesk Slov Neurol N 2010; 74/106 (4): 409–414.
25. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in girls. Arch Dis Child 1969; 44 : 291–303.
26. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in boys. Arch Dis Child 1970; 45 : 13–23.
27. Bláha P, Vignerová J, Riedlová J, Kobzová J, Krejčovský L. VI. celostátní antropologický výzkum dětí a mládeže 2001. Čes-slov Pediat 2003; 58 (12): 766–770.
28. Greuliche WW, Pyle SI. Radiographic Atlas of Skeletal Development of the Hand and Wrist. 2nd ed. Standford, CA: Stanford University Press, 1959.
29. Ranke M (Ed). Diagnostics of endocrine function in children and adolescents. Basel: Karger, 2011, PP I-IX.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 4-
All articles in this issue
- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Využitie ultrasonografie pri diagnostike akútnej pyelonefritídy
- Hypothalamo-hypofyzární dysfunkce u dětí a dospívajících po mozkovém úrazu – prospektivní sledování
- Gangliozidóza GM1 asociovaná s mnohopočetnými mongolskými škvrnami
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
- Prenatálne a neonatálne prostredie a ich dôsledky na vývoj dieťaťa
- Čtení o logopedii – 2. část
- Prevence návykových nemocí v rodině
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
- Gangliozidóza GM1 asociovaná s mnohopočetnými mongolskými škvrnami
- Využitie ultrasonografie pri diagnostike akútnej pyelonefritídy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

