-
Medical journals
- Career
Staré a nové pohľady na funkčnú morfológiu vajíčkovodov a ich význam pre gynekologickú prax
Authors: N. Hamranová 1,2; N. Hocinec 3; Jozef Záhumenský 4; M. Csöbönyeiová 1; M. Klein 1; C. Feitscherová 1; I. Varga 1
Authors‘ workplace: Ústav histológie a embryológie, LF UK v Bratislave, Slovenská republika 1; Gynekologicko-pôrodnícka klinika FN Trenčín, Slovenská republika 2; Gynekologicko-pôrodnícke oddelenie, Nemocnica AGEL, Komárno, Slovenská republika 3; II. gynekologicko-pôrodnícka klinika LF UK a UN Bratislava, Slovenská republika 4
Published in: Ceska Gynekol 2023; 88(1): 33-43
Category: Review Article
doi: https://doi.org/10.48095/cccg202333Overview
Vajíčkovod, ako súčasť vnútorných pohlavných orgánov ženy, je jediným trubicovým orgánom ľudského tela, ktorý aj za fyziologických podmienok vykonáva transportnú funkciu v oboch smeroch. Smerom do dutiny maternice posúva oocyt uvoľnený počas ovulácie, resp. rané embryo; smerom k abdominálnemu ústiu transportuje spermie. Vajíčkovod má však mnoho ďalších unikátnych funkcií, ako napríklad selekciu spermií, ako jeden z mechanizmov zabránenia polyspermatického oplodnenia, či tvorbu unikátnej tubárnej tekutiny, ktorá je dôležitá nie len pri samotnom oplodnení, ale pred oplodnením aktivuje spermie a vyživuje embryo počas transportu do dutiny maternice. V prvej časti nášho prehľadu literatúry prinášame pohľad do histórie. V rámci neho chceme čitateľom priblížiť, ako vajíčkovody vnímali slávni anatómovia 16. a 17. storočia Gabriele Falloppio a Reiner de Graaf. Nasleduje prehľad aktuálnych anatomických, embryologických a histologických poznatkov, ktoré sú dôležité aj pre lepšie porozumenie patologickým stavom postihujúcich vajíčkovod, ako tubárna infertilita alebo tubárna gravidita. Práve v rámci morfológie vajíčkovodu boli ostatné roky potvrdené tak zásadné objavy, ako jedinečný mechanizmus prúdenia lymfy v sliznici vajíčkovodu, prítomnosť imunologicky aktívnych supresorových T-lymfocytov v rámci epitelu vajíčkovodu, či novoobjavená populácia buniek – telocytov – s pacemakerovou aktivitou v rámci svaloviny.
Klíčová slova:
história – vajíčkovod – anatómia – histológia – embryológia – nové poznatky
Úvod
Prvý morfologický popis vajíčkovodov do odbornej literatúry priniesol taliansky anatóm Gabriele Falloppio v roku 1561. Do tohto času prevládali Galénove názory na pohlavný izomorfizmus ženských a mužských orgánov. Až Fallopio potvrdil, že ženy nemajú nadsemenník, ani semenovod. Falloppio vo svojom diele Observationes Anatomicae nasledujúcim spôsobom opisuje vajíčkovody (obr. 1): „Táto štíhla a úzka semenná rúra (ductus seminarius) je pevnej konzistencie a svetlej farby. Jej začiatok je v oblasti rohu maternice, postupne sa rozširuje a končí v tvare ohnutého konára. Na svojom konci je mäsitý a červený. Je zamotaný ako šev obnoseného kusu odevu. Široký otvor je uzavretý fimbriami, zbiehajúcimi sa strapcami. Keď sú tieto strapce starostlivo oddelené, koncová časť pripomína náustok Thebanovej trúbky. Pretože semenná trubica ženy svojím tvarom pripomína tento klasický hudobný nástroj, nazval som ju ako uteri tuba („…ideo me uteri tuba vocatus est“). Tento malý orgán sa nenachádza len u žien, pozoroval som ho aj u oviec a kráv a u všetkých druhov zvierat, ktoré som pitval“ [1]. Falloppiovo meno ako eponymum sa vo francúzskom jazyku (trompes de fallope), ako aj v angličtine (fallopian tubes) dodnes používa na pomenovanie vajíčkovodov. Už len pre úplnosť dodávame, že ďalšími eponymickými názvami častí ľudského tela pomenovanými podľa Gabriela Falloppia sú canalis Falloppii (kanál tvárového nervu v spánkovej kosti, canalis facialis), ligamentum Falloppii (slabinový väz, ligamentum inguinale), musculus Falloppii (pyramídovitý sval, musculus pyramidalis), plicae circulares Falloppii – Kerckringi (cirkulárne riasy sliznice dvanástnika) a valva Falloppii (chlopňa v mieste vyústenia bedrovníka do slepého čreva, valva ileocaecalis) [2]. Gabriele Falloppio zaviedol do terminológie pre gynekológov aj tak dôležité pojmy ako vagina alebo placenta. Ako lekár navyše veľmi úspešne bojoval proti šíreniu syfilisu, a to vytvorením pomôcky podobajúcej sa na prezervatív. Mužom odporúčal navliecť si na žaluď malú ľanovú čiapku namočenú v roztoku soli a byliniek, a niekedy aj mlieka. Na základe jeho skúseností, nikto z 1 100 mužov, ktorí túto pomôcku používali, sa nenakazil syfilisom [3].
Image 1. Falloppiov anatomický opis vajíčkovodov (Observationes Anatomicae, 1561).
Fig. 1. Fallopian anatomical description of fallopian tubes (Observationes Anatomicae, 1561).
Funkciu vajíčkovodov ako prvý opísal Holanďan Reiner de Graaf (1641–1673), keď na experimentoch na zajacoch potvrdil, že zachytávajú vajíčko a transportujú ho smerom do maternice (obr. 2). Jeho výskum mal však jeden nedostatok, za ktorý ale de Graaf nemohol, nakoľko v tom čase neexistoval ešte svetelný mikroskop. Pojmom vajíčko označoval celý zrelý folikul, ktorý je dnes pomenovaný na jeho počesť ako Graafov folikul. De Graaf však správne opísal aj život ohrozujúci stav akým je tubárna gravidita, či zhotovil nákres hydrosalpinxu [4,5].
Image 2. Nákres vaječníka a abdominálneho ústia vajíčkovodu z de Graafovho diela De Mulierum Organis Generatione Inservientibus (1672).
Fig. 2. Drawing of the ovary and the abdominal oviduct from de Graaf's De Mulierum Organis Generatione Inservientibus (1672).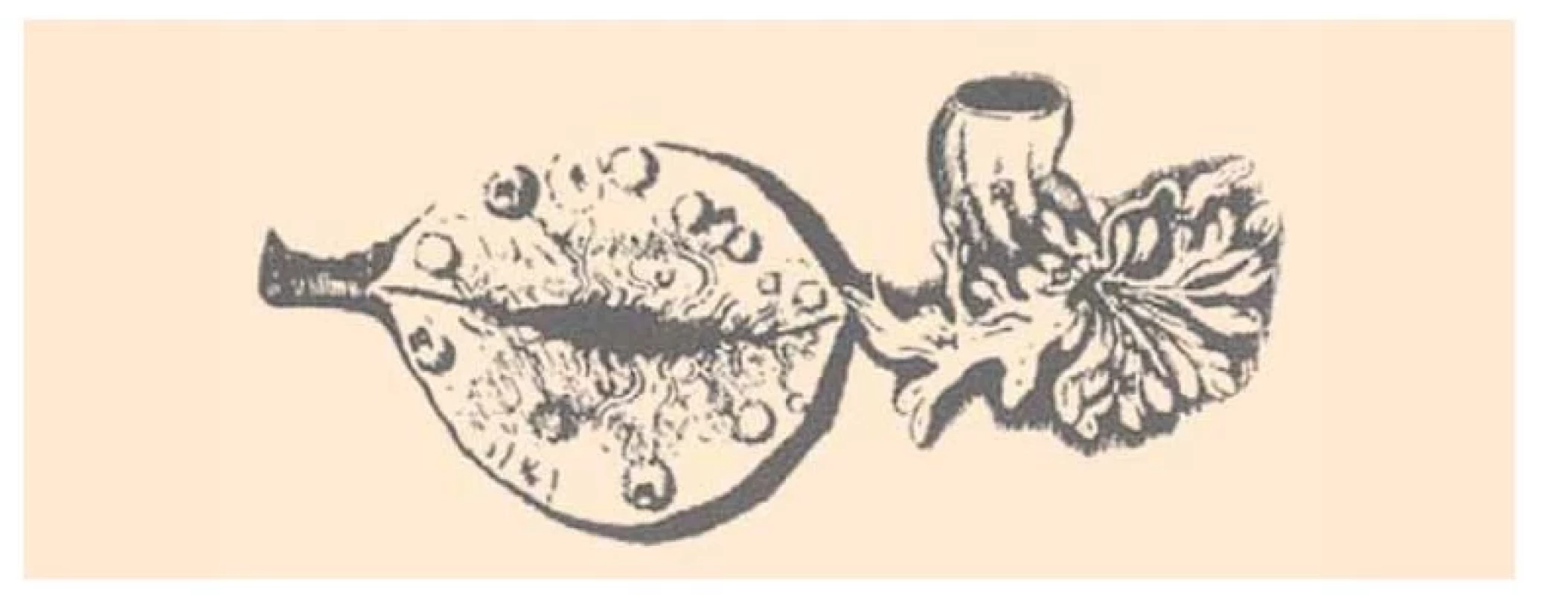
Záujem o význam vajíčkovodu v reprodukcii človeka s príchodom metód umelého oplodnenia výrazne poklesol. Na základe úspechov in vitro fertilizácie, ktoré obchádzajú vajíčkovod, je zrejmé, že vystavenie tubárnemu mikroprostrediu nie je nevyhnutnou podmienkou na to, aby došlo k oplodneniu alebo implantácii. Avšak pri oplodnení in vivo hrá vajíčkovod zásadnú úlohu v transporte gamét, pri selekcii a uskladnení spermií a pri ich hyperaktivácii. Je tiež miestom oplodnenia a raného vývinu embrya [6,7]. Vajíčkovody sa v súčasnosti stávajú dokonca „nepriateľom“ gynekológov, odkedy sa potvrdilo, že high-grade serózne karcinómy vaječníkov nevznikajú z povrchového epitelu vaječníka, ale práve z epitelových buniek distálneho ústia vajíčkovodu. Ich prekurzory sa preto označujú ako serózne tubárne intraepitelové karcinómy [8].
Najnovšia slovenská, ale aj svetová vedecká literatúra obsahuje veľmi málo nových informácii týkajúcich sa mikroskopickej stavby a funkcie vajíčkovodov. Cieľom našej prehľadovej práce je priniesť nové poznatky o funkčnej morfológii vajíčkovodov človeka, ktoré môžu byť prínosom aj v odbore gynekológia a pôrodníctvo. Opierame sa pri tom aj o výsledky nášho vedeckého bádania v tejto oblasti.
Metódy práce
Pri vypracovaní komplexného prehľadu sme pracovali s odbornými databázami PubMed, Scopus a ISI Web of Knowledge. Po prvotnej analýze problematiky sme na základe vybraných kľúčových slov (uterine tube, embryo transport, sperm migration, ciliary transport, tubal infertility) vytvorili literárny rešerš. V rámci neho sme sa zamerali na štyri hlavné oblasti:
1. nové poznatky o makroskopickej a mikroskopickej štruktúre vajíčkovodov;
2. mechanizmus transportu gamét a embrya vajíčkovodom;
3. faktory ovplyvňujúce transportnú funkciu vajíčkovodu;
4. klinické využitie získaných teoretických poznatkov.
Literárny prehľad dopĺňame našimi vlastnými pozorovaniami vajíčkovodov vo svetelnom mikroskope. Vzorky tkaniva pochádzali od žien vo fertilnom veku, ktorým sa počas plánovanej gynekologickej operácie odstránili aj inak fyziologické vajíčkovody (v spolupráci s Gynekologicko-pôrodníckym oddelením Všeobecnej nemocnice v Komárne a II. gynekologicko-pôrodníckou klinikou LF UK a UN v Bratislave-Ružinove).
Anatomické repetitórium
Vajíčkovody sú párové svalové trubice, 10–12 cm dlhé. Prebiehajú v hornom okraji ligamentum latum uteri (mesosalpinx), ktorý obsahuje cievy a nervy. Vajíčkovod sa proximálne otvára do dutiny maternice a distálne do peritoneálnej dutiny v blízkosti vaječníka. V priebehu vajíčkovodu rozlišujeme štyri anatomické časti:
1. Infundibulum, teda lievik vajíčkovodu, je rozšírená časť v blízkosti vaječníka, ktorá sa nachádza najdistálnejšie od maternice. Typickým znakom tohto segmentu sú prstovité výbežky – strapce vajíčkovodu (fimbriae tubae uterinae), ktoré sú umiestnené okolo brušného ústia vajíčkovodu. Fimbrie sú asi 1 mm široké a ich počet je približne 25. Jedna z fimbrií, nazývaná fimbria ovarica je najdlhšia a pripája sa k vaječníku. Je však potrebné poznamenať, že i keď sa táto informácia objavuje vo všetkých anatomických učebniciach, žiadny súčasný výskum sa na prítomnosť a význam tejto výrazne dlhšej fimbrie neodvoláva. Hewer [9] publikoval hypotézu, že tak infundibulum ako aj samotné fimbrie sú typom erektilného tkaniva, čo potvrdzuje výskyt širokých žíl v ich sliznici. V čase ovulácie sa tieto cievy napĺňajú krvou, preto sa fimbrie zväčšujú a hrubnú, čím prichádzajú do kontaktu s povrchom vaječníka. Uľahčujú tak zachytenie uvoľňujúceho sa vajíčka z vaječníka. Aj náš výskum [10] dáva čiastočne za pravdu Hewerovi, aj keď z výsledkov nášho bádania si skôr myslíme, že za zhrubnutie fimbrií zodpovedá akumulácia lymfy v širokých lymfatických lakúnach fimbrií, a nie krvi. Vakaliuk et al [11] opísali špecifické mechanizmy regulácie krvného obehu v rámci infundibula, ako vankúšiky z intimy v rámci krvných ciev, svalové a elastické zúženia a chlopne, ako aj kapiláry s početnými fenestráciami. Je možné, že tieto regulačné mechanizmy sú zodpovedné za tvorbu väčšieho objemu lymfy (ako transudátu krvnej plazmy), ktorá sa akumuluje v širokých lymfatických lakúnach v strede fimbrií. Súčasťou infundibula je tiež aj hladká svalovina, však tá zrejme nehrá významnejšiu úlohu pri zachytení oocytu. Experimentálne totiž dochádza k zachyteniu vajíčka pri ovulácii napriek farmakologickej inhibícii tejto hladkej svaloviny izoproterenolom [12].
2. Ampulla, teda banka vajíčkovodu, zaberá dve tretiny celkovej dĺžky vajíčkovodu. Je to najdlhší segment vajíčkovodu, ktorý má aj najväčší priemer. Má pomerne tenkú stenu, a sliznica vybieha do vysokých a mnohonásobne sa vetviacich rias / krkiev (obr. 3). Táto časť vajíčkovodu predstavuje akési locus fecundationis, nakoľko predstavuje miesto, kde dochádza k oplodneniu, teda splynutiu pohlavných buniek [13].
Image 3. Banka (ampulla) vajíčkovodu s výraznými a mnohopočetne sa vetviacimi slizničnými riasami (SR). Lúmen (čierne hviezdy), jednovrstvový cylindrický epitel (čierne šípky), väzivová vrstva sliznice (žlté šípky), široké lymfatické lakúny (čierne trojuholníky), svalová vrstva (SV). Farbenie hematoxylín a eozín.
Fig. 3. Bank (ampulla) of the fallopian tube with distinct and multiply branching mucosal algae (SR). Lumen (black stars), single- layered cylindrical epithelium (black arrows), connective tissue layer of the mucosa (yellow arrows), wide lymphatic lacunae (black triangles), muscular layer (SV). Hematoxylin and eosin staining.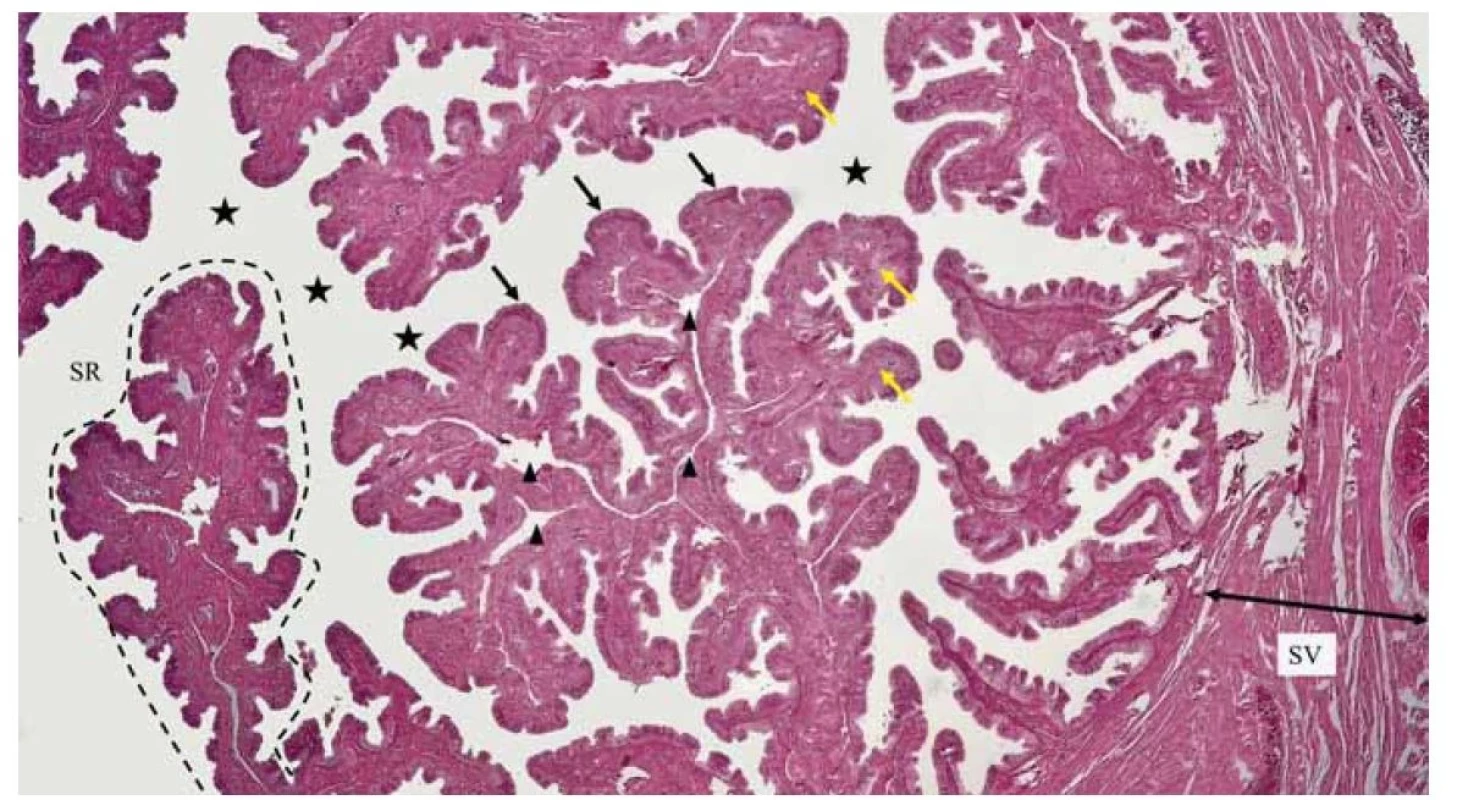
3. Isthmus, teda úžina vajíčkovodu, je naopak najužšia mediálna časť tuba uterina medzi ampullou a maternicou. Je 1–5 mm široký, 3 cm dlhý a na rozdiel od banky vajíčkovodu je jeho stena hrubšia a slizničné riasy menej výrazné (obr. 4).
Image 4. Úžina (isthmus) vajíčkovodu. Slizničné riasy (SR) nie sú také výrazné ako v ampulle. Naproti tomu svalová vrstva (SV) je výrazná (dlhá čierna obojsmerná šípka). Lúmen (čierna hviezda), jednovrstvový cylindrický epitel (čierna šípka), väzivová vrstva sliznice (žltá šípky), väzivová vrstva z riedkeho kolagénového väziva pod serózou (krátka čierna obojsmerná šípka), seróza tvorená jednovrstvovým plochým mezotelom (červená šípka). Farbenie hematoxylín a eozín.
Fig. 4. The isthmus of the fallopian tube. Mucous cilia (SR) are not as prominent as in the ampoule. In contrast, the muscular layer (SV) is prominent (long black bidirectional arrow). Lumen (black star), single-layered cylindrical epithelium (black arrow), fibrous layer of mucosa (yellow arrows), fibrous layer of sparse collagen ligament under serosa (short black bidirectional arrow), serosa formed by single-layered flat mesothelium (red arrow). Hematoxylin and eosin staining.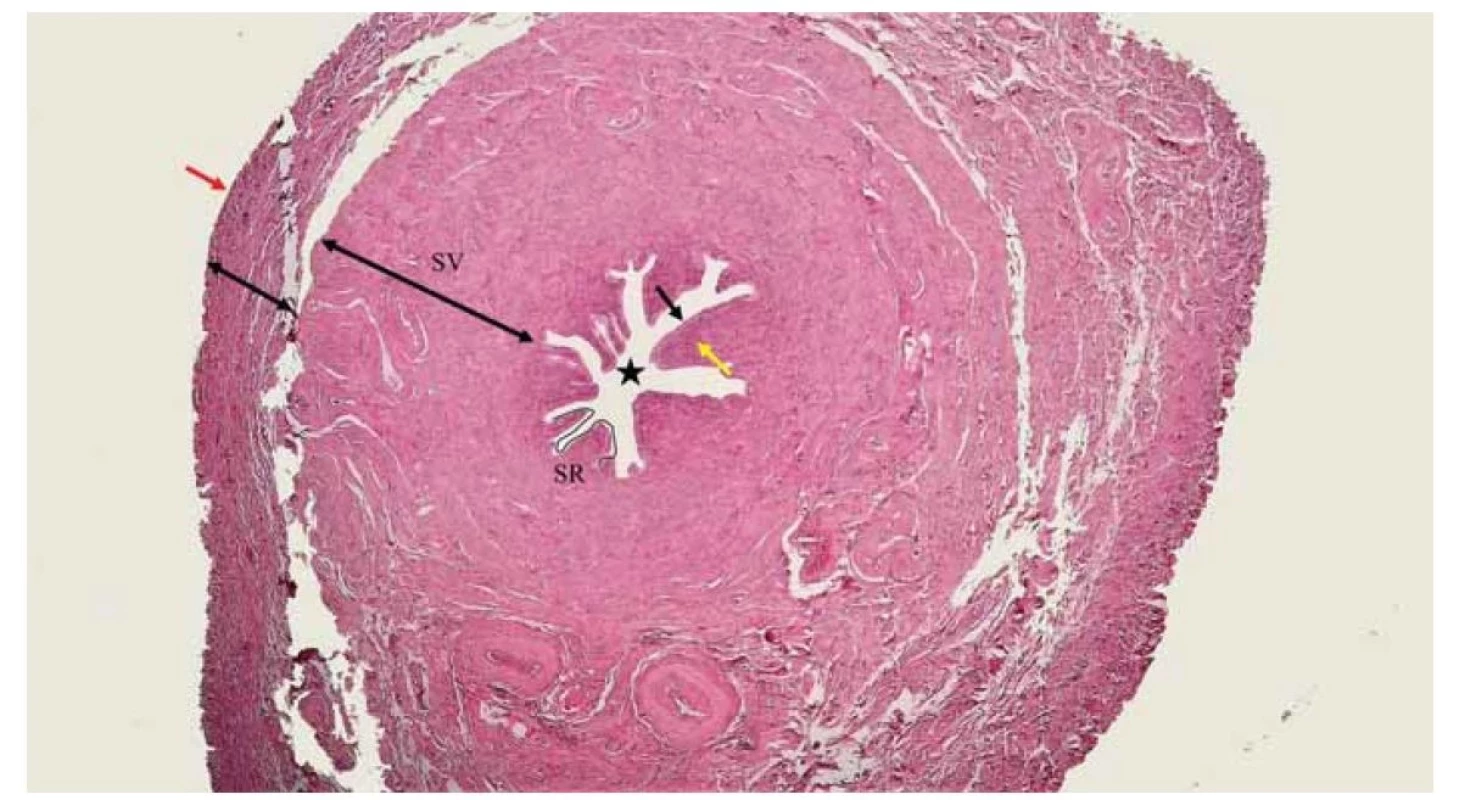
4. Intramurálna časť, teda pars uterina alebo maternicová časť, je približne 1 cm dlhá a 0,7 mm široká. Táto časť vajíčkovodu prebieha v stene maternice a otvára sa do jej dutiny cez maternicový otvor vajíčkovodu (ostium uterinum tubae uterinae).
Vajíčkovody sú inervované autonómnymi vláknami, ktoré prebiehajú spolu s cievami. Väčšia časť tuba uterina má duálnu sympatikovú aj parasympatikovú inerváciu. Pregangliové parasympatikové vlákna pochádzajú z blúdivého nervu (n. vagus) a inervujú distálnu polovicu a splanchnické nervy inervujú proximálnu polovicu. Pregangliové sympatikové zásobovanie pochádza z neurónov v intermediolaterálnom stĺpci T10–L2 miechových segmentov, postgangliové sympatikové vlákna sú odvodené z plexus hypogastricus superior. Viscerálne aferentné vlákna prebiehajú so sympatikovými nervami a spolu vstupujú cez zodpovedajúce chrbtové korene, môžu tiež prebiehať spolu s parasympatikovými vláknami [14].
Arteriálne zásobenie vajíčkovodov predstavujú aa. ovaricae et aa. uterinae. Distálna tretina vajíčkovodu je zásobovaná prostredníctvom a. ovarica, ktorá pokračuje v mesosalpinxe a vytvára početné anastomózy s vetvami a. uterina. Proximálna tretina je zásobovaná prostredníctvom a. uterina. Venózna drenáž je veľmi podobná arteriálnemu zásobeniu. Venóznu drenáž distálnych dvoch tretín zabezpečujú vv. ovaricae, ktoré sa vlievajú do v. cava inferior na pravej strane a v. renalis na ľavej strane. Proximálne dve tretiny vajíčkovodu sú drenované cez plexus uterinus do vv. iliacae internae [14].
Lymfatické cievy vajíčkovodu odvádzajú lymfu do nodi lymphatici lumbales. Lymfatické cievy sledujú priebeh lymfatickej drenáže vaječníkov a maternice. Tri samostatné lymfatické siete drénujú sliznicu, svalovinu a serózu. Po výstupe zo steny vajíčkovodu sa lymfatické siete spoja, spoločne vstúpia do mesosalpinxu a v lig. latum uteri smerujú nahor k paraaortálnym uzlinám [15].
Embryologické repetitórium
Podkladom pre vznik pohlavných orgánov je intermediárna mezoderma embrya. Počas 6. týždňa vývinu majú embryá mužského aj ženského pohlavia dva páry vývodov, ktoré sa tiahnu mediálne od genitálnej lišty (budúce semenníky alebo vaječníky) smerom ku kloake (budúci základ močového mechúra a konečníka). Sú to mezonefrický (Wolffov) vývod, ktorý vychádza z vývinového štádia obličky zvaného mezonefros a otvára sa do kloaky, a laterálne od neho sa vytvára paramezonefrický (Müllerov) vývod. U ženského embrya neprítomnosť génu pre Anti-Müllerovský hormón a génu SRY (sex-determining region Y) podmieňuje regresiu Wolffových vývodov a ďalšiu diferenciáciu Müllerových vývodov [16]. Wolffove vývody embryí ženského pohlavia regredujú aj z dôvodu absencie testosterónu [17]. Zvyšky z Wolffových vývodov však môžu perzistovať vo forme mikroskopicky pozorovateľných uzlíkov buniek, ktoré sa však môžu cysticky zväčšiť. Tieto rudimenty sú anatomicky lokalizované v okolí vajíčkovodov (ako appendix vesiculosa, epoöphoron = Rosenmüllerov orgán a paraoöphoron), alebo v okolí maternice a pošvy uložené v ligamentum latum uteri (Gartnerove vývody a cysty). U embryí ženského pohlavia pretrvávajú Müllerove paramezonefrické vývody, ktoré v kraniálnej časti ostávajú od seba oddelené (budúce vajíčkovody) a počas 8. týždňa vývinu v kaudálnejšej časti splývajú (základ pre maternicu a kraniálnu časť pošvy) [18]. Pôvodné Müllerove vývody sú počas vývinu dlhšie ako je dĺžka formujúcich sa vajíčkovodov. Aj preto najkraniálnejšia časť vývodov regreduje, a z tohto tkaniva sa môžu formovať tzv. Morgagniho hydatidózne cysty. Ide o benígne štruktúry, ktoré sa nachádzajú v blízkosti abdominálneho ústia vajíčkovodov. Zvyčajne sú asymptomatické a väčšinou ide o náhodné nálezy zachytené pri laparotómii alebo laparoskopii. Niektoré štúdie naznačujú, že Morgagniho cysty pripojené k fimbriám vajíčkovodu znižujú jeho schopnosť zachytiť oocyt po ovulácii, a tým znižujú pravdepodobnosť úspešného spontánneho oplodnenia [19]. Rasheed a Abdelmonem [20] publikovali štúdiu, v ktorej sa zamerali na Morgagniho cysty ako možnú príčinu nevysvetliteľnej tubárnej neplodnosti. Prvá skupina pacientiek podstúpila laparoskopickú excíziu Morgagniho cýst, pokiaľ druhá, kontrolná skupina nepodstúpila žiadny zákrok. U väčšiny boli cysty unilaterálne, jednotlivé, juxta-fimbriálne s priemerom 1–2 cm. Autori tejto štúdie zistili, že miera gravidity v skupine, ktorá podstúpila laparoskopickú excíziu cýst, bola výrazne vyššia. Pacientky s bilaterálnymi cystami pripojenými k fimbriám vajíčkovodu dosiahli maximálnu kumulatívnu graviditu takmer 86% na konci 2. a 3. mesiaca po odstránení cýst.
Vrodené vývinové chyby vajíčkovodov sa najčastejšie spájajú s vrodenými anomáliami pošvy, maternice a obličiek [21]. Agenéza Müllerových vývodov (Mayerov-Rokitanského-Küsterov-Hauserov syndróm) sa prejavuje nevyvinutím vajíčkovodov, maternice aj kraniálnej časti pošvy, môžu byť poškodené aj obličky. Vývin vaječníkov však nie je narušený, preto u takýchto dievčat sa normálne vyvíjajú sekundárne pohlavné znaky. Na vyšetrenie ku gynekológovi prichádzajú najčastejšie z dôvodu primárnej amenorhey, bolestiam v oblasti panvy, alebo kvôli problémom pri pohlavnom styku (kvôli nevyvinutiu väčšej časti pošvy). Terapiou je vytvorenie neovagíny, aby sa skvalitnil pohlavný život a psychologické poradenstvo v oblasti plánovania rodičovstva [22]. Na strane druhej, vo svetovej literatúre sa len zriedkavo opisujú izolované prípady unilaterálnej alebo bilaterálnej absencie vajíčkovodov.
Ďalšou zriedkavou anomáliou vajíčkovodov, ktorá je významná pre gynekológov, sú akcesórne vajíčkovody, ktoré sú pripojené k funkčnému vajíčkovodu. Hoci sú zriedkavé, môžu prispieť k neplodnosti a extrauterinnej tehotnosti, ak zachytia uvoľňujúce sa vajíčko skôr ako funkčný vajíčkovod [23]. Prvý prípad duplikácie vajíčkovodu opísal slávny dánsky anatóm Frederick Ruysch (1638–1731). Vypreparovaný vnútorný genitál ženy s troma vajíčkovodmi je dodnes súčasťou zbierky Múzea antropológie a etnografie Petra Veľkého (Kunstkamera) v Petrohrade, v Rusku [24].
Histologické repetitórium
Sliznica vajíčkovodu sa skladá z epitelovej výstelky a sliznicového väziva (lamina propria), vytvára pozdĺžne slizničné riasy, plicae mucosae. Tieto početné rozvetvené záhyby sliznice sú najvýraznejšie v ampulle, ktorá v priereze pripomína labyrint a postupne sa zmenšujú v častiach bližšie k maternici až nakoniec v intramurálnej časti vajíčkovodu absentujú [25]. Vajíčkovod vystiela jednovrstvový cylindrický riasinkový epitel. V závislosti od roviny rezu, jadrá epitelových buniek ležia na rôznych úrovniach, čím miestami mylne pripomínajú viacradový epitel [26]. V rámci výstelky epitelu vajíčkovodu môžeme od 12. týždňa tehotenstva morfologicky a funkčne rozlíšiť rôzne populácie buniek. Patria sem tri typy epitelových buniek, pôvodom ide o deriváty paramezonefrických (Müllerových) vývodov:
- bazálne bunky;
- bunky s mikroklkmi;
- riasinkové bunky.
Na apikálnom povrchu buniek s mikroklkmi je často pozorovateľná jediná riasinka [26]. Medzi histológmi však všeobecne neexistuje jednoznačná dohoda o tom, koľko typov epitelových buniek tvorí epitel vajíčkovodu počas reprodukčného života ženy. Podľa najznámejších medzinárodných histologických učebníc sa epitel skladá z dvoch, troch, prípadne podľa niektorých až z štyroch typov buniek. Väčšina terminologických nezrovnalostí sa týka bazálnych buniek. Diskutuje sa najmä o ich prítomnosti alebo neprítomnosti a o tom, či interkalárne bunky a sekrečné bunky predstavujú rovnakú alebo rozdielnu populáciu buniek. Tieto nezrovnalosti sú spôsobené skutočnosťou, že neexistuje žiadny špecifický marker (histochemický alebo imunohistochemický), ktorý by spoľahlivo odlíšil tieto typy buniek [27]. Podľa medzinárodne akceptovanej a stále platnej nomenklatúry Terminologia Histologica [28] možno v rámci jednovrstvového cylindrického epitelu rozlišovať štyri typy buniek, medzi ktoré patria:
- Epitheliocytus ciliatus – riasinkové bunky;
- Exocrinocytus tubarius – sekrečné bunky vajíčkovodu;
- Epitheliocytus tubarius angustus – interkalárne bunky, anglicky peg cells;
- Epitheliocythus tubarius basalis – bazálne bunky vajíčkovodu.
Imunohistochemicky však možno potvrdiť, že väčšina zrelých, diferencovaných epitelových buniek vajíčkovodu – riasinkových, ale aj sekrečných buniek, je mitoticky aktívna (pozitivita jadra na ki67 proliferačný antigén). Epitel teda nevyžaduje na uľahčenie regenerácie špeciálnu populáciu bazálnych nediferencovaných buniek [26]. Navyše bazálne bunky s výrazne svetlou cytoplazmou sú negatívne na markery proliferácie a preto nie sú mitoticky aktívne. Aj na základe ich povrchových markerov preto pôvodne opisované „bazálne bunky“ predstavujú populáciu intraepitelových regulačných (supresorových) T-lymfocytov. Tie pravdepodobne hrajú úlohu pri regulácii imunitnej tolerancie proti cudzím bunkám, ako sú spermie alebo embryo v ranom štádiu, ktorým je vajíčkovod vystavený [26]. Preto predpokladáme, že v aktualizovanom vydaní Terminologia Histologica vypadne termín „epitheliocytus tubarius basalis“ a nahradí ho termín „lymphocytus T intraepithelialis tubarius“.
Lamina propria je tenká vrstva spojivového tkaniva obsahujúca kolagénové a retikulárne vlákna, fibroblasty, žírne bunky (mastocyty) a lymfatické bunky. U postmenopauzálnych žien sú slizničné riasy hrubšie, epitel je nižší a lamina propria je hustejšia ako počas reprodukčného života. V roku 1904 nemecký gynekológ Paul Kroemer opísal v slizničných riasach vajíčkovodu široké priestory. Predpokladal, že sú to lymfatické cievy a nazval ich „Lymphbahnen“. Až v roku 2018 bola publikovaná štúdia, ktorej autori detailnejšie opísali tieto priestory a dokázali ich asociáciu s lymfatickým systémom. Tieto lymfatické lakúny sa tiahnu stredom každej slizničnej riasy a sú lemované jednou vrstvou lymfatických endotelových buniek. Najnápadnejšie sú vo fimbriách, ale veľmi dobre rozpoznateľné sú aj v slizničných riasach ampully (obr. 5). Ich prítomnosť bola potvrdená bez ohľadu na vek pacientky, teda aj v atrofických záhyboch u postmenopauzálnych žien. Význam týchto priestorov je otázny a autori štúdie predstavili dve hypotézy. Podľa prvej hypotézy, lakúny sa počas ovulácie naplnia lymfou čím dôjde k zväčšeniu a výraznému zhrubnutiu fimbrií. Tie sa tak dostanú do blízkeho kontaktu s povrchom vaječníka a ľahšie zachytia uvoľnený oocyt. Druhá hypotéza predpokladá ich účasť na procese tvorby a resorpcie tubárnej tekutiny [10].
Image 5. Detail slizničnej riasy ampully vajíčkovodu. Imunohistochemický dôkaz širokých lymfatických lakún vo väzivovej vrstve sliznice. Lúmen lymfatických lakún (čierne hviezdy), diaminobenzidínom do hneda zafarbené lymfatické endotelové bunky (čierne šípky) – dôkaz prítomnosti antigénu podoplanínu prostredníctvom protilátky D2-40.
Fig. 5. Detail of the mucous alga of the ampulla of the fallopian tube. Immunohistochemical evidence of wide lymphatic lacunae in the connective tissue layer of the mucosa. Lumen of lymphatic lacunae (black stars), diaminobenzidine brownstained lymphatic endothelial cells (black arrows) – proof of the presence of podoplanin antigen via D2-40 antibody.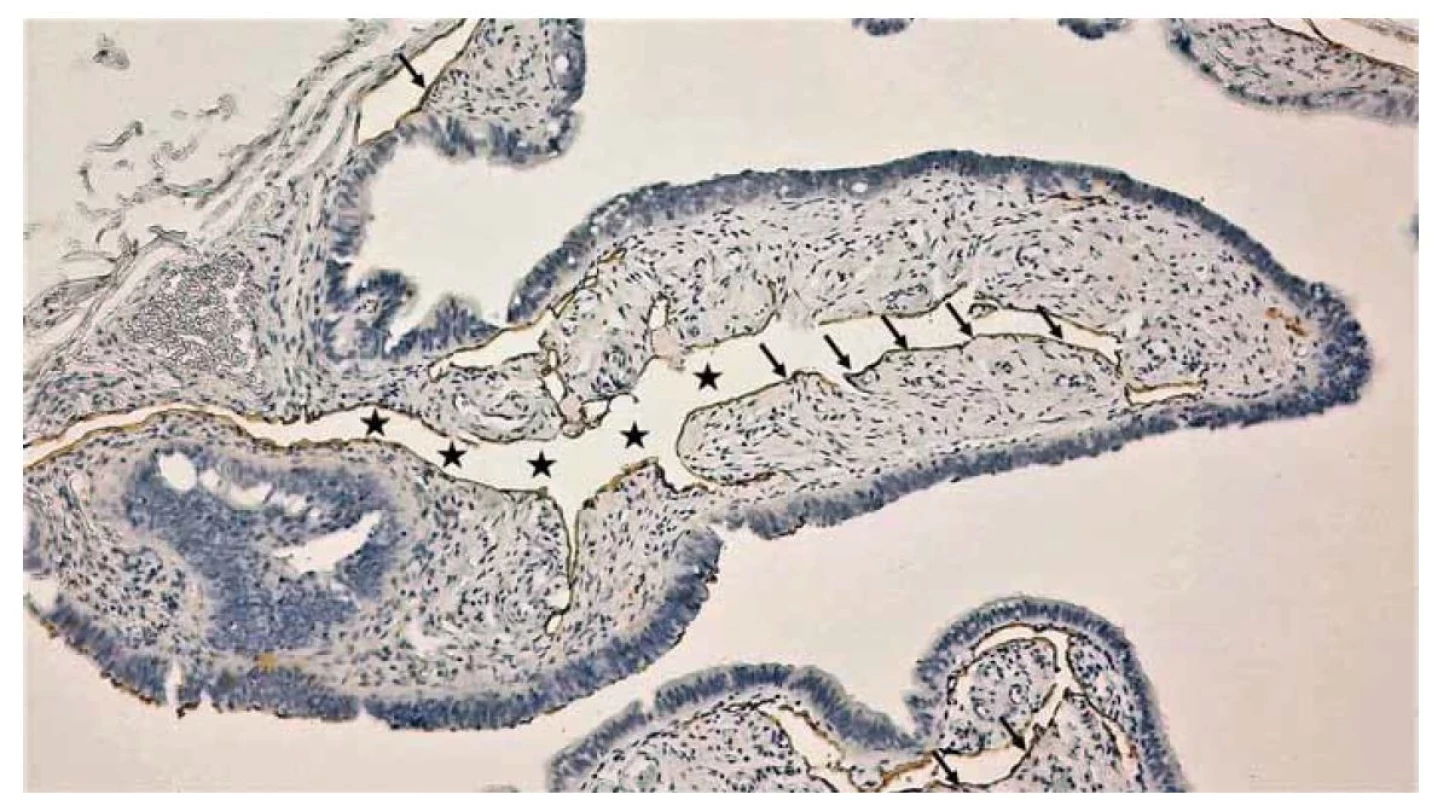
Druhá vrstva steny vajíčkovodu, svalovina, pozostáva z buniek hladkého svalstva usporiadaných do dvoch nevýrazných vrstiev, vnútornej cirkulárnej a vonkajšej pozdĺžnej. Hladké svalové bunky majú na svojom povrchu receptory pre ovariálne hormóny, ktoré ovplyvňujú motilitu svaloviny vajíčkovodu. Jej peristaltické kontrakcie posúvajú oocyt/embryo smerom k maternici. Svalová vrstva je najhrubšia v oblasti isthmu a intramurálnej časti (pars uterina). V stróme medzi hladkým svalovými bunkami sa nachádza aj populácia buniek, ktoré sa pôvodne označovali ako bunky podobné intersticiálnym Cajalovým bunkám (teda bunky podobné Cajalovým bunkám svaloviny čreva). Dnes sa označujú skôr termínom telocyty a v rámci vajíčkovodu ich možno potvrdiť nie len v svalovine, ale aj vo väzive sliznice (obr. 6) [29]. Telocyty majú nevýrazné, malé, oválne bunkové telo obsahujúce jadro obklopené malým množstvom cytoplazmy a mimoriadne dlhé cytoplazmatické výbežky [30]. Ich dĺžka sa pohybuje medzi desiatkami až stovkami mikrometrov, avšak hrúbka dosahuje len približne 0,2 µm, a preto na ich identifikáciu je nevyhnutná transmisná elektrónová mikroskopia [31]. Niektoré z nich majú sekundárne a terciárne vetvy, čím vytvárajú trojrozmernú sieť. Sú v blízkom kontakte s hladkými svalovými bunkami, nervovými vláknami a kapilárami [32]. Medzi normálne funkcie telocytov patria medzibunková signalizácia, regulácia mikroprostredia kmeňových buniek, regulácia hormonálnej signalizácie a regulácia motility. Medzi patologické stavy, pri ktorých sa predpokladá účasť telocytov v etiopatogenéze, patrí endometrióza, idiopatická infertilita, tumorigenéza a mnohé ďalšie [33–35].
Image 6. Detail väzivovej vrstvy sliznice. Imunohistochemický dôkaz prítomnosti novoobjavených intersticiálnych buniek – telocytov prostredníctvom antigénu CD117 (červená šipka).
Fig. 6. Detail of the fibrous layer of the mucous membrane. Immunohistochemical proof of the presence of newly discovered interstitial cells – telocytes through CD117 antigen (red arrow).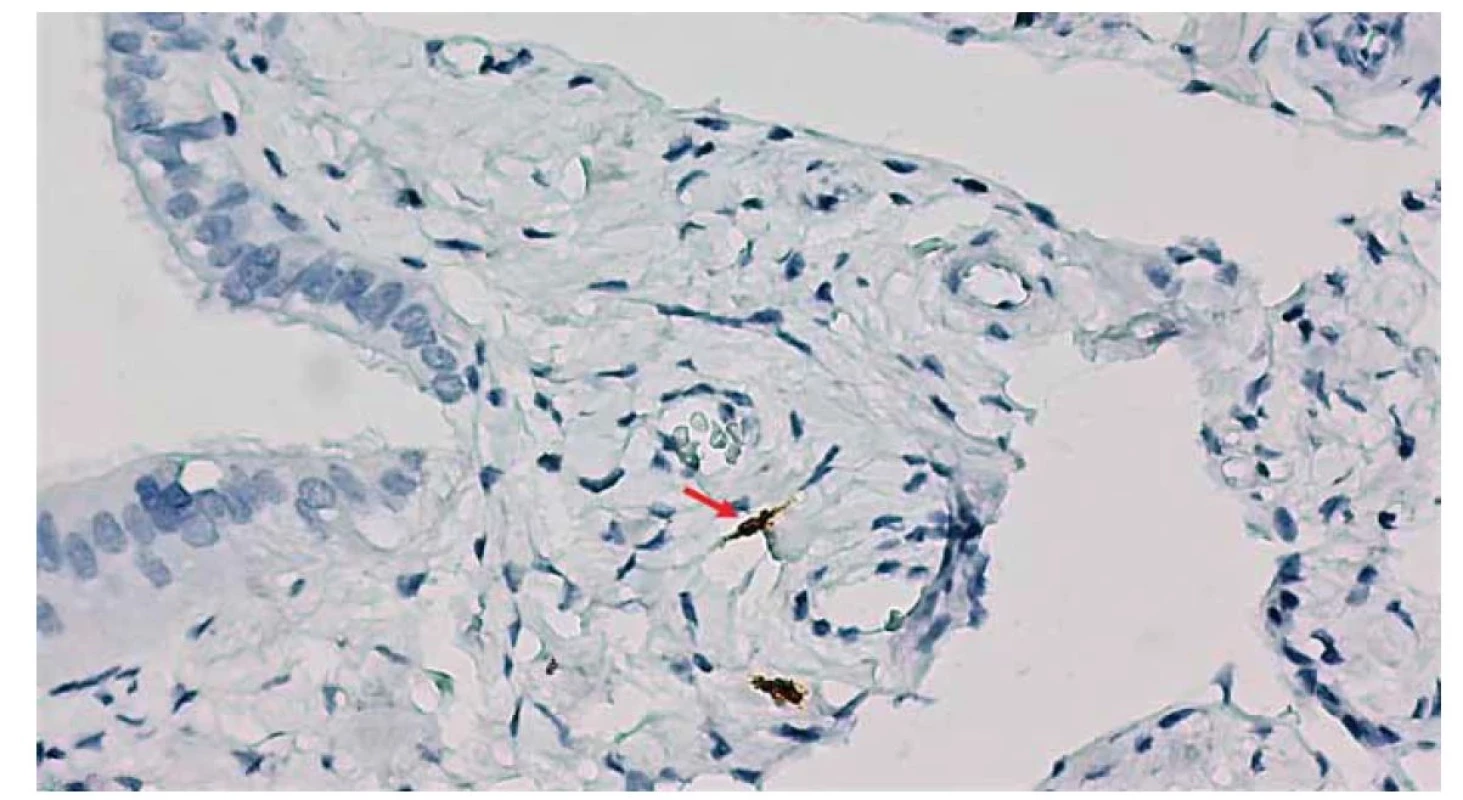
Tretia vrstva steny vajíčkovodu, seróza, pozostáva z tenkej vrstvy riedkeho kolagénového väziva pokrytého jednou vrstvou dlaždicových buniek mezotelu. V seróze sa môžu nachádzať rôzne cystické útvary (častejšie však u starších žien). Paratubárne cysty sú zväčša benígne, klinicky asymptomatické, sú pomerne bežným nálezom pri ultrasonografickom vyšetrení. Riziko ich malígnej transformácie je veľmi nízke (2–3 %) [36]. V odbornej literatúre sú prípady ich malígnej transformácie opisované raritne, najmä ak sa vyskytli u žien v mladšom veku [37]. Medzi časté mikroskopické nálezy v seróze patria malé zhluky epiteliálnych buniek nazývané Walthardove bunkové hniezda. Ich eponymický názov nesie meno ich objaviteľa, švajčiarskeho gynekológa Maxa Waltharda, ktorý ich komplexne opísal v roku 1903. Mikroskopicky sú zložené z polygonálnych buniek podobných epitelu a môžu byť občas cystické a dosahovať veľkosť 2–3 mm (obr. 7). Tieto zhluky epitelových buniek sú pravdepodobne odvodené invagináciou z mezotelu alebo sú pozostatkom Wolffových vývodov [38].
Image 7. Detail serózy vajíčkovodu. Zhluk epitelových buniek označovaných ako Walthardove bunkové hniezda (červená prerušovaná čiara).
Fig. 7. Detail of fallopian tube serosa. A cluster of epithelial cells referred to as Walthard's cell nests (red dashed line).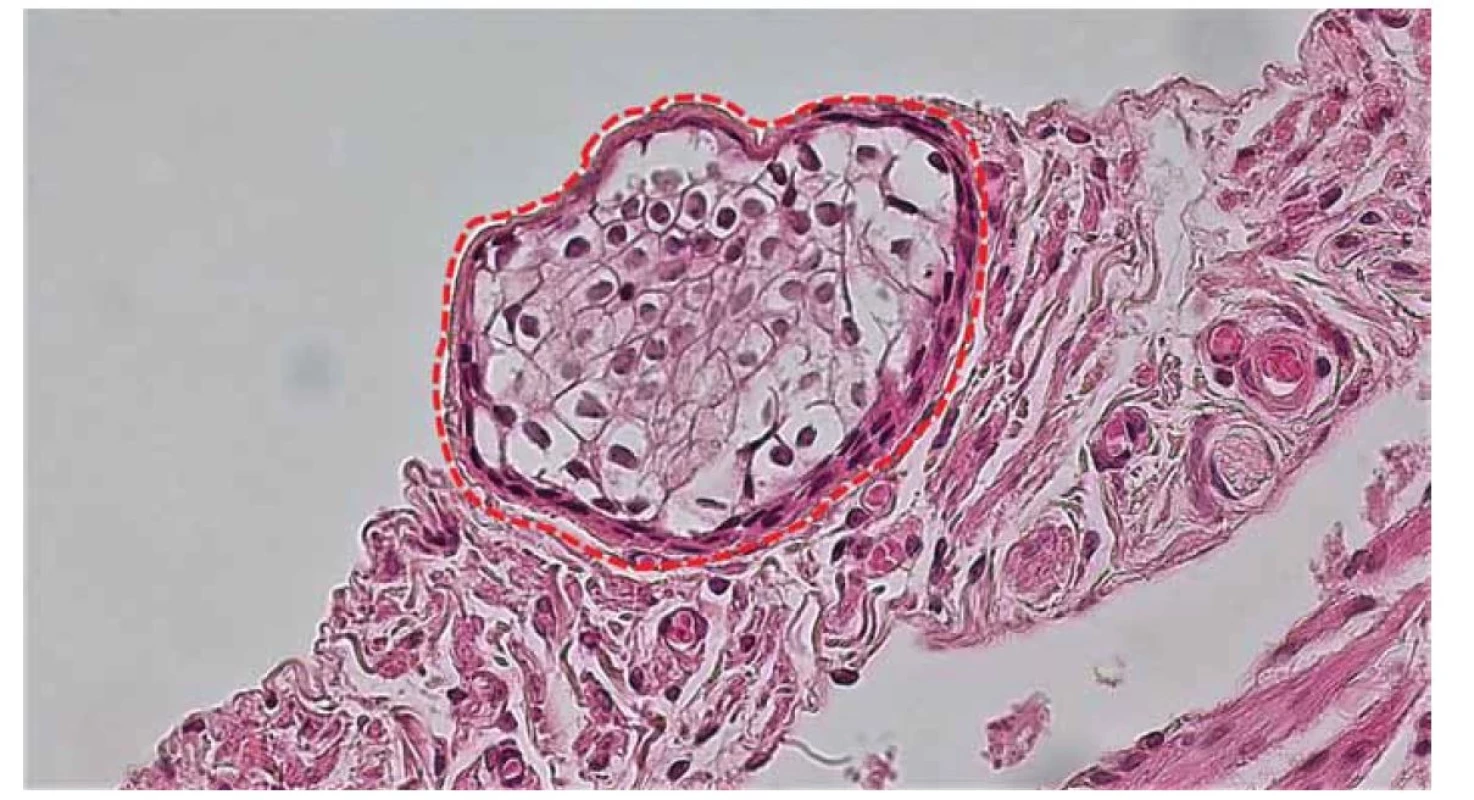
Jedinečnosť epitelu vajíčkovodov
Epitel vajíčkovodov tvoria morfologicky a funkčne rôznorodé bunkové populácie (obr. 8). Riasinkové bunky sú najpočetnejšie v infundibule a ampulle a nachádzajú sa predovšetkým na vrchole slizničných rias. Každá takáto bunka nesie na svojom apikálnom povrchu riasinky, ktoré majú priemernú dĺžku asi 10 µm a priemer 0,25 µm [39]. Všeobecne známy je aj progresívny pokles podielu riasinkových buniek v rámci epitelu z viac ako 50 % na fimbriách, na menej ako 35 % v oblasti isthmu [40]. Vajíčkovod, rovnako ako aj ostatné orgány ženského reprodukčného systému, prechádza cyklickými zmenami, ktoré sa týkajú morfológie epitelových buniek. Patrí sem ciliogenéza, ktorá je stimulovaná zvýšenými hladinami estrogénu a progesterón naopak podporuje deciliáciu. Hypertrofia a ciliogenéza nastáva počas včasnej folikulárnej fázy menštruačného cyklu, kedy sa výška buniek zvyšuje z 24 µm na 30 µm a približne 10–12 % buniek vytvára nové riasinky. Epitelové bunky dosahujú maximálnu výšku a ciliáciu (57 % fimbria, 42 % ampulla) počas neskorej folikulárnej fázy. Na konci menštruačného cyklu nastáva atrofia a deciliácia, čo je spôsobené zvýšenou hladinou progesterónu v krvnej plazme. Tieto procesy pokračujú v prípade gravidity, pričom maximálna atrofia bola zaznamenaná na konci prvého trimestra, ale deciliácia pokračovala až do pôrodu a iba 24 % buniek si zachovalo riasinky v ampulle a fimbriách [41]. Ultraštruktúra epitelu vajíčkovodu sa významne mení nie len v súvislosti s menštruačným cyklom, ale aj v jednotlivých vekových fázach ženy, počas šestonedelia [42] a v menopauze [43], a dokonca aj po chirurgickej ligácii vajíčkovodov [44].
Image 8. Detail slizničnej riasy (SR) ampully vajíčkovodu. Jednovrstvový cylindrický epitel je tvorený dvoma hlavnými populáciami buniek – cylindrickými bunkami s pohyblivými riasinkami (čierne šípky) a sekrečnými bunkami.
Fig. 8. Detail of the mucosal alga (SR) of the ampulla of the fallopian tube. The single-layered columnar epithelium is formed by two main populations of cells – columnar cells with motile cilia (black arrows) and secretory cells.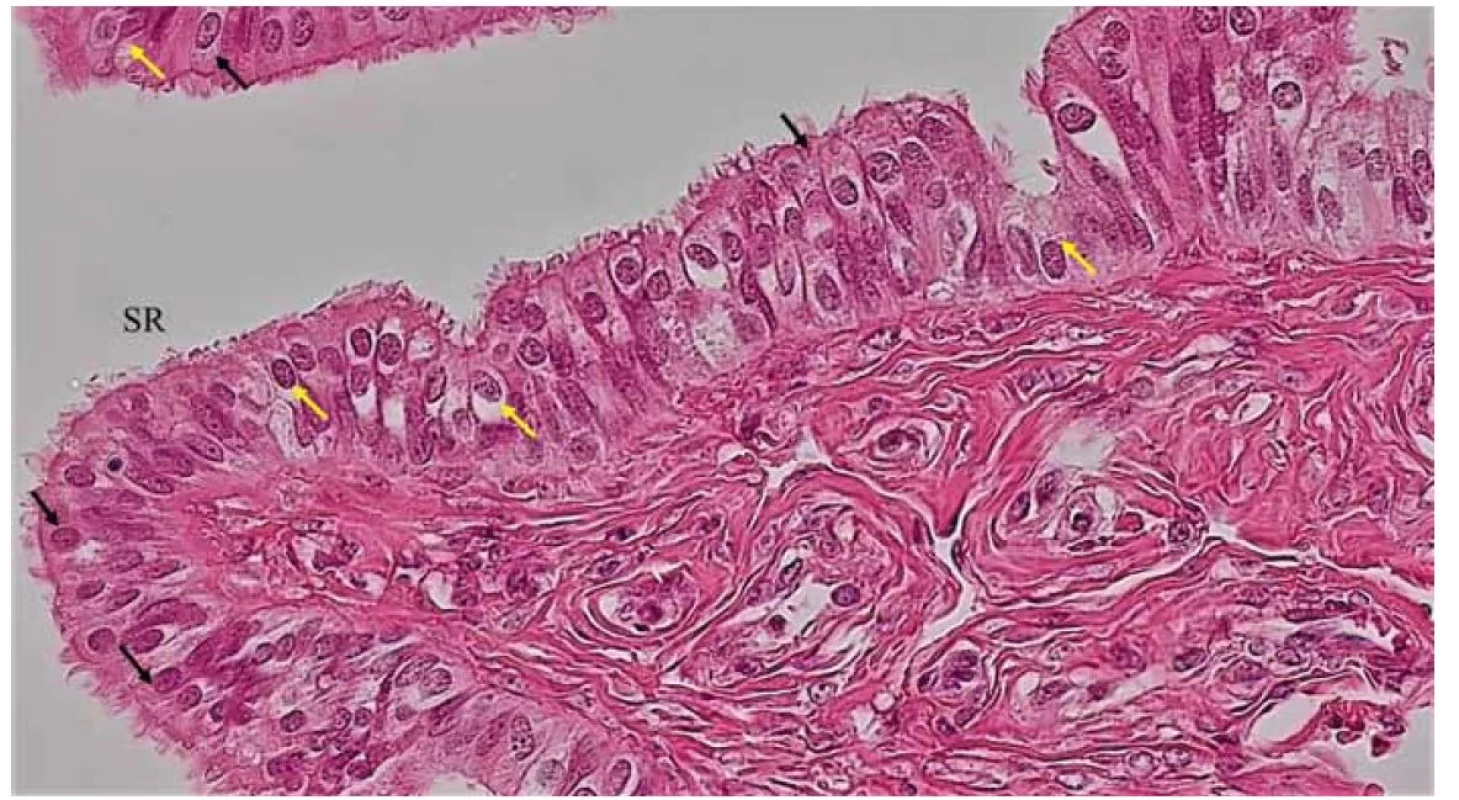
Sekrečné bunky sú najpočetnejšie v oblasti pars uterina vajíčkovodu. Podstupujú tiež cyklické zmeny vo výške a vzhľade, čo poukazuje na ich vývoj, akumuláciu a vylučovanie sekrétu počas menštruačného cyklu [14]. Tieto bunky produkujú tubárnu tekutinu, ktorá sa zložením odlišuje od krvnej plazmy. Obsahuje viac draslíka, hydrogénuhličitanov a má nižšiu koncentráciu vápenatých katiónov. Jej súčasťou sú tiež sérové proteíny vrátane imunoglobulínov [45]. Novšie výskumy potvrdzujú, že práve sekrečné bunky vajíčkovodov predstavujú prekurzorové bunky pre high-grade serózny ovariálny karcinóm (HGSOC). Medzi najvýznamnejšie dôkazy patrí prítomnosť lézií vo vajíčkovode (najmä vo fimbriách) v počiatočnom štádiu a skutočnosť, že sekrečné bunky exprimujú markery a majú rovnaké mutácie TP53 ako metastatické nádory [46,47]. Salpingektómia, teda chirurgické odstránenie vajíčkovodov, bez odstránenia vaječníkov, môže štatisticky významne znížiť riziko rakoviny vaječníkov [48]. Eleje et al [49] priniesli metaanalýzu 10 non-randomizovaných kohortových štúdií. Všetky zahrnuté štúdie porovnávali výsledky u pacientiek, ktoré podstúpili riziká znižujúcu bilaterálnu salpingo-ooforektómiu (RRSO – risk-reducing bilateral salpingo-oopheroctomy) aj riziká znižujúcu mastektómiu (RRM – risk-reducing mastectomy), alebo podstúpili iba RRSO oproti tým, ktoré nepodstúpili ani jednu zo spomenutých operácií. RRSO sa odporúča najmä u žien, ktoré sú nositeľkami mutácií v géne BRCA1 (breast cancer 1 gene) a v géne BRCA2 (breast cancer 2 gene) po ukončení reprodukčných možností. Autori zistili, že RRSO môže zlepšiť celkové prežívanie a môže znížiť počet úmrtí na HGSOC a rakovinu prsníka, keď sa vykonáva u žien, ktoré sú nositeľkami mutácií v obidvoch génoch. V prípade žien, ktoré sú nositeľkami mutácií iba v géne BRCA1 zistili, že RRSO môže znížiť riziko úmrtia na HGSOC a rakovinu prsníka. U žien ktoré sú nositeľkami mutácií v géne BRCA2 môže, ale nemusí znížiť riziko [49].
Záver
V našej práci sme aj na podklade našich vlastných mikrofotografií priniesli unikátny pohľad na nové poznatky o funkčnej morfológii vajíčkovodov, ktoré sú potrebné pre porozumenie rôznych tubárnych patológií, akými sú tubárna gravidita, či tubárna infertilita, ale aj problematika high-grade seróznych ovariálnych karcinómov.
ORCID autorov
N. Hamranová 0000-0002-9839-5738
J. Záhumenský 0000-0003-0475-6035
M. Csöbönyeiová 0000-0003-2754-0915
I. Varga 0000-0002-0918-741X
Doručené/Submitted: 3. 11. 2022
Prijaté/Accepted: 6. 12. 2022
MUDr. Natália Hamranová
Ústav histológie a embryológie
LF UK v Bratislave
Sasinkova 4
811 08 Bratislava
Slovenská republika
Sources
1. Thiery M. Gabriele Fallopio (1523–1562) and the Fallopian tube. Gynecol Surg 2009; 6 : 93–95. doi: 10.1007/s10397-008-0453-3.
2. Páč L. Slovník anatomických eponym. 2. do-plněné vydání. Praha: Galén 2010.
3. Mortazavi MM, Adeeb N, Latif B et al. Gabriele Fallopio (1523–1562) and his contributions to the development of medicine and anatomy. Childs Nerv Syst 2013; 29 (6): 877–880. doi: 10.1007/s00381-012-1921-7.
4. Wessel GM. Microscope not included. Reinier de Graaf (July 30, 1641 – August 17, 1673). Mol Reprod Dev 2014; 81 (3): Fmi. doi: 10.1002/mrd.22315.
5. Jay V. A portrait in history. The legacy of Reinier de Graaf. Arch Pathol Lab Med 2000; 124 (8): 1115–1116. doi: 10.5858/2000-124-1115-TLO RDG.
6. Miller DJ. Review: the epic journey of sperm through the female reproductive tract. Animal 2018; 12 (s1): s110–s120. doi: 10.1017/S175173 1118000526.
7. Li S, Winuthayanon W. Oviduct: roles in fertilization and early embryo development. J Endocrinol 2017; 232 (1): R1–R26. doi: 10.1530/ JOE-16-0302.
8. Gockley AA, Elias KM. Fallopian tube tumorigenesis and clinical implications for ovarian cancer risk-reduction. Cancer Treat Rev 2018; 69 : 66–71. doi: 10.1016/j.ctrv.2018.06.004.
9. Hewer EE. Textbook of histology for medical students. 3rd ed. London: William Heinemann Medical Books Ltd 1945.
10. Varga I, Kachlík D, Žišková M et al. Lymphatic lacunae of the mucosal folds of human uterine tubes – a rediscovery of forgotten structures and their possible role in reproduction. Ann Anat 2018; 219 : 121–128. doi: 10.1016/ j.aanat.2018.06.005.
11. Vakaliuk LM, Zeliak VL, Melman EP. The circulatory bed of the humanuterine tube. Arkh Anat Gistol Embriol 1988; 94 (2): 86–93.
12. Halbert SA, Tam PY, Blandau RJ. Egg transport in the rabbit oviduct: theroles of cilia and muscle. Science 1976; 191 (4231): 1052–1053. doi: 10.1126/science.1251215.
13. Kajanová M, Danihel L, Polák Š et al. Štruktúrny základ transportnej funkcie vajíčkovodu. Ceska Gynekol 2012; 77 (6): 566–571.
14. Atkins KA. Normal histology of the uterus and fallopian tubes. In: Mills SE (ed). Histology for pathologists. 5th edition. Philadelphia: Wolter Kluwer 2020 : 1059–1106.
15. Eddy CA, Pauerstein CJ. Anatomy and physiology of the fallopian tube. Clin Obstet Gynecol 1980; 23 (4): 1177–1193. doi: 10.1097/00 003081-198012000-00023.
16. Schoenwolf GC, Bleyl SB, Brauer PR et al. Larsen’s Human Embryology. 6th edition. Philadelphia: Elsevier 2021.
17. Moore KL, Persaud TV, Torchia MG. The developing human. Clinically oriented embryology. 10th edition. Philadelphia: Elsevier 2016.
18. Varga I, Tonar Z. Klinicky orientovaná embryológia. In: Záhumenský J (ed). Pôrodníctvo. Bratislava: Solen 2022.
19. Cebesoy FB, Kutlar I, Dikensoy E et al. Morgagni hydatids: a new factor in infertility? Arch Gynecol Obstet 2010; 281 (6): 1015–1017. doi: 10.1007/s00404-009-1233-7.
20. Rasheed SM, Abdelmonem AM. Hydatid of Morgagni: a possible underestimated cause of unexplained infertility. Eur J Obstet Gynecol Reprod Biol 2011; 158 (1): 62–66. doi: 10.1016/j.ejogrb.2011.04.018.
21. Acién P, Acién MI. The history of female genital tract malformation classifications and proposal of an updated system. Hum Reprod Update 2011; 17 (5): 693–705. doi: 10.1093/humu pd/dmr021.
22. Sysak R, Bluska P, Stencl P et al. Agenesis of female internal reproductive organs, the Mayer-Rokitansky-Küster-Hauser syndrome. Bratisl Lek Listy 2021; 122 (12): 839–845. doi: 10.4149/BLL_2021_136.
23. Narang K, Cope ZS, Teixeira JM. Developmental genetics of the female reproductive tract. In: Leung PC, Qiao J (eds). Human reproductive and prenatal genetics. Philadelphia: Elsevier Academic Press 2019.
24. Boer L, Radziun AB, Oostra RJ. Frederik Ruysch (1638–1731): historical perspective and contemporary analysis of his teratological legacy. Am J Med Genet A 2017; 173 (1): 16–41. doi: 10.1002/ajmg.a.37663.
25. Mescher AL. Junqueira’s basic histology. Text and atlas. 13th edition. USA: McGraw-Hill Education 2013.
26. Varga I, Miko M, Kachlík D et al. How many cell types form the epithelial lining of the human uterine tubes? Revision of the histological nomenclature of the human tubal epithelium. Ann Anat 2019; 224 : 73–80. doi: 10.1016/ j.aanat.2019.03.012.
27. Barberini F, Correr S, Makabe S. Microscopical survey of the development and differentiation of the epithelium of the uterine tube and uterus in the human fetus. Ital J Anat Embryol 2005; 110 (2 Suppl 1): 231–237.
28. FICAT (Federative International Committee on Anatomical Terminology). Terminologia histologica: international terms for human cytology and histology. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins 2008.
29. Urban L, Miko M, Kajanova M et al. Telocytes (interstitial Cajal-like cells) in human Fallopian tubes. Bratisl Lek Listy 2016; 117 (5): 263–267. doi: 10.4149/bll_2016_051.
30. Aleksandrovych V, Walocha JA, Gil K. Telocytes in female reproductive system (human and animal). J Cell Mol Med 2016; 20 (6): 994–1000. doi: 10.1111/jcmm.12843.
31. Božíková S, Urban L, Kajanová M et al. Funkčná morfológia novo objavených telocytov v ženskom pohlavnom systéme. Ceska Gynekol 2016; 81 (1): 31–37.
32. Popescu LM, Ciontea SM, Cretoiu D. Interstitial Cajal-like cells in human uterus and fallopian tube. Ann NY Acad Sci 2007; 1101 : 139–165. doi: 10.1196/annals.1389.022.
33. Klein M, Lapides L, Fecmanova D et al. From TELOCYTES to TELOCYTOPATHIES. Do recently described interstitial cells play a role in female idiopathic infertility? Medicina (Kaunas) 2020; 56 (12): 688. doi: 10.3390/medicina56120688.
34. Varga I, Polák Š, Kyselovič J et al. Recently discovered interstitial cell population of telocytes: distinguishing facts from fiction regarding their role in the pathogenesis of diverse diseases called “Telocytopathies”. Medicina (Kaunas) 2019; 55 (2): 56. doi: 10.3390/medicina55020056.
35. Klein M, Lapides L, Fecmanova D et al. Novel cellular entities and their role in the etiopathogenesis of female idiopathic infertility – a review article. Clin Exp Obstet Gynecol 2021; 48 (3): 461–465. doi: 10.31083/j.ceog.2021.03. 2395.
36. Savelli L, Ghi T, De Iaco P et al. Paraovarian / / paratubal cysts: comparison of transvaginal sonographic and pathological findings to establish diagnostic criteria. Ultrasound Obstet Gynecol 2006; 28 (3): 330–334. doi: 10.1002/uog.2829.
37. Terek MC, Sahin C, Yeniel AO et al. Paratubal borderline tumor diagnosed in the adolescent period: a case report and review of the literature. J Pediatr Adolesc Gynecol 2011; 24 (5): e115–e116. doi: 10.1016/j.jpag.2011.05.007.
38. Hunt JL, Lynn AA. Histologic features of surgically removed fallopian tubes. Arch Pathol Lab Med 2002; 126 (8): 951–955. doi: 10.5858/2002-126-0951-HFOSRT.
39. Satir P. Mechanisms of ciliary movement: contributions from electron microscopy. Scanning Microsc 1992; 6 (2): 573–579.
40. Crow J, Amso NN, Lewin J et al. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod 1994; 9 (12): 2224–2233. doi: 10.1093/oxfordjournals.humrep.a138 428.
41. Verhage HG, Bareither ML, Jaffe RC et al. Cyclic changes in ciliation, secretion and cell height of the oviductal epithelium in women. Am J Anat 1979; 156 (4): 505–521. doi: 10.1002/aja. 1001560405.
42. Cigánková V, Krajnicáková H, Kokardová M et al. Morphological changes in the ewe uterine tube (oviduct) epithelium during puerperium. Vet Med (Praha) 1996; 41 (11): 339–346.
43. Correr S, Makabe S, Heyn R et al. Microplicae-like structures of the fallopian tube in postmenopausal women as shown by electron microscopy. Histol Histopathol 2006; 21 (3): 219–226. doi: 10.14670/HH-21.219.
44. Li J, Chen X, Zhou J. Ultrastructural study on the epithelium of ligated fallopian tubes in women of reproductive age. Ann Anat 1996; 178 (4): 317–320. doi: 10.1016/S0940-96 02 (96) 80082-3.
45. Lowe JS, Anderson PG, Anderson SI. Stevens & Lowe‘s Human Histology. 5th edition. Edinburgh: Elsevier 2018.
46. Callahan MJ, Crum CP, Medeiros F et al. Primary fallopian tube malignancies in BRCA-positive women undergoing surgery for ovarian cancer risk reduction. J Clin Oncol 2007; 25 (25): 3985–3990. doi: 10.1200/JCO.2007.12.2622.
47. Gilks CB, Irving J, Köbel M et al. Incidental nonuterine high-grade serous carcinomas arise in the fallopian tube in most cases: further evidence for the tubal origin of high-grade serous carcinomas. Am J Surg Pathol 2015; 39 (3): 357–364. doi: 10.1097/PAS.0000000000000353.
48. Falconer H, Yin L, Grönberg H et al. Ovarian cancer risk after salpingectomy: a nationwide population-based study. J Natl Cancer Inst 2015; 107 (2): dju410. doi: 10.1093/jnci/dju410.
49. Eleje GU, Eke AC, Ezebialu IU et al. Risk-reducing bilateral salpingo-oophorectomy in women with BRCA1 or BRCA2 mutations. Cochrane Database Syst Rev 2018; 8 (8): CD012464. doi: 10.1002/14651858.CD012464.pub2.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2023 Issue 1-
All articles in this issue
- Analýza tkáňové exprese proteomu cervikálního hlenu
- Akutní recidivující pankreatitida v průběhu III. trimestru těhotenství
- Fertilitu šetřící terapie u ektopické gravidity
- Předčasný odtok plodové vody před termínem porodu
- Staré a nové pohľady na funkčnú morfológiu vajíčkovodov a ich význam pre gynekologickú prax
- Kryokonzervace ovariální tkáně jako metoda pro zachování fertility u žen
- Zkušenosti s rekonstrukcí zanedbaných rozsáhlých porodních poranění zahrnujících poranění análního svěrače
- Oxytocin a další peptidová uterotonika – jejich pražské osudy
- Seznam recenzentů
- Zápis z jednání volební komise pro volbu výboru Onkogynekologické sekce České gynekologické a porodnické společnosti ČLS JEP
- Epidermolýza u novorodenca matky s kožnou manifestáciou covid-19 v III. trimestri gravidity
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kryokonzervace ovariální tkáně jako metoda pro zachování fertility u žen
- Předčasný odtok plodové vody před termínem porodu
- Fertilitu šetřící terapie u ektopické gravidity
- Staré a nové pohľady na funkčnú morfológiu vajíčkovodov a ich význam pre gynekologickú prax
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

